Revisão
|
|
| Avaliação de risco ambiental de ambientes aquáticos afetados pelo uso de agrotóxicos Environmental risk assessment of aquatic systems affected by pesticide use |
|
Rafaela Maciel RebeloI; Eloisa Dutra CaldasII,*
IInstituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis (IBAMA), 70818-900 Brasília - DF, Brasil Recebido em 12/09/2013 * e-mail: eloisa@unb.br Ecological risk assessment is a process evaluating the likelihood that adverse ecological effects may occur or are occurring as a result of exposure to one or more substances. Relevant information needed to predict risks from pesticides includes their physical chemical properties, mobility in soil, persistence in the environment, and bioaccumulation and toxicity in relevant organisms. Although currently a requirement for pesticide registration in Brazil, this process is not yet fully implemented in the country. This review aims to outline the principles of environmental risk assessment for pesticides, focusing on aquatic organisms, and to discuss the studies and efforts conducted in Brazil in this area. INTRODUÇÃO Os agrotóxicos estão entre os principais instrumentos do atual modelo de desenvolvimento da agricultura brasileira, centrado em ganhos de produtividade.1 Os produtos agrotóxicos são regulados no Brasil desde a promulgação do Decreto nº 24.114 em 1934, que estabeleceu as diretrizes e obrigações para a produção, importação, exportação, comercialização e uso no Brasil.2 A Lei nº 7802/1989 trouxe mudanças importantes na regulação do tema, como a inclusão do órgão responsável pelo setor de meio ambiente, o Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis (IBAMA), no processo de avaliação e registro destes produtos no país.3 Além do IBAMA, o registro envolve o Ministério da Agricultura Pecuária e Abastecimento (MAPA), que avalia questões agronômicas, e a Agência Nacional de Vigilância Sanitária (ANVISA), que avalia o impacto do uso dos agrotóxicos na saúde humana.3 Os agrotóxicos são legalmente definidos como os produtos e os agentes de processos físicos, químicos ou biológicos, destinados ao uso nos setores de produção, no armazenamento e beneficiamento de produtos agrícolas, nas pastagens, na proteção de florestas, nativas ou implantadas, e de outros ecossistemas e também de ambientes urbanos, hídricos e industriais, cuja finalidade seja alterar a composição da flora ou da fauna, a fim de preservá-las da ação danosa de seres vivos considerados nocivos.3 Estes produtos são, portanto, sintetizados para causar danos a organismos vivos e são lançados no meio ambiente. Os processos envolvidos no destino ambiental dos agrotóxicos dependem de suas propriedades físico-químicas e forma de aplicação, características do solo e condições ambientais.4 Dentre estes processos estão a lixiviação, escoamento superficial, sorção, degradação química e biológica e volatilização (Figura 1). A lixiviação é o transporte do agrotóxico pelo perfil do solo e, dependendo principalmente da umidade e porosidade do solo, pode levar à contaminação do lençol freático. O escoamento superficial pode contaminar reservatórios, lagos e rios, e expor os organismos aquáticos a níveis de agrotóxicos que podem ser tóxicos a várias espécies.5
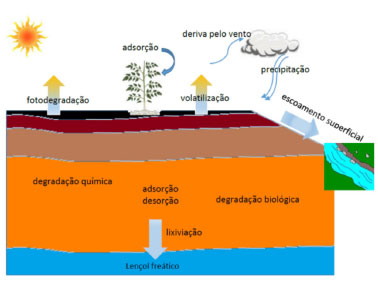 Figura 1. Alguns processos que afetam o destino ambiental dos agrotóxicos. Adaptado de Spadotto et al.4
A avaliação do potencial risco ao meio ambiente pelo uso dos agrotóxicos é uma importante etapa no processo de registro de agrotóxicos de vários países. Nos Estados Unidos, a Lei Federal de Controle de Inseticidas, Fungicidas e Rodenticidas (Federal Insecticide, Fungicide, and Rodenticide Act, FIFRA) fornece a base para a regulação, venda e distribuição dos agrotóxicos no país, e possui entre seus elementos chaves o registro destes produtos com base em um padrão de avaliação de riscos e benefícios.6 A publicação em 1998 do Guideline on Ecological Risk Asssessment pela agência ambiental americana (United States Enviromental Protecion Agency, USEPA), uma revisão da publicação de 1992,7 foi um marco para um novo paradigma de avaliação de risco ambiental. Na Europa, a European and Mediterranean Plant Protection Organisation desenvolveu guias de avaliação de risco ambiental de agrotóxicos com procedimentos flexíveis que podem ser adaptados para serem usados de acordo com as prioridades dos países membros da comunidade européia.8 Outros países, como Canadá,9 Austrália10 e Japão,11 também possuem procedimentos estabelecidos para avaliação de risco ambiental, enquanto que na China estes ainda estão sendo desenvolvidos.12 No Chile,13 o Ministério da Agricultura desenvolveu uma base de dados de agrotóxicos que permite uma avaliação de risco simplificada, baseada no trabalho de Finzio et al.,14 para determinar a concentração ambiental esperada do agrotóxico após seu uso. No Brasil, a avaliação de risco ambiental de agrotóxicos foi prevista na Portaria IBAMA nº 84/1996,15 e posteriormente na regulamentação da Lei nº 7802 pelo Decreto nº 4074/2002.16 Inicialmente, o IBAMA concentrou seus esforços em estabelecer métodos para avaliação do potencial de perigo das substâncias, definindo protocolos de interesse e qualificando o processo de avaliação. Mais recentemente, o IBAMA passou a adotar a estrutura conceitual do processo de avaliação de risco ambiental definido pela USEPA na avaliação de novos ingredientes ativos.17 A presente revisão tem como objetivos delinear os princípios que regem o processo de avaliação de risco ambiental de agrotóxicos e como este processo é conduzido no Brasil, e discutir estudos relacionados com o tema conduzidos no país nos últimos anos.
AVALIAÇÃO DE RISCO AMBIENTAL DO USO DE AGROTÓXICOS A avaliação de risco ambiental, também denominado risco ecológico, avalia a probabilidade da ocorrência de um efeito ecológico adverso como resultado da exposição a uma ou mais substâncias.7 O processo é usado para sistematicamente avaliar e organizar dados, informações, estimativas e incertezas com a finalidade de ajudar a compreender e predizer as relações entre os agrotóxicos e seus efeitos ecológicos de forma que seja útil para a tomada de decisão do ponto de vista ambiental.7 Efeitos ecológicos adversos são aqueles que alteram características importantes, estruturais ou funcionais, dos ecossistemas. Uma avaliação da adversidade ecológica causada pelo uso de agrotóxicos pode considerar o tipo, a intensidade e a escala do efeito, bem como o potencial do sistema para recuperação.7 O processo de avaliação risco ambiental pode ser descrito em quatro etapas: 1. Coleta de informações; 2. Formulação do problema; 3. Análise de risco e 4. Caracterização do risco (Figura 2). O resultado deste processo deve ser comunicado ao gestor de risco e a outras partes interessadas (incluindo empresas e sociedade civil), e pode levar a ações de gerenciamento/mitigação do risco pela agência reguladora para a garantia do uso seguro dos produtos agrotóxicos7 (Figura 2). A avaliação de risco pode ser prospectiva ou retrospectiva e as descrições dos efeitos adversos podem variar de julgamentos qualitativos para probabilidades quantitativas. Os critérios usados para decidir sobre a aceitabilidade dos riscos ambientais causados pelos agrotóxicos e os caminhos pelos quais os riscos são estimados variam largamente.7 De uma forma geral, esta aceitabilidade é determinada pelos gestores de risco, e visa balancear os benefícios e os riscos do uso destes produtos.
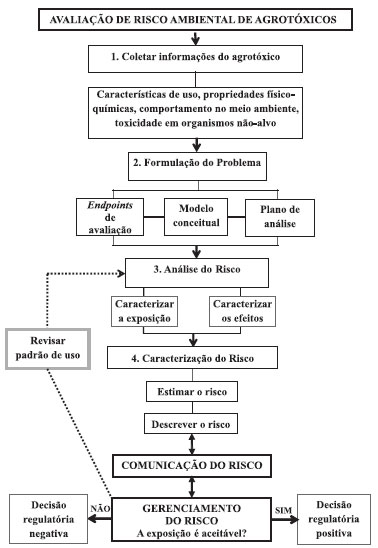 Figura 2. Avaliaçao de risco ambiental de agrotóxicos. Adaptado da USEPA16
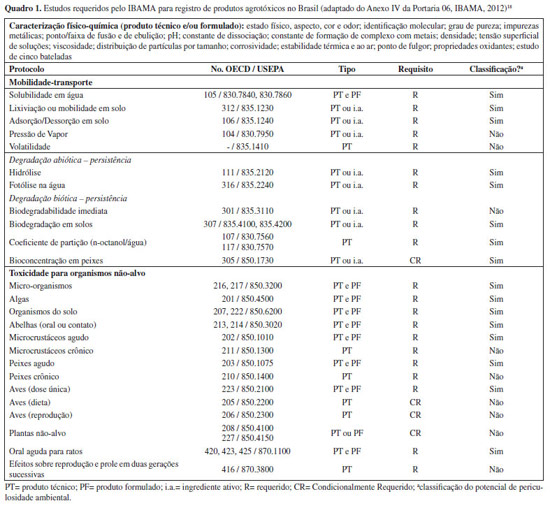
Coleta de informações Na primeira etapa da avaliação de risco ambiental do uso de agrotóxicos (Figura 2) é feita a coleta de informações referentes aos potenciais usos do produto, instruções de uso no campo, propriedades físico-químicas do ingrediente ativo e do produto final, persistência ambiental, destino e transporte, e informações laboratoriais sobre efeitos ambientais, incluindo a toxicidade para organismos não-alvo.7,8 Estes dados podem ser obtidos da literatura, bases de dados e/ou a partir de resultados de testes laboratoriais exigidos pelas autoridades regulatórias, conforme estabelecido em legislação específica. No Brasil os estudos exigidos para avaliação ambiental de um produto agrotóxico foram definidos pela Portaria IBAMA nº 84/1996,15 recentemente modificada pela Portaria IBAMA nº 6/2012,18 e estão apresentadas no Quadro 1. Para cada agrotóxico a ser registrado, são exigidos 23 estudos físico-químicos para produto técnico (obtido diretamente da matéria-prima e com teor definido de ingrediente ativo e impurezas), e dez estudos físico-químicos para produto formulado ou ingrediente ativo. Para se avaliar a toxicidade para organismos não-alvo, são exigidos nove estudos para produto técnico ou ingrediente ativo, e oito estudos para o produto formulado. Adicionalmente são exigidos três estudos do comportamento do agrotóxico em solos nacionais e um de biodegradabilidade imediata.
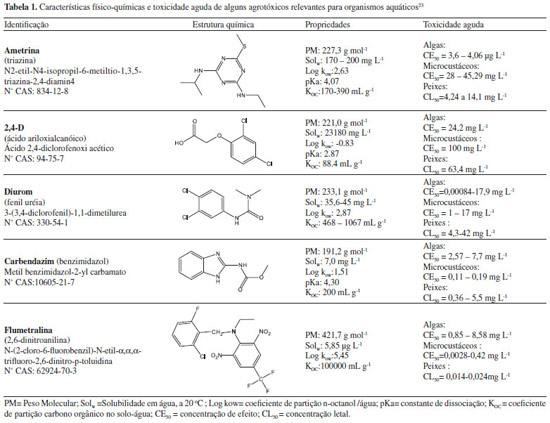
Sempre que possível, os estudos exigidos pelo IBAMA para registro devem ser conduzidos de acordo com protocolos internacionalmente aceitos, como aqueles publicados pela OECD (Organisation for Economic Co-operation and Development),19,20 ou pelo USEPA.21 Esses estudos são realizados em ambiente de laboratório, sob condições controladas e podem não refletir uma situação real de campo. Os protocolos recomendam que estudos de lixiviação, adsorção e biodegradação em solos devem ser conduzidos em solos característicos da região ou país de interesse.19 A maioria dos protocolos de estudos de toxicidade sugere algumas espécies como organismo teste, porém outras espécies podem ser usadas se adequadamente justificado.20 A utilização de espécies alternativas para avaliar a toxicidade de organismos aquáticos será discutida posteriormente neste artigo. Os estudos devem também ser conduzidos de acordo com os princípios de Boas Práticas de Laboratório (BPL) em laboratórios monitorados por autoridades reconhecidas, que no Brasil é o Instituto Nacional de Metrologia, Qualidade e Tecnologia (INMETRO).22 Tal exigência é importante para garantir que as informações usadas na avaliação de risco sejam precisas e rastreáveis. A Tabela 1 apresenta algumas características físico-químicas e toxicidade aguda para organismos aquáticos de alguns agrotóxicos utilizados no país.23 Atrazina, diurom e 2,4-D são herbicidas registrados para uso em diversas culturas, sendo o 2,4-D o mais hidrossolúvel (Solw: 23180 mg L-1) e o menos tóxico entre eles (maior CL50 e CE50). A flumetralina, um regulador de crescimento para cultura do fumo, tem a maior toxicidade para peixes (CL50= 0,014-0,024 mg L-1), enquanto o fungicida carbendazim é o mais tóxico no modelo para microcustáceos (CE50 = 0,11 - 0,19 mg L-1).
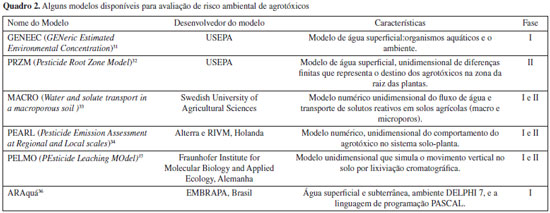
Apesar dos estudos mostrados no Quadro 1 ainda não serem usados sistematicamente em processos de avaliação de risco ambiental de agrotóxico pelo IBAMA, eles são usados para a classificação do potencial de periculosidade ambiental (PPA). Esse sistema consiste num ranking em que são considerados o potencial de transporte (peso 1), persistência e bioconcentração (peso 2) e a ecotoxicidade a diversos organismos (peso 1). Os agrotóxicos a serem registrados são incluídos em uma das quatro classes PPA, sendo a classe I a mais restritiva (altamente perigoso) e a classe IV a menos restritiva (pouco perigoso).24 Formulação do problema A etapa de formulação do problema pode ser considerada de planejamento, quando hipóteses preliminares sobre os efeitos ambientais que podem resultar do uso do agrotóxico são geradas e avaliadas. Os principais produtos desta etapa são os endpoints de avaliação, o plano de análise e o modelo conceitual (Figura 2).7,25 Os endpoints de avaliação correspondem ao valor ambiental que se deseja proteger, e podem ser definidos por uma entidade ecológica ou seus atributos. Uma entidade ecológica pode ser uma espécie, um grupo funcional de espécies, uma comunidade, um ecossistema ou outra entidade de importância ou preocupação. Um atributo é a característica da entidade que deve ser protegido e está potencialmente em risco. O modelo conceitual especifica as potenciais rotas de exposição, os organismos afetados e os endpoints de maior preocupação.25 A complexidade do modelo depende do número de agentes estressores, dos endpoints e das características do ecossistema. O plano de análise delineia como os dados disponíveis serão avaliados, e identifica rotas e relações mais relevantes para a condução da análise de risco, a próxima etapa do processo.7 Análise do risco A etapa de análise do risco é guiada pelos resultados obtidos na formulação do problema para determinar a probabilidade de exposição a um agrotóxico e os tipos de efeitos ecológicos potenciais que podem ser esperados desta exposição. Esta etapa inclui a caracterização da exposição e a caracterização dos efeitos (Figura 2). A análise dos dados deve caracterizar a natureza da exposição e as respostas ecológicas dentro das circunstâncias definidas no modelo conceitual.7 Caracterização da exposição A caracterização da exposição descreve as fontes do agrotóxico, sua distribuição no ambiente e seu contato ou coocorrência com os receptores ecológicos. Esta etapa pode envolver dados de monitoramento em campo e a utilização de modelos matemáticos, os quais apresentam limitações e incertezas. As incertezas dos dados de monitoramento estão relacionadas à seleção de locais de amostragem (que podem não representar os de maior exposição), à frequência de amostragem (que pode ser insuficiente para determinar as concentrações máximas) e possíveis erros relacionados à coleta. A variabilidade geográfica natural e espacial relacionada ao evento da aplicação do agrotóxico e seu posterior comportamento no meio ambiente pode dificultar a coleta de dados de monitoramento. As incertezas envolvidas nos modelos matemáticos estão relacionadas à sua adequação à situação que se pretende avaliar, a sua sensibilidade e limitações para estimar a variabilidade temporal e espacial decorrentes da exposição ao agrotóxico. Apesar das limitações, estes modelos podem ser uma ferramenta poderosa para explorar as interações entre os diversos fatores relevantes e predizer os efeitos dos agrotóxicos sobre as populações de espécies não-alvo.7 De uma forma geral, os modelos estimam a concentração do agrotóxico no meio ambiente (água e solo) depois da aplicação no campo para examinar potenciais efeitos adversos para as espécies ecológicas expostas. Pode-se usar um sistema de avaliação em fases para determinar o tipo de modelagem apropriado para o risco apresentado, de maneira a otimizar os recursos a serem empregados na análise conforme a complexidade do problema e o risco potencial do produto. As fases iniciais são mais simples, conservadoras, usam modelos determinísticos para descrever um cenário único, enquanto que a fase de mais alto nível é a mais refinada, inclui dados de campo em modelos probabilísticos para descrever vários cenários.7,8 As fases intermediárias podem incluir alguns refinamentos, como variáveis temporais e espaciais. Um modelo muito simples pode não trazer respostas adequadas para determinadas situações, e um muito complexo utilizado prematuramente pode levar a uma situação onde os dados disponíveis e o conhecimento não são suficientes para parametrizar precisamente o modelo. A compreensão do cenário que se pretende avaliar e da situação problema é fundamental para a escolha adequada do modelo a ser utilizado. Métodos de triagem para avaliar o potencial de lixiviação e escoamento superficial dos agrotóxicos no solo baseiam-se nas propriedades físico-químicas da substância e do solo onde serão aplicados. Para águas subterrâneas, os métodos incluem os critérios de triagem da USEPA,26 e os índices de GUS (Groundwater Ubiquity Score),27 de LIX (Leaching IndeX)28 e TLPI (Temperature Leaching Potential Index),29 os dois últimos desenvolvidos por pesquisadores brasileiros. Em geral, substâncias com elevada solubilidade em água (Sw), baixa adsorção à matéria orgânica no solo (Koc) e alta meia-vida no solo (DT50solo) atingem mais facilmente o lençol freático. Os critérios de triagem da USEPA consideram, além destes parâmetros, a volatilidade do composto (dado pela constante da Lei de Henry, KH), o pKa (constante de dissociação ácida) e o tempo de meia vida na água.26 O índice de GUS é estimado a partir da equação GUS=logDT50solo * (4-log Koc), e classifica as substâncias de acordo com seu potencial de lixiviação entre extremamente baixo (Guss <0,01) a muito alto (Guss >4).27 O LIX é estimado a partir da equação LIX = exp(-k* Koc), sendo k a constante de degradação do agrotóxico no solo; o índice varia ente 0 (potencial mínimo) e 1 (potencial máximo de lixiviação).28 O TLPI considera o efeito da temperatura do solo como um fator atenuante da lixiviação, utilizando a equação de degradação de Arrhenius, e um fator de retardação considerando o efeito no Koc.29 Para águas superficiais, o mais utilizado é o método de GOSS, que, baseado nos parâmetros de DT50solo, Solw e Koc, avalia o potencial do agrotóxico de ser transportado dissolvido em água ou associado ao sedimento em suspensão.30 Alguns modelos computacionais para estimar as concentrações ambientais de exposição (CAE) para organismos aquáticos desenvolvidos nos Estados Unidos e Europa, e também utilizados no Brasil, estão mostrados no Quadro 2. O GENEEC é um modelo computacional de Fase I que usa o Koc e os valores de meia-vida de degradação da substância para estimar o escoamento de um campo de dez hectares em uma lagoa padrão de dois metros de profundidade.31 O PRZM é um modelo de fase II específico de campo, com escala de tempo diária, que pode ser usado para estimar o escoamento superficial, a lixiviação e o carreamento de contaminantes associados. Esse modelo permite entradas de variáveis do solo, coeficientes de degradação da substância em diferentes camadas de solo, fatores de cultivo, erosão do solo, e manejo no decorrer do tempo.32 O simulador PEARL tem como objetivo principal simular a lixiviação dos agrotóxicos em solos usando fatores que atuam de forma direta e indireta nesse tipo de transporte, como os atributos químicos e físicos do solo, o clima e as características físico-químicas dos agrotóxicos.34
Modelos para avaliar o risco ambiental de agrotóxicos também têm sido desenvolvidos no Brasil. O sistema computacional ARAquá (Avaliação de Risco Ambiental de Agrotóxico) considera as possíveis contaminações de corpos d'água superficiais e subterrâneos pela comparação de suas concentrações estimadas em cenários de uso agrícola no país com parâmetros de qualidade de água (Quadro 2).36 O ACHA (Avaliação da Contaminação Hídrica por Agrotóxico) é capaz de simular perfis de umidade do solo e concentração do agrotóxico em função do tempo,37 porém é uma ferramenta que ainda precisa ser validada. Caracterização dos efeitos A caracterização dos efeitos ecológicos avalia a evidência de que a exposição a um dado agrotóxico causa a resposta observada. A caracterização se inicia pela avaliação dos dados para especificar os efeitos adversos relevantes, verificando se eles são consistentes com os endpoints de avaliação e se as condições em que eles ocorrem são consistentes com o modelo conceitual definido na formulação do problema. As concentrações com efeitos específicos de curto e longo prazo para as espécies de interesse podem ser expressas em termos de CE50 (concentração efetiva que afeta 50% dos indivíduos), CL50 (concentração que causa morte em 50% dos animais testados) e NOAEC (no observed adverse effect concentration). A Tabela 1 mostra estes parâmetros para alguns agrotóxicos registrados no Brasil. Caracterização de risco A caracterização de risco é a fase final da avaliação de risco ambiental, e integra as informações das etapas anteriores, incluindo as hipóteses, incertezas e limitações da análise. O produto final inclui uma interpretação das adversidades ecológicas/ambientais esperadas e descrições das incertezas e linhas de evidência, formando as bases sobre as quais as decisões de gerenciamento do risco podem ser feitas. A caracterização do risco inclui a estimativa e a descrição do risco (Figura 2). Estimativa do risco Na estimativa do risco, uma abordagem determinística é feita pelo cálculo do Quociente de Risco (QR), dividindo-se as estimativas de exposição (CAE) pelos valores agudos e crônicos de ecotoxicidade (QR = exposição/toxicidade). Estes QR são comparados com os níveis de preocupação, que são critérios definidos pela autoridade regulamentadora. A Tabela 2 mostra os parâmetros para caracterização de risco para organismos aquáticos utilizados pela USEPA.38 O risco potencial a organismos não-alvo pode existir quando o QR ultrapassa o nível de preocupação, o que pode requerer uma ação regulatória. O QR fornece um meio eficiente e barato de identificar situações de alto ou baixo risco, e podem permitir que as decisões de gestão de risco sejam feitas sem a necessidade de mais informações. Porém, enquanto o quociente pode ser útil para responder quando os riscos são altos ou baixos, ele pode não ser útil para um gerenciador de risco que exige uma quantificação incremental dos riscos. Além disso, o método do quociente de risco pode não ser o mais favorável para predizer efeitos secundários.7 Em situações onde esta predição é desejada, utiliza-se ferramentas computacionais para conduzir uma estimativa de risco probabilística.

A estimativa de risco probabilística é desenhada de maneira a combinar grupos de informações que são expressas em termos de distribuição probabilística, o que permite uma caracterização mais completa da variabilidade e incerteza da estimativa e a determinação dos principais fatores que afetam a exposição.39 Esta avaliação produz uma distribuição probabilística ou intervalos de valores de exposição e risco, ao invés de valores fixos, como os estimados na estimativa determinística. Descrição do risco A descrição do risco corresponde a uma avaliação das linhas de evidência que suportam ou refutam a(s) estimativa(s) de risco, e uma interpretação da significância dos efeitos adversos nos endpoints de avaliação. Quando a caracterização do risco está completa, os avaliadores de risco devem ser capazes de estimar os riscos ecológicos, indicar o grau geral de confiança dos riscos estimados, citar as linhas de evidência que suportam as estimativas de risco, e interpretar as adversidades dos efeitos ecológicos.7
GERENCIAMENTO DE RISCO O gerenciamento de risco engloba todas as ações tomadas para eliminar ou reduzir os riscos identificados na avaliação de risco a um nível aceitável. Adicionalmente, são considerados também outros fatores, como questões sociais, econômicas, políticas ou legais. É importante também considerar o grau de confiança da avaliação de risco, a justificativa para a decisão de gestão e as opções para reduzir o risco. A escolha por uma opção e seus riscos associados, custos e benefícios depende do conjunto de opções, consequências, valores e fatos avaliados no processo de tomada de decisão. Em diferentes situações, diferentes opções, valores e informações podem ser relevantes.7 Se a caracterização do risco indicar níveis de exposição de um dado organismo como aceitáveis, a autoridade regulatória poderá ter uma decisão positiva (aprovação do produto no que tange às questões ambientais) (Figura 2). Se a caracterização de risco indicar uma exposição em níveis inaceitáveis, o gestor de risco pode decidir não registrar o produto ou implementar ações para diminuir a exposição e a análise de risco recomeça (Figura 2). Estudos adicionais (inclusive de campo) poderão subsidiar outras decisões de gestão, como a manutenção das condições iniciais de registro, indicação de novas restrições, ou mesmo a proibição do uso destes ingredientes ativos no país. Um exemplo de ação de gestão no Brasil foi a decisão do IBAMA de restringir a aplicação aérea dos produtos à base de imidacloprido, tiametoxam, clotianidina e fipronil devido a toxicidade para abelhas.40 Posteriormente, este uso foi mantido para algumas culturas até 30 de junho de 2013.41 Outro exemplo se refere aos produtos a base do inseticida endossulfam, cujo uso foi restrito a áreas distantes mais de 100 m de rios, lagos, estuários, açudes, represas, áreas alagadas ou sujeitas à inundação para garantir a proteção de organismos aquáticos. Esta medida foi tomada a partir de resultados monitoramento de água conduzidos em São Paulo e Paraná (2002-2005). Posteriormente, a ANVISA, por questões relacionadas à saúde pública, proibiu a comercialização do endosulfam após 31 de julho de 2013.42
COMUNICAÇÃO DO RISCO Na caracterização do risco, obtêm-se a base para comunicar os riscos ecológicos para o gestor e outras partes interessadas, incluindo o setor privado, organizações civis e o público em geral. No âmbito regulatório, o documento final com os resultados e conclusões da avaliação de risco e as decisões de gestão podem ser disponibilizados no site da agência governamental que a conduziu e incluir audiência pública para discutir os detalhes do processo. Nessa etapa, é importante descrever claramente as fontes e causas do risco ecológico, o seu valor, os custos monetários e os outros custos de proteção (e falha na proteção) dos recursos naturais. O grau de confiança na avaliação de risco, a justificativa para a decisão de gestão de risco e as opções para reduzir o risco também são importantes.7 Deve-se considerar que o processo de avaliação de risco é iterativo de forma que a compreensão de determinados aspectos da avaliação em etapas mais avançadas podem levar a uma reavaliação de etapas anteriores. Assim, um conhecimento adquirido na caracterização do risco pode levar a uma revisão da formulação do problema ou ao entendimento de que são necessários dados adicionais.
IMPACTO DO USO DE AGROTÓXICOS EM ORGANISMOS AQUÁTICOS NO BRASIL Estudos de avaliação de risco ambiental O número de estudos conduzidos sobre o tema no Brasil cresceu nos últimos anos, porém essa ainda é uma área que requer muitos avanços no país. Neste artigo, alguns estudos relacionados ao ambiente aquático realizados nos últimos 10 anos são discutidos. Primeiramente, estudos que utilizaram métodos de triagem são abordados, seguidos de estudos com modelos mais complexos (conforme descrito na análise de fases) e estudos que avaliaram a sensibilidade de organismos aquáticos regionais em comparação a organismos padrões utilizados em protocolos internacionais. O Quadro 3 mostra alguns estudos que avaliaram o potencial de contaminação de águas superficiais e subterrâneas por agrotóxicos utilizando métodos de triagem. A maioria dos estudos utilizou dados da literatura relativos às propriedades físico-químicas dos agrotóxicos e características do solo.
Entre os 37 agrotóxicos usados na região do Baixo Jaguaribe (Ceará) avaliados por Milhome et al.,43 16 foram considerados contaminantes em potencial de águas subterrâneas segundo o critério USEPA (Sw > 30 mg L-1, Koc < 300 mL g-1, KH < 10-2 Pa m3 mol-1, ionizado negativamente a pH 5-8; DT50solo > 14 e DT50w > 175 dias).26 Somente cinco desses (atrazina, imidacloprido, metolacloro, nicosulfuron e tiametoxan) foram classificados pelo índice de GUS como prováveis de serem lixiviados (GUS > 2,8). Essa aparente contradição pode ser explicada pelo impacto dos parâmetros adicionais utilizados no critério USEPA quando comparado ao GUS, que só considera DT50solo e Koc.27 Com exceção do nicosulfurm, os outros quatro agrotóxicos foram também considerados de alto potencial para transporte superficial dissolvido em água pelo método de GOSS.30 Oito compostos foram de alto potencial para transporte associado ao sedimento, dos quais quatro também dissolvidos na água (Quadro 3). Brito et al.44 avaliaram 14 herbicidas usados na região produtora de cana-de-açúcar na sub-bacia do Rio Poxim (Sergipe). Nove foram classificados como prováveis de serem lixiviados pelo índice GUS (incluindo atrazina e 2,4-D), dos quais apenas dois obedeceram ao critério de contaminante potencial segundo o USEPA (metribuzim e diurom). Onze dos compostos foram considerados de alto potencial de transporte dissolvido na água, incluindo o diurom (Quadro 3). Esse herbicida foi detectado em 8 das 14 amostras coletadas em 2009 e 2010 em dois pontos do Rio Poxim (0,03 e 0,9 µg L-1), confirmando o seu potencial de contaminação previsto pelo método de GOSS. Soares et al.45 detectaram atrazina, flutriafol e epoxiconazol em águas superficiais de Manhuaçu (MG). Esses agrotóxicos estão entre os 12 mais utilizados na cultura de café na região e com maiores potenciais de transporte dissolvido em água pelo método de GOSS, entre os mais de 140 compostos investigados (Quadro 3). Paraíba et al.29 estimaram o potencial de lixiviação para águas subterrâneas de 31 herbicidas usados nas culturas de milho e soja na região de São Gabriel do Oeste (MS) utilizando o índice TLPI, que considera também a temperatura do solo. Sete herbicidas foram considerados como alto ou muito alto potencial de lixiviação (TLPI > 80) em pelo menos um dos solos investigados (neossolo quartzarênico órtico espódico e latossolo vermelho distrófico típico) (Quadro 3). Desses, 5 também foram classificados com potencial de lixiviação segundo o índice de LIX por Barbosa et al. (Quadro 3),46 que incluiu também o metolacloro (LIX = 0,21). Esse herbicida também foi identificado por Mariot et al.47 como de alto potencial de lixiviação em ensaio de laboratório, porém os autores não identificaram essa característica pelo LIX (< 0,1) quando o Koc determinado no laboratório foi usado para o cálculo do índice. Rosa et al.48 investigaram 104 agrotóxicos usados na agricultura do Alto Valo do Itajaí (SC), encontrando 29 compostos com potencial de lixiviação pelo índice de GUS, dos quais 26 também foram classificados como tal pelo índice LIX, alguns mostrados no Quadro 3. Esta boa correlação é esperada, já que ambos usam parâmetros de degradação (DT50 e constante de degradação, respectivamente) e de adsorção do pesticida no solo (Koc) na estimativa.27, 28 A espacialização de informações relativas à aplicação de modelos que integram o potencial de contaminação com a identificação de áreas de risco pode fornecer subsídios para tomadas de decisões mais rápidas e eficientes. Moraes et al.49 utilizaram mapas para espacializar as estimativas de contaminação de águas subterrâneas por tebutiurom identificada pelo índice de LIX. As simulações foram realizadas utilizando o sistema ARAquá considerando diferentes lâminas de irrigação anuais da Bacia do Rio Pardo (SP). O IBAMA utiliza o ARAquá na avaliação de risco ambiental para água superficial (adjacente) e subterrânea, além do GENEEC (Quadro 2) para água superficial e o SCI-GROW para água subterrânea.17 A partir da plataforma Express 1.03.02 do USEPA, o IBAMA, em parceria com a Universidade de Brasília, desenvolveu recentemente a plataforma Express BRA 1.0, que deverá possibilitar a condução de estudos de avaliação de risco ambiental no modelo PRZM utilizando dados edafoclimáticos brasileiros.50 O simulador PEARL foi utilizado para avaliar a lixiviação dos principais agrotóxicos usados na região da Bacia do Rio Dourados (MS) e identificar áreas com maior vulnerabilidade à contaminação de águas subterrâneas.51 Os agrotóxicos que apresentaram maior potencial de contaminação foram bentazona, imazetapir, fomesafen, 2,4-D, metamidofós, imazaquin, tiodicarbe e monocrotofós. O solo argissolo mostrou-se mais vulnerável à contaminação das águas subterrâneas quando comparado ao latossolo. Outro estudo utilizando o PEARL avaliou o potencial de lixiviação do inseticida tiametoxam em solo na cultura de soja em Dourados (MS).4 Como primeira alternativa de calibração do modelo, usou-se os valores de meia-vida do tiametoxam utilizando-se as concentrações totais no perfil do solo conforme as datas de amostragem. Esse procedimento resultou em decréscimo no valor de meia-vida, que foi satisfatório para descrever a rápida dissipação desse agrotóxico logo após a aplicação, porém não foi coerente para descrever a taxa de degradação do tiametoxam observada no campo para as outras datas de amostragem. A alternativa encontrada foi assumir uma menor dose aplicada para compensar a rápida dissipação, possivelmente devido à volatilização do produto, a qual não é prevista no modelo. A lixiviação do tiametoxam também foi testada pelo simulador MACRO em duas classes de solo brasileiro, latossolo vermelho acriférrico típico (LVwf) e argissolo vermelho-amarelo distrófico típico.52 As simulações foram comparadas a dados experimentais de lixiviação durante duas estações chuvosas. Houve uma superestimação da lixiviação para a profundidade de 0,45 m do LVwf entre 150 e 250 dias após a aplicação do produto (período seco) como consequência do maior fluxo de água simulado. O potencial de lixiviação foi subestimado para a profundidade de 0,9 m para os dois solos no primeiro período de chuva. De uma maneira geral, o desempenho do MACRO foi considerado satisfatório para os cenários avaliados. Uma comparação entre as performances dos simuladores PEARL e MACRO foi conduzida com endossulfam e tiametoxam em Ponta Porã (MS), numa região de solo latossolo vermelho distrófico típico, de textura média.53 Amostras de solo foram coletadas até 125 dias após a aplicação do produto. Os simuladores indicaram a presença de endossulfam entre 0-20 cm de profundidade, enquanto que experimentalmente o composto estava presente somente até 10 cm de profundidade. O simulador PEARL superestimou a lixiviação do tiametoxam em todas as datas de amostragem, com picos de concentração em profundidades maiores que as estimadas experimentalmente. Os estudos relatados anteriormente avaliaram o potencial de contaminação dos recursos hídricos por agrotóxicos sem levar em conta o possível dano aos organismos aquáticos. Pinto54 usou os modelos GENNEC e SCI-GROW para avaliar os potenciais de sorção, lixiviação e dissipação, em águas superficiais e subterrâneas, respectivamente, de um herbicida da classe da sulfonamida-triazopirimidinas em quatro solos brasileiros.54 Foram estimados valores de EC50 e NOEC para algas (Pseudokirchneriella subcapitata), microcustáceos (Daphnia magna) e peixes (incluindo Oncorhynchus mykiss, truta arco-íris), e organismos terrestres. A CAE foi estimada simulando o pior cenário (menor valor de sorção e menor potencial de fotodegradação) nos dois modelos. Para todos os organismos, os quocientes de risco foram menores que 1, com níveis de preocupação menores que os preconizados pela USEPA (Tabela 2). Outro estudo avaliou os resíduos do herbicida quincloraque em sete bacias do estado de Santa Catarina onde o arroz irrigado é cultivado, e seus efeitos sobre a comunidade de plâncton.55 A análise de risco mais conservadora (usando o método determinístico) indicou efeitos nocivos do quincloraque sobre a comunidade de produtores primários, mas o método probabilístico não indicou situações de risco significativo, de acordo com o critério de decisão do USEPA.26 Toxicidade dos agrotóxicos aos organismos aquáticos A maioria dos dados de toxicidade para organismos aquáticos disponíveis na literatura foi obtido para espécies padrões de regiões temperadas, mas sabe-se que a sensibilidade a alguns agrotóxicos são marcadamente diferentes para espécies de clima tropical e temperado.56 Em geral, são usados modelos computacionais para extrapolar os resultados obtidos com espécies padrões para outras espécies, incluindo aquelas ameaçadas de extinção. Um exemplo de ferramenta usada para predizer a toxicidade em diferentes espécies é a Web-ICE (Web-based Interspecies Correlation Estimation) utilizada pela USEPA.57 Para que estas ferramentas sejam usadas adequadamente, um banco de dados com resultados de estudos de toxicidade relativas ao organismo testado, substância, e condições do teste devem estar disponíveis. Neste sentido, alguns estudos ecotoxicológicos têm sido conduzidos no Brasil com espécies locais. A toxidade aguda de sulfato de cobre e do inseticida organofosforado triclorfom para duas espécies de Daphnia usadas em protocolos internacionais (D. similis e D. magna) e uma espécie nativa (D. laevis) foi avaliada na presença e ausência de sedimento.58 O triclorfom foi considerado mais tóxico que o sulfato de cobre para as três espécies estudadas, e a presença de sedimento reduziu a toxicidade dos dois agrotóxicos. Não houve diferença de sensibilidade ao triclorfom entre as três espécies e os autores propõem que a espécie nativa do Brasil (D. laevis) possa ser usada também como organismo-teste na avaliação da toxicidade aguda e crônica dos inseticidas organofosforados e a base de cobre. Peixes da espécie Poecilia reticulata, coletados no córrego Polonês (Campo Grande/MS) foram utilizados em testes de toxicidade aguda com formulações de glifosato e parationa-metílica.59 A CL50 foi de 8,11 mg L-1 para o glifosato e 0,64 mg L-1 para a parationa-metílica. Os peixes testados com o produto a base de parationa-metílica apresentaram alterações comportamentais (tais como natação descoordenada), típicas da ação do agrotóxico no sistema nervoso do peixe. Um estudo de toxicidade aguda do herbicida Roundup® (a base de glifosato) sobre juvenis de piauçu (Leporinus macrocephalus) indicou uma CL50 de 15,8 mg L-1 e alterações hepáticas nas concentrações de 6,67 e 13,3 mg L-1.60 Outro estudo conduzido com o piaçu e o herbicida Reward® (a base de diquat) indicou uma CL50 (96 h) de 34,76 mg diquat L-1, com alterações reversíveis na brânquia e no fígado dos peixes expostos.61 Os efeitos do carbofurano na biota do solo e água de uma região de cana-de açúcar em São Carlos (SP) foram avaliados utilizando organismos padrão para solo (Eisenia andrei, Folsomia candida, e Enchytraeus crypticus) e água (Ceriodaphnia silvestrii).62 E. crypticus foi o organismo mais sensível em solo e a maior mortalidade de C. silvestrii foi encontrada em amostras de escoamento superficial. Em geral, os resultados obtidos em laboratório foram consistentes com aqueles obtidos em campo, indicando que o modelo laboratorial pode ser uma ferramente útil para avaliar os efeitos tóxicos de agrotóxicos em solo e água de regiões trópicas. Um método para estudos em doses sub-letais de curto prazo para regiões trópicas com a espécie de peixe Poecilia reticulata foi proposto para simular o escoamento superficial no rio de Paraguaçu (BA) após aplicação de um produto a base de deltametrina e em condições de laboratório.63 Em ambas as condições, houve uma inibição significativa de acetylcholinesterase e indução de lactase desidrogenase e glutationa S-transferase observada na menor dose de exposição. Daam e van den Brink64 avaliaram as diferenças nas repostas ao estresse por agrotóxicos entre ecossistemas de água doce em climas tropicais e temperados considerando, entre outros, parâmetros relacionados ao clima, sensibilidade do ecossistema e práticas agrícolas. Os autores recomendaram a condução de estudos de campo para gerar dados de entrada em modelos ambientais e suas respectivas validações e o desenvolvimento de testes de toxicidade com espécies locais de água doce, com ênfase especial em camarões e espécies de macro invertebrados. Este é o desafio que os pesquisadores brasileiros vem vencendo nos últimos anos.
CONCLUSÃO Os processos que determinam a distribuição dos agrotóxicos no meio ambiente são múltiplos, e alguns são determinantes para compreender o risco para organismos aquáticos, como o escoamento superficial, lixiviação, sorção e degradação. A aplicação de modelos matemáticos e ferramentas informatizadas que auxiliem a compreender estes processos é importante para subsidiar uma tomada de decisão cientificamente embasada para o registro de um produto e identificar a necessidade de aprofundamento do conhecimento sobre o comportamento ambiental dos agrotóxicos em diferentes condições, racionalizando o processo de tomada de decisão. Vários documentos guias e modelos computacionais para a condução de avaliação de risco ambiental de agrotóxicos estão disponíveis atualmente e alguns trabalhos já foram realizados no sentido de adaptar ou desenvolver modelos para organismos aquáticos propostos em outros países para as condições edafoclimáticas do Brasil. Adicionalmente, é necessário organizar dados toxicológicos para organismos aquáticos que incluam não só espécies padrões indicadas em protocolos internacionais, mas também espécies locais de forma a contribuir para a construção de modelos que permitam extrapolar as conclusões da avaliação de risco para espécies representativas das regiões estudadas. Apesar de o Brasil possuir um arcabouço legal que prevê a avaliação de risco ambiental no processo de registro de agrotóxicos, até a presente data este processo não foi implementado sistematicamente pelo IBAMA, e os procedimentos se limitam a modelos de fase I. O avanço deste procedimento para etapas e ferramentas mais complexas ainda apresenta uma série de limitações, principalmente devido à larga extensão territorial do país, diversidade edafoclimática, e biodiversidade. A contribuição da comunidade científica neste processo é fundamental no sentido de avaliar cientificamente a viabilidade da aplicação de ferramentas e modelos já existentes ou no desenvolvimento de modelos que sejam adequados aos cenários brasileiros.
REFERÊNCIAS 1. Felena, J.; Raiher, A. P.; Ferreira, C. R.; Rev. Econ. Sociol. Rural 2013, 51, 555. 2. Decreto Nº 24.114 de 12 de abril de 1934. DOU, 28/05/1934. Rio de Janeiro. 3. Lei nº 7802, de 11 de julho de 1989. DOU, 12/07/1989. Brasília. 4. Spadotto, C. A.; Scorza Jr., R. P.; Dores, E. F. G. C.; Gleber, L.; Moraes, D. A. C.; Embrapa Monitoramento por Satélite. Documentos, 2010, 78, 46p. 5. Peters, K.; Bundschuh, M.; Schäfer, R. B.; Environ. Pollut. 2013, 180, 324. 6. http://www.epa.gov/oecaagct/lfra.html, acessada em Abril 2014. 7. U.S. Environmental Protection Agency. EPA/630/R-95/002F, Washington, DC, 1998. 8. European and Mediterranean Plant Protection Organization; EPPO Bulletin 2003, 33, 147. 9. Stephenson, G. R.; Solomon, K. R.; Pesticides and the Environment; Canadian Network of Toxicology Centres Press Guelph, Ontario, Canada, 2007. 10. Department of Health and Ageing. IBSN:0642820910, Commonwealth of Australia, 2002. 11. http://www.sumitomo-chem.co.jp/english/rd/report/theses/docs/20080102_tnf.pdf, acessada em Abril 2014. 12. Zhou, J. In Global Framework for Implementing Consistent Ecological Risk Assessment for Sustainable Agriculture, Cap. 2; IUPAC Environmental Risk Assessment Workshop, Beijing, China, 2012. 13. Jerez, J.; Peralta, J. M.; Tapia, F.; Mejias, J.; Jerez, A.; Encina, F.; Licitacion Pública 612-807-Le05, Ministerio de Agricultura, Santiago, Chile, 2006. 14. Finizio, A.; Calliera, M.; Vighi, M.; Ecotoxicol. Environ. Saf. 2001, 49, 262. 15. Portaria Normativa IBAMA nº 84, de 15 de outubro de 1996. Brasília. 16. Decreto Nº 4.074, de 4 de janeiro de 2002. DOU 08/01/2002, Brasília. 17. http://www.ibama.gov.br/phocadownload/Qualidade_Ambiental/avaliacao_risco_ambiental_agrotoxicos 18. Portaria IBAMA nº 6 de 17 de maio de 2012. DOU 23/05/2012, Brasília, 2012. 19. http://www.oecd-ilibrary.org/environment/oecd-guidelines-for-the-testing-of-chemicals-section-1-physical-chemical 20. http://www.oecd-ilibrary.org/environment/oecd-guidelines-for-the-testing-of-chemicals-section-2-effects-on- 21. http://www.epa.gov/ocspp/pubs/frs/home/guidelin.htm, acessada em Abril 2014 22. Portaria Conjunta IBAMA/INMETRO nº1 de 29 de março de 2010. DOU 08/04/2012, Brasília. 23. http://sitem.herts.ac.uk/aeru/iupac/, acessada em Fevereiro 2014. 24. http://www.ibama.gov.br/qualidade-ambiental/avaliacao-do-potencial-de-periculosidade-ambiental-ppa, acessada em Abril 2014. 25. Guidance for the Development of Conceptual Models for a Problem Formulation Developed for Registation Review. U.S. Environmental Protection Agency Ed. Washington, D.C., 2011. 26. Cohen, S. Z.; Wauchope, R. D.; Klein, A. W.; Eadsforth, C. V.; Graney, R.; Pure & Appl. Chem. 1995, 67, 2109, 27. Gustafson, D. I.; Environ. Toxicol. Chem. 1989, 8, 339. 28. Spadotto, C. A.; Pesticidas: Revista de Ecotoxicologia e Meio Ambiente 2002, 12, 69. 29. Paraíba, L. C.; Cerdeira, A. L.; da Silva, E. F.; Martins, J. S.; Coutinho, H. L.; Chemosphere 2003, 53, 1087. 30. Goss, D. W.; Weed Technology 1992, 6, 701. 31. http://www.epa.gov/oppefed1/models/water/geneec2_users_manual.htm, acessada em Abril 2014 32. http://www2.epa.gov/exposure-assessment-models/przm-version-index, acessada em Abril 2014. 33. http://www.slu.se/en/collaborative-centres-and-projects/centre-for-chemical-pesticides-ckb1/areas-of-operation-within 34. http://www.pearl.pesticidemodels.eu, acessada em Abril 2014. 35. http://focus.jrc.ec.europa.eu/gw/index.html, acessada em Abril 2014. 36. Spadotto, C. A.; Moraes, D. A. C.; Ballarin, A. W.; Laperuta Filho, J.; Colenci, R. A.; Embrapa Monitoramento por Satélite, Boletim de Pesquisa e Desenvolvimento 2010, 7, disponível em http://www.infoteca.cnptia.embrapa.br/bitstream/doc/662332/1/boletim6ATUAL.pdf, acessada em Abril 2014. 37. Scorza Junior, R. P.; Névola, F. A.; Ayelo, V. S., Embrapa Agropecuária Oeste. Boletim de pesquisa e desenvolvimento 2010, 58, disponível em http://www.infoteca.cnptia.embrapa.br/bitstream/doc/880316/1/BP201058.pdf, acessada em abril 2014 38. http://www.epa.gov/oppefed1/ecorisk_ders/toera_risk.htm, acessada em Abril 2014. 39. USEPA, Risk Assessment Guidance for Superfund: Volume III - Part A, Process for Conducting Probabilistic Risk Assessment, EPA 540-R-02-002, 2001. 40. Comunicado IBAMA. DOU 19/07/2012 (nº 192, Seção 1, p. 112), Brasília. 41. Ato Conjunto MAPA/IBAMA no 1, de 2 outubro de 2012. DOU, 03/10/2012, Brasília. 42. RDC ANVISA nº- 28, de 9 de agosto de 2010, DOU Seção 1, 16/08/2010, Brasília. 43. Milhome, M. A. L.; Sousa, D. O. B.; Lima, F. A. F.; Nascimento, R. F.; Engenharia Sanitária e Ambiental 2009, 14, 363. 44. Brito, F. B.; de Vasco, A. N.; Pereira, A. P. S.; Méllo Jr., A. V.; Nogueira, J. C.; Rev. Ciênc. Agron. 2012, 43, 390. 45. Soares, A. F. S.; Leão, M.; Vianna Neto, M. R.; Oliveira, S. M. A. C.; Revista Brasileira de Engenharia Agrícola e Ambiental 2012, 16, 425. 46. Barbosa, R. B. F.; Gabas, S. G.; Lastoria, G.; Cavazzana, G. H.; de Souza, A.; XVI Congresso Brasileiro de Águas Subterrâneas, São Luis, Brasil, 2010. 47. Mariot, E.; Weber, O. L. S.; Spadotto, C. A.; Carvalho Dores, E. F. G., Pesticidas: Revista de Ecotoxicologia e Meio Ambiente 2010, 19, 57. 48. Rosa, F. C.; Pinheiro, A.; da Silva, M. R.; XVII Simpósio Brasileiro de Recursos Hídricos, São Paulo, Brasil, 2007. 49. Moraes, D. A. C.; Zimback, C. R. L.; Spadotto, C. A.; Irriga 2012, 17, 299. 50. Rebelo, R. M; Dissertação de Mestrado, Universidade de Brasília, Brasil, 2013. 51. Scorza Júnior, R. P., Silva, J. P., Embrapa Agropecuária Oeste, Boletim de Pesquisa e Desenvolvimento 2006, 36, disponível em http://www.cpao.embrapa.br/publicacoes/online/zip/BP200636.pdf, acessada em Abril 2014. 52. Castro, N. R. A.; Rigitano, R. L. O.; Lima, J. M.; Scorza Júnior, R. P.; Pesticidas: Revista de Ecotoxicologia e Meio Ambiente 2007, 16, 1. 53. Scorza Júnior, R. P.; Rigitano, R. L. O.; Franco, A. A.; Embrapa Agropecuária Oeste, Boletim de pesquisa e desenvolvimento, 2010, 57, disponível em http://www.infoteca.cnptia.embrapa.br/bitstream/doc/880300/1/BP201057.pdf, acessada em Abril 2014 54. Pinto, O. B.; Dissertação de Mestrado, Universidades de São Paulo, Brasil, 2010. 55. Resgalla, C.; Noldin, J. A.; Tamanaha, M. S.; Deschamps, F. C.; Eberhardt, D. S.; Rörig, L. R.; Ecotoxicology 2007, 16, 565. 56. Kwok, K. W.; Leung, K. M.; Lui, G. S.; Chu, S. V.; Lam, P. K.; Morritt, D.; Maltby, L.; Brock, T. C.; van den Brink, P. J.; Warne, M. S.; Crane, M.; Integr. Environ. Assess. Manage. 2007, 3, 49. 57. http://epa.gov/ceampubl/fchain/webice/, acessada em Abril 2014 58. Arauco, L. R. R.; Cruz, C.; Machado Neto, J. G.; Pesticidas: Revista de Ecotoxicologia e Meio Ambiente. 2005, 15, , 55. 59. Favero, S.; de Souza, E. M.; Matias, R.; Ensaios e Ciência: Ciências Biológicas, Agrárias e da Saúde. 2005, 9, 315. 60. Albinati, A. C. L.; Moreira, E. L. T.; Albinati, R. C. B.; Carvalho, J. V.; Santos, G. B.; Lira, A. D.; Rev. Bras. Saúde Prod. Anim. 2007, 8, 184. 61. Henares, M. N. P.; Cruz, C.; Gomes, G. R.; Pitelli, R. A.; Machado, M. R. F., Pesticidas: Revista de Ecotoxicologia e Meio Ambiente. 2007, 17, 107. 62. Chelinho, S.; Lopes, I.; Natal-da-Luz, T.; Domene, X.; Tenorio Nunes, M. E.; Espíndola, E. L. G.; Ribeiro, R.; Sousa, J. P.; Environ. Toxicol. Chem. 2012, 31, 437 63. Moreira, S. M.; Moreira-Santos, M.; Rendón-von Osten, J.; Da Silva, E. M.; Ribeiro, R.; Guilhermino, L.; Soares, A.; Ecotoxicol. Environ. Saf. 2010, 73, 893. 64. Daam, M. A.; Van den Brink, P. J.; Ecotoxicology 2010, 19, 24. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access