Educação
|
|
| "Serpentes de Faraó" - a história de uma brincadeira pirotécnica e sua aplicabilidade no ensino de princípios químicos básicos "Pharaoh's Snakes" - history of a fun pyrotechnical experiment and its applicability in teaching basic chemical principles |
|
Marcius A. UllmannI; Wilhelm M. WallauI; Daniela BianchiniI,*; Andressa da C. SchneidII; Lara M. P. MontenegroI
ICentro de Ciências Químicas, Farmacêuticas e de Alimentos, Universidade Federal de Pelotas, 96010-900 Capão do Leão - RS, Brasil Recebido em 18/12/2013 *e-mail: danielabianchini.ufpel@gmail.com ABSTRACT Fun methodologies developed with alternative materials for teaching chemical reactions of carbon are interesting activities for discussing concepts of stoichiometry and thermochemistry. The decomposition of organic matter, CO2 production and coal formation can be demonstrated in the experiment "Pharaoh's snake". This experiment is attractive since the simple combustion of sucrose generates a peculiar structure of coal. This paper proposes a simple methodology for making the sugar tablets used in the experiment and contextualizes the experimental observations with the chemical reaction of carbon which leads to coal and to the thermodynamics involving combustion processes. INTRODUÇÃO A História Química das "Serpentes de Faraó" Ninguém nega o valor de experiências práticas tanto para o ensino da Química como também para a simples diversão do público e para a autopromoção da "ciência" em demonstrações práticas, indispensáveis desde as Feiras Medievais até as modernas Conferências Científicas Públicas. Um exemplo de como uma apresentação feita puramente para chamar a atenção do público pode fecundar o progresso da ciência são os trabalhos de Liebig com fulminato de prata, incentivado por um comerciante viajante durante uma feira na sua cidade natal.1 Esses trabalhos, parcialmente desenvolvidos em colaboração com Wöhler, investigando fulminatos e cianatos de diversos metais, culminaram mais tarde na introdução do conceito de isomeria por Berzelius em uma química que já adotara o modelo científico para se firmar como ciência.1 Os estudos de Wöhler renderam-lhe, também, a descoberta de tiocianato de mercúrio(II), o qual foi vendido até os anos sessenta do século passado nas Feiras e Quermesses da Alemanha como artigo pirotécnico. Pequenos cones de tiocianato de mercúrio(II), que podem ser acesos por fricção em uma caixinha de fósforos, se transformam em um sólido espumoso acinzentado com formas pitorescas durante sua queima. O processo de expansão do sólido dá lugar a um material com várias vezes o volume do cone original, como se pode ver pelo arquétipo da Figura 1 e em inúmeros vídeos hospedados na internet.2,3
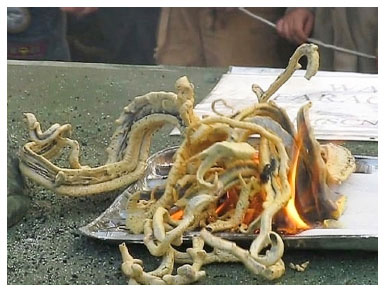 Figura 1. "Serpentes de Faraó" formadas pela decomposição de Tiocianato de Mercúrio(II)2
Lamentavelmente, a ingestão do tiocianato de mercúrio(II) ou da espuma resultante da brincadeira descrita, principalmente constituída por sulfeto de mercúrio, levou a morte de crianças, o que resultou a proibição desse divertimento aparentemente "inocente".4 Além das formas impressionantes, a queima do tiocianato de mercúrio(II) possui uma química interessante.1 Com base nas informações disponíveis na literatura4, propõem-se que durante o aquecimento, o tiocianato (ou rodaneto) de mercúrio(II) se decompõe segundo o Esquema 1a e os produtos intermediários - cianogênio e dissulfeto de carbono - formam com o oxigênio, em uma reação exotérmica, nitrogênio, dióxido de carbono e dióxido de enxofre, conforme o Esquema 1b e o Esquema 1c. A estequiometria da reação de decomposição do tiocianato de mercúrio(II), entretanto, não parece completamente esclarecida, uma vez que paracianogênio também é formado durante o processo.
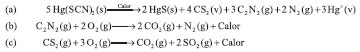 Esquema 1. Reações envolvidas na formação da "Serpente de Faraó"
O paracianogênio (CN)x é um sólido castanho que é resultado da polimerização do cianogênio advindo do tiocianato. A estrutura do paracianogênio é descrita como uma rede policíclica condensada, composta por anéis de seis membros, gerando uma fita polimérica indicada na Figura 2.5,6 Bircumshaw et al.5 mostram a formação de paracianogênio como um agregado filamentoso, cuja forma sugere que a "serpente de faraó" adquire a estrutura macroscópica que lhe é peculiar justamente por causa das fibras de paracianogênio formadas em nível microscópico.
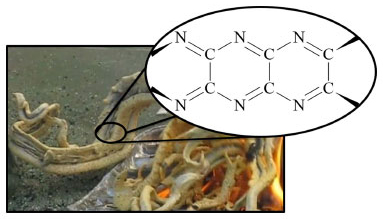 Figura 2. Detalhe indicando esqueleto molecular da fita de paracianogênio, que compõe a "Serpente de Faraó" (ao fundo)
Devido à temperatura de decomposição em torno de 177 ºC,7 supõem-se que o tiocianato de mercúrio(II) se torna líquido na temperatura em que ocorre a reação, permitindo que os produtos de decomposição gasosos o transformem em uma espuma posteriormente. Como a decomposição do tiocianato continua na espuma, o produto final (HgS, Temperatura de fusão = 209-210 ºC e Temperatura de decomposição = 160 ºC)8 preserva a forma espumosa, formando um sólido com volume muitas vezes maior que o do sal de partida. Devido ao movimento ofídico e à forma final das cinzas que fazem a matéria inorgânica aparentar-se com a forma de um ser vivo, semelhante ao fenômeno descrito no Livro do Êxodo,9 essa transformação química é conhecida como "A Serpente de Faraó".1 O sulfeto de mercúrio(II) pode ser encontrado sob duas formas alotrópicas distintas: a α-HgS(s), com estrutura hexagonal e coloração vermelha, conhecida como cinabre; e a β-HgS(s), com estrutura cúbica e coloração preta, chamada metacinabre.10 Como, então, explicar a coloração clara ou esbranquiçada, obtida na quase totalidade dos experimentos de decomposição feitos com rodaneto de mercúrio(II)? Nenhuma literatura explicita o que de fato acontece com a estrutura e composição da serpente para que seja obtida aquela coloração, no entanto a decomposição do tiocianato de mercúrio(II) por ignição é descrita, sensorialmente, pela produção de uma chama azul imperceptível, com formação de dióxido de enxofre e vapor de mercúrio.4 A massa pálida, castanha ou cinza, que é obtida como resultado dos experimentos, segundo Tenney L. Davis,4 possui um recheio mais escuro, constituído de HgS, provavelmente na forma cúbica, e paracianogênio. Propõem-se, então, que a camada externa da massa fique mais clara, pois os gases da decomposição do HgS e Hg0 difundem-se mais facilmente através da superfície, abandonando a casca da espuma, deixando resíduos de paracianogênio de coloração castanha ou cinza clara. Segundo Holleman e Wiberg,11 HgS é capaz de incorporar a si próprio átomos do calcogênio, de forma a produzir ânions [S-Hg-S]2- quase lineares, dando origem a ditiomercuratos ortorrômbicos do tipo Na2HgS2 e K2HgS2, que são, por sua vez, incolores.12 Esses compostos diluem-se ao (CN)x e tornam a massa resultante mais clara, sendo que esse efeito de máscara pode, segundo os autores deste trabalho, justificar a matiz pálida do sólido final formado pela decomposição de tiocianato de mercúrio(II). Embora o rodaneto de mercúrio seja facilmente obtido por precipitação (solubilidade em água a 25 ºC: 2,2×10-3 mol L-1)13 usando soluções de Hg(NO3)2 e NH4SCN,1 ele e os produtos e intermediários da sua decomposição devem ser classificados segundo a Norma ABNT NBR 1472514 como produtos químicos perigosos (ver Tabela 1S no Material suplementar), o que torna proibitivo a realização desse experimento como elemento de show em feira de ciências ou evento semelhante ou em sala de aula, executado por alunos, especialmente do ensino médio. No entanto, tendo o professor acesso ao reagente tiocianato de mercúrio e dispondo de local adequado, que é, via de regra, um laboratório equipado com capela e boa exaustão, sugere-se a execução do experimento de forma demonstrativa, permitindo aos estudantes visualizar os procedimentos de segurança ao trabalhar com compostos nocivos e explicitando o correto modo de descarte dos resíduos; sem, contudo, expor os discentes desnecessariamente a riscos. Isso não só dará uma noção de sustentabilidade aos alunos, como também permitirá a eles ver como uma reação química conduzida de forma segura reduz consideravelmente o perigo de acidentes. O experimento da "Serpente do Faraó" pode ser eficientemente conduzido em capela, acondicionando pequena quantidade do reagente tiocianato de mercúrio(II) em béquer ou vasilha com abertura larga. É necessário que o professor esteja com o seu equipamento de proteção individual (i.e., jaleco, luvas, óculos de proteção, calças compridas e sapatos fechados). É colocado fogo no reagente com fósforos comuns e observa-se o resultado, ou seja, o crescimento da "serpente". Uma versão potencialmente "inofensiva" de "Serpentes de Faraó" consiste em uma mistura de dois gramas de dicromato de potássio, um grama de nitrato de potássio e três gramas de açúcar, que serão finamente pulverizados e acesos.15 Um experimento semelhante, conhecido como "Vulcão",16,17 mostra a decomposição de dicromato de amônio, descrita por Mahieu et al.18 como uma série de reações intermediárias que se processam a medida que a temperatura do sistema aumenta (Esquema 2). A intumescência do óxido de cromo(VI) fundido (Temperatura de fusão 193-198 ºC),19 causada pelo desenvolvimento de nitrogênio e vapor de água, resulta, de forma semelhante à "Serpente de Faraó", em um sólido espumoso constituído, principalmente, por óxido de cromo(III). Como mostra a Tabela 1S, nesses casos os reagentes e intermediários também são altamente tóxicos. A sua realização somente seria possível em condições controladas, usando uma capela altamente eficiente.
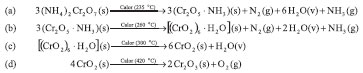 Esquema 2. Reações envolvidas no experimento do "Vulcão"
Já na primeira década do século XX, Witt20 reconheceu que o experimento descrito, além de ser chamativo e divertido, revela-se como arquétipo para a formação de espumas sólidas. Essas espumas são materiais de grande importância técnica, como por exemplo o coque, que na época foi provavelmente o mais importante sólido espumoso, obtido como um resíduo do processo de aquecimento de hulha em atmosfera inerte.11 Witt caracterizou este processo assim: "A hulha se transforma, antes da decomposição definitiva, em um estado pastoso. Nesta pasta, os gases formados na decomposição impelem bolinhas, e assim aparece o caráter espumoso do coque".20 Atualmente, a aplicação tecnológica de espumas sólidas não pode mais ser ignorada: na forma de poliuretanos, são usadas para preencher estofados ou como isolante térmico na construção civil; como alimento, são consumidas na forma de sorvetes e pães; a pedra-pomes, uma rocha esponjosa, é utilizada como abrasivo em cosméticos ou in natura, serve para remover calosidades dos pés, ou ainda, como peneira molecular.21 Existem ainda vidros espumosos e metais espumosos, todos preparados aplicando o mesmo princípio que leva a formação das "Serpentes de Faraó". Dessa forma, o experimento pode ser usado como ponto inicial para discutir as propriedades desses materiais com os alunos nos diversos níveis de educação e exemplificar algumas propriedades das dispersões coloidais na forma de espuma sólida, tais como baixa densidade e elevada superfície específica.22 Por outro lado, Witt20, naquela época, já alertara sobre o perigo inerente ao rodaneto de mercúrio(II), livremente vendido como brinquedo pirotécnico, embora sua toxicidade fosse maior que a de muitos produtos cuja comercialização era já restrita ou proibida no início do século XX. Sugeriram, então, experimentos que mostravam o mesmo efeito da "Serpente de Faraó", porém utilizando como material de partida compostos inofensivos, tanto para o ser humano quanto para o meio ambiente em geral, tais como cinzas de charuto, etanol e Pastilhas de Ems. Este último trata-se de um produto recomendado para aliviar dores de garganta, rouquidão, tosse e para umidificar a mucosa da garganta. Ele é manufaturado a partir da água mineral da estância de Bad Ems no oeste da Alemanha, constituído principalmente de sal natural de Ems, o qual contém basicamente bicarbonato de sódio e sacarose; durante o beneficiamento sofre adição de diversos auxiliares como goma-arábica, ácido esteárico, astragalus, estearato de cálcio e aroma de baunilha.23 Esse tipo de experimento é mais sustentável, dando origem a uma "Serpente (não peçonhenta) de Faraó". Esta nomenclatura, portanto, possui clara conotação de representar um processo ecologicamente correto. Na descrição original do experimento,20 forma-se uma massa com as cinzas de charuto em um pires e dispõe-se no topo dela três pastilhas de Ems bem próximas, como mostra a Figura 3. Subsequentemente, a massa é encharcada com etanol e acesa através de fósforos. Depois de algum tempo as pastilhas começam a ficar escuras e "se levanta a partir da chama uma serpente negra, a qual mais e mais se desenvolve e se deposita na mesa."20 Nas versões mais modernas do experimento,24,25 as cinzas de charuto são substituídas por areia, mantendo os demais procedimentos. O resultado desse experimento pode ser conferido na Figura 3 ou em diversos vídeos hospedados na internet.26
 Figura 3. Preparação de "Serpente (não-peçonhenta) de Faraó" com Pastilhas de Ems
O princípio da formação de serpentes a partir das pastilhas de Ems ou do rodaneto de mercúrio(II) é o mesmo. Com o calor liberado na combustão do etanol, o bicarbonato de sódio se decompõe em torno de 145 ºC27 formando Na2CO3, CO2 e H2O. Os produtos gasosos formam uma espuma com a sacarose, cuja fusão e decomposição inicia em 160 ºC,28 o que resulta no aumento do volume do sólido, preservando a estrutura porosa nas cinzas formadas.20 Assim, é possível demonstrar aos alunos uma das funções mais importantes da Química Aplicada: a substituição de matéria-prima nociva por produtos menos ofensivos e de menor impacto ambiental. Aplicação das "Serpentes (não peçonhentas) de Faraó" nas aulas práticas de Química Inorgânica e Química Geral Embora surpreenda alguns Químicos Orgânicos, o carbono também está presente em substâncias inorgânicas, tais como os carbonatos, encontrados em rochas calcárias na forma de CaCO3, e no dióxido de carbono, principal produto da combustão completa de compostos carbonados.29 Visto que a química envolvendo o elemento carbono exerce uma grande influência sobre parte dos sistemas existentes no universo, inclusive nos organismos vivos, percebe-se o quão importante é para o estudante compreender as propriedades químicas e físicas de compostos que contenham carbono. A partir desta visão, os indivíduos, enquanto seres em formação, devem ser capazes de identificar fenômenos e correlacioná-los com o elemento em questão, conseguindo agir criticamente perante os mesmos.30 As propriedades químicas e físicas de compostos contendo carbono são temas comumente abordados em disciplinas de Química Inorgânica e Química Geral, durante a graduação, quando se trata as propriedades do grupo 14. Sabendo-se que o indivíduo aprende de forma mais efetiva por meio de estímulos visuais e que os experimentos levam ao questionamento das situações contraditórias formuladas na mente do aluno, agregando sentido aos conceitos,31 propõe-se a exploração do experimento "Serpente (não peçonhenta) de Faraó", descrito acima, para apresentar aos graduandos e alunos do ensino médio a decomposição do bicarbonato e a carbonização de compostos orgânicos, fenômenos importantes, pois a compreensão dessas transformações envolve a base de inúmeros conhecimentos termodinâmicos, tais como variações entálpicas, aumento de entropia e conversões de energia. Os saberes citados estão, por sua vez, envolvidos nos processos de funcionamento de máquinas térmicas, queima de carvão e aproveitamento de energia.32 Assuntos muito em voga quando se trata de combustíveis que mantém o funcionamento de uma sociedade, e.g., petróleo, carvão, biodiesel ou bioetanol. Como as Pastilhas de Ems não estão disponíveis no Brasil, neste artigo apresentamos uma metodologia que faz uso de reagentes utilizados no cotidiano e de técnicas simples de preparo das pastilhas, o que permite a realização do experimento também em nível de Ensino Médio. A exploração deste texto em sala de aula pode, ainda, mostrar como a Química Aplicada aborda os conhecimentos dos compostos e reações envolvidas num processo para propor a substituição de materiais indisponíveis por reagentes de melhor disponibilidade ou economicamente mais viáveis. Mais além, a substituição por pastilhas pré-preparadas permite que os estudantes possam estudar a influência de cada um dos compostos envolvidos no resultado final. Além da descrição da nova metodologia de preparo das pastilhas, faz-se a discussão de alguns parâmetros que podem nortear conteúdos de estequiometria e termoquímica utilizando um experimento tão simples quanto é a "Serpente (não peçonhenta) de Faraó".
MATERIAL E REAGENTES Baseado nas funções que os componentes mais abundantes desempenham no experimento e considerando a utilização de materiais e reagentes de baixo valor aquisitivo e fácil acesso, foram escolhidos para a produção e combustão das pastilhas os itens enumerados na Tabela 1.
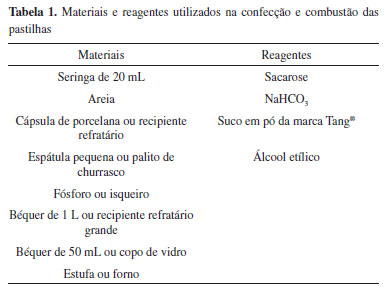
PROCEDIMENTO Foram confeccionadas duas séries de partilhas com quantidades distintas de bicarbonato de sódio ou suco em pó, conforme a Tabela 2. A execução do experimento envolve duas etapas: preparação do agregado orgânico-inorgânico e combustão das pastilhas, que podem ser realizadas em duas aulas de 40 a 50 min.
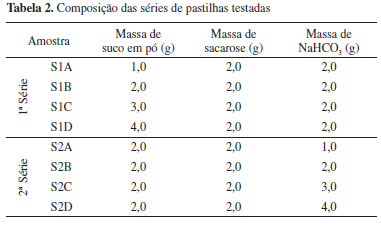
As pastilhas foram confeccionadas seguindo os passos listados abaixo:
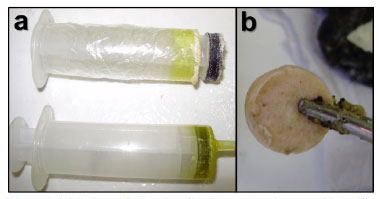 Figura 4. (a) Seringas de 20 mL utilizadas nos experimentos. (b) Pastilha pronta para o experimento
Para combustão do agregado orgânico-inorgânico devem-se seguir as seguintes etapas:
RESULTADOS E DISCUSSÃO A pastilha desenvolvida é uma espécie de agregado orgânico-inorgânico, pois os compostos que a integram podem ser classificados em dois tipos: compostos carbonados, formados por ligações covalentes (i.e., a sacarose e o suco em pó); e compostos salinos, formados por ligações iônicas (i.e., o NaHCO3). O efeito visual observado com a pastilha preparada pela metodologia proposta foi maximizado e pareceu visualmente mais intenso ao efeito que se observa nos vídeos apresentados na internet utilizando as Pastilhas de Ems,26 ou aqueles vídeos em que o experimento era feito somente com o uso de açúcar e bicarbonato.17 Isto se deve ou a diferentes quantidades de açúcar e bicarbonato utilizadas na manufatura dos agregados orgânico-inorgânico em comparação às Pastilhas de Ems, ou à adição do suco em pó, devido aos auxiliares nele contidos, especialmente a goma arábica. A goma arábica ou goma acácia é uma resina natural obtida pela dessecação espontânea do exsudado dos troncos e dos ramos das Acacia senegal e Acacia seyal. Esta resina é empregada para melhorar as características texturais dos alimentos, além de ser utilizada como revestimento para alimentos e medicamentos.33 A goma arábica possui a constituição química de um polissacarídeo acídico contendo D-galactose, L-arabinose, L-ramnose, ácido D-glucurônico e, em pequena quantidade, oligossacarídeos livres (e.g., arabinose, ribose, manose, etc.).34 É essa estrutura química que faz a goma arábica agregar, de forma mais eficiente, os constituintes da pastilha e a ela atribuiu-se a melhor e mais prolongada estruturação da "Serpente". No Esquema 3a é mostrada a equação de combustão incompleta de carboidratos, intuída pelos autores deste trabalho com base na fórmula geral dos carboidratos e na formação da massa negra da Serpente (não peçonhenta) de Faraó, produto da combustão. O Esquema 3b mostra a decomposição do bicarbonato de sódio,27 contextualizando o experimento como consequência dessas reações químicas.
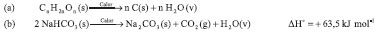 Esquema 3. Reações envolvidas na formação da "Serpente (não peçonhenta) de Faraó"
A Figura 5 mostra uma sequência de queima e crescimento da pastilha com composição S2A, imersa por 30 minutos em álcool etílico. O experimento pode levar cerca de 2 min para o início da combustão e o efeito de serpente saindo da areia pode perdurar de 5 a 10 minutos.
 Figura 5. Evolução da combustão e expansão da pastilha S2A no tempo
Estequiometria intuitiva a partir do efeito visual A Figura 6 mostra a comparação do efeito visual da combustão das pastilhas confeccionadas conforme a Tabela 2, sugerindo que um aumento no teor de suco (série 1) e a diminuição do teor de bicarbonato de sódio (série 2) contribuem positivamente para o tamanho e o tempo de estruturação da "serpente (não peçonhenta)".
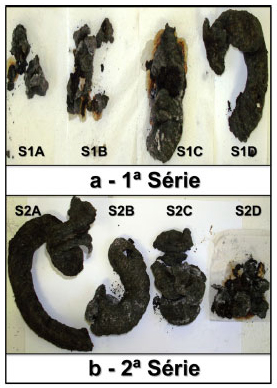 Figura 6. Efeito de "serpente" observado para (a) 1ª série e (b) 2ª série de pastilhas
O experimento mostra que o incremento no teor de suco (série 1) gera uma estrutura de serpente maior e a reação perdura por mais tempo, pois o aumento da massa de goma arábica e outros polissacarídeos presentes no suco aumentam, quase que estequiometricamente, a quantidade de carvão que será gerada a partir da combustão incompleta dos açúcares. Dessa forma, a informação visual obtida permite inferir que havia mais ou menos reagentes de partida, sem que haja a necessidade de um cálculo mais apurado. Essa metodologia permite uma explanação rápida sobre estequiometria para alunos da graduação e bastante lúdica para alunos do ensino médio. A série 2 mostra que o incremento na quantidade de NaHCO3 causa uma diminuição no tamanho da serpente e menor tempo de reação. Esse comportamento contradiz o senso de que uma quantidade maior de CO2, gerado por mais NaHCO3, levará a uma estrutura de carvão maior. No entanto é possível considerar uma justificativa inversa: a quantidade ascendente de NaHCO3 faz diminuir a intensidade do efeito visual da serpente justamente por causa do excesso de óxidos não-inflamáveis gerados e por causa da maior quantidade de CO2 liberado, o qual acarretará no colapso da estrutura de carvão que não suporta a expansão exacerbada do gás carbônico. Assim, a estequiometria entre reagentes e produtos ainda pode ser visualmente identificada, todavia em uma ordem inversa. Para um melhor efeito visual, a pastilha deve ser encharcada com álcool etílico antes do experimento. Deve-se levar em consideração que uma pastilha heterogeneamente encharcada poderia causar distorções na estrutura da "Serpente (não peçonhenta) de Faraó". Das otimizações realizadas, depreende-se que 1 h é o tempo máximo e ideal para a imersão da pastilha. Após o período de 1 h pode haver solubilização do material da pastilha, o que compromete a estrutura de carvão deixando-a quebradiça. Entretanto, 30 minutos já são suficientes para um efeito significativo e é um intervalo de tempo ótimo para um experimento em laboratórios didáticos. Conceitos de quimiometria, procurando a melhor relação mássica de componentes da pastilha e de tempos de imersão em álcool etílico, utilizando um planejamento fatorial, podem ser abordados uma vez que o experimento permite variações nesses parâmetros e permite um fácil entendimento visual da variação dos parâmetros de massa e tempo no etanol. A ausência de suco na pastilha, ou seja, de goma arábica, também foi um parâmetro avaliado no experimento. Conforme mostra a Figura 7, a ausência do suco causa uma depreciação na estrutura orgânica carbonizada, reforçando a necessidade da goma arábica na estruturação da "serpente".
 Figura 7. Comparação de pastilhas com e sem o suco em pó
Termoquímica e o estudo da combustão A decomposição das pastilhas orgânico-inorgânicas pode nortear discussões acerca de termoquímica, mostrando que a combustão incompleta acarreta em menor quantidade de calor gerado pela reação exotérmica, ou seja, um menor aproveitamento de seu potencial energético, como se visualiza na equação de combustão completa da sacarose no Esquema 4a, em comparação com a combustão incompleta desse mesmo composto (Esquema 4b e Esquema 4c). As reações explicitadas no Esquema 4 foram propostas pelos autores deste trabalho, considerando a definição usual para processos de combustão - i.e., Composto(s,l,g) + O2(g) → CO2(g) + H2O(l,v).32 Todos os valores das entalpias referentes às reações de combustão, bem como as entalpias de combustão constantes na Tabela 3, foram calculados com base nas entalpias padrão de formação das substâncias explicitadas na literatura,32 utilizando a Lei de Hess: (ΔHº(reação) = ΣΔfHº(produtos) - ΣΔfHº(reagentes)), onde ΔHº(reação) é a entalpia padrão de combustão, ΔfHº(produtos) é a entalpia padrão de formação dos produtos e ΔfHº(reagentes) é a entalpia padrão de formação dos reagentes.
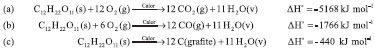 Esquema 4. Combustão completa e incompleta da sacarose
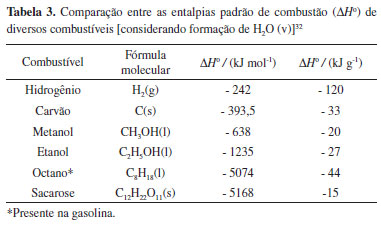
O experimento em questão promove a discussão acerca da decomposição térmica de bicarbonatos e a carbonização de matéria orgânica. Correlacionando o experimento à termoquímica, as perdas entálpicas por decomposição incompleta (equações b e c) são economicamente desvantajosas no caso da queima de combustíveis, na qual uma mesma quantidade de matéria-prima gera menor quantidade de energia. Nesse contexto, a importância do conhecimento termoquímico reside em obter parâmetros comparativos entre substâncias e julgar sua eficiência como combustível. A Tabela 3 mostra diferentes combustíveis e a entalpia padrão de combustão (ΔHº) desses combustíveis. Observa-se que a energia dissipada na combustão, por mol de substância, aumenta com a massa molar dos reagentes, todavia, a entalpia de combustão por grama de reagente apresenta ordem diversa. Avaliando a energia liberada por grama do reagente é possível estabelecer a seguinte ordem descendente: H2 (g) >> C8H18 (g) > C (s) > C2H5OH (l) > CH3OH (l) > C12H22O11 (s), da qual se depreende que o combustível mais eficiente é o hidrogênio, pois libera maior quantidade de energia com a mesma massa que os demais combustíveis, i.e., é necessária menor massa de hidrogênio para conseguir que a reação libere a mesma quantidade energética que o octano, o carvão e assim sucessivamente. Além disso, a combustão do hidrogênio gera unicamente água como produto, portanto, é uma reação limpa em comparação com os demais combustíveis, que geram gás carbônico como um dos produtos de sua combustão. O CO2 é um conhecido gás de efeito estufa. Cabe ressaltar que o hidrogênio está sendo extensivamente estudado como fonte energética pela comunidade científica,35 o que pode ser uma oportunidade para os estudantes de todos os níveis desenvolverem competências para a compreensão e uso dessa tecnologia. A sacarose aparece no outro extremo da escala de energias liberadas por grama de reagente, indicando que ela é o combustível menos eficiente, pois é necessária uma grande quantidade de sacarose, em massa, para conseguir o mesmo potencial energético que o etanol ou a gasolina, por exemplo. Portanto, não faz sentido construir motores alimentados por açúcares com elevada massa molar. O etanol, apesar de não ser tão eficiente quanto carvão ou gasolina, possui o apelo de um combustível renovável, podendo ser obtido através da cana-de-açúcar, extensivamente cultivada no território brasileiro.36 Existem, ainda, pesquisas que buscam a viabilidade de extrair o etanol do bagaço da cana-de-açúcar, aproveitando o resíduo do processamento da cana para a produção de combustível, que recebe o nome de bioetanol.37 O etanol é bastante apreciado como combustível renovável, pois há perspectivas de que os combustíveis fósseis terminem dentre em breve. As estimativas são em torno de 35 anos para petróleo e gás natural e em torno de 107 anos para o carvão.38 Esses dados convidam para que cientistas melhorem a eficiência na obtenção dos combustíveis renováveis já consagrados, como o etanol, buscando novas fontes para obtê-lo. O metanol, que também figura na lista da Tabela 3 por ser apresentado na literatura39 como excelente combustível e intermediário chave para reações industriais, tais como a produção de olefinas, possui menor eficiência energética por grama da substância em relação ao etanol, bastante difundido no cenário nacional. No entanto, o álcool metílico é obtido por meio da reação de reforma do gás de síntese, que consiste em uma mistura de H2 e CO2; em virtude dessa reação, a síntese de metanol a partir de CO2 atmosférico tem sido sugerida por pesquisadores para diminuir as concentrações desse gás do efeito estufa na atmosfera, tornando o metanol um sequestrador de CO2.39 Termodinamicamente, as reações de combustão, como aquelas que levam à formação da "Serpente de Faraó" ou da "Serpente (não peçonhenta) de Faraó", são exotérmicas e resultam em um aumento da entropia. A relação ΔG = ΔH - TΔS mostra que as reações de combustão são espontâneas, pois ΔH < 0 e DS > 0, o que leva invariavelmente a ΔG < 0, indicando a espontaneidade da reação. Como as reações de combustão ocorrem em temperaturas elevadas, esse valor só intensificará o segundo termo da relação e contribuirá para sua espontaneidade. Se as reações de combustão são espontâneas e os açúcares, como a sacarose, sofrem combustão, faz-se um intrigante questionamento: por que, apesar da reação de combustão da sacarose ser espontânea, não ocorre a extinção do açúcar dos açucareiros por ignição ao entrar em contato com o oxigênio do ar? A resposta é que as reações de combustão, tais como a queima do açúcar e da goma arábica, necessitam de uma energia de ativação (Ea), i.e., necessitam de uma energia para que ocorra o início da reação. A energia de ativação, na concepção da teoria das colisões e assumindo uma reação envolvendo a colisão de duas moléculas, é definida como a energia cinética mínima que os reagentes necessitam a fim de formar produtos. A fração de colisões com energia cinética acima da Ea, e passíveis de reagir, é dada pela distribuição de Boltzmann como sendo e-Ea/RT, onde R é a constante universal dos gases e T a temperatura do sistema.32 A equação de Arrhenius, definida como ln k = ln A - (Ea/RT), sendo k é a constante da velocidade da reação e A o fator de frequência, é comumente utilizada para o cálculo da energia de ativação. Para muitas reações, fazendo o gráfico de ln k versus 1/T, obtém-se uma reta cujo intercepto em 1/T = 0 representa o parâmetro A na forma de logaritmo natural (ln A), interpretado como a frequência de colisões efetivas que acarretam na formação de produtos. O coeficiente angular da reta (-Ea/R), representa a energia de ativação do sistema. Juntas, as duas quantidades, Ea e A, são denominadas parâmetros de Arrhenius.32 Quanto ao resíduo do experimento da "Serpente (não peçonhenta) de Faraó", ele pode ser aproveitado como insumo para outros experimentos e para fixar outros conteúdos inerentes à físico-química como, por exemplo, o fenômeno de adsorção de moléculas em superfícies sólidas finamente divididas: após lavagem, secagem e trituração, o carvão gerado no experimento pode ser empregado na remoção de odores em geladeiras ou como material adsorvente para máscaras de gases.40
CONCLUSÕES Foi apresentada uma metodologia inédita para a execução do consagrado experimento da "Serpente (não peçonhenta) de Faraó", na qual a adição de suco em pó melhora a eficiência do efeito visual e aumenta o tempo de duração do efeito. O experimento da "Serpente (não peçonhenta) de Faraó" apresenta-se como atividade lúdica e da qual é possível depreender diversos conceitos inseridos em conteúdos inerentes a disciplinas de Química Geral, Química Inorgânica e Físico-química. A história das "Serpentes de Faraó" e suas mudanças no decorrer do tempo podem ilustrar como evolui a Química Aplicada para o desenvolvimento de processos menos poluentes e mais econômicos. A formação do sólido espumoso pode levar à discussão das propriedades de materiais porosos e suas aplicações tecnológicas. Como foi demonstrado, também é possível ensinar estequiometria e balanceamento químico por meio do efeito visual produzido pela variação dos componentes da pastilha orgânico-inorgânica. O recurso experimental é simples, no entanto pode ser empregado para o estudo da termoquímica, incitando os alunos a pesquisar sobre as propriedades das reações de combustão e sua relação com o consumo de combustíveis fósseis (e.g., octano, carvão) utilizados pela civilização há muito tempo e que podem se extinguir. Nesse contexto, é possível mostrar a importância de investir em combustíveis renováveis (e.g., bioetanol) e em combustíveis não poluentes (e.g., hidrogênio). Uma discussão que se mostra relevante em um país emergente, como o Brasil, e que precisa gerar competências científicas que pensem criativamente em como tornar sua matriz energética autossuficiente.
MATERIAL SUPLEMENTAR A Classificação dos reagentes, produtos e intermediários usados na preparação de "Serpentes de Faraó", com respeito aos perigos para saúde humana segundo o The Globally Harmonized System of Classification and Labelling of Chemicals (GHS), está descrita no material suplementar (.PDF) que pode ser livremente acessado em http://quimicanova.sbq.org.br/.
AGRADECIMENTOS M. A. Ullmann agradece a CAPES pela bolsa concedida, pelo financiamento por meio da Chamada Pública MCT/CNPq/MEC/CAPES - Ação transversal nº 06/2011 - Casadinho/Procad - Processo nº 552197/2011-4 e às turmas de Química Inorgânica I do 2º semestre de 2011 do CCQFA, UFPel, que testaram os experimentos em aula.
REFERÊNCIAS 1. Krätz, O.; Historische chemische Versuche, Aulis Verlag Deubner & Co: Köln, 1997, p. 63. 2. Szymborski, T. http://upload.wikimedia.org/wikipedia/commons/4/43/Weze_faraona.png, licença http://creativecommons.org/licenses/by-sa/3.0/br/deed.pt_BR, acessada em Junho 2014. 3. Exemplo: http://www.youtube.com/watch?v=rsqERBp3wDs, acessada em Junho 2014. 4. Davis, T. L.; J. Chem. Educ. 1940, 17, 268. 5. Greenwood, N. N.; Earnshaw, A.; Chemistry of the Elements, Elsevier Butterworth-Heinemann: Oxford, 1997, p. 321. 6. Bircumshaw, L. L.; Tayler, F. M.; Whiffen, D. H.; J. Chem. Soc. 1954, 931. 7. Rumayor, M; Diaz-Somoano M.; Lopez-Anton, M. A.; Martinez-Tarazona, M. R.; Talanta 2013, 114, 318. 8. https://scifinder.cas.org (Substance Identifier: CAS: 1344-48-5), acessada em Junho 2014. 9. Moisés; Livro do Êxodo; 7; 9 - 10 (9Se o faraó vos pedir um prodígio, tu dirás a Aarão: toma tua vara e joga-a diante do faraó; ela se tornará uma serpente. 10Tendo Moisés e Aarão chegado à presença do faraó, fizeram o que o Senhor tinha ordenado. Aarão jogou sua vara diante do rei e de sua gente, e ela se tornou uma serpente.) 10. Drott, A.; Björn, E.; Bouchet, S.; Skyllberg, U.; Environ. Sci. Technol. Lett. 2013, 47, 4197; Cotte, M.; Susini, J.; Metrich, N.; Moscato, A.; Gratziu, C.; Bertagnini, A.; Pagano, M.; Anal. Chem. 2006, 78, 7484. 11. Holleman, A. F.; Wiberg, N.; Holleman - Wiberg Lehrbuch der Anorganischen Chemie, Walter de Gruyter, Berlin, 2007, p. 866. 12. Klepp, K. O.; Karl, P. Z.; Naturforsch. B Chem. Sci. 1992, 47, 491. 13. Clever, H. L.; Johnson, S. A.; Derrick, M. E.; J. Phys. Chem. Ref. Data 1985, 14, 631. 14. ABNT, Produtos químicos - Informações sobre segurança e meio ambiente, partes 1 - 4, Norma Brasileira ABNT NBR 14725, Associação Brasileira de Normas Técnicas, ed.; ABNT, Rio de Janeiro, 2012. (http://www.abntcatalogo.com.br; procurar a Norma pelo número, acessada em Junho 2014. 15. Pharaoschlangen. In Falbe, J.; Regitz, M (ed.); Römpp Lexikon Chemie, Georg Thieme Verlag, Stuttgart, 1998; p. 3234. 16. Roesky, H. W.; Möckel, K.; Chemische Kabinettstücke, VCH: Weinheim, 1994, p. 79. 17. http://www.youtube.com/watch?v=GItCETwJnBE, acessada em Junho 2014. 18. Mahieu, B.; Apers, D. J.; Capron, P. C.; J. Inorg. Nucl. Chem. 1971, 33, 2857. 19. https://scifinder.cas.org (Substance Identifier: CAS: 1333-82-0), acessada em Junho 2014. 20. Witt, O. N.; Narthekion, Nachdenkliche \ betrachtungen eines Naturforschers, Berlin 1901 - 1908; apud referência [1]. 21. Cangemi, J. M.; dos Santos, A. M.; Claro-Neto, S.; Química Nova na Escola 2009, 31, 160; Mascarenhas, A. J. S.; Oliveira, E. C.; Pastore, H. O.; Química Nova na Escola 2001, Edição especial, 25. 22. Jafelicci-Junior, M.; Varanda, L.C.; Química Nova na Escola 1999, 9, 12; Krawiec, P.; Panda, R. N.; Kockrick, E.; Geiger, D.; Kaskel, S.; J. Solid State Chem. 2008, 181, 938. 23. http://www.emser.de/fileadmin/data/pdfs/GI_EP_ohneMenthol_DA351.pdf, acessada em Junho 2014. 24. Ibid. ref. 16, p. 20. 25. Kreißl, F. R.; Krätz, O.; Feuer und Flamme, Schall und Rauch, Wiley - VCH: Weinheim, 2008, p. 221. 26. http://www.youtube.com/watch?v=j2QUrwz7o24, acessada em Junho 2014. 27. Yamada, S.; Koga, N.; Thermochim. Acta 2005, 431, 38. 28. https://scifinder.cas.org (Substance Identifier: CAS: 57-50-1), acessada em Junho 2014. 29. Atkins, P.; Jones, L.; Princípios de Química: Questionando a vida moderna e o meio ambiente. Bookman: Porto Alegre, 2001. 30. http://portal.mec.gov.br/seb/arquivos/pdf/CienciasNatureza.pdf, acessada em Junho 2014. 31. Server, S.; Yurumezoglu, K.; Oguz-Unver, A.; Procedia Soc. Behav. Sci. 2010, 2, 5619. 32. Atkins, P.; Paula, J.; Atkins' Physical-Chemistry, 8th ed., Oxford University Press: Oxford, 2006. 33. Dror, Y.; Cohen, Y.; Yerushalmi-rozen, R. J.; Polym. Sci. Pol. Phys. 2006, 44, 3265; Gabas, V. G. S.; Cavalcanti, O. A.; Braz. J. Pharm. Sci. 2003, 39, 441. 34. Anderson, D. M. W.; Hirst, E. L.; Stoddart, J. F.; J. Chem. Soc. C 1966, 1959; Tischer, C. A.; Gorin, P. A. J.; Iacomini, M.; Carbohydr. Polym. 2002, 47, 151. 35. Benemann, J. R.; Hallenbeck, P. C.; Int. J. Hydrogen Energ. 2002, 27, 1185; Skintura, B.; Lamari-Darkrim, F.; Hirscher, M.; Int. J. Hydrogen Energ. 2007, 32, 1121; Knotek, V.; Vojtěch, D.; Int. J. Hydrogen Energ. 2013, 38, 3030. 36. Borrero, M. A. V.; Pereira, J. T. V.; Miranda, E. E.; Biomass Bioenerg. 2003, 25, 287; Delzeit, R.; Holm-Müller, K.; Energy 2009, 34, 662. 37. Cardona, C. A.; Quintero, J. A.; Paz, I. C.; Bioresour. Technol. 2010, 101, 4754. 38. Shafiee, S.; Topal, E.; Energ. Policy. 2009, 37, 181. 39. Olah, G. A.; Catal. Lett. 2004, 93, 1; Bansode, A.; Urakawa, A.; J. Catal. 2014, 309, 66. 40. Mimura, A. M. S.; Sales, J. R. C.; Pinheiro, P. C.; Química Nova na Escola, 2009, 32, 53. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





