Artigo
|
|
| Atividade antibacteriana in vitro e toxicidade frente à Artemia salina Leach. de alguns compostos triazenos In vitro antibacterial activity and toxicity toward Artemia salina Leach. of some triazene compounds |
|
Gustavo Luiz ParaginskiI,*; Claiton Roberto BerticelliI; Priscilla Jussiani ZambiaziI; Vanessa Teixeira Kunz ParaginskiI; Manfredo HörnerI; Aline Joana Rolina Wohlmuth Alves dos SantosII; Rosmari HörnerIII,#
IDepartamento de Química, Universidade Federal de Santa Maria, Campus Universitário, Prédio 17, Sala 1447, 97110-970 Santa Maria - RS, Brasil Recebido em 12/11/2013 * e-mail: gustavoparaginski@gmail.com Bacterial resistance to antibacterial agents is currently a major concern. We report the synthesis, in vitro antibacterial activity and toxicity toward Artemia salina of six diaryltriazene compounds bearing different substituent groups. Minimal Inhibitory Concentration (MIC) and Minimal Bactericidal Concentration (MBC) values against standard strains (ATCC) and clinical isolates (including ESBL, MBL and AmpC strains) were good to very good, in the range 8 to 128 µg mL-1. Results suggest that hydroxyl, 4-carboxyl and 4-phenyldiazenil groups attached to the diaryltriazenes provide enhanced activity. Toxicity results showed very low LC50 values for three compounds (10-fold lower than DTIC). INTRODUÇÃO Atualmente há uma urgente necessidade por novos agentes antibacterianos, sendo a comunidade científica convocada para achar soluções para contornar o problema da resistência bacteriana.1 Por outro lado, há uma negligência da indústria farmacêutica pela busca de novos antibióticos, em parte devido ao pequeno retorno de investimento e atual menor período de licença/patente.2 A resistência bacteriana aos antibacterianos comercialmente disponíveis aumenta cada vez mais, principalmente em cepas Gram-negativas. Entre os mecanismos de resistência bacteriana mais comuns em bactérias Gram-negativas encontram-se as enzimas metalo-β-lactamases (MBL - que é uma carbapenemase), as β-lactamases de espectro ampliado (ESBL) e as cepas que possuem o gene AmpC. A classe das MBL tem sido uma das mais importantes, devido à pandemia eminente.3 Essas MBL possuem amplo espectro de ação conferindo resistência a todos os antibacterianos β-lactâmicos, exceto ao monobactâmico aztreonam, conferindo resistência também aos inibidores de β-lactamases, como o ácido clavulânico, o tazobactam e o sulbactam.4,5 Outra classe é a das ESBL, que são enzimas as quais atuam sobre os antibacterianos β-lactâmicos, mas que são inibidas pelo ácido clavulânico.6 E ainda, existem as cepas bacterianas que possuem o gene AmpC, o qual medeia a produção de β-lactamases cromossômicas induzíveis,6,7 as quais conferem resistência aos antibacterianos β-lactâmicos e não são inibidas pelo ácido clavulânico. Triazenos são compostos que contêm três nitrogênios em sequência (-N=N-N(H)-). Triazenos possuem atividade biológica conhecida, sendo alguns fármacos conhecidos. Entre os exemplos, encontram-se a dacarbazina e a temozolomida, dois agentes alquilantes utilizados clinicamente como antitumorais.8 A atividade antibacteriana de compostos triazenos tem sido pouco explorada, existindo somente algumas publicações mostrando a atividade desses compostos frente a bactérias e fungos.9-12 Goswami e Purohit9 avaliaram a atividade de uma série hidroxitriazenos frente à bactérias e fungos e obtiveram sucesso para alguns deles, principalmente para atividade antifúngica. Chauhan e colaboradores12 avaliaram a atividade antibacteriana de 6 hidroxitriazenos e mostraram que eles podem ser mais ativos para bactérias Gram-negativas do que para Gram-positivas. Da mesma forma, Ombaka e colaboradores,11 avaliando as atividades antibacteriana e antifúngica de 11 hidroxitriazenos, apontaram a potencial aplicação dessa classe de moléculas em micróbios resistentes a fármacos. Estes estudos sugerem ainda que o provável mecanismo de ação parece ser pela propriedade quelante dos triazenos com ingredientes da parede celular dificultando a síntese da parede celular. Nosso grupo de pesquisa10 avaliou a atividade de 15 compostos triazenos, incluindo um complexo de vanádio e um sal de potássio de um hidroxitriazeno, frente a várias bactérias, incluindo cepas ESBL. Este estudo serviu para direcionar os compostos mais ativos de acordo com os substituintes presentes, no caso, os grupos hidroxila, carboxílico, nitro e amida. Apesar dos triazenos (principalmente da subclasse hidroxitriazenos) possuírem atividade antimicrobiana relatada, novos estudos são escassos. Neste trabalho, o nosso objetivo foi avaliar a atividade antibacteriana de uma nova série de diariltriazenos sintetizados (Esquema 1) frente a bactérias padrões (American Type Culture Collection, ATCC) e bactérias isoladas clinicamente, incluindo bactérias denominadas atualmente de multirresistentes (do inglês, multidrug resistence, MDR). Além do mais, nós avaliamos a toxicidade aguda dos compostos frente à Artemia salina.
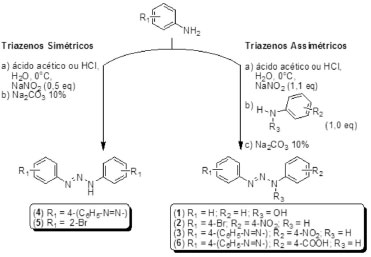 Esquema 1. Síntese dos triazenos simétricos e assimétricos
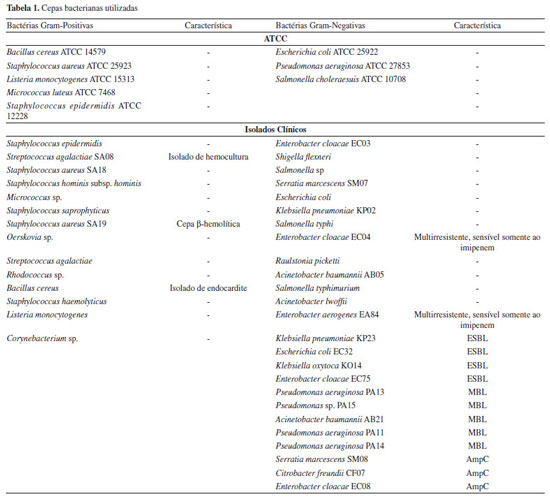
PARTE EXPERIMENTAL Síntese dos diariltriazenos Os reagentes empregados na obtenção dos produtos foram de grau analítico e não passaram por purificação prévia ao uso. A determinação dos pontos de fusão foi realizada em aparelho Melt-Temp II empregando-se capilares de vidro e os valores não foram corrigidos. Os espectros na região do infravermelho foram obtidos em espectrômetro de infravermelho Bruker Tensor-27 em pastilhas de KBr. As absorções foram registradas em centímetros recíprocos (cm-1). Os espectros de ressonância magnética nuclear de 1H e 13C foram obtidos em espectrômetro Bruker Avance DPX-200 ou DPX-400. Análises elementares de carbono, nitrogênio e hidrogênio foram realizados em um equipamento Perkin-Elmer CHN 2400. Espectros de Ultravioleta/Visível foram obtidos em espectrofotômetro 1650 PC Shimadzu em cubetas de quartzo com 1 cm de diâmetro. Procedimento geral de síntese As sínteses foram realizadas de acordo com procedimentos descritos para outros triazenos (Esquema 1).13-15 Para o triazeno 1, o procedimento de síntese foi modificado e é apresentado adiante. Para uma solução de uma amina aromática de partida (usualmente, 5,0 mmol) em uma solução de ácido acético ou HCl 2:1 ou 3:1 (15,0 a 20,0 mL), resfriada entre -5 e 0 ºC, sob agitação, foi adicionado nitrito de sódio (5,5 mmol para triazenos assimétricos e 2,5 mmol para triazenos simétricos). A reação foi mantida por 10 a 20 minutos. Para triazenos assimétricos, a segunda amina (5,0 mmol), aromática ou não, foi adicionada sob agitação, mantendo-se a temperatura entre -5 e 0 ºC. A reação foi mantida por 10 a 20 minutos. A seguir uma solução resfriada (10 ºC) de carbonato de sódio a 10% foi adicionada lentamente em porções até o pH entre 6,5 e 7,0 ser atingido, quando o produto precipita. Os produtos precipitados foram filtrados, lavados com água e purificados por recristalização em etanol. Os rendimentos são baseados na amina aromática de partida. Procedimento de síntese para o 3-hidróxi-1,3-bis(fenil)-1-triazeno ou 1,3-bis(fenil-triazeno-1-óxido (1): para uma solução de anilina (0,93 g, 10,0 mmol) em 15,0 mL de HCl 6,0 N previamente resfriada a -2 ºC, foi adicionada dentro de 10 minutos, sob vigorosa agitação, uma solução de nitrito de sódio (0,73 g, 10,6 mmol) em água (5,0 mL). A reação foi mantida a -2 ºC e, após 10 minutos, uma solução de β-fenilidroxilamina (1,09 g, 10,0 mmol) em ácido acético (4,0 mL) foi lentamente adicionada, mantendo-se a temperatura entre -5 e 0 ºC. Agitação foi mantida por 5 minutos na mesma temperatura. Uma solução aquosa resfriada (10 ºC) de carbonato de sódio (10%) foi então adicionada em pequenas porções até atingir-se pH entre 6,5 e 7,0, enquanto um sólido amarelo pálido precipitava. O produto bruto, separado por filtração, foi lavado com água resfriada (10 ºC) e purificado por recristalização em etanol. O produto microcristalino amarelo pálido na forma de agulhas finas foi seco sob vácuo. Rendimento: 74% (1,58 g, 6,82 mmol) baseado na anilina. p.f. 121 ºC. IV (cm-1) em KBr: 3447 [F, ν(O-H)], 3140 [F, ν(N-H)], 1603 [F, δ(C=C)], 1512 [F, δ(N-H)], 1445 [F, νas(N=N)], 1339 [m, νs(N→O)], 1211 [F, νs(N-N)], 1090 [m, δ(NOH)], 947 [m, ν(N→O)], 760 [F, δ(C-H) fora do plano], 750 [F, δ(C-H) fora do plano]. RMN 1H (CDCl3/TMS, 400 MHz), δ: 10,80 (s, 1H, NH), 8,10-7,05 (m, 10H, ArH). RMN 13C (CDCl3, 100 MHz), δ: 139,5 (s, 2C, Ar), 129,7 (s, 2C, Ar), 129,4 (s, 2C, Ar), 128,7 (s, 2C, Ar), 123,3 (s, 2C, Ar), 119,2 (s, 1C, Ar), 115,0 (s, 1C, Ar). λmax/nm (EtOH) 203, 237, 346 (ε/dm3 mol-1 cm-1 2,61 x 104). AE %, C12H11N3O: C 67,41 (calc. 67,59); H 5,01 (calc. 5,20); N 19,11 (calc. 19,71). 1-(4-bromofenil)-3-(4-nitrofenil)triazeno (2): sólido amarelo; rendimento: 64%, p.f. 185 ºC. IV (KBr, cm-1), principais bandas: 3278 [F, ν(N-H)], 1394 [F, νas(N=N)], 1168 [F, νs(N-N)]. RMN 1H ((CD3)2CO/TMS, 400 MHz), δ: 11,92 (s, 1H, NH); 8,32-7,21 (m, 8H, 4-(Br)Ar) + 4-(NO2)Ar). AE %, C12H9N4O2Br: C 44,32 (calc. 44,88); H 2,61 (calc. 2,82); 16,88 (calc. 17,45). 1-(4-(fenildiazenil)fenil)-3-(4-nitrofenil)triazeno (3): sólido amarelo; rendimento: 68%, p.f. 195 ºC. IV (KBr, cm-1), principais bandas: 3286 [F, ν(N-H)], 1394 [m, νas(N=N)], 1164 [m, νs(N-N)]. RMN 1H ((CD3)2CO/TMS, 400 MHz), δ: 11,79 (s, 1H, NH), 8,33-7,57 (m, 9H, 4-Ar(-N=N-Ar) + 4H, 4-(NO2)Ar). AE %, C18H14N6O2: C 62,43 (calc. 62,42); H 4,04 (calc. 4,07); 24,12 (calc. 24,27). 1,3-bis((fenildiazenil)fenil)triazeno (4): sólido amarelo; rendimento: 69%, p.f. 155 ºC. IV (KBr, cm-1), principais bandas: 3301 [F, ν(N-H)], 1396 [m, νas(N=N)], 1151 [m, νs(N-N)]. RMN 1H ((CD3)2CO/TMS, 300 MHz), δ: 11,90 (s, 1H, NH), 8,05-7,54 (m, 18H, 4-Ar(-N=N-Ar). AE %: C 70,41 (calc. 70,10); H 3,59 (calc. 4,72); 22,81 (calc. 24,18). 1,3-bis(2-bromofenil)triazeno (5): sólido amarelo; rendimento: 80%, p.f. 119 ºC. IV (KBr, cm-1), principais bandas: 3303 [F, ν(N-H)], 1435 [m, νas(N=N)], 1261 [m, νs(N-N)]. RMN 1H (DMSO-d6/TMS, 400 MHz), δ: 11,80 (s, 1H, NH), 7,70-7,60 (dd, 4H, ArH), 7,45-7,41 (td, 2H, ArH), 7,2 (s, 2H, ArH). AE %, C12H9N3Br2: C 40,25 (calc. 40,60); H 2,11 (calc. 2,56); 11,16 (calc. 11,84). 1-(4-fenildiazenil)fenil)-3-(4-carboxifenil)triazeno (6): sólido amarelo; rendimento: 51%, p.f. 208-210 ºC. IV (KBr, cm-1), principais bandas: 3488 [m, ν(O-H)], 3356 [m, ν(O-H)], 3284 [m, ν(N-H)], 1647 [F, ν(C=O)], 1390 [F, νas(N=N)], 1145 [F, νs(N-N)]. RMN 1H (DMSO-d6/TMS, 400 MHz), δ: 12,84 (s, 1H, COOH), δ: 11,56 (s, 1H, NH), 8,45-7,49 (m, 13H, ArH). AE %, C19H15N5O2: C 65,90 (calc. 66,08); H 4,29 (calc. 4,38); 19,76 (calc. 20,28). Atividade antibacteriana A atividade antibacteriana foi determinada de acordo com o método de microdiluição, baseado no documento M7-A6 do Clinical and Laboratory Standards Institute (CLSI)16 com a determinação da Concentração Inibitória Mínima (CIM) e da Concentração Bactericida Mínima (CBM). Diferentes concentrações dos compostos triazenos (128 a 0,25 µg mL-1) foram colocadas em placas de plástico estéreis retangulares com 96 poços, de fundo redondo. Os compostos foram dissolvidos em uma mistura de etanol e água, de modo que a concentração final do etanol nos poços não ultrapassou 2,5%. O meio de cultura utilizado foi o caldo Mueller-Hinton. O inóculo bacteriano foi preparado a partir de culturas recentes de modo que obtivéssemos de 1,0 a 2,0 x108 UFC mL-1 e a quantidade final de bactérias nos poços foi ajustada para 5,0 x105 UFC mL-1. As placas foram incubadas a 35 ± 2 ºC durante 24 h. A CIM foi determinada pela menor concentração do composto capaz de inibir o crescimento bacteriano e determina a atividade bacteriostática. A CBM foi determinada pela menor concentração do composto capaz de matar as bactérias, sendo que para isto foram feitos repiques para placas contendo ágar Mueller-Hinton, a partir das concentrações que inibiram o crescimento bacteriano. A CBM determina a atividade bactericida. Foram realizados controle positivo (meio de cultura contendo o inóculo e 2,5% de etanol) e controle negativo (somente o meio de cultura). As bactérias utilizadas foram bactérias padrões American Type Culture Collection (ATCC) e bactérias isoladas clinicamente pelo laboratório de análises clínicas do Hospital Universitário de Santa Maria (HUSM), incluindo cepas multirresistentes a antibacterianos (Tabela 1). Foram utilizadas 19 cepas Gram-positivas e 32 cepas Gram-negativas. As bactérias isoladas clinicamente tiveram a identificação e a presença de mecanismos de resistência confirmadas posteriormente em nosso grupo de pesquisa. O trabalho em questão foi adequado de acordo com as normas da Resolução CNS 466/12, apesar de não envolver pesquisa diretamente relacionada aos seres humanos.
Toxicidade frente Artemia salina O teste de letalidade frente à Artemia salina,17,18 um microcrustáceo (camarão) de água salgada foi utilizado para avaliar a toxicidade dos compostos triazenos. Os ovos de Artemia salina foram eclodidos em água contendo NaCl (60 g L-1) em temperaturas entre 24 e 30º C. O pH foi ajustado para próximo de 9,0 pela adição de bicarbonato de sódio (NaHCO3, 1,0 g L-1). Após 24 horas, as larvas fototrópicas foram separadas. Cinco diferentes concentrações dos compostos (50,00, 5,00, 0,50 0,05 e 0,005 µg mL-1) foram preparadas em etanol e água e colocadas em tubos de ensaio. A concentração final de etanol não ultrapassou os 2,5%. A solubilidade é determinante no resultado, sendo que a concentração de etanol deve ser ajustada para evitar a precipitação (ou floculação) dos compostos. Não foi observada a desprotonação dos triazenos em questão, apesar do ensaio ter sido realizado em pH próximo a 9,0. Dez larvas ativas foram adicionadas para cada tubo; após 24 horas, as larvas vivas e mortas foram contadas e a concentração letal média (CL50) foi estimada usando-se o método estatístico dos Probitos.19 Os resultados foram comparados com o medicamento dacarbazina (DTIC), o qual foi testado nas mesmas condições.
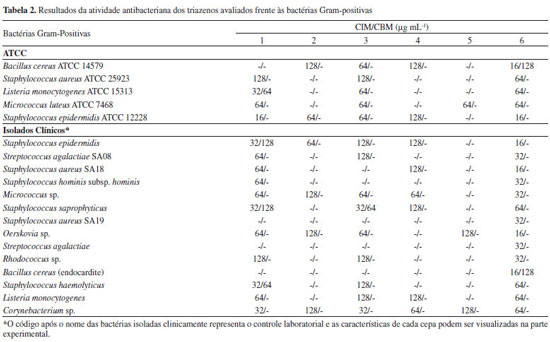
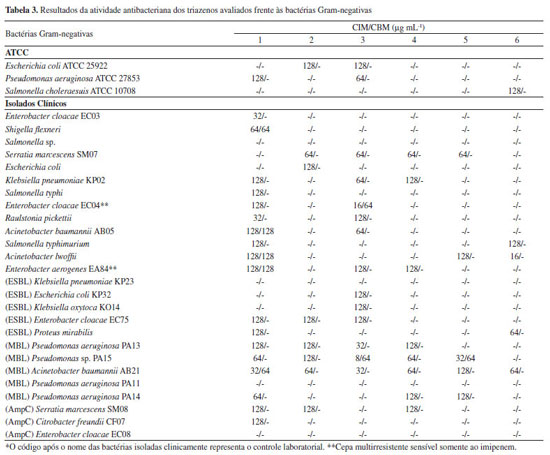
RESULTADOS E DISCUSSÃO A síntese dos compostos triazenos monocatenados sintetizados é relativamente simples, econômica e rápida. Os monotriazenos simétricos e assimétricos sintetizados apresentaram rendimentos entre 51 e 80%. Os compostos foram facilmente purificados por recristalização e a pureza foi confirmada por análise elementar experimental (AE) e por cromatografia em camada delgada usando-se placas de sílica gel 60 F254 usando-se como eluente misturas de hexano e acetato de etila em proporções de 9:1 a 2:1, com exceção do triazeno 1 que se decompõe em sílica gel, regenerando as aminas de partida. O triazeno 1 foi confirmado por análises no infravermelho, RMN 1H e 13C. Os triazenos 2, 3, 4, 5 e 6 foram confirmados por análises de RMN 1H e no infravermelho, e as bandas foram interpretadas com auxílio da literatura.20-22 Os espectros no infravermelho dos triazenos mostram as seguintes bandas principais: estiramentos N-H em 3140 (triazeno 1), 3278 (triazeno 2), 3286 (triazeno 3), 3301 (triazeno 4), 3303 (triazeno 5) e 3284 (triazeno 6) cm-1; estiramento νO-H em 3447 cm-1 referente a forma tautomérica [-N(O-H)-N=N-] do triazeno 1; estiramentos νO-H referentes ao grupo carboxílico do triazeno 6 em 3488 e 3356 cm-1; estiramentos νas N=N em 1445 (triazeno 1), 1394 (triazeno 2), 1394 (triazeno 3), 1396 (triazeno 4), 1435 (triazeno 5) e 1390 (triazeno 6) cm-1; estiramentos νsN-N em 1211 (triazeno 1), 1168 (triazeno 2), 1164 (triazeno 3), 1151 (triazeno 4), 1261 (triazeno 5) e 1145 (triazeno 6) cm-1. Os espectros de RMN 1H mostram um singleto referente aos H do grupo N-H em 10,80 (triazeno 1), 11,92 (triazeno 2), 11,79 (triazeno 3), 11,90 (triazeno 4), 11,80 (triazeno 5) e 11,56 ppm (triazeno 6). O espectro de RMN 1H mostra um singleto referente a 1H do grupo COOH em 12,84 ppm. Demais H aromáticos para todos os compostos aparecem na faixa esperada entre 8,45 e 7,05 ppm. O espectro de RMN 13C do triazeno 1 mostra 7 sinais referente aos 12 carbonos aromáticos. A atividade antibacteriana dos seis triazenos permitiu a determinação das CIMs e CBMs. A atividade foi verificada frente a bactérias Gram-positivas e Gram-negativas, cepas padrões ATCC e cepas isoladas clinicamente no HUSM, incluindo cepas resistentes a múltiplas drogas (cepas multirresistentes). Os resultados desta atividade são mostrados nas Tabelas 2 e 3.
Os resultados mostram que os compostos são ativos em 57,0% dos testes frente às cepas Gram-positivas e 33,9% dos testes frente às cepas Gram-negativas, mostrando resultados promissores como agentes bacteriostáticos e bactericidas. Em nosso estudo, as cepas Gram-negativas, em sua maioria, apresentam mecanismos significativos de resistência, o que pode ter diminuído a porcentagem de atividade em relação às bactérias Gram-positivas. Entretanto, é de grande importância e interesse o estudo de novos compostos frente a bactérias que possuem mecanismos de resistência, como cepas produtoras de ESBL, de MBL e cepas portadoras do gene AmpC. Algumas bactérias avaliadas tiveram o crescimento inibido por concentrações (CIM) consideradas baixas (16 a 8 µg mL-1). Alguns compostos tiveram atividade bactericida a concentrações (CBM) de 64 e 128 µg mL-1. Compostos bactericidas são úteis no tratamento de infecções hospitalares de pacientes com infecções no sistema nervoso central (meningites), com osteomielite ou com endocardite, doenças nas quais agentes bacteriostáticos podem falhar na cura.23 O triazeno 1 foi ativo frente a um maior número de espécies avaliadas, incluindo atividade frente a 15 (78,9%) das 19 bactérias Gram-positivas e frente a 19 (65,5%) das 29 bactérias Gram-negativas. Para bactérias Gram-positivas destaca-se o resultado para S. epidermidis ATCC12228 (CIM = 16 µg mL-1). Os resultados destacam ainda atividade bacteriostática frente às cepas E. cloacae EC03 (CIM = 32 µg mL-1), R. pickettii (CIM = 32 µg mL-1) e A baumannii AB21 (CIM = 32 µg mL-1). O triazeno 1 foi bactericida para A. baumannii AB21 com uma CBM de 64 µg mL-1. Esta bactéria é uma cepa hospitalar na qual foi identificada a produção da enzima metallo-β-lactamase (MBL), a qual confere resistência a todos os antibacterianos β-lactâmicos, exceto o aztreonam, e também aos antibacterianos inibidores de β-lactamases, como sulbactam e ácido clavulânico.4-6 O triazeno 6 foi o segundo mais ativo bacteriostaticamente, mostrando grande seletividade para cepas Gram-positivas. Este triazeno foi ativo para todas as cepas Gram-positivas com valores de CIMs entre 16 e 128 µg mL-1. Contudo, foi ativo para somente cinco (17,2%) cepas Gram-negativas. Ainda assim, apresentou o melhor resultado para Acinetobacter lwoffii, com CIM de 16 µg mL-1. Este composto foi o único composto ativo frente ao B. cereus isolado de uma endocardite, apresentando valores de CIM e CBM de 16 e 128 µg mL-1, respectivamente. Apresentou esses mesmos valores de CIM e CBM para o B. cereus ATCC 14579. Ainda apresentou valores de CIM de 16 µg mL-1 para S. epidermidis ATCC 12228 e os isolados clínicos S. epidermidis, S. aureus SA18 e Oerskovia sp.. Sugere-se que o grupo carboxílico substituinte do anel aromático tenha influência positiva na atividade frente às cepas Gram-positivas. Pelo contrário, isto não ocorre frente às cepas Gram-negativas, as quais possuem uma parede celular com estrutura mais complexa, a qual pode dificultar a entrada do triazeno 6 na célula inibindo a sua ação antibacteriana. Observa-se que este triazeno não foi bactericida para nenhuma cepa Gram-negativa. O triazeno 2 foi bacteriostático frente a 6 (31,6%) cepas Gram-positivas e frente a 8 (27,6%) cepas Gram-negativas, entretanto, não foi bactericida para nenhuma cepa testada. O triazeno 3 foi bacteriostático frente a 14 (73,7%) cepas Gram-positivas e frente a 14 (48,2%) cepas Gram-negativas, sendo os melhores resultados obtidos frente às bactérias Enterobacter cloacae EC04 (cepa multirresistente sensível somente ao imipenem) e Pseudomonas sp. PA15 com CIMs de 16 e 8 µg mL-1, respectivamente. As CBMs para estas duas bactérias foram de 64 µg mL-1, indicando atividade bactericida. Os valores de CIM e CBM para estes dois compostos foram geralmente maiores que para os triazenos 1 e 6, indicando menor atividade dos compostos 2 e 3. Ainda assim, os compostos apresentaram resultados peculiares, ou seja, foram ativos frente algumas bactérias nas quais o triazenos 1 e 6 não foram ativos, por exemplo, B. cereus ATCC 14579 (somente 1), E. coli ATCC 25922 e S. marescens SM07. Os triazenos 4 e 5 foram ativos frente a 8 (42,1%) e 3 (15,8%) cepas Gram-positivas, respectivamente, e frente a 8 (27,6%) e 5 (17,2%) cepas Gram-negativas, respectivamente. Estes compostos não apresentaram atividade bactericida para cepas Gram-positivas e o triazeno 5 foi bactericida para apenas uma bactéria Gram-negativa (Pseudomonas sp. PA15). Esses triazenos foram os menos ativos dos seis triazenos avaliados, fornecendo indícios, a partir da avaliação da relação estrutura-atividade, de que diariltriazenos simétricos contendo os substituintes fenildiazenil e bromo não propiciam efeito sinérgico à atividade antibacteriana. As melhores ações bacteriostáticas e bactericidas são observadas pelos triazenos 1 e 6, ou seja, quando substituintes hidroxil e carboxil estão presentes. Estudos da atividade antibacteriana de triazenos são escassos. Este é o primeiro trabalho que evidencia a atividade bactericida além da atividade bacteriostática de triazenos, incluindo cepas multirresistentes hospitalares. Comparando com um estudo prévio, nossos resultados estão de acordo, pois de uma série de hidroxitriazenos, os que possuíam o substituinte carboxifenil, mostraram melhores atividades antibacterianas e antifúngicas.11 Este estudo confirma os resultados obtidos por Goswami e Purohit, em 2001,9 o qual também mostrou que hidroxitriazenos contendo o substituinte carboxifenil possuem melhores atividades antibacterianas e antifúngicas. No entanto, nossos resultados mostraram atividade frente a uma porcentagem maior de bactérias do que esses estudos. Um estudo publicado por Hörner e colaboradores em 200810 sobre uma série de 15 compostos triazenos, incluindo um complexo de vanádio, mostrou que os diariltriazenos mais ativos foram os que possuíam os substituintes 4-carboxil, 4-nitro e 4-amido. Nesses quatro estudos,9-12 a proposta do mecanismo de ação dos triazenos foi sugerida devido à ação quelante à íons metálicos constituintes da parede celular dos microrganismos, o que dificultaria a sua síntese e justificaria sua ação bacteriostática. Sugere-se ainda, baseado na vasta literatura de triazenos envolvendo compostos de coordenação, que a ação bactericida depende da complexação com íons metálicos essenciais presentes nas bactérias (na parede celular ou no seu interior), sendo mais comuns Mg(II)24,25 e Ca(II),24,26,27 causando a morte bacteriana. Além disso, na maioria dos estudos envolvendo os compostos triazenos, a ação foi mais promissora frente a bactérias Gram-positivas. Isto pode ser explicado pelo fato de bactérias Gram-negativas possuírem uma parede celular mais complexa, dificultando a entrada do triazeno. A parede celular das bactérias Gram-positivas possui uma camada de peptidoglicano mais espessa, no entanto, essa parede ainda é mais simples que a das bactérias Gram-negativas. As bactérias Gram-positivas possuem ainda os ácidos teicóicos, os quais conferem carga negativa à superfície externa da célula e tem função de auxiliar a entrada de íons positivos na célula. Dessa forma, complexos triazenidos com íons metálicos podem atuar sobre essas estruturas das bactérias Gram-positivas, justificando a maior atividade nesses microrganismos. Por outro lado, a parede celular das bactérias Gram-negativas possui além de uma camada fina de peptidoglicano, uma membrana externa de lipopolissacarídeos que confere mais resistência a essas bactérias. Os resultados da toxicidade frente à Artemia salina indicam qual triazeno possui menor toxicidade aguda28 (Tabela 4). Os valores da CL50 variaram de 0,076 a 5,935 µg mL-1, sendo os menores valores de CL50 obtidos para os triazenos 1, 5 e 6, com valores bem próximos para estes três compostos (0,081, 0,076 e 0,077 µg mL-1, respectivamente). Isto evidencia que a maior toxicidade é conferida por estes compostos. O triazeno 2 foi o menos tóxico (5,935 µg mL-1). Uma observação da relação estrutura-toxicidade permite concluir que os substituintes -Br e -NO2 em posição para no anel fenil proporcionaram menor toxicidade, apesar de que entre os compostos mais tóxicos está o triazeno simétrico com o substituinte -Br em posição orto. Estudos da toxicidade com um número maior de compostos permitirá uma melhor avaliação da relação estrutura-toxicidade.
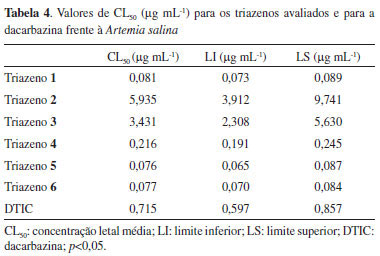
Os triazenos 1 e 6 foram os que apresentaram melhores resultados para a atividade antibacteriana. Esses triazenos mostram toxicidade cerca de 10 vezes maior que a dacarbazina. Isto indica que a atividade antibacteriana pode estar relacionada com a toxicidade aguda dos compostos avaliados. Existem dados experimentais mostrando que há uma correlação entre a CL50 para Artemia salina e a Dose Efetiva média (DE50) obtida para linhagens de células tumorais (citotoxicidade).29,30 Assim, pode-se supor que a dosagem dos triazenos mais tóxicos (1, 5 e 6) para a citotoxicidade é cerca de 10 vezes maior que a citotoxicidade da dacarbazina para linhagens de células tumorais. Novas perspectivas de estudos podem ser realizadas com os compostos triazenos. A atividade de nuclease por meio da metodologia de clivagem do DNA plasmidial in vitro desses compostos está sendo realizada por nosso grupo, o que pode auxiliar na elucidação do mecanismo de ação. Nosso grupo tem interesse em acoplar triazenos contendo esses grupamentos a moléculas conhecidamente utilizadas na terapia antimicrobiana e avaliar o efeito sinérgico sobre as bactérias. Além disso, a obtenção de compostos de coordenação desses triazenos contendo metais como ouro(I) pode fornecer potente atividade antibacteriana como desenvolvida para outras moléculas consideradas pequenas.
CONCLUSÕES A resistência bacteriana é um grande problema, uma vez que poucos agentes antimicrobianos são efetivos para tratar infecções de patógenos multirresistentes e um número limitado de agentes antimicrobianos está em último estágio de desenvolvimento.31,32 Nós aplicamos triazenos já conhecidos pelas suas ações coordenativas a metais dando um enfoque novo na atividade antibacteriana e tóxica frente a Artemia salina. A atividade quelante dos triazenos9-12 pode justificar o possível mecanismo de ação, no entanto, estudos específicos e detalhados devem ser realizados para confirmação. Os triazenos do presente estudo mostraram significativo avanço na atividade antibacteriana em comparação com os triazenos de outros estudos, mostrando maior amplitude de resultados e com menores valores de CIM. Este é o primeiro relato de atividade bactericida para compostos triazenos. Eles foram ativos frente a bactérias multirresistentes, incluindo cepas produtoras de ESBL, MBL e do gene AmpC, sendo os mais ativos aqueles diariltriazenos substituídos com os grupos hidroxil, carboxifenil e (fenildiazenil)fenil. Essas evidências têm grande impacto na atualidade devido a esses mecanismos de resistência bacteriana estarem entre os mais prevalentes. O resultado mais surpreendente foi obtido para o triazeno 6, o qual foi ativo frente a todas as bactérias Gram-positivas. O hidroxitriazeno 1 também mostrou muito boa atividade tanto para bactérias Gram-positivas como para Gram-negativas. Este composto foi ativo frente a bactérias Gram-negativas que possuem as enzimas ESBL ou MBL, ou ainda, o gene AmpC. Os triazenos 2 e 3 apresentaram atividade antibacteriana intermediária e os compostos 4 e 5 foram os menos ativos, indicando que os substituintes bromo e fenildiazenil em diariltriazenos simétricos conferem menor atividade. Sugere-se a pesquisa com um número maior de compostos para melhor evidenciação da relação estrutura-atividade. O teste de toxicidade frente Artemia salina evidencia que os triazenos 1, 5 e 6 são os que apresentaram menores valores de CL50, cerca de 10 vezes menores que a dacarbazina. Isto indica que estes compostos foram os mais tóxicos. Ainda que a atividade antibacteriana possa estar relacionada com a atividade tóxica, os resultados são promissores e podem direcionar a síntese de novas moléculas ativas. Novos estudos destas atividades biológicas devem ser realizados para avaliação dessas moléculas quando complexadas a metais.
AGRADECIMENTOS G.L.P. agradece a CAPES/DAAD, M.H. agracede ao CNPq (proc. 483902/2011-0), P.J.Z. agradece CAPES, V.T.K. agradece CNPq. Os autores agradecem ainda C.M. Bertoncheli e o Laboratório de Análises Clínicas (LAC) do HUSM pela identificação das bactérias e da resistência aos antibacterianos.
REFERÊNCIAS 1. Wise, R.; J. Antimicrob. Chemother. 2011, 66, 1939. 2. Livermore, D. M.; J. Antimicrob. Chemother. 2011, 66, 1941. 3. Rolain, J. M.; Parola, P.; Cornaglia, G.; Clin. Microbiol. Infect. 2010, 16, 1699. 4. Walsh, T. R.; Toleman, M. A.; Poirel, L.; Nordmann, P.; Clin. Microbiol. Rev. 2005, 18, 306. 5. Walsh, T. R.; Clin. Microbiol. Infect. 2005, 11 Suppl. 6, 2. 6. Bush, K.; Jacoby, G. A.; Antimicrob. Agents Chemother. 2010, 54, 969. 7. Jacoby, G. A.; Clin. Microbiol. Rev. 2009, 22, 161. 8. Bonmassar, L.; Marchesi, F.; Pascale, E.; Franzese, O.; Margison, G. P.; Bianchi, A.; D'Atri, S.; Bernardini, S.; Lattuada, D.; Bonmassar, E.; Aquino, A.; Curr. Med. Chem. 2013, 20, 2389. 9. Goswami, A. K.; Purohit, D. N.; Anal. Sci. 2001, 17 Suppl., i789. 10. Hörner, M.; Giglio, V. F.; Santos, A. J. R. W. A.; Westphalen, A. B.; Iglesias, B. A.; Martins, P. R.; Amaral, C. H.; Michelot, T. M.; Reetz, L. G. B.; Bertoncheli, C. M.; Paraginski, G. L.; Hörner, R.; Rev. Bras. Cienc. Farm. 2008, 44, 441. 11. Ombaka, A. O.; Muguna, A. T.; Gichumbi, J. M.; J. Environ. Chem. Ecotoxicol. 2012, 4, 133. 12. Chauhan, L. S.; Jain, C. P.; Chauhan, R. S.; Goswami, A. K.; J. Chem. Pharm. Res. 2010, 2, 979. 13. Back, D. F.; Hörner, M.; Broch, F.; Oliveira, G. M.; Polyhedron 2012, 31, 558. 14. Oliveira, G. M.; Hörner, M.; Machado, A.; Back, D. F.; Monteiro, J. H. S. K.; Davolos, M. R.; Inorg. Chim. Acta 2011, 366, 203. 15. Sogani, N. C.; Bhattacharya, S. C.; Anal. Chem. 1956, 28, 81. 16. Clinical Laboratory Standards Institute; Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically, 9th ed., Document M07-A9. CLSI: Wayne, 2012. 17. Meyer, B. N.; Ferrigni, N. R.; Putnam, J. E.; Jacobsen, L. B.; Nichols, D. E.; McLaughlin, J. L.; Planta Med. 1982, 45, 31. 18. Vanhaecke, P.; Persoone, G.; Claus, C.; Sorgeloos, P.; Ecotoxicol. Environ. Saf. 1981, 5, 382. 19. Finney, D. J., Probit Analysis, 3th ed., Cambridge University: Cambridge, 1971, p. 76-80. 20. Moore, D. S.; Robinson, S. D.; Adv. Inorg. Chem. Radiochem. 1986, 30, 1. 21. Domingues, V. O.; Hörner, R.; Reetz, L. G. B.; Kuhn, F.; Coser, V. M.; Rodrigues, J. N.; Bauschpiess, R.; Pereira, W. V.; Paraginski, G. L.; Locatelli, A.; Fank, J. O.; Giglio, V. R.; Hörner, M.; J. Braz. Chem. Soc. 2010, 21, 2226. 22. Lopes, W. A.; Fascio, M.; Quim. Nova 2004, 27, 670. 23. Finberg, R. W.; Moellering, R. C.; Tally, F. P.; Craig, W. A.; Pankey, G. A.; Dellinger, E. P.; West, M. A.; Joshi, M.; Linden, P. K.; Rolston, K. V.; Rotschafer, J. C.; Rybak, M. J.; Clin. Infect. Dis. 2004, 39, 1314. 24. Westhusin, S.; Gantzel, P.; Walsh, P. J.; Inorg. Chem. 1998, 37, 5956. 25. Nimitsiriwat, N.; Gibson, V. C.; Marshall, E. L.; Takolpuckdee, P.; Tomov, A. K.; White, A. J. P.; Williams, D. J.; Elsegood, M. R. J.; Dale, S. H.; Inorg. Chem. 2007, 46, 9988. 26. Hauber, S.-O.; Lissner, F.; Deacon, G. B.; Angew. Chem., Int. Ed. Engl. 2005, 44, 5871. 27. Barrett, A. G. M.; Crimmin, M. R.; Hill, M. S.; Hitchcock, P. B.; Kociok-Kohn, G.; Procopiou, P. A.; Inorg. Chem. 2008, 47, 7366. 28. Svensson, B.-M.; Mathiasson, L.; Martensson, L.; Bergström, S.; Environ. Monit. Assess. 2005, 102, 309. 29. McLaughlin, J. L. Em Methods in Plant Biochemistry, vol. 6; Hostettmann, K., ed.; Academic Press: London, 1991; p. 1-36. 30. Gales, A. C.; Castanheira, M.; Jones, R. N.; Sader, H. S.; Diagn. Microbiol. Infect. Dis. 2012, 73, 354. 31. Zhao, Y.; Tian, Y.; Liu, W.; Ma, W.; Jiang, X.; J. Am. Chem. Soc. 2010, 132, 12349. 32. Patra, M.; Gasser, G.; Metzler-Nolte, N.; Dalton Trans. 2012, 41, 6350. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access