Artigo
|
|
| Vanadato de bismuto sintetizado por combustão em solução na presença de diferentes combustíveis: síntese, caracterização e estudo da atividade fotocatalítica Bismuth vanadate synthesized by solution combustion with different fuels: synthesis, characterization and study of photocatalytic activity |
|
Jéssica Aparecida SerafimI; Renata AfonsoI; Adriana Campano LucilhaI; Lucas Agostinho de OliveiraI; Paulo Rogério Catarini da SilvaII; Marcelo Rodrigues da SilvaIII; Elen Romao SartoriI; Luiz Henrique Dall'AntoniaI;*
IDepartamento de Química, Universidade Estadual de Londrina, 86057-970 Londrina - PR, Brasil Recebido em 03/12/2013 * e-mail: luizh@uel.br In this manuscript, a BiVO4 semiconductor was synthesized by solution combustion synthesis using different fuels (Alanine, Glycine and Urea). Also, the Tweenr 80 surfactant was added during synthesis. BiVO4 was characterized by XRD, SEM and diffuse reflectance spectroscopy. Photocatalytic activity was evaluated by the discoloration of methylene blue at 664 nm under UV-visible light irradiation. According to XRD, the monoclinic phase of BiVO4 was obtained for the samples. The smallest particle size and highest kobs value were observed for the BiVO4/alanine sample, which promoted greater demethylation of methylene blue. INTRODUÇÃO A síntese de nanomateriais semicondutores fotoativos vem sendo alvo de muitas pesquisas devido a suas características e aplicações na área tecnológica.1 Entre estes materiais, destaca-se o Vanadato de Bismuto (BiVO4) que está sendo investigado por conta da sua capacidade de absorver fótons em comprimentos de ondas na faixa da luz visível. Isso proporciona ao material baixo custo de aplicabilidade, tendo em vista que a fonte de irradiação necessária para a ativação do semicondutor pode ser fornecida pela luz solar.1,2 O BiVO4 pode apresentar três formas cristalinas principais: tetragonal, monoclínica e ortorrômbica, mas somente a fase monoclínica apresenta atividade fotocatalítica quando irradiado sob luz visível, devido à baixa energia de "band-gap" de 2,4 eV.1,2 Entretanto, a fase cristalina monoclínica só pode ser obtida em temperaturas acima de 255 ºC.3 Considerando a necessidade de temperaturas mais elevadas para a obtenção da fase monoclínica de BiVO4, a síntese de combustão em solução (SCS) mostra-se vantajosa frente a outros métodos, como eletrossíntese, síntese em estado sólido-líquido, em solução aquosa, hidrotermal e por precipitação.4-8 Entre as vantagens desse método estão a espontaneidade do processo exotérmico, a rapidez e o custo benefício,9 além da obtenção de pó fino, homogêneo e com alto grau de pureza.10-14 A adição de surfatantes ao meio reacional vem sendo pesquisada a fim de melhorar as propriedades superficiais dos materiais sintetizados. Tais aditivos são agentes tensoativos que atuam diretamente na estrutura dos percursores, produzindo cristais15,16 com diferentes morfologias e tamanhos.17,18 Contudo, a síntese de combustão em solução para obtenção do semicondutor BiVO4 monoclínico na presença do surfatante Tween® 80 não foi reportada por outros autores e apresenta vantagens por ser um método rápido, fácil e de baixo custo, ademais de proporcionar melhorias nas propriedades dos materiais para diversas aplicações. A partir disso, este trabalho tem como objetivo investigar a influência de diferentes combustíveis (alanina, glicina e ureia) e do surfatante neutro Tween® 80 na síntese de combustão do BiVO4 monoclínico e avaliar sua eficiência fotocatalítica para a descoloração do corante azul de metileno.
PARTE EXPERIMENTAL Todos os reagentes utilizados foram de grau analítico sem purificação prévia. As soluções foram preparadas utilizando água ultrapura (Millipore Plus). Síntese de combustão em solução O método de preparação utilizado em outros trabalhos13,14,19 foi adaptado conforme a descrição a seguir. Inicialmente, 1,21 g de Bi(NO3)3.5H2O e 0,481 g de ácido cítrico foram dissolvidos em 50,0 mL de solução aquosa de ácido nítrico 1,50 mol L-1. Em seguida, o pH da solução foi ajustado para 7,00 ± 0,2 com a adição de NH4OH. Ao final, 1,00 g do combustível investigado (alanina, glicina, ureia) foi adicionado obtendo-se uma solução transparente, denominada de solução "A". Uma segunda solução, denominada de solução "B" foi preparada, dissolvendo-se 0,290 g de NH4VO3 e 0,481 g de ácido cítrico em 50,0 mL de água ultrapura aquecida a 70,0 ºC, obtendo-se uma solução verde escura. Foram preparadas duas rotas de síntese para cada combustível utilizado, adicionando a uma delas 20,0 mmol L-1 do surfatante Tween® 80 na solução "A". Após, as soluções "A" e "B" foram misturadas obtendo-se uma solução verde escura uniforme, a qual foi evaporada a 80,0 ºC ± 5 ºC em estufa (Brasdonto modelo 5) por 20 h. Depois da evaporação, o gel azul escuro obtido foi calcinado por 1 h em mufla (EDGCON 1P) a 500 ºC, sob condições atmosféricas. Caracterização dos semicondutores As amostras foram caracterizadas por Difração de Raios X (DRX), pelo método do pó em porta-amostra de aço inox, a 40 kV e 30 mA, utilizando um difratômetro da PANalytical modelo X'Pert PRO MPD, com radiação CuKα (1,54060 Å). Possíveis orientações preferenciais no processo de preparo foram desprezadas ao girar ciclicamente as amostras por 2 segundos durante as medidas. Os espectros de Refletância difusa das amostras foram obtidos em um espectrofotômetro UV-Vis, Shimadzu UV-3101 PC. Os valores de energia de "band-gap" (Eg) dos materiais foram calculados convertendo os dados de refletância para a função de absorção do pó, F(R). A morfologia do material foi investigada por microscopia eletrônica de varredura (MEV), utilizando o microscópio eletrônico (Quanta 200-FEI), sob tensão de 30 kV e ampliação de até 20.000 vezes, para garantir a qualidade das imagens. Atividade fotocatalítica dos semicondutores A atividade fotocatalítica das amostras sintetizadas por SCS foram avaliadas pela descoloração do azul de metileno (20,0 µmol L-1) sob irradiação de luz visível. O azul de metileno, Figura 1S (material suplementar), apresenta estrutura molecular simples (a) e espectro eletrônico definido (b), sendo por isso utilizado como molécula modelo para avaliar a eficiência fotocatalítica dos materiais sintetizados. As irradiações foram realizadas em uma câmara de 70 x 70 x 70 cm, revestida com papel alumínio, composta por 20 lâmpadas incandescentes de 100 W (Cristal) e 4 lâmpadas UV de 250 W (Ecolume), fornecendo 2830 µW cm-2, simulando a irradiação solar. A suspensão constituída por 50,0 mL de azul de metileno 20,0 µmol L-1, e o fotocatalisador sintetizado, 0,40 g L-1, foi adicionada em béquer envolto com papel alumínio e deixada em banho ultrassônico por 30 min. Em seguida, a irradiação foi realizada mantendo a suspensão em mesa agitadora a 200 rpm. Alíquotas foram retiradas em intervalos de tempo pré-determinados (0; 10; 20; 40; 60; 90 e 120 min), centrifugadas por 2 min a 1000 rpm (Centribio modelo 80-2b) e imediatamente analisadas por espectrofotometria UV-Vis (Ocean Optics USB4000) de 200 a 800 nm, em 664 nm.
RESULTADOS E DISCUSSÃO Os difratogramas de raios X, Figura 1, demonstraram a influência significativa das condições de síntese investigadas para a obtenção da estrutura cristalina monoclínica de BiVO4 (18,8º, 101; 18,9º, 011; 28,9º, 112; 30,7º, 004; 34,7º, 200 e 35,3º, 020), por combustão em solução. Isto porque, além de se confirmar a síntese desta estrutura em todas as condições analisadas, também foi possível verificar, em alguns casos, a obtenção de outros compostos, tais como β-Bi2O3 (27,9º, 201), V2O5 (20,3º, 010 e 26,2º, 101) e V0,9Bi8,1O14 (32,3º, 330).
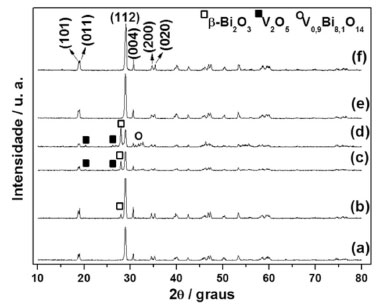 Figura 1. Difratogramas de raios X das amostras sintetizadas por combustao em soluçao utilizando diferentes combustíveis na presença e na ausência de surfatante (a) alanina, (b) alanina/Tween®80, (c) glicina, (d) glicina/Tween®80, (e) ureia e (f) ureia/Tween®80
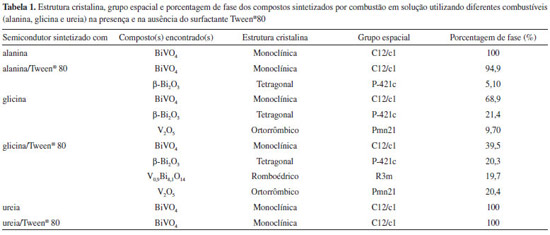
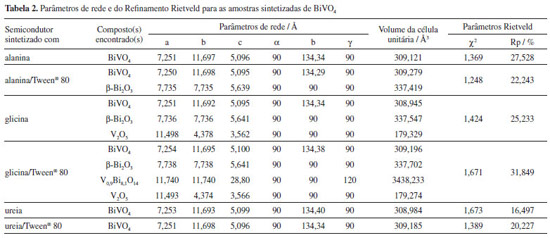
O ajuste dos difratogramas das amostras foi realizado pelo refinamento Rietveld, o qual indicou a porcentagem de fase, a estrutura cristalina e o grupo espacial do(s) composto(s) obtido(s) em cada condição investigada, Tabela 1. A partir destes resultados foi possível verificar a obtenção de 100 % da estrutura cristalina monoclínica de BiVO4 ao utilizar três condições de síntese, alanina, ureia e ureia/Tween®80. Sob condição de alanina/Tween®80 houve a predominância da estrutura monoclínica do BiVO4 (94,9 %) no entanto encontrou-se uma baixa porcentagem (5,1%) de Bi2O3 tetragonal, também denominada β-Bi2O3. Ao utilizar a glicina como combustível na síntese, a porcentagem da fase monoclínica de BiVO4 diminuiu (68,9 %), sendo identificado também as fases β-Bi2O3 (21,4%) e V2O5 ortorrômbico (9,7%). Já a condição glicina/Tween® 80, proporcionou quantidade ainda menor de BiVO4 monoclínico (39,6%), além de outras três fases, β-Bi2O3 (20,3%), V2O5 ortorrômbico (20,4%) e V0,9Bi8,1O14 romboédrico (19,7 %).
Estes resultados podem ser explicados considerando a quantidade necessária de cada combustível utilizado por mol de precursor da mistura (Bi(NO3)3.5H2O e NH4VO3). Ao comparar a quantidade teórica com a real, foi possível verificar menor diferença ao se utilizar a ureia como combustível, o que justifica a obtenção de 100% de BiVO4 nas condições em que se utilizou este combustível para a síntese. No entanto, ao se utilizar a alanina e a glicina, esta diferença foi maior, ou seja, houve excesso de combustível e, assim a obtenção de subprodutos em pelo menos uma das condições investigadas. Isto pode ser justificado, pois o excesso de combustível torna a reação altamente explosiva e não autopropagante, o que inviabiliza o término da cinética da reação, afetando a formação de produtos pela considerável quantidade de subprodutos formados.20 A síntese de BiVO4 usando como combustível a alanina, glicina e ureia pode ser representada pelas equações (1), (2) e (3), respectivamente. As reações estão representadas sem a participação do ácido cítrico, pois considera-se que o papel deste na síntese é estabilizar os íons Bi3+ durante o processo de evaporação. A combustão em solução é caracterizada como um processo redox, em que o precursor da mistura, ou seja, o nitrato do metal atua como agente oxidante e o combustível orgânico como agente redutor.20
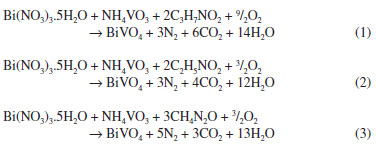
Além da proporção de combustível, características como calor de combustão (alanina 18,2 kJ g-1; glicina 13,0 kJ g-1 e ureia 10,5 kJ g-1),21 quantidade de gases gerados durante a decomposição e temperatura da chama durante a sua ignição também podem influenciar na síntese por combustão em solução, pois estão relacionados com a termodinâmica do processo.20 Neste sentido, a geração de gases viabiliza a dissipação de parte do calor, o que pode influenciar na pré-sinterização do produto reacional. Já a temperatura de chama modifica a fase obtida, o tipo de cristalização e o tamanho das partículas formadas. A partir das reações 1, 2 e 3, foi possível verificar a liberação de maior quantidade de gases ao utilizar a alanina como combustível na síntese. Da mesma forma, com base na proporção utilizada para cada combustível, espera-se a liberação de maior quantidade de calor (cerca de 1,5 vezes) ao se utilizar a alanina e a glicina quando comparadas à ureia. Os resultados obtidos para a síntese de BiVO4 monoclínico, Tabela 1, indicaram que, na comparação com a glicina, o combustível alanina é mais eficiente, obtendo-se 100% de BiVO4. Isto pode estar relacionado à maior disponibilidade do nitrogênio da molécula de alanina para a redução do precursor, instrumentalizando um maior poder de reação. É interessante também comentar que, para estes dois combustíveis, quando na presença do surfatante Tween® 80, há a formação de outras fases. Isto pode ser justificado pelo fato de, além de proteger o precursor, este composto também apresentar características de combustível. Assim, o aumento na temperatura do sistema quando este se encontra na presença de surfatante é esperado, viabilizando a formação de outras fases. Os parâmetros de rede, o volume da célula unitária e a qualidade do Refinamento Rietveld para os compostos sintetizados, em cada condição experimental, estão sumarizados na Tabela 2.
Uma vez que a síntese para BiVO4 não foi eficiente ao se utilizar as condições alanina/Tween® 80, glicina e glicina/Tween ® 80, os materiais obtidos na presença das mesmas não foram caracterizados, assim como aplicados na descoloração de azul de metileno. A Figura 2 apresenta os gráficos de Kubelka-Munk obtidos a partir dos espectros UV-Vis de refletância difusa das amostras sintetizadas sob diferentes condições experimentais, alanina, ureia e ureia/Tween® 80.
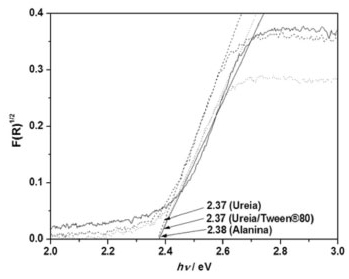 Figura 2. Espectro eletrônico por refletância difusa das amostras sintetizadas por combustao em soluçao utilizando diferentes combustíveis na presença e na ausência de surfatante (—) alanina, (---) ureia e (…) ureia/Tween®80)
Os valores para a energia de "band-gap"(Eg) dos materiais sintetizados variaram entre 2,37 a 2,38 e mostraram que ao utilizar a ureia como combustível, com ou sem o surfatante, a região de absorção manteve-se a mesma, Tabela 3. Isso sugere que a síntese utilizando este combustível não foi afetada pela adição do surfatante. Os menores valores de Eg foram obtidos para as amostras sintetizadas utilizando como combustível a ureia. Entretanto essa diferença entre os valores de Eg para as amostras sintetizadas não é significativa.

A síntese de combustão mostrou-se vantajosa uma vez que os valores de "band-gap" foram menores que aqueles encontrados por outros autores, utilizando métodos diferentes para a síntese de BiVO4, como por exemplo, 2,4 e 2,5 eV por síntese de reação de estado sólido-líquido,4 2,4 eV por solução aquosa,5 2,31 eV por síntese hidrotermal6 e 2,44, 2,45, 2,46 e 2,5 eV por síntese de combustão em solução.9,11,13,22 As imagens obtidas por MEV mostraram alterações na morfologia dos materiais sintetizados ao variar o combustível utilizado na síntese, Figura 3. Pode-se observar que há predominância de partículas de forma esférica, principalmente para as amostras de BiVO4 sintetizadas com ureia.
 Figura 3. Imagens obtidas por MEV dos materiais obtido por SCS utilizando diferentes combustíveis na presença e na ausência de surfactante (a) alanina, (b) ureia e (c) ureia/Tween®80
O material sintetizado com alanina apresentou partículas aglomeradas, com aspecto de sinterização, Figuras 3 (a), o que pode ser justificado pela quantidade de gases liberados ao se utilizar este como combustível da síntese, como discutido anteriormente. Para as partículas esféricas observadas sobre a sinterização do material sintetizado com alanina foi estimado tamanho de aproximadamente 450 nm. Este fato pode estar relacionado ao excesso de combustível adicionado à síntese quando utilizada a alanina, fazendo com que haja maior consumo de oxigênio, verificado pela reação de combustão (1). Esse excesso força a liberação de gases e dissipa maior quantidade de calor tornando a reação mais explosiva e ocasionando a pré-sinterização do material. A rápida evolução desses gases durante a combustão limita o contato interpartículas, devido à presença dos grupos amino e carboxílico nas extremidades da molécula de alanina que atuam como agente complexante para os íons metálicos servindo como uma barreira para o crescimento dos cristais produzindo partículas de menor tamanho.23 Enquanto que o BiVO4 sintetizado com ureia e ureia/Tween® 80 não mostrou diferença significativa em relação a morfologia dos pós. Isso indica que o surfatante não interferiu na síntese, Figura 3 (b) e (c). As partículas sintetizadas na presença desse combustível apresentaram formas esféricas e com tamanhos de aproximadamente 530 nm na ausência e 520 nm na presença do surfatante. Apesar da molécula da ureia apresentar um grupo amino em cada extremidade, complexar metais e ser muito utilizada para síntese de combustão por ser altamente exotérmica e ter baixo custo esta não apresenta uma barreira tão efetiva em relação ao crescimento dos cristais como a alanina devido à falta do grupamento carboxílico na estrutura da molécula.24 A atividade fotocatalítica para os materiais sintetizados na presença de alanina, ureia e ureia/Tween® 80 foi analisada pela diminuição da absorção em 664 nm do corante azul de metileno sob irradiação na região do visível e ultravioleta, simulando a luz solar (Figura 4).
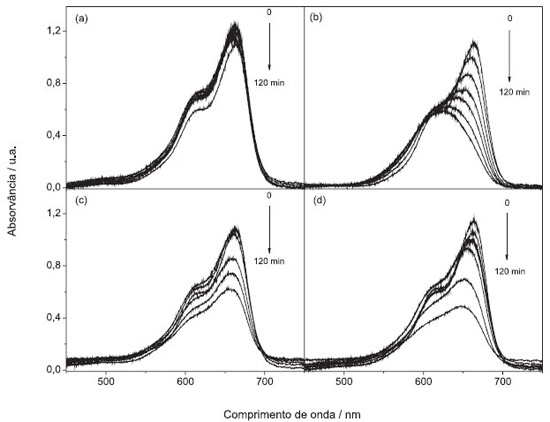 Figura 4. Espectros de absorçao UV-Vis da fotocatálise do azul de metileno: (a) na ausência de fotocalisador; e, em suspensao aquosa contendo fotocatalisador sintetizado na presença de: (b)alanina, (c) ureia e (d) ureia/Tween®80 em funçao do tempo de irradiaçao sob luz UV-visível
Os espectros de absorção apresentaram diminuição na banda característica do azul de metileno. No entanto, os resultados demonstraram deslocamento da banda em 664 nm, devido à desmetilação da molécula do corante, formando intermediários que apresentam banda de absorção máxima em comprimentos de onda menores.25 A desmetilação ocorre pela oxidação da molécula do azul de metileno pelo radical ˙OH, formando o intermediário Azure B (AB), o qual perde mais uma metila do mesmo lado produzindo o Azure A (AA). A perda da metila ligada ao carbono na extremidade oposta forma o Azure C (AC) e por fim, a perda da última metila produz a Tionina (TH) (Figura 5).25-29
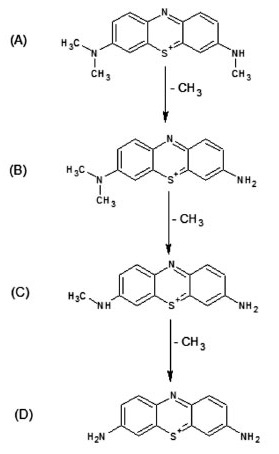 Figura 5. Estruturas dos intermediários formados durante a fotocatálise do corante Azul de Metileno: (a) Azure B, (b) Azure A, (c) Azure C e (d) Tionina
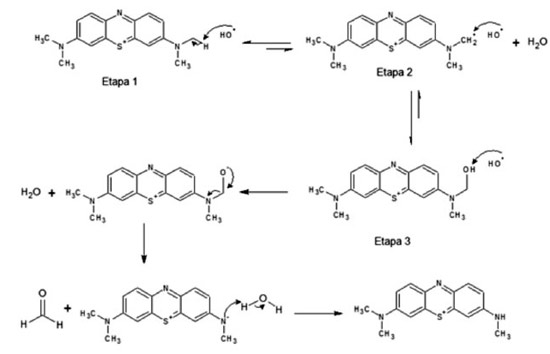
O mecanismo de desmetilação (Figura 6) indica a desprotonação de uma metila, ligada ao nitrogênio ramificado do anel, pelo radical hidroxila (˙OH) (Etapa 1) formando radical. Devido ao elétron desemparelhado do radical ˙OH e da estrutura do corante, ocorre a sobreposição dos orbitais dos dois radicais (Etapa 2). Assim, o grupamento hidroxila sofre oxidação pelo radical ˙OH, liberando uma metila do anel em forma de aldeído (Etapa 3). O processo de desmetilação ocorre até a retirada dos quatro grupamentos metilas da estrutura, seguindo o mesmo mecanismo de reação (Figura 6).
Esta desmetilação acontece de forma gradual, como sugere os espectros UV-Vis mostrados na Figura 4, em que as bandas de absorção deslocam para comprimentos de onda menores, ou seja, para a região azul do espectro. A fim de investigar os possíveis intermediários formados durante a fotocatálise, a deconvolução dos espectros de absorvância foi realizada, Figuras 2S, 3S e 4S (material suplementar). Os resultados foram comparados aos obtidos por Marbán e colaboradores,30 que estudaram e identificaram a formação dos intermediários pelo mesmo método. O deslocamento da banda inicialmente localizada na faixa de 621-623 nm pode ser observado pela deconvolução do espectro de absorvância do corante durante a fotocatálise, promovida pelo material sintetizado com a alanina, mostrado na Figura 2S (material suplementar). Ao final da fotocatálise foram observadas bandas localizadas em 643, 607 e 545 nm referentes à formação do intermediário Azure A, ao utilizar a amostra sintetizada com alanina. As fotocatálises do azul de metileno realizadas em meio de BiVO4 sintetizado com ureia e ureia/Tween® 80, Figura 3S (material suplementar), apresentaram deslocamento pouco significativo da banda, bem como uma diminuição relativa da intensidade das bandas em relação à outra amostra. As bandas observadas para ambas as amostras são características da formação do composto Azure B. Outros autores reportaram bandas características do intermediário AB em 647,27 64828 e entre 648-655,29 para o AA em 632 nm,27 631 nm,28 e entre 620-634 nm,29 para o AC em 614 nm,27 617 nm,28 e entre 608-612 nm.29 A descoloração do azul de metileno na presença de irradiação ultravioleta e visível e na ausência do semicondutor não apresentou uma pequena diminuição na banda de absorção (kobs = 3,51 x 10-4 min-1) comparada às amostras com os semicondutores, assim como não formou intermediários, Figura 7. Isso infere que ação da fotólise e da termólise é pouco significativa e que o semicondutor sintetizado é essencial para a fotocatálise do corante.
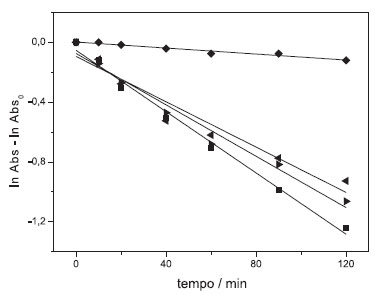 Figura 7. Cinética de descoloraçao do azul de metileno sob condiçao de pseudo-primeira ordem para os fotocatalisadores sintetizados em meio de (■) alanina, (◄) ureia, (►) ureia/Tween®80 e (♦) fotólise
Por meio dos espectros de absorvância, pode-se calcular a constante de velocidade, kobs, da descoloração do azul de metileno em 664 nm, sob condição cinética de pseudo-primeira ordem, em que a concentração do composto fotocatalítico é maior que a do substrato, Figura 7. Os valores foram calculados graficamente, a partir da inclinação da reta entre o logaritmo natural da absorvância do corante, [A], em função do tempo de irradiação, t, conforme a equação (4).  A cinética de descoloração utilizando a amostra sintetizada com alanina apresentou o maior valor de kobs. Além disso, ao adicionar o surfatante a porcentagem de descoloração, medida em 664 nm, e o kobs aumentaram, o que pode ser observado quando utilizado a ureia como combustível, Tabela 4.
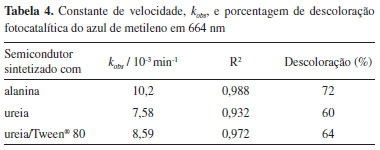
O fato do semicondutor sintetizado com alanina ter apresentado melhor resultado para a descoloração fotocatalítica do azul de metileno pode ser justificado pelo fato de que este combustível apresenta menor entalpia de combustão (ΔcH), -1621,0 ± 1,7 kJ mol-1),31 comparado ao da ureia,32 -632,06 ± 0,67 kJ mol-1. Tal fato indica uma maior espontaneidade do processo e, consequentemente, maior liberação de energia durante a combustão, o que pode afetar a estrutura e o tamanho das partículas sintetizadas. O uso do surfatante proporcionou melhorias na atividade fotocatalítica do composto sintetizado com ureia pelo fato de ser de espécie não iônica e revestir o BiVO4 durante a síntese sem interagir com o mesmo, diminuindo o tamanho da partícula como evidenciado pelas imagens de MEV. Isso também pode ter contribuído para a atividade fotocatalítica. O material sintetizado com alanina apresentou o maior valor de kobs, favorecendo a desmetilação da molécula do azul de metileno e a formação dos intermediários, deslocando a banda de 664 nm para comprimentos de onda menores, proporcionando a maior porcentagem de descoloração, medida em 664 nm, devido ao menor tamanho de partícula verificado pelas imagens de MEV. A síntese utilizando ureia e ureia/Tween® 80 proporcionou partículas de maior tamanho e o espectro de absorvância do azul de metileno na presença do BiVO4, sintetizado com este combustível, não apresentou deslocamento significativo da banda em 664 nm quando comparado com o semicondutor sintetizado com alanina.
CONCLUSÃO O BiVO4 foi preparado pelo método de síntese de combustão em solução que mostrou-se eficiente, já que foi obtido a fase monoclínica comprovada pela DRX. Apenas as amostras sintetizadas na presença de alanina, ureia e ureia/Tween® 80 formaram 100 % de BiVO4 monoclínico, enquanto que para as demais amostras foi observada a formação de outras fases: β-Bi2O3, V2O5 e V0,9Bi8,1O14. Isso ocorre devido ao excesso de combustível tornando a reação altamente explosiva e não auto-propagante, inviabilizando o término da cinética da reação e afetando a formação do produto pela considerável quantidade de subprodutos formados. As imagens de MEV mostraram que o tamanho das partículas foi menor quando o material foi sintetizado com alanina e que, ao adicionar o surfatante, o tamanho das partículas diminuiu quando utilizado o combustível ureia. A presença dos grupos amino e carboxílico nas extremidades da molécula da alanina atuam como uma barreira para o crescimento dos cristais produzindo partículas de menor tamanho. Nos resultados de fotocatálise foram exibidos melhores desempenhos nas propriedades fotocatalíticas ao utilizar o semicondutor sintetizado com alanina (10,2 x 10-3 min-1, 72 % de descoloração) por conta do menor tamanho das partículas, favorecendo a desmetilação da molécula do azul de metileno e a formação dos intermediários.
MATERIAL SUPLEMENTAR O material suplementar encontra-se disponível gratuitamente em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre; apresenta a estrutura e o espectro eletrônico do corante azul de metileno (Figura 1S) e as deconvoluções dos espectros de absorção UV-Vis do corante azul de metileno no início e final da fotocatálise pelo semicondutor BiVO4, sintetizados com diferentes combustíveis e surfactante (Figuras 2S, 3S e 4S).
AGRADECIMENTOS Os autores agradecem ao CNPq, à Fundação Araucária e à FAEPE/UEL pelo auxílio financeiro; ao CNPq e à Capes pelas bolsas de estudo; e aos laboratórios de Microscopia Eletrônica e Microanálise e de Difração de Raios X da UEL e ao Laboratório de Espectroscopia Molecular da USP/SP, onde foram feitas as análises de caracterização. Os autores agradecem aos revisores anônimos cujos comentários foram imprescindíveis para o artigo.
REFERÊNCIAS 1. Meng, X.; Zhang, L.; Dai, H.; Zhao, Z.; Zhang, R.; Liu, Y.; Mater. Chem. Phys. 2011, 125, 59. 2. Zhang, A.; Zhang, J.; Spectrochim. Acta, Part A 2009, 73, 336. 3. Zhang, X.; Ai, Z.; Jia, F.; Zhang, L.; Fan, X.; Zou, Z.; Mater. Chem. Phys. 2007, 103, 162. 4. Iwase, A.; Kudo, A.; J. Mater. Chem. 2010, 20, 7536. 5. Xu, H.; Li, H.; Wu, C.; Chu, J.; Yan, Y.; Shu, H.; Gu, Z.; J. Hazard. Mater. 2008, 153, 877. 6. Wang, D.; Li, R.; Zhu, J.; Shi, J.; Han, J.; Zong, X.; Li, C.; J. Phys. Chem. C 2012, 116, 5082. 7. Jang, J. S.; Kim, H. G.; Lee, S-H.; J. Phys. Chem. Solids 2012, 73, 1372. 8. Dall'Antonia, L. H.; Tacconi, N. R.; Chanmanee, W.; Timmaji, H.; Myung, N.; Rajeshwar, K.; Electrochem. Solid-State Lett. 2010, 13, D29. 9. Jiang, H.; Endo, H.; Natori, H.; Nagai, M.; Kobayashi, K.; Mater. Res. Bull. 2009, 44, 700. 10. Huang, Y.; Tang, Y.; Wang, J.; Chen, Q.; Mater. Chem. Phys. 2006, 97, 394. 11. Jiang, H.; Endo, H.; Natori, H.; Nagai, M.; Kobayashi, K.; J. Eur. Ceram. Soc. 2008, 28, 2955. 12. Timmaji, H. K.; Chanmanee, W.; De Tacconi, N. R.; Rajeshwar, K.; J. Adv. Oxid. Technol. 2011, 14, 93. 13. Silva, M. R.; Dall'antonia, L. H.; Scalvi, L. V. A.; Santos, D. I.; Ruggiero L. O.; Urbano, A.; J. Solid State Electrochem. 2012, 16, 3267. 14. Silva, M. R.; Lucilha, A. C.; Afonso, R.; Dall'antonia, L. H.; Scalvi, L. V. A.; Ionics 2014, 20, 105. 15. Maniasso, N.; Quim. Nova. 2001, 24, 87. 16. Zhou, B.; Zhao, X.; Liu, H.; Qu, J.; Huang, C. P.; Appl. Catal., B 2010, 99, 214. 17. Zhu, Z.; Du, J.; Li, J.; Zhang, Y.; Liu, D.; Ceram. Int. 2012, 38, 4827. 18. Yang, T.; Xia, D.; Chen, G.; Chen, Y.; Mater. Chem. Phys. 2009, 114, 69. 19. Afonso, R.; Serafim, J. A.; Lucilha, A. C.; Silva, M. R.; Lepre, L. F.; Ando, R. A.; Dall'Antonia, L. H.; J. Braz. Chem. Soc. 2014, 25, 726. 20. Rajeshwar, K.; Tacconi N. R.; Chem. Soc. Rev. 2009, 38, 1984. 21. Hwang, C-C.; Wu, T-Y.; Wan, J.; Tsai, J-S.; Mater. Sci. Eng., B 2004, 111, 49. 22. Jiang, H.; Nagai, M.; Kobayashi, K.; J. Alloys Compd. 2009, 479, 821. 23. Toniolo, J. C.; Takimi, A. S.; Bergmann, C. P.; Mater. Res. Bull. 2010, 45, 672. 24. Lima, M. D.; Bonadimann, R.; de Andrade, M. J.; Toniolo, J. C.; Bergmann, C. P.; J. Eur. Ceram. Soc. 2006, 26, 1213. 25. Benetoli, L. O. B.; Cadorin, B. M.; Baldissarelli, V. Z.;Geremias, R.; Souza, I. G.; Debacher, N. A.; J. Hazard. Mater. 2012, 237-238, 55. 26. Bedja, I.; Kamat, P. V.; J. Phys. Chem. 1995, 99, 9182. 27 Yogi, C.; Kojima, K.; Wada, N.; Tokumoto, H.; Takai, T.; Mizoguchi, T.; Tamiaki, H.; Thin Solid Films 2008, 516, 5881. 28 Mohammad, T.; Morrison, H.; Photochem. Photobiol. 2000, 71, 369. 29 Zhang, T.; Oyama, T.; Aoshima, A.; Hidaka, H.; Zhao, J.; Serpone, N.; J. Photochem. Photobiol. A 2001, 140, 163. 30 Marbán, G.; Vu, T. T.; Valdés-Solís, T.; Appl. Catal., A 2011, 402, 218. 31 Contineanu, I.; Marchidan, D. I.; Rev. Roum. Chim. 1984, 29, 43. 32 Kabo, G. Ya.; Miroshnichenko, E. A.; Frenkel, M. L.; Kozyro, A. A.; Simirskii, V. V.; Krasulin, A. P.; Vorob'eva, V. P.; Lebedev, Yu. A.; Chem. Sci. 1990, 662. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access