Nota Técnica
|
|
| Nanopartículas de poli-hidroxibutirato-co-valerato como suporte para a imobilização da lipase de Candida antarctica fração B Nanoparticles of poly(hydroxybutyrate-co-hydroxyvalerate) as support for the immobilization of Candida antarctica lipase (Fraction B). |
|
Ilizandra A. FernandesI; Nádia L. D. NyariI; José Vladimir de OliveiraII; Elisandra RigoIII; Maria Cristiane M. de SouzaIV; Luciana R. B. GonçalvesIV; Sibele Berenice C. PergherV; Débora de OliveiraII,*
IDepartamento de Ciências Agrárias, Universidade Regional Integrada, Campus de Erechim,1621,99700-000 Erechim - RS, Brasil Recebido em 02/04/2013 *e-mail: debora@enq.ufsc.br This work evaluates the immobilization of Candida antarctica lipase (Fraction B) using poly(hydroxybutyrate-co-hydroxyvalerate) (PHBV) nanoparticles as support. The effects of immobilization time (30-150 min) and pH (5-10) on lipase loading were evaluated. The stability of the immobilized enzyme towards temperature (40, 60, and 80 ºC), reuse and storage (at 4 ºC) were also determined. Furthermore, to assess its potential application in a system of interest, the immobilized lipase was used as a catalyst in the esterification of geraniol with oleic acid. The results indicated a time of 120 minutes and pH of 7 as optimal for immobilization. A 21 hour exposure of the PHBV-lipase derivative to 60 ºC showed a 33% reduction of the initial activity while storage at 4 ºC led to a residual activity (5% of the original activity). The derivative was used without significant loss of activity for 4 successive cycles. The use of the immobilized lipase as a catalyst in the production of geranyl oleate led to about 88% conversion of the initial reactants to products. INTRODUÇAO A área da nanotecnologia aplicada ao setor de alimentos vem apresentando um crescimento significativo nos últimos anos. Os processos de microencapsulaçao sao interessantes em diferentes áreas da indústria, como por exemplo, no encapsulamento de ingredientes alimentícios, controle da liberaçao de pesticidas em agroquímica, podendo ainda ser usado em cosméticos, eletrônicos, biomedicina e processamento de materiais especiais.1 Os fluidos supercríticos (FSCs) têm sido propostos como meio para a produçao de nanomateriais. As propriedades que fazem os fluidos supercríticos particularmente atraentes sao a difusividade, o poder solvente, a seletividade e a possibilidade da sua eliminaçao completa ao final do processo.2 O poli(hidroxibutirato-co-valerato) vem se destacando em diversas áreas por ser um polímero biodegradável, com boa biocompatibilidade, sendo uma alternativa como agente encapsulante.3 Neste sentido, os polímeros ganham destaque devido à possibilidade de sua utilizaçao como agente estabilizante de biocompostos, como enzimas. A imobilizaçao de enzimas em suportes sólidos permite a sua reutilizaçao e fácil manuseio e melhora a estabilidade do catalisador, que sao importantes para o desenvolvimento de processos biotecnológicos econômicos.4 Desta forma, a imobilizaçao de enzimas tem sido uma estratégia para a maioria das aplicaçoes em grande escala devido à facilidade de reutilizaçao do catalisador, operaçao contínua e purificaçao do produto.5 A pesquisa nesta área busca a descoberta de novas enzimas eficientes, de novos compostos alvo e também de novos suportes sólidos convenientes, capazes de sustentar a atividade enzimática em meio orgânico com perda mínima. A reutilizaçao de enzimas imobilizadas representa uma excelente abordagem para química verde, reduzindo o custo e a quantidade desses biocatalisadores, em geral, de alto valor agregado.6 A imobilizaçao de enzimas tem atraído grande atençao nas áreas da química fina, biomedicina e biossensores. Sabidamente, o desempenho da enzima imobilizada depende em grande parte da estrutura do suporte, sendo que os suportes nanoestruturados sao capazes de manter a atividade catalítica, bem como garantir a eficiência de imobilizaçao da enzima.7 A imobilizaçao pelo método de adsorçao consiste na utilizaçao da enzima e um suporte sólido por ligaçoes de baixa energia, tais como interaçoes de van der Waals ou hidrofóbicas, ligaçoes de hidrogênio e iônicas, entre outras. Vários materiais podem ser usados para este propósito e a escolha de um deles depende de suas propriedades, como força mecânica, estabilidade física e química, caráter hidrofóbico/hidrofílico, capacidade de adsorçao de enzima e custo.8 Os suportes para adsorçao, tanto na fase sólida ou líquida, podem ser orgânicos (derivados da DEAE-celulose, Dowex) e inorgânicos (celite, bentonita, alumina, argilas, zeólitas, Accurel) entre outros.9,10 Há uma diversidade de biopolímeros naturais ou sintéticos que podem ser empregados como agentes encapsulantes de compostos bioativos, por apresentarem biocompatibilidade e biodegrabilidade. Dentre os principais destacam-se o ácido poliláctico, policaprolactona, polilactídeo, poli(lactídeo-co-glicosídeo), polietilenoglicol, polivinil álcool, polihidroxibutirato e o co-polímero poli(3-hidroxibutirato-cohidrovivalerato).3,11 A utilizaçao de nanopartículas como agentes encapsulantes tem sido alvo de pesquisas recentes, podendo-se citar a aplicaçao de suportes nanométricos tais como sílica, quitosana e ferro.12,13 A formaçao de partículas e o encapsulamento usando técnicas tradicionais (spray-drying, coacervaçao, freeze-drying, polimerizaçao interfacial) podem apresentar algumas desvantagens, como o nao controle do tamanho das partículas, morfologia, degradaçao de compostos termossensíveis, além da baixa eficiência no encapsulamento e rendimento. Neste sentido, alguns fluidos supercríticos têm sido utilizados para este fim. Além de fornecer partículas de tamanho uniforme, com estreita distribuiçao de tamanho de partículas, esta técnica permite uma separaçao eficiente das partículas, impedindo resíduos de solventes orgânicos no produto final, permitindo a reutilizaçao do solvente ou anti-solvente.3 O tratamento de polímeros como o poli-hidroxibutirato-co-valerato com fluidos supercríticos, para posterior imobilizaçao de enzimas, vem se constituindo em alternativa promissora. Neste contexto, destacam-se as lipases, enzimas de relevância biotecnológica por apresentarem várias aplicaçoes na área de alimentos, indústrias de detergentes e fármacos. Novas aplicaçoes biotecnológicas têm sido estabelecidas com sucesso utilizando lipases para a síntese de biopolímeros e biodiesel, a produçao de compostos farmacêuticos enantiopuros, agroquímicos e sabores (flavor).14 A lipase Candida antarctica do tipo B (CalB) possui estrutura globular, é constituída de 317 resíduos de aminoácidos, tem dimensoes de 30 A x 40 A x 50 A, massa molecular (MM) de 33 kDa e o ponto isoelétrico (pI) de 6,0.15,16 Com base nestes aspectos, o presente trabalho tem como objetivo central avaliar o efeito de parâmetros de imobilizaçao (tempo de imobilizaçao e pH) da lipase comercial CalB pelo método de adsorçao, utilizando como suporte nanopartículas do PHBV obtidas através da precipitaçao com dióxido de carbono supercrítico. A estabilidade do derivado enzimático frente à temperatura (40, 60 e 80 ºC), ao reuso e à estabilidade à estocagem (4 ºC) também foram determinados. O derivado enzimático foi utilizado como catalisador na reaçao de esterificaçao do geraniol e ácido oleico para verificar seu potencial de aplicaçao em um sistema de interesse.
PARTE EXPERIMENTAL Materiais Nos experimentos de precipitaçao foram utilizados os seguintes reagentes: dióxido de carbono (White Martins S.A., pureza de 99,8%), diclorometano (FMaia, pureza de 99,5%), e o copolímero, poli(hidroxibutirato-co-hidroxivalerato) (PHBV) com massa molar média (Mw) de 196.000 e índice de polidispersao de 1,85, gentilmente cedido pela empresa PHB Industrial S/A. Estes materiais foram utilizados como recebidos, sem qualquer tratamento prévio, e foram armazenados de forma adequada, evitando contato com a luz, calor e umidade. O co-polímero foi submetido a uma pré-purificaçao, pela sua dissoluçao em clorofórmio P.A. (Vetec, pureza de 99,5%) e posterior precipitaçao em n-heptano P.A. (Vetec, pureza de 99,5%) para retirada de impurezas. A imobilizaçao foi realizada utilizando a lipase solúvel de Candida antarctica do tipo B livre (Novozym CalB), gentilmente doada por Novozymes Latina América Ltda. A atividade hidrolítica foi medida. O meio reacional para determinaçao da atividade de hidrólise consistia de 15 mM de butirato de p-nitrofenila (Sigma Aldrich, pureza de 99,9%) em 10 mL de álcool isopropílico (Neon, pureza de 99,5%) e 100 mL de tampao fosfato de sódio 25 mM, pH 7, sob agitaçao a 28 ºC.16 No estudo da aplicaçao do derivado enzimático como catalisador de reaçoes de esterificaçao em sistema livre de solvente, foram utilizados como substratos o geraniol (Sigma Aldrich, pureza > 97%) e o ácido oleico (Sigma Aldrich, pureza > 99%). Precipitaçao do PHBV A precipitaçao do poli (hidroxibutirato-co-hidroxivalerato) (PHBV) puro foi realizada utilizando dióxido de carbono supercrítico como anti-solvente e diclorometano como solvente orgânico, utilizando a técnica de Dispersao da Soluçao Aumentada por Fluidos Supercríticos (SEDS) para formaçao das nanopartículas. Os valores do parâmetros de processo de precipitaçao utilizados foram a concentraçao de PHBV (30 mg mL-1), pressao da soluçao orgânica (80 bar), a vazao da soluçao foi 1 mL min-1, taxa de fluxo anti-solvente 40 mL min-1 e temperatura constante de 40 ºC.3,17 Detalhes do equipamento utilizado neste trabalho para a precipitaçao do PHBV podem ser encontrados na literatura.18,19 Uma descriçao detalhada do aparato e procedimento experimental de formaçao de partículas de PHBV pode ser encontrada nos trabalhos de Franceschi et al..3,17 Imobilizaçao da lipase utilizando PHBV como suporte Em tubos típicos para uso em centrífuga de 50 mL, foram colocados em contato 0,1 g de nanopartículas de PHBV e 10 mL de soluçao tampao em diferentes valores de pH, contendo 0,1 mL de lipase CalB (atividade inicial 75 U/mL). Os tubos foram mantidos sob agitaçao de 7 rpm utilizando diferentes tempos em agitador rotativo (Tecnal TE-165). Posteriormente, separou-se o sobrenadante por filtraçao a vácuo. O imobilizado foi lavado com água destilada sob filtro com o auxílio de uma bomba de vácuo e, posteriormente, mantido durante 24 horas em dessecador para equalizaçao do teor de umidade. A avaliaçao do tempo de imobilizaçao foi realizada nos valores de 30, 60, 90, 120 e 150 min, segundo metodologia proposta por Rodrigues et al..20 A avaliaçao do efeito do pH na imobilizaçao da enzima foi realizada utilizando-se diferentes tampoes de 25 mM em diferentes pH's: acetato de sódio, pH 5; fosfato de sódio, pH 6, 7 e 8; tris aminometano, pH 9 e carbonato de sódio, pH 10. O mesmo procedimento adotado anteriormente para obtençao do derivado enzimático foi empregado nesta etapa. Estabilidade térmica do derivado imobilizado A enzima livre e imobilizada em PHBV foi mantida em estufa a vácuo a 40, 60 e 80 ºC por 21 horas, segundo metodologia descrita por Silva et al..21 Periodicamente, efetuava-se a dosagem da atividade hidrolítica em butirato de p-nitrofenila. A enzima imobilizada foi armazenada em geladeira (4 ºC) em frascos de vidro (sem presença de tampao). Periodicamente, efetuava-se a dosagem da atividade hidrolítica em butirato de p-nitrofenila. Estabilidade operacional do derivado enzimático Foram adicionados 50 mg de enzima imobilizada em béquer de 50 mL contendo 25 mL de meio reacional (15 mM butirato de p-nitrofenila), 10 mL de álcool isopropílico e 100 mL de tampao fosfato de sódio 25 mM a pH 7. A reaçao foi conduzida em banho-maria a 28 ºC, sob agitaçao. A cada minuto, um volume de 2,5 mL era coletado para medida da atividade em espectrofotômetro a 348 nm e, posteriormente, readicionado ao meio reacional. Cada ciclo teve duraçao de 15 min. Após cada ciclo, o imobilizado era lavado com água destilada e a umidade equalizada em bomba de vácuo por 30 min. Esta etapa teve por objetivo avaliar a possibilidade de reuso do derivado enzimático. A atividade do derivado foi monitorada por quatro ciclos consecutivos. Determinaçao da atividade de hidrólise O meio reacional consistia de 15 mM de butirato de p-nitrofenila em 10 mL de álcool isopropílico e 100 mL de tampao fosfato de sódio 25 mM, pH 7, sob agitaçao a 28 ºC. Adicionava-se 2,5 mL deste substrato em cubeta onde se acrescia 0,1 mL de soluçao de enzima livre. Para dosagem da atividade do imobilizado, foram adicionados 50 mg de enzima imobilizada em 2,5 mL do substrato. Posteriormente, foi efetuada a medida da atividade hidrolítica, em espectrofotômetro Lambda 35, UV-Vis (PerkinElmer) a 348 nm.16 Esterificaçao enzimática do geraniol e ácido oleico utilizando o derivado enzimático A esterificaçao enzimática foi realizada conforme condiçoes otimizadas em trabalho anterior,22 utilizando geraniol e ácido oleico como substratos na proporçao molar de 3:1. Os substratos foram adicionados em Erlenmeyers de 50 mL com volume médio reacional de 5 mL. Pesou-se 0,5 g (10 % m/m em relaçao aos substratos) da enzima CalB imobilizada em PHVB e o tempo reacional foi contado a partir da adiçao da mesma. Todos os experimentos foram realizados em agitador orbital (shaker) com agitaçao constante de 150 rpm e temperatura de 40 ºC. Após o término do tempo de reaçao, fixado em 6 horas, o biocatalisador foi filtrado com papel filtro. A conversao em ésteres foi determinada por titulaçao com hidróxido de sódio (NaOH) 0,05 M até pH 11.22 Caracterizaçao estrutural do polímero e do derivado imobilizado Microscopia Eletrônica de Varredura (MEV) Visando inspecionar a morfologia das nanopartículas de PHBV e do derivado imobilizado foram obtidas micrografias a partir de um microscópio eletrônico de varredura. As análises de Microscopia Eletrônica de Varredura (MEV) foram realizadas no Laboratório de Microscopia Eletrônica de Varredura da UFRN, utilizando um microscópio JEOL - JSM 5800 com voltagem de aceleraçao de 20KV e magnificaçoes de 200x, 1.000x e 10.000x. Difraçao de Raio-X Os difratogramas das amostras das nanopartículas de PHBV e do derivado imobilizado foram obtidas através de um difratômetro de raio-X da marca Rigaku, Miniflex II, com tubo emissor de Cu (λ = 1,54Å). As análises foram realizadas no Laboratório de Instrumentaçao Analítica da Universidade Federal do Rio Grande do Norte. Análise termogravimétrica As análises termogravimétricas foram realizadas em analisador térmico TGA-50H Shimadzu com taxa de aquecimento de 10 ºC/min sobre fluxo de ar sintético no Laboratório de Instrumentaçao Analítica da Universidade Federal do Rio Grande do Norte.
RESULTADOS E DISCUSSAO Maximizaçao das condiçoes de processo para imobilizaçao da lipase em PHBV O estudo do tempo de imobilizaçao da lipase Candida antarctica B em nanopartículas de PHBV indicou o período de contato entre a enzima e o suporte necessário para que houvesse um bom fator de imobilizaçao, sendo os resultados obtidos apresentados na Tabela 1.

De acordo com os resultados obtidos verificou-se que nos tempos de 30 e 60 min a percentagem de adsorçao foi superior a 93%, mas a atividade do imobilizado foi de 0,11 e 0,09 U/g. No tempo de 120 min a imobilizaçao em tampao fosfato de sódio 25 mM, pH 7 resultou no maior valor de atividade do imobilizado (0,33 U/g), sendo que a percentagem de adsorçao foi de 88,90%. A avaliaçao do pH de imobilizaçao foi realizada buscando um maior fator de imobilizaçao. Os resultados do pH ótimo para imobilizaçao estao apresentados na Tabela 2, observando que os resultados obtidos com a imobilizaçao em pH 5 (tampao acetato de sódio 25 mM) e pH 6 (tampao fosfato de sódio 25 mM) apresentaram a maior atividade do imobilizado (0,35 U/g). Contudo, verificou-se que em pH 7 (tampao fosfato de sódio 25 mM) foi obtida uma atividade similar (0,33 U/g) e uma maior percentagem de imobilizaçao (92,30%). Os menores valores de atividade do derivado foram obtidas nos pH 8 (tampao fosfato de sódio 25 mM), 9 (tampao tris-aminometano 25 mM) e 10 (tampao carbonato de sódio 25mM). Levando em consideraçao que o ponto isoelétrico da lipase CalB é 6, os resultados obtidos neste estudo indicaram uma faixa de pH ótimo próxima do ponto isoelétrico da enzima.15,23 Os resultados obtidos no presente trabalho encontram-se em concordância com os de Liu et al.,12 os quais imobilizaram lipase de pâncreas suíno em nanopartículas de quitosana e ferro pelo método de adsorçao, obtendo mais elevadas percentagens de mobilizaçao e atividades enzimáticas em valor de pH igual a 7.

Estabilidade térmica do derivado imobilizado Após determinar a melhor condiçao para imobilizaçao da lipase em PHBV (120 min, pH 7) foi realizada a avaliaçao da estabilidade de temperatura da enzima livre e imobilizada em funçao do tempo, conforme apresentado na Tabela 3.
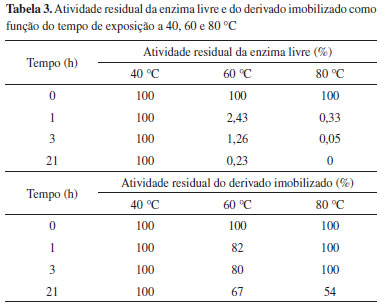
A enzima livre submetida a 40 ºC manteve sua atividade inicial (75 U/mL) após 21 horas de exposiçao. Nas temperaturas de 60 e 80 ºC, as atividades residuais foram de 1,26 e 0,33% após exposiçao de 3 horas. O estudo da estabilidade de temperatura CalB livre foi estudada por Arroyo et al.,24 onde após 1 hora de exposiçao a 50 ºC a atividade apresentou reduçao de 70%. A estabilidade da CalB livre em temperaturas elevadas também foi avaliada por Silva et al.21 Os autores verificaram que a enzima foi completamente inativada após 21 h de exposiçao a 60 ºC. O derivado imobilizado, após exposiçao de 21 horas a 40 ºC manteve sua atividade inicial. Após 21 horas de exposiçao a 60 ºC, a atividade hidrolítica da CalB/PHBV apresentou decréscimo, com atividade residual de 67%. Cabe ressaltar que Silva et al.21 utilizaram diversas preparaçoes de quitosana para imobilizar a lipase Candida antarctica B e a estabilidade térmica dos derivados imobilizados a 60 ºC por 21 horas apresentaram uma atividade residual em torno de 40 %. Na temperatura de 80 ºC a enzima imobilizada manteve mais de 50 % de sua atividade inicial. Nesse sentido, dentro do escopo deste trabalho, pode-se verificar que e metodologia de imobilizaçao proposta apresenta viabilidade técnica, tendo em vista o aumento considerável da estabilidade do derivado enzimático em comparaçao à enzima livre, quando submetida a temperaturas elevadas. O derivado enzimático demonstrou atividade residual de 50% após 30 dias de estocagem em geladeira (4 ºC). Nesta mesma temperatura, o extrato imobilizado perdeu completamente sua atividade hidrolítica após 45 dias de armazenamento. Caracterizaçao das nanopartículas de PHBV e do derivado enzimático A precipitaçao do polímero PHBV em dióxido de carbono supercrítico utilizando a técnica SEDS resultou na formaçao de nanofibras de 5 a 7 µm de largura (Figura 1 (A)) e após a imobilizaçao ocorreu um aumento na espessura das nanofibras para valores entre 7 a 10 µm (Figura 1 (B)). As micrografias demonstram existência de similaridade morfológica. As enzimas imobilizadas possuem maior tamanho de partícula, este fato está relacionado com as pequenas aglomeraçoes formadas durante a imobilizaçao.24
 Figura 1. Micrografias das nanopartículas de PHBV (A) e do derivado imobilizado (B)
A cristalinidade das nanofibras foi avaliada pela análise de DRX. Os difratogramas do suporte e do derivado imobilizado sao apresentados nas Figuras 2 (A) e (B), respectivamente. Os difratogramas para ambas as amostras exibem reflexoes intensas e definidas indicando que o material possui estrutura cristalina. Os compostos cristalinos apresentam estrutura organizada e, consequentemente, uma superfície mais uniforme. Comparando as figuras observa-se o mesmo comportamento, ou seja, aparecem os mesmos planos cristalinos (mesmas reflexoes). Este resultado era esperado tendo em vista que a imobilizaçao ocorre com uma enzima solúvel, sua estrutura permanece praticamente inalterada. Perfis de difraçao similares para PHBV puro foram encontrados por Senhorini et al.,25 trabalho no qual o difratograma deste composto apresentou valores de 2θ correspondentes aos planos cristalinos na faixa de 13 a 30º.
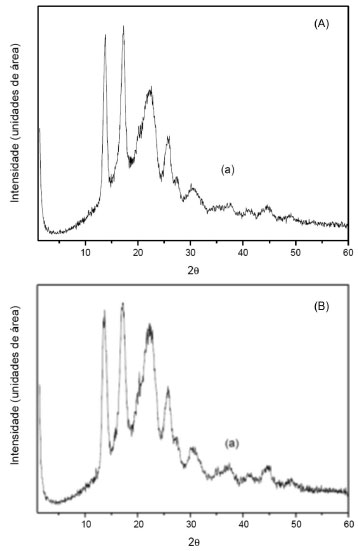 Figura 2. Difratograma de raio X das nanopartículas de PHBV (A) e do derivado imobilizado (B)
A Figura 3 apresenta os espectros de infravermelho dos materiais, onde se pode observar as mesmas bandas nos dois espectros, indicando que a estrutura da nanofibra nao foi modificada com a imobilizaçao da enzima. Estes resultados estao de acordo com os obtidos pelas análises de DRX e MEV. Nos espectros observa-se banda a ~1701 cm-1 devido ao estiramento da ligaçao -C=O, bandas características de 1200 cm-1 a ~1000 cm-1 relacionadas ao estiramento -C-O-C- e bandas a 1455 cm-1 e 1382 cm-1, características do estiramento angular assimétrico -CH.
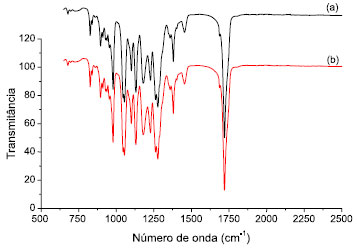 Figura 3. Espectros no infravermelho dos materiais (a) antes (b) depois da incorporaçao da enzima
A Figura 4 apresenta os resultados da análise termogravimétrica das amostras antes e após a incorporaçao da enzima. Observa-se desta figura que os materiais possuem uma grande estabilidade térmica (~ 297 ºC) e que a esta temperatura ocorre uma degradaçao total do polímero com perda total de massa. Esta perda ocorre um uma única etapa, à temperatura de ~ 297 ºC e é associada a um evento exotérmico. Este comportamento sugere que nenhuma alteraçao nas propriedades térmicas ocorre em funçao da imobilizaçao da enzima nas nanofibras.
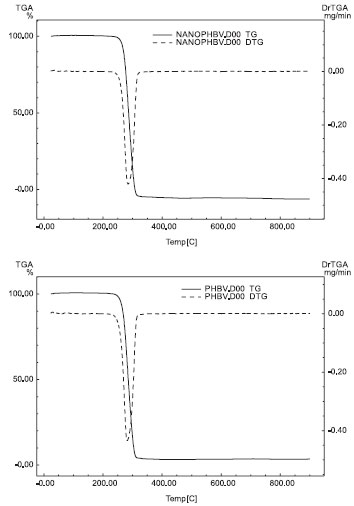 Figura 4. Curvas TG/DTG (A) antes e (B) depois da incorporaçao da enzima
Os resultados de caracterizaçao contribuem para mostrar que as propriedades estruturais, químicas e térmicas nao sao modificadas após o processo de imobilizaçao da enzima. Uma tendência de aumento da largura das nanofibras é observado após o processo de imobilizaçao. Um fato relevante é que a morfologia das nanopartículas é de nanofibra, estrutura interessante para empregos destes materiais como suporte para a imobilizaçao de enzimas, uma vez que o entrelaçamento das fibras pode proporcionar uma maior estabilidade mecânica ao material imobilizado. Aplicaçao do derivado enzimático na esterificaçao de geraniol e ácido oleico Em relaçao à estabilidade operacional da lipase Candida antarctica B em PHBV, estes biocatalisadores foram testados por 4 ciclos nos quais foi possível constatar que os mesmos mantiveram sua atividade inicial inalterada (atividade inicial do primeiro ciclo de 0,33 U/g, atividade residual de 100%). A aplicaçao da lipase na catálise de reaçoes para esterificaçao de geraniol e ácido oleico em sistema livre de solvente orgânico apresentou 88% de conversao, resultado similar ao obtido por Paroul et al.,22 que obtiveram 93% de conversao utilizando uma lipase imobilizada comercial (Novozym 435).
CONCLUSOES Avaliando os resultados concernentes à atividade do imobilizado e percentual de adsorçao, foi possível concluir que o melhor tempo e pH de imobilizaçao foram 120 min e 7, respectivamente. A lipase CalB imobilizada em PHBV possui relativa boa estabilidade a temperaturas mais elevadas comparada com a enzima livre. Apesar da atividade hidrolítica do imobilizado ser baixa, este derivado apresentou boa estabilidade nas temperaturas de 60 e 80 ºC mantendo mais de 50% de sua atividade inicial após 21 horas de exposiçao. Comparando a estabilidade da enzima livre em relaçao à enzima imobilizada, observa-se que nas temperaturas mais elevadas a enzima livre apresenta rápida desnaturaçao, o que nao ocorre com a enzima imobilizada em nanopartículas de PHBV. Portanto, é possível concluir que a imobilizaçao utilizando este suporte biodegradável apresenta uma nova rota, promissora, para imobilizaçao da lipase CalB.
AGRADECIMENTOS Os autores agradecem à CAPES (Brasil) e ao CNPq (Brasil) pelo apoio financeiro, à Novozymes (PR, Brasil) pela amostra de lipase e às IES (URI, UFSC e UFRN) onde o trabalho foi desenvolvido pela infraestrutura disponibilizada.
REFERENCIAS 1. Garay, I.; Pocheville, A.; Madariaga, L: Powder Technol. 2010, 197, 211. 2. Reverchon, E; Adami, R.; J. Supercrit. Fluids 2006, 37, 1. 3. Franceschi, E.; De Cesaro, A. M.; Feiten, M.; Ferreira, S. R. S.; Dariva, C.; Kunita, M. H.; Rubira, A. F.; Muniz, E. C.; Corazza, M. L.; Oliveira, J. V.; J. Supercrit. Fluids 2008, 47, 259. 4. Milasinović, N.; Milosavljević, N.; Filipovic, J.; Knezević-Jugović, Z.; Krusic, M. K.; React. Funct. Polym. 2010, 70, 807. 5. Kim, J.; Grate, J. W.; Wang, P.; Chem. Eng. Sci. 2006, 61, 1017. 6. Andrade, L. H.; Rebelo, L. P.; Netto, C .G. C. M.; Toma, H. E.; J. Mol. Catal. B: Enzym. 2010, 66, 55. 7. Wang, Z. G.; Wan, L. S.; Liu, Z. M.; Huang, X. J.; Xu, Z. K.; J. Mol. Catal. B: Enzym. 2009, 56, 189. 8. Dalla-Vecchia, R.; Nascimento, M. G.; Soldi, V.; Quim. Nova. 2004, 27, 623. 9. Vitolo, M. Em Biotecnologia Industrial, v.3 - Processos Fermentativos e Enzimáticos; Lima, U.A.; Aquarone, E.; Borzani, W.; Schmidell, W., eds.; Edgard Blucher: Sao Paulo. 2001, cap 3, 391-394. 10. Scherer, R.; Oliveira, J. V.; Pergher, S.; Oliveira, D.; Materials Research 2011, 14, 483. 11. Cocero, M. J.; Martin, A.; Mattea, F.; Varona, S.; J. Supercrit. Fluids 2008, 47, 546. 12. Liu, Y.; Jia, S.; Wu, Q.; Ran, J.; Zhang, W.; Wu, S.; Catal. Commun. 2011, 12, 717. 13. Macario, A.; Verri, F.; Diaz, U.; Corma, A.; Giordano, G.; Catal. Today 2013, 204, 148. 14. Hasan, F.; Shah, A. A.; Hameed, A.; Biotechnol. Adv. 2009, 27, 782. 15. Uppenberg, J.; Hansen, M. T.; Patkar, S.; Jans, T. A.; Structure 1994, 2, 293. 16. Brigida, A. I. S.; Pinheiro, A. D. T.; Ferreira, A. L. O.; Gonçalves, L. R. B.; Appl. Biochem. Biotechnol. 2008, 146, 173. 17. Franceschi, E.; Cesaro, A. M.; Ferreira, S. R. S.; Oliveira, J. V.; J. Food Eng. 2009, 95, 656. 18. Priamo, W. L.; Cezaro, A. M.; Ferreira, S. R. S.; Oliveira, J. V.; J. Supercrit. Fluids 2010, 54, 103. 19. Priamo, W. L.; Cezaro, A. M.; Beneti, S. C.; Oliveira, J. V.; Ferreira, S. R. S.; J. Supercrit. Fluids 2011, 56, 137. 20. Rodrigues, D. S.; Cavalcante, G. P.; Ferreira, A. L. O.; Gonçalves, L. R. B.; Chem. Biochem. Eng. Q. 2008, 22, 125. 21. Silva, J. A.; Macedo, G. P.; Rodrigues, D.S.; Giordano, R. L. C.; Gonçalves, L. R. B.; Biochem. Eng. J. 2012, 60, 16. 22. Paroul, N.; Grzegozeski, L. P.; Chiaradia, V.; Treichel, H.; Cansian, R. L.; Oliveira, J. V.; Oliveira, D.; Bioprocess. Biosyst. Eng. 2011, 34, 323. 23. Sun, J.; Jiang, Y.; Zhou, L.; Gao, J.; New Biotechnol. 2010, 27, 53. 24. Arroyo, M.; Sanchez-Monteiro, J. M.; Sinisterra, J. V.; Enzyme Microb. Technol. 1999, 24, 3. 25. Senhorini, G. A.; Zawadzki, S. F.; Farago, P. V.; Zanin, S. M. W.; Marques, F. A.; Mater. Sci. Eng., C 2012, 32, 1121. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





