Artigo
|
|
| Nanocompósitos entre nanotubos de carbono e nanopartículas de platina: preparação, caracterização e aplicação em eletro-oxidação de álcoois Carbon nanotube/platinum nanoparticle nanocomposites: preparation, characterization and application in electrooxidation of alcohols |
|
Adir H. Kalinke; Aldo J. G. Zarbin*
Departamento de Química, Universidade Federal do Paraná, CP 19081, 81531-990 Curitiba - PR, Brasil Recebido em 18/12/2013 *e-mail: aldozarbin@ufpr.br The synthesis and characterization of different platinum nanoparticle/carbon nanotube nanocomposite samples are described along with the application of these nanocomposites as electrocatalysts for alcohol oxidation. Samples were prepared by a biphasic system in which platinum nanoparticles (Pt-NPs) are synthesized in situ in contact with a carbon nanotube (CNT) dispersion. Variables including platinum precursor/CNT ratio, previous chemical treatment of carbon nanotubes, and presence or absence of a capping agent were evaluated and correlated with the characteristic of the synthesized materials. Samples were characterized by Raman spectroscopy, X-ray diffraction, thermogravimetric analysis and transmission electron microscopy. Glassy carbon electrodes were modified by the nanocomposite samples and evaluated as electrocatalysts for alcohol oxidation. Current densities of 56.1 and 79.8/104.7 mA cm-2 were determined for the oxidation of methanol and ethanol, respectively. INTRODUÇAO Células a combustível convertem energia química em energia elétrica, e se mostram uma alternativa muito interessante e ambientalmente favorável para geraçao de energia limpa.1-3 As células abastecidas com hidrogênio permitem a obtençao de alta eficiência com baixíssima emissao de poluentes. No entanto, o hidrogênio é um combustível inviável em aplicaçoes cotidianas, devido ao custo de produçao e dificuldades na manipulaçao e no armazenamento.1,2 Assim, é necessária a busca de combustíveis alternativos. Neste caso, um dos melhores sistemas é a célula movida a metanol direto (DMFC - Direct Methanol Fuel Cell). O metanol é atrativo como combustível, pois é barato, amplamente disponível e de fácil manipulaçao e distribuiçao.3 Entretanto, ele é tóxico, poluente e pode contaminar águas no caso de vazamentos,1 fatores que motivam a busca de um substituto como o etanol, que é pouco tóxico, com maior ponto de ebuliçao, além de apresentar facilidade de estocagem e ser um biocombustível. No entanto, a quebra da ligaçao C-C e a oxidaçao total para CO2 é um grande problema. Neste caso, a oxidaçao parcial leva à formaçao de produtos como: CH3CHO e CH3COOH, e estes intermediários podem causar uma considerável reduçao na capacidade do combustível. Além dessas subtâncias indesejáveis, o CO adsorvido também contribui consideravelmente para o bloqueio parcial da superfície da Pt, e consequentemente para uma diminuiçao nas correntes de oxidaçao com o tempo.4 Na célula a combustível, a oxidaçao do combustível requer a utilizaçao de um catalisador para atingir densidades de corrente que as tornem comercialmente viáveis. A platina em meio ácido apresenta alta atividade catalítica para este processo.3,5 No entanto, seu alto custo, a facilidade do envenenamento dos sítios ativos e as reservas limitadas deste metal dificultam sua utilizaçao em massa. Isto motiva a busca de alternativas que aproveitem sua eficiência com concentraçoes mínimas, sendo que platina na forma de nanopartículas suportadas em substratos adequados é uma alternativa promissora. Dentre os suportes, destacam-se diferentes estruturas de carbono amorfo,6,7 nanotubos de carbono8-10 e grafeno.11,12 Os nanotubos de carbono (NTC) sao formados pelo enrolamento de folhas de grafeno, constituídas por átomos de carbono com hibridizaçao sp2, ligados por arranjos hexagonais, originando pequenos cilindros com diâmetros nanométricos e comprimentos que podem atingir centímetros.13 Existem dois tipos de nanotubos: os de parede simples (SWCNT), formados por uma única folha de grafeno enrolada sobre si mesma para formar um tubo cilíndrico, e os de paredes múltiplas (MWCNT), formados por um conjunto de nanotubos concêntricos com diâmetros decrescentes arranjados de forma coaxial. Nanotubos de carbono apresentam alta resistência à oxidaçao e temperatura, baixa densidade e excelente condutividade térmica e elétrica, tornando-os muito promissores em diversas aplicaçoes tecnológicas.14 Diversos trabalhos preparam nanopartículas de platina dispersas em nanotubos de carbono, e descrevem sua utilizaçao como catalisadores na oxidaçao de álcoois.15-17 O controle de algumas variáveis durante a síntese pode levar a materiais com características e propriedades diferenciadas. Dentre elas, método de preparaçao, tamanho e distribuiçao, presença ou nao de passivantes, tipo de nanotubo de carbono, grau de dispersao das nanopartículas sobre os nanotubos, forma de deposiçao e construçao dos eletrodos, etc. Por exemplo, Mu et al.18 modificaram nanopartículas de Pt preparadas em etilenoglicol com trifenilfosfina. Na sequência as mesmas foram depositadas sobre MWCNT e demonstraram melhor atividade na oxidaçao de metanol, quando comparadas a catalisadores comerciais. Tian et al.19 reportam a síntese de platina em nanotubos de carbono tratados com ácido através de irradiaçao de microondas intermitente (IMI), utilizado em eletrólito polimérico e células de combustível de metanol direto; Chen e Lu5 relatam a formaçao de nanopartículas de platina sobre nanotubos de carbono multi-paredes por processo hidrotermal, e demonstraram o efeito do tamanho das partículas na oxidaçao do metanol; March et al.20 descrevem a formaçao de compósitos entre nanotubos de carbono e nanopartículas de platina passivada com dimetil sulfóxido (DMSO), que foram utilizados na reduçao do oxigênio; Lin et al.21 relatam a formaçao de um compósito entre nanopartículas de platina e nanotubos de carbono através de sistema bifásico água/tolueno, com diâmetro médio das nanopartículas entre 1 e 3 nm. Este trabalho descreve a preparaçao de vários nanocompósitos entre nanopartículas de platina e nanotubos de carbono, sua caracterizaçao física e eletroquímica, a modificaçao de eletrodos com estes nanocompósitos, e o estudo da aplicaçao como catalisadores para oxidaçao de metanol e etanol. Variáveis como tamanho das nanopartículas, presença ou nao de passivantes, tipo de nanotubo de carbono e tratamento químico dos mesmos foram estudados, e os efeitos correlacionados com o rendimento catalítico observado.
PARTE EXPERIMENTAL Preparaçao dos nanotubos de carbono Os nanotubos de carbono foram preparados de acordo com sistemática desenvolvida no GQM-UFPR.22 Um tubo de quartzo (36 mm de diâmetro e 750 mm de comprimento) foi colocado num sistema de aquecimento de dois estágios, sob fluxo de argônio (99%) de 260 mL min-1. Cerca de 0,7 g de ferroceno (Fluka) foi colocado no primeiro forno e sublimado, aumentando a temperatura até 300 ºC a uma taxa de 50 ºC min-1. O fluxo de argônio conduziu o vapor ao segundo forno, previamente aquecido a 900 ºC, onde ocorreu a decomposiçao. Após uma hora o sistema foi desligado. Os nanotubos de carbono foram formados no segundo forno, depositados sobre as paredes do tubo de quartzo.22 Os nanotubos obtidos nesta rota sao do tipo multi-paredes, contendo espécies de ferro (principalmente α-Fe, Fe2O3 e Fe3O4) encapsuladas em suas cavidades. Tratamento dos nanotubos de carbono Os nanotubos foram pré-tratados para aumentar sua dispersabilidade: aproximadamente 20 mg de nanotubos foram colocados em um balao com 50 mL de tolueno, e levados a um banho de ultrassom (Unique, 154 W, 37 kHz) por 1 hora. Após decantar 40 minutos retirou-se o sobrenadante, lavou-se e centrifugou-se o sólido por três vezes em tolueno, e em seguida lavou-se com acetona e secou-se em estufa a 100 ºC por 24 horas. Após esta etapa, aproximadamente 15 mg de nanotubos foram tratados por refluxo em 20 mL de soluçao aquosa de HNO3 (3,0 mol L-1) e H2SO4 (3,0 mol L-1), durante 6 horas e separados por centrifugaçao, lavados diversas vezes com água deionizada até pH neutro e mantidos em estufa a 100 ºC até completa secagem.23 Preparaçao dos nanocompósitos Pt/nanotubos Na formaçao dos nanocompósitos "in situ", 2,2 mg de NTC foram misturados com 0,2734 g de brometo de tetra octil amônio (BTOA) e dispersos em 10 mL de tolueno, sob banho de ultrassom por 3 minutos. Esta dispersao foi gotejada em 3,75 mL de uma soluçao aquosa 0,03 mol L-1 de H2PtCl6 (Riedel-de Haën) e agitada por 10 minutos. Mantendo-se a agitaçao, acrescentou-se 3,5 mL de uma soluçao aquosa 0,4 mol L-1 de NaBH4 (Acrös) recém preparada, rapidamente, com o auxílio de uma seringa. Em algumas amostras, após 90 segundos de agitaçao adicionou-se 51 µL de dodecanotiol (Merck) ao meio reacional. Após a adiçao do tiol agitou-se por 3 h. Na sequência, a fase orgânica foi separada e a ela acrescentou-se 40,0 mL de etanol e manteve-se a - 18 ºC por 1 h. O precipitado formado foi separado por centrifugaçao, lavado com etanol e seco em estufa a aproximadamente 40 ºC. Para comparar, uma amostra foi preparada repetindo o processo, mas sem a adiçao do dodecanotiol. As amostras foram denominadas Pt/BTOA/NTC-DT (com dodecanotiol) e Pt/BTOA/NTC (sem dodecanotiol). Procedimento similar foi realizado sem BTOA. As amostras foram denominadas Pt/NTC-DT (com dodecanotiol e sem BTOA) e Pt/NTC (sem dodecanotiol e sem BTOA). Também se sintetizou nanocompósito com nanotubos de carbono comerciais, do tipo MWCNT, fornecido pela empresa CNT corporation LTD, que foi denominado PtNTCcom. Nanocompósitos também foram sintetizados com nanotubos de carbono após tratamento ácido, seguindo os mesmos procedimentos descritos anteriormente. As amostras obtidas desta forma foram denominadas Pt/NTCtrat e Pt/NTCcomtrat. Para todas as rotas, foram preparadas amostras onde se variou a massa de NTC e o volume da soluçao precursora de platina. Todas as amostras preparadas neste trabalho, com as respectivas condiçoes de síntese, estao resumidas na Tabela 1.
Caracterizaçao das amostras Os difratogramas de raios X (DRX), foram obtidos em um equipamento Shimadzu XRD-6000, com radiaçao Cukα (λ = 1,5418 Å), operando com voltagem de 40 kV, corrente de 40 mA, fenda divergente 1,0 mm, fenda de coleta 0,2 mm, velocidade de varredura de 0,2 graus min-1 em 2θ e acumulaçao para leitura a cada 0,02 graus. As amostras foram medidas através da compactaçao do pó no porta-amostra e as medidas foram realizadas em modo step. Medidas de espectroscopia Raman foram efetuadas em um aparelho Renishaw, com laser de Ar (λ = 514,5 nm) de resoluçao espacial de 1,0 µm. Os espectros foram obtidos na forma de pó sobre quartzo, com acumulaçoes entre 5 a 10 varreduras e tempo de acumulaçao de 20 s na regiao entre 200 e 3500 cm-1. Deconvoluçao das bandas dos espectros foi realizada com o programa Origin 8,0 através de fitting multi-peaks Lorentziano em diferentes regioes espectrais. As análises termogravimétricas (ATG) foram obtidas em um equipamento SDT Q 600 (TA Instruments), utilizando-se ar sintético com fluxo de 100 mL min-1 e aquecimento de 5 ºC min-1 até 1000 ºC, com amostra em cadinho de alumina na forma de pó. Os percentuais de Pt nos nanocompósitos foram calculados a partir dos resíduos das amostras descontando-se o percentual de Fe presente, que foi determinado previamente a partir da curva termogravimétrica dos nanotubos. Imagens de microscopia eletrônica de transmissao (MET) foram realizadas no equipamento JEOL JEM 1200, com voltagem de 120 kV. As amostras foram dispersas em etanol e depositadas, com auxílio de uma micropipeta, sobre grades de cobre recobertas com filme fino de carbono. Medidas de voltametria cíclica (CV) foram obtidas em potenciostato/galvanostato AUTOLAB (PGSTAT 128N) conectado a um microcomputador controlado pelo programa GPES. As varreduras foram realizadas entre -0,2 e 1,0 V para o metanol e -0,2 e 1,4 V para o etanol (vs Ag/AgCl). A célula utilizada foi composta de três eletrodos: como referência Ag/AgCl (KCl (3,0 mol L-1)); fio de platina como contra-eletrodo; e carbono vítreo modificado com amostra como eletrodo de trabalho. A modificaçao foi realizada com a dispersao de 1 mg de amostra em 113 µL de isopropanol, 113 µL de água destilada e 12 µL de soluçao 0,5% de Nafion, em banho de ultrassom por 20 minutos. A seguir um volume conhecido (2 ou 6 µL) destas dispersoes foi depositado na superfície de um eletrodo de carbono vítreo com 3 mm de diâmetro, e seco à temperatura ambiente, até formar um filme. Como eletrólito utilizou-se 40 mL de uma soluçao 0,5 mol L-1 de H2SO4. Inicialmente, o eletrodo de trabalho foi pré-tratado realizando-se 50 ciclos de varredura a uma velocidade de 200 mV s-1 para estabilizaçao da corrente. Foram realizadas medidas de variaçao de velocidade entre 10 e 100 mV s-1, e com adiçao de 1,0 mol L-1 de metanol ou etanol.
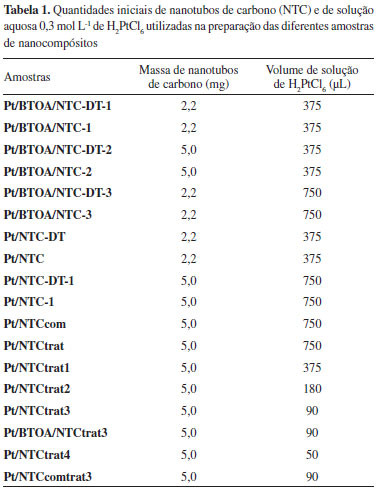
RESULTADOS E DISCUSSAO Caracterizaçao física O tratamento dos nanotubos de carbono com ácidos, realizado neste trabalho para a preparaçao de algumas amostras, leva à formaçao de grupos funcionais superficiais, principalmente carboxílicos e hidroxílicos.23 Na amostra de nanotubos de carbono preenchidos com espécies metálicas descrita aqui, resultados anteriores obtidos por XPS indicam 54% de grupamentos funcionais superficiais após o tratamento ácido, comparado com 28% presente na amostra original, anterior ao tratamento.23 O espectro Raman de materiais carbonáceos com hibridaçao sp2 possui três bandas características: a primeira chamada banda G, em aproximadamente 1580 cm-1, é atribuída ao modo de estiramento C=C em materiais de carbono com hibridaçao sp2. A posiçao e a intensidade dessa banda sao diretamente dependentes do grau de grafitizaçao da amostra, ou seja, com a perfeiçao na estrutura sp2 da amostra. Com o aumento do grau de grafitizaçao ela se torna mais estreita e se desloca para menores números de onda; a segunda, chamada banda D, em aproximadamente 1350 cm-1, é devido à presença de desordem estrutural na amostra, ou a modos relacionados a átomos na borda, sendo relacionada a tamanhos reduzidos da amostra. A razao entre as intensidades destas duas bandas, ID/IG, é um indicativo do grau de desordem da amostra; a terceira, chamada banda 2D (ou G'), ocorre em aproximadamente 2700 cm-1, e está relacionada à organizaçao estrutural no plano bidimensional de materiais grafíticos.24 A Figura 1S (material suplementar-MS) apresenta os espectros Raman (λ = 514,5 nm) das amostras de nanotubos de carbono e de alguns nanocompósitos. A presença das três bandas discutidas anteriormente pode ser detectada em todos os espectros, confirmando a ocorrência dos NTCs nos nanocompósitos. As relaçoes ID/IG foram calculadas e nao mostraram alteraçoes significativas dos valores após a incorporaçao da platina aos nanotubos. Os difratogramas de raios X dos nanotubos de carbono e de alguns nanocompósitos estao ilustrados na Figura 1.
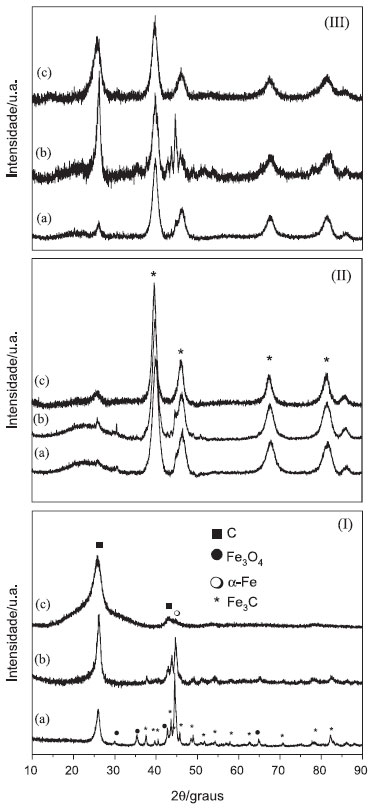 Figura 1. Difratogramas de raios X em (I) nanotubos de carbono (a) NTC, (b) NTCtrat, (c) NTCcomtrat, (II) nanocompósitos com nanotubos sem tratamento ácido (a) Pt/NTC-DT-1, (b) Pt/NTC-1, (c) Pt/NTCcom em (III) nanocompósitos com nanotubos com tratamento ácido (a) Pt/NTCtrat, (b) Pt/NTCtrat3 e (c) Pt/NTCcomtrat3
Na Figura 1(I) estao os difratogramas dos nanotubos de carbono utilizados neste trabalho. Nota-se, em todos os difratogramas, um pico em aproximadamente 2θ = 26 0, relativo à nanotubos de carbono de paredes múltiplas, equivalente à reflexao dos planos (002) do grafite.25,26 No difratograma do nanotubo nominado como NTC (Figura 1(Ia)), notam-se picos relativos à α-Fe, Fe3O4 e Fe3C, intrinsecamente presentes nas cavidades dos nanotubos de carbono, resultantes do método de preparaçao.22,27 Após o tratamento ácido (Figura 1(Ib)) a intensidade dos picos relativos a estas espécies de ferro diminui, em decorrência da sua remoçao por solubilizaçao. Nas Figuras 1(II) e 1(III) estao ilustrados os difratogramas de raios X de algumas amostras de nanocompósitos. Além de alguns dos picos dos NTCs já descritos, percebe-se, em todas as amostras, a presença dos picos característicos da platina metálica com estrutura cfc (marcados com * na Figura).28,29 Sabe-se que quanto maior a largura à meia altura dos picos, menor o tamanho do cristalito. Neste caso, nas Figuras 1(II) e 1(III), a largura dos picos é um forte indicativo do tamanho reduzido dos cristalitos de platina.30 O tamanho médio dos cristalitos de todas as amostras foi estimado pela equaçao de Scherrer, obtendo-se valores entre 6 a 14 nm. No comparativo entre as amostras, nota-se que as preparadas na presença do dodecanotiol têm tamanhos médios de cristalito menores que as amostras similares preparadas sem o passivante. Através de análise termogravimétrica é possível verificar a presença e a quantidade relativa dos diferentes materiais nas amostras. Os resultados estao apresentados na Figura 2S (MS), e sumarizados na Tabela 1S (MS). Os nanotubos têm significativa perda de massa em temperaturas acima de 400 ºC, relativa à oxidaçao do carbono a CO2. Diferenças na temperatura de início da decomposiçao estao relacionadas às porcentagens de funcionalizaçao da superfície das diferentes amostras, e atribuídas à decomposiçao de grupos carboxílicos ligados à parede grafítica, em amostras quimicamente tratadas. Quando se compara as temperaturas de oxidaçao dos NTCs, nota-se que os tratados têm o máximo de temperatura de decomposiçao superior aos NTCs sem tratamento. Os NTCs se decompoem em 444 ºC, os NTCtrat em aproximadamente 560 ºC e os NTCcom em 552 ºC e após o tratamento em 574 ºC. Este aumento na temperatura se deve à remoçao de outras formas de carbono que sao mais instáveis.23 Avaliando a porcentagem de resíduos (oxidaçao das espécies de ferro) remanescentes da análise termogravimétrica, a remoçao de espécies metálicas pelo tratamento ácido, indicado por DRX, foi confirmada por TGA, pela significativa diminuiçao dos resíduos de 43% para 14% após o tratamento. Para o NTCcom o resíduo de aproximadamente 18% antes do tratamento (devido à presença de resíduos do catalisador), é praticamente zero após o tratamento. Nos nanocompósitos, o início da decomposiçao dos nanotubos ocorre em temperaturas mais baixas que os nanotubos "puros", devido à presença da platina na superfície das amostras, pois a presença de defeitos e metais facilita a oxidaçao dos materiais de carbono.31-33 Com relaçao à quantidade de platina remanescente, nao há um padrao de comportamento entre as diferentes amostras preparadas a partir dos nanotubos sem tratamento ácido (Tabela 1S). Este comportamento é esperado, uma vez que apesar de partir da mesma proporçao inicial de NTC/[PtCl6]2-, a presença (ou nao) de BTOA e DT acarreta em diferentes caminhos de reaçao, levando a amostras diferentes. Além disso, sao amostras contendo espécies diferentes, que também se decompoe durante o processo de aquecimento. Nos nanocompósitos preparados com nanotubos de carbono tratados com ácido, nota-se comportamento mais linear, pois à medida que se diminuiu a quantidade de precursor de Pt inicialmente disponível na síntese das amostras, as mesmas mostraram uma diminuiçao no percentual final de platina. A Figura 2 apresenta imagens selecionadas e representativas de microscopia eletrônica de transmissao de algumas amostras dos nanocompósitos. Para estas medidas foram utilizadas amostras dos nanocompósitos Pt/BTOA/NTC-DT-1, Pt/BTOA/NTC-1, Pt/NTC-DT, Pt/NTC, Pt/NTC-DT-1, Pt/NTC-1, Pt/NTCtrat, Pt/NTCtrat3 e Pt/BTOA/NTCtrat3, pois as mesmas contemplam todas as possibilidades de síntese, como a presença de agente transferidor de fase (BTOA) e agente passivante (DT) e ausência de um ou ambos nas amostras, além das variaçoes nas quantidades de NTC e Pt utilizadas durante as sínteses.
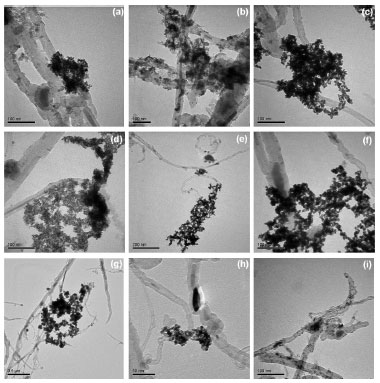 Figura 2. Imagens MET (a) Pt/BTOA/NTC-DT-1, (b) Pt/BTOA/NTC-1, (c) Pt/NTC-DT, (d) Pt/NTC, (e) Pt/NTC-DT-1, (f) Pt/NTC-1, (g) Pt/NTCtrat, (h) Pt/NTCtrat3 e (i) Pt/BTOA/NTCtrat3
Comparativamente, nota-se que todas as amostras sao formadas por nanopartículas de platina em pequenos aglomerados, distribuídos de forma heterogênea sobre as paredes dos nanotubos de carbono. Nota-se também que a distribuiçao das nanopartículas sobre os nanotubos, assim como o grau de aglomeraçao das mesmas, varia ligeiramente entre as amostras, com o nanocompósito Pt/NTC-1 (Figura 2f) apresentando uma maior homogeneidade. O nanocompósito Pt/BTOA/NTCtrat3 (Figura 2i) foi o obtido com menor tamanho e menor aglomeraçao das nanopartículas de platina, decorando as paredes dos nanotubos de forma mais homogênea, o que indica a influência da presença do BTOA no controle do tamanho e aglomeraçao das nanopartículas, provavelmente devido à sua atuaçao como passivante das mesmas. Caracterizaçao eletroquímica Para todos os eletrodos preparados, foram inicialmente realizados 50 ciclos de varredura a 200 mV s-1 entre - 0,2 e 1,0 V (vs Ag/AgCl, KCl 3,0 mol L-1) para estabilizaçao da corrente. A área superficial ativa dos eletrodos foi estimada por voltametria cíclica, através do coeficiente angular obtido na presença de 20 mmol L-1 de [Fe(CN)6]3-/4- em 0,2 mol L-1 de KCl vs Ag/AgCl com velocidades de varredura entre 2 e 10 mV s-1 através da equaçao de Randles-Sevcik:34,35
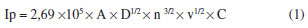
onde A é a área ativa (cm2), D é o coeficiente de difusao da molécula em soluçao (7,60 +/- 0,02 cm2 s-1), n é o número de elétrons transferidos no processo Fe3+/Fe2+, v é a velocidade de varredura (V s-1) e C a concentraçao da molécula em soluçao (mol cm-3). Os valores calculados foram, 4,1 × 10-2 cm2 para GC, 6,4 × 10-2 cm2 para NTC e 5,2 × 10-2 cm2 para NTCtrat. As densidades de corrente destas medidas foram calculadas com base na área ativa do eletrodo de carbono vítreo modificado com as amostras. Como as medidas de oxidaçao do metanol pelos materiais produzidos neste trabalho foram realizadas através de modificaçoes em eletrodos de carbono vítreo, medidas de voltametria cíclica (VC) visando experimento de controle foram realizadas com o eletrodo de carbono vítreo sem modificaçao e modificado somente com os NTCs. Os resultados destas medidas sao mostrados na Figura 3S (MS), realizadas em soluçao aquosa 0,5 mol L-1 de H2SO4 e em soluçao aquosa 1,0 mol L-1 de metanol. Para o carbono vítreo nota-se, em ambos os casos, o mesmo perfil voltamétrico, sem nenhuma evidência de oxidaçao do metanol. Os voltamogramas dos eletrodos modificados com nanotubos de carbono sem tratamento ácido (Figura 3S(II)) apresentam um comportamento capacitivo de dupla camada típico, com um par redox de picos largos entre 0,2 e 0,4 V atribuídos à oxidaçao/reduçao de grupos funcionais COOH, -OH e -C=O da superfície dos nanotubos.3,36,37 Quando se realiza a medida com adiçao de metanol, nota-se a presença de um pico em cerca de 0,64 V para varredura no sentido direto, atribuído à oxidaçao do metanol, e outro pouco evidente em 0,55 V no sentido reverso, atribuído à oxidaçao das espécies intermediárias, indicando que somente os nanotubos, preenchidos com espécies de ferro, apresentam uma ligeira atividade para oxidaçao do metanol. No caso dos eletrodos modificados com nanotubos após o tratamento ácido, este efeito nao foi observado (Figura 3S(III)). Os resultados observados pelas medidas de voltametria cíclica utilizando todos os nanocompósitos apresentaram um mesmo padrao de comportamento, que será ilustrado e discutido em detalhe para a amostra Pt/NTC-1. As medidas de voltametria cíclica realizadas com o eletrodo modificado com o nanocompósito Pt/NTC-1, na ausência e na presença de metanol e etanol (1,0 mol L-1), estao apresentadas na Figura 3. Através destas foi possível calcular a área ativa do catalisador (isto é, a área superficial disponível para a reaçao eletroquímica), determinada nas amostras pela regiao de adsorçao/dessorçao de hidrogênio na velocidade de 50 mV s-1, considerando que neste caso ocorre a adsorçao de monocamada de hidrogênio sobre a platina de 210 µC cm-2.38 O cálculo da área ativa é efetuado através da seguinte relaçao:39
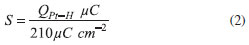
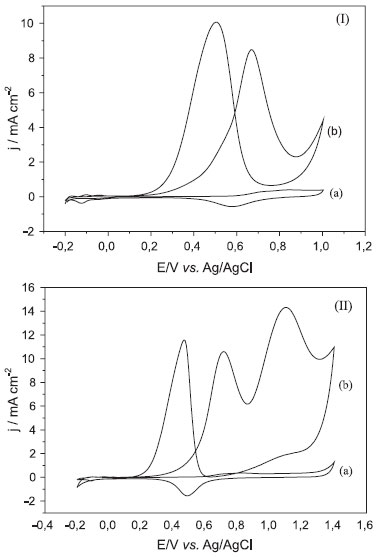 Figura 3. Voltamogramas cíclicos do eletrodo de GC modificado com dispersao do nanocompósito Pt/NTC-1: (I) (a) 0,5 mol L-1 H2SO4, (b) 0,5 mol.L-1 H2SO4 + 1,0 mol L-1 CH3OH; (II) (a) 0,5 mol L-1 H2SO4 , (b) 0,5 mol L-1 H2SO4 + 1,0 mol L-1 CH3CH2OH. Com velocidade de varredura de 50 mV s−1 vs Ag/AgCl
sendo QPt-H = a carga, obtida pela integral de pico da regiao de adsorçao/dessorçao de hidrogênio. As medidas de oxidaçao de metanol na Figura 3(Ib) apresentam um perfil bem conhecido, com dois picos. O primeiro entre 0,6 e 0,9 V no sentido direto corresponde à adsorçao e oxidaçao do metanol, tendo como consequência deste processo a formaçao das espécies intermediárias (CO, HCOOH, HCOH e HCOOCH3). O CO pode ser reabsorvido e causar o envenenamento da superfície durante o processo.15 O pico entre 0,8 e 0,3 V no sentido reverso é atribuído à oxidaçao destas espécies intermediárias formadas no primeiro processo.1 A densidade de corrente determinada na concentraçao de 1,0 mol L-1 de metanol é de 8,4 mA cm-2. Este valor é o maior determinado dentre todos os compósitos sintetizados neste trabalho com os NTCs sem tratamento ácido. A relaçao entre as intensidades da corrente do pico no sentido direto (If) e da corrente de pico no sentido reverso (Ib) possibilita informaçoes relevantes sobre o processo: quanto maior esta relaçao (If/Ib) maior a tolerância do catalisador ao acúmulo e envenenamento por espécies carbonáceas, e consequentemente melhor oxidaçao do metanol para CO2.5,40 O valor determinado para esta amostra foi de 0,84 na concentraçao 1,0 mol L-1. No caso da oxidaçao do etanol, Figura 3(IIb), o voltamograma mostra a existência de três picos. O primeiro, com valores variando entre 0,8 e 0,9 V no sentido direto de varredura, é atribuído à adsorçao de OH e oxidaçao do etanol.1,41 A formaçao das espécies OH tem grande importância na formaçao de CO2, pela quebra das ligaçoes C-C, via CO fortemente adsorvido na superfície da Pt e de outras espécies intermediárias fracamente ligadas; o segundo pico, também no sentido direto e com valores variando entre 1,1 e 1,4 V, é atribuído à formaçao de CO2 e ácido acético (e em concentraçoes superiores a 0,2 mol L-1 de etanol, à formaçao concomitante de aldeído acético). O terceiro pico, com valores variando entre 0,6 e 0,5 V no sentido reverso, é atribuído à oxidaçao dos intermediários.41 Nas nossas amostras estes picos sao muito agudos, indicando uma cinética com velocidade elevada.16,42 As densidades de corrente para os picos 1 e 2 no sentido direto da varredura sao de 10,7 e 14,5 mA cm-2, valores baixos quando se compara com a literatura. As densidades de corrente desta amostra, tanto para metanol quanto etanol, sao as maiores entre os nanocompósitos produzidos neste trabalho, com NTCs nao tratados depositados sobre o eletrodo de carbono vítreo. Estes resultados foram atribuídos a uma ótima relaçao entre diâmetro médio dos cristalitos de platina (11 nm) e quantidade da mesma incorporada (53%) na amostra, e ao mesmo tempo (conforme observado por MET) os aglomerados sao menores em comparaçao com os demais nanocompósitos e estao distribuídos de forma mais homogênea ao longo da amostra. Resultados obtidos com eletrodos modificados com as outras amostras estao ilustrados no material suplementar (Figuras 4S e 5S). Para analisar os nanocompósitos preparados com os nanotubos de carbono tratados, na sequência foram preparados eletrodos modificados dos mesmos. A Figura 6S (MS) mostra os resultados das medidas de voltametria cíclica do eletrodo modificado com o nanocompósito PtNTCtrat, amostra que corresponde diretamente à amostra PtNTC-1 discutida anteriormente. Os perfis das medidas sao iguais aos obtidos para os nanocompósitos com os NTCs nao tratados. No entanto, as densidades de corrente sao muito superiores. Para a oxidaçao de metanol na concentraçao de 1,0 mol L-1, a densidade de corrente é de 14,7 mA cm-2. Este valor é 74% maior que do PtNTC-1 (8,4 mA cm-2) e a relaçao If/Ib de 0,89. Para o etanol os valores foram de 13,2 mA cm-2 para o primeiro pico e 20,2 mA cm-2 para o segundo. Uma amostra de Pt/C comercial (Aldrich) também foi utilizada na oxidaçao dos álcoois e os resultados determinados foram de 1,5 mA cm-2 para o metanol e 2,8 e 6,2 mA cm-2 para o primeiro e segundo pico do etanol (Figura 7S). Estes resultados sao inferiores aos obtidos para os nanocompósitos sintetizados neste trabalho. Os resultados de voltametria cíclica, obtidos a partir dos eletrodos modificados com todas as amostras de nanocompósitos produzidos com os nanotubos tratados indicaram que, dentro da faixa estudada, as intensidades de corrente aumentaram com a diminuiçao da quantidade de platina incorporada. A melhor amostra deste conjunto foi a PtNTCtrat3, cujos resultados de voltametria cíclica (Figura 4) apresentaram densidades de corrente de 56,1 mA cm-2 para o metanol e 79,8 e 104,7 mA cm-2 para o primeiro e segundo pico do etanol, respectivamente.
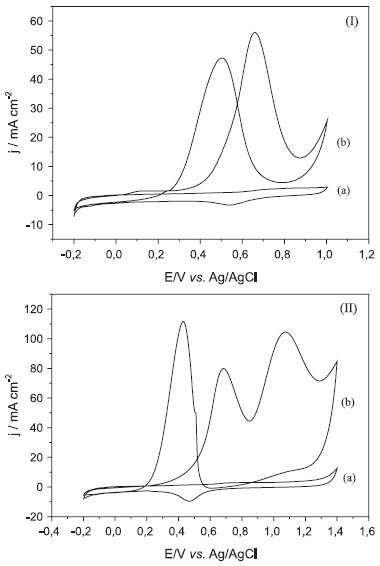 Figura 4. Voltamogramas cíclicos do eletrodo de GC modificado com dispersao do nanocompósito Pt/NTCtrat3: (I) (a) 0,5 mol L-1 H2SO4 , (b) 0,5 mol L-1 H2SO4 + 1,0 mol L-1 CH3OH; (II) (a) 0,5 mol L-1 H2SO4 , (b) 0,5 mol L-1 H2SO4 + 1,0 mol L-1 CH3CH2OH. Com velocidade de varredura de 50 mV s−1 vs Ag/AgCl
A melhora significativa nas respostas eletroquímicas dos nanocompósitos preparados com nanotubos de carbono tratados com ácido, em relaçao aos preparados com nanotubos nao tratados, foi atribuída à presença dos grupos funcionais (carboxila, hidroxila) na superfície dos nanotubos, que aumentam o número de defeitos na amostra e as tornam mais reativas. Além disso, os grupos funcionais podem fornecer os oxigênios necessários à oxidaçao do CO adsorvido nos sítios ativos da platina e, desta forma, diminuir o envenenamento destes sítios através de um mecanismo bifuncional semelhante ao que seria produzido por um segundo metal na amostra (Ru, por exemplo). Este processo pode ser descrito pela equaçao 3.43,44
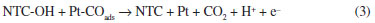
Nanotubos de carbono contendo defeitos gerados pelos grupos funcionais têm alta reatividade e facilidade de oxidaçao a baixos potenciais. Durante medidas de voltametria cíclica os grupos contendo oxigênio fornecem defeitos continuamente aos NTCs para suprir os que estao sendo consumidos.43,44 Estas conclusoes sao corroboradas pelas relaçoes If/Ib maiores nos compósitos produzidos com nanotubos de carbono com tratamento ácido, além dos menores potenciais em que ocorre a oxidaçao. Estas duas observaçoes experimentais demonstram que estas amostras têm maior atividade catalítica com menor envenenamento dos sítios ativos. Estudos complementares precisam ser realizados futuramente, para avaliaçao mais detalhada deste comportamento. Entretanto, Halder et al.44 apresentam resultados de medidas de XPS do nanocompósito (Pt/NTC) utilizado em seu trabalho e relatam que mesmo após 200 ciclos de varredura realizadas por voltametria cíclica, nao encontraram alteraçoes na estrutura metálica da Pt, confirmando a sua estabilidade e a manutençao da sua atividade catalítica. Chen et al.43 também relatam que o catalisador produzido com nanotubos submetidos ao tratamento ácido manteve, após 500 ciclos de varredura, 95,2% da atividade referente ao primeiro ciclo. Medidas de stripping de CO foram realizadas para as amostras Pt/C, Pt/NTC-1 e Pt/NTCtrat em soluçao 0,5 mol L-1 de H2SO4 com velocidade de varredura de 30 mV s-1 e os potenciais de pico encontrados foram de 0,60 V, 0,50 V e 0,57 V, respectivamente (Figura 8S). Potenciais mais baixos para os nanocompósitos Pt/NTC-1 e Pt/NTCtrat indicam que os mesmos sao mais eficientes na oxidaçao do CO adsorvido. Para efeitos de comparaçao, a Figura 5 ilustra a variaçao na densidade de corrente (Figura 5I) e no potencial (Figura 5II) em funçao da concentraçao de metanol, para os eletrodos modificados com dois nanocompósitos preparados de forma equivalente, a partir de nanotubos nao tratados (Pt/NTC-1) e tratados (Pt/NTCtrat). Nota-se que para o nanocompósito Pt/NTCtrat os valores de densidade de corrente (Figura 5a) sao maiores e os potenciais de oxidaçao (Figura 5b) sao menores comparado ao nanocompósito Pt/NTC-1, indicando que a cinética de adsorçao e oxidaçao do metanol no nanocompósito preparado com nanotubos tratado é mais eficiente.
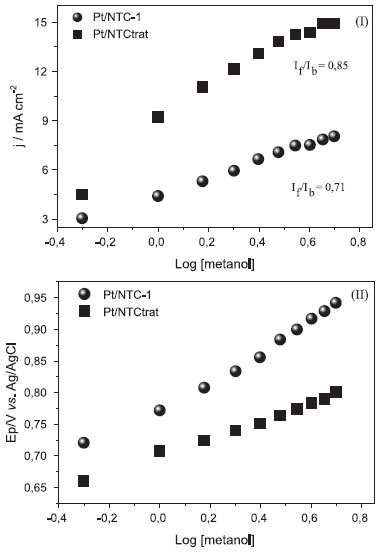 Figura 5. (I) Densidade de corrente vs log concentraçao de metanol e em (II) potencial vs log da concentraçao de metanol entre 0,5 - 5,0 mol L-1 para medidas realizadas com eletrodo de GC modificado com dispersoes dos nanocompósitos Pt/NTC-1 e Pt/NTCtrat em H2SO4 0,5 mol L-1 vs Ag/AgCl
O efeito do tipo de nanotubo de carbono nas respostas voltamétricas foi também estudado. Para isso, preparou-se um nanocompósito exatamente nas mesmas condiçoes da amostra Pt/NTCtrat3, utilizando-se um nanotubo de carbono comercial, com características similares aos utilizados neste trabalho (multi-paredes, diâmetros e comprimentos médios similares), mas sem o preenchimento com espécies de ferro. Os resultados comparativos estao na Figura 9S (MS). Observou-se que o nanocompósito preparado com os nanotubos sintetizados com espécies de ferro nas suas cavidades apresentou uma resposta bem superior ao similar utilizando-se nanotubos comerciais, com valores de densidade de corrente na ordem de 115% maior para o metanol e 120% para o etanol. Além do efeito sinergístico devido à presença das espécies metálicas, diferenças estruturais na superfície dos nanotubos e as diferenças nas quantidades de grupos funcionais presentes em cada amostra podem justificar estas diferenças, que merecem uma investigaçao mais detalhada.
CONCLUSAO A formaçao de nanocompósitos entre nanopartículas de platina sintetizadas in situ e nanotubos de carbono, em um sistema bifásico, foi descrita com sucesso. As nanopartículas de platina apresentaram-se com diâmetros médios entre 6 e 14 nm, em pequenos aglomerados dispersos sobre as paredes dos nanotubos. As amostras foram testadas com sucesso como catalisadores para eletro-oxidaçao de álcoois, e as relaçoes entre as amostras e os resultados foram discutidos. Especificamente, nanocompósitos preparados com nanotubos de carbono previamente submetidos a tratamentos ácidos se mostraram os melhores eletrocatalisadores, provavelmente devido à presença dos grupos funcionais que auxiliam na diminuiçao do envenenamento dos sítios da platina.
MATERIAL SUPLEMENTAR Várias técnicas de caracterizaçao dos sistemas utilizados neste trabalho estao disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Agradecemos o apoio financeiro do CNPq, CAPES, NENNAM (Pronex, Fundaçao Araucária/CNPq), INCT de nanomateriais de carbono, ao CME-UFPR e à Prof. M. M. Oliveira, pelas imagens de MET.
REFERENCIAS 1. Bommersbach, P.; Mohamedi, M.; Guay, D.; J. Electrochem. Soc. 2007, 154. B876. 2. Jafri, R. I.; Ramaprabhu, S.; Int. J. Hydrogen Energy. 2010, 35, 1339. 3. He, Z.; Chen, J.; Liu, D.; Tang, H.; Deng, W.; Mater. Chem. Phys. 2004, 85, 396. 4. Camara, G. A.; de Lima, R. B.; Iwasita, T.; Electrochem. Commun. 2004, 6, 812. 5. Chen, L.; Lu, G.; Electrochim. Acta. 2008, 53, 4316. 6. Bergamaski, K.; Pinheiro, A. L. N.; Teixeira-Neto, E.; Nart, F. C.; J. Phys. Chem. B 2006, 110, 19271. 7. Jia, R.-L.; Wang, C.-Y.; React. Kinet. Catal. Lett. 2006, 88, 51. 8. Lin, Y.; Cui, X.; Yen, C.; Wai, C. M.; J. Phys. Chem. B 2005, 109, 14410. 9. Liu, Z.; Gan, L. M.; Hong, L.; Chen, W.; Lee, J. Y.; J. Power Sources 2005, 139, 73. 10. Xie, J.; Wang, S.; Aryasomayajula, L.; Varadan, V. K.; Nanotechnology 2007, 18, 065503. 11. Shang, N.; Papakonstantinou, P.; Wang, P.; Silva, S. R. P.; J. Phys. Chem. C 2010, 114, 15837. 12. Seger, B.; Kamat, P. V.; J. Phys. Chem. C 2009, 113, 7990. 13. Anantram, M. P.; Léonard, F.; Rep. Prog. Phys. 2006, 69, 507. 14. Zarbin, A. J. G.; Quim. Nova 2007, 30, 1469. 15. Freitas, R. G.; Santos, M. C.; Oliveira, R. T. S.; Bulhoes, L. O. S.; Pereira, E. C.; J. Power Sources 2006, 158, 164. 16. Lemos, S. G.; Oliveira, R. T. S.; Santos, M. C.; Nascente, P. A. P.; Bulhoes, L. O. S.; Pereira, E. C.; J. Power Sources 2007, 163, 695. 17. Park, I.-S.; Lee, K.-S.; Cho, Y.-H.; Park, H.-Y.; Sung, Y.-E.; Catal. Today 2008, 132, 127. 18. Mu, Y. L. H.; Hu, J.; Jiang, L.; Wan , L.; J. Phys. Chem. B 2005, 109, 22212. 19. Tian, Z. Q.; Jiang, S. P.; Liang, Y. M.; Shen, P. K.; J. Phys. Chem. B 2006, 110, 5343. 20. March, G.; Volatron, F.; Lachaud, F.; Cheng, X.; Baret, B.; Pinault, M.; Etcheberry, A.; Perez, H.; Electrochim. Acta 2011, 56, 5151. 21. Lin, J. F.; Kamavaram, V.; Kannan, A. M.; J. Power Sources 2010, 195, 466. 22. Schnitzler, M. C.; Oliveira, M. M.; Ugarte, D.; Zarbin, A. J.; Chem. Phys. Lett. 2003, 381, 541. 23. Moraes, R. A.; Matos, C. F.; Castro, E. G.; Schreiner, W. H.; Oliveira, M. M.; Zarbin, A. J. G.; J. Braz. Chem. Soc. 2011, 22, 2191. 24. Costa, S.; Borowiak-Palen, E.; Kruszyñska, M.; Bachmatiuk, A.; Kalenczuk, R. J.; Materials Science-Poland. 2008, 26, 433. 25. Cao, A.; Xu, C.; Liang, J.; Wu, D.; Wei, B.; Chem. Phys. Lett. 2001, 344, 13. 26. Li, W.; Liang, C.; Zhou, W.; Qiu, J.; Zhou, Z.; Sun, G.; Xin, Q.; J. Phys. Chem. B 2003, 107, 6292. 27. Nossol, E.; Zarbin, A. J. G.; J. Mater. Chem. 2012, 22, 1824. 28. Neto, A. O.; Vasconcelos T. R. R.; Da Silva, R. W. R. V.; Linardi, M.; Spinacé, E. V.; J. Appl. Electrochem. 2005, 35, 193. 29. Neto, A. O.; Dias, R. R.; Tusi, M. M.; Linardi, M.; Spinacé, E. V.: J. Power Sources 2007, 166, 87. 30. Castro, E. G.; Salvatierra, R. V.; Schreiner, W. H.; Oliveira, M. M.; Zarbin, A. J. G.; Chem. Mater. 2009, 22, 360. 31. Bom, D.; Andrews, R.; Jacques, D.; Anthony, J.; Chen, B.; Meier, M. S.; Selegue, J. P.; Nano Lett. 2002, 2, 615. 32. Serp, P.; Corrias, M.; Kalck, P.; Appl. Catal., A 2003, 253, 337. 33. McKee, G. S. B.; Vecchio, K. S.; J. Phys. Chem. B 2005, 110, 1179. 34. Majdi, S.; Jabbari, A.; Heli, H.; Yadegari, H.; Moosavi-Movahedi, A. A.; Haghgoo, S.; J. Solid State Electrochem. 2009, 13, 407. 35. Hrapovic, S.; Liu, Y.; Male, K. B.; Luong, J. H. T.; Anal. Chem. 2003, 76, 1083. 36. Kim, J. H.; Nam, K.-W.; Ma, S. B.; Kim, K. B.; Carbon 2006, 44, 1963. 37. Barisci, J. N.; Wallace, G. G.; Baughman, R. H.; J. Electrochem. Soc. 2000, 147, 4580. 38. Villers, D.; Sun, S. H.; Serventi, A. M.; Dodelet, J. P.; Désilets, S.; J. Phys. Chem. B 2006, 110, 25916. 39. Khan, A. S. A. A., R.; Mirza, M. L.; J. Chem. Soc. Pak. 2008, 30, 810. 40. Abida, B.; Chirchi, L.; Baranton, S.; Napporn, T. W.; Kochkar, H.; Léger, J.-M.; Ghorbel, A.; Appl. Catal., B. 2011, 106, 609. 41. Gao, G.; Yang, G.; Xu, M.; Wang, C.; Xu, C.; Li, H.; J. Power Sources 2007, 173, 178. 42. Chen, S.; Schell, M.; J. Electroanal. Chem. 1999, 478, 108. 43. Chen, J.; Wang, M.; Liu, B.; Fan, Z.; Cui, K.; Kuang, Y.; J. Phys. Chem. B 2006, 110, 11775. 44. Halder, A.; Sharma, S.; Hegde, M. S.; Ravishankar, N.; J. Phys. Chem. C 2009, 113, 1466. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





