Nota Técnica
|
|
| Medição e interpretação de valores do potencial redox (EH) em matrizes ambientais Measurement and interpretation of redox potential values (EH) in environmental matrices |
|
Wilson F. Jardim*
Instituto de Química, Universidade Estadual de Campinas, Campinas - SP, Brasil Recebido em 30/01/2014 *e-mail: wfjardim@iqm.unicamp.br Direct measurements of Redox Potential (ORP) have been used to infer the degree of electrons availability in waters, wastewaters, sediments and soils. Although the interpretation of the results obtained in direct measurements is not trivial, this parameter is part of a list of compulsory determinations required by many Environmental State Agencies as well as consulting companies. Nonetheless, the vast majority of EH reported values are not corrected to the reference electrode used, what makes most of the data incomparable with the literature, and not suitable for a correct environmental diagnostics. INTRODUÇÃO Medidas de potencial redox podem ser utilizadas basicamente de duas maneiras. Em titulações, onde um eletrodo inerte (platina, por exemplo) juntamente com um eletrodo de referência são usados para monitorar a variação do potencial durante uma titulação de redução-oxidação (Fe2+ com Cr2O7= é um exemplo típico), num procedimento rápido, confiável, robusto e de baixo custo. Neste caso a variação do potencial na vizinhança do ponto de equivalência muda tão rápido e numa magnitude tal que a resposta do eletrodo é satisfatória para atender a precisão desejada, pois são medidas relativas. Medidas diretas (absolutas) de potencial redox em matrizes ambientais tais como águas, efluentes, sedimentos e solos começaram a ser utilizadas no início do século passado, mas foi a partir do estudo detalhado feito em 1960 por Baas-Becking et al. que este parâmetro passou a ser determinado rotineiramente nos estudos geoquímicos, limnológicos e da química aquática.1 Muitas reações de importância na natureza envolvem tanto elétrons como prótons, o que faz com que sejam governadas tanto pelo pH como pelo EH. Dependendo destas duas variáveis, ferro, manganês, carbono, nitrogênio e enxofre, dentre outros elementos, podem alterar drasticamente sua mobilidade e, em alguns casos, a toxicidade num dado compartimento ambiental. Por exemplo, o enxofre pode estar presente como o íon sulfato de mobilidade reduzida num ambiente óxido, e alterar sua mobilidade e toxicidade quando este mesmo ambiente passar para uma condição anóxida, na qual o sulfato poderá ser reduzido a sulfeto e eventualmente ao gás sulfídrico. O mesmo pode ser aplicado para nitrato e amônia, para os quais o número de oxidação do nitrogênio pode variar entre +5 e -3. Embora para muitos as medidas de EH possam ser usadas para fazer previsões e diagnósticos quanto à oferta ou deficiência de elétrons num dado meio, e consequentemente estabelecer espécies químicas predominantes, os dados de potencial redox precisam ser analisados com cautela, uma vez que nem sempre a cinética permite que as condições de equilíbrio termodinâmico sejam estabelecidas em ambientes complexos e que se alteram constantemente, como é o caso de sistemas aquáticos naturais. Nas reações redox, o potencial elétrico está associado com cada uma das semirreações de redução e de oxidação (para revisar os conceitos básicos veja Mahan e Meyers), e o potencial medido é aquele obtido no equilíbrio de todos os pares redox ativos presentes numa dada amostra.2 No entanto, para o caso de águas naturais ou sedimento, sabe-se que este equilíbrio dificilmente é atingido, e os valores do potencial são influenciados pelos pares que estão em concentrações mais elevadas. Discrepâncias observadas entre valores de EH medidos em águas subterrâneas e valores teóricos esperados estão bem documentados.3
MEDINDO EH Medidas eletrométricas de potencial redox são feitas de modo similar às medidas de pH, utilizando um voltímetro de alta impedância (pHmetro comercial), um eletrodo de trabalho e o eletrodo de referência (ou um eletrodo combinado). Esta similaridade com as medidas de pH faz com que muitos dos dados obtidos para o potencial redox não sejam devidamente corrigidos devido ao tipo de eletrodo de referência usado. Para maiores detalhes do procedimento em campo, vide ASTM D 1498.4 O potencial redox é dado por:

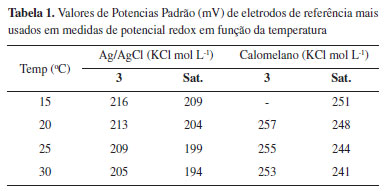
sendo EH o potencial redox (em mV) da amostra e que deve ser reportado em relação ao eletrodo padrão de hidrogênio (EPH), Emedido o potencial lido no instrumento (e quase sempre reportado incorretamente como resultado final) e Eref o potencial referente ao eletrodo de referência, quase sempre um eletrodo de Ag/AgCl ou calomelano, tendo em vista a falta de praticidade de se trabalhar com o eletrodo de hidrogênio. Eletrodos usados nas medidas de ORP quase sempre são comercializados na forma combinada (como eletrodos de pH), e assim sendo, o eletrodo de referencia está no mesmo corpo do eletrodo de trabalho, quase sempre de platina. É importante salientar que o potencial lido em campo (Emedido) poderá ser reportado sem correções somente se for fornecido o tipo de eletrodo de referência, sua solução interna, o pH e a temperatura. Mesmo assim, não pode ser denominado de EH. A Tabela 1 traz alguns valores de potenciais padrão de redução dos eletrodos de referência mais comumente usados nas medidas de EH.
Para verificar o bom funcionamento dos eletrodos e do equipamento, há soluções que facilmente podem ser feitas no laboratório e que são usadas como "tampões" de redox, muito embora questiona-se se estas seriam tampões verdadeiros. Assim usa-se o termo "soluções de referência". As soluções mais conhecidas são as de Light e as de ZoBell, as quais são usadas para verificar a resposta dos eletrodos e do equipamento antes e depois das medidas em campo, uma vez que as leituras de potencial são muito influenciadas pela integridade do eletrodo de platina.5,6 Recomenda-se sempre o polimento da superfície do eletrodo com uma material de baixa abrasão, mas suficiente para remover finas camadas de óxido que possam se formar na superfície da platina. Também a solução interna do eletrodo de referência deve ser trocada com frequência. A influência do tratamento do eletrodo de trabalho nos valores de potencial foi discutida em detalhes por Teasdale et al.7
SOLUÇÕES DE REFERÊNCIA PARA VERIFICAÇÃO DO POTENCIAL REDOX A solução de Light é feita tomando-se 39,21 g de sulfato ferroso amoniacal (Fe(NH4)2(SO4)2.6H2O) e 48,22 g de sulfato férrico amoniacal (Fe(NH4)(SO4)2.12H2O) com pureza de pelo menos 99% e dissolvendo em aproximadamente 600 mL de água. A esta solução adicionam-se 56,2 mL de ácido sulfúrico concentrado e o volume é ajustado para 1 L. Esta solução é bastante estável se mantida bem fechada em refrigerador e recomenda-se que porções de volumes menores sejam usadas para verificações periódicas e depois descartadas. A solução de ZoBell é feita tomando-se 1,408 g de ferrocianeto de potássio (K4Fe(CN)6·3H2O), 1,098 g de ferricianeto de potássio (K3Fe(CN)6) e 7,456 g de cloreto de potássio e dissolvendo em 1 L de água. A solução é estável por muitos meses se mantida bem fechada e refrigerada, e deve ser utilizada em volumes suficientes para cada aferição. Tendo qualquer uma destas soluções, o aparato de medição de potencial redox pode ser testado. A Tabela 2 traz os valores de potencial que deve ser obtido quando se usa a solução de Light com diversos eletrodos de referência a 25 ºC, enquanto que a Tabela 3 mostra os valores esperados quando se utiliza a solução de ZoBell, a qual foi estudada em detalhes por Nordstrom.8


Caso os valores lidos mostrem uma discrepância superior a 10 mV dos valores tabelados, é necessária a limpeza dos eletrodos. Se esta diferença permanecer, recomenda-se que a diferença entre o valor lido e o valor esperado seja anotada e corrigida nas leituras feitas em campo, e nunca ajustar no potenciômetro. Outro aspecto importante é o tempo de resposta do eletrodo. Os pares redox que mais contribuem para o potencial são aqueles que estão numa concentração acima de 10-5 mol L-1, sendo que em muitas amostras o tempo de resposta é superior a 15 min. Recomenda-se anotar o valor do potencial quando o mesmo oscilar em não mais do que 5 mV. Deve-se ter em mente que o uso destas soluções de referência não dispensa a correção final do valor lido, pois de acordo com a equação (1), o potencial lido é o termo Emedido e não EH. Também é importante frisar que, como já realçado, se para uma amostra de água subterrânea ou sedimento for fornecido o valor de Emedido bem como o tipo de eletrodo de referência utilizado, além da temperatura e do pH, pode-se obter o valor de potencial redox com respeito ao eletrodo padrão de hidrogênio. No entanto, o uso de EH justamente foi proposto para se evitar este tipo de inconsistências e dúvidas, já que o mesmo dispensa qualquer ajuste ou correção adicional, além de permitir a comparação de valores obtidos em qualquer condição experimental.
EXEMPLO ILUSTRATIVO Suponha que na medição do potencial redox da água de torneira obtida da rede de abastecimento, e usando um eletrodo combinado de platina com um eletrodo de referência Ag/AgCl (KCl saturado), primeiramente o valor de potencial lido na solução de Light foi + 471 mV, sendo que o mesmo estabilizou após 20 min em ± 4 mV em torno deste valor. Tomando-se estas flutuações como aceitáveis (25±2) ºC nesta avaliação preliminar do eletrodo, o potencial medido na água de torneira foi igual a 324 mV. O potencial em amostras com baixa força iônica como água de abastecimento muitas vezes demanda mais do que 30 min para estabilizar. Utilizando a equação 1 para expressar o valor de EH desta amostra, tem-se: EH = Emedido + Eref
EH = 324 + 199 = 523 mV Sendo que o valor 199 mV foi extraído da Tabela 3. Para maiores detalhes sobre este procedimento pode-se consultar o Manual Nacional de Campo Para Coleta de Águas do USGS, disponível na internet.9
INTERPRETANDO VALORES DE EH E DIAGRAMAS EH X PH Para interpretar adequadamente os valores de potencial redox obtidos para uma determinada amostra, deve-se considerar primeiramente as condições de contorno impostas pela termodinâmica. Os diagramas EH x pH são construídos tendo como limite superior a oxidação da água (equação 2,3 e 4), enquanto que o limite inferior trata da redução da água (equação 5 e 6). Usando a faixa de pH que se estende de 0 até 14, o diagrama, a 25 ºC, toma a forma mostrada na Figura 1.10 Valores positivos de EH indicam condições oxidantes, enquanto que valores negativos indicam disponibilidade de elétrons, ou condições redutoras. A semirreação de oxidação da água, que impõe o limite de estabilidade superior do diagrama, é dada por:

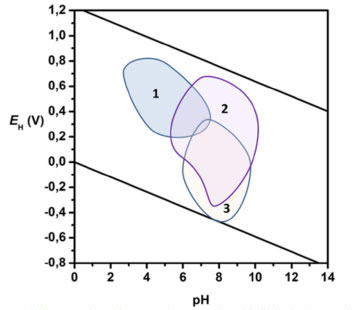 Figura 1. Diagrama EH x pH mostrando a área de estabilidade da água, tendo na parte superior a linha que delimita a sua oxidação e na parte inferior o limite da sua redução. Áreas de predominância obtidas para água de chuva (1), rios e lagos (2) e águas subterrâneas (3) são mostradas para exemplificar
Que resulta na equação de Nernst:
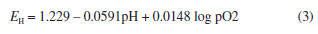
e assumindo-se a pressão parcial do oxigênio na atmosfera como sendo 0,21, a equação se reduz a
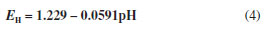
O limite inferior é estabelecido pela redução da água, cuja semirreação é:

E que similarmente ao que foi feito para a oxidação, e assumindo-se a pressão de 1 atm para o hidrogênio (extremo de atmosfera redutora, ou 100% de hidrogênio), tem-se

Os valores de potencial redox medidos em sistemas naturais deverão se situar dentro dos limites mostrados no diagrama, o que possibilita apontar as espécies predominantes que devem ser encontradas na amostra investigada, muito embora nem sempre a cinética química permita que esta previsão ocorra, em especial em reações mediadas por micro-organismos. Assim, recomenda-se cautela neste tipo de previsão. Dentro desta premissa, numa amostra de água natural a pH 7, o oxigênio deve ser o principal receptor de elétrons quando o potencial redox medido está próximo (e acima) de + 400 mV. Quando o valor de EH situa-se entre +100 e +300 mV, todo oxigênio deve ter sido consumido e os principais receptores de elétrons serão respectivamente NO3- e Mn4+, tendo como produtos mais abundantes nitrogênio e amônia, além de solubilizar o manganês na forma de Mn2+. Em condições mais drásticas de anoxia, indo de 0 a -300 mV, por exemplo, os receptores de elétrons serão Fe3+, depois SO4= e finalmente a matéria orgânica e CO2, gerando como produtos de redução o íon ferro (II), sulfeto e metano, respectivamente. A Figura 1 também traz uma série de regiões de predominância, aqui colocadas para efeito didático, de tipos de ambientes aquáticos que normalmente são encontrados na natureza.1 Por exemplo, uma amostra de água subterrânea rica em CO2, devido ao seu confinamento em regiões deficientes de oxigênio, certamente irá apresentar valores de EH mais negativos do que aquelas águas superficiais em contato com a atmosfera oxidante. Exceto pelas águas ácidas características de áreas de mineração, águas interiores e de mar apresentam valores de pH que normalmente oscilam entre 4 e 9, sendo que estas águas são sistemas abertos para a atmosfera e, portanto, podem estar saturadas com oxigênio próximo à superfície. No entanto, na interface água-sedimento, normalmente estas mesmas águas podem apresentar valores de EH bastante negativo, podendo ser ricas em metano e sulfeto oriundo da extrema anoxia que se desenvolve nesta interface.
CONCLUSÃO Medidas de potencial redox ganharam importância no monitoramento ambiental nas últimas décadas e passaram a compor a lista de parâmetros exigidos para um melhor diagnóstico destes sistemas. Ainda que aparentemente triviais de serem realizadas em campo com instrumentação de baixo custo, a interpretação e a medição deste parâmetro exigem uma análise bastante criteriosa. Primeiramente porque o potencial redox é sempre expresso em termos do eletrodo padrão de hidrogênio, exigindo, portanto, uma correção do potencial lido em campo, cujo erro situa-se na faixa de 200 mV se não aplicado este procedimento. Em segundo lugar, o eletrodo responde a todos os pares redox presentes em concentrações superiores a 10-5 mol L-1, e cujo equilíbrio é dificilmente atingido nestas condições. Assim, não é raro que a instabilidade da leitura perdure por mais de 30 min. Soluções de referência estão disponíveis para se avaliar o funcionamento do conjunto de medição e devem sempre ser usadas antes e após a leitura de EH. Finalmente, as previsões envolvendo espécies predominantes em sistemas monitorados estão centradas nos aspectos termodinâmicos e, assim sendo, devem ser interpretados dentro desta condição de contorno, uma vez que muitas das reações que ocorrem nos ambientes naturais podem ser limitadas cineticamente, além de grande parte delas serem reações mediadas por micro-organismos.
AGRADECIMENTOS Diego Campaci de Andrade por preparar e testar as soluções de referência (ZoBell e Light) e Cristiane Vidal pela arte do diagrama.
REFERÊNCIAS 1. Baas-Becking, L.G.M.; Kaplan, I.R.; Moore, D.; J. Geol. 1960, 68, 243. 2. Mahan, B.M.; Meyers, R. J.; Química: um curso universitário, 4ª ed., Blucher: São Paulo, 1995. 3. Lindberg, R.D.; Runnells, D.D.; Science 1984, 225, 925. 4. ASTM Standard Test Method for Oxidation-Reduction Potential of Water. http://www.astm.org/Standards/D1498.htm 5. Light, T.S.; Anal. Chem. 1972, 44, 1038. 6. ZoBell, C.E.; Am. Assoc. Pet. Geol. Bull. 1946, 30, 447. 7. Teasdale, P.R.; Minett, A.I.; Dixon, K.; Lewis, T.W.; Batley, G.E.; Anal. Chim. Acta 1998, 367, 201. 8. Nordstrom, D.K.; Geochem. Cosmochim. Acta 1977, 41, 1835. 9. USGS National Field Manual for the Collection of water - Quality Data (TWRI Book 9), Reduction-Oxidation Potential. http://water.usgs.gov/owq/FieldManual/Chapter6/6.5_contents.html, acessado em 28/11/2013. 10. Barnum, D.W. J.; Chem. Educ. 1982, 59, 809. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





