Artigo
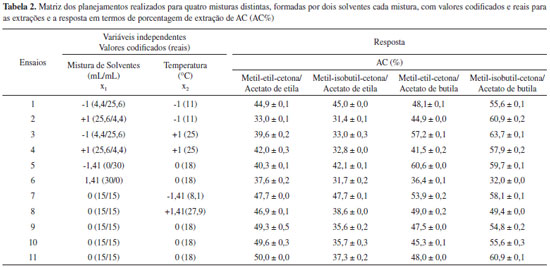
|
|
| Otimização da etapa de extração do ácido clavulânico presente no caldo de fermentação utilizando misturas de solventes Optimization of liquid-liquid extraction step for clavulanic acid from fermentation broth using solvent mixtures |
|
Mariane de A. Mancilha; Gabriela C. Guimaraes; Joao Cláudio S. de C. Nardi; Jaine H. H. L. de Oliveira; Daniela B. Hirata*
Instituto de Química, Universidade Federal de Alfenas, 37130-00 Alfenas - MG, Brasil Recebido em 12/02/2014 *e-mail: daniela.hirata@unifal-mg.edu.br The purpose of this work was to study four different solvent mixtures intended to increase the yield of the extraction stage of clavulanic acid (CA), which is one of the steps in the purification process. Four central composite rotatable designs (CCRD) were utilized to optimize the solvent mixtures. The variables selected for the factorial design were solvent mixture ratio (mL/mL) and temperature (ºC). The results showed that the yield of CA extracted from fermentation broth with the solvent mixtures of methyl-ethyl-ketone and ethyl acetate, and methyl-isobutyl-ketone and ethyl acetate (44.7 and 50.0%, respectively) was higher than that of the individual ethyl acetate alone (36.5%). INTRODUÇAO O ácido clavulânico (AC) é um excelente inibidor de β-lactamases, que sao enzimas responsáveis pela resistência bacteriana aos antibióticos β-lactâmicos. É constituído por um anel ß-lactâmico condensado a um anel oxazolidina (Figura 1).1 O uso combinado do AC com antibióticos β-lactâmicos tornou possível a cura de várias infecçoes resistentes a terapias convencionais, sem necessitar de utilizaçao de medicamentos com fortes efeitos colaterais.2,3 A associaçao do AC com a amoxicilina destaca-se como um produto de grande sucesso comercial.4,5.
 Figura 1. Fórmula estrutural do ácido clavulânico
Devido a sua importância no ramo de medicamentos, pesquisas foram realizadas para elucidar métodos alternativos de purificaçao deste fármaco.6-9 Um dos métodos de grande potencial é a reaçao de precipitaçao do ácido clavulânico com o 2-etil-hexanoato de potássio no qual a reaçao promove a conversao de cerca 70% do AC presente inicialmente a clavulanato de potássio, sendo esta a forma final do fármaco presente no medicamento.8,9 Dentro do processo de purificaçao do AC um dos fatores limitantes é a etapa de extraçao do AC do caldo de fermentaçao, que geralmente é realizada com a utilizaçao de solvente orgânico.10 Esta etapa é considerada a limitante do processo, visto que o máximo rendimento obtido é inferior a 50% para o AC presente no caldo de fermentaçao.8,11 Diante do exposto, é de extrema importância que esta etapa seja estudada para proporcionar uma maior extraçao do AC do caldo de fermentaçao e, consequentemente, possibilitar um aumento no rendimento total do AC ao final do seu processo de purificaçao. Dessa forma, o presente trabalho visou avaliar o emprego de misturas de solventes orgânicos para a etapa de extraçao liquido-liquido. Ressalta-se que até o momento nao foi relatado em literatura o emprego de misturas de solventes para a etapa de extraçao do AC do caldo de fermentaçao, apenas a extraçao com solventes individuais. O emprego de uma mistura de solventes para a etapa de extraçao é muito interessante, pois as combinaçoes dos solventes podem proporcionar além de um rendimento elevado para a extraçao do AC, ainda um incremento na sua purificaçao, devido às diferenças das propriedades físico-químicas dos solventes empregados para a extraçao.12-14 Assim, os solventes foram selecionados levando-se em consideraçao que a etapa de extraçao precede a reaçao de precipitaçao do AC, sendo necessário que os mesmos apresentem pouca solubilidade em água, para que a reaçao de precipitaçao possa ocorrer de maneira desejável.9,12 Planejamentos fatoriais foram utilizados buscando a otimizaçao do processo de extraçao do AC empregando misturas constituídas por dois solventes distintos, sendo que os melhores resultados obtidos foram aplicados ao caldo de fermentaçao.
PARTE EXPERIMENTAL Acido clavulânico Nos experimentos foram utilizadas as fontes de AC: i- Clavulanato de potássio fornecido pela DSM-Anti Infectives; ii - Clavulanato de potássio obtido do medicamento produzido por Ranbaxy® (constituído de 625 mg de amoxicilina e 125 mg de clavulanato de potássio); iii- Acido clavulânico produzido por Streptomyces clavuligerus ATCC 27064 em mesa incubadora rotativa (shaker), a temperatura de 28 ºC, 250 rpm, por 72 h. O micro-organismo foi cedido pelo Departamento de Engenharia Química da UFSCar. O meio de cultura utilizado era composto essencialmente por glicerol (1,5% m/v), extrato de levedura (0,1% m/v), peptona bacteriológica (1,0% m/v), extrato de malte (0,075% m/v) e sais minerais (0,1% m/v), MgSO4.7H2O, KH2PO4, MnCl2.4H2O, FeSO4.H2O e ZnSO4.H2O. Ao final do cultivo o caldo foi centrifugado, filtrado em papel filtro para a retirada das células e posteriormente realizou-se a extraçao com a mistura de solventes.15 Nos planejamentos fatoriais visando o estudo da extraçao do AC, por meio de uma mistura constituída por dois solventes, foi utilizado o AC disponível no medicamento adquirido comercialmente. Isso foi necessário para que as variáveis utilizadas no planejamento fatorial pudessem ser corretamente avaliadas, garantindo-se que a quantidade inicial de AC empregada seria a mesma e que nao haveria a interferência de outras substâncias, geralmente presentes no caldo de fermentaçao. Para a utilizaçao do AC presente no medicamento foi necessário realizar a extraçao líquido-líquido para posterior utilizaçao. O comprimido foi triturado, descartando-se seu revestimento e em seguida dissolvido em 20 mL de água milli-Q à 10 ºC e filtrado a vácuo em membrana de 0,45 µm. Com este procedimento 99% do AC presente no medicamento foi recuperado, com um mínimo de substâncias que poderiam causar interferências.9,16 Clavulanato de potássio cedido pela DSM-Anti Infectives foi utilizado como padrao de AC para as análises. Solventes utilizados na mistura Para a extraçao foram utilizadas misturas contendo dois solventes. As combinaçoes de solventes foram realizadas levando-se em consideraçao fatores como a seletividade e a capacidade de recuperaçao do AC pelos solventes. Assim buscou-se agrupar um solvente mais seletivo a outro que proporcionasse uma maior extraçao do AC. Para tanto, ensaios prévios utilizando os solventes, metil-etil-cetona, metil-isobutil-cetona, diclorometano, clorofórmio e éter (nao mostrados aqui) foram realizados, obtendo-se como solventes mais seletivos a metil-etil-cetona e a metil-isobutil-cetona. Os solventes que apresentaram maiores porcentagens de recuperaçao do AC foram o acetato de etila e o acetato de butila. Dessa forma as misturas: metil-etil-cetona e acetato de etila, metil-isobutil-cetona e acetato de etila, metil-etil-cetona e acetato de butila, metil-isobutil-cetona e acetato de butila foram estudadas. Todos os solventes utilizados possuíam grau analítico (Synth). Cálculo de parâmetros de extraçao Os parâmetros calculados foram a porcentagem de extraçao de AC (rendimento) e para o caldo de fermentaçao foi calculado também o fator de purificaçao (FP).12 A porcentagem de extraçao do AC (AC%) foi calculada pela Equaçao 1:
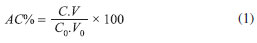
Na qual C0 é a concentraçao inicial do ácido clavulânico na fase aquosa, V0 é o volume da fase aquosa inicial, C é a concentraçao final e V o volume final de AC após a reextraçao. Foi considerado que todo o AC presente na fase orgânica foi reextraído pela etapa de reextraçao com tampao a pH 7,0. O fator de purificaçao (FP) foi calculado pela Equaçao 2:

Na qual V e V0 sao os volumes final e inicial e C e C0 sao as concentraçoes de AC final e inicial respectivamente. CT e CT0 referem-se às concentraçoes final e inicial de impurezas presentes no caldo de fermentaçao, respectivamente. Métodos analíticos A determinaçao da concentraçao de ácido clavulânico nas amostras foi realizada utilizando o método espectrofotométrico a 311 nm, com reaçao prévia do ácido clavulânico com imidazol (Vetec).17 Foi utilizado o espectrofotômetro Pharmacia Biotech UV/VIS. Os resultados foram obtidos utilizando-se uma curva de calibraçao construída a partir de padrao de ácido clavulânico fornecido pela DSM-Anti Infectives. No procedimento de derivatizaçao do AC, o imidazol ataca o grupo carbonila do anel β-lactâmico quebrando a ligaçao C-N e formando uma nova ligaçao entre o imidazol e o carbono da carbonila. A quebra do anel β-lactâmico também leva à abertura do anel oxazolidina com consequente descarboxilaçao, originando o produto da Figura 2. O produto dessa reaçao é mais estável que o AC e sua formaçao é diretamente proporcional à concentraçao de AC presente na reaçao, apresentando máxima absorçao no ultra violeta (UV) em 311nm.
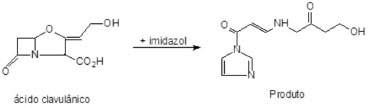 Figura 2. Esquema da reaçao do ácido clavulânico com o imidazol
Determinaçao dos contaminantes presentes no caldo de fermentaçao A concentraçao dos contaminantes foi determinada por espectrofotometria a 280 nm, (Pharmacia Biotech UV/VIS), desconsiderando a influência do AC.12,18 Este comprimento de onda foi selecionado, levando-se em consideraçao a presença de anéis aromáticos em uma grande quantidade de aminoácidos constituintes de proteínas como tirosina, triptofano e fenilalanina, que estao presentes no caldo de fermentaçao. Planejamento fatorial Para cada mistura de dois solventes foi realizado um delineamento composto central rotacional (DCCR), ou seja, um planejamento 22 incluindo 4 ensaios nas condiçoes axiais e 3 repetiçoes no ponto central, totalizando 11 ensaios.19 As variáveis independentes avaliadas foram: mistura de solventes (x1) e temperatura (x2). Os níveis das variáveis foram escolhidos baseando-se na importância dos mesmos para o processo de extraçao. O tempo de agitaçao para promover o contato entre as fases foi fixado em 90 s. Este tempo foi pré-determinado pelo DCCR realizado para a extraçao na qual somente o acetato de etila foi utilizado como solvente. Neste planejamento 22 as variáveis independentes foram: tempo de agitaçao e temperatura. No total foram realizados 5 planejamentos fatoriais distintos, sendo utilizado o software Statistica versao 7,0 (StatSoft Inc., USA) para análise e construçao das superfícies de respostas. Procedimento experimental para os ensaios de extraçao Ao filtrado contendo AC oriundo do medicamento foi adicionado 130 mL de água destilada (totalizando 150 mL), que foi acidificado com H2SO4 (1 mol L-1) até pH 2 (pKa do AC é de 2,5) e em seguida colocado em contato com a mistura de solventes para a extraçao. Após a acidificaçao a concentraçao inicial de AC (C0) era de aproximadamente 550 mg L-1. Três partiçoes (v = 30 mL) foram realizadas e a fraçao aquosa reservada. Cada fraçao orgânica foi re-extraída com tampao fosfato pH 6,8 (v = 30 mL). Na re-extraçao o tempo de contato com agitaçao foi de 150 s. Após este tempo, a mistura foi deixada em repouso no funil de separaçao para a completa separaçao das fases por decantaçao. Amostras foram coletadas durante o processo para análise posterior. Posteriormente, as melhores condiçoes obtidas nestes experimentos, avaliadas pelo planejamento fatorial, foram aplicadas nos ensaios utilizando o caldo de fermentaçao. O volume utilizado de caldo de fermentaçao foi de 500 mL, Foram realizadas três partiçoes utilizando a mistura de solventes (v = 100 mL). Os ensaios foram realizados em triplicata.
RESULTADOS E DISCUSSAO Resultados obtidos para os planejamentos fatoriais completos O estudo da extraçao com acetato de etila foi realizado no intuito de se obter um maior conhecimento das influências das variáveis envolvidas no processo de extraçao utilizando-se apenas um solvente, para posteriormente se fazer a seleçao das variáveis para os ensaios realizados com misturas de dois solventes. As variáveis tempo de agitaçao (s) e temperatura (ºC), para a extraçao com acetato de etila, foram selecionadas. Por meio dos resultados obtidos (Tabela 1), observou-se que a porcentagem extraída de AC variou de 27,4% (18 ºC e 17,7 s) a 34,1% (25 ºC e 90 s).

O tempo de agitaçao para contato entre as fases foi estatisticamente significativo a 5% de significância (p < 0,05), entretanto nao foi possível a utilizaçao do modelo para a construçao e análise de superfície, uma vez que na análise de variância o Fcalculado (Fcalc) encontrado, foi de 3,6, sendo inferior ao Ftabelado (Ftab) que foi de 5,5. Visto que o ensaio para o qual foi obtido o maior rendimento (34,1%) ocorreu a 90 s e 25 ºC, foi fixado o tempo de contato entre as fases em 90 s para os planejamentos seguintes. O acetato de etila foi escolhido no trabalho de Brites et al.12 como o melhor solvente a ser utilizado para a extraçao do AC presente no caldo de fermentaçao, considerando apenas o emprego de solventes individuais, para o qual foi obtido um rendimento de extraçao de 35,6 % a uma concentraçao inicial de AC de 161,9 mg L-1. Assim, o resultado encontrado neste trabalho está de acordo com o relatado por Brites et al..12 Sabe-se que o AC possui uma elevada velocidade de degradaçao a temperaturas acima de 20 ºC e, por esse motivo, nos trabalhos descritos em literatura a temperatura utilizada nos processos está abaixo de 20 ºC ou preferencialmente em torno de 10 ºC, na qual este apresenta maior estabilidade.4,20,21 Neste planejamento foi observado que o maior rendimento obtido para a extraçao do AC ocorreu para o nível +1 do planejamento, ou seja, para a temperatura ambiente (25 ºC). Portanto é possível afirmar que a utilizaçao do planejamento fatorial foi de grande utilidade, mesmo sem a análise de superfície de resposta, pois desta forma foi possível avaliar as interaçoes entre as variáveis que proporcionaram uma extraçao com elevado rendimento à temperatura ambiente, implicando em um menor gasto de energia no processo de extraçao do AC utilizando o acetato de etila como solvente. Na Tabela 2 encontram-se os resultados obtidos para os planejamentos fatoriais que avaliaram o emprego de quatro misturas distintas de solventes em diferentes temperaturas para o processo de extraçao do AC.
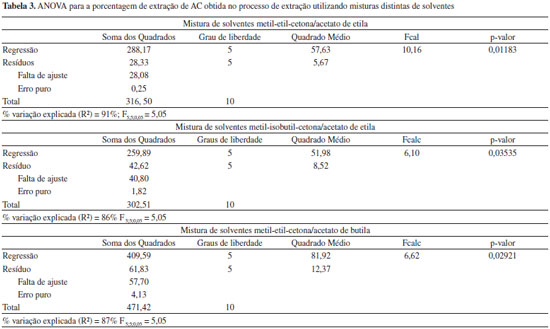
No planejamento em que foi utilizada a mistura dos solventes metil-etil-cetona e acetato de etila observou-se que porcentagem de AC extraída variou de 33,0 a 50,0%. O termo quadrático da mistura de solventes e o termo mistura de solventes x temperatura foram os parâmetros estatisticamente significativos a 5% (p < 0,05). A ANOVA (Tabela 3) apresentou uma boa porcentagem de variaçao explicada (R2) pelo modelo (91%), e o valor de 10,16 para o Fcalc é significativo, ou seja, o modelo se ajusta bem aos dados experimentais sendo possível a construçao da superfície de resposta para a análise dos resultados (Figura 3). O modelo completo com as variáveis codificadas que representa a porcentagem de extraçao de AC obtida em funçao da temperatura e da razao de solventes na faixa estudada está representado pela Equaçao 3. 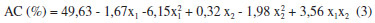
 Figura 3. Superfície de resposta para porcentagem de extraçao de AC (AC%) em funçao da mistura de solventes de Metil-etil-cetona/Acetato de etila (mL/mL) e da Temperatura (°C)
O melhor resultado encontrado foi no ensaio 11 (50,0%) no qual a temperatura utilizada foi de 18 ºC e a razao de solventes era 15/15 v/v (metil-etil-cetona/acetato de etila). Pode-se afirmar que a mistura de solventes estudada foi favorável, visto que a porcentagem de extraçao de AC foi superior à do acetato de etila, quando este foi utilizado puro, no ensaio 5 (40,3%) e ainda superior à do ensaio no qual foi utilizada somente a metil-etil-cetona, ensaio 6 (37,6%). Ainda no ensaio 5 pôde-se observar que houve um aumento significativo da porcentagem de AC extraído em relaçao aos ensaios 9, 10 e 11 do primeiro planejamento fatorial (Tabela 1), quando também foi utilizado a temperatura a 18 ºC, mas num tempo de agitaçao menor (60 s). Dessa forma é possível afirmar que o tempo escolhido de 90 s foi adequado para o processo de extraçao de AC, possibilitando o incremento observado para a extraçao. Nos ensaios 7 e 8 que correspondem aos níveis extremos de temperatura de -1,41 (8,1 ºC) e 1,41 (27,9 ºC) respectivamente, é interessante observar que ambos os rendimentos obtidos foram superiores a 45% de AC. Acredita-se que uma menor temperatura favoreça uma menor degradaçao do AC, por proporcionar ao mesmo uma maior estabilidade, entretanto, sabe-se que em maior temperatura a partiçao do sistema é favorecida, confirmado o resultado apontado por este planejamento fatorial que mostrou ser significativo o termo "razao de mistura x temperatura". Analisando a superfície de resposta gerada pelo modelo (Figura 3) foi possível verificar que a faixa ótima para a extraçao está compreendida para a razao de solventes entre os níveis -1 e +1 e para a temperatura em toda a faixa estudada, sendo mais favorável nos pontos centrais (nível 0), para os quais realmente foram encontrados os maiores valores de porcentagem extraída de AC (acima de 49,0%). Este resultado é de extrema importância, pois se verifica que esta mistura de solventes permitiu que a extraçao do AC ocorresse com bons resultados em faixas mais amplas de temperatura do que as faixas tradicionalmente utilizadas em outros processos de purificaçao de AC.4,21 Para o planejamento no qual foi utilizado a mistura dos solventes metil-isobutil-cetona e acetato de etila observou-se que a porcentagem de extraçao de AC variou de 31,4 a 47,7%. Neste planejamento os parâmetros significativos a 5% (p < 0,05) foram o termo linear da mistura de solventes e o termo linear da temperatura. Foi observado que o Fcalc para a regressao (6,10) foi superior ao Ftab (5,05). A porcentagem de variaçao (R2) explicada pelo modelo foi de 86% (Tabela 3) e os desvios encontrados para o modelo estao abaixo de 5%, justificando o emprego do modelo (Equaçao 4) para a construçao da superfície e análise dos dados experimentais (Figura 4). 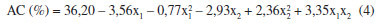
 Figura 4. Superfície de resposta para porcentagem de extraçao de AC (AC%) em funçao da mistura de solventes de Metil-isobutil-cetona/Acetato de etila (mL/mL) e da Temperatura (°C)
O melhor rendimento foi obtido no experimento 7 (47,7%) que corresponde ao menor nível para a temperatura -1,41 que equivale a 8,1 ºC. Como mostrado pelo planejamento a temperatura apresentou uma maior influência neste sistema de extraçao. Assim, embora a partiçao possa ser beneficiada pelo aumento da temperatura, a reaçao de degradaçao do AC foi predominante, tendo em vista que o AC se degrada a temperaturas elevadas (acima de 35 ºC),22 resultando que as melhores extraçoes obtidas corresponderam aos menores valores de temperaturas empregadas como observado para o ensaio 1, no qual foi observado uma extraçao de AC de 45% para a temperatura de 11 ºC. A composiçao da mistura de solventes também influiu na extraçao do AC. Enquanto as misturas ricas em metil-isobutil-cetona parecem nao afetar consideravelmente a extraçao de AC (ensaios 2 e 4) com a variaçao da temperatura (de 11 ºC para 25 ºC) o mesmo nao ocorreu com os sistemas ricos em acetato de etila (ensaios 1, 3). Para estes últimos foi observado que uma menor temperatura proporcionou um aumento na porcentagem extraída de AC, podendo-se concluir que seria no acetato de etila presente na mistura de extraçao que ocorreria a maior degradaçao do AC em funçao da temperatura. Isto provavelmente ocorre devido a maior solubilidade de água presente no acetato de etila (8,5 g/100 g de H2O) do que na metil-isobutil-cetona (1,9 g/100 g de H2O)12 e assim a maior quantidade de água presente no solvente orgânico favoreceria a hidrólise do AC com o aumento da temperatura, tal como acontece na cinética de degradaçao de AC para meios aquosos.20 Desse modo, para este sistema de extraçao estudado, pode-se afirmar que seriam mais interessantes o emprego de misturas de metil-isobutil-cetona e acetato de etila na proporçao de 1:1 ou ricas em acetato de etila a baixas temperaturas (Figura 4). Também aqui o emprego do planejamento fatorial possibilitou a obtençao de rendimentos próximos a 50% de extraçao de AC. No planejamento em que foi utilizado a mistura dos solventes metil-etil-cetona e acetato de butila observou-se que a porcentagem de extraçao de AC variou de 36,4 a 60,6%. Neste planejamento o único parâmetro significativo a 5% (p < 0,05) foi o termo linear da mistura de solventes. A ANOVA (Tabela 3) apresentou uma boa porcentagem de variaçao explicada (R2) pelo modelo (87%), e o valor de 6,62 para o Fcalc foi significativo, sendo possível a construçao da superfície de resposta para a análise dos resultados (Figura 5). O modelo completo com as variáveis codificadas que representa a porcentagem de extraçao de AC obtida em funçao da temperatura e da razao de solventes na faixa estudada está representado pela Equaçao 5. 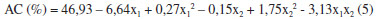
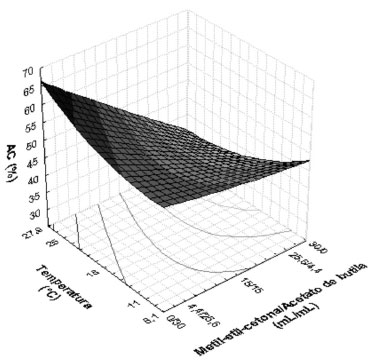 Figura 5. Superfície de resposta para porcentagem de extraçao de AC (AC%) em funçao da mistura de solventes de Metil-etil-cetona/Acetato de butila (mL/mL) e da Temperatura (°C)
A maior porcentagem de extraçao de AC foi observada no ensaio 5 (60,6%) que corresponde ao nível -1,41 do planejamento, no qual foi utilizado para a extraçao apenas o solvente acetato de butila a 18 ºC. Também para o ensaio 3 foi observado uma boa porcentagem de extraçao de AC (57,2%). Neste ensaio foi utilizado uma mistura de 4,4 mL de metil-etil-cetona e 25,6 mL de acetato de butila a temperatura de 25 ºC. Esse resultado tem grande relevância, considerando que em temperaturas próximas à ambiente, o gasto com energia diminui significativamente. Os resultados obtidos demonstraram ainda que a proporçao da mistura de solventes interferiu na extraçao líquido-líquido, sendo que nas misturas mais ricas em acetato de butila o efeito da temperatura na partiçao se sobrepôs ao efeito de degradaçao do AC. Para o planejamento no qual foi utilizado a mistura dos solventes metil-isobutil-cetona e acetato de butila observou-se que a porcentagem de extraçao de AC variou de 32,0 a 63,7%. Nenhuma das variáveis foi estatisticamente significativa e apesar de nao ter sido feita a análise de superfície, pôde-se obter uma excelente porcentagem de extraçao do AC, visto que o resultado obtido para o ensaio 3 do planejamento (63,7%) foi superior aos encontrados nos demais planejamentos, quando a extraçao foi realizada a temperatura ambiente (25 ºC). Além disso, esses ensaios foram importantes para avaliar a interaçao entre as variáveis, visto que tais interaçoes nao poderiam ser previstas de outra maneira. Sendo assim, pôde-se concluir que a mistura acetato de butila e metil-isobutil-cetona foi considerada a melhor para o processo de extraçao do AC puro a temperatura de 25 ºC. Resultados obtidos para as extraçoes do AC proveniente do caldo de fermentaçao As condiçoes que propiciaram os melhores valores encontrados em cada planejamento, em termos de porcentagem de extraçao de AC, foram aplicadas ao caldo de fermentaçao. Na Tabela 4 estao os resultados obtidos.

A mistura de solventes metil-etil-cetona e acetato de etila apresentou o maior valor para a extraçao de AC, de 50,0%, reproduzindo com exatidao o resultado obtido pelo planejamento fatorial. A mistura de solventes metil-isobutil-cetona e acetato de etila também apresentou uma boa correlaçao da extraçao do AC para o caldo, de 44,7%, contra os 47,7% obtido no planejamento fatorial, sendo que a pequena diferença de valores pode ser explicada pela interferência das várias substâncias presentes no caldo de fermentaçao no processo de extraçao. Isto pode ser confirmado pelos fatores de purificaçao observados para estes experimentos. O primeiro ensaio, contendo metil-etil-cetona e acetato de etila apresentou o maior valor de FP observado de 4,4, enquanto no segundo ensaio o FP observado foi de 3,9. Com este resultado também foi possível verificar que a mistura de solventes empregada para extraçao influenciou no fator de purificaçao para o AC. Quando a metil-etil-cetona foi substituída por metil-isobutil-cetona foi observado um decréscimo no fator de purificaçao do experimento contendo acetato de etila, indicando que, para as condiçoes estudadas, a metil-etil-cetona com o acetato de etila formaram uma mistura de solventes mais seletiva para a extraçao do AC do caldo de fermentaçao frente às diferentes substâncias que também se encontravam presentes. Em relaçao à porcentagem de extraçao de AC para o caldo, ambos os ensaios apresentaram um valor elevado de extraçao (de 50 a 44,7%) quando comparado aos valores relatados em literatura, nos quais somente o acetato de etila foi utilizado para a extraçao do AC (de 36,5 a 25,5%).12 Ressalta-se ainda que no primeiro ensaio, para a mistura de metil-etil-cetona e acetato de etila, a temperatura utilizada foi de 18 ºC, já no segundo ensaio, contendo a mistura de metil-isobutil-cetona e acetato de etila, a temperatura utilizada foi mais baixa, de 8 ºC, o que significa em termos de ampliaçao de escala um custo adicional para este último. Embora os antibióticos possuam um alto valor agregado, que justifique o custo de se empregar baixas temperaturas em seu processamento, uma economia de energia no processo pode favorecer um menor preço do produto final no mercado, tornando-o mais competitivo. Assim verificou-se que, para os experimentos nos quais o acetato de etila foi um dos constituintes da mistura de solventes utilizada na extraçao, a mistura contendo metil-etil-cetona e acetato de etila foi a mais indicada para a extraçao do AC presente no caldo de fermentaçao. Com relaçao aos ensaios 3 e 4, nos quais foram utilizados somente o acetato de butila e a mistura de solventes de metil-isobutil-cetona e acetato de butila, verificou-se que os valores encontrados na extraçao de AC de 46,8 e 43,6% respectivamente, foram inferiores aos valores observados no planejamento fatorial (de 60,6 e 63,7% respectivamente). A este resultado podem ser atribuídas duas possíveis explicaçoes. Os ensaios contendo acetato de butila apresentaram um fator de purificaçao de 2,9, valor inferior aos obtidos para as misturas que continham acetato de etila, significando que o acetato de butila é muito menos seletivo para o AC do que o acetato de etila. Isto faz com que as outras substâncias presentes no caldo de fermentaçao concorram com o AC diminuindo desta forma a porcentagem de extraçao do mesmo do caldo. Outra possível causa do baixo rendimento observado pode ser atribuída à formaçao de uma emulsao entre as fases aquosa e orgânica, de difícil remoçao para estes experimentos. Esta emulsao teria retido o AC na interface, diminuindo desta forma a sua recuperaçao na fase solvente. Acredita-se que os dois fatores tenham contribuído sensivelmente para a diminuiçao dos valores de porcentagem de extraçao do AC do caldo de fermentaçao, uma vez que para o AC puro as porcentagens de extraçao observadas foram superiores e que nao foi observada a formaçao de emulsao. Por meio dos resultados obtidos concluiu-se que os melhores sistemas de extraçao para AC presente no caldo de fermentaçao foram aqueles no qual foi utilizada uma mistura de solventes contendo acetato de etila e metil-etil-cetona ou metil-isobutil-cetona.
CONCLUSAO Os planejamentos fatoriais utilizados permitiram a otimizaçao dos quatro sistemas de extraçao estudados, nos quais foram utilizadas misturas distintas de solventes. Na maior temperatura estudada, de 27,9 ºC, foi possível a verificaçao de combinaçoes dentre as variáveis que propiciaram rendimentos de até 49,4% de AC. Para a temperatura ambiente foi obtido um rendimento de AC de 63,7%, quando foi utilizada a mistura de solventes metil-isobutil-cetona e acetato de butila. A utilizaçao de misturas com diferentes combinaçoes entre os dois solventes também resultou em sistemas de extraçao com características distintas entre si, como exemplo pode-se citar o sistema no qual foi empregada a mistura entre metil-isobutil-cetona e acetato de etila, no qual foi observada uma maior influência da temperatura na degradaçao do AC quando foram empregadas na extraçao misturas ricas em acetato de etila. Utilizando o caldo de fermentaçao, dois sistemas de extraçao se destacaram. As misturas de solventes contendo metil-etil-cetona e acetato de etila e metil-isobutil-cetona e acetato de etila possibilitaram uma maior extraçao do AC do caldo de fermentaçao (de 44,7 a 50,0%) quando comparado ao acetato de etila individualmente, reportado em literatura como de 36,5%. Desta forma o emprego de misturas de solventes se mostrou altamente vantajoso na etapa de extraçao líquido-líquido para o processo de purificaçao do AC do caldo de fermentaçao.
AGRADECIMENTOS Os autores agradecem ao CNPq e à UNIFAL/MG pelo apoio financeiro.
REFERENCIAS 1. Howarth, T. T.; Brown, A. G.; King, T. J.; J. Chem. Soc. Chem. Commun. 1976, 266. 2. Baggaley, K. H.; Brown, A.; Shofield, C. J.; Nat. Prod. Rep. 1997, 14, 309. 3. Cole, M.; Howarth, T. T.; Reading, C.; GB 1,508,978 A 1978. (CA 90:23022) 4. Mayer, A. F.; Anspach, F. B.; Deckwer, W. D.; Bioseparation 1996, 6, 25. 5. Bellao, C.; Antonio, T.; Araujo, M. L. G. C.; Badino A. C.; Braz. J. Chem. Eng. 2013, 30, 257. 6. Videira, M.; Aires-Barros, M. R.; J. Chromatogr. A 1994, 668, 237. 7. Silva, C. S.; Cuel, M. F.; Barreto, V. O.; Kwong, W. H.; Hokka, C. O.; Barboza, M.; New Biotechnol. 2012, 29, 428. 8. Hirata, D. B.; Oliveira, J. H. H. L.; Leao, K. V.; Rodrigues, M. I.; Ferreira, A. G.; Giulietti, M.; Barboza, M.; Hokka, C. O.; Sep. Purif. Technol. 2009, 66, 598. 9. Hirata, D. B.; Oliveira, J. H. H. L.; Leao, K. V.; Rodrigues, M. I.; Ferreira, A. G.; Giulietti, M.; Barboza, M.; Hokka, C. O.; Braz. J. Chem. Eng. 2013, 30, 231. 10. Butterworth, D. Em Biotechnology of Industrial Antibiotics; Vandame, E. J., ed.; Marcel Dekker: New York, 1984, cap. 6. 11. Capuder, E.; US pat. 6,180,782B1 2001. (CA 126:22874) 12. Brites, L. M.; Oliveira, J. H. H. L.; Barboza, M.; Hokka, C. O.; Latin Am. Appl. Res. 2012, 42, 65. 13. Moreira, I.; Scheel, G. L.; Hatumura, P. H.; Scarminio, I. S.; Quim. Nova 2014, 37, 39. 14. DiCiaula, M. C.; Lopes, G. C.; Scarminio, I. S.; Mello, J. C. P.; Quim. Nova 2014, 37, 158. 15. Rosa, J. C.; Baptista-Neto, A.; Hokka, C. O.; Badino, A. C.; Bioprocess Biosyst. Eng. 2005, 27, 99. 16. Bird, E. A.; Bellis, M. J.; Gasson, C.; Analyst 1982, 107, 1241. 17. Milagre; C. D. F.; Cabeça, L. F.; Almeida, W. P.; Marsaioli, A. J.; J. Braz. Chem. Soc. 2012, 23, 403. 18. Almeida, R. M. R. G.; Barboza, M.; Hokka, C. O.; Appl. Biochem. Biotechnol. 2003, 105, 867. 19. Rodrigues, M. I.; Iemma, A. F.; Planejamento de experimentos e otimizaçao de processos, 2ª ed., Casa do Espírito Amigo Fraternidade Fé e Amor: Campinas, 2009. 20. Bersanetti, P. A.; Almeida, R. M. R. G.; Barboza, M.; Araujo, M. L. G. C.; Hokka, C. O.; Biochem. Eng. J. 2005, 23, 31. 21. Barboza, M.; Almeida, R. M. R. G.; Hokka, C. O.; Bioseparation 2002, 10, 221. 22. Haginaka J.; Yasuda, H.; Uno, T.; Nakagawa, T.; Chem. Pharm. Bull. 1985, 33, 218. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access