Artigo
|
|
| Carcinogenicidade do carbendazim e seus metabólitos Carcinogenicity of carbendazim and its metabolites |
|
Renato C. Silva; Karina A. Barros; Antonio C. Pavao*
Departamento de Química Fundamental, Universidade Federal de Pernambuco, 50740-540 Recife - PE, Brasil Recebido em 03/02/2014 *e-mail: pavao@ufpe.br The carcinogenic potential of carbendazim and its metabolites was analyzed using statistical treatment of electronic parameters obtained from DFT/ 6-311++G(d,p) and AM1 calculations. The carcinogen-DNA interaction is described in the framework of the theory of unsynchronized resonance of covalent bond as a process of electron transfer involving the HOMO and LUMO frontier orbitals. Through a Principal Component Analysis (PCA) of the electron affinity, carcinogen-DNA interaction energy, electrostatic attraction and cell membrane permeability (dipole moment µ and partition coefficient LogP) evidence was obtained showing carbendazim displays carcinogenic activity. For the metabolites of carbendazim, no evidence was found in the literature of their carcinogenic activities. However, the electronic parameters for these metabolites exhibited similarity to known carcinogens, thereby showing the importance of the results obtained in this study for a policy based on the precautionary principle. INTRODUÇAO O fungicida benzimidazólico metil-2-benzimidazole-carbamato (MBC), fórmula molecular C9H9N3O2, conhecido popularmente como carbendazim (Figura 1),
 Figura 1. Fórmula estrutural do carbendazim
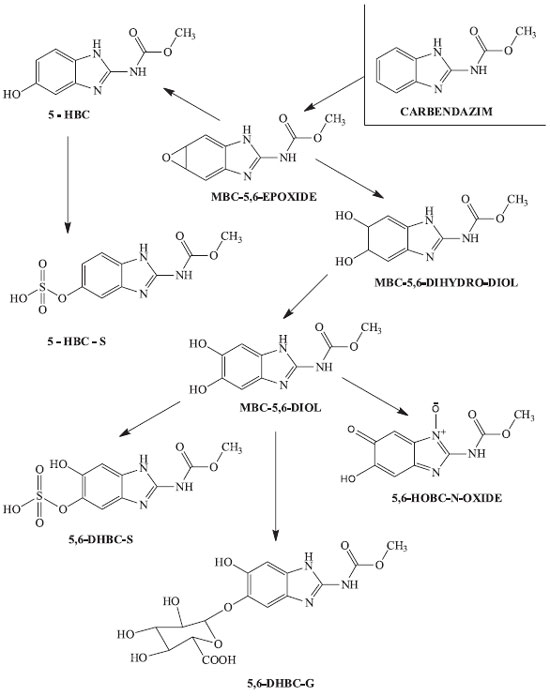
foi notícia internacional em janeiro de 2012, quando os EUA proibiram a importaçao do suco de laranja brasileiro devido à presença deste fungicida. Esta decisao causou um enorme impacto já que o Brasil destina cerca de 15% das suas 1,3 milhoes de toneladas de suco de laranja aos EUA. O carbendazim é um produto legalizado no Brasil e é utilizado no combate de pragas como a Guignardia citricarpa (pinta preta) e Colletotrichum acutatum (estrelinha), que sao fungos comuns em lavouras de laranjas.1 Entretanto, segundo a Food and Drug Administration (FDA), agência norte-americana responsável pela fiscalizaçao de alimentos e medicamentos, o consumo do fungicida está associado a um aumento no risco de tumores de fígado e, por essa razao, a substância é proibida no país.2 Segundo as especificaçoes da Agência Nacional de Vigilância Sanitária (ANVISA)3 e da U.S. Environmental Protection Agency (EPA),4 o carbendazim é um fungicida de classe toxicológica III, considerado de toxicidade média. A DL50, quantidade necessária para matar metade de uma populaçao em teste, para o carbendazim em ratos administrado por via oral é de 6400 mg kg-1 por peso do animal.5 Em conformidade com a tabela toxicológica da EPA, o MBC é considerado do grupo C, classificado como possível carcinógeno em humanos. Pesquisas experimentais relatam a formaçao de neoplasias hepatocelulares em fêmeas de camudongos4 e a induçao da atividade tumoral em células do ovário humano.6 O tempo de meia vida do MBC no meio ambiente é relativamente alto, em torno de dois meses em condiçoes aeróbias e vinte e cinco meses sob condiçoes anaeróbias.7 Por conta disso, sua degradaçao é considerada lenta, o que torna o MBC um composto quimicamente estável. Contudo na presença de luz (fotodegradaçao) e em diferentes condiçoes ambientais, tais como mudanças na temperatura e no pH, sua estabilidade é afetada, como por exemplo em meio alcalino e na presença de oxigênio torna-se mais instável e sua degradaçao é acelerada. Na temperatura ambiente o MBC possui baixa solubilidade em água, já em temperaturas mais altas passa a ser solúvel.8 Portanto, este é um dos fatores que leva o carbendazim a ser encontrado no meio ambiente na forma de resíduos. Os produtos formados a partir do processo de degradaçao do MBC dependem do meio onde ocorre a degradaçao. A forma como é absorvido e/ou eliminado muda conforme o ambiente em que sofreu a decomposiçao, se em animais, plantas ou solo. A rota metabólica do MBC já foi estudada em diversas espécies de animais, tais como: galinhas, ratos, camudongos, coelhos, cachorros, ovelhas, vacas, e em plantas e solos. Estudos com ratos revelam que o MBC é bem absorvido quando administrados por via oral cerca de 80 a 85%, sendo posteriormente metabolizado em diversos compostos dentro do organismo.9 Durante o processo metabólico do carbendazim em ratos (Figura 2), a principal reaçao química que ocorre é a hidroxilaçao,10 fornecendo como principais metabólitos: o 5-hidroxi-2-benzimidazole-carbamato (5-HBC) encontrado na urina e fezes de ratos machos; o 2-metoxicarbonil-amino-1H-benzimidazol-5-il-(sulfato de hidrogênio) (5-HBC-S); e o 5,6-hidroxi-2-benzimidazole-carbamato-N-óxido (5,6-HOBC-N-óxido) encontrado nas excretas de ratos fêmeas, principalmente na forma glucuronizada.
Como metabólitos secundários temos o 5,6-dihidroxibenzimidazol-2-il-carbamato (5,6-DHCB) que pode se metabolizar a 6-hidroxi-2-metoxicarbonil-amino-1H-benzimidazol-5-il-5-(sulfato de hidrogênio) (5,6-DHCB-S) e 6-hidroxi-2-metoxicarbonil-amino-1H-benzimidazol-5-il-β-D-ácido glucopiranosiduronico (5,6-DHCB-G) nas formas conjugadas sulfatadas e glucuronizadas, respectivamente. Pesquisas descrevem que os metabólitos secundários citados anteriormente sao excretados de forma rápida por meio da urina em ratos machos e fêmeas.11 A intoxicaçao por carbendazim é passível de ocorrer por meio da ingestao de alimentos tais como: feijao, arroz, trigo, soja, citros onde geralmente é aplicado esse fungicida.3 Os trabalhadores rurais aplicadores diretos do carbendazim nas plantaçoes sofrem maiores riscos de exposiçao e intoxicaçao. Desse modo, para o Poder Público conceder satisfatoriamente o direito à saúde humana com alimentos seguros e saudáveis, a toxicidade do princípio ativo carbendazim necessita passar por um processo de reavaliaçao pela ANVISA. Considerando a problemática toxicidade do carbendazim e seus metabólitos aos efeitos mutagênicos, a causalidade deve ser estudada utilizando-se o maior número possível de informaçoes, tanto qualitativas como quantitativas. A modelagem química computacional que estuda a interaçao de espécies químicas com o DNA, enzimas e proteínas está cada vez mais em evidência e oferece uma opçao viável por ser de baixo custo e informar rapidamente sobre o potencial carcinogênico de substâncias químicas. Neste sentido, o objetivo deste estudo foi caracterizar o potencial carcinogênico do carbendazim e seus metabólitos a partir de uma análise estatística de parâmetros eletrônicos obtidos por cálculos precisos de química quântica.
METODOLOGIA A partir de cálculos químico-quânticos de orbitais moleculares, selecionamos um conjunto de descritores para realizar um estudo estatístico visando caracterizar a atividade carcinogênica dos compostos aqui investigados. Este procedimento já foi utilizado em vários trabalhos publicados sobre carcinogênese química, como os que descrevem com sucesso a atividade carcinogênica de aflatoxinas, DDT, nitrosaminas, benzopirenos e uma variedade de pesticidas, além da atividade protetora de antioxidantes (vitamina C e resveratrol) contra o câncer.12-17 Por meio de um tratamento estatístico multivariado com análise de componentes principais (ACP) foi possível correlacionar os descritores eletrônicos com o potencial cancerígeno. A ACP é uma técnica estatística que permite interpretar a estrutura de um conjunto de dados diversos a partir das respectivas matrizes de variâncias-covariâncias ou de correlaçoes entre os parâmetros considerados. Matematicamente, a ACP corresponde a uma fatoraçao da matriz X de dados originais com "n" carcinógenos e "p" descritores. Este procedimento requer a diagonalizaçao da matriz de covariância XtX, em que Xt é a transposta da matriz X. Os elementos dos autovetores, que na ACP sao chamados de pesos, representam a contribuiçao com que cada um dos eixos originais entra na composiçao dos novos eixos, chamados de componentes principais. Os autovalores representam a quantidade de variância original explicada pelos respectivos autovetores. Metodologicamente, a ACP procura rotacionar os eixos originais para a obtençao de um novo conjunto de eixos de menor dimensao que concentre o máximo das informaçoes. Os novos eixos apresentam um certo padrao que permite relacionar esses descritores com a atividade estudada. Na análise ACP é possível estabelecer uma relaçao entre determinados descritores com a propriedade que se deseja avaliar sem necessariamente ter que levar em consideraçao as características estruturais dos compostos investigados. Assim, uma vantagem desta técnica é que permite a descriçao de determinada propriedade para um conjunto de moléculas que nao apresentam semelhanças em suas estruturas geométricas. A informaçao considerada como relevante na ACP refere-se às duas componentes principais. A primeira (PC1) descreve o eixo de maior variância, sendo neste eixo onde os pontos se encontram mais espalhados. A segunda (PC2), ortogonal a PC1, representa o segundo eixo de maior variância residual. Veremos que os cálculos e gráficos da ACP obtidos a partir do software computacional STATISTICA 8.0, para o grupo de compostos estudados, separou de forma clara os nao-carcinogênicos, carcinógenos e protetores. Os parâmetros selecionados para a ACP sao: afinidade eletrônica adiabática (AE), energia de interaçao carcinógeno-DNA (ΔEH-L), atraçao eletrostática carcinógeno-DNA (Δq), momento de dipolo elétrico (µ) e logarítimo do coeficiente de partiçao (LogP). A justificativa para a escolha deste conjunto considera que os parâmetros selecionados devem ter alguma correlaçao com o problema em questao. Assim, vejamos inicialmente o caso da AE. Desde os trabalhos pioneiros de Elizabeth Miller,18 substâncias carcinogênicas têm sido reconhecidas pela sua natureza eletrofílica, sendo capazes de reagir com sítios nucleofílicos de macromoléculas como DNA e proteínas. Daí a justificativa para a inclusao de AE entre os parâmetros selecionados para o estudo estatístico. Neste trabalho vamos utilizar a afinidade eletrônica adiabática (AE), que é obtida pela diferença entre a energia total da molécula neutra e a energia total da molécula aniônica (Etotal molécula neutra - Etotal molécula aniônica), estando ambas as moléculas com suas geometrias otimizadas. Valores altos para AE adiabática indicam que a molécula tem grande facilidade em receber elétrons. Este procedimento é mais realista do que simplesmente usar o Teorema de Koopmans ou calcular AE vertical, quando apenas a geometria da molécula neutra é otimizada. Outro parâmetro eletrônico aqui considerado é a diferença de energia (ΔEH-L) entre o orbital molecular ocupado de mais alta energia (HOMO) do DNA e o orbital molecular desocupado de mais baixa energia (LUMO) do carcinógeno. Segundo a teoria de ressonância nao-sincronizada das ligaçoes covalentes (RVB) desenvolvida por L. Pauling,19 a transferência de elétron do DNA para o carcinógeno leva à formaçao de uma ligaçao química covalente entre essas espécies (Figura 3).
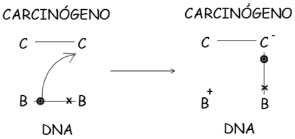 Figura 3. Ressonância nao sincronizada: C representa a espécie carcinogênica e B a base do DNA
A RVB considera dois tipos de ressonância: a sincronizada, como aquela amplamente conhecida no caso da ressonância do benzeno onde uma ligaçao é transferida sincronizadamente com outra, e a nao-sincronizada, onde apenas uma ligaçao é transferida, resultando na transferência de elétron de um átomo para outro. É intrigante o fato de que, embora Pauling tenha explicitado essas duas ressonâncias em sua formulaçao original da teoria da ressonância e tenha utilizado a nao-sincronizada para explicar diversos fenômenos, somente a ressonância sincronizada tenha se popularizado entre os químicos. Em diversos trabalhos que temos realizado também mostramos a utilidade da ressonância nao-sincronizada para explicar fenômenos como magnetismo, supercondutividade, catálise, estabilidade molecular e outros.13 No caso presente da ressonância nao-sincronizada envolvendo o carcinógeno e o DNA, o descritor ΔEH-L é uma medida da interaçao entre essas espécies. Valores baixos da ΔEH-L indicam que a interaçao será mais efetiva. Vale a pena destacar que este modelo de interaçao já foi aplicado para outras moléculas carcinógenas conhecidas.12-17 Um esquema de orbitais moleculares da interaçao carcinógeno-DNA é mostrado na Figura 4, onde se representa a transferência de elétron do HOMO da guanina para o LUMO do carcinógeno. Dentre as bases nitrogenadas do DNA, a guanina é a que apresenta o menor valor da energia de ionizaçao (energia do HOMO mais elevada), fato que justifica a preferência dos carcinógenos por esta base.12
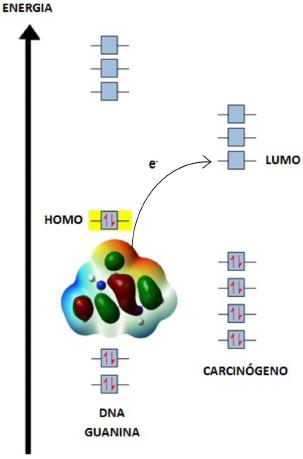 Figura 4. Modelo de transferência de elétron DNA/Guanina (HOMO) à Carcinógeno (LUMO)
Conforme mostrado na Figura 5, a densidade de carga negativa na guanina é mais pronunciada entre o oxigênio (O16) e o nitrogênio (N7). Com base nos cálculos DFT/BLYP 6-311++G(d,p), o oxigênio apresenta uma maior densidade eletrônica (com carga de Mulliken -0,308), sendo portanto o sítio provável da interaçao do carcinógeno, com a quebra da ligaçao do grupo carbonila.
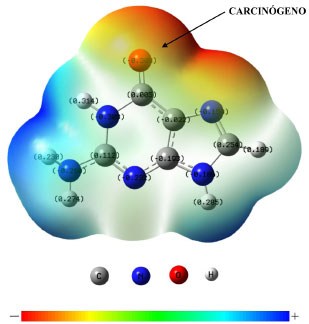 Figura 5. Mapa do potencial eletrostático e distribuiçao de cargas da guanina. Azul indica a densidade de carga positiva e vermelho a negativa
A diferença de carga entre o O16 da guanina e o átomo mais positivo no sítio de ataque do carcinógeno, aqui denominada atraçao eletrostática carcinógeno-DNA, é outro descritor selecionado para a presente análise estatística. O Δq é um indicador da facilidade de aproximaçao do agente eletrofílico e o DNA para a transferência do elétron. Quanto mais elevada for a atraçao eletrostática do átomo mais positivo do carcinógeno e o O16 guanina, maior será a facilidade para transferência do elétron e para formar uma ligaçao química entre estas espécies. Os dois outros descritores que completam a lista utilizada na ACP sao: o logaritmo do coeficiente de partiçao (LogP) e momento de dipolo elétrico (µ). Ambos estao relacionados com a capacidade do carcinógeno em ultrapassar a membrana celular e atingir o núcleo. O LogP descreve a razao das concentraçoes do composto em dois meios líquidos imiscíveis em equilíbrio (água e octanol), sendo que quanto maior o valor de LogP, maior a afinidade com a regiao hidrofóbica da membrana. Em relaçao ao momento de dipolo, quanto menor o seu valor, maior será a permeabilidade do composto na membrana celular. Os valores do LogP foram calculados utilizando a versao do software ALOGPS 2.1.20 É preciso lembrar que numa análise estatística nao é necessário um grande número de descritores, mas sim o maior número possível de elementos no universo de análise. Em nosso caso, iremos analisar um total de 21 compostos, incluindo o carbendazim, seus metabólitos e os compostos controle. Foram utilizadas substâncias nao carcinogênicas (água, glicose e glicerol), carcinógenos conhecidos (benzopireno, tetracloreto de carbono, aflatoxina-B1, dimetilnitrosamina, 2-naftilamina e 2-acetilaminofluoreno) e conhecidas substâncias protetoras antioxidantes: resveratrol na forma ionizada (resveratrol-H), acetilsalicilato e ascorbato. Todas as moléculas foram desenhadas com o software GaussView 5.0 e os cálculos computacionais de modelagem molecular foram efetuados com o software Gaussian 09.21 Nestes cálculos utilizamos a Teoria do Funcional da Densidade (DFT) em nível BLYP, que combina o funcional de troca proposto por Becke22 para correçao da energia com o funcional de correlaçao desenvolvido por Lee, Yang e Parr.23 O conjunto de funçoes de base utilizado foi o 6-311++G(d,p). Para verificar a adequaçao do método BLYP/6-311++G(d,p) no cálculo das propriedades aqui analisadas seria necessário realizar uma comparaçao com dados experimentais. Entretanto, estes dados sao muito escassos para os compostos controle e inexistentes para os metabólitos do carbendazim, o que dificulta uma boa caracterizaçao por esta via (de toda forma, observamos uma boa concordância com alguns valores disponíveis, como por exemplo, para o resveratrol encontramos, µ = 14,4 D e LogP = 2,9, enquanto os respectivos valores experimentais sao, µ = 14,7 D e LogP = 3,0).24,25 Uma alternativa que utilizamos para analisar a adequaçao do cálculo DFT foi realizar cálculos semi-empíricos com o modelo AM1, que em geral é bem parametrizado para reproduzir dados experimentais para o tipo de moléculas aqui analisadas (para o resveratrol encontramos, µ = 15,0 D e LogP = 3,1). Veremos que ambos os níveis de cálculo levam a resultados semelhantes na análise estatística da carcinogenicidade do carbendazim e seus metabólitos. Tal concordância é uma indicaçao a favor da confiabilidade dos cálculos químico-quânticos.
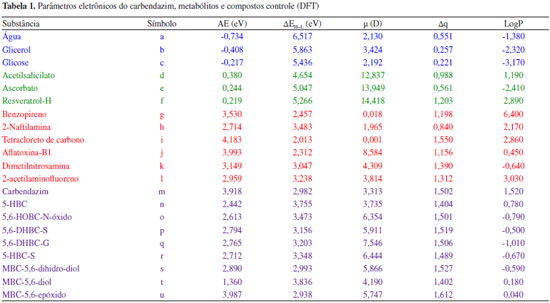
RESULTADOS E DISCUSSAO A Tabela 1 apresenta os parâmetros eletrônicos obtidos por cálculos DFT para o carbendazim, seus metabólitos e para os compostos controle.
A primeira componente principal (PC1) é resultado da combinaçao linear das cinco variáveis calculadas (AE, ΔEH−L, µ, Δq e LogP). A PC1 foi composta por 61,39% da variância total, enquanto a segunda componente principal (PC2) foi composta por 19,95% da variância total, totalizando para as duas componentes principais 81,34% da variância total. Como mais de 50% dos resultados foi elucidado pelos 1º e 2º eixos, a correlaçao é claramente explícita.
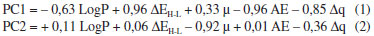
A Equaçao 1 da primeira componente principal (PC1) e a Equaçao 2 da segunda componente principal (PC2) permitem verificar as variáveis que mais contribuem para identificar o potencial carcinogênico dos compostos investigados. Os resultados da PC1, com maior peso para AE, ΔEH-L, Δq e LogP, e PC2 com maior peso para a variável m, separaram de forma clara no gráfico os três grupos de compostos (Figura 6): nao-carcinógenos, carcinógenos e protetores.
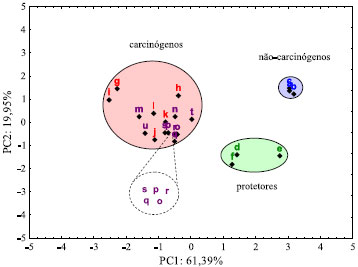 Figura 6. PCA dos descritores eletrônicos do carbendazim, metabólitos e compostos controle (DFT)
Carbendazim e seus metabólitos têm parâmetros próximos aos dos compostos cancerígenos aqui utilizados e sao, portanto, classificados como potencialmente cancerígenos com base nesse modelo. Na análise comparativa dos resultados, é possível afirmar pela posiçao do carbendazim (símbolo m) e o metabólito MBC-5,6-epóxido (símbolo u) na Figura 6, que estes compostos apresentam o maior potencial carcinogênico, uma vez que se encontram bem à esquerda da PC1. Compostos à esquerda (valores negativos) da PC1 têm alta AE, contribuindo com maior peso (96%) para o potencial carcinogênico. Também apresentam elevados valores de Δq (85%) e LogP (63%). Pode ser visto na Tabela 1 que o carbendazim apresentou um maior valor para o LogP, tendo uma correlaçao inversa com o momento de dipolo elétrico. Os outros metabólitos do carbendazim estao agrupados muito próximos na Figura 6, indicando que possuem um potencial carcinogênico muito semelhante. Os compostos nao-carcinógenos (em azul) e protetores (em verde) na Figura 6 estao deslocados para a direita (valores positivos) da PC1, com elevados valores de ΔEH-L. Ainda na Figura 6, vemos que dentre o grupo de substâncias protetoras, o resveratrol possui um momento de dipolo elétrico maior, o que o desloca para mais baixo na Figura 6 (valor negativo na PC2). A Figura 7 mostra o resultado da ACP utilizando dados dos cálculos semi-empíricos AM1, que igualmente aos resultados DFT, separa os três tipos de compostos analisados. A variância total para as duas componentes principais é de 80,53%, muito próxima do valor obtido para os cálculos DFT (81,34%), explicitando claramente a correlaçao entre os descritores da carcinogenicidade do carbendazim e seus metabólitos. Tal como no resultado DFT, com AM1 a PC1 fornece maior peso para EA, ΔEH-L e µ, e a PC2 para µ e Δq, que assim separam de forma clara os três grupos de compostos: nao-carcinógenos, carcinógenos e protetores.
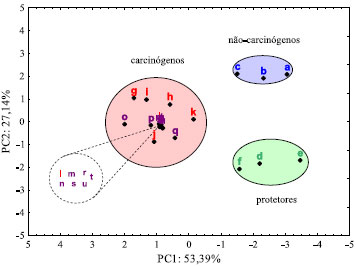 Figura 7. PCA dos descritores eletrônicos do carbendazim, metabólitos e compostos controle (AM1)
Apesar dos poucos dados na literatura sobre a carcinogenicidade do carbendazim, estudos em animais apontam que ele pode prejudicar o sistema hepático, afetar a produçao de hormônios causando anomalias da diferenciaçao sexual e da reproduçao (sistema endócrino), provocar alteraçoes cromossômicas com anomalias do número de cromossomos nas células, tanto em testes in vitro, como in vivo, trazendo danos à molécula do DNA (efeitos mutagênicos) e perturbar o desenvolvimento embrionário ou fetal (efeitos teratogênicos/embriotoxicidade).26 Estudos recentes relatam que a toxicidade do carbendazim em ratos é capaz de afetar o aparelho reprodutor masculino com anomalias na formaçao dos espermatozoides, diminuiçao da fertilidade e atrofia testicular do epidídimo (toxicidade testicular reprodutiva).6,8 Assim, podemos concluir que nossos resultados para o carbendazim sao compatíveis com os efeitos relatados acima. Quanto aos metabólitos do carbendazim, nao foi possível localizar na literatura evidências de suas atividades carcinogênicas (assim também como nao localizamos valores experimentais de momento de dipolo elétrico, afinidade eletrônica e coeficiente de partiçao). No entanto, os parâmetros eletrônicos para estes metabólitos apresentaram similaridade aos carcinógenos conhecidos, mostrando assim a importância dos resultados obtidos nesse estudo para uma política baseada no princípio da precauçao.
CONCLUSAO Com base numa análise estatística de parâmetros eletrônicos obtidos por cálculos de química quântica, o fungicida carbendazim e seus metabólitos sao indicados como potencialmente carcinogênicos. Dado o risco para a saúde humana, principalmente para os trabalhadores agrícolas que estao mais expostos a este composto, seria recomendável a limitaçao do uso desta substância já que, de acordo com a legislaçao brasileira, sao proibidos o registro de agrotóxicos com potenciais mutagênicos e/ou carcinogênicos.27 O presente estudo apresenta assim mais um exemplo da importância de modelos teóricos proporcionados pela química quântica para a identificaçao de espécies com atividades carcinogênicas.
AGRADECIMENTOS A Fundaçao de Amparo à Ciência e Tecnologia de Pernambuco (FACEPE) e ao CENAPAD-PE.
REFERENCIAS 1. Kupper, K. C.; Corrêa, F. E.; Azevedo, F. A.; Silva, A. C.; Sci. Hortic. 2012, 134, 139. 2. http://www.fda.gov/downloads/Food/GuidanceRegulation/UCM292266.pdf, acessada em Janeiro 2014. 3. http://www4.anvisa.gov.br/base/visadoc/CP/CP[20903-1-0].PDF, acessada em Janeiro 2014. 4. http://www.epa.gov/pesticides/factsheets/chemicals/carbendazim_ra.pdf, acessada em Janeiro 2014. 5. Michael, A.; Irene, A. Em Handbook of Preservatives; Taft, A., eds.; Synapse Info Resources: New York, 2004, p. 319. 6. Hidetaka, M.; Toshihiko, Y.; Masatoshi, N.; Taijiro, O.; Kiminobu, G.; Nobuhiro, H.; Hajime, N.; J. Clin. Endocrinol. Metab. 2004, 145, 1860. 7. Escalada, J. P.; Pajares, A.; Gianotti, J.; Massad, W. A.; Bertolotti, S.; Amat-Guerri, F.; Garcia, N. A.; Chemosphere 2006, 65, 237. 8. Lee, J.; Hong, W.; Yao, W.; Mark, G.; Steve, D. W.; J. Pharm. Sci. 2003, 92, 161. 9. Muthuviveganandavel, V.; Muthuraman, P.; Muthu, S.; Srikumar, K.; J. Toxicol. Sci. 2008, 33, 25. 10. http://www.apvma.gov.au/products/review/docs/carbendazim_prf_human_health.pdf, acessada em Janeiro 2014. 11. Yu, G.; Guo, Q.; Xie, L.; Liu, Y.; Wang, X.; Toxicol. Ind. Health. 2009, 25, 41. 12. Leao, M. B. C.; Pavao, A. C.; Espinoza, V. A. A.; Taft, C. A.; Bulnes, E. P.; J. Mol. Struct.: THEOCHEM 2005, 710, 129. 13. Pavao, A. C.; Taft, C. A.; Guimaraes, T. C. F.; Leao, M. B. C.; Mohallem, J. R.; Lester, W. A.; J. Phys. Chem. A. 2001, 105, 5. 14. Pavao, A. C.; Soares Neto, L. A.; Ferreira Neto, J.; Leao, M. B. C.; J. Mol. Struct.: TEOCHEM 1995, 337, 57. 15. Leao, M. B. C.; Pavao, A. C.; Int. J. Quantum Chem. 1997, 62, 323. 16. Leao, M. B. C.; Pavao, A. C.; J. Mol. Struct.: TEOCHEM 2001, 539, 297. 17. Bedor, G. N. V.; Morais, R. J. L.; Cavalcanti, L. S.; Ferreira, J. V.; Pavao, A. C.; Sci. Total Environ. 2010, 408, 6281. 18. Elizabeth, C. M.; James, A. M.; Cancer Cytopathol. 1981, 47, 1055. 19. Pauling, L. C.; J. Solid State Chem. 1984, 54, 297. 20. Tetko, I. V.; Tanchuk, V. Y.; J. Chem. Inf. Comput. Sci. 2002, 42, 1136. 21. Frisch, M. J.; Trucks, G. W.; Schlegel, H. B.; Scuseria, G. E.; Robb, M. A.; Cheeseman, J. R.; Scalmani, G.; Barone, V.; Mennucci, B.; Petersson, G. A.; Nakatsuji, H.; Caricato, M.; Li, X.; Hratchian, H. P.; Izmaylov, A. F.; Bloino, J.; Zheng, G.; Sonnenberg, J. L.; Hada, M.; Ehara, M.; Toyota, K.; Fukuda, R.; Hasegawa, J.; Ishida, M.; Nakajima, T.; Honda, Y.; Kitao, O.; Nakai, H.; Vreven, T.; Montgomery, J. A., Jr.; Peralta, J. E.; Ogliaro, F.; Bearpark, M.; Heyd, J. J.; Brothers, E.; Kudin, K. N.; Staroverov, V. N.; Kobayashi, R.; Normand, J.; Raghavachari, K.; Rendell, A.; Burant, J. C.; Iyengar, S. S.; Tomasi, J.; Cossi, M.; Rega, N.; Millam, N. J.; Klene, M.; Knox, J. E.; Cross, J. B.; Bakken, V.; Adamo, C.; Jaramillo, J.; Gomperts, R.; Stratmann, R. E.; Yazyev, O.; Austin, A. J.; Cammi, R.; Pomelli, C.; Ochterski, J. W.; Martin, R. L.; Morokuma, K.; Zakrzewski, V. G.; Voth, G. A.; Salvador, P.; Dannenberg, J. J.; Dapprich, S.; Daniels, A. D.; Farkas, Ö.; Foresman, J. B.; Ortiz, J. V.; Cioslowski, J.; Fox, D. J.; GAUSSIAN-09; Revision D.01; Gaussian, Inc., Wallingford CT, 2009. 22. Becke, A. D.; J. Chem. Phys. 1993, 98, 5642. 23. Lee, C.; Yang, W.; Parr, R. G.; Phys. Rev. B: Condens. Matter Mater. Phys. 1988, 37, 785. 24. Lou, B.; Wu, P.; Hou, C.; Cheng, F.; Chen, J.; J. Pharm. Biomed. Anal. 2014, 94, 99. 25. Leopoldini, M.; Russo, N.; Toscano, M.; J. Agric. Food Chem. 2006, 54, 3078. 26. Talal, A. Z.; Atef, M. A.; Riv. Eur. Sci. Med. Farmacol. 2011, 15, 413. 27. http://www.planalto.gov.br/ccivil_03/leis/l7802.htm, acessada em Janeiro 2014. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access