Artigo
|
|
| Biodegradação bacteriana de compostos organoclorados Bacterial biodegradation of organochloride compounds |
|
Mariana Consiglio Kasemodel; André Luiz Meleiro Porto; Marcia Nitschke*
Departamento de Físico-Química, Instituto de Química de São Carlos, Universidade de São Paulo, 13560-970 São Carlos - SP, Brasil Recebido em 18/03/2014 *e-mail: nitschke@iqsc.usp.br Due to their recalcitrant nature, organochlorides are already found in environment and the search for alternatives to eliminate these compounds such as biodegradation using native microorganisms is of great interest. A screening trial to select environmental bacteria able to degrade DDD, PCP and dieldrin was conducted. Among 14 isolates, the soil bacteria Pseudomonas aeruginosa L2-1 showed the highest tolerance to increasing concentrations of the organochlorides and was selected for further studies. Biodegradation was assessed in liquid medium, varying the concentrations of glucose and the presence of rhamnolipids (RL). The best medium for the occurrence of biodegradation of the compounds contained 0.5% glucose, giving approximately 50% yield after three days of incubation. Results showed that the biodegradation rates of the organochlorides by P. aeruginosa L2-1 were greater at low concentrations of glucose and in the presence of rhamnolipids. INTRODUÇAO A qualidade da produçao agrícola sempre foi comprometida devido ao surgimento de formas de vida indesejáveis, tais como insetos e ervas daninhas, tornando-se necessário o uso de compostos específicos para o controle destas espécies. Em 2008, o Brasil alcançou a liderança do mercado consumidor de defensivos agrícolas, com investimentos de US$ 7 bilhoes e aplicaçao de 986,5 mil toneladas de produtos.1 Em 2009, seu uso no país atingiu 1 milhao de toneladas, o equivalente a 5,2 kg por habitante brasileiro.1 Os organoclorados incluem os derivados clorados do difenil etano (que inclui o DDT, seus metabólitos DDE e DDD, e o metoxicloro); o hexaclorobenzeno (HCB); o grupo dos hexaclorocicloexanos (α-HCH, β-HCH, δ-HCH, ϒ-HCH ou lindano); o grupo dos ciclodienos (aldrin, dieldrin, endrin, clordano, nonacloro, heptacloro e heptacloro-epóxido), e os hidrocarbonetos clorados (dodecacloro, toxafeno, e clordecona).2-4 A maioria dos organoclorados é enquadrada como substâncias tóxicas persistentes (STP), estas substâncias compreendem as bifenilas policloradas (PCB), os hidrocarbonetos policíclicos aromáticos (PAH), o hexaclorobenzeno, o aldrin, o dieldrin, o endrin, o p,p' -DDT, o p,p' -DDE, o p,p' -DDD, os hexaclorocicloexanos, o endossulfan, o heptacloro e o pentaclorofenol.5 O uso dos organoclorados iniciou com a introduçao do diclorodifeniltricloroetano (DDT) que devido a sua pronunciada propriedade inseticida, juntamente com baixa solubilidade em água e alta persistência no meio ambiente, propiciou resultados notáveis favorecendo a sua rápida disseminaçao.6 O DDT foi utilizado no combate aos mosquitos transmissores de malária e também foi aplicado na pele de soldados, durante a segunda guerra mundial, para combater piolhos que transmitiam tifo.7 O uso excessivo de organoclorados e sua difícil degradabilidade levaram a um acúmulo destes compostos no meio ambiente e nos seres vivos, portanto, o poder residual considerado como qualidade positiva desses compostos tornou-se um sério problema ambiental e de saúde pública.8 Devido a sua natureza tóxica e recalcitrante, muitos organoclorados como aldrin, dieldrin, endrin, toxafeno, mirex e heptacloro, além do DDT, tiveram seu uso proibido em diversos países, entretanto no Brasil o DDT ainda é utilizado em situaçoes de emergência para combate ao mosquito da malária,7 e nos Estados Unidos o pentaclorofenol (PCP) tem seu uso permitido como conservante de madeiras.9 Mesmo após a maioria dos organoclorados terem sido banidos, estes ainda sao encontrados na natureza, e em alguns casos metabólitos como DDD e dieldrin (derivados de DDT e aldrin) sao relatados. A presença de DDT foi detectada em peixes da costa brasileira,10 em leite materno na regiao amazônica11 e em solo contaminado no Mato Grosso.12 Estudos realizados na China apontaram a presença de PCP em leite materno e em sedimentos do rio Pearl Delta13 mesmo após seu uso ter sido banido no país há vários anos. A presença de organoclorados também esta associada a acidentes em plantas de produçao industrial e ao descarte inadequado como ocorrido com o PCP em Cubatao5 e com dieldrin e endrin em Paulínia,14 no estado de Sao Paulo. A biorremediaçao é uma alternativa de baixo custo para reduzir a concentraçao de organoclorados acumulados no meio ambiente. Além de possibilitar o tratamento in situ, reduzindo gastos com o transporte do material contaminado, a biorremediaçao permite o tratamento em áreas de preservaçao ambiental e de resíduos considerados de difícil degradaçao.15 Agências ambientais como a CETESB nao permitem o uso de micro-organismos exógenos ao ambiente para fins de biorremediaçao, ou seja, é importante isolar e caracterizar micro-organismos diretamente de áreas impactadas. Além disso, para tornar processos de biorremediaçao mais eficazes, faz-se necessário selecionar micro-organismos capazes de degradar eficientemente a molécula alvo, o que possibilita a aplicaçao direta dos micro-organismos ou de suas enzimas na degradaçao dos poluentes. O objetivo deste trabalho foi selecionar micro-organismos capazes de degradar os organoclorados dieldrin, PCP e DDD e estudar os efeitos da presença de nutrientes sobre a biodegradaçao.
PARTE EXPERIMENTAL Reagentes Os compostos DDD na mistura dos isômeros, 2,2'-bis(o-clorofenil)-1,1-dicloroetano e 4,4'-bis(p-clorofenil)-1,1-dicloroetano; pentaclorofenol (PCP) e dieldrin foram adquiridos da Sigma-Aldrich. Todos os organoclorados foram dissolvidos em dimetilsulfóxido (DMSO) e adicionados aos meios de cultura previamente esterilizados. O ramnolipídio (RL) comercial em soluçao 25% (v/v) foi adquirido de Rhamnolipid Inc (EUA). O RL apresentou concentraçao micelar crítica de 99,0 mg/L e tensao superficial de 29,0 mN/m. Micro-organismos e meios de cultura Foram testados 14 isolados bacterianos provenientes de solo contaminado com hidrocarbonetos16 e isolados de origem marinha obtidos na regiao de Sao Sebastiao, Sao Paulo.17 As bactérias foram identificadas em nível de gênero (marinhas) e em nível de espécie (solo), utilizando-se técnicas convencionais de análise morfológica (microscopia, coloraçao de Gram e aspecto das colônias), caracterizaçao bioquímica e tipagem molecular. Os micro-organismos foram armazenados em freezer a -20 ºC em caldo nutriente adicionado de 20% de glicerol. As bactérias foram cultivadas em caldo ou ágar nutriente (Himedia). Para os ensaios de biodegradaçao foi utilizado o meio salino de Robert et al. 18 com a seguinte composiçao (em g/L): 2,0 NaNO3; 2,0 KH2PO4; 2,0 K2HPO4; 0,5 MgSO4. 7H2O; 0,1 KCl; 0,01 FeSO4.7H2O; 0,01 CaCl2; 7,5 × 10-7 H3BO3; 1,0 × 10-9 CuSO4.5H2O; 7,7 × 10-7 MnSO4.H2O, 5,0 × 10-6 Mo7(NH4)6.O24.H2O e 9,0 × 10-7 ZnSO4.H2O. O meio foi modificado pela adiçao de glicose e ramnolipídios, conforme a Tabela 1, para verificar a influência destes na biodegradaçao. O pH foi ajustado para 7,0 ± 0,1 e os meios de cultura foram esterilizados em autoclave a 121 ºC durante 20 minutos.
Seleçao das bactérias: ensaios de tolerância aos organoclorados O inóculo bacteriano foi preparado a partir de culturas estoques mantidas a -20 ºC, que foram transferidas para placas contendo ágar nutriente e incubadas por 24 horas a 30 ºC. Uma alíquota da cultura bacteriana (24 h) foi adicionada à soluçao de NaCl 0,86%, ajustando-se a absorbância da suspensao para 0,100 ± 0,01 (610 nm) que corresponde a uma populaçao de aproximadamente 108 UFC/mL, obtendo-se assim o inóculo bacteriano padronizado. Os testes de crescimento na presença dos compostos foram realizados em tubos de ensaio contendo 5 mL de caldo nutriente adicionados de 5, 10, 20, 50 e 100 mg/L de DDD, PCP e dieldrin individualmente. Após a adiçao de 0,5 mL da suspensao bacteriana padronizada, os tubos foram deixados em repouso em temperatura ambiente (aproximadamente 30 ºC) durante 24 horas, e em alguns casos, quando nao houve crescimento, durante 48 horas. Os ensaios foram realizados em duplicata e para cada concentraçao foi feito um controle abiótico (sem bactéria). Cultivos sem o organoclorado foram utilizados como controle para comparar o crescimento bacteriano na ausência deste. O crescimento bacteriano foi acompanhado por medidas de absorbância (turbidez) em 610 nm, utilizando-se o controle abiótico em cada concentraçao como branco. Ensaios de biodegradaçao Preparo do inóculo O inóculo bacteriano de foi preparado a partir de culturas estoques armazenadas a -20 ºC, que foram transferidas para placas contendo ágar nutriente incubando-se a temperatura de 30 ºC por 24 horas. Uma alíquota da cultura foi transferida com alça de inoculaçao para erlenmeyer de 125 mL, contendo 50 mL de caldo nutriente incubando-se a 30 ºC e 150 rpm, durante 8 horas, para que a cultura atingisse o final da fase exponencial de crescimento. A cultura resultante foi submetida à centrifugaçao (8.000 g) por 15 minutos. O sobrenadante foi descartado e o sedimento celular suspendido com soluçao de NaCl 0,86%. A amostra foi centrifugada novamente, nas mesmas condiçoes. A biomassa bacteriana foi diluída com soluçao salina, de tal forma a obter a absorbância de 0,400 ± 0,01 (610 nm), que corresponde a uma populaçao de 109 UFC/mL. Biodegradaçao em meio líquido Os testes de biodegradaçao foram realizados em erlenmeyer de 125 mL, contendo 50 mL de meio salino18 modificado de acordo com a Tabela 1 e 1 mL (2%) da suspensao bacteriana preparada conforme item anterior. Os compostos foram dissolvidos em DMSO e adicionados na concentraçao de 50 mg/L (2,5 mg/50 mL). Os frascos foram incubados em agitador rotatório a 150 rpm e 30 ºC. Para cada tempo de incubaçao, um controle negativo (meio de cultura e organoclorado) foi incubado nas mesmas condiçoes para monitorar perdas abióticas. A cada intervalo amostras foram retiradas, procedendo-se as determinaçoes analíticas descritas a seguir. Determinaçoes analíticas Extraçao e quantificaçao dos organoclorados Amostras (50 mL) do meio de cultura foram submetidas a centrifugaçao (8.000 g, 15 min). As células (pellet ) e o sobrenadante resultantes foram separados e submetidos à extraçao com acetato de etila (3 × 50 mL). Os extratos orgânicos foram reunidos, adicionados de Na2SO4 anidro e filtrados em algodao. Após a filtragem a amostra foi submetida à secagem em evaporador rotativo a vácuo. O extrato foi analisado em cromatógrafo a gás (Shimadzu GC2010plus) com detector de ionizaçao por chama (GC/FID) equipado com coluna DB5 fundida com sílica (J&W Scientific 30 m × 0,25 mm × 0,25). A temperatura do forno foi programada para 90 ºC, elevando-se a taxa de 10 ºC/min até atingir 270 ºC, quando foi mantida por 7 minutos. A temperatura de injeçao foi de 250 ºC; a razao de fracionamento da amostra para injeçao foi 1:5 e nitrogênio foi utilizado como gás de arraste.19 Determinaçao do número de células viáveis A populaçao bacteriana foi quantificada em cada amostra a partir de diluiçoes sucessivas e contagem em placa utilizando o método da gota.20 Determinaçao de glicose Foi determinada pelo método enzimático glicose oxidase/peroxidase (GOD/POD) utilizando kit comercial (LaborLab). Determinaçao da tensao superficial (TS) e diluiçao micelar crítica (CMD) Amostras do meio de cultura foram submetidas à centrifugaçao (8.000 g, 15 min) para remoçao das células e o sobrenadante utilizado para a determinaçao da TS em tensiômetro automático (Sigma 700 - KSV Instruments) pelo método do anel de Du Nöuy. A CMD foi determinada por meio da diluiçao do sobrenadante em água 1:10 (CMD-1) procedendo-se a determinaçao da TS das amostras diluídas.16 Os ensaios de tolerância aos organoclorados foram realizados em duplicata e expressos como média de duas repetiçoes independentes. Os demais ensaios foram realizados em triplicata e expressos como média de três repetiçoes independentes.
RESULTADOS E DISCUSSAO Seleçao do micro-organismo: ensaios de tolerância aos organoclorados Entre as bactérias testadas quanto à tolerância frente a cada organoclorado, destacaram-se as pertencentes ao gênero Pseudomonas e que foram isoladas de solo.16 Bactérias deste gênero sao conhecidas por sua versatilidade, e como a maioria das linhagens testadas neste trabalho foram isoladas de ambientes contaminados, é possível que estas tenham adquirido maior habilidade de sobreviver em ambientes hostis. Os isolados bacterianos de origem marinha foram previamente identificados como pertencentes aos gêneros Arthrobacter, Bacillus e Micrococcus.17 Estes micro-organismos apresentaram pouco ou nenhum crescimento na presença dos organoclorados e por esta razao, nao foram selecionados para a sequência do trabalho. Comparando-se os resultados obtidos para cada micro-organismo, a bactéria Pseudomonas aeruginosa L2-1 destacou-se por apresentar tolerância a todas as concentraçoes testadas, para os três organoclorados. Observou-se que seu crescimento na presença dos compostos foi inferior em comparaçao ao controle positivo, no entanto, mesmo aumentando-se as concentraçoes dos organoclorados, o crescimento bacteriano se manteve praticamente constante, observando-se decréscimo no crescimento em 50 mg/L de PCP e em 100 mg/L de DDD (Figura 1). O fato da presença dos organoclorados no meio nao influenciar de forma significativa o crescimento do micro-organismo (quando comparado aos outros isolados testados) sugere que esta bactéria apresenta mecanismos para se proteger dos efeitos tóxicos dos organoclorados que podem estar relacionados à degradaçao destes e, por isso, essa linhagem foi selecionada para os ensaios subsequentes.
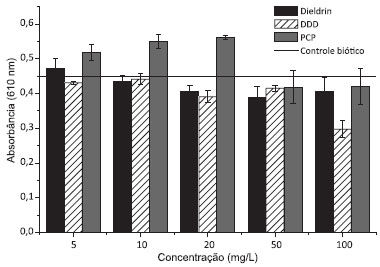 Figura 1. Avaliaçao da tolerância de P. aeruginosa L2-1 aos pesticidas organoclorados
Biodegradaçao dos organoclorados A biodegradaçao dos três compostos foi testada em meio líquido na presença e ausência de glicose como fonte de carbono com o objetivo de avaliar se os organoclorados poderiam ser degradados em um ambiente pobre em nutrientes com privaçao de uma fonte de carbono prontamente assimilável. Também foram preparados ensaios nos quais foi adicionado o biosurfatante ramnolipídio com o objetivo de avaliar seu efeito na biodegradaçao. Este ensaio foi realizado porque se detectou a presença de ramnolipídio no meio quando P. aeruginosa L2-1 cresceu na presença de glicose (meio MS1 e MS2). Biodegradaçao de dieldrin Na presença de glicose (MS1 e MS2) foi observada degradaçao de 49,2% do dieldrin presente no meio após 72 h. A populaçao bacteriana foi maior no meio MS2 apesar da menor concentraçao de glicose, o que pode ter causado o mesmo percentual de degradaçao. Já para os meios sem adiçao de glicose, observou-se maior biodegradaçao e maior crescimento celular em MS4. No meio MS3 apenas 16,9% do dieldrin foi degradado comparado a 33,6% em MS4 portanto, a adiçao de ramnolipídio favoreceu a degradaçao do dieldrin por P. aeruginosa L2-1. Embora o tempo de cultivo tenha sido maior para os meios sem glicose pode-se inferir que este carboidrato é necessário para crescimento intenso das células resultando em maior degradaçao em menor tempo. A Figura 2 apresenta a degradaçao do dieldrin nos meios MS2 e MS4.
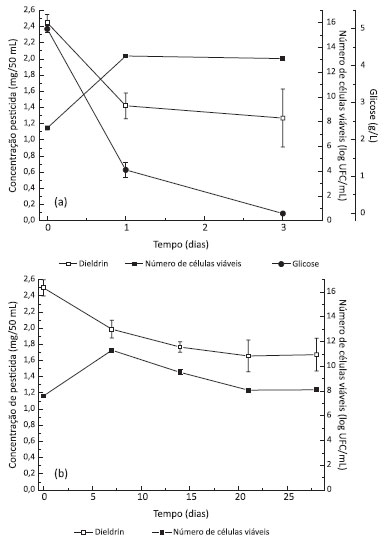 Figura 2. Biodegradaçao de dieldrin por P. aeruginosa L2-1 em (a) meio MS2 e (b) meio MS4
Bandala et al.21 avaliaram a biodegradaçao de dieldrin por uma linhagem de Pseudomonas fluorescens. Os autores utilizaram meio de cultura contendo glicose e peptona e uma concentraçao inicial de dieldrin de 10 mg/L, observando degradaçao de 77,8% após 120 horas. Xiao et al.22 também descreveram a degradaçao de dieldrin por um fungo pertencente ao gênero Phlebia. A concentraçao inicial de dieldrin foi de 9,5 mg/L, em meio de cultura contendo glicose como fonte de carbono e sais de amônio como fonte de nitrogênio. Foi observado que após 28 dias o fungo degradou 50% do dieldrin. Comparativamente, P. aeruginosa L2-1 foi capaz de degradar 25 mg/L de dieldrin em 72 horas, demonstrando a elevada tolerância e potencialidade da bactéria selecionada para a degradaçao deste organoclorado. Biodegradaçao do DDD Com respeito à degradaçao do DDD, observou-se 50% de degradaçao quando o meio MS2 foi utilizado enquanto no meio MS1 23% do DDD foi degradado em 72 horas. Utilizando meio mínimo contendo DDD como fonte de carbono (MS3) observou-se 23,8% de biodegradaçao sendo que a adiçao de ramnolipídios (MS4) promoveu 35% de degradaçao após 28 dias. Assim como observado para o dieldrin, pode-se afirmar que a glicose favorece o crescimento celular intenso e uma maior taxa de biodegradaçao. A Figura 3 mostra a cinética de degradaçao do DDD em meio MS2 e MS4.
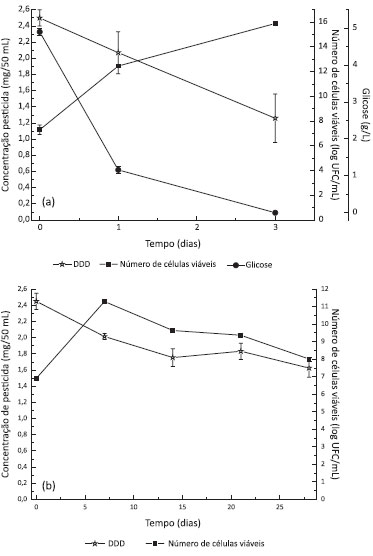 Figura 3. Biodegradaçao de DDD por P. aeruginosa L2-1 em (a) meio MS2 e (b) meio MS4
Poucos trabalhos relatam a biodegradaçao do DDD; entretanto, o fungo marinho Trichoderma sp. foi capaz de degradar 33 mg/L de DDD, resultando em 100% de degradaçao após 14 dias de cultivo.19 Biodegradaçao do PCP O número de células viáveis nos meios contendo PCP foi semelhante ao observado para os outros organoclorados corroborando com o observado nos ensaios de seleçao (Figura 1). Dentre os meios contendo glicose, o MS2 promoveu as melhores condiçoes para a degradaçao de PCP sendo observado um aumento de 5 vezes na degradaçao (50%) quando a concentraçao de glicose foi reduzida à metade (0,5%). Para os meios mínimos (sem glicose) o MS4 mostrou 32% de degradaçao enquanto que na ausência de glicose e RL a degradaçao do PCP foi de 20% após 28 dias, mostrando a influência positiva da presença destas moléculas na biodegradaçao. A Figura 4 mostra a cinética de degradaçao do PCP nos meios MS2 e MS4, nos quais foram obtidos os melhores resultados.
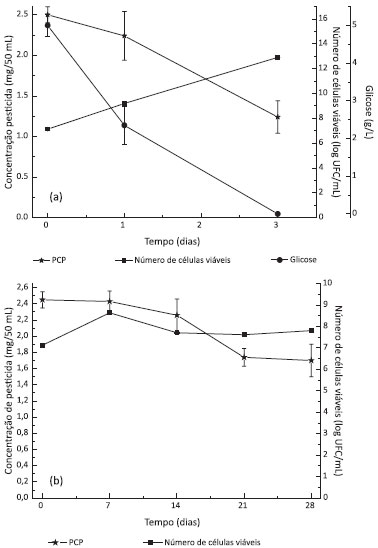 Figura 4. Biodegradaçao de PCP por P. aeruginosa L2-1 em (a) meio MS2 e (b) meio MS4
Wolski et al.23 relataram a seleçao de um isolado de Pseudomonas sp. capaz de utilizar o PCP como fonte de carbono em meio mínimo contendo NaNO3 como fonte de nitrogênio, sendo que 150 mg/L de PCP foram consumidos após 8 dias; enquanto em meio contendo glicose e NH4NO3 um isolado de P. aeruginosa degradou 200 mg/L de PCP (100% de degradaçao) após 5 dias de cultivo.24 A partir dos resultados obtidos, pode-se afirmar que a biodegradaçao dos organoclorados por Pseudomonas aeruginosa L2-1, ocorreu principalmente durante a fase exponencial de crescimento, sugerindo uma correlaçao direta entre o crescimento celular e a degradaçao. A reduçao na concentraçao de glicose presente no meio de cultura (de 1% para 0,5%) aumentou a biodegradaçao dos organoclorados, exceto para o dieldrin, que manteve o mesmo percentual de biodegradaçao. Em meio contendo 0,5% de glicose a degradaçao de PCP (200 mg/L) por um isolado de Pseudomonas sp. foi favorecida, entretanto, os autores afirmaram que em concentraçoes superiores a 0,5% o crescimento da bactéria era suprimido,24 fato que nao foi observado neste estudo. Estas diferenças podem ser relativas às diferentes condiçoes de cultivo, além das características metabólicas de cada micro-organismo, que podem variar mesmo entre indivíduos de uma mesma espécie. Comparativamente aos resultados da literatura, a P. aeruginosa L2-1 selecionada neste trabalho apresentou resultados superiores para a biodegradaçao do organoclorado dieldrin, além de demonstrar potencial para a degradaçao de PCP e DDD. A Figura 5 mostra a comparaçao entre os percentuais de biodegradaçao obtidos nos diferentes meios utilizados.
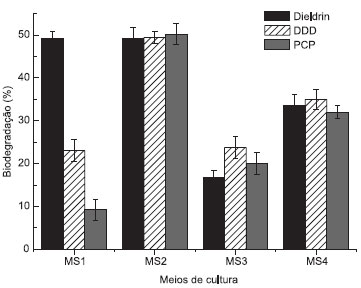 Figura 5. Percentual de biodegradaçao dos organoclorados por Pseudomonas aeruginosa L2-1, MS1-MS2: 3 dias de incubaçao, MS3-MS4: 28 dias de incubaçao
Influência dos ramnolipídios na biodegradaçao Algumas espécies de Pseudomonas sao capazes de produzir glicolipídios contendo ramnose, também chamados ramnolipídios (RL). Quando cultivados em meio líquido, espécies de P. aeruginosa produzem uma mistura de dois tipos de ramnolipídios chamadas de: mono-ramnolipídios, consistindo de um grupo ramnosila e dois grupos β-hidroxidecanoila e di-ramnolipídios, consistindo de dois grupos ramnosila e dois grupos β-hidroxidecanoila. Os ramnolipídios, quando excretados no meio de cultura, reduzem a tensao superficial do meio para valores menores de 30 mN/m, a tensao interfacial em sistemas água/óleo de 43 para valores inferiores a 1 mN/m e apresentam CMC de aproximadamente 100 mg/L.25 Observou-se que a linhagem P. aeruginosa L2-1 produziu compostos tensoativos durante o cultivo nos meios MS1 e MS2, que foram posteriormente identificados como ramnolipídios. Esta observaçao sugeriu que a presença destas moléculas poderia influenciar na biodegradaçao dos organoclorados. Por esta razao foram realizados ensaios em meio mínimo contendo o composto sem adiçao de glicose (MS3 onde nao há biossíntese de RL) e com adiçao de RL comercial (MS4). Observou-se que a adiçao de RL favoreceu a biodegradaçao dos três organoclorados (Figura 5). A adiçao de surfatantes é uma estratégia para o tratamento microbiológico de efluentes ricos em hidrocarbonetos de indústrias e refinarias petroquímicas. O aprisionamento de compostos hidrofóbicos no núcleo micelar é o principal fator responsável pelo aumento na solubilizaçao de defensivos, alcanos, solventes clorados ou hidrocarbonetos aromáticos policíclicos.26 O aumento na biodegradaçao na presença de RL provavelmente se deve à emulsificaçao dos organoclorados, que favoreceu o contato entre as células e as moléculas hidrofóbicas, contribuindo com a sua captaçao em meio aquoso. Paralelamente, o fato de P. aeruginosa L2-1 produzir biotensoativos pode ter influenciado na seleçao prévia deste micro-organismo nos ensaios de tolerância aos organoclorados. A concentraçao de ramnolipídios no meio MS4 foi monitorada por medidas de tensao superficial e diluiçao micelar crítica (CMD) e nao foram observadas variaçoes significativas. Para todos os organoclorados, a tensao superficial inicial do meio de cultura era de 27,2 mN/m e após 28 dias se manteve praticamente constante (27,4 mN/m); a CMD-1 variou de 27,1 mN/m (tempo zero) para 29,8 mN/m (28 dias). Estes resultados permitem excluir a hipótese de que o aumento da biodegradaçao possa ter sido causado pela utilizaçao do RL como nutriente, o que poderia favorecer o crescimento e a consequente degradaçao dos organoclorados. Para verificar se a reduçao na concentraçao dos organoclorados presentes nos meios de cultura estava relacionada à adsorçao das moléculas pelas células sem, no entanto, ocorrer degradaçao, a massa celular bacteriana também foi submetida a extraçao e os extratos obtidos (massa celular e meio líquido) foram reunidos para entao se proceder a análise cromatográfica. No meio MS3 os organoclorados eram a única fonte de carbono presente no meio, entretanto, foi observado incremento na populaçao celular, sugerindo que esses compostos foram utilizados pela bactéria para promover seu crescimento/manutençao tendo como consequência a degradaçao. Nenhum produto intermediário foi detectado nas condiçoes experimentais utilizando CG-MS que permitissem a proposiçao de uma rota de degradaçao dos organoclorados por P. aeruginosa L2‑1. Resultados semelhantes também foram relatados por Ortega et al.,19 que descreveram a degradaçao de DDD por Trichoderma sp. Gc1, entretanto, nenhum composto intermediário da degradaçao foi encontrado.
CONCLUSAO Comparando-se a biodegradaçao na presença e ausência de glicose é evidente que a adiçao deste carboidrato é importante para suprir o metabolismo e crescimento celular levando a um aumento na taxa de biodegradaçao; contudo, P. aeruginosa L2-1 também foi capaz de degradar os organoclorados na ausência de glicose (embora em taxas menores), um fato importante, considerando que em ambientes naturais há, em geral, disponibilidade limitada de nutrientes. A presença de ramnolipídios favoreceu a biodegradaçao de DDD, dieldrin e PCP por P. aeruginosa L2-1. A bactéria selecionada demonstrou potencialidade para degradaçao dos organoclorados e pode ser explorada para aplicaçoes futuras na biorremediaçao.
MATERIAL SUPLEMENTAR Ilustraçoes das estruturas químicas dos compostos organoclorados e dos ramnolipídios utilizados neste trabalho estao disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Os autores agradecem a CAPES pela bolsa concedida e a FAPESP pelo auxílio financeiro.
REFERENCIAS 1. Londres, F.; Agrotóxicos no Brasil: um Guia para Açao em Defesa da Vida, AS-PTA: Rio de Janeiro, 2011. 2. Matolcsy, G. Em Studies in Environmental Science: Pesticide Chemistry; Matolcsy, G.; Nádasy, M.; Andrsika,V., eds.; Elsevier: New York, 1988, cap.1. 3. Menone, M. L.; de Moreno, J. E. A.; Moreno, V. J.; Lanfranchi, A. L.; Metcalfe L.; Metcalfe, C. D.; Arch. Environ. Contam. Toxicol. 2000, 38, 202. 4. Patnaik, P. Em A Comprehensive Guide to the Hazardous Properties of Chemical Substances; Patnaik, P., ed.; John Wiley & Sons: New Jersey, 2003, cap. 47. 5. Almeida, F. V.; Centeno, A. J.; Bisinoti, M. C.; Jardim, W. F.; Quim. Nova 2007, 30, 1976. 6. Konradsen, F.; Van Der Hoek, W.; Amerrasinghe, F. P.; Mutero, C.; Boelee, E.; Acta Trop. 2004, 89, 99. 7. D'Amato, C.; Torres, J. P. M.; Malm, O.; Quim. Nova 2002, 25, 995. 8. Matuo, Y. K.; Lopes, J. N. C.; Matuo, T.; Contaminaçao do Leite Humano por Organoclorados DDT, BHC e Ciclodienos, Editora FUNEP: Jaboticabal, 1990. 9. http://cfpub.epa.gov/ncea/iris_drafts/recordisplay.cfm?deid=230890, acessada em Dezembro 2013. 10. Azevedo e Silva, C. E.; Azeredo, A.; Britto, J. L.; Torres, J. P. M.; Malm, O.; Chemosphere 2007, 67, S48. 11. Azeredo, A.; Torres, J. P. M.; Fonseca, M. F.; Britto, J. L.; Bastos, W. R.; Azevedo e Silva, C. E.; Cavalcanti, G.; Meire, R. O.; Sarcinelli, P. N.; Claudio, L.; Markowitz, S.; Malm, O.; Chemosphere 2008, 73, S246. 12. Villa, R. D.; Dores, E. F. G. C.; Carbo, L.; Cunha, M. L. F. C.; Chemosphere 2006, 64, 549. 13. Hong, H. C.; Zhou, H. Y.; Luan, T. G.; Lan, C. Y.; Environ. Int. 2004, 31, 643. 14. Suassuna, K.; Contamination in Paulínia by Aldrin, Dieldrin, Endrin and Other Toxic Chemicals Produced and Disposed of by Shell Chemicals of Brazil, Relatório técnico Greenpeace Brazil: Sao Paulo, 2001. 15. Yong, R. N.; Mulligan, C. N.; Natural Attenuation of Contaminants in Soil, Lewis Publishers: Boca Raton, 2003. 16. Costa, S. G. V. A. O.; Tese de Doutorado, Universidade Estadual Júlio de Mesquita Filho, Rio Claro, Brasil, 2010. 17. Menezes, C.A.B.; Bonugli-Santos, R. C.; Miqueletto, P. B.; Passarini, M. R. Z.; Silva, C. H. D.; Justo, M. R.; Leal, R. R.; Fantinatti-Garboggini, F.; Oliveira, V. M.; Berlinck, R.G.S.; Sette, L. D.; Microbiol. Res. 2010, 165, 466. 18. Robert, M.; Mercadé, M. E.; Bosch, M. P.; Parra, J. L.; Espuny, M. J.; Manresa, M. A.; Guinea, J.; Biotechnol. Lett. 1989, 1, 871. 19. Ortega, N. O.; Nitschke, M.; Mouad, A. M.; Landgraf, M. D.; Rezende, M. O. O.; Seleghim, M. H. R.; Sette, L. D.; Porto, A. L. M.; Biodegradation 2010, 22, 43. 20. Miles, A. A.; Misra, S. S.; J. Hyg. 1938, 38, 732. 21. Bandala, E. R.; Andres-Octaviano, J.; Pastrana, P.; Torres, L. G.; J. Environ. Sci. Health, Part B 2007, 41, 553. 22. Xiao, P.; Mori, T.; Kamei, I.; Kondo, R.; FEMS Microbiol. Lett. 2011, 314, 140. 23. Wolski, E. A.; Murialdo, S. E.; Gonzalez, J. F.; Water SA 2006, 32, 93. 24. Premalatha, A.; Rajakumar, G. S.; World J. Microbiol. Biotechnol. 1994, 10, 334. 25. Nitschke, M.; Costa, S. G. V. A. O.; Contiero, J.; Process Biochem. 2011, 46, 621. 26. Chrzanowski, L.; Owsianiak, M.; Szulc, A.; Marecik, R.; Piotrowska-Cyplika, A.; Olejnik-Schmidt, A. K.; Staniewski, J.; Lisiecki, P.; Ciesielczyk, F.; Jesionowski, T.; Heipieper, H.; Int. Biodeterior. Biodegrad. 2011, 65, 605. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





