Revisão
|
|
| Química entre a microcamada superficial oceânica e os aerossóis marinhos Chemistry between the sea surface microlayer and marine aerosols |
|
Célia A. Alves*
Centro de Estudos do Ambiente e do Mar, Departamento de Ambiente, Universidade de Aveiro, 3810-193 Aveiro, Portugal Recebido em 11/12/2013 *e-mail: celia.alves@ua.pt The sea surface microlayer (SML), although poorly understood, is important in biogeochemical cycling and sea-air exchanges; it is a source or a sink for a range of pollutants. In this paper, an overview of sampling techniques and the role of SML in biogeochemical cycles and climate is presented. The chemical and biological nature of the ocean surface film and its interaction with atmospheric aerosols are discussed. Special attention is given to organic constituents, gel-like compounds, surfactants, halogenated compounds, and metals. Estimates of air-sea exchange fluxes-with focus on organic carbon, polycyclic aromatic hydrocarbons, and polychlorinated biphenyls-are compiled. In addition, research gaps in the chemical composition of marine aerosols and their relationship with SML are described. INTRODUÇÃO Todos os tipos de aerossol atmosférico contribuem para o "escudo térmico", mas aqueles que são formados sobre os oceanos representam os que têm mais peso nesse efeito climático, uma vez que eles cobrem 70% da superfície terrestre. Os aerossóis marinhos são principalmente gerados por processos de formação de bolhas na superfície do oceano e pela rebentação das ondas nas áreas costeiras. Estes processos são favorecidos pela ação do vento e produzem aerossóis que replicam as características da microcamada superficial oceânica (sea surface microlayer, SML), contendo matéria orgânica, sais inorgânicos e microrganismos semelhantes aos da água do mar. A SML engloba a superfície da água até às primeiras centenas de micrómetros. Os aerossóis formados a partir da SML podem ser transportados por longas distâncias, desempenhando um papel ativo nos ciclos biogeoquímicos.1 A SML apresenta propriedades físico-químicas e biológicas consideravelmente distintas das observadas nas águas subjacentes.2 Atendendo à sua posição única na interface água-atmosfera, a SML é de suma importância para variadíssimos processos biogeoquímicos globais relacionados com o clima. As partículas originadas no oceano desempenham um papel marcante no sistema climático, diretamente ao dispersarem e absorverem a radiação solar, ou indiretamente ao atuarem como núcleos de condensação de nuvens (cloud condensation nuclei, CCN), influenciando assim os tamanhos das gotículas, a cobertura de nuvens e o albedo.3 Nas décadas de 50 a 70 do século passado foram realizadas várias pesquisas para melhor caracterizar o processo de rebentação de bolhas nos oceanos e sua influência nos processos biogeoquímicos.4 O interesse científico ressurgiu no início dos anos 2000 quando novos estudos identificaram componentes orgânicas muito abundantes em aerossóis marinhos de diferentes regiões.5-8 O modo e a magnitude com que a SML influencia a formação e composição dos aerossóis marinhos são ainda mal conhecidos e caracterizados.9,10 Recentemente, foram realizados vários estudos com o objetivo de descrever as interações entre a SML e a atmosfera, os mecanismos de formação dos aerossóis marinhos primários e secundários, os fluxos, os fatores de enriquecimento do spray marinho, a proporção entre frações orgânicas solúveis e insolúveis em água, a composição química dos aerossóis orgânicos e a influência dos aerossóis nas propriedades microfísicas das nuvens e no clima. Os estudos que recaem sobre a SML, além de permitirem compreender os efeitos das transferências de substâncias químicas e organismos entre a hidrosfera e a atmosfera, são também fundamentais para avaliar o papel da matéria orgânica nas transformações fotoquímicas e biológicas na superfície oceânica e o impacto de poluentes antropogénicos nas cadeias alimentares e nos ciclos reprodutores das espécies marinhas.11 Além disso, a SML tem sido associada a perturbações dos fluxos de gases biogénicos, tais como o metano, na interface oceano-atmosfera,12 provavelmente como consequência da atividade microbiana na superfície oceânica.13 O objetivo global deste manuscrito é captar a atenção da comunidade científica para a importância da SML numa panóplia de processos climáticos e biogeoquímicos, focando sobretudo o seu papel na produção de aerossóis marinhos. Os processos de formação desses aerossóis a partir da SML, a sua composição e os seus potenciais efeitos são apresentados e discutidos. São também expostas as questões científicas em aberto.
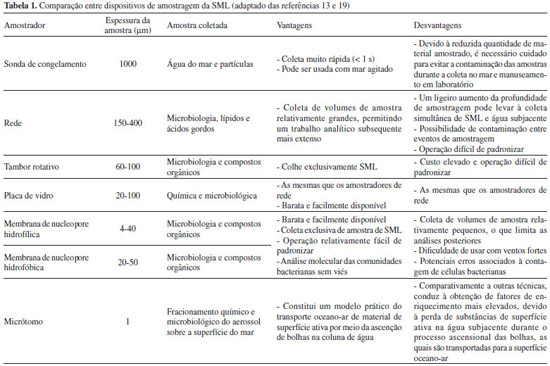
TÉCNICAS DE AMOSTRAGEM DA SML A SML pode ser classificada como um micro-habitat constituído por várias camadas, as quais podem ser distinguidas pelas suas propriedades ecológicas e físico-químicas. Foi proposto que uma espessura de 60 µm poderia ser utilmente utilizada para estudar as propriedades físico-químicas da SML,14 enquanto que, dependendo dos organismos alvo e das características ecológicas, a adoção de uma espessura até 1000 µm seria mais vantajosa. Estão disponíveis vários métodos para amostrar a SML, incluindo sondas de congelamento, malhas de rede, placas de vidro, membranas hidrofóbicas (PTFE, politetrafluoroetileno) e hidrofílicas (PC, policarbonato), tambores rotativos e bolhas de micrótomo.15-18 A Figura 1 e a Tabela 1 comparam alguns dessas técnicas de amostragem. A primeira técnica consiste na utilização de uma sonda com nitrogénio líquido na qual a SML e o material particulado são destacados por congelamento rápido a uma profundidade aproximada de 1000 µm por meio de um processo que decorre em menos de 1 segundo.20 A rede consiste numa malha de aço inoxidável que é mergulhada na vertical, posicionada horizontalmente depois de imersa e, por último, levantada através da SML.21 A placa de vidro é uma chapa de acrílico ou vidro que facilita a aderência da SML, a qual é imersa verticalmente na corrente líquida. A água aderente à superfície da placa é depois recuperada para um frasco esterilizado, utilizando, por exemplo, um objeto semelhante a um rodo limpa-vidros.22 As membranas hidrofílicas possuem uma película que adere à superfície da água. Depois de deixadas a flutuar à superfície da água, são recuperadas por submersão de recipientes de plástico esterilizados sob elas. Após remoção delicada do filtro e da água subjacente, as membranas são retiradas do recipiente com pinças.23,24 No tambor rotativo, uma grande lâmina de neoprene é pressionada firmemente contra a superfície do cilindro giratório para remover continuamente a película de água aderente.25 A amostragem por processo de micrótomo assenta no fato de as gotículas expelidas das bolhas com diâmetro inferior a 1 mm serem formadas por uma fina película superficial. O rebentamento das bolhas é considerado um processo superficial muito eficaz com resultados semelhantes aos da utilização de um micrótomo.26
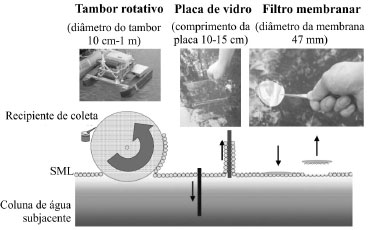 Figura 1. Algumas técnicas de amostragem da SML (Adaptado da referência 18)
Hühnerfuss efetuou a revisão de algumas técnicas de amostragem pouco dispendiosas.27 Recentemente foram realizadas comparações sistemáticas das técnicas de amostragem da SML destinadas à investigação das propriedades microbiológicas,15,28 das especificidades e limitações de diversos amostradores,29-31 e das estratégias de preservação de amostras após coleta.32 A adsorção seletiva de bactérias, causando sobre-estimativas desses microrganismos na SML, têm sido apontada como a principal limitação da amostragem com membranas. Agogué et al. demonstraram que a malha de rede e a placa de vidro são apropriadas para amostrar vírus e bactérias quer totais, quer cultiváveis, e ainda para investigar a atividade bacteriana e a estrutura da comunidade microbiana.29 Num estudo recente foi constatado que as membranas de policarbonato flutuantes são a melhor técnica para detetar diferenças nas estruturas microbianas entre a SML e a água subjacente.15 Tais diferenças não puderam ser observadas em amostras da SML coletadas em placa de vidro ou rede de malha.21,22 As distintas especificidades e eficiências de coleta de cada uma das várias técnicas estão na origem das diferenças observadas.28 As amostragens com placa de vidro ou rede de malha são apropriadas para a caracterização química da SML, mas a sua utilização é difícil quando se pretende estudar parâmetros microbiológicos.33,34 Apesar da existência de diversas técnicas, a caracterização integral das amostras de SML constitui ainda um desafio, devido à heterogeneidade física, química e biológica. Em resultado da movimentação das ondas, a espessura da SML depende da velocidade do vento. Assim, a composição química pode ser rapidamente alterada, sobretudo em áreas onde a tensão superficial é maior. A coleta de amostras de SML reprodutíveis e representativas é também um repto, porque a utilização e operação dos dispositivos de coleta requerem experiência do utilizador, sobretudo com estados de mar mais alterados.35 Além disso, diferentes técnicas conduzem à amostragem de microcamadas de espessura e seletividade variáveis.15,32,34,35 Normalmente, a coleta envolve a imersão e rápida retirada do dispositivo de amostragem, permitindo a obtenção de apenas alguns mL em cada operação. Assim, o período de amostragem pode tornar-se demasiado longo quando se pretende obter um volume de SML adequado para certas análises, como é o caso da determinação de poluentes em concentrações vestigiais. Apesar das técnicas de amostragem mais habituais recorrerem à placa de vidro, rede de malha ou membranas, todas elas apresentam vantagens e desvantagens. A comunidade científica internacional discute ainda a adoção de protocolos de amostragem padronizados que tornem comparáveis os resultados das distintas pesquisas.
PAPEL NOS CICLOS BIOGEOQUÍMICOS E CLIMA SML como biofilme ativo e fonte de bioaerossóis Os aerossóis marinhos são formados primariamente pela erupção das bolhas que ascendem através da SML, representando o principal vetor de transporte quer de constituintes orgânicos e inorgânicos, quer de bactérias e vírus, através da interface oceano-atmosfera.36 A SML foi identificada como uma interface chave a ser estudada para compreender os fluxos e efeitos dos poluentes respiráveis e material particulado do oceano para a atmosfera e vice-versa. Pesquisas recentes indicam que os efeitos biológicos da SML e a magnitude de transferência de energia e material entre a água do mar e a atmosfera podem ter sido largamente subestimados. Apesar de alguns estudos dispersos em vários campos da oceanografia, ainda não se tem uma perceção global sobre o papel da SML na concentração e dispersão de poluentes através dos aerossóis marinhos. Pouco se sabe, por exemplo, sobre os tempos de vida dos microrganismos patogénicos na água do mar, embora trabalhos recentes tenham evidenciado que estes possam permanecer viáveis no ambiente aquático por períodos bastante mais longos (dias a meses) do que anteriormente se pensava.37 Apesar do estresse provocado pela radiação ultravioleta (UV) às bactérias patogénicas, a matriz orgânica da SML pode representar um escudo protetor para estes microrganismos. Sabe-se que as bactérias podem ser 103-105 mais abundantes na SML do que nas águas subjacentes.13 A matéria orgânica particulada e dissolvida pode estar até 1000 vezes mais enriquecida na SML com relação aos primeiros centímetros de coluna de água imediatamente abaixo.38 Uma nova bolha pode rapidamente coletar moléculas orgânicas dissolvidas, tais como surfactantes naturais, e matéria particulada em suspensão durante a ascensão na coluna de água. Durante a subida, os poluentes dissolvidos podem ser eliminados da coluna de água por interações hidrofóbicas ou iónicas que atuam na superfície externa da bolha envelhecida. Uma vez chegadas à interface oceano-ar, as bolhas rebentam, ejetando gotículas com o material químico e microbiológico coletado que irão constituir novos aerossóis na atmosfera (Figura 2).39
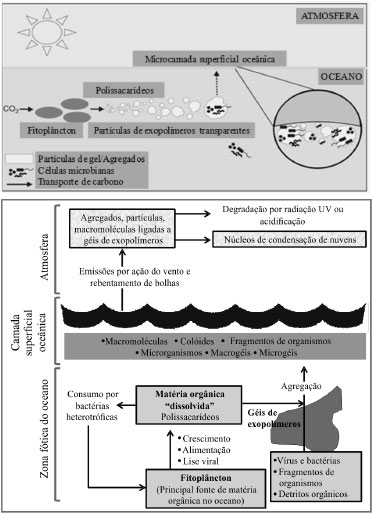 Figura 2. Formação de partículas orgânicas a partir do oceano (Adaptado das referências 40 e 41). O fitoplâncton é a fonte primária de matéria orgânica no oceano. Durante o seu crescimento, predação por outros organismos e lise viral gera ou exsuda formas de carbono orgânico, designadas globalmente por matéria orgânica dissolvida, embora alguns constituintes coloidais não sejam verdadeiramente solúveis. Os géis exudados pelo próprio fitoplâncton, ricos em polissacarídeos, agregam as pequenas moléculas orgânicas (e.g. proteínas, peptídeos, aminoácidos), detritos orgânicos, microalgas, bactérias e vírus. Estes agregados são ejetados na atmosfera por rebentamento de bolhas
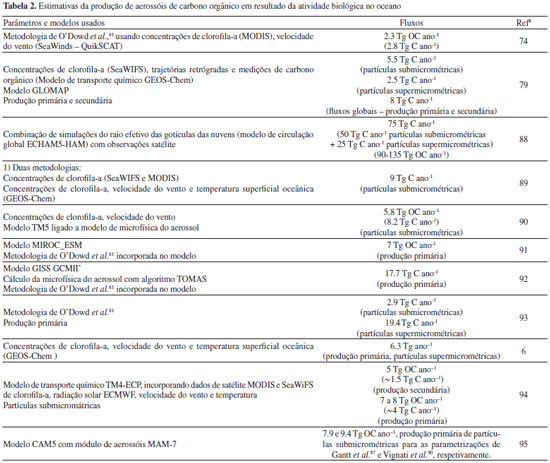
As elevadas concentrações de substâncias dissolvidas, tais como aminoácidos e carbohidratos, podem constituir um suporte para o crescimento das bactérias na SML.42,43 Esta suposição é comprovada pelas elevadas atividades enzimáticas observadas na SML,44,45 indicativas de que a matéria orgânica é um constituinte utilizável pelos microrganismos altamente concentrado na microcamada superficial.46 No entanto, as baixas eficiências de crescimento bacteriano na SML sugerem que o bacterioneuston (comunidade bacteriana presente na SML) contém apenas biomassa celular e que esta não cresce significativamente.47 Outros estudos, nos quais foram descritos aumentos das taxas de respiração bacterianas e diminuição da produtividade do bacterioneuston na SML, corroboraram esta observação.28,48 O envolvimento direto do bacterioneuston nas trocas gasosas oceano-ar tem sido comprovado experimentalmente utilizando caixas flutuantes in situ ou tanques laboratoriais.12,49 Foram observadas eficiências de crescimento bacteriano semelhantes na SML e nas águas subjacentes. Porém, as taxas de respiração bacteriana são bastante superiores na SML, o que sugere um possível controlo pela comunidade bacteriana dos fluxos O2/CO2 através da interface.47 Esses estudos também enfatizaram a complexidade das trocas gasosas oceano-ar e a necessidade de uma abordagem multidisciplinar. A variabilidade temporal e espacial da SML resulta de fatores atmosféricos e meteorológicos, sucessões temporais (e.g. variações sazonais e estados tróficos), acumulação de substâncias inibidoras (e.g. metais), etc.50-52 A radiação UV, por exemplo, tem sido apontada como um fator influenciador dos ciclos diurnos da matéria orgânica e da produtividade bacteriana na SML.53,54 Igualmente, as concentrações de carbono orgânico particulado e a produtividade bacteriana na SML têm sido relacionados com a velocidade do vento.52 Contudo, esses fatores não explicam completamente os padrões de atividade do bacterioneuston.47,55 A dispersão do material da interface pelo vento, em combinação com gradientes de tensão superficial, representa um mecanismo único que garante o transporte do bacterioneuston (e dos seus componentes químicos e biológicos) ao longo de grandes distâncias, independentemente da velocidade e direção seguidas pela água subjacente.56 Por outro lado, a SML pode também atuar como uma espécie de armadilha para o material orgânico e inorgânico alóctone transportado através da atmosfera. Comparativamente com a SML e as águas subjacentes, os aerossóis marinhos são ainda mais enriquecidos em bactérias e vírus. Esses aerossóis incluem o material orgânico, metais, bactérias e vírus coletados pelas bolhas.57 Nalgumas regiões, o enriquecimento nos aerossóis em relação às águas subjacentes pode ser até 3 ordens de magnitude.58 Assumindo uma concentração média de bactérias nas águas superficiais marinhas de 4.2×106 cm-3 e fatores de enriquecimento variáveis de 15 a 100, o fluxo de emissão para a atmosfera pode variar de 200 a 1000 células bacterianas m-2 s-1. Estes valores conduzem a estimativas globais de emissão entre 30 e 600 Gg ano-1, embora cálculos mais especulativos cheguem a valores de 10 Tg ano-1.59 O número de vírus no oceano foi estimado em 1030. A cada segundo, ocorrem aproximadamente 1023 infeções virais, as quais representam uma causa maioritária de mortalidade em inúmeros organismos aquáticos, desde o pequeno camarão até à gigantesca baleia.60,61 Ao contrário do que sucede com outros microrganismos, não há métodos universais para a determinação de vírus. Até ao advento das técnicas moleculares, apenas os vírus viáveis podiam ser determinados. Esses aspectos, associados ao facto de que vários fatores ambientais provocam a sua inativação, têm contribuído para a inexistência de estimativas de fluxos de emissão oceano-atmosfera.62 Apesar de não ser possível prever a magnitude, há inúmeras evidências científicas que indicam que os vírus marinhos interferem com os ciclos de carbono, representando um componente biótico chave que deve ser considerado nos modelos climáticos globais.63 Trabalhos anteriores sugerem que os endósporos bacterianos e os esporos de fungos podem ser transportados e percorrer distâncias intercontinentais.57 Por outro lado, aerossóis não marinhos originados em África atravessam o oceano Atlântico, transportando microrganismos e poluentes até às Caraíbas.64,65 Vários estudos mostraram que os aerossóis marinhos possuem tamanho suficiente para conter micróbios e outras partículas orgânicas, podendo permanecer suspensos na atmosfera durante semanas e ser transportados a centenas de km das fontes.66-68 Existem evidências de que algumas bactérias marinhas se mantêm viáveis durante a aerolização (transferência de microrganismos para aerossóis) e o transporte do oceano para as zonas costeiras (200 m em direção ao interior, coletadas 30 m acima do nível do mar), apesar da exposição a radiação UV, alterações na temperatura e salinidade e outros fatores de estresse.58 Como esses resultados foram obtidos com placas e, dado que apenas uma pequena fração das bactérias marinhas viáveis cresce em meios de cultura, é provável que o número de bioaerossóis tenha sido largamente subestimado. O transporte de microrganismos viáveis em aerossóis marinhos pode representar um enorme risco para a saúde humana, particularmente em áreas metropolitanas costeiras.57 A descarga de águas residuais domésticas ou pecuárias em regiões costeiras introduz microrganismos na água do mar, os quais mantêm a patogenicidade após formação de bioaerossóis respiráveis.57 Infeções bacterianas e virais comuns, associadas ao transporte de aerossóis marinhos, podem contribuir para o aumento da morbilidade.38 Apesar da Organização Mundial de Saúde estabelecer limites para as concentrações de microrganismos nas águas costeiras, não há qualquer diretriz para os níveis de bioaerossóis patogénicos na atmosfera.69 Uma das substâncias que pode ser libertada para a atmosfera a partir de cianoboctérias marinhas é a β-N-metilamino-L-alanina (BMAA), uma potente neurotoxina, mesmo em baixas concentrações, associada a doenças como o Alzheimer. Atendendo à importância das florações de cianobactérias nos corpos de água, tais como as geradas pela deposição de poeiras ricas em ferro nos oceanos Pacífico e Atlântico, é necessária uma análise mais ampla da produção de BMAA em ecossistemas marinhos.70 A toxicidade dos aerossóis marinhos não está apenas relacionada com a presença de microrganismos patogénicos, mas também com constituintes químicos originários da água do mar (e.g. surfactantes e NaCl), cujo transporte para regiões costeiras pode desencadear potenciais efeitos nocivos em animais e vegetação.71,72 Foram, por exemplo, observadas lesões foliares em várias espécies de pinheiros mediterrâneos em resultado da exposição a aerossóis marinhos. Constatou-se que concentrações de cloro superiores a 2 mg g-1 folha (peso seco) desencadeiam o aparecimento de lesões. No entanto, os efeitos da exposição só se manisfestam se, simultaneamente, as concentrações de surfactantes na água do mar que origina os aerossóis excederem 30 mg L-1.73 Caracterização e papel dos compostos orgânicos e inorgânicos Carbono orgânico primário e secundário Os aerossóis orgânicos são ubíquos na atmosfera marinha. Tendo em conta a extensão dos oceanos, facilmente se percebe a importância que os aerossóis marinhos têm na atmosfera à escala global.7,74 As partículas marinhas desempenham um papel primordial no sistema climático quer diretamente ao dispersarem e absorverem a radiação solar, quer indiretamente ao atuarem como CCN.74 Até recentemente, a investigação focou apenas o sulfato como principal espécie do aerossol marinho,75,76 mas nos últimos estudos foram detetadas concentrações de carbono orgânico (OC) muito expressivas em várias regiões oceânicas, e especialmente em áreas de elevada produtividade biológica.8,77-80 Os modelos globais subestimam o OC, sobretudo durante os períodos de bloom de plâncton, alturas em que os níveis previstos podem ser menosprezados num fator de 5-20.8,79,81 Por exemplo, quando se registram extensos florescimentos de plâncton, no Atlântico Norte, a contribuição orgânica para o aerossol marinho chega a representar 63%. No inverno, quando o plâncton se encontra menos ativo, a fração orgânica no aerossol decai para 15%.8 As concentrações de aerossol orgânico na camada limite marinha (marine boundary layer, MBL), embora tipicamente variando de 0.2 a 0.5 µg m-3,82 podem atingir valores de 3.8 µg m-3 na costa atlântica da Irlanda em períodos de eflorescência algal,83 onde, em média, 80% do material carbonáceo está diretamente ligado às emissões do plâncton.84 As correlações estatisticamente significativas observadas entre as concentrações de carbono orgânico e dados extraídos de imagens de satélite da cor do oceano sugerem uma fonte marinha para o OC relacionada com a atividade biológica.85 Os resultados de múltiplos estudos quer ambientais, quer laboratoriais, indicam que as concentrações de clorofila-a, carbono orgânico dissolvido (DOC) e carbono orgânico particulado (POC) podem ser usadas como indicadores indiretos da fração mássica de matéria orgânica no aerossol associado ao spray marinho.4,8,80,82 A maior parte das parametrizações recentes das emissões de aerossol marinho orgânico primário utilizam a clorofila-a para estimar a fração orgânica desses constituintes atmosféricos ou para determinar a magnitude das emissões.79,81,86,87 As diferentes estimativas dos fluxos anuais globais do OC marinho são bastante discrepantes, variando de 2.8 a 78 TgC ano-1 (Tabela 2). A faixa alargada reflete as elevadas incertezas associadas às quantificações dessas emissões e as diferentes metodologias aplicadas (partículas submicrométricas versus partículas submicrométricas e supermicrométricas, fontes primárias versus primárias e secundárias, etc.). Vários pesquisadores adotaram a metodologia de O''Dowd et al.,81 com ou sem adaptações, usando funções que combinam a fração orgânica e inorgânica do aerossol. As estimativas são realizadas recorrendo a concentrações de clorofila-a fornecidas por satélite e velocidades do vento. A validação das estimativas é feita com medições pontuais de OC e spray marinho. Apesar das discrepâncias de resultados dos vários trabalhos, uma conclusão consensual foi produzida: a magnitude desta emissão é comparável (ou superior) à emissão de OC associada à utilização de combustíveis fósseis e, a sua inclusão em modelos globais, aumenta em pelo menos 20% as emissões totais de OC. A inserção desta fração orgânica em modelos de simulação da formação de nuvens pode aumentar a concentração das gotículas em 15%, tornando-as numa componente importante nos modelos climáticos.8
Uma perceção global das fontes e composição da fração orgânica dos aerossóis marinhos é necessária para avaliar os seus impactos no clima.96 A composição química em função do tamanho das partículas é um dos parâmetros chave para definir as propriedades do aerossol marinho com influência na dispersão ou absorção da radiação. Várias medições de campo documentaram a presença de matéria orgânica em partículas individuais,97 e a significativa contribuição das espécies orgânicas para a massa do aerossol fino na MBL remota.98 Porém, o papel dos compostos orgânicos nos aerossóis marinhos de áreas remotas, apesar de reconhecido como potencialmente importante,99,100 continua a apresentar inúmeras incertezas, devido sobretudo à falta de medições quantitativas da composição para os diferentes tamanhos granulométricos. Além disso, apesar de vários estudos terem focado a ocorrência de compostos individuais ou de classes de compostos, a caracterização detalhada da matéria orgânica nos aerossóis marinhos continua indisponível.101-105 Os aerossóis orgânicos marinhos podem ser subdivididos em aerossóis orgânicos primários (POA) e aerossóis orgânicos secundários (SOA) (Figura 3). O precursor de SOA mais conhecido é o dimetil sulfeto (DMS), produzido biologicamente no oceano.96,106 O SOA marinho é originado a partir de compostos orgânicos voláteis biogénicos (BVOCs) emitidos pelo fitoplâncton e/ou por transformações químicas de componentes primários ou secundários na fase condensada.106 Estas complexas transformações podem ocorrer à superfície das partículas,107,108 na fase aquosa,109,110 ou ainda envolver etapas adicionais na fase gasosa, nas quais os componentes orgânicos semivoláteis são oxidados formando novos produtos condensáveis.106 Os compostos emitidos pela SML podem participar em eventos de formação de novas partículas via nucleação de clusters estáveis de 0.5-1 nm de tamanho. Tais clusters podem crescer para maiores tamanhos por meio de processos de condensação/coagulação.7 A formação de aerossol orgânico marinho a partir de processos de nucleação que geram nanopartículas frescas (5-25 nm) tem sido constatada em áreas costeiras na costa oeste da Irlanda,111 ou na costa este da Austrália.112,113 O ácido metanosulfónico (MSA), que resulta da oxidação atmosférica do DMS, é um componente bem conhecido do SOA marinho.107,108,114-117 Outros mecanismos de formação envolvendo diferentes precursores, tais como o isopreno biogénico, foram recentemente sugeridos.115,118-120 Porém, uma fração mássica ainda muito significativa da matéria orgânica no aerossol marinho continua por desvendar. Muitos outros constituintes adicionais do SOA continuam por inventariar. Os aerossóis orgânicos marinhos são influenciados não só pelas emissões oceânicas primárias e por precursores de SOA, mas também pelo transporte de longa distância de emissões continentais. Assim, além da complexidade dos processos de troca oceano-atmosfera, diferentes fontes e origens contribuem para uma compreensão escassa da composição química dos aerossóis orgânicos marinhos. Num recente artigo de revisão, foram analisados os estudos relacionados com a constituição química, distribuição granulométrica, estado de mistura, mecanismos de emissão e impactos no clima dos aerossóis marinhos primários associados ao spray marinho.6
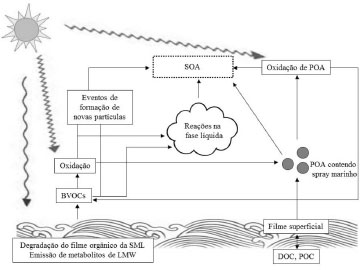 Figura 3. Esquema representativo dos principais caminhos que conduzem à formação de aerossol orgânico primário e secundário na camada limite oceânica (adaptado da referência 106). SOA - aerossol orgânico secundário, POA - aerossol orgânico primário, BVOCs - compostos orgânicos voláteis biogénicos, LMW - compostos de baixo peso molecular, DOC - carbono orgânico dissolvido, POC - carbono orgânico particulado
Grupos orgânicos maioritários Wurl e Obbard efetuaram uma revisão crítica das faixas de concentração e fatores de enriquecimento de poluentes na SML em diferentes regiões oceânicas do globo.121 Os autores mostraram que a SML, por meio do processo de rebentamento de bolhas, pode produzir uma fração significativa do POA que tipicamente compreende séries de oxo-, hidróxi-, metóxi-, ácidos gordos ramificados, ácidos mono-, di- e tricarboxílicos e ainda monoterpenos e açúcares.122 Para associar a presença de vários contaminantes quer na SML, quer nos aerossóis marinhos, com as suas possíveis fontes, podem ser usados marcadores moleculares específicos (e.g. rácios entre concentrações de vários compostos). Alguns dos marcadores propostos são hidrocarbonetos alifáticos e traçadores de poluição por petróleo (e.g. n-alcanos, mistura complexa não resolvida, hopanos, esteranos), hidrocarbonatos aromáticos policíclicos (PAHs) (petrogénicos, pirogénicos e reteno), ftalatos, ácidos dicarboxílicos, ácidos gordos insaturados, compostos homólogos das algas (n-alcanóis, ácidos n-alcanóicos, etc.), coprostanol (traçador de esgotos domésticos), etc.101,104,123-127 As medições de DOC e POC na SML são úteis quer para a obtenção de parâmetros gerais, quer para a normalização das concentrações dos traçadores atrás mencionados. É de suma importância estudar a distribuição do carbono entre as fases dissolvida e particulada de forma a perceber os processos na atmosfera sobrejacente e na coluna de água subjacente. Gagosian et al. identificaram uma série de álcoois, sais de ácidos gordos e ésteres, como traçadores específicos com origem marinha em partículas atmosféricas amostradas numa região pristina do oceano Pacífico.128 Amostras de aerossol oriundas da ilha Terceira no arquipélago dos Açores, localizado no oceano Atlântico a meia distância entre a Europa e a América, revelaram que os constituintes orgânicos secundários contribuíam para 14-37% das concentrações mássicas, enquanto a contribuição primária marinha representava até 19%, sendo ambas as componentes mais representativas no verão.101 No entanto, os autores reconheceram que esta distribuição poderia ter elevadas incertezas associadas, porque alguns compostos usados como traçadores podem, além duma possível origem marinha na SML, provir de outras fontes. A análise detalhada do aerossol açoriano mostrou a presença de uma mistura complexa não resolvida, sugerindo uma possível contribuição petrogénica para as partículas marinhas. Todavia, a ausência de biomarcadores típicos do petróleo (séries de 17α(H)-hopanos e esteranos) pode também indicar uma fonte marinha para a componente de hidrocarbonetos não resolvidos. Além disso, alguns compostos classificados como componentes autóctones (e.g. lípidos fitoplanctónicos) podem, na realidade, resultar de transporte a longas distâncias. Assim, a clarificação destes aspetos requer estudos adicionais com uma abordagem multidisciplinar, combinando a análise da SML com a caracterização simultânea dos aerossóis marinhos. Os avanços recentes das técnicas analíticas permitiram expandir o leque de compostos individuais nos aerossóis com origem marinha, abrangendo constituintes de elevada massa molecular, compostos biogénicos parcialmente oxidados, ácidos gordos e álcoois, aminas e aminoácidos.5,8,57,129-135 Vários estudos recentes têm reportado a presença de aminoácidos livres e combinados nos aerossóis,136-141 mas comparativamente pouco se sabe sobre estes ou outros compostos nitrogenados nos aerossóis marinhos. A fonte mais provável na atmosfera marinha remota é a injeção de materiais proteináceos nos aerossóis de sal marinho durante a sua formação na superfície oceânica.142 O transporte a longas distâncias de emissões por fontes terrestres pode também contribuir para a deteção destes compostos nos aerossóis marinhos. Os aminoácidos podem sofrer fotodegradação na atmosfera dando origem a espécies mais simples, tais como amonião, ácidos carboxílicos e formas oxidadas de enxofre. A presença de compostos oxidados, como a metionina, em água da chuva marinha, foi atribuída, num estudo realizado há mais de duas décadas, a reações mediadas fotoquimicamente dentro das partículas de sal marinho.143 Aluwihare et al. mostraram que os carbohidratos constituem 80% do DOC da água do mar.144 Embora alguns dos carbohidratos possam ser constituintes dos microrganismos, a maioria é representada pelos seus subprodutos ou metabolitos.145 Crahan et al. atribuíram 7-20% da massa orgânica das partículas atmosféricas com origem oceânica a estes carbohidratos marinhos.129 Porém, uma grande parte da fração mássica destes compostos continua por identificar. Os resultados de uma pesquisa realizada durante um cruzeiro científico internacional (International Chemistry Experiment in the Arctic LOwer Troposphere, ICEALOT) em 2008 mostraram que a matéria orgânica constituía 15-47% da massa de partículas submicrométricas coletadas nas atmosferas do Atlântico Norte e do Ártico. A maior parte dos componentes orgânicos consistiam em grupos hidroxílicos (incluindo polióis e outros álcoois), característicos dos sacarídeos, semelhantes aos carbohidratos biogénicos encontrados na água do mar.82 As elevadas percentagens mássicas de grupos orgânicos hidroxílicos medidos no aerossol atmosférico submicrométrico durante o ICEALOT excederam as previamente registradas noutras campanhas, mas foram semelhantes aos níveis observados em partículas marinhas coletadas em mar aberto (sudeste do oceano Pacífico), em regiões costeiras no norte do Alasca (Barrow) e no noroeste da América do Norte (Ilha de Appledore e Chebogue Point). As concentrações mássicas de compostos hidroxílicos com origem oceânica medidas durante o ICEALOT foram também correlacionadas significativamente com os níveis de Na nas partículas submicrométricas e com a velocidade do vento. Os rácios entre material orgânico e Na nessas partículas eram 102-103 mais elevados do que os mesmos rácios na água do mar. Este fato sugere que o processo de rebentamento dos filmes é controlado por fenómenos de superfície e influenciado pelos componentes orgânicos dissolvidos da SML. Quer os componentes orgânicos marinhos, quer o Na, aumentam com o aumento do diâmetro médio do modo de acumulação, indicando possíveis interrelações entre os constituintes orgânicos na superfície do oceano, os aerossóis e as nuvens. Na baia de Jiaozhou, as concentrações de mono-, polissacarídeos, DOC e clorofila-a na SML foram significativamente correlacionadas com os níveis observados nas águas subjacentes. As concentrações mais elevadas de mono- e polissacarídeos foram registradas num período de eflorescência algal no verão. Porém, os fatores de enriquecimento para os sacarídeos foram inferiores nesse período. Temperaturas mais elevadas, radiação solar mais intensa, difusão molecular mais acentuada, produção primária e remineralização podem justificar o decréscimo nos fatores de enriquecimento relativamente a outros períodos. A correlação negativa entre as concentrações totais de carbohidratos dissolvidos nas águas subjancentes e a salinidade é indicativa de que as descargas ribeirinhas em baias intervêm na distribuição dos sacarídeos e, possivelmente, de outros compostos.146 A análise dos mesmos parâmetros em amostras de SML e águas subjacentes coletadas no mar de Bohai (China) permitiram retirar idênticas conclusões.147 A composição molecular orgânica das amostras de aerossol marinho coletado no oceano Ártico durante o cruzeiro MALINA foi caracterizada por cromatografia gasosa/espectrometria de massas. Foram identificados mais de 110 compostos orgânicos individuais, os quais foram agrupados em diferentes classes baseadas na funcionalidade química e nas fontes emissoras desses compostos.96 A classe orgânica dominante foi a dos sacarídeos, seguida pelos traçadores de SOA formados por oxidação de compostos orgânicos voláteis (VOCs), como o isopreno, α-pineno e β-cariofileno. O manitol, um traçador específico de esporos fúngicos no ar, foi detetado como espécie orgânica mais abundante nas amostras. Seguiram-se a glucose, o arabitol e os produtos da oxidação do isopreno (2-metiltetróis). O estudo indicou que as emissões oceano-atmosfera de compostos orgânicos marinhos ou a foto-oxidação de VOCs biogénicos são aspectos importantes que controlam a composição orgânica dos aerossóis marinhos no oceano Ártico. Parece que, durante a estação polar com radiação solar, a atmosfera do Ártico atua como um fotoreator químico influenciado simultaneamente por partículas com origem oceânica e por partículas continentais ou seus precursores com origem nas latitudes médias da Eurasia ou América do Norte.96,119,148,149 Tradicionalmente, o componente mais estudado do SOA na MBL é o MSA resultante da oxidação do DMS. Outros constituintes, como os organossulfatos (ésteres de sulfato C9-C13 de ácidos carboxílicos hidroxilados), podem ser também considerados traçadores de SOA marinho para a oxidação de ácidos gordos insaturados originários das algas marinhas.150 Meskhidze e Nenes sugeriram que a formação de SOA a partir da oxidação de isopreno derivado do fitoplâncton pode afetar a composição química dos CCN marinhos e influenciar o número de gotículas de nuvens.120 Experiências laboratoriais mostraram que os 2-metiltetróis, e os compostos relacionados também resultantes da oxidação do isopreno, podem aumentar os níveis de CCN na atmosfera marinha pristina.151 Medições realizadas a bordo de um navio no Atlântico Sul mostraram que, além das emissões de isopreno, o oceano também pode produzir monoterpenos.152 Porém, estudos de modelagem recentes indicaram que as fontes oceânicas de isopreno e monoterpenos não são significativamente importantes para controlar a produção de aerossóis orgânicos marinhos.79,93,118,153 Embora o fitoplâncton oceânico possa emitir vários tipos de VOCs, sendo o isopreno o componente maioritário, sabe-se hoje que o SOA resultante de fontes marinhas de isopreno representa apenas menos de 10% do total de aerossóis orgânicos marinhos.153 Foi estimado que a produção anual global de SOA marinho com origem no isopreno é minoritário (0.1 Tg ano-1) com relação à produção de aerossóis que resultam da oxidação de DMS (4 Tg ano-1) ou de aminas marinhas (1 Tg ano-1).154 Os compostos de nitrogénio orgânico (ON) são sujeitos a transformações químicas na troposfera, formando produtos que potencialmente podem influenciar as propriedades físico-químicas dos aerossóis atmosféricos.155 Apesar da importância dos ON nos ciclos biogeoquímicos marinhos e do seu papel crítico na atmosfera, as origens e composição química desses compostos nos aerossóis marinhos são quase desconhecidas devido à escassez de estudos.77,139,156 O conhecimento sobre a importância relativa das emissões diretas e a formação secundária dos ON é também ainda muito incipiente. No que se refere aos ON solúveis em água, foram encontradas elevadas concentrações de dimetilamina e dietilamina em aerossóis marinhos submicrométricos coletados no Atlântico Norte, reforçando o papel das alquilaminas como traçador biogénico do SOA.130 Foi também demonstrado que as concentrações de aminas nesse oceano seguem uma padrão sazonal, sugerindo que a produção de ON é provavelmente influenciada pela produtividade primária do fitoplâncton.130,157 Miyazaki et al. constataram que as concentrações médias globais de ON eram duas a três vezes mais altas em aerossóis coletados em regiões oceânicas com produtividade biológica primária mais elevada.77 Medições realizadas na região oeste do Pacífico Norte mostraram que os compostos ON insolúveis em água eram os mais abundantes, representando 55±16% da massa total de compostos nitrogenados nos aerossóis.139 Os resultados indicam que as fontes biológicas marinhas contribuem significativamente para os compostos ON, a maior parte dos quais é constituída por frações insolúveis em água.130,139 Compostos do tipo gel Após um estudo sistemático de dois anos, foi demonstrado que a SML é consistentemente enriquecida em matéria orgânica (OM) de superfície ativa, para velocidades de vento até, pelo menos, 10 m s-1,158 valor que excede em 3.5 m s-1 a velocidade de vento média global no oceano.159 Os maiores enriquecimentos são observados sob condições oligotróficas.158 Enriquecimentos em OM com velocidades de vento até 10 m s-1 foram também observados e confirmados noutros estudos.47,133 Embora com frequência desfeita pelas ondas, a SML é reconstituída rapidamente por meio da ascensão de bolhas de ar que são recobertas com o material disperso da microcamada superficial. Quer em experiências laboratoriais,160 quer de campo,43 foi observada a reconstituição dos filmes superficiais segundos após a disrupção. Borbulhando água do mar dissolvida, Zhou et al. comprovaram a formação de partículas de exopolímeros transparentes (TEP) por meio da agregação de OM dissolvida à superfície de bolhas.161 Isto indica que o rebentamento das ondas pode facilitar a produção de TEP, as quais se acumulam na SML à medida que as bolhas ascendem na coluna de água, formando matrizes de biofilmes do tipo gel à superfície do oceano.162 A hipótese de que a SML é uma camada hidratada do tipo gel, formada por estruturas complexas de carbohidratos, proteínas e lípidos, foi recentemente confirmada ao se descobrir que a SML é enriquecida em TEP.15,162-165 As partículas do tipo gel são redes poliméricas penetradas pela água do mar, cujo tamanho pode variar de 1 nm a alguns mm. As suas propriedades aglomerantes facilitam a agregação de bactérias, outros microrganismos e matéria orgânica (Figura 2). As TEP representam um grupo especial de partículas do tipo gel compostas por polissacarídeos, os quais contêm açúcares acídicos. Os polissacarídeos surgem principalmente a partir de exsudados do fitoplâncton, representando uma fração importante dos compostos da matéria orgânica dissolvida com elevada massa molecular (> 1kDa) na superfície oceânica. Na SML, os polissacarídeos representam aproximadamente 30% da matéria orgânica, enquanto as proteínas contribuem com 16%. As proteínas constituem outra classe de TEP, observável ao microscópio após coloração com azul de Coomassie. Podem servir como substrato para certos microrganismos. Algumas bactérias pelágicas usam as proteínas como fonte de nitrogénio.166 Embora o volume total da SML é pequeno comparativamente com o volume do oceano, na interface ocorrem reações únicas, as quais não ocorrem (ou sucedem a um ritmo muito mais lento) nas águas subjacentes.167 Assim, a SML desempenha um papel importante na diagéneses de carbono na parte superior do oceano. Foi estimado que 200 Tg C se acumulam anualmente na SML, valor equivalente ao da taxa de sedimentação de carbono no fundo do oceano.168 Os biofilmes na interface oceano-atmosfera abrem novas perspectivas de pesquisa no campo dos aerossóis enriquecidos em matéria orgânica. Alguns estudiosos têm apontado as matrizes do tipo gel dos aerossóis marinhos como potenciais formadores de CCN.82,134,169 Foi levantada a hipótese de que o enriquecimento da SML com partículas do tipo gel, o componente primário do biofilmes na superfície oceânica, é a fonte dos aerossóis ricos em gel encontrados na atmosfera do Ártico.134 Porém, as pesquisas que combinem a caracterização simultânea dos aerossóis e da SML de forma integrada continuam a representar um grande desafio. O enriquecimento em compostos orgânicos que ocorrem naturalmente, como os carbohidratos, proteínas e lípidos, altera as propriedades físico-químicas da superfície oceânica, retardando os processos de trocas gasosas.170-172 A SML é uma camada laminar na ausência de turbulência através da qual o transporte gasoso é dominado por processos de difusão molecular lentos. A liberação de um filme artificial de surfactantes no oceano Atlântico confirmou a supressão das trocas gasosas em, pelo menos, 25%, mesmo com ventos fortes (10 m s-1),173 corroborando observações anteriores no Mar do Norte,174 e num túnel de vento posicionado sobre um canal de ondas.170 Frew et al. verificaram que o enriquecimento da OM na SML pode contribuir para a diminuição das velocidades das transferências gasosas.171 A partir de trabalhos laboratoriais foi concluído que as variações sazonais nas velocidades de transferência gasosas são provavelmente devidas às diferenças nas quantidades e composição do material orgânico enriquecido na SML.172 Surfactantes Alguns estudos mostraram que uma variedade de contaminantes naturais e antropogénicos se concentram na SML devido à sua natureza surfactante, propriedades hidrofóbicas, possíveis associações com partículas flutuantes, mecanismos de difusão vertical e processos de remoção de bolhas.71 É de esperar que, na atmosfera, os surfactantes orgânicos, que tipicamente cobrem a superfície das partículas, afetem grande parte das propriedades superficiais dos aerossóis.175 Os surfactantes nos aerossóis podem influenciar a dispersão da luz, alterar a agregação das partículas, ajudar na nucleação das gotículas das nuvens e interagir com os tecidos pulmonares. A ocorrência de matéria orgânica com propriedades tensioativas pode contribuir para um enriquecimento considerável em substâncias hidrofóbicas tóxicas, tais como pesticidas, nas gotículas da neblina. Nos anos sessenta, as substâncias tensioativas foram identificadas como componentes naturais da SML. Estudos posteriores desse tipo de substâncias na água da chuva e nos aerossóis atmosféricos sugeriram que a sua concentração era demasiado baixa para terem qualquer efeito nos processos físicos das nuvens.176 Porém, quando as concentrações são elevadas, como acontece nas pequenas gotículas em crescimento, as substâncias tensioativas podem efetivamente intervir em diversos processos físicos. Quando tal acontece, a tensão superficial das gotículas das nuvens decresce, conduzindo ao aumento da população de gotículas de menores granulometrias.177 Isto pode prolongar o tempo de vida das nuvens, contribuir para um aumento global do albedo e, consequentemente, favorecer o arrefecimento da atmosfera. Tem sido reportado que os surfactantes da SML consistem em compostos de carbonilo de baixo peso molecular produzidos pelos microrganismos. Estes compostos são formados fotoquimicamente a partir da degradação da OM refratária dissolvida (e.g. substâncias húmicas), na SML. Stortini et al. estudaram a concentração de surfactantes orgânicos na camada superficial calculando o Índice de Preferência de Carbonos (CPI), o qual engloba compostos homólogos de C15 a C32.178 Cincinelli et al. reportaram que a OM de natureza surfactante e fluorescente na SML pode formar complexos com alguns compostos hidrofóbicos, como os hidrocarbonetos alifáticos e os PAHs, contribuindo para o aumento da solubilidade desses compostos na água do mar.71 Além do uso e consumo generalizados, a presença de surfactantes pode também estar relacionada com fontes naturais, particularmente com o fitoplâncton. A componente autotrófica das comunidades de plâncton é mais abundante à superfície da zona eufótica, onde as oportunidades para efetuar trocas químicas com a atmosfera são maiores.179 Tais trocas podem ser significativamente influenciadas pela SML. A maior parte dos surfactants naturais é originada a partir dos exudatos do fitoplâncton, os quais contêm proteínas e seus produtos de degradação, uma variedade grande de lípidos, complexos de glicopeptídeos-lípidos-oligossacarídeos e pigmentos que se acumulam na interface marinha.180,181 Foi sugerido um modelo para a composição, estrutura e processamento atmosférico dos aerossóis orgânicos marinhos.168 O modelo, denominado de "micelo invertido", consiste num núcleo aquoso encapsulado por uma monocamada orgânica, hidrofóbica e inerte (Figura 4). Os materiais orgânicos que cobrem as partículas de aerossol são surfactantes de origem biológica. Os autores propuseram um mecanismo químico que engloba o processamento da camada orgânica superficial por reações com radicais atmosféricos. O resultado da exposição de um aerossol orgânico a uma atmosfera oxidante será a transformação de um filme hidrofóbico inerte numa camada hidrofílica reativa e oticamente ativa. Em resultado desses mecanismos, os aerossóis orgânicos processados podem crescer por adição de água e formar CCN, influenciando a transferência radiativa atmosférica. A transferência radiativa pode ser diretamente afetada pelos cromóforos deixados na superfície do aerossol após transformação química. O processamento atmosférico dos aerossóis orgânicos conduzirá à libertação para a troposfera de pequenos fragmentos orgânicos, os quais desempenharão um papel subsequente em processos químicos homogéneos.
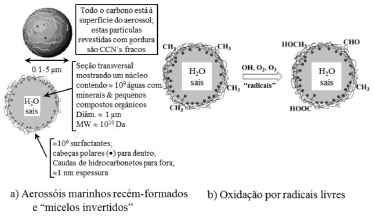 Figura 4. Modelo de micelo invertido proposto por Ellison et al. em que os agentes tensioactivos estão com as suas cabeças polares inseridos no núcleo aquoso iónico e com as suas caudas de hidrocarbonetos hidrofóbicos expostos à atmosfera.168 Adaptado de http://www.colorado.edu/chem/ellison/research/resAerosols.html
Compostos halogenados A produção oceânica de compostos orgânicos bromados de curta duração, tais como o bromofórmio (CHBr3) e o dibromometano (CH2Br2), pelo fitoplâncton e macroalgas tem sido apontada como elo entre a biologia oceânica, a composição da atmosfera e o clima.182-186 Os átomos de bromo, libertados durante a foto-oxidação do bromo orgânico e, na MBL, nas reações heterogéneas no aerossol de sal marinho, participam nos ciclos catalíticos de destruição do ozônio e indiretamente levam à redução da sua formação na troposfera ao restringirem os níveis de óxidos de nitrogénio.182,187 Os compostos halogenados de curta duração e os seus produtos de oxidação podem chegar à estratosfera por meio da rápida convecção a partir da MBL.188 O CHBr3 constitui a principal fonte de bromo orgânico do oceano para a atmosfera. Julga-se que a contribuição de espécies bromadas de curta duração para o bromo total na baixa estratosfera seja da ordem de 20-60%.189-191 Apesar de existirem alguns estudos e revisões sobre compostos biogénicos bromados de curta duração,192,193 ainda persistem inúmeras incertezas acerca das distribuições globais, especialmente devido à variabilidade espacial dos fluxos oceano-atmosfera desses compostos. Alguns modelos assumem uma multiplicidade de parametrizações para as emissões oceânicas de bromo, as quais requerem validação com medições múltiplas e repetitivas no oceano.185,194 Os fluxos oceano-atmosfera de CHBr3 e CH2Br2 foram medidos durante dois cruzeiros nas regiões nordeste e leste tropical do Atlântico, incluindo o sistema de afloramento costeiro africano.182 As saturações e os fluxos oceano-atmosfera desses compostos decrescem geralmente na seguinte ordem: costa > afloramento > plataforma > oceano aberto. Fora das regiões costeiras, são observadas concentrações elevadas (e.g. clorofila-a) na superfície da água do mar. As regiões de afloramento (costeiras e equatoriais) constituem focos de bromocarbonos. Contudo, globalmente contribuem apenas com uma pequena percentagem do total de emissões de CHBr3 e CH2Br2. A partir dos escassos dados obtidos para a linha de costa do Atlântico leste, foi estimado que, globalmente, os oceanos costeiros (profundidade <180 m) contribuem com ~ 2.5 (1.4-3.5) Gmol Br ano-1 de CHBr3, excluindo as influências de fontes antropogénicas, tais como as usinas termoelétricas no litoral. As espécies de iodo são emitidas por fontes marinhas bióticas e abióticas, embora não possam ser excluídas origens em fontes terrestres.195,196 O papel da química do iodo na MBL tem recebido muita atenção nos últimos anos.197-202 Vários iodocarbonos, como o CH3I, CH2I2, CH2ClI, CH2BrI, C2H5I, C3H7I, ou C4H9I, têm sido propostos como precursores de vários processos atmosféricos relacionados com o iodo.195 Porém, medições recentes mostraram que o iodo molecular (I2) é provavelmente a fonte dominante de iodo atmosférico em certas regiões costeiras.197 Durante o dia, as moléculas de I2 são fotolizadas a átomos de I, os quais reagem com O3 formando monóxido de iodo (IO). Uma clara anticorrelação entre o IO e a altura das marés e uma correlação entre o IO e a radiação solar foram observadas em Mace Head, na costa da Irlanda.203,204 Os níveis surpreendentemente altos de óxidos de iodo que têm sido verificados são, em parte, justificados pela descoberta de que uma variedade de iodetos alquílicos (e.g., CH2I2, CH2ICl, CH3I) escapam do oceano, sendo rapidamente fotolizados para formar átomos de I e, dessa forma, IO por meio da reação com o O3.205 Apesar da passagem dos compostos de iodo pelas partículas de sal marinho, as quais devolvem esses compostos à fase gasosa, ajudando a manter as concentrações de IO,202 as fontes de iodetos alquílicos parecem não ser suficientes para justificar os níveis surpreendentes de óxidos de iodo medidos na atmosfera.206 Foi demonstrado que as macroalgas na maré-baixa representam muito provavelmente outra fonte maioritária de emissões atmosféricas de iodo molecular, I2. Verificou-se que essa fonte é a responsável pela produção durante o dia de novas partículas na MBL costeira, explicando também os elevados níveis de óxidos de iodo registrados durante a noite.199 Há agora evidências de que a MBL tem influências na destruição do ozônio, na capacidade oxidativa da troposfera e nos processos de remoção de NOx.195,199 Ultimamente têm também sido discutidos os possíveis efeitos radiativos do iodo atmosférico associados ao seu papel na formação de novas partículas em regiões costeiras.207,208 A formação de novas partículas pela produção fotolítica de compostos condensáveis contendo iodo a partir do diiodometano (CH2I2), emitido por algas, tem sido demonstrada em estudos em câmaras de reação.198,201-211 Isto sugere a existência de mecanismos adicionais para a conversão gás-partícula do ácido sulfúrico formado na foto-oxidação do DMS para o repovoamento do aerossol marinho.212 Com base nesses estudos, foi sugerido que os processos atmosféricos de oxidação de iodocarbonos emitidos por macroalgas conduzem à produção de vapores de iodo condensáveis e à formação de novas partículas. McFiggans et al. demonstraram, pela primeira vez, que as partículas ultrafinas contendo iodo são produzidas por macroalgas intertidais expostas a concentrações ambientais de ozônio.207 Lai et al. estabeleceram a conexão entre espécies contendo iodo, nas fases gasosa e particulada, e grupos funcionais específicos de fitoplâncton.213 O CH2I2 tem sido apontado como o principal precursor do iodo inorgânico reativo, dado que é rapidamente fotolizado, originando átomos de iodo. As reações que se seguem têm sido extensivamente estudadas e usadas nos estudos dos ciclos dos compostos halogenados na MBL.199,202 O radical monóxido de iodo resulta da reação entre os átomos de iodo e o ozônio. A autorreação do IO, e a reação do IO com o radical hidroperoxi (HO2) ou com o dióxido de nitrogénio (NO2), conduzem à formação de espécies de iodo condensáveis. Os produtos dessas reações condensam em embriões supercríticos pré-existentes (clusters termodinamicamente estáveis). Devido ao seu rápido crescimento, quer o tempo de vida relativamente à coagulação, quer a probabilidade de atuarem como CCN, aumentam.207 A absorção de compostos inorgânicos de iodo, tais como HOI e INO3, pelos aerossóis de sal marinho, liberta cloro e bromo para a fase gasosa. Os halogenados são também agentes destruidores do ozônio e os seus átomos e óxidos muito reactivos com certos compostos orgânicos.214 Outro aspecto da química do iodo está relacionado com o fato de que os óxidos de iodo de mais elevado estado de oxidação (e.g. I2O5) condensam rapidamente, o que explica os surtos extensivos de novas partículas observados durante o dia na atmosfera marinha.198 Os estudos de modelagem recentes são razoavelmente consistentes nas previsões de que a depleção do ozônio catalisada pelo iodo pode contribuir para até metade das quantidades destruídas quimicamente na MBL. Porém, as incertezas associadas às características das fontes e aos parâmetros cinéticos contribuem para que os modelos não sejam capazes de reproduzir dados experimentais das espécies reativas de iodo. Os mecanismos de formação de partículas contendo iodo são ainda ambíguos, pelo que as previsões dos modelos devem ser tratadas com cautela.198 As variações atmosféricas observadas para as espécies de iodo podem resultar não só das regiões fonte e abundância e tipo de biomassa, como também de fatores, tais como as trocas oceano-atmosfera, o grau de mistura, a reatividade da atmosfera e a meteorologia.215-217 Metais O enriquecimento em metais na SML é outro exemplo da forma como a microcamada superficial pode influenciar os ciclos biogeocquímicos. Alguns elementos vestigiais (Mn, Fe, Co, Ni, Cu, Zn, Cd, etc.) são micronutrientes essenciais para a atividade biológica, nomeadamente para o crescimento do fitoplâncton. Outros (Al e Pb) são bons traçadores da deposição natural ou antropogénica de aerossóis sobre o oceano. As concentrações de metais na SML variam muito de região para região. Metais como o Cd, Cu, Pb e Zn podem surgir em concentrações inferiores a 0.001 µg L-1 até dezenas ou centenas de µg L-1, quer na fase dissolvida, quer na particulada. Têm sido medidos fatores de enriquecimento com relação às águas subjacentes desde valores à volta de 1 até 65.121 Um dos metais mais extensamente estudado é o ferro. A importância do Fe para a produtividade primária dos oceanos tem sido discutida desde que Moore el al. sugeriram que o input atmosférico pode constituir uma fonte importantíssima do elemento para o biota.218 Foi demonstrado que grande parte do ferro dissolvido nas águas superficiais do Giro do Atlântico Norte e do Mar dos Sargassos resulta do input atmosférico de partículas de aerossol marinho.219 Trabalhos subsequentes indicaram que o ferro atmosférico pode ser o nutriente limitante para a produtividade do fitoplâncton em certas regiões oceânicas onde outros nutrientes maioritários são abundantes.220-223 Foi sugerido que (i) a mistura de poeiras minerais com aerossóis de sulfato/ácido sulfúrico, por meio de processos de coalescência dentro de nuvens, pode constituir um mecanismo de aumento da solubilidade do ferro atmosférico nas gotículas das nuvens ou na precipitação; e que (ii) a redução fotoquímica do Fe(III) a Fe(II) pode representar um mecanismo importante para o aumento da solubilidade do ferro, permitindo que este seja rapidamente libertado para a água da chuva, gotículas das nuvens ou nevoeiro, quando as partículas de aerossol entram em contacto com esses meios líquidos durante o transporte a longa distância sobre o oceano. O input anual de ferro atmosférico para todo o Pacífico Norte foi estimado em ~15-25 × 1012 g.224 Ao longo das últimas décadas o interesse pela deposição atmosférica de metais na superfície oceânica aumentou, sobretudo em tópicos relacionados com tempestades de areia e poeiras minerais.225 Curiosamente, o papel da SML neste contexto tem sido ignorado, embora a biodisponibilidade de metais traço possa ser alterada devido a processos de solubilização ou transformação específicos. Hoffman et al. compararam as taxas de deposição atmosférica com os enriquecimentos em metais traço observados na SML ao longo da costa oeste africana sob influência de intrusões de poeiras do deserto do Saara.226 Os autores concluíram que as taxas de deposição são suficientemente elevadas para explicar os enriquecimentos medidos. Seguiram-se vários estudos sobre o enriquecimento de metais traço na SML, mas sem inclusão de informações detalhadas relativas aos inputs atmosféricos ou às transformações químicas sofridas na microcamada superficial oceânica. Recentemente, foram estimadas as taxas de deposição de vários metais no Mar Negro,227 Pacífico Norte Ocidental,228 e Mar da China Oriental.229 No caso do Fe e do Al, os fluxos diários de deposição podem ascender a centenas ou milhares de µg por m2 de superfície oceânica. Em experimentos com mesocosmos foram avaliados os impactos da deposição de poeira mineral nas concentrações de metais traço dissolvidos (Fe, Al e Mn).230 Uma outra pesquisa relativamente recente sugeriu que os metais traço dissolvidos podem sofrer processos fotoquímicos e de remoção muito complexos.231 Parametrizações para o spray marinho e fluxos oceano-atmosfera Medições diretas de fluxos na interface oceano-atmosfera são importantes para estudos de diagnóstico e prognóstico de mudanças climáticas e monitoramento ambiental. A teoria da similaridade de Monin e Obukhov para a camada limite superficial e as técnicas de medição diretas e indiretas dos fluxos têm constituído a base para estabelecer condições de fronteira necessárias para os modelos de circulação oceânica e atmosférica usados para efetuar previsões meteorológicas e climáticas. Nos últimos anos têm sido desenvolvidas diversas parametrizações para a produção do spray marinho.232-244 Os modelos existentes de emissões de gotículas a partir da superfície oceânica têm por base estudos laboratoriais ou medições de campo.236,237,240-245 É de notar que a determinação precisa das emissões das gotículas pulverizadas a partir da superfície oceânica é de extrema importância para avaliar se essas emissões afetam os fluxos oceano-atmosfera de calor e calor latente.246,247 As "funções fonte" descrevem os fluxos de aerossol de spray marinho (tipicamente a 10 m acima da superfície do oceano), i.e. o número de gotículas produzidas por unidade de superfície oceânica e por unidade de tempo. As medições podem proporcionar fluxos totais (número total de partículas em determinada faixa de tamanhos) ou fluxos espectrais. Estes últimos são expressos em número de gotículas para um conjunto de faixas de intervalos de tamanhos, i.e. µm-1 m-2 s-1.7 As "funções fonte" podem ser traduzidas por uma expressão numérica do tipo dF/dr, onde r representa o raio das partículas, dado que muitas vezes este parâmetro é usado em substituição do diâmetro. É de notar que r pode representar o raio seco, ou seja o raio da partícula de spray marinho para uma umidade relativa de 0%, o raio normalizado para 80% de umidade (r80) ou o raio na altura da formação da partícula (r0). Neste último caso, o raio está associado a uma partícula com a composição da água do mar e com uma umidade relativa em equilíbrio com a superfície oceânica de 97%. Em regra, r0≈2r80≈4rseco. As formulações normalmente usadas para a produção de aerossol têm por base a relação entre a cobertura de espuma nas cristas das ondas (whitecap) e a velocidade do vento, embora outras variáveis, como a salinidade e a temperatura da superfície do oceano, possam também afetar os fluxos.236 Monahan et al. usaram o método whitecap, combinando parametrizações teóricas com a produção de aerossóis de sal marinho por unidade de cobertura de espuma determinada em laboratório.237 Märtensson et al. simularam a formação de bolhas em laboratório, com água do mar sintética. Os pesquisadores efetuaram a determinação dos aerossóis produzidos (0.020-20.0 µm) para diferentes salinidades, temperaturas da água e fluxos de bolhas.236 O número de partículas produzidas por incremento de diâmetro (Dp), unidade de tempo e superfície coberta com espuma (Ф) foi descrito como uma função linear da temperatura da água e uma função polinomial do diâmetro. Combinando Ф com a fração superficial W coberta por espuma (em percentagem), derivaram uma expressão para estimar os fluxos de produção de aerossol marinho primário [dF0/dlogDp=WФ (m-2 s-1)]. Porém, as parametrizações propostas para a fração coberta por espuma em função da velocidade do vento apresentam incertezas significativas, abrangendo duas ordens de magnitude.248 Reid et al., usando uma aeronave, mediram as variações nas concentrações de spray marinho numa coluna atmosférica à medida que ocorria adveção de massas de ar a partir do oceano.249 Mediram também os fluxos de spray marinho gerados pelas coberturas espumosas nas cristas das ondas em condições de estabilidade atmosférica neutra para diversas velocidades de vento. Por outro lado, Leeuw et al. e Clarke et al. basearam as suas parametrizações em medições efetuadas na zona de rebentação.233,250 A maioria das "funções fonte" para estimar a produção de spray marinho foi inferida a partir de técnicas indiretas. Uma das técnicas mais usadas consiste em medir o tamanho médio do espectro granulométrico, assumindo condições de equilíbrio, de tal forma que a produção de spray marinho pode ser estimada a partir da taxa de deposição seca, a qual foi derivada em estudos anteriores.241,251 Porém, essa metodologia mostrou-se inapropriada para partículas pequenas, porque a deposição seca é muito lenta e o tempo de residência dessas partículas na atmosfera excede as escalas temporais associadas à observação de alterações nas concentrações devidas a mecanismos superficiais ou a fenómenos de adveção.252 Petelski e Piskozub, usando um contador ótico de partículas, inferiram uma "função fonte" a partir de medições do gradiente vertical das concentrações de aerossol entre os 8 e os 20 m.253 Os autores compararam os seus resultados com outras "funções fonte", verificando que a produção de sal marinho reportada na literatura é subestimada, até 6 vezes, para a faixa de raios entre 1 e 8 µm. Apesar do método do gradiente possuir uma base física mais robusta do que a técnica do equilíbrio, Andreas questionou a omissão de Petelski e Piskozub da constante de von Kármán (≈0.4) nas equações de estimativa dos fluxos.254 Essa omissão contribui para uma estimativa de fluxos aumentada num fator de 2.5. Por outro lado, o método do gradiente baseia-se na teoria de Monin-Obukhov, a qual ainda não foi validada para aerossóis. O método mais direto, mas desafiador, para medir fluxos turbulentos é o da covariância dos vórtices (Eddy covariance, EC). As concentrações numéricas habitualmente baixas impossibilitam muitas vezes a validação estatística das contagens, problema tanto mais grave quanto maior o tamanho das partículas e resolução das medições.252 A natureza volumosa de muitos instrumentos e a necessidade de os instalar em locais à prova de intempéries torna necessária, muitas vezes, a utilização de longas linhas de amostragem. Isto introduz um desfasamento temporal entre as medições do vento turbulento e do aerossol, perda das flutuações de alta frequência e, possivelmente, das partículas de maiores dimensões nas paredes das linhas de amostragem, sendo necessário estimar funções de correção.252 Por outro lado, a frequência de aquisição para muitos equipamentos é demasiado baixa e a variabilidade turbulenta fracamente captada, o que resulta em subestimativas dos fluxos por EC. Medições diretas dos fluxos de partículas de spray marinho por EC foram recentemente efetuadas para regiões costeiras,255-257 ou para oceano aberto.252,258 Para incluir os efeitos do spray marinho em modelos numéricos é necessário parametrizar com precisão os fluxos superficiais do aerossol - a "função fonte" do spray marinho. Uma revisão extensa e detalhada sobre a formação do aerossol marinho primário e secundário e de algumas "funções fonte" foi recentemente realizada.7 Têm sido propostas muitas parametrizações para a função de geração do spray marinho, baseadas em variadíssimas técnicas de medição.259 Os resultados obtidos com a aplicação das diversas funções podem diferir em 6 ordens de magnitude.260 Contudo, a variabilidade foi reduzida até uma ordem de magnitude, nos estudos mais recentes, para partículas com r80 entre aproximadamente 0.1 e 10 µm.7,255,261 As características dos sensores meteorológicos e bóias, utilizados a bordo de navios para medir os fluxos de momento e calor sobre o oceano, foram extensivamente revisados por Weller et al.262 Uma abordagem tem sido a de estimar os fluxos na interface por unidade de área de espuma, reajustando-os tendo em conta a percentagem de superfície oceânica coberta por essas espumas (W). Por sua vez, W é um parâmetro muitas vezes parametrizado em função da velocidade média do vento. É comum assumir que os fluxos são independentes da natureza e mecanismos de formação das coberturas espumosas. As formulações de Monahan e O''Muircheartaigh são as mais usadas.263 Essas formulações são baseadas nos fluxos de produção de partículas por unidade de área de cobertura com espumas brancas obtidos em laboratório,264 e na relação empírica da fração coberta (W, em %) em função da velocidade do vento:265

na qual u10 é a velocidade do vento 10 m acima da superfície do mar. Muitas parametrizações para W derivam de fotografias e vídeos da superfície oceânica obtidos em torres, aeronaves ou navios. Uma compilação detalhada dos vários estudos pode ser encontrada em Anguelova e Webster.248 Para velocidades de vento < 3 m s-1, a fração da superfície oceânica coberta por manchas de espuma é considerada nula.266 Os fluxos de produção de aerossol por unidade de área coberta com espuma têm sido estimados quer a partir de medições oceânicas, quer a partir de estudos laboratoriais.233,236,245,250,267-272 As vantagens das medições laboratoriais estão relacionadas com a possibilidade de controlo das condições ambientais. Porém, não é fácil simular condições realmente representativas do oceano aberto, tais como ondas bem desenvolvidas e ventos fortes.252 A abordagem mais correta é estimar in situ a produção direta de aerosol a partir das espumas brancas no oceano. No entanto, é difícil efetuar medições em oceano aberto perto da superfície e separar o aerossol gerado pela espuma branca do aerossol presente na atmosfera de fundo.252 Os contadores óticos de partículas têm sido usados para estudar as propriedades físicas dos aerossóis, mas são difíceis de instalar perto da superfície oceânica. Assim, grande parte das medições das concentrações numéricas do spray marinho foi efetuada a 5-25 m acima da superfície oceânica e depois interpoladas para um nível de referência (geralmente a superfície ou 10 m acima do nível médio do mar).252,260 O desenvolvimento tecnológico tem disponibilizado sensores cada vez menores, mais leves e mais baratos, permitindo realizar medições anteriormente impossíveis.273 Foram recentemente efetuadas medições sobre a zona de rebentação para estimar a produção de spray marinho.233,250 As medições na zona de rebentação possibilitam a colocação dos instrumentos em terra firme, mas, por outro lado, podem não ser representativas das espumas brancas observadas no mar alto. O espectro de tamanhos são muito diferentes para bolhas de raio > 50 µm, pelo que, na zona de rebentação, as concentrações numéricas podem ser duas ordens de grandeza superiores às registradas em mar alto.274 Enquanto no oceano aberto o rebentamento das ondas é forçado pelo vento e pela interação onda-onda, o processo na zona de rebentação resulta da interação com o leito do mar. Contudo, alguns pesquisadores observaram que os espectros dos aerossóis produzidos na zona de rebentação e no oceano aberto são similares.259 Norris et al. mediram o espectro do aerossol próximo da superfície de espumas brancas em mar alto, no Atlântico Norte, deduziram fluxos de produção de spray marinho por unidade de área de espuma e efetuaram estimativas dos fluxos médios para essa fonte.252 Grythe et al. efetuaram a revisão de 21 "funções fonte" reportadas na literatura para o spray marinho, algumas das quais são usadas em modelos climáticos, e propuseram uma nova parametrização.244 Dependendo da função usada, as estimativas realizadas variaram de 3 a 70 Pg ano-1. Ao compararem as estimativas com observações em várias estações de monitoramento, os autores concluíram que o melhor ajuste é conseguido quando se considera que a produção de spray de sal marinho é proporcional a u103.5. Uma forte influência da temperatura da superfície oceânica na produção de spray marinho foi também observada. A nova função, que inclui velocidade do vento e temperatura da superfície oceânica, proposta pelos autores, conduziu a estimativas de 9 Pg ano-1, correlacionando-se relativamente bem com as concentrações observadas. Recentemente, foi desenvolvida uma outra "função fonte", combinando medições de concentrações numéricas do aerossol em Mace Head (costa da Irlanda) com fluxos medidos em alto mar pelo método de covariância dos vórtices durante o cruzeiro SEASAW.275 Em vez da típica velocidade do vento a 10 m, a nova função parametriza a produção de partículas em função do número de Reynolds, restringindo, assim, as influências da altura das ondas e da viscosidade do mar, a qual depende da temperatura da superfície oceânica e da salinidade. Embora os valores dos fluxos obtidos com a nova função se situem no limite inferior de outras estimativas recentemente publicadas, ajusta-se bem aos dados experimentais da fração submicrométrica de spray marinho medidos em Mace Head. Muitos modelos à escala global já incorporam as "funções fonte" para a produção de spray marinho.234,276,277 Comparativamente, poucos estudos foram aplicados à escala regional com alta resolução.278 O número limitado de medições da composição química do aerossol limita, no entanto, a validação desses modelos. Fluxos de poluentes orgânicos As parametrizações para estimar os fluxos oceano-atmosfera para poluentes orgânicos, como os poluentes orgânicos persistentes (POPs) (e.g. bifenilos policlorados, PCBs) e PAHs, têm sido diretamente adaptadas dos estudos de transferência de CO2 na interface entre os dois compartimentos. As propriedades físico-químicas específicas desses poluentes tornam, no entanto, necessária a obtenção de dados experimentais que clarifiquem os mecanismos envolvimentos no seu transporte.279 As transferências gasosas através da interface oceano-atmosfera podem ser descritas por um modelo clássico de bicamada,280 o qual tem sido aplicado às trocas de poluentes orgânicos através dessa interface.279,281 O fluxo F (ng m-2 dia-1) do poluente através da interface oceano-atmosfera pode ser determinado a partir do coeficiente de transferência mássica (Kol), que descreve o transporte e o gradiente de concentração entre a mistura e a fase gasosa:

nas quais ctruly representa a concentração do composto químico verdadeiramente dissolvido em água (ng m-3); c* é a concentração do composto químico dissolvido em equilíbrio com a pressão parcial do gás na atmosfera acima (ng m-3); car é a concentração do constituinte químico na fase gasosa (ng m-3); H'' é a constante adimensional relacionada com a constante da Lei de Henry H (Pa m3 mol-1), sendo igual a H/RT; R é a constante dos gases perfeitos (Pa m3 mol-1 K-1); T é a temperatura na interface oceano-atmosfera (K); Kol é o coeficiente de transferência de massa (m h-1); Ka é o coeficiente de transferência de massa através da camada de ar (m h-1); Kw é o coeficiente de transferência de massa através da camada de água (m h-1); 1/Kol é a resistência total à transferência de massa através da interface oceano-atmosfera, a qual é igual à soma das resistências através da camada de ar (1/kaH) e da camada de água (1/kw). O coeficiente de transferência de massa para um composto no ar, Ka,comp (cm s-1), pode ser calculado da seguinte forma:

nas quais M é a massa molar (g mol-1) e u10 é a velocidade do vento (m s-1) a uma altura de 10 m acima do nível do mar. O coeficiente de transferência de massa kw,comp (cm h-1) na água do mar é calculado da seguinte forma:
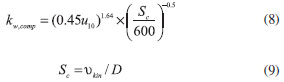
sendo Sc o número de Schmidt, nkin a viscosidade cinemática (cm2 s-1) e D a difusividade (cm2 s-1) da água do mar. As trocas através da interface oceano-atmosfera de compostos orgânicos semivoláteis foram estudadas por He e Balasubramanian em regiões costeiras de Singapura.282 O primeiro cenário estudado foi uma superfície marinha sem cobertura por surfactantes. Todos os PAHs apresentaram fluxos negativos, indicando a transferência desses poluentes da atmosfera para o oceano (absorção líquida). Os fluxos de ΣPAH atingiram valores de -5884.0±2167.6 ng m-2 dia-1. A cobertura da superfície marinha com surfactantes reduziu os fluxos de ΣPAH para valores até -3340.1±1431.7 ng m-2 dia-1. A magnitude dos fluxos de PAHs reportada para Singapura é semelhante à descrita para um lago urbano em Guangzhou, China (-0.01~-21.2 µg m-2 dia-1).283 Quer o porto de Nova Iorque, quer a baía de Raritan (entre Nova Iorque e Nova Jersey) apresentaram fluxos de volatilização para a maioria dos PAHs.284 No porto de Mumbai, foram registrados fluxos positivos para os PAHs de baixo peso molecular, enquanto os compostos de elevado peso molecular produziram fluxos negativos.285 Usando as concentrações de PAHs observadas na água do mar e na SML em regiões costeiras do NW do Mediterrâneo e tendo por base o modelo clássico de bicamada,280 Guitart et al. estimaram os fluxos difusivos entre a superfície oceânica e a atmosfera.279 Os fluxos ar-SML de PAHs totais (Σ15) variaram de 411 a 12,292 ng m-2 dia-1 (absorção) e de -506 a -13,746 ng m-2 dia-1 (volatilização). O transporte de PAHs na fase particulada foi estimado a partir da análise de aerossóis atmosféricos e de armadilhas programadas para capturar material particulado durante o processo de sedimentação. Os fluxos de deposição atmosfera-oceano dos PAHs totais variou de 13 a 114 ng m-2 dia-1 e os fluxos de sedimentação no oceano (nos primeiros 5 m de coluna de água) oscilaram de 184 a 323 ng m-2 dia-1. Os resultados desses estudos indicam que a magnitude e direção dos fluxos através das SML podem ser subestimadas ou sobrestimadas quando ocorre, respetivamente, enriquecimento ou depleção de PAHs por volatilização, se as concentrações nas águas subjacentes são usadas nas equações de trocas gasosas ar-oceano. Esses fenómenos são designados por "efeitos de encapsulamento dos fluxos", i.e., alteração dos fluxos de volatilização ou absorção de um composto químico pelo oceano devido à ocorrência variável de um enriquecimento ou depleção da concentração desse composto na SML. Pensa-se que esses efeitos também ocorrem com os gases de efeito estufa (e.g., CO2, CH4).279 Porém, as grandes inconsistências verificadas nas estimativas de fluxos de PAHs em regiões costeiras, sobretudo devidas às incertezas associadas a vários parâmetros, requerem medições adicionais e outras abordagens experimentais, incluindo um aprimoramento das parametrizações. Em primeiro lugar, o cálculo de fluxos é baseado nos seguintes pressupostos gerais: i) não há perdas de PAHs quer na forma particulada, quer dissolvida (e.g. via degradação, reações fotoquímicas ou transporte advectivo) e ii) existência de condições de estado estacionário. A hipótese de estado estacionário não é inteiramente correta, visto que os parâmetros ambientais são dinâmicos, sofrendo alterações constantes. O uso exclusivo da velocidade do vento para prever a velocidade de transferência apresenta falhas substanciais, originando erros sistemáticos. Por outro lado, o próprio cálculo dos fluxos inclui várias aproximações e simplificações implícitas nos parâmetros utilizados.279 Os fluxos oceano-atmosfera de Σ35PAHs foram estimados para uma área no Mediterrâneo oriental tendo por base os gradientes de concentração medidos em amostras de água do mar e em amostras atmosféricas.286 Os fluxos totais de deposição conduziram a um valor médio de -1940 ng m-2 dia-1. Os valores negativos indicam que o processo dominante é a absorção dos PAHs pela coluna de água. A magnitude dos fluxos de PAHs varia sazonalmente, dependendo das velocidades do vento, das temperaturas e dos gradientes de concentração água-ar. Sabe-se que os POPs, incluindo os compostos organoclorados, se encontram substancialmente enriquecidos (até 100 vezes) na SML das regiões costeiras com relação às águas subjacentes.121 Os efeitos da SML nos fluxos oceano-atmosfera de POPs têm sido amplamente desprezados devido às dificuldades de quantificação quer desses compostos, quer das alterações nas propriedades da SML causadas por parâmetros ambientais. Realizando medições simultâneas de PCBs e de isómeros do hexaclorociclohexanos (HCHs) na água do mar, SML e atmosfera e usando um modelo de bicamada modificado, Wurl et al. estimaram fluxos médios de ΣPCBs e ΣHCHs de 67.2 e -43.1 ng m-2 dia-1, respectivamente.281 Iwata et al. reportaram fluxos negativos de HCHs em todas as regiões oceânicas estudadas, indicando adsorção líquida no oceano desses compostos.287 Altos fluxos de adsorção têm sido reportados para o mar da China Oriental e Sul, Golfo de Bengala e mar da Arábia. Porém, esses valores foram obtidos antes ou durante a implementação de regulamentos a restringir o uso de HCHs na India e na China. Pensa-se que, atualmente, os valores sejam substancialmente menores, tal como descrito numa recente campanha de medições de POPs levada a cabo no oceano Índico.281 A Tabela 3 apresenta uma compilação de valores de fluxos obtidos nessas e noutras regiões.
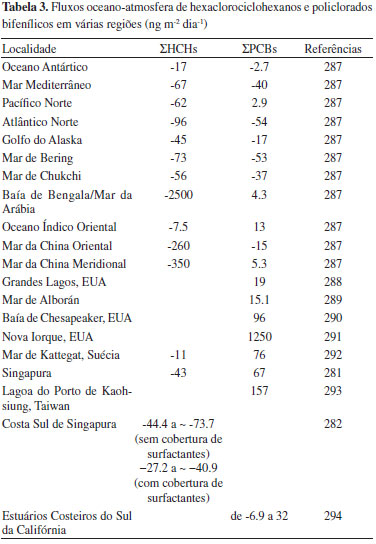
As trocas oceano-atmosfera de OC permanecem largamente inexploradas, exceto para alguns compostos orgânicos que representam uma pequena fração mássica do carbono orgânico total (gasoso e particulado) na atmosfera. Os fluxos oceano-atmosfera de OC total foram estimados para o NE Subtropical do Atlântico.295 Foram determinados fluxos difusivos gasosos médios de -31 e -25 mmol C m-2 dia-1 na primavera e no outono, respetivamente, valores que excedem as contribuições de OC por deposição seca de aerossóis (Fdeposição seca de OC, -0.98 mmol C m-2 dia-1) e os fluxos de CO2 (FCO2, -6.3 mmol C m-2 dia-1). Os fluxos de OC são importantes para compreender os balanços regionais de carbono e o dinamismo de trocas entre o oceano e a atmosfera e vice-versa.295 Questões para futuras pesquisas Há ainda muitas questões em aberto relacionadas com a produção de aerossóis a partir da SML. O estudo da magnitude dos fluxos de aerossóis de vários tamanhos formados no oceano está em seus estágios iniciais, sendo necessárias novas pesquisas sobre a variação espacial (e.g. oceano versus regiões costeiras) e temporal desse importante componente da atmosfera. Ainda estão por estabelecer quais as forças motrizes que controlam os fluxos de aerossol marinho e seus constituintes. O modo como alguns fatores ambientais (e.g. vento, ondas, temperatura da superfície oceânica, salinidade, etc.) atuam e a parametrização dos processos associados precisam do suporte de campanhas experimentais. Apesar dos esforços nos últimos anos, há várias questões fundamentais que permanecem sem resposta: - Quais são as fontes da OM detetada em aerossóis recém-formados ou envelhecidos? Como é que a contribuição das diversas fontes e a composição do aerossol variam sazonalmente? Quais as diferenças entre regiões oceânicas biologicamente produtivas e não produtivas e como essas diferenças se refletem nos fluxos, processamento químico e efeitos climáticos do aerossol marinho? Como é que os processos biogeoquímicos que ocorrem nas camadas mais superficiais do oceano afetam os fluxos e as propriedades físico-químicas dos aerossóis marinhos? Há um consenso geral de que o conhecimento sobre os ciclos biogeoquímicos dos componentes vestigiais na atmosfera ainda é muito vago. Para melhor entender a composição e efeitos do aerossol marinho é fundamental estabelecer relações com a sua origem. Portanto, estudos aprofundados dos fenómenos que ocorrem nos aerossóis marinhos, especialmente sob condições de intensa produtividade biológica no oceano, são necessários. O impacto dos aerossóis marinhos no balanço radiativo terrestre e na química da atmosfera constitui um tema de pesquisa atual. Na verdade, os efeitos do aerossol marinho no clima ainda estão em seus estágios formativos. A quantificação dos fluxos de aerossóis marinhos e a forma como os seus tamanhos e composição químicas influenciam a sua atuação como CCN às escalas regional e global constituem temas alvo de investigação. Deve ser dada atenção à forma como os aerossóis marinhos impactam a química da troposfera e, em particular, a MBL, em áreas costeiras, onde as massas de ar continentais poluídas se misturam com as oceânicas, ou em regiões no oceano aberto mais intocadas pela poluição. A separação qualitativa e quantitativa entre aerossóis marinhos resultantes do transporte de emissões antropogénicas desde áreas continentais, aerossóis produzidos na SML e aerossóis emitidos pelas embarcações deve ser aprimorada e exige a aplicação de novas ferramentas. Grande parte dos estudos sobre aerossóis marinhos tem abordado apenas uma faceta, focando os fluxos, a composição ou a biogeoquímica do oceano. Têm faltado abordagens multidisciplinares que permitam compreender os impactos do aerossol marinho no clima e nos oceanos, de uma forma integrada. Devem ser planejadas campanhas de medição multidisciplinares em regiões oceânicas representativas, cobrindo um leque vasto de condições que permitam testar e desenvolver parametrizações para a produção, a composição e evolução dos aerossóis marinhos primários, processos biogeoquímicos nas camadas oceânicas mais superficiais, propriedades físicas (e.g., temperatura da água, salinidade, etc.), condições meteorológicas e características das ondas. A conceção dessas campanhas deve ter em conta que a produção de spray marinho, embora influenciada pela velocidade do vento, é sobretudo forçada pelo rebentamento das ondas e que, portanto, o monitoramento das características das ondas é muito importante para parametrizar com rigor os fluxos de produção do aerossol. Experimentos laboratoriais controlados poderão fornecer informações para avaliar os efeitos de alguns parâmetros, como a temperatura da água do mar, a salinidade ou os surfactantes, na produção de aerossol marinho. Porém, esses testes precisam de água do mar fresca e devem, se possível, ser realizados em combinação com experimentos a bordo para quantificar fatores determinantes para os processos oceano-atmosfera (velocidade do vento, rebentamento das ondas, etc.).268,296 Na última década têm sido realizadas medições diretas das taxas de produção de aerossol marinho com discriminação por tamanhos por meio de métodos micrometeorológicos.255,257,297 É necessário verificar se os fluxos de aerossol marinho medidos diretamente têm correspondência com as parametrizações derivadas de aerossóis marinhos gerados em laboratório.270,297,298 Experimentos de laboratório podem ser conduzidos para gerar e estudar aerossóis marinhos recém-formados, mas a transposição dos resultados de tais testes para o oceano aberto é incerta. Assim, a intercomparação de aerossóis gerados em laboratório com resultados de observações de campo independentes (e.g., Eddy covariance) é crucial para avaliar as parametrizações das "funções fonte" de produção de aerossol marinho. Será igualmente importante estudar a composição detalhada da matéria orgânica quer em partículas de spray marinho recém-formadas, quer em aerossóis ambientais, dado que uma fração significativa e ainda não identificada pode ter origem em áreas continentais ou ser secundariamente formada por processos de conversão gás-partícula. Para restringir ainda mais as "funções fonte" do spray marinho segregado por tamanhos são necessários estudos de campo integrados, compreendendo a composição química e as propriedades físicas. As pesquisas multidisciplinares devem integrar físicos do aerossol, químicos, biólogos marinhos, meteorologistas, oceanógrafos, etc. Para melhorar a precisão das estimativas do forçamento direto e indireto pelos aerossóis com origem oceânica, novas parametrizações resultantes de estudos laboratoriais e de campo devem ser integradas quer em modelos climáticos regionais e globais, quer em modelos de transferência radiativa. Uma representação dos aerossóis a uma escala global pode apenas ser efetuada por sensoriamento remoto com satélites, o único meio capaz de captar a heterogeneidade das distribuições temporais e espaciais. Assim, as campanhas de campo devem ser apoiadas por atividades de sensoriamento remoto. Os satélites podem ser ferramentas preciosas para expandir as medições locais durante as campanhas de campo para escalas espaciais mais alargadas (regional a global), dado que eles fornecem informações sobre parâmetros tais como velocidade do vento, temperatura da superfície do mar, salinidade e cor do oceano, indicadores da atividade biológica e características das ondas. Têm sido desenvolvidos esforços para detetar remotamente a fração da superfície oceânica coberta por espumas brancas (whitecap fraction), a qual representa um parâmetro fundamental para formular as "funções fonte".248 Medições diretas desse parâmetro são preferíveis a parametrizações que exibem incertezas de várias ordens de grandeza.299 Observações de satélite também proporcionam a radiância no topo da atmosfera e, por conseguinte, uma medida direta para o efeito dos aerossóis no balanço de radiação do planeta. No entanto, os algoritmos para processamento do sinal dos satélites ainda não se encontram bem desenvolvidos e congregam muitas incertezas, sobretudo quando se tenta separar os efeitos das partículas de aerossol marinho dos efeitos de outras partículas. Assim, a aplicação desses algoritmos a campanhas de campo interdisciplinares será limitada, mas, por outro lado, contribuirá para a melhoria de tais experiências.
REFERÊNCIAS 1. Hatje, V.; Costa, M. F.; Cunha, L. C.; Quim. Nova 2013, 36, 1497. 2. Kuznetsova, M.; Lee, C.; Aller, J.; Mar. Chem. 2005, 96, 359. 3. Meskhidze, N.; McClain, C. R.; Petters, M. D.; Vignati, E.; Stetzer, O.; Osburn, C.; Kieber, D. J.; Adv. Meteorol. 2010, 2010, 250896. 4. Duce, R. A.; Hoffman, E. J.; Annu. Rev. Earth Planet. Sci. 1976, 4, 187. 5. Cavalli, F.; Facchini, M. C.; Decesari, S.; Mircea, M.; Emblico, L.; Fuzzi, S.; Ceburnis, D.; Yoon, Y. J.; O''Dowd, C. D.; Putaud, J. P.; Dell''Acqua, A.; J. Geophys. Res. 2004, 109, D24215. 6. Gantt, B.; Meskhidze, N.; Atmos. Chem. Phys. 2013, 13, 3979. 7. O''Dowd, C. D.; de Leeuw, G.; Philos. Trans. R. Soc. A 2007, 365, 1753. 8. O''Dowd, C. D.; Facchini, M. C.; Cavalli, F.; Ceburnis, D.; Mircea, M.; Decesari, S.; Fuzzi, S.; Yoon, Y. J.; Putaud, J. P.; Nature 2004, 431, 676. 9. Rinaldi, M.; Facchini, M. C.; Decesari, S.; Carbone, C.; Finessi, E.; Mircea, M.; Fuzzi, S.; Ceburnis, D.; Ehn, M.; Kulmala, M.; de Leeuw, G.; O''Dowd, C. D.; Atmos. Chem. Phys. 2009, 9, 9635. 10. Smoydzin, L.; von Glasow, R.; Atmos. Chem. Phys. 2007, 7, 5555. 11. Calace, N.; Mirante, S.; Petronio, B. M.; Pietroletti, M.; Rugo, C.; Int. J. Anal. Chem. 2004, 84, 413. 12. Upstill-Goddard, R. C.; Frost, T.; Henry, G. R.; Franklin, M.; Murrell, J. C.; Owens, N. J. P.; Global Biogeochem. Cycles 2003, 17, 19.1. 13. Franklin, M.; McDonald, I. R.; Bourne, D. G.; Owens, N. J. P.; Upstill-Goddard, R. C.; Murrell, J. C.; Environ. Microbiol. 2005, 7, 723. 14. Zhang, Z.; Cai, W.; Liu, L.; Liu, C.; Chen, F.; Sci. China, Ser. B: Chem. 2003, 46, 339. 15. Cunliffe, M.; Harrison, E.; Salter, M.; Schaefer, H.; Upstill-Goddard, R. C.; Murrell, J. C.; Aquat. Microb. Ecol. 2009, 57, 69. 16. Gladyshev, M. I.; Biophysics of the Surface Microlayer of Aquatic Ecosystems, IWA Publishing: London, 2002. 17. Hardy, J. T.; Coley, J. A.; Antrin, L. D.; Kiesser, S. L.; Can. J. Fish. Aquat. Sci. 1988, 45, 822. 18. Ramos, I. C. S. S. F.; Tese de Mestrado, Universidade de Aveiro, Portugal, 2009. 19. Cunliffe, M.; Upstill-Goddard, R. C.; Murrell, J. C.; FEMS Microbiol. Rev. 2011, 35, 233. 20. Hamilton, E. I.; Clifton, R. J.; Limnol. Oceanogr. 1979, 24, 188. 21. Garret, W. D.; Limnol. Oceanogr. 1965, 10, 602. 22. Harvey, G. W.; Burzell, L. A.; Limnol. Oceanogr. 1972, 17, 156. 23. Crow, S. A.; Ahearn, D. G.; Cook, W. L.; Bourquin, A. W.; Limnol. Oceanogr. 1975, 20, 644. 24. Kjellenberg. T.; Stenström, A.; Odham, G.; Mar. Biol. 1979, 53, 21. 25. Harvey, G. W.; Limnol. Oceanogr. 1966, 11, 608. 26. MacIntyre, F.; J. Phys. Chem. 1968, 72, 589. 27. Hühnerfuss, H.; Sonder. Meerestech. 1981, 12, 137. 28. Stolle, C.; Nagel, K.; Labrenz, M.; Jürgens, K.; Aquat. Microb. Ecol. 2009, 58, 67. 29. Agogué, H.; Casamayor, E.; Joux, F.; Obernosterer, I.; Dupuy, C.; Lantoine, F.; Catala, P.; Weinbauer, M. G.; Reinthaler, T.; Herndl, G. J.; Lebaron, P.; Limnol. Oceanogr.: Methods 2004, 2, 213. 30. Zhang, Z. B.; Liu, L. S.; Liu, C. Y.; Cai, W. J.; J. Colloid Interface Sci. 2003, 264, 148. 31. Cunliffe, M.; Engel, A.; Frka, S.; Gašparovic'', B.; Guitart, C.; Murrell, J. C.; Salter, M.; Stolle, C.; Upstill-Goddard, R.; Wurl, O.; Prog. Oceanogr. 2013, 109, 104. 32. Schneider, K.; Salter, M. E.; Mann, P. J.; Upstill-Goddard, R. C.; Biogeosciences 2013, 10, 4927. 33. Hatcher, R. F.; Parker, B. C.; Limnol. Oceanogr. 1974, 19, 162. 34. Momzikoff, A.; Brinis, A.; Dallot, S.; Gondry, G.; Saliot, A.; Lebaron, P.; Limnol. Oceanogr.: Methods 2004, 2, 374. 35. Carlson, D. J.; Limnol. Oceanogr. 1983, 28, 415. 36. Posfai, M.; Li, J.; Anderson, J. R.; Buseck, P. R.; Atmos. Res. 2003, 66, 231. 37. Joux, F.; Lebanon, P.; Troussellier, M.; FEMS Microbiol. Ecol. 1997, 22, 65. 38. Liss, P. S.; Duce, R. A.; The sea surface and global change, Cambridge University Press: Cambridge, 1997. 39. Saint-Louis, R.; Pelletier, E.; Mar. Chem. 2004, 84, 211. 40. Quinn, P. K.; Bates, T. S.; Nature 2011, 880, 51. 41. Cunliffe, M.; Murrell, J. C.; The ISME Journal 2009, 3, 1001. 42. Kuznetsova, M.; Lee, C.; Aquat. Sci. 2002, 64, 252. 43. Williams, P. M.; Carlucci, A. F.; Henrichs, S. M.; van Vleet, E. S.; Horrigan, S. G.; Reid, F. M. H.; Robertson, K. J.; Mar. Chem. 1986, 19, 17. 44. Kuznetsova, M. R.; Lee, C.; Mar. Chem. 2001, 73, 319. 45. Münster, U.; Heikkinen, E.; Knulst, J.; Hydrobiologia 1997, 363, 261. 46. Stolle, C.; Nagel, K.; Labrenz, M.; Jürgens, K.; Biogeosciences 2010, 7, 2975. 47. Reinthaler, T.; Sintes, E.; Herndl, J.; Limnol. Oceanogr. 2008, 53, 122. 48. Obernosterer, I.; Catala, P.; Reinthaler, T.; Herndl, G. J.; Lebaron, P.; Aquat. Microb. Ecol. 2005, 39, 293. 49. Conrad, R.; Seiler, W.; J. Atmos. Chem. 1988, 6, 83. 50. Falkowska, L.; Oceanologia 1999, 41, 211. 51. Falkowska, L.; Oceanologia 1999, 41, 223. 52. Obernosterer, I.; Catala, P.; Lami, R.; Caparros, J.; Ras, J.; Bricaud, A.; Dupuy, C.; van Wambeke, F.; Lebaron, P.; Biogeosciences 2008, 5, 693. 53. Carlucci, A. F.; Craven, D. B.; Robertson, K. J.; Williams, P. M.; Mar. Biol. 1986, 92, 289. 54. Falkowska, L.; Oceanologia 2001, 43, 201. 55. Santos, A. L.; Mendes, C.; Gomes, N. C. M.; Henriques, I.; Correia, A.; Almeida, A.; Cunha, A.; J. Plankton Res. 2009, 31, 1545. 56. Hale, S.; Mitchell, J. G.; Mar. Ecol. Progr. Ser. 1997, 147, 269. 57. Aller, J. Y.; Kuznetsova, M. R.; Jahns, C. J.; Kemp, P. F.; J. Aerosol Sci. 2005, 36, 801. 58. Marks, R.; Kruczalak, K.; Jankowska, K.; Michalska, M.; J. Aerosol Sci. 2001, 32, 237. 59. Burrows, S. M.; Elbert, W.; Lawrence, M. G.; Pöschl, U.; Atmos. Chem. Phys. 2009, 9, 9263. 60. Suttle, C. A.; Nat. Rev. Microbiol. 2007, 5, 801. 61. Culley, A. I.; Proc. Natl. Acad. Sci. U. S. A. 2013, 110, 12166. 62. Després, V. R.; Huffman, J. A.; Burrows, S. M.; Hoose, C.; Safatov, A. S.; Buryak, G.; Fröhlich-Nowoisky, J.; Elbert, W.; Andreae, M. O.; Pöschl, U.; Jaenicke, R.; Tellus, Ser. B 2012, 64, 15598. 63. Danovaro, R.; Corinaldesi, C; Dell''Anno, A.; Fuhrman, J. A.; Middelburg, J. J.; Noble, R. T.; Suttle, C. A.; FEMS Microbiol. Rev. 2011, 35, 993. 64. Detres, Y.; Armstrong, R. A.; Abstracts of the American Geophysical Union Fall Meeting, San Francisco, USA, 2003. 65. Mota, A.; Betancourt, C.; Detres, Y.; Armstrong, R.; Transactions, American Geophysical Union Meeting, San Francisco, USA, 2003. 66. Chow, J. C.; Watson, J. G.; Green, M. C.; Lowenthal, D. H.; Bates, B.; Oslund, W.; Torre; G.; Atmos. Environ. 2000, 34, 1833. 67. Moorthy, K. K.; Satheesh, S. K.; Krishna Murthy, B. V.; J. Atmos. Sol. -Terr. Phys. 1998, 60, 981. 68. Dueñas, C.; Fernandez, M. C.; Carretero, J.; Liger, E.; Cañete, S.; Atmos. Environ. 2004, 38, 1291. 69. WHO; Draft guidelines for safe recreational water environments, Vol. 1.: Coastal and fresh waters, World Health Organization, Geneva, 2003. 70. Cox, P. A.; Banack, S. A.; Murch, S. J.; Rasmussen, U.; Tien, G.; Bidigare, R. R.; Metcalf, J. S.; Morrison, L. F.; Codd, G. A.; Bergman, B.; Proc. Natl. Acad. Sci. U. S. A. 2005, 102, 5074. 71. Cincinelli, A.; Stornini, A. M.; Perugini, M.; Checchini, L.; Lepri, L.; Mar. Chem. 2001, 76, 77. 72. Oppo, C.; Bellandi, S.; Innocenti, N. D.; Stortini, A. M.; Loglio, G.; Schiavuta, E.; Cini, R.; Mar. Chem. 1999, 63, 235. 73. Rettori, A.; Paoletti, E.; Nicolotti, G.; Gullino, M. L.; Ann. For. Sci. 2005, 62, 351. 74. Langmann, V.; Scannell, C.; O''Dowd, C.; Atmos. Environ. 2008, 42, 7821. 75. O''Dowd, C.; Smith, M. H.; Consterdine, I. E.; Lowe, J. A.; Atmos. Environ. 1997, 31, 73. 76. Ooki, A.; Miura, K.; Uematsu, M.; J. Oceanogr. 2003, 59, 799. 77. Miyazaki, Y.; Kawamura, K.; Sawano, M.; Geophys. Res. Lett. 2010, 37, L06803. 78. Sciare, J.; Favez, O.; Sarda-Estève, R.; Oikonomou, K.; Cachier, H.; Kazan, V.; J. Geophys. Res. 2009, 114, D15302. 79. Spracklen, D. V.; Arnold, S. R.; Carslaw, K. S.; Sciare, J.; Pio, C.; Geophys. Res. Lett. 2008, 35, L12811. 80. Quinn, P. K.; Bates, T. S.; Schulz, K. S.; Coffman, D. J.; Frossard, A. A.; Russell, L. M.; Keene, W. C.; Kieber, D. J.; Nat. Geosci. 2014, 7, 228. 81. O''Dowd, C. D.; Langmann, B.; Varghese, S.; Scannell, C.; Ceburnis, D.; Facchini, M. C.; Geophys. Res. Lett. 2008, 35, L01801. 82. Russell, L. M.; Hawkins, L. N.; Frossard, A. A.; Quinn, P. K.; Bates, T. S.; Proc. Natl. Acad. Sci. U. S. A. 2010, 107, 6652. 83. Ovadnevaite, J.; Ceburnis, D.; Martucci, G.; Bialek, J.; Monahan, C.; Rinaldi, M.; Facchini, M. C.; Berresheim, H.; Worsnop, D. R.; O''Dowd, C.; Geophys. Res. Lett. 2011, 38, L21806. 84. Ceburnis, D.; Garbaras, A.; Szidat, S.; Rinaldi, M.; Fahrni, S.; Perron, N.; Wacker, L.; Leinert, S.; Remeikis, V.; Facchini, M. C.; Prevot, A. S. H.; Jennings, S. G.; Ramonet, M.; O''Dowd, C. D.; Atmos. Chem. Phys. 2011, 11, 8593. 85. Sorooshian, A.; Padró, L. T.; Nenes, A.; Feingold, G.; McGomiskey, A.; Hersey, S. P.; Gates, H.; Jonsson, H. H.; Miller, S. D.; Stephens, G. L.; Flagan, R.; Seinfeld, J. H.; Global Biogeochem. Cycles 2009, 23, GB4007. 86. Vignati, E.; Facchini, M. C.; Rinaldi, M.; Scannell, C.; Ceburnis, D.; Sciare, J.; Kanakidou, M.; Myriokefalitakis, S.; Dentener, F.; O''Dowd, C. D.; Atmos. Environ. 2010, 44, 670. 87. Gantt, B.; Meskhidze, N.; Facchini, M. C.; Rinaldi, M.; Ceburnis, D.; O''Dowd, C. D.; Atmos. Chem. Phys. 2011, 11, 8777. 88. Roelofs, G. J.; Atmos. Chem. Phys. 2008, 8, 709. 89. Lapina, K.; Heald, C. L.; Spracklen, D. V.; Arnold, S. R.; Allan, J. D.; Coe, H.; McFiggans, G.; Zorn, S. R.; Drewnick, F.; Bates, T. S.; Hawkins, L. N.; Russel, L. M.; Smirnov, A.; O''Dowd, C. D.; Hind, A. J.; Atmos. Chem. Phys. 2011, 11, 8847. 90. Vignati, E.; Facchini, M. C.; Rinaldi, M.; Scannell, C.; Ceburnis, D.; Sciare, J.; Kanakidou, M.; Myriokefalitakis, S.; Dentener, F.; O''Dowd, C. D.; Atmos. Environ. 2010, 44, 670. 91. Ito, A.; Kawamiya, M.; Global Biogeochem. Cycles 2010, 24, GB1012. 92. Westervelt, D. M.; Moore, R. H.; Nenes, A.; Adams, P. J.; Atmos. Chem. Phys. 2012, 12, 89. 93. Gantt, B.; Meskhidze, N.; Kamykowski, D.; Atmos. Chem. Phys. 2009, 9, 4915. 94. Myriokefalitakis, S.; Vignati, E.; Tsigaridis, K.; Papadimas, C.; Sciare, J.; Mihalopoulos, N.; Facchini, M. C.; Rinaldi, M.; Dentener, F. J.; Ceburnis, D.; Hatzianastasiou, N.; O''Dowd, C. D.; van Weele, M.; Kanakidou, M.; Adv. Meteorol. 2010, 2010, 939171. 95. Meskhidze, N.; Xu, J.; Gantt, B.; Zhang, Y.; Nenes, A.; Ghan, S. J.; Liu, X.; Easter, R.; Zaveri, R.; Atmos. Chem. Phys. 2011, 11, 11689. 96. Fu, P. Q.; Kawamura, K.; Chen, J.; Charrière, B.; Sempére, R.; Biogeosciences Discuss. 2012, 9, 10429. 97. Middlebrook, A. M.; Murphy, D. M.; Thomson, D. S.; J. Geophys. Res. 1998, 103, 16475. 98. Putaud, J. P.; van Dingenen, R.; Mangoni, M.; Virkkula, A.; Raes, F.; Maring, H.; Prospero, J. M.; Swietlicki, E.; Berg, O. H.; Hillamo, R.; Mäkelä, T.; Tellus, Ser. B 2000, 52, 141. 99. Matsumoto, K.; Tanaka, H.; Nagao, I.; Ishizaha, Y.; Geophys. Res. Lett. 1997, 24, 655. 100. Novakov, T.; Corrigan, C. E.; Penner, J. E.; Chuang, C. C.; Rosario, O.; Mayel Bracero, O. L.; J. Geophys. Res. 1997, 102, 21307. 101. Alves, C.; Oliveira, T.; Pio, C.; Silvestre, A.; Fialho, P.; Barata, F.; Legrand, M.; Atmos. Environ. 2007, 41, 1359. 102. Kawamura, K.; Sakaguchi, F.; J. Geophys. Res. 1999, 104, 3501. 103. Mochida, M.; Kawabata, A.; Kawamura, K.; Hatsushika, H.; Yamazaki, K.; J. Geophys. Res. 2003, 108, 4193. 104. Simoneit, B. R. T.; Kobayashi, M.; Mochida, M.; Kawamura, K.; Lee, M.; Lim, H. J.; Turpin, B. J.; Komazaki, Y.; J. Geophys. Res. 2004, 109, D19S10. 105. Wang, H.; Kawamura, K.; Yamazaki, K.; J. Atmos. Chem. 2006, 53, 43. 106. Rinaldi, M.; Decesari, S.; Finessi, E.; Giulianelli, L.; Carbone, C.; Fuzzi, S.; O''Dowd, C. D.; Ceburnis, D.; Facchini, M. C.; Adv. Meteorol. 2010, 2010, 310682. 107. Charlson, R. J.; Lovelock, J. E.; Andreae, M. O.; Warren, S. G.; Nature 1987, 326, 655. 108. Shaw, G. E.; Climatic Change 1983, 5, 297. 109. Ervens, B.; George, C.; Williams, J.; Buxton, G.; Salmon, G.; Bydder, M.; Wilkinson, F.; Dentener, F.; Mirabel, P.; Wolke, R.; Herrmann, H.; J. Geophys. Res. 2003, 108, 1. 110. Warneck, P.; Atmos. Environ. 2003, 37, 2423. 111. Vaattovaara, P.; Huttunen, P. E.; Yoon, Y. J.; Joutsensaari, J.; Lehtinen, K. E. J.; O''Dowd, C. D.; Laaksonen, A.; Atmos. Chem. Phys. 2006, 6, 4601. 112. Johnson, G. R.; Ristovski, Z.; D''Anna, B.; Morawska, L.; J. Geophys. Res. 2005, 110, D20203. 113. Modini. R. L.; Ristovski, Z. D.; Johnson, G. R.; He, C.; Surawski, N.; Morawska, L.; Suni, T.; Kulmala, M.; Atmos. Chem. Phys. 2009, 9, 7607. 114. Carvalho, N. F.; Silva, S. P.; Simão, P.; Resende, S. M.; J. Braz. Chem. Soc. 2011, 22, 950. 115. Chen, T.; Jang, M.; Atmos. Environ. 2012, 46, 271. 116. Holmes, N. S.; Atmos. Environ. 2007, 41, 2183. 117. Miyazaki, Y.; Kawamura, K.; Sawano, M.; J. Geophys. Res. 2010, 115, D23210. 118. Anttila, T.; Langmann, B.; Varghese, S.; O''Dowd, C.; Adv. Meteorol. 2010, 2010, 482603. 119. Fu, P. Q.; Kawamura, K.; Chen, J.; Barrie, L. A.; Environ. Sci. Technol. 2009, 43, 4022. 120. Meskhidze, N.; Nenes, A.; Science 2006, 314, 1419. 121. Wurl, O.; Obbard, J. F.; Mar. Pollut. Bull. 2004, 48, 1016. 122. Schmitt-Kopplin, P.; Liger-Belair, G.; Koch, B. P.; Flerus, R.; Kattner, G.; Harir, M.; Kanawati, B.; Lucio, M.; Tziotis, D.; Hertkorn, N.; Gebefügi, I.; Biogeosciences 2012, 9, 1571. 123. Ling, W.; Jiang, G.; Cai, Y.; He, B.; Wang, Y.; Shen, D.; J. Environ. Sci. 2007, 19, 874. 124. Mochida, M.; Kitamori, Y.; Kawamura, K.; Nojiri, Y.; Suzuki, K.; J. Geophys. Res. 2002, 107, AAC 1-1. 125. Simoneit, B. R. T.; Cardoso, J. N.; Robinson, N.; Chemosphere 1991, 23, 447. 126. Zhao, J.; Peng, P. M; Song, J.; Ma, S.; Sheng, G.; Fu, J.; J. Environ. Sci. 2009, 21, 1658. 127. Ya, M. L.; Wang, X. H.; Wu, Y. L.; Ye, C. X.; Li, Y. Y.; Mar. Pollut. Bull. 2014, 78, 110. 128. Gagosian, R. B.; Zafiriou, O. C.; Peltzer, E. T.; Alford, J. B.; J. Geophys. Res. 1982, 87, 11133. 129. Crahan, K. K.; Hegg, D. A.; Covert, D. S.; Jonsson, H.; Reid, J. S.; Khelif, D.; J. Atmos. Sci. 2004, 61, 2544. 130. Facchini, M. C.; Decesari, S.; Rinaldi, M.; Carbone, C.; Finessi, E.; Mircea, M.; Fuzzi, S.; Moretti, F.; Tagliavini, E.; Ceburnis, D.; O''Dowd, C. D.; Environ. Sci. Technol. 2008, 42, 9116. 131. Fu, P. Q.; Kawamura, K.; Miura, K.; J. Geophys. Res. Atmos. 2011, 116, D13302. 132. Hawkins, L. N.; Russell, L. M.; Adv. Meteorol. 2010, 2010, 612132. 133. Kuznetsova, M.; Lee, C.; Aller, J.; Frew, N.; Limnol. Oceanogr. 2004, 49, 1605. 134. Leck, C.; Bigg, E. K.; Geophys. Res. Lett. 2005, 32, L19803. 135. Sicre, M. A.; Peltzer, E. T.; Atmos. Environ. 2004, 38, 1615. 136. Mandalakis, M.; Apostolaki, M.; Stephanou, E. G.; J. Chromatogr. A, 2010, 1217, 143. 137. Mandalakis, M.; Apostolaki, M.; Tziaras, T.; Polymenakou, P.; Stephanou, E. G.; Atmos. Environ. 2011, 45, 1003. 138. Matsumoto, K.; Uematsu, M.; Atmos. Environ. 2005, 39, 2163. 139. Miyazaki, Y.; Kawamura, K.; Jung, J.; Furutani, H.; Uematsu, M.; Atmos. Chem. Phys. 2011, 11, 3037. 140. Wedyan, M. A.; World Appl. Sci. J. 2008, 3, 454. 141. Zahardis, J.; Geddes, S.; Petrucci, G. A.; Int. J. Environ. Anal. Chem. 2008, 88, 177. 142. Milne, P. J.; Zika, R. G.; J. Atmos. Chem. 1993, 16, 361. 143. Mopper, K.; Zika, R. G.; Nature 1987, 325, 246. 144. Aluwihare, L. I.; Repeta, D. J.; Chen, R. F.; Nature 1997, 387, 166. 145. Aluwihare, L. I.; Repeta, D. J.; Mar. Ecol. Prog. Ser. 1999, 186, 105. 146. Zhang, Y. P.; Yang, F. P.; Lu, X. L.; Ding, H. B.; Zhang, H. H.; Cont. Shelf Res. 2013, 63, 85. 147. Chen, Y.; Yang, G. P.; Wu, G. W.; Gao, X. C.; Xia, Q. Y.; Cont. Shelf Res. 2013, 52, 97. 148. Fu, P. Q.; Kawamura, K.; Barrie, L. A.; Environ. Sci. Technol. 2009, 43, 286. 149. Quinn, P. K.; Shaw, G.; Andrews, E.; Dutton, E. G.; Ruoho-Airola, T.; Gong, S. L.; Tellus, Ser. B 2007, 59, 99. 150. Claeys, M.; Wang, W.; Vermeylen, R.; Kourtchev, I.; Chi, X.; Farhat, Y.; Surratt, J. D.; Gomez-Gonzalez, Y.; Sciare, J.; Maenhaut, W.; J. Aerosol Sci. 2010, 41, 13. 151. Ekström, S.; Nozière, B.; Hansson, H. C.; Atmos. Chem. Phys. 2009, 9, 973. 152. Yassaa, N.; Peeken, I.; Zöllner, E.; Bluhm, K.; Arnold, S.; Spracklen, D.; Williams, J.; Environ. Chem. 2008, 5, 391. 153. Arnold, S. R.; Spracklen, D. V.; Williams, J.; Yassaa, N.; Sciare, J.; Bonsang, B.; Gros, V.; Peeken, I.; Lewis, A. C.; Alvain, S.; Moulin, C.; Atmos. Chem. Phys. 2009, 9, 1253. 154. Myriokefalitakis, S.; Vignati, E.; Tsigaridis, K.; Papadimas, C.; Sciare, J.; Mihalopoulos, N.; Facchini, M. C.; Rinaldi, M.; Dentener, F. J.; Ceburnis, D.; Hatzianastasiou, N.; O''Dowd, C. D.; van Weele, M.; Kanakidou, M.; Adv. Meteorol. 2010, 2010, 939171. 155. Zhang, Q.; Anastasio, C.; Jimenez-Cruz, M.; J. Geophys. Res. 2002, 107, AAC 3-1. 156. Duce, R. A.; LaRoche, J.; Altieri, K.; Arrigo, K. R.; Baker, A. R.; Capone, D. G.; Cornell, S.; Dentener, F.; Galloway, J.; Ganeshram, R. S.; Geider, R. J.; Jickells, T.; Kuypers, M. M.; Langlois, R.; Liss, P. S.; Liu, S. M.; Middelburg, J. J.; Moore, C. M.; Nickovic, S.; Oschlies, A.; Pedersen, T.; Prospero, J.; Schlitzer, R.; Seitzinger, S.; Sorensen, L. L.; Uematsu, M.; Ulloa, O.; Voss, M.; Ward, B.; Zamora, L.; Science 2008, 320, 893. 157. Müller, C.; Iinuma, Y.; Karstensen, J.; van Pinxteren, D.; Lehmann, S.; Gnauk, T.; Herrmann, H.; Atmos. Chem. Phys. 2009, 9, 9587. 158. Wurl, O.; Wurl, E.; Miller, L.; Johnson, K.; Vagle, S.; Biogeosciences 2011, 8, 121. 159. Archer, C. L.; Jacobson, M. Z.; J. Geophys. Res. 2005, 110, D12110. 160. Dragćević, D.; Pravdić, V.; Limnol. Oceanogr. 1981, 26, 492. 161. Zhou, J.; Mopper, K.; Passow, U.; Limnol. Oceanogr. 1998, 43, 1860. 162. Wurl, O.; Miller, L.; Vagle, S.; J. Geophys. Res. 2011, 116, C00H13. 163. Engel, A.; J. Plankton Res. 2002, 24, 49. 164. Wurl, O.; Holmes, M.; Mar. Chem. 2008, 110, 89. 165. Wurl, O.; Miller, L.; Röttgers, R.; Vagle, S.; Mar. Chem. 2009, 115, 1. 166. Galgani, L.; Engel, A.; Int. J. Geosci. 2013, 4, 129. 167. Carlson D. J.; Limnol.Oceanogr. 1983, 28, 415. 168. Ellison, G. B.; Tuck, A. F.; Vaida, V.; J. Geophys. Res. 1999, 104, 11633. 169. Orellana, M. V.; Matrai, P. A.; Leck, C.; Rauschenberg, C. D.; Lee, A. M.; Coz, E.; Proc. Natl. Acad. Sci. U. S. A. 2011, 108, 13612. 170. Broecker. H. C.; Petermann, J.; Siems, W.; J. Mar. Res. 1978, 36, 595. 171. Frew, N. M.; Bock, E. J.; Schimpf, U.; Hara, T.; Haußecker, H.; Edson, J. B.; McGillis, W. R.; Nelson, R. K.; McKenna, S. P.; Jähne, B.; J. Geophys. Res. 2004, 109, C08S17. 172. Schmidt, R.; Schneider, B.; Mar. Chem. 2011, 126, 56. 173. Salter, M. E.; Upstill-Goddard. R. C.; Nightingale, P. D.; Archer, S. D.; Blomquist, B.; Ho, T.; Huebert, B.; Schlosser, P., Yang, M.; J. Geophys. Res. 2011, 116, C11016. 174. Brockmann, U. H.; Hühnerfuss, H.; Kattner, G.; Broecker, H. C.; Hentschel, G.; Limnol. Oceanogr. 1982, 27, 1050. 175. Peterson, R. E.; Tyler, B. J; Atmos. Environ. 2002, 36, 6041. 176. Latif, M. T.; Brimblecombe, P.; Environ. Sci. Technol. 2004, 38, 6501. 177. Lo, J. H. A.; Lee, W. M. G.; Chemosphere 1996, 33, 1391. 178. Stortini, A. M.; Martellini, T.; Del Bubba, M.; Lepri, L.; Capodaglio, G.; Cincinelli, A.; Microchem. J. 2009, 92, 37. 179. Wedyan, M. A.; Preston, M. R.; Atmos. Environ. 2008, 42, 8698. 180. Vojvodic, V.; Cosovic, B.; Mar. Chem. 1996, 54, 119. 181. Roslan, R. N.; Hanif, N. M.; Othman, M. R.; Azmi, W. N. F. W.; Yan, X. X.; Ali, M. M.; Mohamed, C. A. R.; Latif, M. T.; Mar. Pollut. Bull. 2010, 60, 1584. 182. Carpenter, L. J.; Jones, C. E.; Dunk, R. M.; Hornsby, K. E.; Woeltjen, J.; Atmos. Chem. Phys. 2009, 9, 1805. 183. Keene, W. C.; Stutz, J.; Pszenny, A. A. P.; Maben, J. R.; Fischer, E. V.; Smith, A. M.; von Glasow, R.; Pechtl, S.; Sive, B. C.; Varner, R. K.; J. Geophys. Res. 2007, 112, D10S12. 184. Quack, B.; Atlas, E.; Petrick, G.; Stroud, V.; Schauffler, S.; Wallace, D. W. R.; Geophys. Res. Lett. 2004, 31, L23S05. 185. Yang, X.; Cox, R.A.; Warwick, N. J.; Pyle, J. A.; Carver, G. D.; O''Connor, F. M.; Savage, N. H.; J. Geophys. Res. 2005, 110, D23311. 186. Salawitch, R. J.; Nature 2006, 439, 275. 187. von Glasow, R.; Crutzen, P. J. Em Treatise on Geochemistry; Holland, H. D.; Turekian, K. K., eds.; Elsevier: Oxford, 2007, Update 1, vol. 4.02, pp. 1-67. 188. Solomon, S.; Garcia, R. R.; Ravishankara, A. R.; J. Geophys. Res. 1994, 99, 20491. 189. Nielsen, J. E.; Douglass, A. R.; J. Geophys. Res. 2001, 106, 8089. 190. Pfeilsticker, K.; Sturges, W. T.; Bosch, H.; Camy-Peyret, C.; Chipperfield, M. P.; Engel, A.; Fitzenberger, R.; Muller, M.; Payan, S.; Sinnhuber, B. M.; Geophys. Res. Lett. 2000, 27, 3305. 191. Sturges, W. T.; Oram, D. E.; Carpenter, L. J.; Engel, A.; Penkett, S. A.; Geophys. Res. Lett. 2000, 27, 2081. 192. Butler, J. H.; King, D. B.; Lobert, J. M.; Montzka, S. A.; Yvon-Lewis, S. A.; Hall, B. D.; Warwick, N. J.; Mondeel, D. J.; Aydin, M.; Elkins, J. W.; Global Biogeochem. Cycles 2007, 21, GB1023. 193. Quack, B.; Wallace, D. W. R.; Global Biogeochem. Cycles 2003, 17, 1023. 194. von Glasow, R.; von Kuhlmann, R.; Lawrence, M. G.; Platt, U.; Crutzen, P. J.; Atmos. Chem. Phys. 2004, 4, 2481. 195. Carpenter, L. J.; Chem. Rev. 2003, 103, 4953. 196. Williams, J.; Gros, V.; Atlas, E.; Maciejczyk, K.; Batsaikhan, A.; Schöler, H. F.; Forster, C.; Quack, B.; Yassaa, N.; Sander, R.; Van Dingenen, R.; J. Geophys. Res. 2007, 112, D07302. 197. Huang, R. J.; Seitz, K.; Neary, T.; O''Dowd, C. D.; Platt, U.; Hoffmann, T.; Geophys. Res. Lett. 2010, 37, L03803. 198. O''Dowd, C.; Jimenez, J. L.; Bahreini, R.; Flagan, R. C.; Seinfeld, J. H., Hämeri, K.; Pirjola, L.; Kulmala, M.; Jennings, S. G.; Hoffmann, T.; Nature 2002, 417, 632. 199. Saiz-Lopez, A.; Plane, J. M. C.; Geophys. Res. Lett., 2004, 31, L04112. 200. Saiz-Lopez, A.; Mahajan, A. S.; Salmon, R. A.; Bauguitte, S. J. B.; Jones, A. E.; Roscoe, H. K.; Plane, J. M. C.; Science 2007, 317, 348. 201. Seitz, K.; Buxmann, J.; Pöhler, D.; Sommer, T.; Tschritter, J.; Neary, T.; O''Dowd, C.; Platt, U.; Atmos. Chem. Phys. 2010, 10, 2117. 202. Vogt, R.; Sander, R.; von Glasow, R.; Crutzen, P. J.; J. Atmos. Chem. 1999, 32, 375. 203. Carpenter, L. J.; Hebestreit, K.; Platt, U.; Liss, P. S.; Atmos. Chem. Phys. 2001, 1, 9. 204. Saiz-Lopez, A.; Shillito, J. A.; Coe, H.; Plane, J. M. C.; Atmos. Chem. Phys. 2006, 6, 1513. 205. Carpenter, L. J.; Sturges, W. T.; Penkett, S. A.; Liss, P. S.; Alicke, B.; Hebestreit, K.; Platt, U.; J. Geophys. Res. 1999, 104, 1679. 206. McFiggans, G.; Plane, J. M. C.; Allan, B. J.; Carpenter, L. J.; Coe, H.; O''Dowd, C. D.; J. Geophys. Res. 2000, 105, 371. 207. McFiggans, G.; Coe, H.; Burgess, R.; Allan, J.; Cubison, M.; Alfarra, M. R.; Saunders, R.; Saiz-Lopez, A.; Plane, J. M. C.; Wevill, D. J.; Carpenter, L. J.; Rickard, A. R.; Monks, P. S.; Atmos. Chem. Phys. 2004, 4, 701. 208. O''Dowd, C. D.; Hämeri, K.; Mäkelä, J.; Väkeva, M.; Aalto, P.; de Leeuw, G.; Kunz, G. J.; Becker, E.; Hansson, H. C.; Allen, A. G.; Harrison, R. M.; Berresheim, H.; Kleefeld, C.; Geever, M.; Jennings, S. G.; Kulmala, M.; J. Geophys. Res. 2002, 107, PAR12.1. 209. Burkholder, J. B.; Curtius, J.; Ravishankara, A. R.; Lovejoy, E. R.; Atmos. Chem. Phys. 2004, 4, 19. 210. Jimenez, J. L.; Bahreini, R.; Cocker, D. R.; Zhuang, H.; Varutbangkul, V.; Flagan, R. C.; Seinfeld, J. H.; O''Dowd, C. D.; Hoffmann, T.; J. Geophys. Res. 2003, 108, 4318. 211. Kolb, C.; Nature 2002, 417, 59. 212. Nakano, Y.; Enami, S.; Nakamichi, S.; Aloisio, S.; Hashimoto, S.; Kawasaki, M.; J. Phys. Chem. A 2003, 107, 6381. 213. Lai, S. C.; Williams, J.; Arnold, S. R.; Atlas, E. L.; Gebhardt, S.; Hoffmann, T.; Geophys. Res. Lett. 2011, 38, L20801. 214. McFiggans, G.; Cox, R. A.; Mössinger, J. C.; Allan, B. J.; Plane, J. M. C.; J. Geophys. Res. 2002, 107, ACH10/1. 215. Arnold, S. R.; Spracklen, D. V.; Gebhardt, S.; Custer, T.; Williams, J.; Peeken, I.; Alvain, S.; Environ. Chem. 2010, 7, 232. 216. Jones, C. E.; Hornsby, K. E.; Sommariva, R.; Dunk, R. M.; von Glasow, R.; McFiggans, G.; Carpenter, L.; J. Geophys. Res. Lett. 2010, 37, L18804. 217. Mahajan, A. S.; Plane, J. M. C.; Oetjen, H.; Mendes, L.; Saunders, R.W.; Saiz-Lopez, A.; Jones, C. E.; Carpenter, L. J.; McFiggans, G. B.; Atmos. Chem. Phys. 2010, 10, 4611. 218. Moore, R. M.; Milley, J. E.; Chatt, A.; Oceanol. Acta 1984, 7, 221. 219. Duce, R.A.; Em The Role of Air-Sea Exchange in Geochonical Cycling; Buat-Menard, P., ed.; Reidel, Norwell, 1986, pp. 497-529. 220. Martin, J. H.; Fitzwater, S. E.; Nature 1988, 331, 341. 221. Martin, J. H.; Gordon, R. M.; Deep Sea Res. 1988, 35, 177. 222. Martin, J. H.; Gordon, R. M.; Fitzwater, S. E.; Nature 1990, 345, 156. 223. Martin, J. H.; Gordon, R. M.; Fitzwater, S. E.; Broenkow, W. W.; Deep Sea Res. 1989, 36, 649. 224. Zhuang, G.; Yi, Z.; Duce, R. A.; Brown, P. R.; Global Biogeochem. Cycles 1992, 6, 161. 225. Han, Y.; Fang, X.; Zhao, T.; Kang, S.; J. Environ. Sci. 2008, 20, 424. 226. Hoffman, G. L.; Duce, R. A.; Walsh, P. R.; Hoffman, E. J.; Ray, B. J.; Fasching, J. L.; J. Rech. Atmos. 1974, 8, 746. 227. Theodosi, C.; Stavrakakis, S.; Koulaki, F.; Stavrakaki, I.; Moncheva, S.; Papathanasiou, E.; Sanchez-Vidal, A.; Koçak, M.; Mihalopoulos, N.; J. Marine Syst. 2013, 109-110, 94. 228. Okubo, A.; Takeda, S.; Obata, H.; Atmos. Res. 2013, 129-130, 20. 229. Hsu, S. C.; Wong, G. T. F.; Gong, G. C.; Shiah, F. K.; Huang, Y. T.; Kao, S. J.; Tsai, F. J.; Lung, S. C. C.; Lin, F. J.; Lin, I. I.; Hung, C. C.; Tseng, C. M.; Mar. Chem. 2010, 120, 116. 230. Wuttig, K.; Wagener, T.; Bressac, M.; Dammshäuser, A.; Streu, P.; Guieu, C.; Croot, P. L.; Biogeosciences 2013, 10, 2583. 231. Jones, M. R.; PhD Thesis, University of East Anglia, UK, 2011. 232. Andreas, E. L.; J. Geophys. Res. 1992, 97, 11429. 233. de Leeuw, G.; Neele, F. P.; Hill, M.; Smith, M. H.; Vignati, E.; J. Geophys. Res. 2000, 105, 29397. 234. Gong, S. L.; Global Biogeochem. Cycles 2003, 17, 1097. 235. Iida, N.; Toba, Y.; Chaen, M.; J. Oceanogr. 1992, 48, 439. 236. Mårtensson, E. M.; Nilsson, E. D.; de Leeuw, G.; Cohen, L. H.; Hansson, H. C.; J. Geophys. Res. 2003; 108, 4297. 237. Monahan, E. C.; Spiel, D. E.; Davidson, K. L. Em Oceanic whitecaps and their role in air-sea exchange processes; Monahan, E. C.; MacNiocaill, E. C., eds.; Riedel: Norwell, 1986, pp. 167-174. 238. Petelski, T.; J. Aerosol Sci. 2003, 34, 359. 239. Wu. J.; J. Geophys. Res. 1992, 97, 2327. 240. Smith, S. D.; Fairall, C. W.; Geernaert, G. L.; Hasse, L.; Bound. -Lay. Meteorol. 1996, 78, 247. 241. Smith, M. H.; Park, P. M.; Consterdine, I. E.; Q. J. R. Meteorol. Soc. 1993, 119, 809. 242. Smith, M. H.; Harrison, N. M.; J. Aerosol Sci. 1998, 29(Suppl. 1), 189. 243. Werner, M.; Kryza, M.; Dore, A. J.; Blás, M.; Hallsworth, S.; Vieno, M.; Tang, Y. S.; Smith, R. I.; Atmos. Chem. Phys. 2011, 11, 1023. 244. Grythe, H.; Ström, J.; Krejci, R.; Quinn, P.; Stohl, A.; Atmos. Chem. Phys. 2014, 14, 1277. 245. Monahan, E. C.; Spiel, D. E.; Davidson, K. L.; J. Geophys. Res. 1982, 87, 8898. 246. Petelski, T.; Chomka, M.; Oceanologia 2000, 42, 399. 247. Petelski, T.; Chomka, M.; Atmos. Phys. 1996, 18, 35. 248. Anguelova, M. D.; Webster, F.; J. Geophys. Res. 2006, 111, C03017. 249. Reid, J. S.; Jonsson, H. H.; Smith, M. H.; Smirnov, A.; J. Geophys. Res. 2001, 106, 12039. 250. Clarke, A. D.; Owens, S. R.; Zhou, J.; J. Geophys. Res. 2006, 111, D06202. 251. Hoppel, W. A.; Frick, G. M.; Fitzgerald, J. W.; J. Geophys. Res. 2002, 107, 4382. 252. Norris, S. J.; Brooks, I. M.; Hill, M. K.; Brooks, B. J.; Smith, M. H.; Sproson, D. A. J.; J. Geophys. Res. 2012, 117, D07210. 253. Petelski, T.; Piskozub, J.; J. Geophys. Res. 2006, 111, C06039. 254. Andreas, E. L.; J. Geophys. Res. 2007, 112, C11010. 255. de Leeuw, G., Moerman, M.; Zappa, C. J.; McGillis, W.R.; Norris, S.; Smith, M. Em Transport at the Air Sea Interface; Garbe, C. S.; Handler, R. A.; Jähne, B., eds.; Springer-Verlag: Berlin, 2007, pp. 297-311. 256. Geever, M. C.; O''Dowd, D.; van Ekeren, S.; Flanagan, R.; Nilsson, E. D.; de Leeuw, G.; Rannik, Ü.; Geophys. Res. Lett. 2005; 32, L15810. 257. Norris, S.; Brooks, I.; de Leeuw, G.; Smith, M. H.; Moeman, M.; Lingard, J.; Atmos. Chem. Phys. 2008, 8, 555. 258. Nilsson, E. D.; Rannik, Ü.; Swietlicki, E.; Leck, C.; Aalto, P. P.; Zhou, J.; Norman, M.; J. Geophys. Res. 2001, 106, 32139. 259. Lewis, E. R.; Schwartz, S. E.; Geophysical Monograph Series, AGU: Washington, 2004. 260. Andreas, E. L. Em Atmosphere-Ocean Interactions, Vol. 1; Perrie, W., ed.; WIT Press: Southampton, 2002, pp. 1-46. 261. de Leeuw, G.; Andreas, E. L.; Anguelova, M. D.; Fairall, C. W.; Lewis, E. R.; O''Dowd, C.; Schulz, M.; Schwartz, S. E.; Rev. Geophys. 2011, 49, RG2001. 262. Weller, R. A.; Bradley, E. F.; Edson, J. B.; Fairall, C. W.; Brooks, I.; Yelland, M. J.; Pascal, R. W.; Ocean Sci. 2008, 4, 247. 263. Monahan, E. C.; O''Muircheartaigh, I.; Int. J. Remote Sens. 1986, 7, 627. 264. Spiel, D. E.; A study of aerosols generated in a whitecap simulation tank, BDM Technical Report 006-83, Monterey, 1983. 265. Monahan, E. C.; O''Muircheartaigh, I.; J. Phys. Oceanogr. 1980, 10, 2094. 266. Blanchard, D. C.; Progr. Oceanogr. 1963, 1, 171. 267. Cipriano, R. J.; Monahan, E. C.; Bowyer, P. A.; Woolf, D. K.; J. Geophys. Res. 1987, 92, 6569. 268. Facchini, M. C.; Rinaldi, M.; Decesari, S.; Carbone, C.; Finessi, E.; Mircea, M.; Fuzzi, S.; Ceburnis, D.; Flanagan, R.; Nilsson, E. D.; de Leeuw, G.; Martino, M.; Woeltjen, J.; Geophys. Res. Lett. 2008, 35, L17814. 269. Fuentes, E.; Coe, H.; Green, D.; de Leeuw, G.; McFiggans, G.; Atmos. Meas. Tech. 2010, 3, 141. 270. Keene, W. C.; Maring, H.; Maben, J. R.; Kieber, D. J.; Pszenny, A. A. P.; Dahl, E. E.; Izaguirre, M. A.; Davis, A. J.; Long, M. S.; Zhou, X.; Smoydzin, L.; Sander, R.; J. Geophys. Res. 2007, 112, D21202. 271. Sellegri, K.; O''Dowd, C. D.; Yoon, Y. J.; Jennings, S. G.; de Leeuw, G.; J. Geophys. Res. 2006, 111, D22215. 272. Tyree, C. A.; Hellion, V. M.; Alexandrova, O. A.; Allen, J. O.; J. Geophys. Res. 2007, 112, D12204. 273. Hill, M. K.; Brooks, B. J.; Norris, S. J.; Smith, M. H.; Brooks, I. M.; de Leeuw, G.; Lingard, J. J. N.; J. Atmos. Ocean. Tech. 2008, 25, 1996. 274. Brooks, I. M.; Yelland, M. J.; Upstill-Goddard, R. C.; Nightingale, P. D.; Archer, S.; d''Asaro, E.; Beale, R.; Beatty, C.; Blomquist, B.; Bloom, A. A.; Brooks, B. J.; Cluderay, J.; Coles, D.; Dacey, J.; DeGrandpre, M.; Dixon, J.; Drennan, W. M.; Gabriele, J.; Goldson, L.; Hardman-Mountford, N.; Hill, M. K.; Horn, M.; Hsueh, P. C.; Huebert, B.; de Leeuw, G.; Leighton, T. G.; Liddicoat, M.; Lingard, J. J. N.; McNeil, C.; McQuaid, J. B.; Moat, B. I.; Moore, G.; Neill, C.; Norris, S. J.; O''Doherty, S.; Pascal, R. W.; Prytherch, J.; Rebozo, M.; Sahlee, E.; Salter, M.; Schuster, U.; Skjelvan, I.; Slagter, H.; Smith, M. H.; Smith, P. D.; Srokosz, M.; Stephens, J. A.; Taylor, P. K.; Telszewski, M.; Walsh, R.; Ward, B.; Woolf, D. K.; Young, D.; Zemmelink, H.; Bull. Am. Meteorol. Soc. 2009, 90, 629. 275. Ovadnevaite, J.; Manders, A.; de Leeuw, G.; Ceburnis, D.; Monahan, C.; Partanen, A. I.; Korhonen, H.; O''Dowd, C. D.; Atmos. Chem. Phys. 2014, 14, 1837. 276. Gong, S. L.; Bartie, L. A.; Blanchet, J. P.; J. Geophys. Res. 1997, 102, 3805. 277. Witek, M. L.; Flatau, P. J.; Quinn, P. K.; Westphal, D. L.; J. Geophys. Res. 2007, 112, D08115. 278. Foltescu, V. L.; Pryor, S. C.; Bennet, C.; Atmos. Environ. 2005, 39, 2123. 279. Guitart, C.; García-Flor, N.; Miquel, J. C.; Fowler, S. W.; Albaigés, J.; J. Marine Syst. 2010, 79, 210. 280. Liss, P. S.; Slater, P. G.; Nature 1974, 247, 181. 281. Wurl, O.; Karuppiah, S.; Obbard, J. P.; Sci. Total Environ. 2006, 369, 333. 282. He, J.; Balasubramanian, R.; Atmos. Chem. Phys. 2010, 10, 1837. 283. Li, J.; Cheng, H.; Zhang, G.; Qi, S.; Li, X.; Environ. Pollut. 2009, 157, 273. 284. Gigliotti, C. L.; Brunciak, P. A.; Dachs, J.; Glenn, T. R.; Nelson, E. D.; Environ. Toxicol. Chem. 2002, 21, 235. 285. Pandit, G. G.; Sahu, S. K.; Puranik, V. D.; Venkat Raj, V.; Environ. Int. 2006, 32, 259. 286. Tsapakis, M.; Apostolaki, M.; Eisenreich, S.; Stephanou, E. G.; Environ. Sci. Technol. 2006, 40, 4922. 287. Iwata, H.; Tanabe, S.; Sakai, N.; Tatsukawa, R.; Environ. Sci. Technol. 1993, 27, 1080. 288. Baker, J. E.; Eisenreich, S. J.; Environ. Sci. Technol. 1990, 24, 342. 289. Dachs, J.; Bayona, J. M.; Fowler, S. W.; Miquel, J. C.; Albaigés, J.; Mar. Chem. 1996, 52, 75. 290. Nelson, E. D.; McConnell, L. L.; Baker, J. E.; Environ. Sci. Technol. 1998, 32, 912. 291. Totten, L. A.; Brunciak, P. A.; Gigliotti, C. L.; Dachs, J.; Glenn, T. R.; Nelson, E. D.; Einsenreich, S. J.; Environ. Sci. Technol. 2001, 35, 3834. 292. Sundqvist, K. L.; Wingfors, H.; Brorstöm-Lundén, E.; Wiberg, K.; Environ. Poll. 2004, 128, 73. 293. Fang, M. D.; Ko, F. C.; Baker, J. E.; Lee, C. L.; Sci. Total Environ. 2008, 407, 548. 294. Sabin, L. D.; Maruya, K.; Lao, W.; Diehl, D.; Tsukada, D.; Stolzenbach, K. D.; Schiff, K. C.; A pilot study of air-water exchange of organochlorine compounds at three coastal estuaries in southern California, SCCWRP Annual Report 2011, University of California, Los Angeles, 2011. 295. Dachs, J.; Calleja, M. L.; Duarte, C. M.; del Vento, S.; Turpin, B.; Polidori, A.; Herndl, G. J.; Agustí, S.; Geophys. Res. Lett. 2005, 32, L21807. 296. Hultin, K. A. H.; Nilsson, E. D.; Krejci, R.; Mårtensson, M. E.; Ehn, M.; Hagström, Å.; de Leeuw, G.; J. Geophys. Res. 2010, 115, D06201. 297. Nilsson, E. D.; Mårtensson, E. M.; van Ekeren, J. S.; de Leeuw, G.; Moerman, M. M.; O''Dowd, C. D.; Atmos. Chem. Phys. Discuss. 2007, 7, 13345. 298. Mårtensson, M.; Ph.D. Thesis, University of Stockholm, Sweden, 2007. 299. Callaghan, A. H.; de Leeuw, G.; Cohen, L.; O''Dowd, C. D.; Geophys. Res. Lett. 2008, 35, L23609. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access