Revisão
|
|
| Redes metalorgânicas e suas aplicações em catálise Metal-organic frameworks and their applications in catalysis |
|
André Luis Dantas Ramos * , #, I; Stefania TanaseII; Gadi RothenbergII
IDepartamento de Engenharia Química, Universidade Federal de Sergipe, Av. Marechal Rondon, S/N, B. Jardim Rosa Elze, 49100-000 São Cristóvão - SE, Brasil Recebido em 28/05/2013 *e-mail: aldramos@ufs.br Metal-organic frameworks (MOFs) form a new class of materials with well-defined yet tunable properties. These are crystalline, highly porous and exhibit strong metal-ligand interactions. Importantly, their physical and chemical properties, including pore size, pore structure, acidity, and magnetic and optical characteristics, can be tailored by choosing the appropriate ligands and metal precursors. Here we review the key aspects of synthesis and characterization of MOFs, focusing on lanthanide-based and vanadium-based materials. We also outline some of their applications in catalysis and materials science. INTRODUÇAO Desde a primeira metade do século XIX, a partir dos estudos de Berzelius, os catalisadores sao investigados pela comunidade científica e aplicados em diversos processos industriais. Ao longo da evoluçao dos estudos da Catálise, a introduçao de técnicas de caracterizaçao superficiais, a modelagem molecular e o desenvolvimento de métodos de síntese avançados transformaram a preparaçao de catalisadores de uma arte à base da tentativa e erro (a partir do conhecimento químico e experiência do pesquisador) em uma ciência multidisciplinar que permite o projeto molecular de catalisadores sólidos específicos para determinada aplicaçao. Destacam-se o desenvolvimento na síntese de zeólitas, "zeotypes" e materiais mesoporosos, que permitiram a introduçao, identificaçao e otimizaçao de sitos ativos bem definidos (prótons, ácidos de Lewis, redox) na estrutura destes materiais.1 No entanto, as dimensoes dos poros das zeólitas e zeotypes limitavam as reaçoes para moléculas com tamanho inferior a 1 nm, até a descoberta de zeólitas com poros maiores, na faixa dos mesoporos. Mesmo assim, algumas reaçoes sao limitadas nestes materiais pelo tamanho dos poros incompatíveis com moléculas como triglicerídeos e metaloporfirinas. Além disso, o controle e modulaçao das propriedades eletrônicas dos sítios ativos da rede ainda é muito limitado em comparaçao aos catalisadores à base de complexos de metais de transiçao. Esses problemas foram um pouco contornados com o desenvolvimento de materiais mesoporosos, mas os resultados ainda sao limitados. Nesse contexto, surgem os polímeros de coordenaçao, que combinam as funcionalidades de seletividade de poros e a modulaçao de propriedades eletrônicas dos organometálicos. Eles podem ser definidos como uma extensa rede de íons ou agrupamentos (clusters) metálicos coordenados a moléculas orgânicas multidentadas, em dimensoes porosas bem definidas.1 As redes metalorgânicas (metal organic frameworks-MOFs) pertencem a uma nova classe de polímeros de coordenaçao com desenvolvimento bem recente que alia três características: cristalinidade, alta porosidade e existência de forte interaçao metal-ligante orgânico.2 Na sua síntese pode-se modular tanto a estrutura porosa quanto as propriedades eletrônicas do sítio ativo, escolhendo cuidadosamente o ligante orgânico ou o modificando com tratamentos pós-síntese, mostrando grande potencial de aplicaçao industrial no século XXI, em especial na fabricaçao de produtos químicos e na química fina. Em termos de porosidade, as MOFs preenchem uma lacuna entre as zeólitas microporosas e silicatos mesoporosos. Quimicamente, os MOFs têm potencial para preencher a lacuna entre as zeólitas e as enzimas, pois podem ter três características: sítios polinucleares isolados, interaçao específica sítio ativo-substrato e um ambiente da cavidade com hidrofobicidade ajustável. Em especial, as MOFs à base de lantanídeos têm grande potencial para catálise heterogênea, visto que os íons lantanídeos têm uma esfera de coordenaçao flexível, tornando possível criar centros metálicos coordenativamente insaturados, com canais 1D de alta estabilidade térmica. Destacam-se também as MOFs à base de vanádio, para reaçoes de oxidaçao parcial, em especial a epoxidaçao. Cientistas consideram que o desenvolvimento das MOFs ainda está na sua infância, em especial sua aplicaçao em reaçoes catalíticas e processos industriais,3 visto que há vários desafios tecnológicos a serem superados com base no desenvolvimento científico. O presente artigo pretende abordar alguns aspectos da síntese e caracterizaçao das MOFs e revisar as suas principais aplicaçoes, especialmente catalíticas. Um enfoque especial será dado às MOFs à base de lantanídeos e vanádio.
HISTORICO DAS REDES METALORGANICAS Polímeros de coordenaçao sao conhecidos há décadas. Primeiramente, em 1954, Wells4 introduziu o conceito de estruturas cristalinas inorgânicas, onde os íons metálicos, agindo como nós, ligam-se entre si através de um espaçador (spacer), tais como as moléculas orgânicas multidentadas dos polímeros de coordenaçao. A topologia da rede resultante depende da geometria e do ambiente de coordenaçao dos nós, sendo o espaçador apenas uma conexao linear entre nós adjacentes.5 Um outro trabalho pioneiro registrado sobre polímeros de coordenaçao critalinos foi o de Kinoshita et al.,6 em 1959, descrevendo a estrutura do composto de cobre com adiponitrila e ânions nitrato. No entanto, nada foi discutido sobre a porosidade do material e, embora mais alguns trabalhos tenham sido publicados na década de 60, pouca atençao foi dada ao tema. Por volta de 1989, a partir do trabalho de Hoskins e Robson sobre redes poliméricas constituídas por segmentos tridimensionais com unidades de conexao tipo haste, em especial o composto {CuI[C(C6H4.CN)4]}nn+,7 esta classe de material foi "redescoberta". Em trabalho posterior,8 os autores mencionam o potencial uso destes materiais em Catálise, embora nao tenham realizado nenhum estudo. Outros trabalhos foram publicados no início da década de 90,9 sendo que a primeira aplicaçao catalítica, na reaçao de cianosililaçao de aldeídos, foi reportada por Fujita et al.10 em 1994 e o termo "metal-organic framework" surgiu na literatura de periódicos apenas em 1995 nos trabalhos do grupo de Yaghi,11 ressaltando-se que nenhum dos trabalhos citados mostrou dados de porosidade e pouco foco tenha sido dado para aplicaçoes catalíticas. Um grande avanço no estudo dos polímeros de coordenaçao ocorreu quando começou a se desenvolver materiais com porosidade permanente, estáveis termicamente e quimicamente e sem a presença de moléculas visitantes.12 O trabalho de Li et al.13 pode ser considerado um marco no estudo das MOFs e o primeiro caso de sucesso de síntese de um polímero de coordenaçao de altíssima porosidade e estabilidade. Os autores sintetizaram uma MOF 3-D com grupamentos de Zn4O e ácido tereftálico como ligante, [Zn4O(bdc)3], batizada de MOF-5, com uma estrutura cúbica e um sistema poroso tridimensional, área BET de 3800 m2 g-1, que manteve suas propriedades estruturais mesmo quando totalmente dessolvatada e aquecida até 300 ºC. A partir deste trabalho, várias MOFs foram sintetizadas com base neste bloco de construçao, com área porosa de até 6260 m2 g-1.14 Uma busca na base de dados Web of Knowledge até abril de 2013 mostra 5140 trabalhos com a palavra-chave "metal-organic framework" no título, sendo o mais antigo de 1995. Destes, 2439 trabalhos (47,5 %) foram publicados de 2011 até abril de 2013, mostrando a atualidade do tema.
NOMENCLATURA E DEFINIÇOES A síntese das MOFs passa pela adiçao de uma soluçao contendo o metal e outra com o componente orgânico. Ao juntar as duas, ocorre um processo de auto-arranjo (self-assembly), com os metais ou clusters formando os "nós" e a molécula orgânica as "hastes", atuando como ligante, cedendo os elétrons na ligaçao coordenada com o centro metálico. É possível, nessa estrutura, a presença de moléculas "visitantes" em seu interior. Além da ligaçao coordenada com o ligante orgânico, os átomos de metal podem estar coordenados com outras moléculas, tais como CO2, H2O, Cl, CN, etc. Existem algumas possibilidades de geometria do centro metálico, as chamadas unidades secundárias de construçao (secondary building units - SBUs), que representam a forma como o metal está cooordenado. A Figura 1 mostra algumas destas SBUs.15 Segundo Eddaoudi et al.,16 SBUs sao complexos moleculares e grupamentos nos quais os modos de coordenaçao do ligante e os ambientes de coordenaçao do metal podem ser utilizados para a transformaçao destes fragmentos em redes porosas estendidas usando ligantes politópicos. Em alguns casos, a SBU é composta apenas de um átomo de metal, em um bloco de construçao molecular chamado MBB (single-metal-ion-based molecular building block), que pode ser obtido in situ a partir de íons metálicos heteroquelados com ligantes multifuncionais.17 Em outros, há formaçao de um grupamento de átomos metálicos (cluster). Uma das mais comuns é a chamada "paddle-wheel" (haste-roda), representada na Figura 1A, onde dois átomos metálicos estao ligados a quatro grupos carboxílicos na configuraçao syn-syn,18 com os dois átomos de oxigênio do mesmo grupo carboxílico fazendo uma espécie de ponte com os dois átomos metálicos. Outras SBUs usuais sao a unidade básica de acetato de zinco octaédrica e o trímero prisma trigonal com um átomo de oxigênio no centro.2 Tranchemontagne et al.19 apresentam uma revisao com diversas SBUs que podem ser observadas nas MOFs, com três (Ex: triângulo), quatro (Ex: paddle-wheel, tetraedro), cinco (Ex: pirâmide quadrada), seis (Ex: prisma trigonal, octaedro), oito (Ex: octógono, prisma retangular), nove, dez, onze, doze, quatorze, quinze, dezesseis, dezoito e vinte e dois pontos de extensao, sendo estes geralmente átomos de carbono.
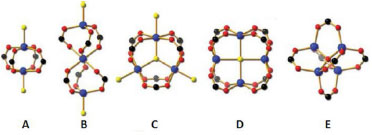 Figura 1. Unidades secundárias de construçao (SBUs) comumente observadas nas redes metalorgânicas. Código de cores: preto: carbono; vermelho: oxigênio; azul: metal; amarelo: outros. (A) haste-roda (padle-wheel) binuclear; (B) ampulheta trinuclear; (C) prisma trinuclear; (D) cubóide tetranuclear; (E) octaedro tetranuclear. Reimpressa com permissao de Acc. Chem. Res. 2011, 44, 123, 15 Copyright 2011 American Chemical Society
Quanto ao ligante orgânico, existem diversos compostos que podem ser utilizados. A Figura 2 mostra alguns deles. Destacam-se moléculas aromáticas policarboxiladas, bipiridinas e moléculas poliazoheterocíclicas (imidazol, triazol, tetrazol, pirimidina, pirazinas etc), sendo o ácido tereftálico um dos mais utilizados. Paz et al.20 apresentam uma revisao sobre o projeto de ligantes para MOFs funcionais, mostrando a relaçao entre a natureza e a estrutura de ligantes orgânicos especificamente projetados e as propriedades dos produtos. A posiçao dos grupos de coordenaçao nas moléculas do ligante é muito importante para definir aonde o metal irá se coordenar e como a rede irá crescer, definindo a estrutura final da MOF.
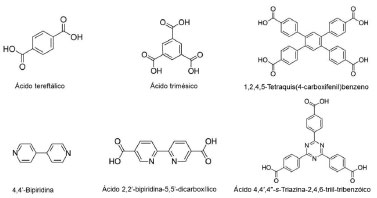 Figura 2. Ligantes (moléculas aromáticas policarboxiladas, bipiridinas e moléculas poliazoheterocíclicas) comumente utilizados na síntese de MOFs
Assim como as zeólitas, as MOFs sao compostas de células unitárias que se repetem, a partir da uniao das duas SBUs, formando uma rede tridimensional que dá a característica de porosidade e cristalinidade à MOF. Características geométricas e químicas das SBUs levam à prediçao da topologia da rede.16 Por exemplo, a MOF-5 reportada por por Li et al.13 tem uma célula unitária cúbica, sendo que em cada vértice um grupamento do tipo Zn4(O)O12C6 está presente, ligando-se através de uma molécula do ligante bdc, compondo as "arestas" do cubo, estrutura batizada de pcu (primitive cubic unit). Este cubo tem uma cavidade interna capaz de hospedar uma esfera de 18,5 Å. Existem várias outras estruturas de rede reportadas na base de dados RCSR (reticular chemistry structure resource), tais como diamante (dia), quartzo (qtz), colméia de abelha (63honeycomb), cooperita (PtS), SrSi2, ThSi2, NbO, sodalita (sod), cúbica de corpo centrado (bcu), etc.16,21 Em termos de nomenclatura, o pouco tempo de descoberta dessa família de material e o fato de ser um campo de pesquisa multidisciplinar, envolvendo a química do estado sólido, inorgânica e de coordenaçao, faz com que ainda nao haja uma nomenclatura padrao. Pelo contrário, há uma interposiçao de conceitos, terminologias e classificaçoes.22 Por exemplo, os termos "polímeros de coordenaçao" e "redes metalorgânicas" muitas vezes sao considerados sinôminos,12 ou que o último é um subgrupo do primeiro.1 Alguns autores consideram que, para ser MOF, deve ser provado que o material é poroso por meio de isotermas de adsorçao. Outros julgam que isto nao é necessário, bastando que o material tenha uma estrutura 2-D ou 3-D com ligantes orgânicos. Batten et al.22 concordam com esta última proposiçao e sugerem três classificaçoes: a primeira com base na estrutura ou topologia da rede (Ex: dia-MOF, srs-MOF); a segunda com base nos componentes (Ex: carboxylate-MOF, imidazolate-MOF, anionic-MOF) e a terceira com base nas propriedades (Ex: porous-MOF, porous-CP, spin transition-MOF). No entanto, Perry IV et al.5 consideram MOF uma subclasse de polímeros de coordenaçao 3-D apenas. Segundo Rowsell e Yaghi,2 é inapropriado o uso do termo MOF para materiais que foram caracterizados apenas por cristalografia, visto que é necessário que a molécula do solvente seja removida ou trocada sem a perda de integridade da rede. Na verdade, a síntese de estruturas abertas metal-ligante orgânico (Ex: metal-bipiridina) pode produzir muitas estruturas de rede catiônicas, mas o desafio é evitar o colapso da estrutura com a evacuaçao ou troca da molécula visitante. Para isto, é necessário o uso de ligantes multidentados (Ex: carboxilatos), a fim de que se forme uma estrutura rígida com ligaçoes do tipo M-O-C.16 Kitagawa et al.23 já tinha proposto algo parecido, classificando os polímeros de coordenaçao em geraçoes: a primeira seria composta por aqueles em que a rede porosa seria sustentada por moléculas vizinhas, que colapsaria com a remoçao das mesmas; a segunda seria de sistemas porosos robustos, com porosidade permanente, mesmo após a retirada de moléculas de solvente (as primeiras MOFs estariam classificadas nesta geraçao); e a terceira, com sistema poroso flexível, com possibilidade de mudanças reversíveis dependendo da presença de moléculas visitantes ou em resposta a estímulos externos, tais como luz, temperatura ou campos elétrico e magnético. A IUPAC iniciou um projeto de unificaçao de nomenclatura em 2009, denominado "Coordination polymers and metal-organic frameworks: terminology and nomenclature guidelines", ainda nao concluído, embora haja uma recomendaçao provisória já publicada.24 O documento define MOF como um polímero de coordenaçao (alternativamente rede de coordenaçao) com uma rede aberta (open framework) contendo espaços potenciais. Percebe-se que a IUPAC está caminhando para uma definiçao bem genérica, mas que deixa claro que o espaço interno precisa estar disponível e as moléculas do solvente devem estar livres para fluir e sua remoçao ser testada. O documento também recomenda fortemente o uso de topologia para melhorar a descriçao das estruturas dos cristais das MOFs e dos polímeros de coordenaçao 3-D, segundo descrito no trabalho de O'Keeffe et al.21 Até o presente momento, as MOFs têm sido batizadas com um acrônimo, seguido de um número sequencial em termos de descoberta. Os acrônimos podem indicar o tipo de material (Ex: MOF =metal organic framework; COF=covalent organic framework; RPF = rare earth polymeric framework), o tipo de estrutura (Ex: ZMOF=MOF com estrutura similar à uma zeólita; ZIF=zeolitic imidazole framework; IRMOF=MOF isoreticular) ou o laboratório que o material foi preparado (Ex: CPO = coordination polymer of Oslo). Uma alternativa a esta nomenclatura é o uso da fórmula empírica, expressando o(s) metal(is), o(s) ligante(s) e a estequiometria na célula unitária, podendo aparecer também a molécula "visitante". Ex: [Zn4(O)(bdc)3].3H2O, sendo que o oxigênio e a molécula de 1,4-benzenodicarboxilato (bdc) sao ligantes e a H2O é uma molécula "visitante".1 Também é adotada uma nomenclatura em relaçao às dimensoes da rede e sua conectividade: 0-D (molécula discreta, amorfa), 1D (filamentos), 2D (planos) e 3D (rede tridimensional).25
SINTESE E MODIFICAÇOES POS-SINTESE DE MOFS Experimentalmente, a síntese das MOFs é relativamente trivial, em temperaturas relativamente amenas (usualmente abaixo de 200 ºC), pela questao da estabilidade. Pode-se empregar até mesmo tubos de ensaio com rosca, a depender da temperatura da síntese, em condiçoes ambientes ou solvotérmicas (solvente a quente, pressurizado), com solvente puro ou mistura. Caso temperaturas maiores sejam necessárias, comumente se utilizam recipientes (liners) de teflon inseridos em vasos de aço inoxidável. O processo normalmente ocorre em recipiente único (one pot), sendo procedido de etapas de filtraçao e lavagem com solvente apropriado, nao sendo recomendada uma etapa de calcinaçao devido à baixa estabilidade térmica. Se experimentalmente nao há grandes dificuldades, a grande questao do processo da síntese é prever como ocorrerá o processo de auto-montagem (self assembly) do ligante e do centro metálico, o que exige conhecimento de química de coordenaçao, de estado sólido e exploraçao das condiçoes reacionais. Sendo assim, a criteriosa escolha do ligante e do precursor metálico é fundamental para a obtençao de uma MOF com as características desejadas. O processo de auto-montagem acontece pela formaçao de ligaçoes coordenadas entre o metal e o ligante, assim como ligaçoes mais fracas do tipo van der Waals ou pontes de hidrogênio entre os componentes nao metálicos.18 É possível preparar uma série de compostos com a mesma topologia de rede, mas diferindo apenas na natureza e tamanho do ligante, formando uma série de compostos isoreticulares.14 Uma dada combinaçao metal-ligante também pode levar a várias estruturas diferentes, fenômeno denominado polimorfismo.1 Segundo Makiura e Kitagawa,26 a fim de obter um material de alta porosidade, deve-se ter em mente que as moléculas têm uma tendência de se agregar, em ordem de estabilizar suas interaçoes intermoleculares. Logo, o processo de auto-montagem deve ocorrer com as moléculas se alinhando na superfície de uma forma que cada componente adota uma proximidade topológica ideal e distâncias que levam à criaçao de cavidades. Os autores descrevem dois métodos para preparo de MOFs 2-D: o método Langmuir-Blodgett, voltado para a fabricaçao de monocamadas bem ordenadas em substratos líquidos, e o método camada por camada (layer-by-layer), técnica representativa para crescimento de filme, onde um substrato sólido é utilizado para o crescimento de camadas consecutivas sobre a primeira camada formada pelo método anterior. Segundo Edaoudi et al.,16 existem duas estratégias para a síntese de estruturas rígidas porosas: uma, chamada expansao, faz o uso de ligantes longos (Ex: 4,4'-bipiridina) que aumentam o espaço entre os vértices da rede, gerando espaços vazios proporcionais ao comprimento do ligante. Assim, uma ligaçao é substituída por uma sequencia de ligaçoes. O grande problema desta estratégia é a grande possibilidade de interpenetraçao de rede, isto é, uma malha de rede se interpoe à outra, diminuindo os espaços vazios e, consequentemente, a porosidade. Segundo os autores, as estruturas de rede com maior possibilidade de interpenetraçao sao a cúbica, diamante e SrSi2. Por contrassenso, quanto maior o tamanho do espaço vazio de uma célula unitária, maior a tendência de interpenetraçao, embora o fenômeno nao impeça a obtençao de materiais porosos abertos. Cristais com poros extralargos sao naturalmente instáveis e só se estabilizam com a ocorrência do fenômeno de interpenetraçao ou com a inclusao de moléculas visitantes.27 A segunda estratégia, chamada decoraçao, envolve o uso de grupamentos metálicos (clusters) ao invés de átomos individuais nos vértices da rede. Desta forma, estes grupamentos rígidos (ex: cluster metal-carboxilato) ocupam o vértice de células unitárias (Ex: cubo) e sao conectados por estruturas estáveis de ligantes politópicos (ex: anel benzênico do ligante 1,4-benzenodicarboxilato), formando uma rede rígida, aberta e sem a tendência de interpenetraçao. Burnett e Choe28 definem um processo chamado auto-montagem sequencial, no qual primeiro se sintetiza uma estrutura, que serve de modelo de partida para outras etapas do processo de auto-montagem. Eles descrevem três estratégias de síntese: inserçao do ligante no modelo de partida, substituiçao de um ligante do modelo de partida por outro ou entao remoçao do ligante do modelo de partida 3-D, substituindo-o por uma molécula, formando uma MOF 2-D. Hoskins e Robson8 introduziram o conceito de síntese de compostos polinucleares com blocos de construçao (building-block approach) em 1990. Desde entao, muitos autores têm utilizado este método, trazendo novas contribuiçoes. Um exemplo é a síntese reportada por Tanase et al.29 de MOFs à base de lantanídeos. Os autores comentam que a grande esfera de coordenaçao dos lantanídeos faz com que nao seja fácil inseri-los em uma estrutura altamente ordenada como as MOFs. Uma maneira de superar este problema é associá-los com íons metais de transiçao. No entanto, desta forma nao é possível controlar a posiçao do lantanídeo na estrutura da MOF, o que, na verdade, fornece as propriedades óticas e de luminescência. Assim, os autores propuseram um método de síntese baseado na afinidade dos íons lantanídeos a ligantes contendo doadores híbridos oxigênio-nitrogênio (Ex: ácido 5-metil-2-pirazina carboxílico - Hmpca), realizando um bloco de construçao de lantanídeos in situ, associando-os com [Mo(CN)8]4-, conforme mostra a Figura 3. Dessa forma, obteve-se uma rede porosa 3-D, com interessantes propriedades magnéticas e de luminescência.
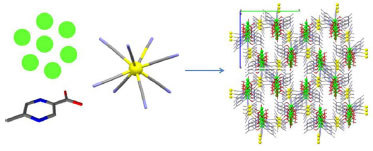 Figura 3. Síntese pelo método dos blocos de construçao da MOF [Ln(mpca) 2(CH3OH)2Ln(H2O)6Mo(CN)8]·xCH3OH·yH2O. Código de cores: verde: lantanídeo; vermelho: oxigênio; amarelo: molibdênio; azul: nitrogênio; cinza: carbono. Atomos de Ln (III) estao coordenados com átomos de Mo (IV), moléculas de metanol e com o ligante orgânico 5-metil-2-pirazina carboxilato - mpca, tanto no átomo de nitrogênio quanto nos átomos de oxigênio do grupo carboxila, formando uma rede tridimensional
Algumas MOFs podem ser sintetizadas com ligantes ou moléculas de solventes passíveis de serem removidos com tratamentos pós-síntese (Ex: aquecimento). Desta forma, o sítio metálico pode ficar com uma posiçao de coordenaçao livre para agir como catalisador, sensor ou sítio de adsorçao. Neste caso, a estratégia é a utilizaçao de ligantes que se adsorvem fracamente no sítio metálico (ex: metanol, etanol) como solventes na síntese, que ficam apontados para o centro da rede, podendo se dissociar e ser evacuado dos póros, produzindo centros metálicos abertos e redes porosas.16 Para evitar o bloqueio da esfera de coordenaçao em torno do centro metálico pelo ligante orgânico, além da estratégia anterior, outras duas sao utilizadas:1
Deve-se levar em conta que, muitas vezes, os grupos funcionais nao sao incorporados no ligante, mas ficam coordenados diretamente com o metal, o que nao é desejável. Outro ponto que deve ser levado em conta é que o tratamento deve preservar a estrutura da MOF. Uma das funcionalizaçoes mais empregadas é no carbono do anel aromático de MOFs que utilizam ácido tereftálico como ligante. Um dos trabalhos pioneiros na pós-funcionalizaçao de MOFs foi o de Wang e Cohen,31 que utilizaram MOFs com grupamentos amina (IRMOF-3) tratadas com anidrido acético, obtendo-se uma MOF de acetamida. Posteriormente os autores publicaram dois artigos de revisao,30,32 citando vários outros processos de pós-funcionalizaçao, tais como alquilaçao de grupos piridínicos com haletos de alquila, oxidaçao do átomo de enxofre com dimetildioxirano, modificaçao do grupo amina da MOF-3 com 1,3-propanosultona e 2-metilaziridina, ou com salicilaldeído, seguido de metalaçao com vanádio, transformaçao do grupo amina livre em iso(tio)cianatos reativos através de reaçao com difosgênio ou tiofosgênio, dentre outras. Goesten et al.33 reportaram um novo método pós-funcionalizaçao de MOFs, visando introduzir acidez nas mesmas para aplicaçoes em catálise, que consiste no tratamento das MOFs MIL-101 (Cr) e MIL-53 (Al), ambas tendo como ligante o ácido tereftálico, com uma mistura de anidrido trifluorometanossulfônico e ácido sulfúrico. Os autores verificaram, por infravermelho, a presença do grupo sulfoxi, com acidez de Bronsted e atividade catalítica para várias reaçoes que exigem sítios ácidos, que serao discutidas na seçao específica de catálise. Recentemente, o método "click chemistry" se mostrou adequado para projetar MOFs sob medida, promovendo reaçoes in situ dos grupos funcionais com alcinos.34
CARACTERIZAÇAO DE MOFS Sendo as MOFs materiais cristalinos de alta área superficial, as técnicas de caracterizaçao sao as usuais de materiais com estas características, tais como as zeólitas. Como a estabilidade da MOF é sempre uma preocupaçao, as técnicas de caracterizaçao muitas vezes sao utilizadas tanto após a síntese quanto após aquecimento e/ou vácuo, para comprovar a manutençao das propriedades da MOF após a remoçao de moléculas visitantes, por exemplo. Uma característica importante é a estabilidade térmica da MOF. Para este monitoramento, a técnica indicada é a análise térmica gravimétrica (TGA) e diferencial (DSC). A MOF precisa mostrar uma perda negligível de massa entre a temperatura de dessorçao da molécula visitante e o colapso da estrutura, que deve ocorrer na maior temperatura possível.2 Normalmente a técnica é utilizada sob fluxo de gás inerte (Ex: He, Ar, N2). Ao final do experimento, tanto moléculas visitantes quanto ligantes foram decompostos e, normalmente, a massa restante é apenas do óxido metálico. A Figura 4 mostra espectros de análise termogravimétrica da MOF [La(btb)(H2O)·3dmf], onde btb é o ligante 1,3,5-tris(4-carboxyphenyl)benzeno, reportada por Mu et al.35 Nota-se que, após remoçao das moléculas visitantes de dimetilformamida (dmf) e da molécula de água coordenada (de 20-325 ºC), o composto se mantém estável até 560 ºC, podendo ser considerada uma das MOFs de lantanídeos mais estáveis reportadas na literatura. O mesmo ocorre no caso de uma troca de solvente com diclorometano e após ativaçao a 330 ºC, o que na verdade reflete a estabilidade da MOF inicial. Vale ressaltar que a MOF ativada mostrou uma área superficial BET elevada, de 1014 m2 g-1.
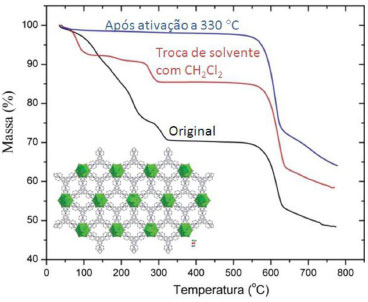 Figura 4. Análise termogravimétrica da MOF [La(btb)(H2O).3dmf]n, como sintetizada e após as etapas de ativaçao a 330 °C e troca de solvente com diclorometano. A MOF mostra alta estabilidade térmica, mesmo após os processos de troca de solvente e ativaçao térmica. Adaptado da referência 35 com permissao da The Royal Society of Chemistry
Para checar se a síntese foi bem sucedida, isto é, se houve a formaçao da rede composta pelo centro metálico e os ligantes, a técnica de espectrometria de absorçao no infravermelho pode ser empregada, para checar as bandas características do ligante. As bandas mais investigadas sao as do grupo carboxilato, dos anéis imidazólico e piridínico e da hidroxila. Quanto ao grupo carboxilato, as bandas mais investigadas sao a de vibraçao de alongamento assimétrica (em torno de 1550-1620 cm-1) e simétrica (em torno de 1385-1430 cm-1). A diferença de frequência entre estas duas bandas pode indicar se a coordenaçao com o ligante é bidentada (diferença em torno de 205 cm-1). Quanto ao anel imidazólico, existe uma banda característica da ligaçao C=N em torno de 1467 cm-1, enquanto o anel piridínico é em torno de 1500-1590 cm-1. Quanto à hidroxila, a regiao característica de várias bandas é de 3000-4000 cm-1.27,33,36,37 Dependendo do ligante, outras bandas específicas podem ser investigadas. Alguns autores empregam a técnica de ressonância magnética nuclear em estado sólido para checar a presença de grupos funcionais e o ambiente químico do centro metálico das MOFs, assim como a dinâmica de moléculas visitantes.2,33,38 A cristalinidade da MOF deve ser checada por difraçao de raios-X, tanto do pó (PXRD) quanto do monocristal, que também pode ser utilizada para verificar a pureza do composto sintetizado. A técnica, aplicada a monocristais, permite refinar (resolver) a estrutura e determinar padroes de rede (Ex: espaço d, I/I0, hkl) que auxiliam na determinaçao da topologia da mesma. Técnicas de microscopia, tais como a microscopia eletrônica de transmissao (TEM), também fornecem informaçoes sobre a estrutura e cristalinidade, assim como a presença de defeitos.36,39 A Figura 5 mostra espectros de difraçao de raios-X (parte inferior) e de absorçao no infravermelho (parte superior) da MOF MIL-71 (ou VIII2(OH)2F2{O2C-C6H4-CO2}.H2O) sintetizada por Barthelet et al.40 Esta MOF tem uma estrutura tridimensional que consiste de camadas construídas por octaedros de [VIIIO2(OH)2F2] conectados por unidades orgânicas de tereftalatos. Moléculas livres de água estao presentes em pequenas cavidades da estrutura e estao ligadas por pontes de hidrogênio a hidroxilas, o que pode ser comprovado pelos espectros de infravermelho. Os espectros de difraçao de raios-X mostram que esta MOF é estável até 250 ºC, temperatura a partir da qual se inicia um processo que a torna amorfa.
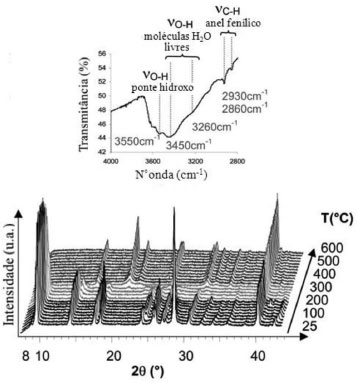 Figura 5. Espectros de absorçao no infravermelho e de difraçao de raios-X da MOF MIL-71 (ou VIII 2(OH)2F2{O2C-C6H4-CO2}.H2O) submetida a aquecimento até 600 °C. As bandas de infravermelho em torno de 3500 cm-1 confirmam a presença de grupos OH e água na estrutura, enquanto as bandas em torno de 2900 cm-1 sao características dos anéis fenílicos do ligante. Os espectros de DRX mostram estabilidade até 250 °C. Adaptado da referência 40 com permissao da The Royal Society of Chemistry
A porosidade da MOF pode ser comprovada por técnicas de adsorçao, sendo a adsorçao de N2 a 77 K, tanto pelo método volumétrico quanto gravimétrico, a mais indicada. Como normalmente as MOFs sao microporosas, isotermas do tipo I (classificaçao IUPAC) sao os mais comuns e as equaçoes de Dubinin-Radushkevich, t-plot e Langmuir podem ser aplicadas para determinaçao das propriedades texturais (área superficial e volume de póros) a partir dos dados do volume adsorvido em funçao da pressao relativa (p/p0), embora, usualmente, a equaçao BET seja aplicada. Há estudos com adsorçao de outros compostos, tais como CO2, H2O e álcoois. Quando há interesse nas propriedades de luminescência, torna-se necessário medir o espectro de excitaçao-emissao em estado sólido da MOF, realizado em espectrofluorômetro, normalmente na faixa de 250 a 550 nm, além da medida do tempo de luminescência, também realizada em espectrofluorômetro, em comprimento de onda específico de maior emissao.27,29,41 Dependendo das características das MOFs e aplicaçoes desejadas, outras técnicas de caracterizaçao podem ser empregadas, tais como espectroscopia fotoeletrônica de raios-X (XPS), de absorçao de raios-X (XANES), de reflectância difusa (DRS), de absorçao no UV-VIS, suscetibilidade magnética, análise elementar, etc.
CARACTERISTICAS E APLICAÇOES DAS MOFS Embora as MOFs porosas tenham um desenvolvimento bastante recente, fica clara a série de vantagens desta classe de material. Primeiramente, sua síntese é relativamente simples, na qual se pode modular tanto a estrutura porosa quanto o ambiente químico do sítio ativo, selecionando criteriosamente os blocos de construçao (metal e ligante orgânico) e como eles estao conectados. As zeólitas e compostos similares (aluminofosfatos, silicoaluminofosfatos) nao possuem esta flexibilidade, já que a unidade de construçao secundária (SBU) sao tetraedros de sílica e alumina, com ligaçoes rígidas e bem definidas entre átomos de Si/Al com oxigênio, nao sendo tao fácil de alterar nem a composiçao química nem a estrutura, fazendo que suas principais aplicaçoes estejam relacionadas apenas às moléculas visitantes pequenas dentro de sua estrutura.17 Quanto às propriedades porosas, com a possibilidade de controle das mesmas, as MOFs podem atuar como peneiras moleculares, selecionando-se as moléculas que podem se difundir nos poros. Dessa forma, as MOFs preenchem uma lacuna entre catalisadores organometálicos superficiais nao porosos, zeólitas microporosas e silicatos mesoporosos, com poros que podem variar de ultramicroporos a mesoporos. Em reaçoes em que o controle difusivo nao é desejado, pode-se projetar MOFs com poros largos, que se mantêm após ativaçao. Em geral, a área superficial pode atingir 6300 m2/g e volume de poros de 2 cm3/g, com poros de dimensoes e topologias variadas. A presença de forte interaçao metal-ligante pode (e deve) conferir porosidade permanente ao material, mesmo após a retirada de moléculas de solvente, sem colapso da estrutura. Esta alta área superficial, facilidade de ajuste do tamanho dos póros e de outras propriedades fizeram com que uma de suas primeiras aplicaçoes reais fosse na área de separaçao e armazenamento de gases e mostram o potencial para Catálise. Rosi et al.42 publicaram um dos primeiros trabalhos de aplicaçao de MOFs para armazenamento de hidrogênio, no caso a MOF-5, capaz de adsorver 4,5% do seu peso (17,2 moléculas de hidrogênio por unidade), a 78 K e 1% à temperatura ambiente e pressao de 20 bar. Com a IRMOF-6 e IRMOF-8, encontrou-se o dobro de consumo (2%), à temperatura ambiente e 10 bar. Os autores identificaram dois sítios de adsorçao, sendo um no átomo de zinco e outro no ligante BDC. Trabalhos posteriores com a MOF-5 obtiveram uma capacidade de armazenamento de 7,1% a 77 K e 40 bar, 10% a 100 bar e uma densidade de estocagem de 66 g L-1, próxima do N2 líquido.43 Murray et al.43 publicaram uma revisao sobre esta aplicaçao. Segundo eles, para o desenvolvimento de células a combustível, há necessidade de desenvolver materiais de baixo custo e peso, que possam estocar hidrogênio rápida e reversivelmente, em condiçoes próximas da ambiente, com uma densidade igual ou maior à do hidrogênio líquido. As MOFs, com suas altas áreas superficiais, seriam candidatas naturais para esta aplicaçao. A adsorçao seria por forças de van der Waals, isto é, com baixo calor de adsorçao (4-7 kJ mol-1) e fracas. Isto faz com que o principal desafio para esta aplicaçao seja aumentar esta energia de ligaçao, de forma que quantidades significativas podem ser adsorvidas à temperatura ambiente. Cargas parciais na estrutura tornariam a ligaçao mais forte, de caráter dipolo-dipolo. Caso a entalpia de adsorçao chegue a 20 kJ mol-1, a quantidade fisissorvida poderia aumentar num fator de 3-4. Calores de adsorçao maiores que este nao seriam desejados, por resultar em grandes liberaçoes de calor no momento da adsorçao e dificuldade de dessorçao. Três métodos poderiam ser empregados para este aumento: introduzir sítios de coordenaçao metálicos abertos, promover a interpenetraçao (criando pequenos poros) e o fenômeno de spillover (migraçao do hidrogênio do metal para a rede). A quantidade adsorvida também dependeria do tamanho do póro. Os autores citam mais de 150 trabalhos de adsorçao de H2 com MOFs e procuraram relacionar a estrutura delas com a performance de armazenamento, através de técnicas de caracterizaçao. Outra revisao interessante sobre o assunto é a publicada por Sculley et al.44 Segundo Czaja et al.,45 embora sejam conhecidas várias características promissoras, apenas um número limitado de aplicaçoes para as MOFs já foram discutidas, sendo que nenhuma delas foi aplicada industrialmente. No entanto, os autores apontam várias aplicaçoes promissoras, dentre elas a purificaçao, separaçao e estocagem de gases e catálise heterogênea. O potencial para armazenamento reside na alta área superficial e ausência de volumes mortos. Além do hidrogênio, eles citam o armazenamento de metano e acetileno, que também foram estudados por outros autores. Na purificaçao de gases, os autores citam a remoçao de traços de compostos de enxofre, aminas, fosfinas, oxigenados, álcóois e água que, por serem compostos doadores de elétrons, teriam muita afinidade a sítios de coordenaçao metálicos disponíveis, com uma capacidade de adsorçao (70 g de tetrahidrotiofeno por L de MOF) uma ordem de magnitude superior a materiais comerciais à base de carvao ativado. Na separaçao de gases, eles citam a separaçao de criptônio do xenônio, de metano do gás natural e de hidrogênio do nitrogênio já realizadas com MOFs, sendo a separaçao do CO2 de emissoes gasosas uma das aplicaçoes mais promissoras, embora atualmente o desempenho seja inferior aos tradicionais lavadores com soluçoes de amina. A aplicaçao para adsorçao seletiva e separaçao de gases também foi estudada por Li et al. 46 Segundo os autores, a capacidade de adsorçao depende da pressao de equilíbrio, temperatura, natureza do adsorbato e dos microporos do adsorvente. Já a seletividade para adsorçao é significativamente mais complicada de prever, mas dependeria dos mesmos fatores. A flexibilidade da síntese das MOFs, tanto na estrutura porosa quanto química, tornam essas redes promissoras para esta aplicaçao. Interaçoes específicas molécula visitante-matriz (Ex: pontes de hidrogênio) podem ser geradas com a remoçao de moléculas do solvente, fazendo a MOF ter bastante afinidade para adsorçao de certos grupos funcionais, tais como álcoois.16 Férey et al47 sintetizaram uma MOF à base de cromo e tereftalato, batizada de MIL-101, com célula unitária cúbica, com duas cavidades, uma maior hexagonal e uma menor pentagonal, área BET de 4100 m2 g-1. Devido às largas janelas, eles visualizaram aplicaçao deste material para adsorçao de gás ou moléculas maiores. Eles provaram isto com a incorporaçao de poliânions Keggin, com o precursor K7PW11O40.nH2O e vislumbraram possibilidade de introduçao de espécies e a promoçao de reaçoes favorecidas por efeito de confinamento (similar à pressao), com monodispersao de nanomateriais e carreador de princípios ativos de medicamentos, com liberaçao controlada (drug delivery). Esta última aplicaçao tem sido estudada por alguns grupos, tomando como princípio a alta área superficial das MOFs e a possibilidade de armazenar moléculas orgânicas um pouco maiores, com seletividade. Horcajada et al.48 reportaram uma capacidade de adsorçao de até 1,4 gramas de ibuprofen por grama da MOF MIL-101 desidratada, com liberaçao controlada. Vallet-Regí et al.49 destacam a aplicaçao em reparo de tecidos ósseos. Um grupo de pesquisa brasileiro, da UFPE, reportou um trabalho com o método de acoplamento molecular para distinguir o desempenho de medicamentos candidatos para incorporaçao em MOFs.50 Outros trabalhos interessantes do mesmo grupo abordam o uso de MOFs à base de lantanídeos com propriedades fotoluminescentes que podem ser utilizadas como marcadores óticos para identificaçao de resíduos de pólvora, em especial em muniçoes sem chumbo.51,52 A propósito, este mesmo grupo publicou, até o momento, o único artigo de uma revista nacional indexada, em português, sobre MOFs, na revista Química Nova, abordando a síntese hidrotermal da MOF [Zn(bdc)(H2O)2]n assistida por microondas,53 embora se encontrem na literatura alguns artigos sobre polímeros de coordenaçao,54,55 mas sem atender ao critério definido para MOF: manter uma estrutura porosa após remoçao de moléculas do solvente. Uma pesquisa no portal do periódico "Brazilian Journal of Chemical Society" mostra apenas 1 trabalho sobre MOF, do prof. Ricardo Longo, da UFPE, um trabalho teórico sobre a análise conformacional de um dipeptídeo protonado dentro das cavidades de MOFs tipo IRMOFs-phen, com ligante 2,7-dicarboxilato fenantreno, com aplicaçao na catálise enantiomérica.56 Quanto à aplicaçao como sensores químicos, ela pode estar baseada tanto nas propriedades magnéticas quanto óticas. Algumas MOFs têm algumas de suas propriedades magnéticas alteradas (Ex: temperatura crítica de magnetismo, ferrimagnetismo/ferromagnetismo/antiferromagnetismo) quando armazenam/liberam moléculas visitantes devido a transformaçoes estruturais reversíveis, seja devido à mudança de estrutura amorfa para cristalina, seja uma transformaçao de fases cristalinas. Desta forma, elas podem ser utilizadas como sensores de reconhecimento molecular. As moléculas mais comuns que provocam estas transformaçoes sao água e álcoois.57,58 Sendo assim, MOFs com estruturas flexíveis têm um interesse tecnológico intrínseco para sensores. Esta sensibilidade está bastante relacionada com a existência de sítios de coordenaçao metálicos livres. A propriedade de luminescência também está relacionada a isto. Em geral, a luminescência é resultante de decaimento radiativo (isto é, emissao de luz) por moléculas eletronicamente excitadas, após um processo de absorçao de energia. Quando esta absorçao ocorre de um campo eletromagnético na forma de fótons (luz), a subsequente emissao de luz é chamada de fotoluminescência.59 No caso das MOFs, a luminescência pode ocorrer tanto devido a estruturas presentes nos ligantes (Ex: grupos aromáticos) quanto devido a íons lantanídeos com esta habilidade, tais como a M2(bdc)3.(H2O)4 , sendo M= Eu ou Tb, reportada por Reineke et al.41 Isto gera potencial de aplicaçao tanto para sensores químicos como para fotocatálise, mostradores eletroluminescentes, detecçao de radiaçao, efeitos óticos nao lineares, etc.27,59 Na aplicaçao como sensor químico, quando as moléculas do solvente sao liberadas, centros metálicos ficam disponíveis para adsorverem moléculas como a própria água, amônia ou outras moléculas que sao emissoras ou sensíveis. Quando ocorre esta adsorçao, a constante de decaimento de luminescência ou comprimentos de onda do espectro de emissao se alteram, podendo assim se utilizar destas medidas para detectar a presença destas moléculas. Allendorf et al.60 descrevem o chamado efeito antena, que consiste na presença de um composto fluoróforo, seja na estrutura da MOF, seja adsorvido no centro metálico, que tem a funçao de aumentar a intensidade e tempo de luminescência através da transferência de energia absorvida para o metal, o que em geral é necessário nos lantanídeos, que emitem fluorescência com comprimento de onda bem definido, mas que possuem baixo coeficiente de absorçao de radiaçao, principalmente quando há moléculas de água coordenadas. Quanto à aplicaçao para troca iônica, trata-se de uma das mais antigas. O trabalho de Hoskin e Robson, em 1990, já previa a capacidade de troca de ânions com polímeros de coordenaçao porosos.8 Aliás, esta é uma diferença em relaçao às zeólitas, que normalmente trocam cátions, enquanto as MOFs tendem a ter redes catiônicas, construídas com íons metálicos catiônicos e ligantes neutros, tendo preferência para acomodar contra-ânions em sua cavidade, ligado ao metal. Hoje existem vários registros do uso das MOFs para esta aplicaçao: troca H/D, BF4-/PF6-, NO2-1/NO3- e hidrogênio. 57 No entanto, a maior parte das aplicaçoes industriais envolve troca de cátions, para tratamento de água, por exemplo. Trocar o metal dos nós pode significar o colapso da estrutura. Sendo assim, a estratégia para troca catiônica passa por desenvolver MOFs iônicas, com a rede aniônica necessitando de contra-cátions.61,62 Por exemplo, com estruturas similares às zeólitas.63
MOFS APLICADAS A CATALISE Alguns bons artigos de revisao da aplicaçao das MOFs em catálise já foram publicados,1,12,64 muitos deles mais focados na catálise assimétrica/enantioseletiva,65-68 centenas de reaçoes já foram reportadas, de forma que o objetivo deste artigo é fornecer ao leitor uma visao geral, explicar onde reside esta atividade catalítica e dar um foco um pouco maior na aplicaçao catalítica de duas classes de MOFs: à base de lantanídeos e de vanádio. Conforme já discutido anteriormente, algumas características das MOFs, tais como alta área superficial e flexibilidade de síntese e da estrutura, tornam-nas promissoras para aplicaçoes catalíticas. Isto já foi vislumbrado pelos primeiros autores que trabalharam com polímeros de coordenaçao.10 A estrutura porosa modulável as tornam candidatas naturais a reaçoes que exigem seletividade de forma, tais como as zeólitas. Quanto ao ambiente químico, é possível modular as interaçoes entre a fase ativa e a molécula visitante (inclusive moléculas adsorvidas) e os estados de transiçao formados por reaçoes químicas. As MOFs permitem uma alta densidade de sítios catalíticos, em particular quando os sítios ativos sao metais de transiçao. No entanto, na prática, este uso ainda é bastante restrito, devido a uma combinaçao de dois fatores: a menor estabilidade em relaçao à temperatura, umidade e reagentes comparada com materiais similares, como as zeólitas, e o bloqueio de sítios ativos pelo ligante orgânico, nao deixando posiçoes livres disponíveis para quimissorçao dos reagentes.1 Quanto à baixa estabilidade, isto se deve à presença de ligantes orgânicos e à menor força da ligaçao metal-ligante comparada às ligaçoes covalentes Si-O. Quanto à estabilidade química, ela está bastante relacionada com o metal de coordenaçao e costuma ser maior em hidrocarbonetos e solventes apolares. A umidade pode afetar a estabilidade estrutural das MOFs. Quanto à estabilidade térmica, ela é limitada à faixa de 300-400 ºC em ar, dependendo do ligante orgânico utilizado. Sendo assim, o desenvolvimento recente de MOFs com aplicaçoes catalíticas passa por minimizar estes problemas. Corma et al.1 dividiram a atuaçao das MOFs em Catálise em 3 grandes grupos:
Por fim, moléculas visitantes cataliticamente ativas também podem ser hospedadas, sendo as metaloporfirinas uma das mais utilizadas,70 dada a sua atividade para oxidaçao de alcanos, epoxidaçao e ciclopropanaçao de alcenos. Como moléculas grandes sao incorporadas dentro de cavidades, estas sínteses sao chamadas de ship-in-a-bottle. Neste caso, ocorre uma espécie de transformaçao de um catalisador homogêneo em um heterogêneo e um aumento da estabilidade da molécula visitante. A incorporaçao de heteropoliânions, tais como os polioxometalatos, que podem exibir acidez de Brönsted elevada, promovendo reaçoes como hidrataçao de alcenos, esterificaçao, alquilaçao e oxidaçao seletiva, também tem sido estudada, superando as desvantagens deste material de possuir baixa área superficial e ter tendência à aglomeraçao.71 Um grande potencial das MOFs é o desenvolvimento de materiais com grupamentos polinucleares, que se assemelham muito às enzimas, que aliam esta característica a um ambiente químico e estrutural específico. Os MOFs têm potencial para preencher a lacuna entre as zeólitas e as enzimas se tiverem três características: sítios polinucleares isolados, interaçao específica sítio ativo-substrato e um ambiente da cavidade com hidrofobicidade ajustável. Dada a similaridade com as enzimas, este material é denominado biomimético. O reconhecimento molecular é característico das enzimas, com uma resposta substrato-sítio ativo específica. Ele nao é possível nas zeólitas, dada a rigidez da sua estrutura, mas é perfeitamente possível nas MOFs, dada a flexibilidade de sua síntese e ao fato da sua estrutura ser flexível (MOFs de terceira geraçao). Quanto à hidrofobicidade, ela pode ser controlada nas MOFs, tanto pela escolha do ligante quanto por modificaçoes pós-síntese, o que pode aumentar a eficiência catalítica para determinada reaçao.12 De uma forma geral, a baixa estabilidade térmica limita o uso das MOFs em reaçoes em fase gás, em temperaturas acima de 300 ºC, tais como refino e processos petroquímicos, principalmente se as reaçoes geram coque e produtos mais pesados.1 Nesses casos, as zeólitas continuarao a ser utilizadas, mas, em reaçoes a baixas temperaturas, tais como a isomerizaçao de alcanos, é esperado que as MOFs desativem muito menos, além de ser possível sintetizar facilmente MOFs com sítios metálicos/ácidos bifuncionais. Também se vislumbra um grande potencial de uso das MOFs em reaçoes de síntese orgânica em fase líquida, aplicadas principalmente na química fina. A literatura mostra a aplicaçao das MOFs em diversas reaçoes químicas. As MOFs têm flexibilidade para atuar como catalisador ácido de Lewis, ácido de Bronsted (Ex: acilaçao Friedel-Crafts), base de Lewis, reaçoes de oxidaçao e polimerizaçao/formaçao de ligaçao C-C (Ex: acoplamento Suzuki-Miyaura). Como testes catalíticos para avaliar seus sítios ácidos de Lewis, a reaçao de cianosililaçao de aldeídos, representada na Figura 6, é comumente empregada.72 Já para sítios básicos, a reaçao de condensaçao de Knoevenagel é bastante estudada.73 A condensaçao Aldol, representada na Figura 7, é uma outra reaçao bastante empregada para avaliar os sítios ácidos e básicos de Lewis.74,75 Há ainda registro de diversas reaçoes nas quais os MOFs possuem atividade catalítica, tais como: hidrogenaçao, reduçao de nitrobenzeno, isomerizaçao, acetalizaçao, hidrodessulfurizaçao, (trans)esterificaçao, etc.1
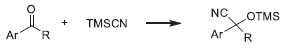 Figura 6. Reaçao de cianosililaçao de aldeídos (R=H) ou cetonas (R=grupo alquílico), utilizada para caracterizar os sítios ácidos das MOFs
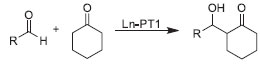 Figura 7. Reaçao de condensaçao Aldol da cicloexanona com aldeídos, utilizada para caracterizar os sítios básicos das MOFs
Vale destacar uma classe de reaçoes onde as MOFs têm sido aplicadas: a catálise assimétrica (enantiomérica), resultante da flexibilidade da sua estrutura das MOFs. O confinamento de substratos quirais ou configuraçoes particulares de complexos organometálicos nos microporos, inclusive com possibilidade de rotaçao como resultado de estímulo externo ou molécula visitante, pode induzir ou promover a enantioseletividade, de grande valor na indústria de fármacos. Estas MOFs sao sintetizadas com base na escolha criteriosa de blocos de construçao quirais, por meio do uso de direcionadores de estrutura (templates) ou de modificaçoes pós-síntese e troca de molécula visitante.66 O mesmo princípio serve para explicar a aplicaçao destas MOFs homoquirálicas para separaçao de enantiômeros.
CATALISE COM MOFS A BASE DE VANADIO O vanádio é um metal de transiçao do grupo 5B. O óxido de vanádio e seus derivados (Ex: fosfatos - VPO, aluminofosfatos e acetilacetonatos) têm sido utilizado na Catálise em uma série de aplicaçoes, principalmente em oxidaçoes seletivas, tanto com complexos homogêneos à base de vanádio ou com estes imobilizados em matrizes micro ou mesoporosas como sílica e zeólitas, na forma heterogênea.76 Por exemplo, a oxidaçao parcial do n-butano a anidrido maleico utilizando óxido misto de vanádio e fósforo é um processo comercial, sendo as ligaçoes V-O-suporte funcionalidades cinéticas críticas para esta reaçao.77 A epoxidaçao de olefinas, de interesse para produçao de epóxidos como os óxidos de acetileno e propileno, intermediários químicos na síntese de produtos naturais, substâncias biologicamente ativas, glicóis e resinas, também têm sido estudadas. Outra reaçao aplicada é a amoxidaçao de olefinas ou compostos aromáticos.78 A atividade e seletividade das espécies de vanádio nestas reaçoes está bastante relacionada com os estados de oxidaçao que o vanádio pode assumir (de +2 a +5), se ele está isolado (monomérico) ou na forma de espécies polimerizadas, ao ambiente de coordenaçao (tetraédrico, pentaédrico, octaédrico), dispersao e estabilidade das espécies.79 O estado V5+ tende a formar polioxoânions e espécies superficiais com este número de oxidaçao, em baixos teores de vanádio, costuma formar espécies monoméricas VO4 com boa atividade catalítica para reaçoes como a desidrogenaçao oxidativa de alcanos.80 No caso dos VPOs, a presença das espécies pirofosfato de vanadila, (VO)2P2O7 , com V4+, e da espécie VOPO4, com V5+, tem sido identificada como crítica para o desempenho industrial.81,82 No entanto, aplicaçoes catalíticas das MOFs à base de vanádio nao sao tao reportadas na literatura quanto as de lantanídeos, por exemplo. Dado o histórico do estudo de imobilizaçao de complexos de vanádio em matrizes micro e mesoporosas, torna-se evidente que as MOFs, com suas vantagens, tem um potencial para as mesmas aplicaçoes. Um dos primeiros trabalhos sobre MOFs à base de vanádio foi o de Barthelet et al.,83 que reportam a síntese da MOF MIL-47(V), ou VIVO{O2C-C6H4-CO2}, com estrutura 3-D ortorrômbica, utilizando VCl3 como precursor de vanádio e ácido tereftálico como ligante. Os autores reportaram uma área superficial BET de 930 m2g-1. Em trabalho posterior84 o grupo mostrou que certo grau de flexibilidade pode ser introduzido nesta estrutura controlando o estado de oxidaçao do vanádio, o que seria importante para as aplicaçoes de separaçao e estocagem seletiva de gases. Outro trabalho de MOF à base de vanádio que merece destaque é o de Lieb et al.,85 sobre a MOF V3O(H2O)2X[C9H3O6]2.yH2O, sendo x=(Cl-)1-z(C9H5O6)7-, batizada de MIL-100(V), com arquitetura similar às zeólitas, cavidades mesoporosas de 5 e 29 Å, acessíveis através de janelas de 5,5 e 8,9 Å e área BET de 2320 m2 g-1. Leusa et al. 86 utilizaram esta mesma MIL-47(V) na reaçao de oxidaçao do cicloexeno com hidroperóxido de terc-butila, comparando seu desempenho com catalisadores referências de vanádio (VAPO-5, VOx/SiO2 e o catalisador homogêneo VO(acac)2). A MOF mostrou um desempenho catalítico superior, preservando sua estrutura cristalina e área superficial após a reaçao e desativando pouco. Outra reaçao com emprego de MOFs à base de vanádio é a do metano com peroxidissulfato de potássio, produzindo ácido acético, estudada por Phan et al.87 com as MOFs MIL-47 e MOF-48. Eles obtiveram um rendimento de 70% e os catalisadores puderam ser reutilizadas diversas vezes, permanecendo cataliticamente ativos e com sua estrutura cristalina intacta. Liu et. al.88 desenvolveram uma nova MOF nao porosa, batizada de COMOC-3as, com a fórmula estrutural VIII(OH)(O2C-C10H6 - CO2)·H2O, sintetizada a partir do precursor VCl3 e do ligante NDC (ácido 2,6-naftalenodicarboxílico). A caracterizaçao mostrou uma estrutura similar à MOF MIL-69 e o V3+ pode ser oxidado a V4+ mantendo a topologia da rede. A MOF foi testada na reaçao de oxidaçao do cicloexeno em fase líquida, com conversao de 38% em 7 horas e seletividade de 82% para cicloexeno, comparável à MOF MIL-47 e com lixiviaçao de vanádio negligível, possibilidade de regeneraçao e manutençao da performance catalítica.
CATALISE COM MOFS A BASE DE LANTANIDEOS As MOFs à base de íons lantanídeos tem atraído bastante interesse na última década devido às suas propriedades magnéticas e de luminescência.20 Por isto, existem inúmeros trabalhos publicados com estes materiais, conhecendo-se vários aspectos relacionados à sua síntese e caracterizaçao, o que torna natural se vislumbrar aplicaçoes em outras áreas, tais como Catálise. Em termos de coordenaçao, os íons lantanídeos têm uma esfera flexível, tornando possível criar MOFs com centros metálicos coordenativamente insaturados com a eliminaçao de moléculas visitantes (Ex: aquecimento), formando canais 1D de alta estabilidade térmica (350-500 ºC) e gerando sítios ácidos e básicos de Lewis, tornando-as potenciais catalisadores para reaçoes que necessitem destes sítios.89 Um dos primeiros estudos com a aplicaçao de polímeros de coordenaçao à base de lantanídeos como catalisadores foi o de Reineke et al.,90 que sintetizou a MOF [Tb(bdc)(NO3)].2dmf, cuja forma dessolvatada apresentou uma estrutura microporosa que manteve sua topologia após dessolvataçao e se mostrou estável até 450 ºC. Em seguida, Dewa et al.,91 estudaram um material sintetizado com o composto La(OiPr)3 e o composto orgânico antracenobisresorcinol, na época nem mesmo batizado como MOF e sem dados de cristalinidade, mas que apresentou uma área BET de 230 m2 g-1. Este composto fo,, , i,, ativo na reaçao de troca hidrogênio/deutério, o que, pelos mecanismos de reaçao, mostra potencial de aplicaçao nas reaçoes de enolizaçao de cetonas e condensaçao Aldol, reaçoes tipicamente catalisadas por ácidos e bases de Lewis. Outros autores utilizaram estas reaçoes para avaliar as suas MOFs à base de lantanídeos. Wu et al.92 estudando MOFs do tipo [Tb6(H3L)4(NO3)9-3H+]6+, onde H3L era um ligante com grupo piridina, verificaram que a presença de cicloexanona leva à mudanças no espectro de absorçao da MOF e aumento de luminescência. Desta forma, eles concluíram que as interaçoes entre a cicloexanona e os grupos amida das MOFs foram dominantes para ativar a cicloexanona na reaçao de condensaçao Aldol, que possivelmente ocorreria nas cavidades do octaedro. Sen et al.,93 trabalhando com MOFs de neodímio e praseodímio, utilizando ligantes carboxilados, com estrutura de prisma trigonal, mostraram que estas MOFs eram muito mais ativas e seletivas na epoxidaçao de várias olefinas, cíclicas e alifáticas, que seus respectivos óxidos. A reaçao de cianosililaçao de aldeídos e cetonas, uma espécie de incorporaçao dos grupos CN e SiMe3 ao átomo de carbono, representada na Figura 6, também pode ser utilizada como reaçao modelo para avaliar os sítios ácidos de Lewis das MOFs à base de lantanídeos.89,90,94,95 Wu et al.92 concluíram que as interaçoes correspondentes ao sítios de Tb3+ foram dominantes para a ativaçao dos aldeídos. D'Vries et al.96 também estudaram esta reaçao e concluíram que acidez destes materiais está diretamente ligada ao raio iônico do lantanídeo, variando de forma inversa. Em outro trabalho do grupo,97 trabalhando com MOFs com o ligante 3,5-benzenodissulfonato, eles concluíram que a atividade catalítica depende principalmente da estrutura da rede, com pouca influência do cátion de lantanídeo utilizado e que o mecanismo inclui, provavelmente, uma troca de moléculas de água coordenadas ao metal por aldeído antes da ativaçao do catalisador. Em relaçao aos sítios básicos de Lewis, a reaçao de condensaçao de Knoevenagel com aldeídos é bastante utilizada para avaliaçao, pois requer a formaçao de um ânion de um composto básico ativo que contém metileno. Wu et al.94 desenvolveram uma MOF à base de térbio que continha tanto sítios ácidos quanto básicos de Lewis, sendo os ácidos presentes no Tb3+ e os básicos nos sítios de trifenilamina dos ligantes, apresentando atividade tanto para a cianosililaçao quanto para a reaçao Knoevenagel. Existem outras reaçoes já citadas na literatura das MOFs à base de lantanídeos, tais como a acetalizaçao do benzaldeído com metanol, utilizada por Ren et al.98 para avaliar a atividade dos sítios ácidos de Lewis de MOFs de lantanídeos com o ligante 1,4-fenilenodiacetato. Gandara et al.99 mostraram que MOFs de vários lantanídeos com o ligante naftalenodissulfonato foram ativas para a oxidaçao de linalool com peróxido de hidrogênio, produzindo compostos (óxidos, éteres) utilizados na indústria de perfumes, reaçao que necessita de catalisadores bifuncionais com sítios ácidos e redox. O mesmo grupo mostrou a atividade de MOFs de itérbio para a mesma reaçao e também para a hidrodessulfurizaçao do tiofeno e oxidaçao de sulfetos, mostrando a importância da densidade de carga e do número de coordenaçao no átomo do lantanídeo para o desempenho catalítico100 Em outro trabalho, com MOFs de Yb e ácido succínico, eles propuseram um mecanismo para a oxidaçao de sulfetos, baseado em evidências espectroscópicas, em que as espécies Yb-O-OH seriam responsáveis pela atividade catalítica.101 Eles também testaram as mesmas MOFs para as reaçoes de oxidaçao de metilsulfanilbenzeno e acetalizaçao de benzaldeído. MOFs de lantanídeos também foram testadas por Cunha-Silva et al.102 na reaçao de ciclodesidrataçao de xilose a fulfural e por Vitorino et al.103 na polimerizaçao de Ziegler-Natta.
CONCLUSOES As redes metalorgânicas (MOFs), polímeros de coordenaçao porosos e cristalinos, têm um desenvolvimento que pode ser considerado ainda na infância. A flexibilidade envolvida na sua síntese, a depender da escolha do precursor metálico e do ligante orgânico, podendo gerar estruturas flexíveis, a depender da molécula visitante e como resposta a estímulos externos (calor, luz, campo magnético) e a sua grande porosidade as tornam potenciais candidatas para uma série de aplicaçoes, tais como sensores químicos baseados em suas propriedades óticas, magnéticas e elétricas, separaçao seletiva, purificaçao e armazenamento de gases, troca iônica, detector de radiaçao, mostradores eletroluminescentes, etc. Na Catálise, os sítios ativos podem estar localizados tanto no ligante orgânico quanto no centro metálico, ou ainda a MOF pode ser aplicada como matriz hospedeira de materiais cataliticamente ativos, tais como nanopartículas metálicas. Isto as torna potenciais catalisadores para diversas reaçoes, nas quais, na maior parte delas, a atividade está relacionada com a remoçao de moléculas de solvente coordenadas ao metal, gerando vacâncias de coordenaçao que podem ser ocupadas por reagentes, atuando como sítios ácidos ou básicos de Lewis. Dentre algumas reaçoes nas quais as MOFs já sao aplicadas, destacam-se a fotocatálise, catálise assimétrica, epoxidaçao de olefinas, cianosililaçao de aldeídos, condensaçao de Knoevenagel, condensaçao Aldol, hidrodessulfurizaçao, acetalizaçao de benzaldeído, oxidaçoes, etc. Até o momento, apenas as aplicaçoes mais fáceis e diretas foram estudadas e o desenvolvimento destes materiais tende a aproximá-los do comportamento catalítico observado em enzimas, com os ligantes sendo formados por complexos de metais de transiçao, combinando a presença de sítios uni ou multimetálicos com o confinamento molecular nos poros. Há também um grande potencial para reaçoes de conversao de biomassa, que envolve moléculas grandes, tais como triglicerídeos, terpenos e carboidratos. Espera-se que, assim como ocorreu com as zeólitas, a gradual introduçao das MOFs como catalisador industrial dê relevância à área e estimule novas pesquisas, sem necessariamente substituir as zeólitas e zeotypes, mas sejam complementares em reaçoes específicas, como a produçao de produtos químicos e da química fina.
REFERENCIAS 1. Corma, A.; Garcia, H.; Xamena, F. X. L.; Chem. Rev. 2010, 110, 4606. 2. Rowsell, J. L. C.; Yaghi, O. M.; Microporous Mesoporous Mater. 2004, 73, 3. 3. Wee, L. H.; Alaerts, L.; Martens, J. A.; Vos, D. D.; Em Metal-Organic Frameworks: Applications from Catalysis to Gas Storage; Farruseng, D., ed.; Wiley-VCH: Weinheim, 2011, cap. 9. 4. Wells, A. F.; Acta Crystallogr. 1954, 7(8-9), 535; Wells, A. F.; Acta Crystallogr. 1954, 7(8-9), 545. 5. Perry IV, J. J.; Perman, J. A.; Zaworotko, M. J.; Chem. Soc. Rev. 2009, 38, 1400. 6. Kinoshita, Y.; Matsubara, I.; Higuchi, T.; Saito, Y.; Bull. Chem. Soc. Jpn. 1959, 32, 1221. 7. Hoskins, B. F.; Robson, R.; J. Am. Chem. Soc. 1989, 111, 5962. 8. Hoskins, B. F.; Robson, R.; J. Am. Chem. Soc. 1990, 112, 1546. 9. Park, K. M.; Iwamoto, T.; J. Chem. Soc., Chem. Commun. 1992, 72; Abrahams, B. F.; Hoskins, B. F.; Robson, R.; J. Am. Chem. Soc. 1991, 113, 3606. 10. Fujita, M.; Kwon, Y, J.; Washizu, S.; Ogura, K.; J. Am. Chem. Soc. 1994, 116, 1151. 11. Yaghi, O. M.; Li, H.; J. Am. Chem. Soc. 1995, 117, 10401. 12. Farrusseng, D.; Aguado, S.; Pinel, C.; Angew. Chem. Int. Ed. 2009, 48, 7502. 13. Li, H.; Eddaoudi, M.; O'Keeffe, M.; Yaghi, O. M.; Nature 1999, 402, 276. 14. Furukawa, H.; Ko, N.; Go, Y. B.; Aratani, N.; Choi, S. B.; Choi, E.; Yazaydin, A. O.; Snurr, R. Q.; O'Keeffe, M.; Kim, J.; Yaghi, O. M.; Science 2010, 329, 424. 15. Zhao, D.; Timmons, D. J.; Yuan, D.; Zhou, H-C.; Acc. Chem. Res. 2011, 44, 123. 16. Eddaoudi, M.; Moler, D. B.; Li, H.; Chen, B.; Reineke, T. M.; O'Keefee, M.; Yagui, O. M.; Acc. Chem. Res. 2001, 34, 319. 17. Brant, J. A.; Liu, Y.; Sava, D. F.; Beauchamp, D.; Eddaoudi, M.; J. Mol. Struct. 2006, 796, 160. 18. Vagin, S. I.; Ott, A. K.; Rieger, B.; Chem. Ing. Tech. 2007, 79, 767. 19. Tranchemontagne, D. J.; Mendoza-Cortés, J.L.; O'Keeffe, M.; Chem. Soc. Rev. 2009, 38, 1257. 20. Paz, F. A. A.; Klinowski, J.; Vilela, S. M. F.; Tomé, J. P. C.; Cavaleiro, J. A. S.; Rocha, J.; Chem. Soc. Rev. 2012, 41, 1088. 21. O'Keeffe, M.; Peskov, M. A.; Ramsden, S.; Yaghi, O. M.; Acc. Chem. Res. 2008, 41, 1782. 22. Baten, S. R.; Champness, N. R.; Chen, X. M.; Garcia-Martinez, J.; Kitagawa, S.; Öhrström, L.; O'Keeffe, M.; Suh, M. P.; Reedijk, J.; CrystEngComm 2012, 14, 3001. 23. Kitagawa, S.; Mitsuru, K.; Bull. Chem. Soc. Jpn. 1998, 71, 1739. 24. htttp://www.iupac.org/web/ins/2009-012-2-200, acessada em Maio 2013. 25. Steed, J. W.; Atwood, J. L.; Supramolecular Chemistry, 2nd ed., Wiley: Chichester, 2009. 26. Makiura, R.; Kitagawa, H.; Eur. J. Inorg. Chem. 2010, 3715. 27. Lu, Y.; Lan, Y.; Xu, Y.; Su, Z.; Li, S.; Zang, H.; Xu, G.; J. Sol. St. Chem. 2009, 182, 3105. 28. Burnett, B. J.; Choe, W.; Dalton Trans. 2012, 41, 3889. 29. Tanase, S.; Mittelmeijeer-Hazeleger, M. C.; Rothenberg, G.; Mathonière, C.; Jubera, V.; Smits, J. M. M.; de Gelder, R.; J. Mater. Chem. 2011, 21, 15544. 30. Tanabe, K. K.; Cohen, S. M.; Chem. Soc. Rev. 2011, 40, 498. 31. Wang, Z.; Cohen, S. M.; J. Am. Chem. Soc. 2007, 129, 12368. 32. Wang, Z.; Cohen, S. M.; Chem. Soc. Rev. 2009, 38, 1315. 33. Goesten, M. G.'; Juan-Alcañiz, .; Ramos-Fernandez, E. V.; Gupta, K. B. S. S.; Stavitski, E.; van Bekkun, H.; Gascon, J.; Kapteijn, F.; J. Catal. 2011, 281, 177. 34. Goto, Y.; Sato, H.; Shinkai, S.; Sada, K.; J. Am. Chem. Soc. 2008, 130, 14354. 35. Mu, B.; Li, F.; Huang, Y.; Walton, K. S.; J. Mater. Chem. 2012, 22, 10172. 36. Xuan-Dong, D.; Vinh-Thang, H.; Kaliaguine, S.; Microporous Mesoporous Mater. 2011, 141, 135. 37. Yang, L.; Song, S.; Zhang, H.; Zhang, W.; Wu, L.; Bu, Z.; Ren, T.; Synth. Met. 2012, 162, 261. 38. Sutrisno, A.; Huang, Y.; Solid State Nucl. Magn. Reson. 2013, 49-50, 1. 39. Liu, Z.; Fujita, N.; Miyasaka, K.; Han, L.; Stevens, S. M.; Suga, M.; Asahina, S.; Slater, B.; Xiao, C.; Sakamoto, Y.; Anderson, M. W.; Ryoo, R.; Terasaki, O.; Microscopy 2013, 62, 109. 40. Barthelet, K.; Adil, K.; Millange, F.; Serre, C.; Riou, D.; Férey, G.; J. Mater. Chem. 2003, 13, 2208. 41. Reineke, T. M.; Eddaoudi, M.; Fehr, M.; Kelley, D.; Yaghi, O.M.; J. Am. Chem. Soc. 1999, 121, 1651. 42. Rosi, N. L.; Eckert, J.; Eddaoudi, M.; Vodak, D. T.; Kim, J.; O'Keeffee, M.; Yaghi, O. M.; Science 2003, 300, 1127. 43. Murray, L. J.; Dinca, M.; Long, J. R.; Chem. Soc. Rev. 2009, 38, 1294. 44. Sculley, J.; Yuan, D.; Zhou, H.; Energy Environ. Sci. 2011, 4, 2721. 45. Czaja, A. U.; Trukhan, N.; Müller, U.; Chem. Soc. Rev. 2009, 38, 1284. 46. Li, J.; Kuppler, R. J.; Zhou, H.; Chem. Soc. Rev. 2009, 38, 1477. 47. Férey, G.; Mellot-Draznieks, C.; Serre, C.; Millange, F.; Dutour, J.; Surblé, S.; Margiolaki, I.; Science 2005, 309, 2040. 48. Horcajada, P.; Serre, C.; Vallet-Régí, M.; Sebban, M.; Taulelle, F.; Férey, G.; Angew. Chem. Int. Ed. 2006, 45, 5974. 49. Vallet-Régí, M.; Balas, F.; Arcos, D.; Angew. Chem. Int. Ed. 2007, 46, 7548. 50. Rodrigues, M. O.; Paula, M. V.; Wanderley, K. A.; Vasconcelos, I. B.; Júnior, S. A.; Soares, T. A.; Int. J. Quantum Chem. 2012, 112, 3346. 51. Weber, I. T.; Melo, A. J. G.; Lucena, M. A. M.; Rodrigues, M. O.; Júnior, S. A.; Anal. Chem. 2011, 83, 4720. 52. Weber, I. T.; Terra, I. A. A.; Melo, A. J. G.; Lucena, M. A. M.; Wanderley, K. A.; Paiva-Santos, C. O.; Antônio, S. G.; Nunes, L. A. O.; Paz, F. A. A.; Sá, G. F.; A; Júnior, S. A.; Rodrigues, M. O.; RSC Adv. 2012, 2, 3083. 53. Wanderley, K. A.; Júnior, S. A.; Paiva-Santos, C. O.; Quim. Nova, 2011, 34, 434. 54. Santos, R. S.; Jannuzzi, S. A. V.; Formiga, A. L. B.; Quim. Nova, 2010, 33, 1815. 55. Cunha, T. T.; Stumpf, H. O.; Pereira, C. L. M.; Pires, H. S.; Oliveira, L. F. C.; Pedroso, E. F.; Nunes, W. C.; Quim. Nova, 2012, 35, 1776. 56. Braga, C. F.; Longo, R. L.; J. Braz. Chem. Soc. 2008, 19, 321. 57. Kitagawa, S.; Kitaura, R.; Noro, S.; Angew. Chem. Int. Ed. 2004, 43, 2334. 58. Ma, L.; Lin, W.; Em Functional Metal-Organic Frameworks: Gas Storage, Separation and Catalysis; Schröder, M., ed.; Springer: Berlin, 2010, 175-205. 59. Perry IV, J. J.; Bauer, C. A..; Allendorf, M. D.; Em Metal-Organic Frameworks: Applications from Catalysis to Gas Storage; Farruseng, D., ed.; Wiley-VCH: Weinheim, 2011, cap. 12. 60. Allendorf, M. D.; Bauer, C. A.; Bhakta, R. K.; Houk, R. J. T.; Chem. Soc. Rev. 2009, 38, 1330. 61. Xiong, S.; Li, S.; Wang, S.; Wang, Z.; CrystEngComm 2011, 13, 7236. 62. Banerjee, D.; Kim, S. J.; Wu, H.; Xu, W.; Borkowski, L. A.; Li, J.; Parise, J. B.; Inorg. Chem. 2011, 50, 208. 63. Nalaparaju, A.; Jiang, J.; J. Phys. Chem. C 2012, 116, 6925. 64. Isaeva, V. I.; Kustov, L. M.; Pet. Chem. 2010, 50, 167. 65. Ma, L.; Abney, C.; Lin, W.; Chem. Soc. Rev. 2009, 38, 1248. 66. Liu, Y.; Xuan, W.; Cui, Y.; Adv. Mater. 2010, 22, 4112. 67. Lin, W.; Top. Catal. 2010, 53, 869. 68. Wang, C.; Zheng, M.; Lin, W.; J. Phys. Chem. Lett. 2011, 2, 1701. 69. Kim, H.; Chun, H.; Kim, G.; Lee, H.; Kim, K.; Chem. Commun. 2006, 26, 2759. 70. Alkordi, M. H.; Liu, Y.; Larsen, R. W.; Eubank, J. F.; Eddaoudi, M.; J. Am. Chem. Soc. 2008, 130, 12639. 71. Maksimchuk, N. V.; Timofeeva, M. N.; Melgunov, M. S.; Shmakov, A. N.; Chesalov, Y. U.; Dybtsev, D. N.; Fedin, V. P.; Kholdeeva, O. A.; J. Catal. 2008, 257, 315. 72. Schlichte, K.; Kratzke, T.; Kaskel, S.; Microporous Mesoporous Mater. 2004, 73, 81. 73. Gascon, J. Aktay, U.; Alonso, M. D. H.; Van Klink, G. P. M.; Kapteijn, F.; J. Catal. 2009, 261, 75. 74. Vermoortele, F.; Ameloot, R.; Vimont, A.; Serre, C.; Vos, D. D.; Chem. Commun. 2011, 47, 1521. 75. Pathan, N. B.; Rahatgaonkar, A. M.; Chorghade, M. S.; Catal. Commun. 2011, 12, 1170. 76. Tsoncheva, T.; Ivanova, L.; Dimitrova, R.; Rosenholm, J.; J. Colloid Interface Sci. 2008, 342, 321. 77. Guliants, V. V.; Benziger, J. B.; Sundaresan, S.; Wachs, E.; Stud. Surf. Sci. Catal. 2000, 130, 1721. 78. Mikolajska, E.;Garcia, E. R.; Medina, R. L.; Lewandowska, A. E.; Ferro, J. L. G.; Bañares, M.A.; Appl. Catal., A 2011, 404, 93. 79. Bhunia, S.; Koer, S.; J. Porous Mater. 2011, 18, 399. 80. Strassberger, Z.; Ramos-Fernandez, E. V.; Boonstra, A.; Jorna, R.; Tanase, S.; Rothenberg, G.; Dalton Trans. 2013, 42, 5546. 81. Guliants, V. V.; Benziger, J. B.; Sundaresan, S.; Wachs, I. E.; Jehng, J. - M.; Roberts, J. E.; Catal. Today 1996, 28, 275. 82. Mikolajska, E.; Calvino-Casilda, V.; Bañares, M.A.; Appl. Catal., A 2012, 421, 164. 83. Barthelet, K.; Marrot, J.; ;Riou, D.; Férey, G.; Angew. Chem. Int. Ed. 2002, 41, 281. 84. Leclerc, H.; Devic, T.; Devautour-Vinot, S.; Bazin, P.; Audebrand, N.; Férey, G.; Daturi, M.; Vimont, A.; Clet, G.; J. Phys. Chem. C 2011, 115, 19828. 85. Lieb, A.; Leclerc, H.; Devic, T.; Serre, C.; Margiolaki, I.; Mahjoubi, F.; Lee, J. S.; Vimont, A.; Daturi, M.; Chang, J. S.; Microporous Mesoporous Mater. 2012, 157, 18. 86. Leusa, K.; Muylaerta, I.; Speybroeckb, V. V.; Marinc, G. B.; van der Voorta, P.; Stud. Surf. Sci. Catal. 2010, 175, 329. 87. Phan, A.; Czaja, A. U.; Gándara, F.; Knobler, C. B.; Yaghi, O. M.; Inorg. Chem. 2011, 50, 7388. 88. Liu, Y. Y.; Leus, K.; Grzywa, M.; Weinberger, D.; Strubbe, K.; Vrielinck, H.; Deun, R. V.; Volkmer, D.; Speybroeck, V.; Voort, P. V. D.; Eur. J. Inorg. Chem. 2012, 16, 2819. 89. Gustafsson, M.; Bartoszewicz, A.; Martin-Matute, B.; Sun, J.; Grins, J.; Zhao, T.; Li, Z.; Zhu, G.; Zou, X.; Chem. Mater. 2010, 22, 3316. 90. Reineke, T. M.; Eddaoudi, M.; O'Keeffe, M.; Yaghi, O. M.; Angew. Chem. Int. Ed. 1999, 38, 2590. 91. Dewa, T.; Saiki, T.; Aoyama, Y.; J. Am. Chem. Soc. 2001, 123, 502. 92. Wu, X.; Lin, Z.; He, C.; Duan, C.; New J. Chem. 2012, 36, 161. 93. Sen, R.; Saha, D.; Koner, S.; Catal. Lett. 2012, 142, 124. 94. Wu, P.; Wang, J.; Li, Y.; He, C.; Xie, Z.; Duan, C.; Adv. Funct. Mater. 2011, 21, 2788. 95. Evans, O. R.; Ngo, H. L.; Lin, W.; J. Am. Chem. Soc. 2001, 123, 10395. 96. D'Vries, R. F.; Iglesias, M.; Sneijko, N.; Gutiérrez-Puebla, E.; Monge, A. M.; Inorg. Chem. 2012, 51, 11349. 97. D'Vries, R. F.; O'Shea, V. A. P.; Sneijko, N.; Iglesias, M.; Gutiérrez-Puebla, E.; Monge, A. M.; Cryst. Growth Des. 2012, 12, 5535. 98. Ren, Y.; Liang, J.; Lu, J.; Cai, B.; Shi, D.; Qi, C.; Jiang, H.; Chen, J.; Zheng, D.; Eur. J. Inorg. Chem. 2011, 4369. 99. Gándara, F.; García-Cortés, A.; Cascales, C.; Gómez-Lor, B.; Gutiérrez-Puebla, E.; Iglesias, M.; Monge, A.; Snejko, N.; Inorg. Chem. 2007, 46, 3475. 100. Gándara, F.; Gutiérrez-Puebla, E.; Iglesias, M.; Proserpio, D. M.; Snejko, N.; Monge, A.; Chem. Mater. 2009, 21, 655. 101. Bernini, M. C.; Gándara, F.; Iglesias, M.; Snejko, N.; Gutiérrez-Puebla, E.; Brusau, E. V.; Narda, G. E.; Monge, A.; Chem. Eur. J. 2009, 15, 4896. 102. Cunha-Silva, L.; Lima, S.; Ananias, D.; Silva, P.; Mafra, L.; Carlos, L. D.; Pillinger, M.; Valente, A. A.; Paz, F. A. A.; Rocha, J.; J. Mater. Chem. 2009, 19, 2618. 103. Vitorino, M. J.; Devic, T.; Tromp, M.; Férey, G.; Visseaux, M.; Macromol. Chem. Phys. 2009, 210, 1923.
#Endereço atual (Pós-Doutorado): Van't Hoff Institute for Molecular Sciences, University of Amsterdam, Science Park 904, 1098XH, Amsterdam, The Netherlands Vertigem, é comum. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





