Artigo
|
|
| Imobilização de lacase de Aspergillus sp. em quitosana e sua aplicação na bioconversão de fenóis em reatores de leito fixo Immobilization of laccase (Aspergillus sp.) on chitosan and its application in the bioconversion of phenols in packed bed reactors |
|
Everton Skoronski*,I; Mylena FernandesII; Agenor Furigo JúniorII; Carlos Henrique Lemos SoaresIII; Jair Juarez JoaoIV
IDepartamento de Engenharia Ambiental, Universidade do Estado de Santa Catarina, 88520-000 Lages - SC, Brasil Recebido em 10/04/2013 *e-mail: skoronski@cav.udesc.br The immobilization of laccase on chitosan by cross-linking and application of the immobilized laccase in the bioconversion of phenolic compounds in batch and fixed bed reactors were studied. The process for immobilization of enzyme was optimized using a rotational central composite design. The optimized conditions to generate immobilized laccase with maximal activity were determined to be a glutaraldehyde concentration of 1.0% (v/v), a pH of 6.0, an immobilization time of 5.0 hours and an enzyme concentration of 5.2 g L-1. In packed bed reactors, the activity of the immobilized enzyme is maintained for a longer time in the bioconversion of 2,6-dimethoxyphenol than in the bioconversion of syringaldazine. INTRODUÇAO A contaminaçao ambiental causada por fenóis demanda atençao devido à sua elevada toxicidade para plantas e animais. Mesmo em baixas concentraçoes (< 1 mg L-1), sua presença pode modificar o gosto e o sabor da água. Além disso, estes compostos sao considerados persistentes e bioacumulativos no meio ambiente.1 Fenóis sao encontrados em diversos efluentes industriais como os provenientes das indústrias têxtil, papel e celulose, petroquímica, plástico, resinas, farmacêutica e de fabricaçao de pesticidas.2 As concentraçoes típicas de fenóis nestes efluentes sao entre 100 e 1000 mg L-1.3 Devido a sua elevada toxicidade, os processos biológicos usados para remediaçao destes compostos apresentam baixa eficiência em concentraçoes acima de 100 mg L-1.4 Assim, processos físico-químicos sao utilizados como uma alternativa para remoçao de fenóis em efluentes líquidos.5 No entanto, o elevado custo desses processos é um fator motivador ao estudo e desenvolvimento de novas metodologias de remediaçao de fenol em efluentes líquidos, sendo o tratamento enzimático um deles. A oxidaçao de fenóis catalisada por enzimas (usando peroxidases e polifenoloxidases) vêm apresentando resultados promissores com relaçao à remediaçao destes compostos em efluentes líquidos.6-9 Polifenoloxidases sao aplicadas na hidroxilaçao de monofenóis a o-difenóis e em seguida, na presença de oxigênio molecular, realizam a oxidaçao até o-quinonas. Estes compostos sao entao polimerizados e precipitados, sendo facilmente removidos por processos de coagulaçao e floculaçao.10 Lacases (EC 1.10.3.2) sao polifenoloxidases que catalisam a oxidaçao de uma variedade de substâncias orgânicas e inorgânicas, incluindo mono e polifenóis, aminas, metoxifenóis e aminas aromáticas, com reduçao concomitante do oxigênio para água. A enzima utiliza o oxigênio dissolvido na água como aceptor final de elétrons, tornando este processo mais atrativo em relaçao àqueles que utilizam peroxidases, onde o peróxido de hidrogênio é o agente oxidante. As lacases têm sido estudadas em várias aplicaçoes biotecnológicas, como a biodegradaçao de xenobióticos e efluentes industriais, descoloraçao de corantes, bioremediaçao de solos contaminados, produçao de etanol, clarificaçao de vinhos e chás e utilizaçao em biosensores.11-13 A aplicaçao de enzimas em processos industriais torna o processo mais atrativo quando elas podem ser imobilizadas em um suporte inerte, permitindo a sua fácil separaçao após a reaçao. Além deste fator, enzimas imobilizadas conferem maior estabilidade operacional ao catalisador e permitem a sua reutilizaçao após uma série de ciclos reacionais.14 Após a imobilizaçao, a enzima pode ser aplicada em reatores de leito fixo (PBR), que sao largamente usados em processos envolvendo elevada capacidade produtiva.15-17 Embora um grande número de trabalhos envolvendo a aplicaçao de lacase na bioconversao de fenóis em sistemas batelada tenha sido publicado,7,18 nao existem trabalhos relevantes que descrevam a aplicaçao de reatores contínuos para o propósito em questao. Além disso, estudos exploratórios com relaçao à avaliaçao da estabilidade da enzima na bioconversao de fenóis, o qual é um dos principais fatores para viabilizar sua aplicaçao ambiental, devem ser considerados no sentido de aproximar esta técnica de aplicaçoes em escala real. O objetivo deste trabalho foi avaliar o desempenho da enzima lacase de Aspergillus sp. imobilizada na bioconversao de fenóis em reatores de leito fixo. Considerando as inúmeras variáveis envolvidas no procedimento de imobilizaçao, optou-se pelo uso da ferramenta do planejamento experimental para otimizaçao da imobilizaçao da lacase em esferas de quitosana.
PARTE EXPERIMENTAL Enzima Os experimentos foram realizados com lacase de Aspergillus sp. comercializada pela Novozymes (Dinamarca) como DeniliteTM. Como suporte foi utilizado quitosana (417963) adquirida da Sigma-Aldrich (Alemanha) com grau de desacetilaçao de 86,94 %. Foi ainda utilizado glutaraldeído (25 %), siringaldazina e 2,6-dimetóxifenol. Todos os outros reagentes foram de grau analítico. Otimizaçao do processo de imobilizaçao A quitosana (0,5 g) foi inicialmente dissolvida em 40 mL de ácido acético 5% (m/v). O gel obtido foi gotejado com o auxílio de uma bomba peristáltica em um banho de precipitaçao (NaOH 2 mol L-1). As esferas foram mantidas nessa soluçao por 12 h. Após esse período, as esferas foram separadas e lavadas com água deionizada até a água de lavagem atingir pH por volta de 8,0. Em seguida, as esferas foram ativadas em soluçao de glutaraldeído (0,5 a 5% v/v) para formaçao de ligaçao cruzada. As esferas de quitosana ativadas foram lavadas com água deionizada para remover o excesso de aldeído. Essa operaçao foi conduzida até a água de lavagem apresentar um resultado negativo para o teste com reagente de Feder, preparado com tiossulfato de sódio e cloreto de mercúrio.19 As condiçoes de imobilizaçao da lacase foram otimizadas por meio de um planejamento experimental do tipo DCCR (delineamento composto central rotacional) com replicata do ponto central, considerando como fatores a concentraçao de glutaraldeído (0,5 a 5% v/v), tempo (1 a 9 h), pH de imobilizaçao (3,5 a 8,0) e concentraçao de enzima (1,0 a 10,0 g L-1). Como variável resposta foi considerada a atividade enzimática do biocatalisador. Os resultados obtidos foram analisados com auxílio do programa STATISTICA (StatSoft, Inc., version 7). Determinaçao da atividade enzimática A atividade da enzima foi medida utilizando siringaldazina como substrato padrao. Este método é baseado na oxidaçao da siringaldazina gerando sua quinona respectiva (absorçao a 525 nm e ε = 65.000 M-1 cm-1). As determinaçoes foram conduzidas em um espectrofotômetro UV-Vis (Varian 300 Carry). Uma unidade de atividade enzimática (U) foi definida como a quantidade de enzima necessária para oxidar 1 µmol L-1 de substrato por minuto. Aplicaçao em reatores de leito fixo A estabilidade operacional da enzima foi avaliada em reator de leito fixo (coluna de vidro medindo 8 mm de diâmetro e 200 mm de altura) empacotado com diferentes massas do biocatalisador de 0,5, 1,0 e 2,0 g, correspondendo a atividades enzimáticas em torno de 50, 100 e 200 U (medidas com siringaldazina), respectivamente. O reator foi provido de controle de temperatura (camisa externa de recirculaçao) que permitiu operar o sistema em três condiçoes experimentais: 20, 30 e 40 ºC (Figura 1). Dois substratos foram utilizados: siringaldazina dissolvido em tampao tartarato (pH 5,0) e 2,6-dimetóxifenol (DMP) dissolvido em tampao tartarato (pH 4,0). Em ambos os casos a concentraçao de substrato foi de 10 mg L-1 e a vazao de alimentaçao do reator fixada em 50 mL h-1. A geraçao do produto de oxidaçao foi monitorada a 525 nm no caso da siringaldazina e a 470 nm para os experimentos com DMP.
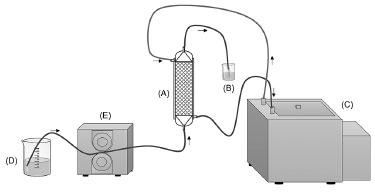 Figura 1. Diagrama esquemático mostrando os dispositivos empregados para avaliar a bioconversao dos compostos fenólicos com a lacase imobilizada em um reator contínuo (PBR). (A) reator de leito fixo, (B) coletor de amostras, (C) banho termostatizado, (D) soluçao de alimentaçao, (E) bomba peristáltica
RESULTADOS Imobilizaçao da enzima lacase em quitosana A matriz fatorial juntamente com os dados obtidos é apresentada na Tabela 1, incluindo ainda os dados preditos por um modelo de segunda ordem.
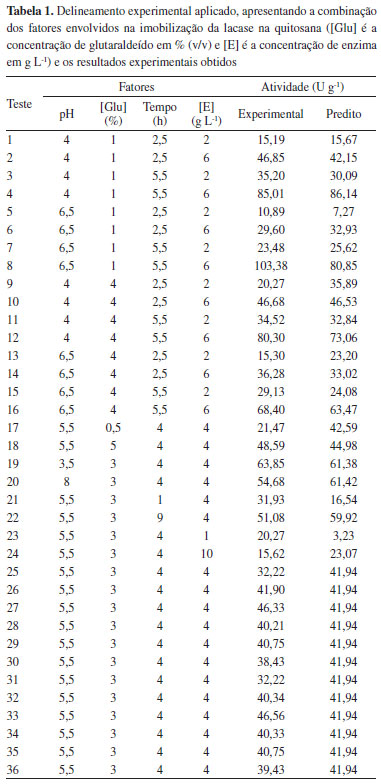
Com os dados experimentais apresentados na Tabela 1, foi possível gerar as seguintes superfícies de resposta como apresentado na Figura 2.
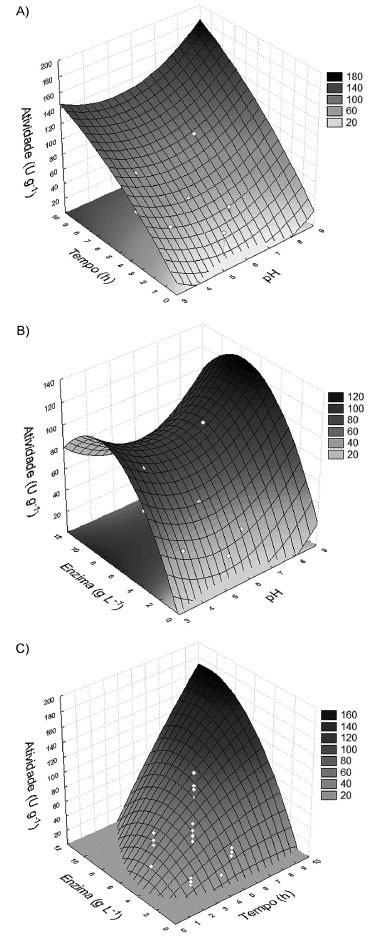 Figura 2. Superfícies de respostas apresentando as relaçoes de efeito da concentraçao de glutaraldeído, pH e tempo de imobilizaçao e concentraçao de enzima sobre a atividade enzimática
Os resultados demonstram que existem faixas de valores dos fatores experimentais que afetam de forma significativa a atividade da enzima obtida após o processo de imobilizaçao. Este processo envolve a ligaçao de resíduos de aminoácidos da enzima ao suporte. Uma vez que a enzima necessita conservar suas distâncias intermoleculares, o processo de imobilizaçao torna a estrutura da enzima mais rígida. Assim, a enzima se torna mais resistente à presença de agentes desnaturantes. Entretanto, quando a quantidade de ligaçoes cruzadas é elevada, devido a altas concentraçoes de glutaraldeído ou tempo prolongado de imobilizaçao, existe um aumento na rigidez da enzima ligada, afetando negativamente a sua conformaçao e, como consequência, uma menor atividade enzimática é observada. Para baixas concentraçoes de enzima, existe um menor número de ligaçoes entre a enzima e o suporte, criando assim, um sistema com baixa atividade enzimática como apresentado nas Figuras 2-B) e C). Um aumento na atividade do sistema enzima-suporte foi observado para valores de concentraçao de enzima no meio entre 5,0 a 6,0 g L-1. Isto pode ser ocasionado pela elevada quantidade de enzimas no meio, permitindo assim uma maior difusividade destas substâncias. De acordo com a Tabela 2, este é o fator mais significante para o processo de imobilizaçao.
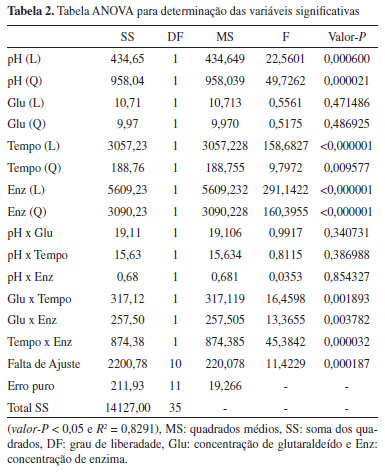
Com relaçao ao tempo de imobilizaçao, o segundo fator mais significativo de acordo com a análise de variância (Tabela 2), quando o tempo de imobilizaçao é prolongado, um maior valor na atividade enzimática foi observado (Figura 2-A), e C)), demonstrando que o tempo de contato entre o suporte e a enzima é um importante fator para ser considerado neste sistema de imobilizaçao. Com relaçao ao pH e à concentraçao de glutaraldeído, foi observado que esses fatores sao menos significativos com relaçao à atividade enzimática conferida ao biocatalisador. Em particular, a concentraçao de glutaraldeído, como fator isolado, nao apresenta efeito significativo sobre o processo de imobilizaçao. O fator concentraçao de glutaraldeído somente é significante quando combinado com outros fatores como a concentraçao de enzimas e o tempo de imobilizaçao (Tabela 2). Estes resultados demonstram a importância da otimizaçao das condiçoes experimentais, utilizando o DCCR como ferramenta de planejamento experimental, no sentido de se buscar as condiçoes otimizadas de atividade catalítica no processo de imobilizaçao. Uma vez que os valores de P e F do modelo foram 0,000187 e 11,4229, respectivamente, o modelo estimado ajustou-se bem aos dados experimentais (Tabela 2). O coeficiente de determinaçao R2 do modelo foi determinado, sendo igual a 0,8291. A condiçao experimental que permitiu a produçao de um biocatalisador com a mais elevada atividade enzimática envolveu a concentraçao de glutaraldeído de 1% (v/v), pH de imobilizaçao igual a 6,0, concentraçao de enzima de 5,2 g L-1 e tempo de imobilizaçao de 5,0 horas. As esferas de quitosana contendo a enzima imobilizada sob as condiçoes otimizadas de imobilizaçao apresentaram uma massa média individual de 19,7 ± 0,1 mg, diâmetro médio de 3,1 ± 0,1 mm e massa específica média de 1,35 ± 0,03 g cm-3. Aplicaçao da lacase imobilizada em reator de leito fixo A estabilidade do biocatalisador obtido foi avaliada utilizando dois substratos típicos para enzima lacase, siringaldazina e DMP em reator de leito fixo. As Figuras 3 a 5 apresentam os resultados do monitoramento do produto de bioconversao da siringaldazina, catalisada pela lacase imobilizada em quitosana empregando diferentes carregamentos de enzima (0,5 a 2,0 g) e temperatura (20 a 40 ºC).
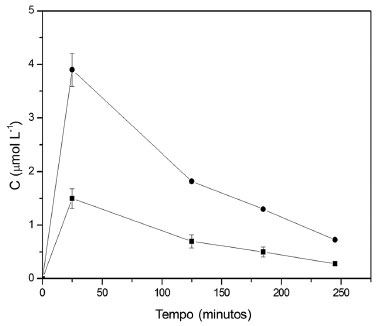 Figura 3. Valores de concentraçao do produto de oxidaçao da siringaldazina medido a 525 nm em amostras coletadas na saída do reator. O fluxo de alimentaçao foi de 50 mL h-1, concentraçao de siringaldazina na soluçao de alimentaçao igual a 10 mg L-1 e temperatura de 20 ºC. (■ 1,0 g, ● 2,0 g)
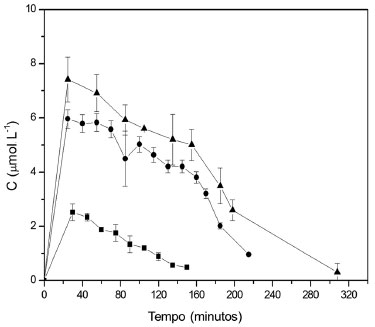 Figura 4. Valores de concentraçao do produto de oxidaçao da siringaldazina medido a 525 nm em amostras coletadas na saída do reator. O fluxo de alimentaçao foi de 50 mL h-1, concentraçao de siringaldazina na soluçao de alimentaçao igual a 10 mg L-1 e temperatura de 30 ºC. (■ 0,5 g, ● 1,0 g e ▲ 2,0 g)
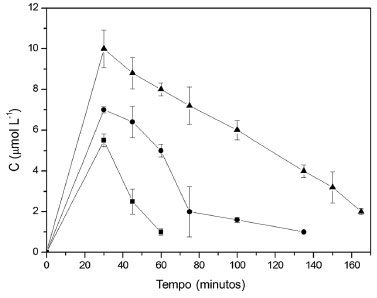 Figura 5. Valores de concentraçao do produto de oxidaçao da siringaldazina medido a 525 nm em amostras coletadas na saída do reator. O fluxo de alimentaçao foi de 50 mL h-1, concentraçao de siringaldazina na soluçao de alimentaçao igual a 10 mg L-1 e temperatura de 40 ºC. (■ 0,5 g, ● 1,0 g e ▲ 2,0 g)
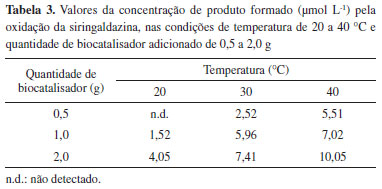
Em todas as condiçoes avaliadas, verifica-se que o biocatalisador perde rapidamente a atividade enzimática ao longo do tempo. Esta desativaçao é maior quando se eleva a temperatura de operaçao do sistema. Analisando a aparência visual do biocatalisador antes e após sua aplicaçao no reator, foi constatada a modificaçao da coloraçao para tom mais escuro, devido à adsorçao dos produtos de oxidaçao da siringaldazina no suporte (esferas de quitosana), que provavelmente atuou no sentido de reduzir a atividade catalítica da enzima. Além disso, a presença de um intermediário de reaçao que modifica quimicamente a enzima pode também ser responsável pelo efeito observado. Os resultados demonstraram que o aumento da quantidade de biocatalisador adicionado ao reator promoveu um aumento na formaçao do produto em qualquer temperatura (20 a 40 ºC). Entretanto, associado ao aumento na taxa de bioconversao em funçao da temperatura ocorre aumento na perda de atividade do biocatalisador, que pode ser causada tanto pela geraçao de produto de oxidaçao adsorvido pelo suporte quanto pela degradaçao estrutural da enzima, em funçao da temperatura mais elevada. Estes valores sao apresentados na Tabela 3.
Nos experimentos em que foi utilizado DMP como substrato modelo, foi observado uma maior estabilidade do biocatalisador ao longo do tempo, no sentido de manter a taxa de bioconversao do substrato. Os resultados sao apresentados nas Figuras 6 a 8.
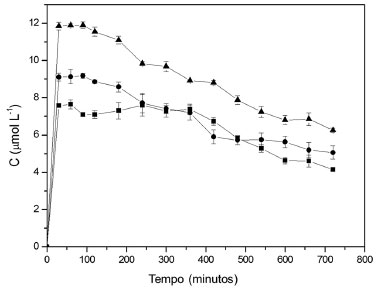 Figura 6. Concentração de produto de oxidação do DMP medido a 470 nm na corrente de saída do reator. A vazão de alimentação foi de 50 mL h-1, a concentração de DMP na solução de alimentação igual a 10 mg L-1 e a temperatura foi mantida a 20 ºC. (■ 0,5 g, ● 1,0 g e ▲ 2,0 g de esferas)
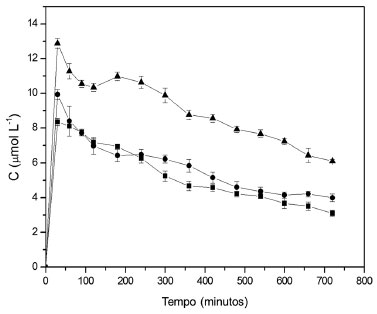 Figura 7. Concentração de produto de oxidação do DMP medido a 470 nm na corrente de saída do reator. A vazão de alimentação foi de 50 mL h-1, a concentração de DMP na solução de alimentação igual a 10 mg L-1 e a temperatura foi mantida a 30 ºC. (■ 0,5 g, ● 1,0 g e ▲ 2,0 g de esferas)
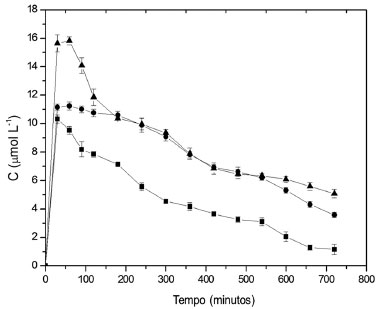 Figura 8. Concentração de produto de oxidação do DMP medido a 470 nm na corrente de saída do reator. A vazão de alimentação foi de 50 mL h-1, a concentração de DMP na solução de alimentação igual a 10 mg L-1 e a temperatura foi mantida a 40 ºC. (■ 0,5 g, ● 1,0 g e ▲ 2,0 g de esferas)
Foi observado que o aumento na quantidade de biocatalisador promoveu um aumento na bioconversao do substrato, semelhante ao comportamento dos experimentos que envolveram a utilizaçao da siringaldazina como substrato padrao. As concentraçoes máximas obtidas nos experimentos conduzidos com DMP sao apresentadas na Tabela 4.
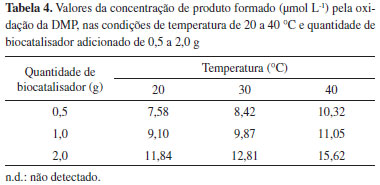
Com relaçao à diminuiçao da capacidade de bioconversao no reator operado com DMP, ao longo do tempo, para uma quantidade de biocatalisador igual a 2,0 g, a concentraçao de produto diminui de 11,84 para 6,25 µmol L-1 em 720 minutos. Isto representa uma reduçao de aproximadamente 41% na atividade catalítica do biocatalisador, comparado à atividade máxima observada no início da operaçao do biorreator. Para outras quantidades de biocatalisador, a porcentagem de reduçao na atividade enzimática foi de 38 e 45% para quantidades de 1,0 e 0,5 g de esferas de quitosana com enzima, respectivamente. Esses valores foram calculados com base na reduçao da concentraçao do produto de oxidaçao, medido na saída do reator, que foi de 9,10 para 5,06 µmol L-1 para a massa de 1,0 g e 7,58 para 4,15 µmol L-1 para a massa de 0,5 g. Desta forma, uma menor massa de biocatalisador aplicada ao reator, quando sujeita à mesma carga de substrato, apresenta uma maior porcentagem de reduçao em sua atividade ao longo do tempo. Para experimentos conduzidos a 30 ºC, as reduçoes na atividade enzimática foram maiores que a 20 ºC, atingindo valores de aproximadamente 50, 50 e 58% para massas de biocatalisador de 2,0, 1,0 e 0,5 g, respectivamente. Nesta condiçao experimental, foi observado novamente que a perda de atividade enzimática é similar nas maiores quantidades de biocatalisador utilizados (1,0 e 2,0 g), mas é maior na massa de 0,5 g. Finalmente, para os experimentos conduzidos a 40 ºC, a reduçao na atividade enzimática foi a mais acentuada dentre todas as condiçoes experimentais testadas. Para as quantidades de enzima iguais a 1,0 e 2,0 g, as reduçoes foram de 68 e 60%, respectivamente. Para a massa de 0,5 g a reduçao na atividade enzimática foi de 86% (Figura 8). O produto de oxidaçao do DMP apresentou uma coloraçao amarelada, permitindo seu monitoramento por espectrofotometria UV-VIS a 470 nm. No entanto, este composto é instável e em aproximadamente 3,0 h era convertido em composto insolúvel de coloraçao marrom formado pela polimerizaçao de produtos de oxidaçao do DMP. Essa substância gerada na bioconversao foi provavelmente responsável pela reduçao na capacidade catalítica do biocatalisador devido à facilidade de ser adsorvida na superfície do biocatalisador. A adsorçao desse composto foi verificada visualmente, observando a aparência das esferas de quitosana no início do processo e após 720 minutos de operaçao no reator.
CONCLUSOES A imobilizaçao de lacase em quitosana nas condiçoes otimizadas forneceu um sistema enzimático ativo para a bioconversao de substâncias fenólicas. Além de permitir o uso da enzima em diversos ciclos de oxidaçao, o processo de imobilizaçao permitiu a aplicaçao da lacase em reatores PBR e favoreceu a estabilidade operacional do biocatalisador ao longo do tempo. Entre os dois substratos avaliados em fluxo contínuo, o desempenho do reator foi mais estável quando se utilizou como substrato DMP. A utilizaçao de siringaldazina foi limitada devido à formaçao de compostos de oxidaçao que afetaram o desempenho do biocatalisador.
AGRADECIMENTOS Os autores agradecem à NOVOZYMES por fornecer a enzima e à FAPESC, UNISUL e UFSC pelo suporte financeiro.
REFERENCIAS 1. Russel, I. M.; Burton, S. G.; Anal. Chim. Acta 1990, 389, 161. 2. González, P. S.; Capozucca, C. E.; Tigier, H. A.; Milrad, S. R.; Agostini, E.; Enzyme Microb. Technol. 2006, 39, 647. 3. López-Molina, D.; Hiner, A. N. P.; Tudela, J.; García-Cánovas, F.; Rodríguez-López, J. N.; Enzyme Microb. Technol. 2003, 33, 738. 4. Hosseini, S. H.; Borghei, S. M.; Process Biochem. 2005, 40, 1027. 5. Moreno-Castilla, C.; Rivera-Utrilla, J.; Lopez-Ramón, M. V.; Carrasco-Marín, F.; Carbon 1995, 33, 845. 6. Durán, N.; Espósito, E.; Appl. Catal., B 2000, 28, 83. 7. Zhang, J.; Xu, Z.; Chen, H.; Zong, Y.; Biochem. Eng. J. 2009, 45, 54. 8. D'Annibale, A.; Stazi, S. R.; Vinciguerra, V.; Di Mattia, E.; Sermanni, G. G.; Process Biochem. 1999, 34, 697. 9. Xu, R.; Zhou, Q.; Li, F.; Zhang, B.; Chem. Eng. J. 2013, 222, 321. 10 . Whiteley, C. G.; Lee, D. J.; Enzyme Microb. Technol. 2006, 38, 291. 11. Mayer, A. M.; Staples, R. C.; Phytochemistry 2002, 60, 551. 12. Couto, S. R.; Herrera, J. L. T.; Biotechnol. Adv. 2006, 24, 500. 13. Diaconu, M.; Litescu, S. C.; Radu, G. L.; Sens. Actuators, B 2010, 145, 800. 14. Fernandes, S. C.; de Oliveira I. R. W. Z.; Fatibello-Filho, O.; Spinelli, A.; Vieira, I. C. Sens. Actuators, B 2008, 133, 202. 15. Shuler, M.; Kargi, F.; Bioprocess Engineering, 2nd ed., Prentice Hall: New Jersey, 1992. 16. Cristóvao, R. O.; Tavares, A. P. M.; Ribeiro, A. S.; Loureiro, J. M.; Boaventura, R. A. R.; Macedo, E. A. Bioresour. Technol. 2008, 99, 4768. 17. Cabana, H.; Alexandre, C.; Agathos, S. N.; Jones, J. P.; Bioresour. Technol. 2009, 100, 3447. 18. Sadighi, A.; Faramarzi, M. A.; J. Taiwan Inst. Chem. Eng. 2013, 44, 156. 19. Morita, T.; Assumpçao, R. W. V.; Manual de soluçoes, reagentes e solventes, Edgard Blüchner: Sao Paulo, 1995. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





