Artigo
|
|
| Conversão química de NO e CO sobre catalisadores à base de óxidos de cobalto ou de ferro Chemical conversion of NO and CO on catalysts based on cobalt or iron oxides |
|
Andreza A. LongatiI; Willian C. FerreiraI; Cristiane M. Finzi QuintaoI; Maikel L. MaloncyII; Marcelo S. BatistaI,*
IDepartamento de Engenharia Química e Estatística, Campus Alto Paraopeba, Universidade Federal de São João Del Rei, 36420-000 Ouro Branco - MG, Brasil Recebido em 15/04/2013 *e-mail: marcelobatista@ufsj.edu.br Cobalt or iron oxides supported or not on zeolite Hbeta were prepared and evaluated in the reduction reaction of NO by CO in presence of O2, SO2 or H2O. XRD results evidenced the Hbeta structure and the formation of Co3O4 and Fe2O3. TPR-H2 analysis showed complete reduction of cobalt oxide at lower temperatures than for iron oxide. The catalysts are quite active and the activity depends on the reaction temperature. The highest conversions rates were observed for pure iron oxide, which can be a relatively low cost catalyst for reduction of NO by CO, with high selectivity towards the N2 formation. INTRODUÇAO Nas últimas décadas vem aumentando fortemente a preocupaçao com a poluiçao do ar devido às graves consequências geradas pela chuva ácida, "smog" urbano, o efeito estufa e a depleçao de ozônio da atmosfera. Esses fenômenos sao causados por emissoes de gases poluentes e provocam danos ao meio ambiente, à saúde humana, à flora e à fauna. A preocupaçao com os efeitos da poluiçao tem levado os órgaos de controle ambiental a revisar a legislaçao em vigor, estipulando limites mais rigorosos para as emissoes de poluentes atmosféricos.1 Dentre as substâncias causadoras da poluiçao atmosférica, os óxidos de enxofre (SOx), óxidos de nitrogênio (NOx), monóxido de carbono (CO), material particulado (MP) e compostos orgânicos voláteis (VOLS) destacam-se pela abundância em que sao liberados pelos exaustores industriais.2 Em particular, o grupo de gases altamente reativos, que contêm nitrogênio e oxigênio em proporçoes variadas na sua composiçao, recebe a denominaçao genérica de óxidos de nitrogênio (NOx).3 Várias tecnologias vêm sendo propostas para reduçao de NOx (95% NO e 5% NO2) na presença de NH3, CO, H2 ou hidrocarbonetos, bem como a decomposiçao de NO.4 A reaçao de NO com CO presente na mistura gasosa poluente é bastante relevante, uma vez que ambos os reagentes sao poluentes atmosféricos.5 Vários tipos de catalisadores têm sido estudados na tentativa de se acelerar a velocidade da reaçao de reduçao de NO a N2 e, assim, evitar a formaçao de N2O. Dentre os sólidos pesquisados podem ser citados: metais nobres, óxidos metálicos, perovskitas, metais suportados e metal/zeólitas.4,5 Os catalisadores que possuem na sua composiçao cobre, ferro e/ou cobalto destacam-se por serem mais baratos e ativos para a reaçao.6 Na reduçao de NO com CO sobre os óxidos de cobre, cobalto ou ferro suportados sobre a zeólita USY ou ZSM-5, o óxido de ferro, sobre ambos os suportes, mostrou-se mais ativo e seletivo a N2.7 Embora a utilizaçao da zeólita beta como suporte para o óxido de ferro seja atraente devido à sua estrutura com ampla abertura de poros, sistema de canais tridimensionais e elevada área superficial, poucos estudos sao encontrados.8 A literatura mostra que Fe/Hbeta apresenta maior atividade para reduçao de NO com NH3 que o catalisador comercial V2O5/WO3/TiO2.9 Além disso, o resultado do catalisador de óxido de ferro suportado nao tem sido comparado com o óxido de ferro puro, ou seja, nao está claro se o óxido de ferro necessariamente precisa está dispersos sobre o suporte. O catalisador Co-beta também se destaca devido à sua estabilidade catalítica para reduçao de NO com metano na ausência de SO2.10 Entretanto, em unidades industriais, diante da complexa mistura gasosa, os catalisadores devem ser, além de ativos e seletivos na reduçao de NO a N2 com CO, estáveis na presença de oxigênio, vapor de água e compostos de enxofre. Neste artigo, procurou-se avaliar o comportamento de catalisadores à base de óxidos de ferro ou cobalto suportados em zeólita Hbeta e, também, do óxido de ferro puro, na reaçao de reduçao de NO com CO. Durante a reaçao procurou-se avaliar, ainda, o efeito da adiçao de O2, SO2 e H2O, comumente presentes nas misturas gasosas poluentes em fontes fixas.
PARTE EXPERIMENTAL Preparação dos catalisadores A zeólita beta comercial foi produzida pela Tricat (beta standart products B-25). A forma ácida da zeólita beta (Hbeta) utilizada como suporte foi obtida por trocas iônicas com uma soluçao de ácido clorídrico 0,1 mol L-1 na proporçao de 50 mL de soluçao ácida para cada grama de zeólita. Foram realizadas três trocas iônicas consecutivas de 8 h cada uma, à temperatura ambiente, sob agitaçao magnética constante. Após cada intervalo, a suspensao foi filtrada a vácuo e lavada com água destilada para remover o resíduo de HCl. Em seguida, o sólido foi secado em estufa a 110 ºC por aproximadamente 1 h. Após o término das trocas iônicas, o material foi calcinado a 600 ºC por 2 h (taxa de aquecimento de 10 ºC min-1). Os catalisadores foram obtidos por impregnaçao incipiente, utilizando soluçao de sais de cobalto e de ferro sobre a zeólita Hbeta. Foram utilizados nitrato de cobalto [Co(NO3)2.6H2O] e nitrato de ferro [Fe(NO3)3.9H2O], devido à alta solubilidade desses sais em água e à maior disponibilidade no laboratório. A massa de sal foi calculada a corresponder a 10 % m/m de metal no catalisador. A massa necessária de nitrato de cobalto ou de ferro foi dissolvida em uma quantidade mínima de água destilada; a soluçao obtida era gotejada aos poucos sobre zeólita Hbeta e macerada, para se obter uma mistura homogênea. O sólido foi secado em estufa a 110 ºC por 1 h e, posteriormente, submetido à calcinaçao a 600 ºC (taxa de aquecimento de 2 ºC min-1) sob fluxo de ar durante 2 h, para a obtençao de óxidos metálicos. A amostra de óxido de ferro puro foi preparada por calcinaçao do nitrato de ferro III nas condiçoes supracitadas. Caracterizaçao dos catalisadores As amostras preparadas foram caracterizadas por difratometria de raios X (DRX) e reduçao com hidrogênio à temperatura programada (RTP-H2). A formaçao do óxido de cobalto ou de ferro foi verificada por DRX, comparando-se as posiçoes dos picos com difratogramas publicados na literatura.11 As análises por DRX foram realizadas pelo método do pó em um difratômetro Shimadzu 6000 com tubo de Cu e filtro de Ni, operado com radiaçao CuKα. A velocidade do goniômetro utilizada foi de 2º (2θ) min-1, com variaçao do ângulo na faixa de 10º a 80º (2θ). As análises de RTP-H2 foram realizadas em um equipamento Micromeritics modelo AutoChem 2920, em que 30 mg de amostra ou 5 mg de óxido de ferro puro foram acondicionados em um reator de quartzo tipo "U" e aquecidos a 10 ºC min-1 sob um fluxo de 50 mL min-1 de N2 até 200 ºC, por 30 min. Em seguida, a amostra foi resfriada, para entao ser aquecida (10 ºC min-1) da temperatura ambiente (25 ºC) até a temperatura de 1000 ºC, sob fluxo de mistura gasosa de 5 % de H2 em N2 (V/V). Para o acompanhamento do consumo de hidrogênio foi utilizado um detector de condutividade térmica.
AVALIAÇAO CATALITICA Nos ensaios catalíticos foi utilizado um reator tubular de leito fixo, contendo 100 mg de catalisador misturado com 100 mg de carbeto de silício, usado para se evitar a formaçao de pontos quentes. O reator foi alimentado com fluxo gasoso continuo de 30 mL min-1, contendo 0,5 % NO e 0,5 % CO com balanço em He. A reaçao foi realizada entre 150 ºC e 600 ºC, com intervalo de 50 ºC. Em cada temperatura, os produtos eram analisados em duplicata utilizando-se um cromatógrafo a gás Shimadzu (GC-17A) equipado com detector de condutividade térmica (TCD). NO, N2, CO e CO2 foram separados a 50 ºC, usando-se duas colunas empacotadas conectadas em série, uma Porapak N e uma peneira molecular 13X operadas com sistema de fluxo reverso. Na reaçao em estudo, avaliou-se o efeito da adiçao de SO2, O2 ou vapor de água sobre o desempenho do catalisador de óxido de ferro. No ensaio, foram adicionados ao fluxo gasoso 16 ppm de SO2, 0,25% (V/V) de O2 ou 10% (V/V) de vapor de água, que eram arrastados ao reator pela mistura gasosa de alimentaçao. A temperatura da reaçao foi mantida fixa em 600 ºC para os testes nessas condiçoes. A atividade catalítica dos catalisadores nas reaçoes de reduçao de NO com CO foi avaliada em funçao da conversao de NO a N2 e de CO a CO2.12 Os cálculos da eficiência de conversao foram efetuados de acordo com as equaçoes 1 e 2.
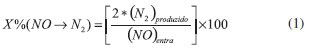
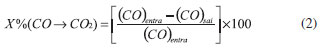
RESULTADOS E DISCUSSAO Os difratogramas de raios X do suporte Hbeta e dos catalisadores FeHbeta e CoHbeta preparados com 10% m/m de metal sao apresentados na Figura 1. A identificaçao das estruturas cristalinas foi realizada com base na comparaçao dos difratogramas em estudo com os dados da literatura.8,13,14 Os picos mais intensos que caracterizam a zeólita Hbeta estao em 2θ = 7,4º e 22,4º.8 Como as análises foram realizadas na faixa de 2θ = 10º a 80º, só foi possível identificar o pico em 2θ = 22,4º. Ao se comparar o difratograma da zeólita Hbeta com dados descritos por Valencia 14 e Malvesti et al,13 é possível observar que se trata da zeólita beta cristalina e nao se observa a presença de outras estruturas cristalinas. Esse pico foi observado em todas as amostras, indicando que a carga de metal no catalisador e o tratamento térmico nao mudaram a estrutura cristalina do suporte Hbeta.
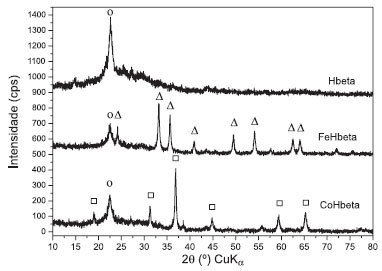 Figura 1. Difratogramas de raios X do suporte Hbeta (o) e dos catalisadores FeHbeta e CoHbeta (picos dos óxidos de ferro (Δ) e de cobalto (□))
No difratograma dos catalisadores FeHbeta e CoHbeta pode-se observar a presença de óxido de ferro ou de cobalto, formados após a calcinaçao das amostras. É possível observar que o pico da zeólita Hbeta (2θ = 22,4º) diminui a sua intensidade na presença do óxido de cobalto ou de ferro. Sabe-se que, na ausência de suporte, a decomposiçao de acetato de cobalto II leva à formaçao, principalmente, de CoO, em atmosfera de nitrogênio, ou de Co3O4, em ar. Já na decomposiçao de nitrato de cobalto II, o Co3O4 é o principal produto formado em atmosfera de nitrogênio ou de ar.15 No catalisador CoHbeta, os principais picos identificados, referentes ao óxido de cobalto, estao em 2θ = 18,9º; 31,3º; 36,8º; 38,5º; 44,8º; 59,3º e 65,2º.11 Esses picos confirmam a presença de Co3O4 (Ficha nº 80-1541 JCPDS, 1994).11 Nao foi observado pico em 2θ = 42,4º, referente ao CoO (Ficha nº 78-0431 JCPDS, 1994).7 O difratograma do catalisador FeHbeta apresentou picos em 2θ = 24,1º; 33,1º; 35,6º; 40,9º; 49,4º; 54,0º; 62,8º e 64,1º, que sao característicos da hematita (Fe2O3). Na Figura 2 sao apresentados os perfis de RTP-H2 dos catalisadores FeHbeta e CoHbeta, do suporte Hbeta e, também do óxido de ferro puro (Fe2O3). Como se pode observar, o suporte Hbeta nao apresenta picos de reduçao na faixa de temperatura de 25 a 1000 ºC. Portanto, o consumo de hidrogênio observado para os catalisadores FeHbeta e CoHbeta refere-se à reduçao dos óxidos (Co3O4 e Fe2O3) presentes na superfície da Hbeta.
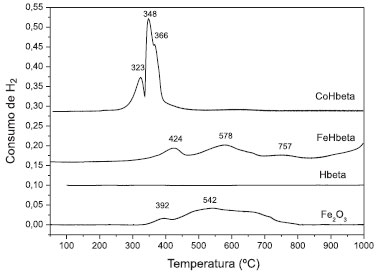 Figura 2. Perfis de RTP-H2 dos catalisadores CoHbeta e FeHbeta e do suporte Hbeta
No perfil de RTP-H2 do catalisador CoHbeta, observa-se um pico a 323 ºC e outro a 348 ºC, com um ombro em 366 ºC. Esses dois estágios de reduçao, de acordo com dados da literatura, indicam que a reduçao do Co3O4 ocorre em duas etapas: inicialmente, o Co3O4 é reduzido a CoO (pico a 323 ºC); na segunda etapa, ocorre a reduçao do CoO a Coº (pico a 348 ºC).16 O ombro observado em 366 ºC pode ser atribuído à reduçao do óxido de cobalto, interagindo mais fortemente com o suporte.14 Para o catalisador contendo ferro, FeHbeta, o perfil de RTP-H2 apresenta pico de reduçao em 424 ºC, atribuído à reduçao da hematita (α-Fe2O3) para magnetita (Fe3O4); os outros picos entre 450 e 850 ºC sao atribuídos à reduçao do Fe3O4 a Feº, podendo ocorrer via FeO (Fe3O4 Na Figura 2, o perfil de RTP-H2 do óxido de ferro puro apresenta pico de redução em 392 ºC, atribuído à redução do Fe2O3 para Fe3O4, e também uma banda entre 420 e 800 ºC, atribuída à redução do Fe3O4 a Feº, podendo ocorrer via FeO (Fe3O4 Comparando-se as curvas de RTP-H2 dos catalisadores de cobalto e de ferro, observa-se que a reduçao completa dos íons cobalto ocorre em temperaturas menores (cerca de 100 ºC menores) do que a dos íons do ferro, indicando que os íons de cobalto reduzem-se mais facilmente do que os íons de ferro. A atividade dos catalisadores foi avaliada na reduçao de NO a N2 utilizando-se CO como agente redutor. Na Figura 3 sao apresentadas as conversoes de NO a N2 e de CO a CO2 em funçao da temperatura de reaçao sobre o catalisador à base de cobalto. Observa-se, no início da reaçao, o aumento da conversao de NO e de CO com o aumento da temperatura. Uma queda na conversao de NO e CO entre 400 ºC e 500 ºC pode ser atribuída à reduçao do Co3O4 com CO e à ocorrência de reaçoes paralelas. É conhecido que a reduçao de NO com CO pode levar à formaçao de N2 e/ou N2O, conforme as reaçoes representadas pelas equaçoes (3) e (4).
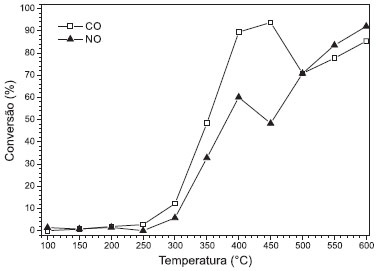 Figura 3. Conversao de NO a N2 e de CO a CO2 sobre o catalisador CoHbeta
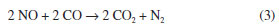
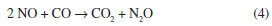
Considerando que a reaçao representada pela equaçao (3) é mais interessante do ponto de vista ambiental em virtude dos inúmeros problemas que o N2O causa ao ambiente, o catalisador usado na reduçao de NO com CO precisa ser seletivo à formaçao de N2.7,22 Considerando, ainda, que as quantidades requeridas de NO e de CO nessa reaçao (equaçao 3) sao equimolares, suas conversoes devem ser idênticas. Quando as curvas de NO e de CO afastam-se em valores superiores a 5 % (considerando faixa de incerteza da medida), significa que a formaçao de N2O também está ocorrendo no sistema, ou seja, a reaçao representada pela equaçao 4 ocorre simultaneamente à reaçao representada pela equaçao 3. As conversoes de NO e de CO foram notoriamente diferentes, indicando que paralelamente à formaçao de N2 ocorre também a formaçao de N2O (Figura 3).23 Esse comportamento foi atribuído ao fato de o CO reduzir o Co3+ a Co2+. Dessa maneira, o sítio onde ocorre a reduçao de NO com CO é modificado durante a reaçao. Os sítios Co2+ sao seletivos à formaçao de N2, enquanto que os sítios Co3+ sao favoráveis à formaçao de N2O.24 Conforme discutido, a reduçao do Co3O4 com CO pode aumentar a quantidade de sítios Co2+ e, consequentemente, aumentar a formaçao de N2 em maiores temperaturas. Na Figura 4, o catalisador FeHbeta apresentou um aumento das conversoes de NO e de CO com o aumento da temperatura, atingindo um máximo de 90 % de conversao à temperatura de 600 ºC. Esse catalisador apresentou, também, conversoes de NO e CO muito similares, em cada temperatura, o que indica alta seletividade a N2 e o favorecimento da reaçao representada na equaçao 3.
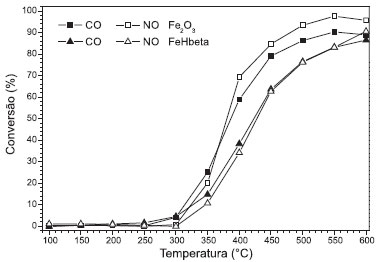 Figura 4. Comparaçao entre FeHbeta e o Fe2O3 puro na reduçao de NO a N2 e oxidaçao de CO a CO2
A atividade do catalisador FeHbeta na reduçao do NO com CO foi comparada com a do óxido de ferro puro (nao suportado), contendo teor de ferro equivalente. Os resultados mostraram (Figura 4) que os catalisadores apresentam conversoes de NO e de CO semelhantes, em cada temperatura, confirmando a alta seletividade a formaçao de N2. Na temperatura de 600 ºC observa-se pequena diferença entre as conversoes de NO e CO sobre ambos os catalisadores. No entanto, esperava-se que no catalisador FeHbeta o óxido de ferro estivesse mais disperso no suporte e apresentasse maior conversao. Ao contrário do esperado, o óxido de ferro puro apresentou maiores conversoes que o catalisador FeHbeta, principalmente, entre 350 ºC e 550 ºC. Este resultado indica que o óxido de ferro puro pode ser utilizado sem o suporte na reduçao de NO com CO e que a alta seletividade à formaçao de N2 será mantida. A Figura 5 apresenta os perfis de conversao para o óxido de ferro na presença dos interferentes: O2, SO2 e H2O. Analisando-se a Figura 5, é possível observar que inicialmente o catalisador apresenta cerca de 90 % de conversao de NO a N2 e CO a CO2. Observa-se ainda, que, com a adiçao de oxigênio, a conversao de NO é reduzida para 15 % e a conversao de CO é praticamente mantida, sugerindo a ocorrência da reaçao CO + O2, ou seja, a presença de O2 favorece a reaçao de oxidaçao do CO e apenas parte do CO reage com o NO. Com a remoçao de O2, a reduçao do NO com CO volta a ser favorecida e os níveis de conversao de NO sao restabelecidos, retornando aos patamares iniciais em torno de 90%. A adiçao de 16 ppm de SO2 causa pequena reduçao na conversao de NO e, após a remoçao de SO2, a conversao parece ser restabelecida. Essa desativaçao reversível foi, também, observada por outros autores que estudaram o efeito da adiçao de SO2 (78 ppm) na conversao de NO.10 Embora a concentraçao de SO2 utilizada na Figura 5 seja muito conservadora e pouco representativa de emissoes gasosas tanto de fontes fixas quanto de fontes móveis, os resultados mostram a sensibilidade dos catalisadores à presença de compostos de enxofre. Por outro lado, na presença de vapor de água, as conversoes de NO e CO reduzem acentuadamente e nao ultrapassam os 20 % após a remoçao do vapor.
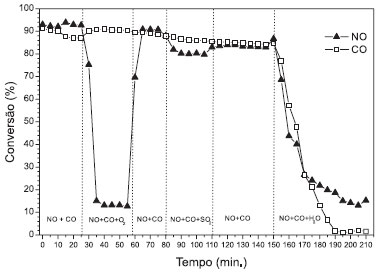 Figura 5. Conversao de NO e CO sobre óxido de ferro na presença de O2, SO2 e H2O
CONCLUSAO Com base nos resultados apresentados, nas condiçoes utilizadas, pode-se concluir que os catalisadores preparados pelo método de impregnaçao incipiente e calcinados levaram à formaçao de óxido de cobalto (Co3O4) e óxido de ferro (Fe2O3), conforme observado por difratometria de raios X. Por DRX foi possível confirmar, também, que a carga de metal no catalisador e o tratamento térmico nao mudaram a estrutura do suporte Hbeta. As análises de RTP-H2 mostraram que o consumo de hidrogênio observado para os catalisadores FeHbeta e CoHbeta refere-se a reduçao dos óxidos (Co3O4 e Fe2O3) presentes na superfície da Hbeta. A reduçao completa do óxido de cobalto ocorre em temperaturas menores do que a do óxido de ferro, indicando que os íons de cobalto reduzem-se mais facilmente do que os íons de ferro. O perfil e as maiores temperaturas de reduçao observada na RTP-H2 do catalisador FeHbeta, comparado com os resultados do óxido de ferro puro, evidenciaram a interaçao desse óxido com o suporte Hbeta. Os resultados dos testes catalíticos de reduçao do NO com CO mostraram que os catalisadores CoHbeta e FeHbeta sao bastante ativos e que a atividade depende da temperatura de reaçao. O catalisador CoHbeta apresentou diferentes conversoes de NO e de CO, indicando que paralelamente à formaçao de N2 ocorre também a formaçao de N2O. O catalisador FeHbeta apresentou conversoes de NO e CO muito similares, em cada temperatura, indicando alta seletividade a N2. Foi observado que o óxido de ferro puro apresenta, entre 350 ºC e 550 ºC, maiores conversoes do que o catalisador FeHbeta. Este resultado sugere que o óxido de ferro puro pode ser um catalisador de baixo custo para reduçao de NO com CO, com alta seletividade à formaçao de N2. No entanto, a presença de O2 e SO2 parece afetar reversivelmente a conversao de NO e o vapor de água desativa acentuadamente o catalisador.
AGRADECIMENTOS Ao apoio financeiro do projeto CAPES/BRANETEC 009/2012.
REFERENCIAS 1. Sierra-Pereira, C. A.; Tese de Doutorado, Universidade Federal de Sao Carlos, Brasil, 2012. 2. Lima, K. C.; Batista, M. S.; Wallau, M.; Sanches, E. A.; Mascarenhas, Y. P.; Urquieta-Gonzalez, E. A.; Appl. Catal. B: Environ. 2009, 90, 441. 3. Batista, M. S.; Tese de Doutorado, Universidade Federal de Sao Carlos, Brasil, 2002. 4. Parvulescu, V. I.; Grange, P.; Elmon, B.; Catal. Today 1998, 46, 233. 5. Castillo, S.; Pineda, M. M.; Gómez, R.; Catal. Commun. 2001, 2, 295. 6. Conte, C. H.; Dissertaçao de Mestrado, Universidade de Sao Paulo, Brasil, 2007. 7. Silva, E. D.; Dissertaçao de Mestrado, Universidade Federal de Sao Carlos, Brasil, 2007. 8. IZA - International Zeolite Association - Structures Databases. http://www.iza-structure.org/databases, acessada em Outubro 2013. 9. Balle, P.; Geiger, B.; Kureti; S.; Appl. Catal. B: Environ. 2009, 85, 109. 10. Chen, S.; Yan, X.; Wang, Y.; Chen, J.; Pan, D.; Ma, J.; Li, R.; Catal. Today 2011, 175, 12. 11. JCPDS - Joint Committee on Powder Diffraction Standards, International Center of Diffraction Data, Pennsylvania, USA, 1994. 12. Zhang, J.; Fan, W.; Liu, Y.; Li, R.; Appl. Catal. B: Environ. 2007, 76, 174. 13. Malvesti, A. L., Mignoni, M. L.; Schere, R. P.; Penha, F. G.; Perguer, S. B. C.; Quim. Nova 2009, 32, 1491. 14. Valencia, S. V.; Tese de Doutorado, Universidade Politécnica de Valencia, Espanha, 1997. 15. Zhang, L.; Dong, L.; Yu, W.; Liu, L.; Deng, Y.; Liu, B.; Wan, H.; Gao, F.; Sun, K.; Dong, L.; J Colloid Interface Sci. 2011, 355, 464. 16. Tiernan, M. J.; Barnes, P. A.; Parkers, G. M. B.; J. Phys. Chem. B 2001, 105, 220. 17. Lei, Z.; Bai, S.; Dang, L.; Xia, H.; Xu, Q.; Cao, Y.; An, L.; Zhao, M.; Lo, A.-Y.; Liu, S.-B.; Microporous Mesoporous Mater. 2009, 123, 306. 18. Lobree, L. J.; Hwang, I.; Reimer, J. A.; Bell, A. T., J. Catal. 1999, 186, 242. 19. Feng, X.; Hall, W. K.; J. Catal. 1997, 166, 368. 20. Li, M.; Wu, X.; Cao, Y.; Liu, S.; Weng, D.; Ran, R.; J. Colloid Interface Sci. 2013, 408, 157 21. Sierra-Pereira, C. A.; Silva-Neto, A. V.; Urquieta-González, E. A.; Anais do 15º Congresso Brasileiro de Catálise-5º Congresso de Catálise do MERCOSUL, Armaçao de Búzios, Brasil, 2009. 22. Mendes, M. H.; Bellido, J. A.; Batista, M. S.; Resumos do 16º Congresso Brasileiro de Catálise, Campos do Jordao, Brasil, 2011. 23. Simonot, L.; Garin, F. O.; Maire, G.; Appl. Catal. B: Environ. 1997, 11, 181. 24. Liotta, L. F.; Pantaleo, G.; Di Carlo, G.; Marci, G.; Deganello, G.; Appl. Catal. B: Environ. 2004, 52, 1. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access






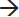 FeO
FeO