Artigo
|
|
| Celdas solares fotoelectroquímicas basadas en Bi2WO6 Photoelectrochemical solar cells based on BI2WO6 |
|
Lorean Madriz*; José Tatá; Verónica Cuartas; Alejandra Cuéllar; Ronald Vargas
Departamento de Química, Universidad Simón Bolívar, Apartado 89000, Caracas 1080 A, Venezuela Recebido em 18/04/2013 *e-mail: lmadriz@usb.ve In this study, photoelectrochemical solar cells based on bismuth tungstate electrodes were evaluated. Bi2WO6 was synthesized by a hydrothermal method and characterized by scanning electron microscopy, UV-Vis reflectance spectroscopy, and X-ray powder diffraction. For comparison, solar cells based on TiO2 semiconductor electrodes were evaluated. Photoelectrochemical response of Grätzel-type solar cells based on these semiconductors and their corresponding sensitization with two inexpensive phthalocyanines dyes were determined. Bi2WO6-based solar cells presented higher values of photocurrent and efficiency than those obtained with TiO2 electrodes, even without sensitization. These results portray solar cells based on Bi2WO6 as promising devices for solar energy conversion owing to lower cost of production and ease of acquisition. INTRODUCCION El crecimiento acelerado de las poblaciones en la actualidad, trae consigo un incremento en el consumo de energía que proviene, en su mayoría, de combustibles fósiles como el carbón, petróleo y gas natural. Uno de los mayores retos de la humanidad consiste en sustituir dichos combustibles por fuentes de energías renovables y limpias.1,2 Este desafío implica el uso de materias primas de bajo costo y abundantes en la naturaleza, como es el caso del sol, cuyo aprovechamiento en las tecnologías fotovoltaicas ha venido creciendo en los últimos años.1-4 Hasta ahora, las celdas solares disponibles comercialmente se basan en materiales inorgánicos, los cuales presentan altos costos y pueden resultar tóxicos. El uso de materiales orgánicos podría resolver dicho problema, pero las eficiencias de las celdas construidas de esta manera se encuentran por debajo de las asociadas a las celdas inorgánicas.2 Desde hace aproximadamente dos décadas se registran investigaciones en torno a celdas solares sensibilizadas con colorantes (CSSC); estas consisten en un semiconductor al cual se le adsorbe un colorante, y éste al ser excitado por la radiación visible del espectro solar, le transfiere electrones a la banda de conducción de dicho semiconductor.5 Estas celdas solares han llegado a ofrecer eficiencias de conversión de energía de hasta 13% y amplia disponibilidad de materiales.2,6,7 Se ha estimado actualmente, que el total de la energía solar que incide sobre el planeta Tierra en una hora es equivalente al consumo total de energía consumida por el hombre en un año, lo que indica que el empleo de CSSC de eficiencias del 10% y superiores podrían proveer a la humanidad de una fracción significativa de la energía que necesita,8-10 sin embargo, las CSSC que han sido sintetizadas son dispositivos que generan poca potencia, por tanto la mayoría de ellas se emplean para cargar acumuladores de energía. Se han fabricado celdas solares basadas en silicio con eficiencias hasta de 25,0%, pero el costo de los materiales supera al de cualquier CSSC.1 Existen, por ejemplo, celdas basadas en arseniuro de galio (GaAs), cuya eficiencia de conversión de energía es la más alta reportada (26,1%), pero además de la toxicidad del arsénico (As), el costo también es elevado. En eficiencia le siguen las celdas solares basadas en silicio (Si), de forma monocristalina (25,0%) y policristalina (20,4%), pero no son recomendables para producción en masa por sus altos costos y por la variabilidad del precio de sus componentes. Las celdas solares sensibilizadas con colorantes de mayor proyección han mostrado eficiencias entre 5 y 13 % y el proceso de producción asociado resulta ser poco demandante desde el punto de vista técnico - económico, además, este tipo de celdas puede ser empleada con fines comerciales y decorativos. Por último, con eficiencias más bajas, se encuentran las celdas basadas en películas orgánicas delgadas (1 - 5 %), con características similares a las de las CSSC pero con menor eficiencia.1,2,7 Luego de la incidencia de radiación solar sobre las CSSC y la respectiva generación de electrones excitados, una fracción de los mismos son colectados como fotocorriente y el resto se pierde en fenómenos de recombinación. Sin embargo al ser un proceso continuo en el tiempo, la generación de portadores de carga resulta sostenida por la iluminación y la recombinación se establece en un valor estacionario a escalas de tiempo donde ocurre la conversión de energía. Para cuantificar éste último proceso, resulta útil representar la respuesta corriente - voltaje mediante la ecuación del fotodiodo (ecuación 1),11,12 en ella se tiene que la generación de corriente se establece en un valor constante cuando el voltaje tiende a cero, y a medida que se aumenta el voltaje entre los electrodos hasta su valor a circuito abierto, la corriente tiende a cero de forma exponencial.
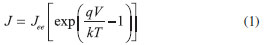
donde J es la densidad de fotocorriente, V el voltaje, Jee es la densidad corriente en estado estacionario, k la constante de Boltzman, T la temperatura absoluta y q la carga del electrón. Adicionalmente en la literatura2,5,11-13 se ha definido el factor de llenado como parámetro de funcionamiento de la celda solar (ecuación 2), este valor representa la relación entre la potencia máxima que entrega la celda solar (Pm = JPmVPm) y la potencia ideal asociada a la celda (JeeVca); un factor de llenado que tienda a 100% indica que la característica de la curva corriente - voltaje presenta un valor de corriente constante, minimizando las pérdidas de energía del circuito.
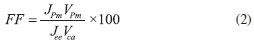
donde FF es el factor de llenado (Fill Factor por sus siglas en inglés), JPm y VPm, la densidad de fotocorriente y el voltaje asociados al valor de potencia máxima, respectivamente, y Vca el voltaje a circuito abierto. Otro de los parámetros de conversión de energía más representativos es la eficiencia de conversión de energía de celda solar, ésta es la relación entre la potencia máxima entregada por la celda y la potencia de la radiación incidente (ecuación 3); valores altos de eficiencia indican que efectivamente se estaría transformando toda la energía incidente a potencia eléctrica.
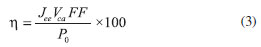
donde η es la eficiencia de conversión de energía y P0 es la potencia de la radiación incidente. Desde principio de la década de los años 70, cuando Fujishima y Honda14 estudiaron la electrólisis del agua sobre electrodos de TiO2, este semiconductor ha sido objeto de una gran cantidad de investigaciones. El TiO2 posee una elevada estabilidad, bajo costo y toxicidad prácticamente despreciable, sumado a una eficiencia relativamente ventajosa,5,15,16 lo que lo ha hecho un compuesto muy atractivo para su empleo en tecnología fotovoltaica.1-5 Sin embargo, su energía interbandas (3,2 eV) le permite absorber radiación electromagnética en el rango ultravioleta (λ < 400 nm), lo cual representa cerca del 5 % de la energía solar incidente en la tierra.16,17 Para superar los problemas de la alta energía requerida debida a la separación de las bandas de conducción en el TiO2 que conlleva a la ineficiente utilización del espectro solar, se pueden adsorber colorantes sensibilizadores como las ftalocianinas en la superficie del electrodo o sobre la partícula,5,18-20 las cuales presentan fuerte absorbancia por encima de 600 nm, tienen altos coeficientes de extinción, y poseen buena estabilidad térmica, química y fotolítica, dada por su estructura macrocíclica.20 En años recientes, la familia de óxidos Aurivillius, cuya fórmula general es (Bi2O2)2+(An-1BnO3n+3)2-, (con A = Ca, Sr, Ba, Pb, Bi, Na, K; B = Ti, Nb, Ta, Mo, W, F; y n = 1-5), ha sido investigada debido a sus propiedades y aplicaciones.16,17 El Bi2WO6, uno de los óxidos Aurivillius más simples, ha atraído mucho interés debido a su estabilidad, estrecha energía interbandas (2,4 eV) que le permite ser activo en el espectro visible, posibilidad de ser sintetizado como nanoestructura, lo cual aumenta la relación área/volumen y su sensibilidad como semiconductor, invariabilidad de estructura cristalina al intervenir en una reacción, y capacidad de generar radicales libres en solución acuosa.16,17 Este semiconductor ha sido estudiado en fotocatálisis heterogénea para degradación de colorantes y otros compuestos contaminantes, es por ello que se muestra prometedor para aplicaciones fotovoltaicas basadas en celdas solares, en las cuales no ha sido utilizado hasta ahora. En la presente investigación se determinará la eficiencia de conversión de energía de celdas solares fotoelectroquímicas basadas en Bi2WO6 y TiO2, así como su desempeño bajo la sensibilización con colorantes del tipo ftalocianinas, los cuales son relativamente económicos, de fácil adquisición y de amplio uso en aplicaciones fotovoltaicas.20-22 De esta manera, se determinará el potencial del Bi2WO6 como material semiconductor en celdas solares, estudio que no ha sido reportado en la literatura.
SECCION EXPERIMENTAL Reactivos El nitrato de bismuto pentahidratado (Bi(NO3)3·5H2O, 99%), hidróxido de potasio (KOH, 99 %) y el yoduro de litio (LiI, grado síntesis), fueron adquiridos de la casa Merck, el tungstato de sodio dihidratado (Na2WO4·2H2O, 99%), el ácido nítrico (HNO3, 99%) y el dodecil sulfato de sodio (SDS, C12H25NaO4S, 99 %), de la casa Riedel de Häen; el tetracloruro de titanio (TiCl4, 99%) de Fisher Scientific; la sal tetrasódica de ftalocianina tetrasulfónica ácida de níquel (II) (NiPcTSNa4 (por sus siglas en inglés), C32H12N8Na4NiO12S4, > 99%) y la sal tetrasódica de ftalocianina tetrasulfónica ácida de cobre (II) (CuPcTSNa4 (por sus siglas en inglés), C32H16CuN8O12S4Na4, > 99%), fueron obtenidas de la casa Sigma. Electrodos transparentes de dióxido de indio dopado con estaño (ITO por sus siglas en inglés), In2O3(90%)-SnO2(10%) con resistencia < 20 Ω cm fueron adquiridos de PPG Industries; y el amoníaco (NH3, >99,99%), acetonitrilo (CH3CN, >99,9%), valeronitrilo (CH3(CH2)3CN, >99%), yoduro de 1-butil-3-metilimidazolio (C8H15IN2, >98,5%), tiocianato de guanidinio, (NH2C(=NH)NH2·HSCN, 97%), 4-t-butilpiridina (C9H13N, 96%), solución de ácido hexacloroplatínico, (H2PtCl6, 8% en H2O), fueron obtenidos de la casa Aldrich. Los demás reactivos fueron de grado analítico. Síntesis del Bi2WO6 El semiconductor de Bi2WO6 se preparó mediante síntesis hidrotérmica23,24 mezclando soluciones de Bi(NO3)3·5H2O y Na2WO4·2H2O en una relación molar 2:1, ajustando el pH a 7 bajo agitación magnética por 2 horas y a temperatura ambiente. La solución resultante se colocó en un reactor Parr y se calentó a 160 ºC por 24 horas bajo agitación. El material obtenido se filtró para obtener las nanopartículas del semiconductor, las cuales se lavaron y se secaron a 80 ºC por 12 horas. Síntesis del TiO2 Las partículas de TiO2 se prepararon por síntesis química en microemulsión,25-27 agregando una solución ácida de tetracloruro de titanio a una microemulsión, en caliente, constituida por surfactante SDS. Las nanopartículas se filtraron, se secaron a 105 ºC por 12 horas y se calcinaron a 600 ºC por 3 horas para obtener la fase cristalina requerida. Caracterización de los semiconductores Las energías interbandas de los semiconductores se calcularon a partir de espectroscopía de reflectancia UV - Vis con un equipo Ocean Optics (S1024DW) Fiber Optics Spectrometer, una fuente de luz Analytical Instrument System AIS modelo UV - 2D, y un accesorio de reflectancia especular (Specular Reflectance Accesory) con incidencia a 90º (sonda de reflexión de 1/4" modelo R200-7-UV/VIS). Para un semiconductor cristalino, la absorción óptica cerca de la brecha de banda puede evaluarse a través de la representación espectral de Kubelka - Munk (ecuación 4),28-31 mediante la cual se puede determinar la energía interbandas (Eg) del semiconductor.
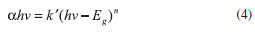
siendo α el coeficiente de absorción, h la constante de Planck, v la frecuencia de la luz empleada, k' la constante de proporcionalidad de Kubelka - Munk, Eg la energía interbandas, y n una constante asociada al tipo de transición que ocurre en el semiconductor, encontrándose reportado para transiciones directas el valor de 1/2 y para transiciones indirectas el valor de 2.31 La morfología de las partículas de TiO2 y Bi2WO6 se observó mediante Microscopios Electrónicos de Barrido Philips SEM 505 y Jeol SEM JSM 6390, operados a un voltaje de aceleración de 30 kV. Con el fin de obtener la imagen del TiO2 sintetizado, se preparó una suspensión concentrada de dicho sólido en una solución etanol:agua, ésta se colocó sobre una placa transparente de ITO soportado sobre vidrio, esparciéndola homogéneamente y calentándola para evaporar los solventes; y finalmente se calentó dicha superficie a 600 ºC por 3 horas para realizarle el recubrimiento de oro.27,31 Para obtener la microscopía del Bi2WO6, se fijó directamente el sólido sobre un papel de carbono y se le hizo recubrimiento de oro. El área superficial específica se determinó por fisisorción de N2 usando un equipo Quantacrome Nova 2000; y la fase cristalina de ambos sólidos se determinó por difracción de rayos X utilizando un Difractómetro Bruker AXS D8; con radiación de alta intensidad monocromática Cu Kα (λ = 0,15406 nm). Caracterización de Bi2WO6 y TiO2 en arreglos tipo celda solar fotoelectroquímica Para la evaluación fotoelectroquímica de los semiconductores sintetizados, se construyeron celdas solares tipo Grätzel4 constituidas por un electrolito, un contraelectrodo y un electrodo de trabajo (fotoelectrodo). Se evaluaron seis sistemas: electrodos de Bi2WO6, electrodos de TiO2 y electrodos de estos materiales sensibilizados con dos colorantes ftalocianínicos, CuPcTSNa4 y NiPcTSNa4 respectivamente. El electrolito empleado presentó la siguiente composición: 0,025 M de LiI, 0,6 M de yoduro de 1-butil-3-metilimidazolio, 0,04 M de yodo, 0,05 M de tiocianato de guanidinio, 0,28 M de t-butilpiridina en una mezcla 15/85 (v/v) de valeronitrilo y acetonitrilo.32 El contraelectrodo de platino sobre ITO fue preparado por reducción térmica de iones Pt4+ a 400 ºC, dicho método empleó 7,0 mM de una solución de H2PtCl6 en 2-propanol; el electrodo obtenido fue caracterizado por voltametría cíclica, obteniéndose la respuesta típica de un electrodo de platino masivo de alta área superficial, pues sobre el ITO desnudo, hay respuesta capacitiva muy cercana al cero de corriente.33,34 Cada electrodo de trabajo consistió de una capa fina de uno de los semiconductores preparados que fue soportado sobre ITO mediante screen printing.32 El fotoelectrodo resultante (~5 µm de espesor) se calentó primero a 450 ºC durante 30 min y luego a 600 ºC por 30 min,35 de esta manera se garantizó el contacto eléctrico entre las nanopartículas. Finalmente cada electrodo de trabajo fue ensamblado en un estructura tipo sándwich con el electrolito y el contraelectrodo, luego de ser provisto de un sello epóxido DuPontTM Surlynr.32,33,35 El área geométrica efectiva de iluminación de las celdas construidas fue de 4,0 cm2. La sensibilización de los electrodos de Bi2WO6 y TiO2 con los colorantes ftalocianínicos, se llevó a cabo por adsorción en equilibrio luego de poner en contacto los materiales semiconductores soportados sobre ITO con una solución acuosa 500 mg L-1 de cada colorante. Adicionalmente, se registró el espectro de reflectancia UV-visible de los electrodos sensibilizados con el objetivo de verificar las zonas de actividad óptica. La caracterización de estos sistemas se realizó mediante voltametría bajo condición de iluminación y oscuridad respectivamente, para ello se empleó un Potenciostato/Galvanostato Princeton Applied Research modelo EG&G PAR 263, bajo control digital por el software M270, acoplado con un simulador solar Solar Light Co. con una lámpara de xenón de 1000 W; el mismo fue provisto de filtros que garantizan radiación visible en la región del espectro igual a 400-900 nm. En cada experimento la intensidad de radiación se determinó con un radiómetro Solar Light Co., la misma fue ajustada típicamente a 1000 W m-2.
RESULTADOS Y DISCUSION Caracterización de los semiconductores En la Figura 1A y 1B se pueden observar las microscopías electrónicas de barrido para el Bi2WO6 y el TiO2, en las cuales se aprecia su morfología.
 Figura 1. Microscopía electrónica de barrido de los semiconductores sintetizados. (A) Bi2WO6 y (B)TiO2
Por otro lado, se realizó un análisis por espectroscopía UV-Visible de reflectancia de los semiconductores sintetizados (Figuras 2A y 2B) y se observó que el Bi2WO6 absorbe radiación en longitudes de onda inferiores a 500 nm, lo que implica la posibilidad de presentar una actividad fotoquímica elevada bajo radiación visible, a diferencia del TiO2, el cual absorbe en el ultravioleta a longitudes de onda inferiores a 400 nm.
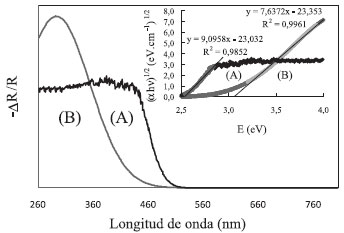 Figura 2. Cambio relativo de reflectancia vs. longitud de onda de los semiconductores sintetizados: (A) Bi2WO6 y (B) TiO2. El inserto muestra la representación espectral de Kubelka-Munk para (A) Bi2WO6 y (B) TiO2
Para el Bi2WO6 y para el TiO2 se reportan transiciones indirectas; por lo tanto, la energía interbandas, estimada de la relación entre el intercepto y la pendiente de un ajuste lineal del espectro expresado como (α hn)1/2 vs. E,16,27,29,31 la representación de Kubelka - Munk (ecuación 4), indicada en el inserto de la Figura 2, arrojó un valor de 2,53 eV para el Bi2WO6 y 3,10 eV para el TiO2, los cuales concuerdan con los reportados en la literatura.16,28,30 Estos valores indican que el Bi2WO6 tiene una energía interbandas adecuada para la activación fotoquímica bajo radiación de luz visible, a diferencia del TiO2, el cual puede ser activado en la zona UV del espectro electromagnético. La estructura de las fases de los semiconductores se estudió mediante difracción de rayos X (DRX).9,25,28,36-38 Los patrones de DRX para el Bi2WO6 y el TiO2, se muestran en las Figuras 3A y 3B.
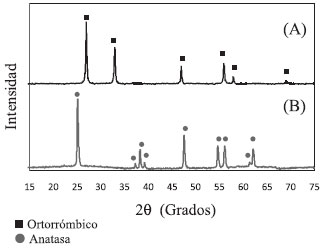 Figura 3. Patrón de difracción de Rayos X de los semiconductores sintetizados: (A) Bi2WO6, (ortorrómbico según la carta JCPDS nº 39 - 0256) y (B) TiO2 (anatasa según la carta JCPDS n° 21 - 1272)
El Bi2WO6 presentó un patrón de difracción que indica una fase cristalina ortorrómbica según la tarjeta JCPDS nº. 39-025639 y el TiO2 sintetizado presentó estructura cristalina anatasa según la tarjeta JCPDS nº. 84-1286.39 Evaluación de los semiconductores Bi2WO6 y TiO2 en arreglos tipo celda solar fotoelectroquímica Mediante espectroscopía de reflectancia UV-Visible fue posible verificar la actividad óptica de los semiconductores sintetizados, adicionalmente, también se compararon estos espectros con los asociados a ambos semiconductores sensibilizados con los colorantes ftalocianínicos seleccionados, CuPcTSNa4 y NiPcTSNa4 respectivamente, en la Figura 4 se presentan estos resultados. En líneas generales se tiene que, la adsorción química de los sensibilizadores sobre la superficie del Bi2WO6 trae como consecuencia la ampliación del intervalo de absorción de radiación visible, se observa la aparición de señales entre 550 y 800 nm debido a las bandas Q de las ftalocianinas, y también se observa el aumento de intensidad en la región comprendida entre 250 y 450 nm debido a la absorción combinada del semiconductor y las bandas B asociadas a estos compuestos orgánicos. En el caso del TiO2 se tiene un comportamiento similar, la adsorción química de los sensibilizadores sobre la superficie de este semiconductor trae como consecuencia la aparición de señales en la región visible del espectro debido a las bandas Q de los colorantes, y en la región UV hay un incremento pequeño debido a las bandas B de los compuestos orgánicos adsorbidos. Se debe destacar que la ftalocianina de cobre adsorbida sobre ambos semiconductores, presentó mayor intensidad de absorción de radiación que la asociada a la ftalocianina de níquel en todo el espectro UV-Visible, esto se debe principalmente a una ligera diferencia entre los coeficientes de extinción molar de ambos colorantes.40-42
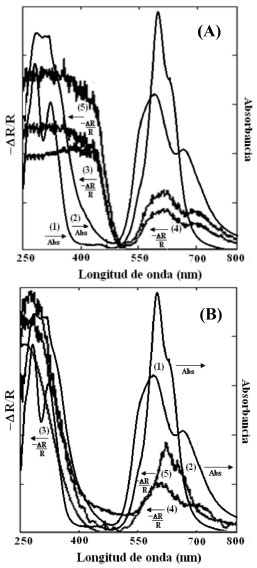 Figura 4. Cambio relativo de Reflectancia vs. Longitud de onda de los semiconductores con y sin sensibilizador (izquierda). Absorbancia de los colorantes utilizados (derecha). (A): (1) NiPcTSNa4, (2) CuPcTSNa4, (3) Bi2WO6, (4) Bi2WO6 - NiPcTSNa4 y (5) Bi2WO6 - CuPcTSNa4 y (B): (1) NiPcTSNa4, (2) CuPcTSNa4, (3) TiO2, (4) TiO2 - NiPcTSNa4 y (5) TiO2 - CuPcTSNa4
El resultado anterior muestra que se amplió el espectro de actividad óptica de los semiconductores hacia la región del visible, sin embargo, para cuantificar la energía que se puede aprovechar realmente, resulta necesario evaluar los sistemas electroquímicamente bajo condiciones de iluminación controlada. En la Figura 5 se muestra la fotocorriente generada por las CSSC bajo iluminación solar en la región visible del espectro. En el caso del Bi2WO6 se tiene una fotocorriente en estado estacionario debida a la generación directa de portadores de carga en el semiconductor por incidencia de luz visible; sin embargo, cuando dicho semiconductor es sensibilizado por los colorantes orgánicos seleccionados, se observa un aumento de la fotocorriente para cada valor de potencial, en este caso se obtuvo que la modificación con el colorante CuPcTSNa4 resultó en una sensibilización más efectiva, pues los valores de corriente alcanzados fueron superiores a los obtenidos con el colorante NiPcTSNa4. En el caso del TiO2 la iluminación con radiación visible no presentó respuesta en intensidad de corriente, debido a la amplia energía interbandas de este material; sin embargo, al adsorberle químicamente los colorantes ftalocianínicos se encontró que bajo irradiación de luz visible fue posible colectar cierta cantidad de corriente en los sistemas; al igual que en el Bi2WO6 se obtuvo que la sensibilización con el colorante CuPcTSNa4 resultó en fotocorrientes superiores a las obtenidas con el colorante NiPcTSNa4. Para todos los sistemas evaluados, la respuesta en oscuridad no presentó valores significativos de corriente. Se debe destacar que los valores de corriente obtenidos con las CSSC basadas en Bi2WO6, presentaron valores aproximadamente tres veces superiores a los obtenidos con las CSSC basadas en TiO2 para la misma condición de sensibilización; inclusive, la respuesta del Bi2WO6 sin sensibilizar con colorante es bastante alta debido a que éste compuesto presenta absorción en el espectro visible, lo que lo hace mucho más prometedor para la conversión de energía solar sin sensibilización.
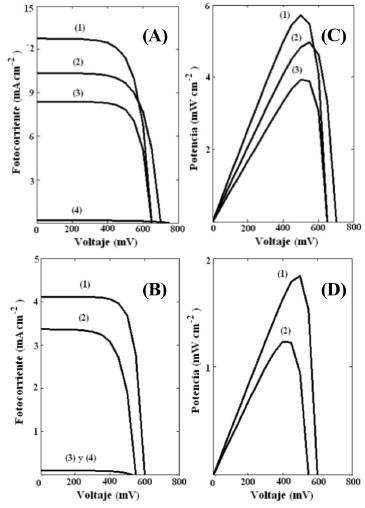 Figura 5. Fotocorriente generada por las CSSC basadas en (A) Bi2WO6 y (B) TiO2 bajo iluminación solar en la región visible del espectro. Curvas de potencia asociadas: (C) Bi2WO6 y (D) TiO2. Compuesto orgánico adsorbido: (1) CuPcTSNa4, (2) NiPcTSNa4, (3) Sin sensibilizador y (4) sin iluminación
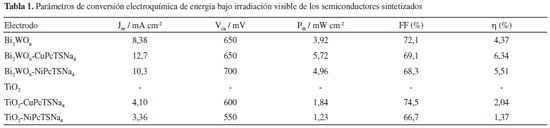
Las curvas de fotocorriente asociadas a los sistemas estudiados presentan el comportamiento predicho por la ecuación del fotodiodo (ecuación 1), a partir de la forma matemática de dicha ecuación, se verifica que la potencia entregada por la celda debe aumentar mientras se incrementa el voltaje entre los electrodos hasta establecer un valor máximo, a partir de este punto, la potencia empieza a disminuir hasta hacerse cero al voltaje de circuito abierto. Efectivamente este fue el comportamiento que se obtuvo para las curvas de potencia en función del voltaje. En la Tabla 1 se muestran los parámetros de conversión de energía obtenidos luego de analizar las curvas fotocorriente - voltaje según el modelo del fotodiodo (ecuación 1). Por definición resulta posible obtener de cada curva experimental la corriente en estado estacionario (Jee = J(V → 0)) y el voltaje a circuito abierto (Vca = V(J → 0)); y mediante la ecuación 2 y la ecuación 3, se pueden obtener el factor de llenado y la eficiencia de conversión de energía respectivamente.
Los valores de factor de llenado y eficiencias de conversión obtenidos para las celdas solares basadas en TiO2 se encuentran acorde a los reportados en la literatura para sistemas químicamente similares.20 Inicialmente Ma y colaboradores en el 201019 obtuvieron eficiencia de 0,004 % y factor de llenado de 27 % para celdas construidas con TiO2 mesoporoso al cual se le adsorbió la ftalocianina de cobre empleada en el presente estudio, CuPcTSNa4 y luego se calcinó a 300 ºC. Posteriormente en el mismo estudio19 reportaron eficiencia de 0,53 % y factor de llenado de 65 % para celdas de TiO2 sensibilizadas con la misma ftalocianina pero sintetizadas por coprecipitación mediante una técnica hidrotérmica generando un sólido enlazado químicamente, CuPcTSNa4 - Ti. En el caso de las celdas basadas en Bi2WO6, los parámetros obtenidos indican una capacidad de conversión de energía representativa; obteniéndose mayor eficiencia que la encontrada por Ma y colaboradores19 incluso para el semiconductor sin sensibilizar, siendo mayor aún al emplear CuPcTSNa4 y NiPcTSNa4; y el factor de llenado resultó comparable con el de las celdas estudiadas por dichos autores. La eficiencia de las celdas ensambladas con Bi2WO6 sin colorante resultaron comparables con las celdas reportadas por Mori y colaboradores en el 2010,43 en las cuales se emplearon ftalocianinas con grupos funcionales enlazados a través de un carbono β como la PcS6 (ftalocianina de cinc con grupos difenil fenoxi y un ácido benzoico como sustituyentes) y la FeTsPc (ftalocianina tetrasulfónica de hierro). El hecho de que el Bi2WO6 posea una eficiencia de 4,37% se puede justificar considerando su energía interbandas relativamente estrecha (2,53 eV), y adicionalmente la máxima absorción de radiación del semiconductor se solapa con la zona en la cual el espectro solar resulta ser máximo (λmaxespectro solar = 480 nm).11 La sensibilización de ambos semiconductores con los colorantes ftalocianínicos seleccionados, mejoró la eficiencia de conversión de estos electrodos, en ambos casos se encontró que la sensibilización con el colorante CuPcTSNa4 resultó en parámetros de conversión superiores a las obtenidas con el colorante NiPcTSNa4, esto posiblemente se deba a la diferencia en los coeficientes de extinción molar de ambos compuestos orgánicos. Por último, se estudió la estabilidad de todas las configuraciones de celda (tanto de TiO2 como de Bi2WO6) durante un lapso de tiempo de 12 semanas y los valores de Jee, Vca, Pm, FF y η se mantuvieron constantes dentro del error experimental.
CONCLUSIONES Los parámetros de conversión de energía fotoelectroquímica bajo irradiación visible obtenidos para las celdas solares basadas en electrodos de Bi2WO6, aún sin sensibilización, resultaron ser superiores a los obtenidos para las celdas basadas en TiO2. Las eficiencias de conversión de energía alcanzadas para las celdas solares basadas en tungstato de bismuto (6,34% Bi2WO6-CuPcTSNa4; 5,51% Bi2WO6-NiPcTSNa4 y 4,37% Bi2WO6), hacen que dicho material se considere prometedor para diferentes aplicaciones fotovoltaicas con posibilidades de alto impacto, entre ellas, las celdas solares, debido a su menor costo, aprovechamiento de la luz visible y fácil adquisición.
REFERENCIAS 1. Kawakita, J.; Science and Technology Trends - Quarterly Review 2010, 35, 70. 2. Nazeeruddin, Md. K.; Baranoff, E.; Grätzel, M.; Sol. Energy 2011, 85, 1172. 3. O'Regan, B.; Grätzel, M.; Nature 1991, 353, 737. 4. Grätzel M.; Inorg. Chem. 2005, 44, 6841. 5. Grätzel, M.; J. Photochem. Photobio. C: Photochem. Rev. 2003, 4, 145. 6. Sealy, C.; Nano Energy 2012, 1, 1. 7. Yu, R.; Lin, Q.; Leung, S.-F.; Fann, Zh.; Nano Energy 2012, 1, 57. 8. Lewis, N. S.; Nocera, D. G.; Proc. Natl. Acad. Sci. U.S.A. 2006, 103, 15729. 9. Hoffert, M. I.; Caldeira, K.; Jain, A. K.; Haites, E. F.; Harvey, L. D. D.; Potter, S. D.; Schlesinger, M. E.; Schneider, S. H.; Watts, R. G.; Wigley, T. M. L.; Wuebbles D. J.; Nature 1998, 395, 881. 10. Smil. V.; American Scientist 2011, 99, 212. 11. Fabregat-Santiago, F.; Garcia - Belmonte, G.; Mora - Seró, I.; Bisquert, J.; Phys. Chem. Chem. Phys. 2011, 13, 9083. 12. Tobin, L. L.; O'Reilly, Th.; Zerulla, D.; Sheridan, J.; Optik 2011, 122, 1225. 13. Grätzel, M.; Nature 2001, 414, 338. 14. Fujishima, A.; Honda, K.; Bull. Chem. Soc. Jpn. 1971, 44, 1148. 15. Ulrike, D.; Surf. Sci. Rep. 2003, 48, 53. 16. Shang, M.; Wang, W.; Sun, S.; Zhou, L.; Zhang, L.; J. Phys. Chem. 2008, 112, 10407. 17. Chen, Y.; Zhang, Y.; Liu, Ch.; Lu, A.; Zhang, W.; Int. J. Photoenergy 2012, doi:10.1155/2012/510158 18. Bard, A.; Fox, M. A.; Acc. Chem. Res. 1995, 28, 141. 19. Ma, T.-Y.; Wei, Y.-Sh.; Ren, T.-Z.; Liu, L;Guo, Q; Yuan, Z.-Y.; Appl. Mater. Interfaces 2010, 2, 3563. 20. Walter, M. G.; Rudine, A. B.; Wamser, C. C.; J. Porphyrins Phthalocyanines 2010, 14, 759. 21. Giraudeau, A.; Fan, F. - R.; Bard, A. J.; J. Am. Chem. Soc. 1980, 102, 5137. 22. Patrocínio, A. O. T.; Mizoguchi, S. K.; Paterno, L. G.; Murakami Iha, N.Y.; Synth. Met. 2009, 159, 2342. 23. Zhang, L.; Zhu, Y.; Catal. Sci. Technol. 2012, 2, 694. 24. Zhang, J.; Huang, Z-H.; Xu, Y.; Kang, F.; Int. J. Photoenergy 2012, doi:10.1155/2012/469178 25. Lee, M. S.; Park, S. S.; Lee, G.-D.; Ju., Ch.-S.; Hong, S.-S.; Catal. Today 2005, 101, 283. 26. Madriz, L.; Carrero, H.; Herrera, J.; Cabrera, A.; Canudas, N.; Fernández, L.; Top. Catal. 2011, 54, 236. 27. López, D.; Lozada, W.; Blanco, S.; Durán, G.; Madriz, L.; Vargas, R.; Avances en Ciencia e Ingeniería. 2011, 2, 47. 28. Chen, X.; Mao, S. S.; Chem. Rev. 2007, 107, 2891. 29. Song, X-M.; Wu, J-M.; Yan, M.; Thin Solid Films 2009, 517, 4341. 30. Rajeshwar, K. In Fundamentals of Semiconductor Electrochemistry and Photoelectrochemistry. Encyclopedia of Electrochemistry vol. 6: Semiconductor Electrodes and Photoelectrochemistry; Bard, A. J.; Stratmann, M.; Unwin, P. R., eds.; Wiley: New York, 2002. 31. Hagfeldt, A.; Grätzel, M.; Chem. Rev. 1995, 95, 49. 32. Yum, J-H.; Hardin, B. E.; Hoke, E. T.; Baranoff, E.; Zakeeruddin, S. M.; Nazeeruddin, M. K.; Torres, T.; McGehee, M. D.; Grätzel, M.; Chem. Phys. Chem. 2011, 12, 657. 33. Park, J.; Koo, H-J.; Yoo, B.; Yoo, K.; Kim, K.; Choi, W.; Park, N-G.; Sol. Energy Mater. Sol. Cells 2007, 91, 1749. 34. Bard, A. J.; Faulkner, L. R.; Electrochemical methods: Fundamentals and applications. John Wiley & Sons: New York, 2001. 35. Barea, E. M.; Gónzalez-Pedro, V.; Ripollés-Sanchis, T.; Wu, H-P.; Li, L-L.; Yeh, C-Y.; Wei-Guang Diau, E.; Bisquert, J.; J. Phys. Chem. C 2011, 115, 10898. 36. Fang, D.; Luo, Zh.; Huang, K.; Lagoudas, D. C.; Appl. Surf. Sci. 2011, 257, 6451. 37. Zlamal, M.; Macak, J. M.; Schmuki, P.; Krysa, J.; Electrochem. Commun. 2007, 9, 2822. 38. Górska, P.; Zaleska, A.; Kowalska, E.; Klimczuk, T.; Sobczak, J. W.; Skwarek, E.; Janusz, W.; Hupka, J.; Appl. Catal. B. 2008, 84, 440. 39. JCPDS, International Center for diffraction data (1988). Powder diffraction files. Swarthmore, P.A. 40. Phthalocyanines: Properties and Applications vol. 1. Leznoff, C. C.; Lever, A. B. P., eds.; VCH Publishers: New York, 1989. 41. Phthalocyanines: Properties and Applications vol. 4. Leznoff, C. C.; Lever, A. B. P., eds.; VCH Publishers: New York, 1996. 42. Nyokong, T. In Electronic Spectral and Electrochemical Behavior of Near Infrared Absorbing Methallophthalocyanines; Mingos, D.M.P. ed.; Springer-Verlag Berlin Heidelberg: New York, 2010, Structure and Bonding (135): Funtional Phthallocyanine Molecular Materials (p. 45) 43. Mori, S; Nagata, M; Nakahata, Y; Yasuta, K; Goto, R; Kimura, M; Taya, M.; J. Am. Chem. Soc. 2010, 132, 4054. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access