Revisão
|
|
| Metodologias de coleta, preservação e armazenamento de amostras de água para análise de mercúrio - uma revisão Methodologies for sampling, preservation and storage of water samples for mercury analysis - a review |
|
Daniele KasperI,*; Bruce R. ForsbergI; Ronaldo de AlmeidaII; Wanderley R. BastosIII; Olaf MalmIV
IInstituto Nacional de Pesquisas da Amazônia, 69060-020 Manaus - AM, Brasil Recebido em 05/09/2014 *e-mail: kasperdani@yahoo.com.br Knowing the mercury levels of an environment allows a diverse array of biogeochemical studies into the mercury cycle on a local or global scale. Among matrices commonly evaluated, water remains a challenge for research because its mercury levels can be very low, requiring development of complex analytical protocols. Currently, sample preservation methods, protocols that avoid contamination, and analytical techniques with low detection limits allow analysis of mercury in pristine waters. However, different protocols suggest different methods depending on a range of factors such as the characteristics of water sampled and storage time. In remote areas, such as oceanic and Amazonian regions, sample preservation and transport to a laboratory can be difficult, requiring processing of the water during the sampling expedition and the establishment of a field laboratory. Brazilian research on mercury in water can be limited due to difficulty obtaining reagents, lack of laboratory structure, qualified personnel, and financial support. Considering this complexity for analyzing water, we reviewed methodologies for sampling, preservation, and storage of water samples for analysis of the most commonly evaluated mercury species (dissolved gaseous mercury, reactive mercury, methylmercury and total mercury). INTRODUÇÃO O ciclo do mercúrio (Hg) no ambiente é o resultado de processos físicos, químicos e biológicos extremamente complexos, muitos dos quais ainda não bem conhecidos, que envolvem volatilização, transporte, deposição, transformações químicas e bioacumulação. Além de seu estado elementar, o mercúrio pode estar ligado a diferentes ânions formando compostos orgânicos ou inorgânicos que são designados espécies químicas. Há uma série de processos naturais e antrópicos que influenciam na transformação entre as diferentes espécies de mercúrio e, consequentemente, influenciam no seu fluxo entre atmosfera, hidrosfera, biosfera e litosfera. Conhecer estas espécies, sua concentração nas diferentes matrizes ambientais e suas possíveis transformações químicas são os primeiros passos que possibilitam estudos ecológicos do ciclo do Hg em escala local ou global. A bioacumulação de Hg sempre foi alvo de pesquisas,1-3 principalmente porque estes estudos podem auxiliar na compreensão da contaminação humana. No entanto, para um melhor entendimento da contaminação da biota, é necessário avaliar o ciclo do elemento no meio ambiente. Cada espécie química apresenta concentrações diferentes nas matrizes ambientais, e uma taxa de bioacumulação distinta. Dentre as diversas matrizes abióticas que têm sido avaliadas, a água é um desafio para os pesquisadores porque suas concentrações de mercúrio são muito baixas, centenas a milhares de vezes menores do que na biota, tornando os protocolos de análise muito complexos. Técnicas analíticas com limites de detecção muito baixos estão disponíveis atualmente, permitindo a análise de águas prístinas. A espectrometria de fluorescência atômica e a emissão em plasma indutivamente acoplado em associação à espectrometria de massas são as técnicas mais comumente utilizadas para análise de água. A primeira técnica tem maior sensibilidade e menores custos associados à instrumentação e manutenção, e por isso, é, em geral, preferida quando o único elemento de interesse é o Hg.4 A espectrometria de massas pode ser utilizada para análises com finalidades diversas, como, por exemplo, a obtenção de informações qualitativas e quantitativas sobre a composição atômica e molecular de diferentes amostras com alta precisão e reprodutibilidade. A utilização destas técnicas é amplamente discutida, inclusive pelas empresas fabricantes de tais equipamentos. No entanto, para que o resultado obtido seja confiável, é necessário evitar a contaminação, perda e inter-conversão das espécies de Hg presentes na amostra desde o momento da coleta. Assim, associado ao desenvolvimento de técnicas analíticas, houve necessidade de aperfeiçoar os protocolos que evitam a contaminação dessas amostras, pois em regra têm concentrações muito baixas (ng L-1) e qualquer pequena contaminação pode alterar o resultado.4 Muitos dos estudos históricos de elementos-traço em água, realizados antes do desenvolvimento de técnicas ultralimpas, são erroneamente altos porque as concentrações refletem a contaminação da amostra ao invés das concentrações ambientais.5 Concomitantemente, houve o aprimoramento de metodologias de preservação das espécies químicas de Hg de interesse até o momento da análise. Dentre as diferentes espécies químicas de Hg, as mais comumente avaliadas são mercúrio dissolvido gasoso, mercúrio reativo, metilmercúrio e mercúrio total. O mercúrio dissolvido gasoso compreende as espécies voláteis de mercúrio, que são em sua maioria Hg0, e uma pequena fração de outras espécies como o Dimetil-Hg e o HgCl2.6,7 O Hg reativo compreende todo o Hg presente na forma oxidada que pode facilmente ser reduzido a Hg0 pela adição de um redutor.4,8 Inclui principalmente o Hg2+ dissolvido e o Hg fracamente associado a orgânicos.9 O metilmercúrio é uma espécie de mercúrio organometálica, que além de bioacumular, biomagnifica ao longo das cadeias alimentares. Portanto, sua determinação em amostras ambientais é muito importante para o entendimento da contaminação da biota. O mercúrio total compreende todas as espécies químicas de mercúrio. A escolha correta do procedimento a ser seguido deve levar em consideração múltiplos fatores, como, por exemplo, a qualidade da água amostrada, o tipo de garrafa utilizada na coleta e o tempo de armazenamento até a análise. Novas metodologias têm sido discutidas a fim de simplificar os procedimentos, reduzir custos e aumentar o tempo de estoque das amostras. Considerando a complexidade para avaliar a concentração de mercúrio na água, o objetivo deste trabalho é revisar as metodologias de coleta, preservação e armazenamento de amostras de água para a análise das espécies químicas de Hg mais comumente avaliadas (mercúrio dissolvido gasoso, mercúrio reativo, metilmercúrio, e mercúrio total). Estes métodos são discutidos avaliando a realidade dos laboratórios brasileiros, que buscam a validação de metodologias alternativas porque os protocolos muitas vezes sugerem materiais pouco disponíveis ou de alto custo no país, ou ainda sugerem uma estrutura laboratorial inexistente na maioria das instituições de pesquisa.
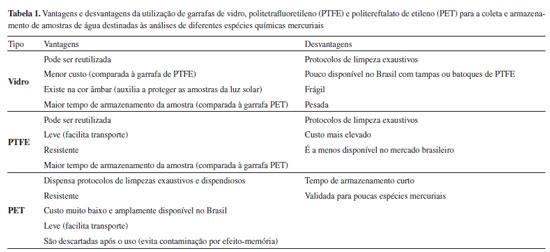
FRASCOS DE COLETA Qual tipo de garrafa utilizar? A escolha correta do tipo de garrafa que será utilizada para a coleta e o armazenamento das amostras de água é fundamental. Vários tipos de materiais já foram testados como frascos de coleta (e.g., PVC, polipropileno), e foi observado que muitos deles interagem com a amostra, alterando a concentração de algumas espécies mercuriais em horas ou dias.10 Por isso, o ideal é que o material da garrafa seja relativamente inerte para que não modifique a estabilidade das espécies mercuriais presentes. Em geral, materiais como o politetrafluoretileno (PTFE ou Teflon®) e vidro de borosilicato têm sido recomendados.11,12 O quartzo é um dos materiais que poderia ser empregado, no entanto, devido ao seu alto custo, sua utilização em análises laboratoriais rotineiras é impraticável.10 Apesar de serem ideais para a coleta de amostras de água, garrafas de PTFE não são amplamente encontradas no Brasil e muitas vezes apresentam alto custo, inviabilizando sua compra em grande quantidade (e.g., para serem utilizadas em uma campanha amostral com muitos pontos de coleta). Garrafas de vidro são amplamente disponíveis a um baixo custo no mercado brasileiro, ou podem ainda ser obtidas pela reutilização daquelas que armazenam ácidos como HCl, HNO3 e H2SO4. Apesar do baixo custo, as garrafas de vidro são mais frágeis e pesadas do que as de PTFE, o que pode resultar, respectivamente, na perda de amostras e em altos custos de transporte. A tampa da garrafa também deve ser de material inerte para evitar mudanças nas concentrações das espécies de mercúrio das amostras. As garrafas de PTFE em geral são vendidas com a tampa no mesmo material. As garrafas de vidro com tampa de vidro estão disponíveis no mercado, no entanto, elas não vedam bem e podem facilmente vazar, causando perda ou contaminação da amostra. A disponibilidade de frascos de vidro com tampa ou batoque de PTFE é muito pequena no mercado brasileiro. Uma alternativa é utilizar garrafas de vidro com batoques feitos a partir de lâminas de PTFE que estão disponíveis no Brasil a um baixo custo. Para isso, basta cortar com tesoura de inox as lâminas no diâmetro da tampa da garrafa. Garrafas de vidro com batoques feitos a partir de lâminas de PTFE apresentaram brancos de garrafa considerados adequados para o armazenamento de amostra de água destinada à análise de mercúrio.13 Garrafas de polietileno não são adequadas para coleta e armazenamento de amostras de água para análise de mercúrio.11,12 As paredes internas das garrafas de polietileno têm sítios ativos que podem causar a rápida degradação do mercúrio orgânico14 e a interconversão entre espécies mercuriais.15 Este tipo de garrafa possibilita a perda de mercúrio por adsorção, redução16,17 e a difusão de Hg gasoso, especialmente o mercúrio elementar, devido à sua porosidade.18 O polietileno de baixa densidade permite maior difusão que o de alta densidade, mas ambos são inadequados para a coleta e armazenamento de amostras de água.18 O Hg gasoso pode migrar da amostra ou para a amostra, dependendo da concentração da amostra e do ar da sala onde a garrafa está guardada, assim a magnitude da difusão de Hg será proporcional à diferença de concentração entre o ambiente e a amostra.18 Apesar do polietileno não poder ser usado para estocar amostras de Hg, ele pode ser lavado em ácido quente e, então, ser usado para contato temporário com as amostras, como, por exemplo, em um funil de coleta de água de chuva.18 Garrafas de politereftalato de etileno (PET) foram testadas para a coleta e o armazenamento de água e demonstraram resultados semelhantes às de vidro e PTFE para algumas espécies mercuriais.19,20 A PET é uma alternativa para vários dos problemas supracitados, como fragilidade, peso no transporte, disponibilidade e preço no mercado brasileiro. Copeland et al.19 validaram a PET para a coleta e o armazenamento de amostras de água para análise de mercúrio total (HgT) com concentrações de 50-1500 ng L-1. Estas concentrações são altas comparadas àquelas normalmente observadas nos ambientes naturais.21-24 Posteriormente, Fadini e Jadim20 validaram o uso das garrafas PET para a coleta e o armazenamento de amostras de água naturais destinadas às análises de HgT e de Hg reativo com concentrações de 1-9 ng L-1, e de 0,3-2,0 ng L-1, respectivamente. Isso demonstrou a possibilidade de usar a PET para amostragem de águas naturais, com concentrações em ng L-1.20 Garrafas de vidro, PTFE e PET podem ser utilizadas para coleta e armazenamento de amostras de água destinadas à análise de HgT e Hg reativo. Para as demais espécies mercuriais, o vidro e o PTFE são os materiais validados até o momento (Tabela 1). É interessante utilizar garrafas de vidro na cor âmbar para auxiliar a proteger as amostras destinadas às análises de mercúrio dissolvido gasoso (MDG), Hg reativo e metilmercúrio (MeHg), porque estas espécies químicas podem ser modificadas pela radiação solar.25,26 No entanto, o uso de garrafas transparentes ou translúcidas não inviabiliza a análise destas espécies químicas desde que a garrafa contendo a amostra esteja sempre protegida da luz, como, por exemplo, dentro de caixas térmicas com tampa.
Detalhes de lavagem, preservação e tempo de estoque em cada tipo de garrafa serão discutidos nas seções posteriores. Como lavar as garrafas antes da coleta? As garrafas de vidro e de PTFE são normalmente reutilizadas inúmeras vezes para a coleta de água, e, para isso, devem passar por um rigoroso protocolo de limpeza. Já as garrafas do tipo PET em geral são descartadas após o uso devido ao seu baixo custo. Portanto, as etapas de limpeza da garrafa PET antes da utilização são muito mais simples. Os protocolos EPA-163112 e EPA-163011 recomendam limpar as garrafas de vidro e de PTFE da seguinte maneira: preencher as garrafas com HCl 4 mol L-1 (ou HNO3 concentrado) e deixá-las em aquecimento (65-75 ºC) por no mínimo 48 h dentro de uma capela com exaustão; esperar esfriar e enxaguar três vezes com água ultra-pura; preencher as garrafas com HCl 1% (v/v), tampar e deixar overnight em aquecimento (60-70 ºC); esperar esfriar e enxaguar três vezes com água ultra-pura. A partir desta etapa, o HCl utilizado deve ser ultra puro. Assim, continuando o procedimento, deve-se preencher as garrafas com uma solução de HCl 0,4% (v/v) de alta pureza, tampar e deixá-las em um local limpo (e.g., sala livre de mercúrio classe 100) até que as partes externas das garrafas estejam secas; verificar se as tampas estão bem vedadas e colocar cada garrafa em dois sacos tipo zip de polietileno novos. Antes da campanha para coleta, por segurança pode-se esvaziar o HCl 0,4% das garrafas e levá-las para a coleta com uma solução de HCl 0,04% (v/v) de alta pureza, com água ultra-pura ou vazias.12 Se a garrafa havia armazenado uma amostra com concentração menor que 100 ng L-1, todos os passos do protocolo de limpeza devem ser iguais, exceto o primeiro, em que a garrafa pode ficar em aquecimento somente por 6-12 h ao invés de 48 h.11,12 Para evitar o acúmulo de mercúrio nas paredes das garrafas de vidro e de PTFE, recomenda-se uma pré-limpeza das mesmas com BrCl diluído.11,12 Para isso, as garrafas devem ser preenchidas com uma solução de BrCl 0,02 mol L-1 overnight. Após este período, o BrCl deve ser neutralizado com a adição de 0,2 mL de uma solução NH2OH 20% (m/v) e as garrafas podem ser limpas como descrito acima, com exceção do primeiro passo, em que a garrafa pode ficar em aquecimento somente por 6-12 h ao invés de 48 h.11,12 Esta pré-limpeza com BrCl é especialmente útil nas garrafas de PTFE, pois elas podem adsorver Hg0 às paredes, que é difícil de remover somente com as etapas de HCl e aquecimento.18 Se a amostra que havia anteriormente na garrafa não foi oxidada dentro da mesma, pode ocorrer a adsorção de Hg2+ nas paredes, e as etapas de limpeza com HCl a quente nem sempre conseguem remover, contaminando a próxima amostra a ser guardada naquela garrafa.18 Portanto, também neste caso, a pré-limpeza com BrCl seria muito importante.18 Outras maneiras de realizar uma pré-limpeza das garrafas é lavá-las com ácido nítrico concentrado a quente ou, no caso das garrafas de vidro, por incineração em mufla a 475 ºC por horas,18 observando se o tipo de vidro resistirá a essa temperatura. Para a limpeza das garrafas de vidro, Leopold et al.4 recomendam o seguinte protocolo: enxaguar três vezes com HCl 1% (v/v); preencher com BrCl 10% (v/v) e deixar por 24 h; enxaguar três vezes com água ultra-pura; repetir as duas últimas etapas (BrCl e enxague com água ultra-pura) em uma sala limpa classe 100; aquecer a garrafa a 250 ºC por no mínimo 12 h; deixar esfriar; tampar; embalar em sacos plásticos e guardar em local limpo até o uso. Para a limpeza das garrafas de PTFE, Leopold et al.4 recomendam seguir os mesmos passos de limpeza das garrafas de vidro descritos acima com exceção da etapa final de aquecimento da garrafa a 250 ºC. Em substituição a esta etapa, deve-se preencher a garrafa com água ultra-pura, e assim tampar, embalar em dois sacos plásticos tipo zip e guardar até o uso.4 A limpeza pode não ser eficiente porque a solução de limpeza (e.g., HCl, BrCl) que preenche a garrafa pode não estar em contato com toda a superfície da tampa ou batoque. Para evitar isso, durante a pré-limpeza com BrCl diluído, as garrafas podem ser invertidas por overnight para permitir o contato da solução com a tampa ou batoque.18 Leopold et al.4 recomendam um protocolo específico de limpeza para as tampas e batoques, que consiste em: enxaguar três vezes com HCl 1% (v/v); mergulhar em BrCl 10% (v/v) por 24 h; enxaguar três vezes com água ultrapura; repetir as duas últimas etapas (BrCl e enxague com água ultra-pura) em uma sala limpa classe 100; deixar secar nesta sala limpa e então usar as tampas para fechar as garrafas já descontaminadas. Alternativamente, garrafas certificadas podem ser compradas, no entanto, ainda assim brancos de garrafa de cada lote devem ser avaliados de acordo com a metodologia descrita abaixo.12 As garrafas certificadas têm um custo maior do que as garrafas de vidro e PTFE comuns justamente por serem limpas. Como vantagem, usando este tipo de garrafa o laboratório gastará menos com reagentes, espaço laboratorial e pessoal, porque não haverá necessidade de fazer a limpeza das mesmas. Estas garrafas podem ser muito úteis para aqueles laboratórios que estão iniciando trabalhos de determinação de Hg em água, e que ainda estão treinando pessoal e estabelecendo os melhores protocolos de limpeza das garrafas. Ou ainda para aqueles laboratórios que eventualmente fazem coletas de água para análise de Hg, e que, portanto, não têm os protocolos de descontaminação das garrafas como rotina. A preparação das garrafas PET para a coleta é muito mais simples que as de PTFE e vidro. A PET pode ser adquirida direto da fábrica e/ou com água mineral e descartada como plástico reciclável após o uso, evitando o tempo e os reagentes demandados devido aos exaustivos protocolos de lavagem das garrafas de vidro e PTFE. Como não são reutilizadas, as garrafas PET evitam ainda os problemas de contaminação cruzada pelo armazenamento pretérito de amostras muito contaminadas. A preparação da garrafa PET para coleta consiste em: descarregar a água mineral original (quando for comprada com água); lavar várias vezes com água ultrapura; secar em uma capela classe 100; encher com 100 mL de 0,1 mol L-1 de HCl de alta pureza; embalar em 3 sacos plásticos tipo zip e guardar em local limpo até o uso.20 Assim, uma das vantagens da utilização das garrafas PET para coleta de água é economia do tempo do pessoal de laboratório, reagentes e espaço laboratorial que são consumidos durante a lavagem das garrafas de vidro e PTFE. Antes de ir para a campanha amostral, ao menos 5% das garrafas de cada lote limpo ou comprado (no caso de garrafas certificadas) deve ser testado para verificar se a limpeza foi eficiente e as garrafas estão então com um nível de contaminação por Hg aceitável e, portanto, prontas para o uso.11,12 Para analisar estes brancos de garrafa, as mesmas devem ser preenchidas com água ultra-pura acidificada a pH < 2, fechadas e guardadas por no mínimo 24 h.12 Para garrafas que serão testadas para contaminação por MeHg, a solução deve ser HCl 0,4%.11 Se a concentração observada na solução ácida for maior que a concentração mínima de quantificação do método, o problema de contaminação deve ser identificado, os procedimentos de limpeza corrigidos e todo o lote de garrafas deve ser novamente lavado antes do uso.11,12 Parker e Bloom18 recomendam que todas as garrafas que armazenaram amostras de água com concentração de HgT > 50 ng L-1 devem ser testadas depois da limpeza. Este teste pode ser feito enchendo a garrafa com uma solução de BrCl 0,5% em água ultra-pura (v/v) e deixando por overnight. No dia seguinte deve-se quantificar o HgT desta solução para verificar se o processo de limpeza da garrafa foi eficiente, evitando a contaminação cruzada.18 Independentemente de qual protocolo de limpeza será seguido, é essencial que as garrafas sejam testadas quanto à possível contaminação ou ineficiência de limpeza. Mesmo os laboratórios com muita experiência neste tipo de análise devem testar cada lote de garrafas porque, eventualmente, alguma contaminação ou falha no processo podem ocorrer, fazendo com que as garrafas fiquem inadequadas ao uso.
PRODEDIMENTOS DE COLETA Durante os procedimentos de coleta, é essencial que a amostra de água não seja contaminada e nem alterada. O ambiente de coleta não é um ambiente que possa ser controlado pelo analista como uma sala de um laboratório, onde muitas das condições podem ser ajustadas. Entender os possíveis meios de contaminação e alteração da amostra pelo ambiente natural e pelos aparatos de coleta é o primeiro passo para que o coletor possa agir de maneira correta, prevenindo a contaminação da amostra e a interconversão entre as diferentes espécies mercuriais. As amostras de água podem ser coletadas manualmente pela submersão direta da garrafa na água. É interessante amostrar alguns centímetros abaixo da superfície (sub-superfície) para evitar a coleta da camada superficial que tem características diferentes do restante da coluna d'água, exceto nos casos em que amostrar esta camada é o objetivo. Para evitar a contaminação atmosférica, a garrafa pode ser aberta e fechada somente quando já estiver mergulhada na água, ou pode ser imersa rapidamente após abrir a tampa.27 Esse procedimento será essencial em regiões onde a contaminação pelo ar é importante; onde há relevante quantidade de partículas em suspensão no ar, em regiões com solo exposto/nu e sujeito à erosão pelo vento, perto de cidades, tráfego de veículos, indústrias e queimadas, pois estas podem ser importantes fontes de contaminação por mercúrio. A água também pode ser coletada com o auxílio de um aparato de coleta (e.g., uma garrafa de van dorn para amostragens do hipolímnio de um lago). Se o objetivo é quantificar o mercúrio gasoso dissolvido na água, uma garrafa de coleta do tipo fluxo contínuo pode ser adequada porque não provoca o borbulhamento da amostra durante o processo de coleta, evitando perdas da fase gasosa.8 Todos os aparatos de coleta devem ser lavados com ácido diluído e água ultrapura e levados para o campo embalados em sacos plásticos limpos, protegidos de possíveis fontes de contaminação. No momento da coleta, qualquer aparato utilizado deve ser inicialmente enxaguado três vezes com a água do local (que será amostrada), e somente depois se inicia a coleta das amostras de água. Se o coletor sabe a priori que uma amostra terá maior concentração de mercúrio que outra, deve coletar primeiro a amostra menos contaminada.27 Se isso não é possível pela logística de campo, ou se não há conhecimento do corpo d'água, o aparato de coleta deve ser lavado entre uma amostragem e outra com ácido diluído, água ultrapura27 e deve ser novamente enxaguado com a água do local que será amostrado a seguir. Amostras muito contaminadas não devem ser processadas concomitantemente com amostras pouco contaminadas.27 As amostras devem ser coletadas à montante do movimento do barco, direcionando o frasco de modo que a boca fique em sentido contrário à corrente.27 Se o sistema aquático for praticamente estático, o coletor deve movimentar o frasco lentamente no sentido do barco para frente, para criar uma corrente artificial. Motores a gasolina ou diesel devem ser evitados sempre que possível para evitar a contaminação da amostra pelo ar. Se a coleta ocorrer em ambiente que exija um barco com motor, ele deve ser desligado longe o suficiente do ponto de coleta para evitar a contaminação, e o deslocamento até o local de coleta deve ocorrer manualmente (e.g., remando) com o motor desligado.27 A aproximação do ponto de coleta, seja com o coletor andando dentro do corpo d'água ou remando em um barco, deve ser feita sempre contracorrente para evitar os riscos de contaminação. Os aparatos que entram em contato com a amostra não devem ficar no chão do barco, pois pode haver resquícios de óleo e gasolina que podem contaminar a amostra. Para evitar isto, todo material pode ser carregado dentro de caixas plásticas de paredes grossas com tampa. As garrafas contendo amostras de água podem ser transportadas em caixas térmicas, o que auxilia a protegê-las do calor e da luz solar. Isso é especialmente importante para as amostras destinadas às análises de MDG, Hg reativo e MeHg, pois estas espécies químicas podem ser alteradas devido à radiação solar.25,26 Seja pela imersão da garrafa diretamente na água, ou utilizando algum aparato de coleta, a amostragem deve seguir o protocolo do "mão suja"/"mão limpa".27 Um membro da equipe é designado como o "mão suja", enquanto outro é o "mão limpa". Todas as atividades que envolvam o contato com a garrafa e a transferência da amostra para a garrafa são realizadas pelo "mão limpa". Todas as outras atividades, que não envolvam contato direto com a amostra ou a garrafa de coleta, são realizadas pelo "mão suja". Apesar desta separação de atividades parecer lógica, sua realização em campo vai requerer coordenação e prática dos dois coletores, e realizar uma espécie de ensaio antes da coleta pode ser muito útil. No momento da coleta, o "mão suja" abre o saco plástico externo que guarda a garrafa. O "mão limpa" deve abrir o saco plástico interno e pegar a garrafa; retirar a solução ácida (ou a água ultra-pura) que está dentro da garrafa; encher parcialmente com água do local; tampar e agitar para que a água do local enxague bem as paredes internas da garrafa e despejar a água. O "mão limpa" deve repetir este enxague com água do local três vezes, e somente depois preencher com água local que será guardada como amostra. Ao final, verificar se a garrafa está bem vedada para evitar vazamentos e trocas de Hg gasoso entre a atmosfera e a amostra.11 O "mão limpa" coloca a garrafa com a amostra no saco interno e insere este no saco externo. O "mão suja" fecha o saco externo e coloca a garrafa na caixa térmica para o transporte.27 Não tocar na parte interna dos frascos de coleta (tampa, batoque, parede interna da garrafa) para evitar a transferência de possíveis contaminações da luva para a amostra. Não fumar (a fumaça do cigarro pode contaminar fortemente as amostras), falar ou comer durante a coleta.27 Os coletores devem utilizar luvas limpas e livres de pó durante o procedimento de coleta.27 Estas só devem ser colocadas no momento da amostragem para evitar que sujem. As luvas estão tão limpas quanto o último objeto tocado, e ao vesti-las, as mãos nuas não devem tocar no exterior das luvas.28 Vestir uma sequência de luvas (uma em cima da outra) pode facilitar a troca da luva durante os procedimentos de coleta, assim, caso seja necessário trocar a luva, pode-se retirar aquela que está suja (mais externa), e uma limpa já estará vestida na mão. Isso evita parar o procedimento de coleta. O "mão limpa" deve vestir luvas longas para poder imergir o braço na água durante a coleta. Na falta de luvas longas, pode-se usar um saco plástico grande limpo que cubra desde a mão até o antebraço, prendendo o mesmo com um elástico.28 Para cada amostra deve-se utilizar um par de luvas limpo. Utilizar equipamentos de proteção individual para proteger a amostra, e também para proteger o coletor de águas contaminadas por patógenos ou substâncias químicas e da solução ácida que está dentro das garrafas e que é descartada durante o procedimento de coleta. A identificação das amostras deve ser feita pelo lado externo do saco plástico zip externo para evitar contaminação da garrafa com as tintas de canetas. Convém levar garrafas adicionais, pois as mesmas podem quebrar, ser contaminadas ou vazar, obrigando o coletor a substituir a garrafa. No caso da coleta de água de chuva, as garrafas podem ser simplesmente esvaziadas antes de colocadas no coletor, visto que tanto a possibilidade de contaminação com os resíduos, como a possibilidade de diluição da amostra são muito pouco prováveis.28
PROCESSAMENTO DA AMOSTRA APÓS A COLETA E SUA PRESERVAÇÃO O processamento da amostra após a coleta pode ocorrer ainda em campo ou no laboratório. Enviar a amostra para o laboratório ajuda a minimizar o potencial de contaminação da amostra tendo em vista que, em geral, no laboratório o risco de contaminação é menor do que em campo. No entanto, a decisão de processar ou não a amostra em campo depende do tipo de campanha amostral realizada. Por exemplo, em campanhas amostrais de dias a semanas (e.g., campanhas oceânicas ou em muitas regiões isoladas da Amazônia), as amostras devem ser pré-processadas, preservadas e muitas vezes analisadas ainda em campo, pois não há tempo hábil de envio da amostra para o laboratório. As espécies mercuriais mais comumente analisadas em águas naturais são: Hg dissolvido gasoso, Hg reativo, MeHg e HgT. As duas últimas podem ainda ser analisadas em sua forma total na água ou como uma razão dissolvido/associado ao material particulado (Figura 1). O pré-processamento e a preservação da amostra são dependentes da espécie mercurial alvo e do tempo que o coletor pretende deixar a amostra armazenada até o momento da análise. Os detalhes para cada espécie química são discutidos a seguir.
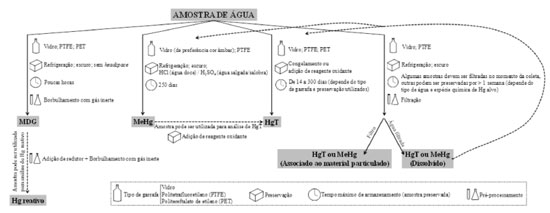 Figura 1. Resumo esquemático da metodologia que pode ser utilizada desde a coleta até o pré-processamento das amostras de água destinadas à análise das espécies químicas denominadas como mercúrio dissolvido gasoso (MDG), mercúrio reativo (Hg reativo), metilmercúrio (MeHg), mercúrio total (HgT) e o mercúrio associado ao material particulado ou dissolvido na água
Mercúrio dissolvido gasoso Durante a coleta das amostras destinadas às análises de MDG, deve-se evitar o borbulhamento da água. As amostras devem ser mantidas refrigeradas, no escuro e sem headspace. A preservação é difícil porque esta espécie é muito instável; portanto, para evitar perdas, o MDG deve ser separado das amostras dentro de algumas horas após a coleta pela purga da água com argônio ou nitrogênio (99,999%) isento de mercúrio.29,30 A purga ocorre em um frasco extrator, que pode ser feito com vidrarias do laboratório ou com uma garrafa PET adaptada para este fim.31 Após borbulhar a amostra, o ar passa por uma coluna contendo cal sodada para absorver a umidade,32 e depois é direcionado para o equipamento de análise para a quantificação do MDG total33 ou do Dimetil-Hg.11 Se no momento do borbulhamento da amostra o equipamento de análise não estiver disponível, o ar deve passar (após a coluna com cal sodada) por um trap contendo areia coberta de ouro ou um trap Tenax®/Carbotrap® para a captura do MDG total ou do Dimetil-Hg, respectivamente, que depois serão analisados no equipamento analítico.34,35 Hg reativo O Hg reativo é definido como todo o Hg presente na forma oxidada que pode facilmente ser reduzido a Hg0 pela adição de um redutor.4,8 Para separá-lo da água, a amostra já purgada para a retirada de MDG deve ser incrementada com um redutor, como por exemplo SnCl2 em meio ácido,8,36 ou ácido fórmico,4 e borbulhada da mesma maneira que foi realizado para o MDG total porque o Hg reativo será transformado em Hg0 devido à presença do redutor. As amostras de Hg reativo devem ser purgadas dentro de algumas horas após a coleta. Para evitar a contaminação da amostra, a solução redutora pode ser previamente purgada com argônio ou nitrogênio isento de Hg8,31 durante 30-45 min20,31 a 3 h.8 O tempo de purga deve ser ajustado de acordo com a concentração de Hg do redutor e com o fluxo de ar utilizado para borbulhar. Testes de branco de reagentes auxiliarão neste ajuste do tempo necessário. O mesmo procedimento pode ser realizado com os demais redutores utilizados nas análises de Hg (e.g., cloridrato de hidroxilamina), auxiliando a diminuir o branco de reagentes e a contaminação das amostras. MeHg O MeHg pode ser fotodegradado,25 sendo a luz solar mais eficiente na degradação do que a fluorescente.18 É importante evitar a exposição das amostras à luz solar, mas durante a rotina de análises no laboratório, não é necessário protegê-las da luz fluorescente.18 O uso de garrafas de vidro âmbar e de caixas não transparentes para transportar as amostras pode auxiliar a proteger as águas da fotodegradação. Em amostras de água filtrada, o MeHg permanece estável por até uma semana na amostra preservada refrigerada (1-4 ºC) no escuro.18 Para a amostra não-filtrada, este tempo pode ser menor, devido à desmetilação biológica.18 Para preservar por mais tempo, as amostras devem ser estocadas refrigeradas (0-4 ºC) no escuro, e, dentro de 48 h após a coleta, as águas continentais com baixa concentração de Cl- devem ser acidificadas com HCl 0,3-0,5% (v/v) e as águas salobra e salgada ([Cl-] > 500 ppm) com H2SO4 0,1-0,2% (v/v).11 Amostras preservadas com HNO3 não podem ser analisadas para MeHg pois ele é parcialmente decomposto pelo ácido nítrico durante a etapa da destilação11 e do armazenamento, com cerca de 30% de perda em um mês.18 Se adequadamente preservadas (acidificadas, resfriadas e no escuro), o protocolo EPA-163011 estabelece que as amostras possam ser armazenadas por até seis meses. No entanto, Parker e Bloom18 observaram que após 250 dias (> 8 meses), não houve perdas significativas de MeHg, e as amostras continuaram adequadas às análises. É possível que a água possa ser armazenada por um período ainda mais longo, entretanto, testes devem ser realizados para verificar o período máximo de estocagem, pois até o momento, o maior tempo avaliado foi de 250 dias. O MeHg não é estável em ácido concentrado, portanto o HCl ou H2SO4 utilizados geralmente não resultam em contaminação das amostras. Ainda assim, o método EPA-163011 recomenda utilizar ácido com concentração de Hg < 5 pg mL-1. A acidificação da água, mesmo em amostras de água filtrada, pode causar a coagulação de carbono orgânico dissolvido formando flocos que podem adsorver Hg e se depositar no fundo da garrafa.36 Assim, as amostras devem ser homogeneizadas antes de se remover uma sub-amostra para análise. Em geral, agitar bem a garrafa antes de retirar uma alíquota é suficiente. Garrafas de PTFE e de vidro com tampa ou batoque de PTFE são aceitáveis para a coleta e o armazenamento de amostras de água para análise de MeHg.11 O enxague das garrafas com água ultrapura durante a lavagem e com a água do local durante a coleta deve ser feito com muita atenção para que se remova todo resíduo de oxidantes utilizados na limpeza destes frascos, prevenindo a decomposição do MeHg.4 HgT A água destinada à análise de HgT deve ser manuseada cuidadosamente para evitar a contaminação da amostra. Ao contrário do MeHg, a contaminação da amostra por HgT é mais difícil de ser controlada, o que exige muito investimento de tempo para o treinamento de pessoal e ajuste de protocolos. A utilização de aparatos adequados (como salas classe 100 e capelas de fluxo laminar) auxilia no controle da contaminação. Entretanto, nem sempre os laboratórios dispõem destes materiais, e, muito menos, os laboratórios de campo, onde muitas vezes as amostras devem ser manipuladas. Além de todas as recomendações já citadas nas seções anteriores, algumas atitudes podem auxiliar no controle da contaminação: utilizar luvas e roupas limpas e livres de pó durante o manuseio das amostras; revestir as bancadas com plásticos limpos; armazenar todo material necessário à coleta em dois sacos plásticos limpos (desde pipetas até equipamentos); utilizar somente vidraria cuidadosamente lavada e de uso exclusivo para as amostras de água, separada do restante de vidraria do laboratório. Quando a amostra é utilizada para quantificar outras espécies mercuriais além do HgT, deve ser preservada, em um primeiro momento, de acordo com os protocolos dessas espécies a serem avaliadas porque para a quantificação do HgT toda a informação da especiação é perdida. Uma vez que as outras espécies tenham sido determinadas, uma das formas de preservar a água para a análise de HgT é adicionar 5 mL L-1 de BrCl à garrafa para ter certeza de que qualquer Hg aderido às paredes da garrafa seja resolubilizado antes da análise. O BrCl destrói toda informação de especiação, pois promove a conversão de todo o Hg presente na amostra a Hg2+, inclusive destruindo os complexos orgânicos.12,18 Se a adição do BrCl à garrafa não for possível, as subamostras de água utilizadas na análise de HgT devem ser retiradas somente após forte agitação da garrafa, para remover qualquer Hg aderido às paredes.12 No entanto, a adição do oxidante à garrafa é preferível porque assim a remoção do Hg aderido às paredes da garrafa é mais eficiente. Após aproximadamente 12 h da adição do BrCl, a cor amarelada do reagente na amostra deve se manter. Caso contrário, mais BrCl deve ser adicionado à amostra até que ela tenha uma cor amarelada permanente. O desaparecimento da cor amarela significa que houve consumo de todo o oxidante pela matéria orgânica ou sulfetos presentes na amostra. Frascos de coleta transparentes facilitam esta inspeção visual do excesso de BrCl. Uma vez que a amostra esteja preservada com BrCl, a temperatura de estoque da garrafa não é crítica, ela pode ser guardada em temperatura ambiente. Utilizando garrafas de vidro ou de PTFE e a preservação com BrCl, o método EPA-163112 estabelece que a amostra permanece adequada por até 90 dias a partir da data de coleta. No entanto, Parker e Bloom18 verificaram que, preservando desta maneira, o HgT foi completamente recuperado após 300 dias de armazenamento. Utilizando garrafas do tipo PET para a coleta e o armazenamento da água, as amostras podem ser preservadas com a adição de 1 mL L-1 de BrCl e devem ser analisadas em até 14 dias.20 A utilização de uma única garrafa contendo amostra de água para análise de diferentes espécies mercuriais pode ocasionar dois problemas, contaminação da amostra e super-estimativa de sua concentração. Ao abrir e fechar a garrafa repetidas vezes para remover alíquotas de água que serão analisadas para diferentes espécies mercuriais, o analista está expondo a amostra repetidas vezes, o que pode resultar em contaminação da mesma.18 Isso é especialmente importante quando as amostras são preservadas com ácidos ou soluções oxidantes, porque elas se tornam eficientes capturadoras de Hg, convertendo o Hg0 a Hg2+.18 Além da possibilidade de contaminação, o uso de uma única garrafa para a quantificação de diversas espécies mercuriais pode gerar a superestimativa do HgT.18 Isso pode ocorrer porque se uma quantidade considerável da amostra for removida da garrafa para as demais análises, o Hg adsorvido às paredes da garrafa será solubilizado quando a amostra for oxidada para a análise de HgT e irá incrementar a concentração do líquido restante na garrafa (a razão parede/amostra será maior). Estes dois problemas são resolvidos facilmente com a coleta de uma garrafa para cada espécie que se quer avaliar ou ainda com a coleta de água destinada à determinação de HgT em uma garrafa separada daquela coletada para as demais espécies mercuriais alvo. O BrCl pode não ser um oxidante adequado para amostras que contenham alta concentração de material particulado em suspensão, sendo a oxidação com 3 H2O: 2 HCl: 1 HNO3 (v/v) mais eficiente neste tipo de amostra.8 Outras formas de oxidação podem ser utilizadas para a preservação do HgT na água, como por exemplo, permanganato de potássio e persulfato de potássio.4,24 Se garrafas do tipo PET forem utilizadas para a coleta e armazenamento da água, as amostras podem ser preservadas congeladas a -18 ºC, devendo ser analisadas em até 40 dias.20 A escolha da preservação vai depender da análise química e equipamento de detecção que serão utilizados posteriormente. A não contaminação do reagente que será adicionado à amostra para a preservação do HgT é muito importante. Isso porque, ao contrário dos redutores, a descontaminação do reagente oxidante é complexa. É importante verificar com o fabricante qual é a concentração de Hg no reagente. Há reagentes ultrapuros diponíveis no mercado. No Brasil eles têm um custo elevado, mas, como são utilizados em pequena quantidade, o custo relativo por amostra não é significante. Para descontaminar os ácidos, a destilação sub-boiling é uma opção frequentemente utilizada pelos laboratórios que possuem um destilador para este fim. Uma alternativa econômica e simples é a destilação de ácido por via isotérmica.28 Esta pode ser feita em laboratório e foi eficiente para diminuir as concentrações de cobre no ácido destilado,28 mas não foi testada quanto às concentrações de Hg, deixando em aberto uma possível alternativa que pode ser utilizada pelos laboratórios. A síntese de uma solução concentrada de HCl, com a utilização de um sistema contendo NH4Cl e H2SO4, resultou em uma solução ácida com baixas concentrações de mercúrio.37 Portanto, este HCl sintetizado em laboratório37 é adequado para a preservação de amostras de água destinadas à determinação de mercúrio total e/ou a lavagem de vidraria e de garrafas de coleta. Estas podem ser possíveis alternativas de baixo custo para aqueles laboratórios que não possuem ácidos ultrapuros ou destiladores sub-boiling. Filtração As amostras de água podem ser filtradas no momento da coleta (com filtros adaptados à garrafa ou bomba coletora), após a coleta no laboratório de campo, ou no laboratório de análises até dias depois da coleta. O método EPA-166927 recomenda que, em laboratório, a filtração seja feita em capela de fluxo laminar ou em uma sala classe 100 para evitar o risco de contaminação nas condições de campo. No entanto, o local no qual a amostra será filtrada depende das condições de campo, do tipo de água coletada e da espécie mercurial alvo. Por exemplo, se a campanha amostral for muito longa e não houver possibilidade logística de envio do material para o laboratório, a equipe deverá filtrar a água no momento da coleta ou no laboratório de campo. Os cuidados que auxiliam a evitar a contaminação das amostras em campo, discutidos nas seções anteriores, também são válidos para a filtração. Se a filtração não ocorrer no momento da coleta, garrafas de vidro ou de PTFE devem ser utilizadas para armazenar a amostra até o momento da filtração no laboratório.18 Estas amostras devem permanecer no escuro e resfriadas para evitar a degradação do MeHg e a dessorção do Hg do material particulado para a solução.18,28 Mesmo nestas condições de preservação, não há um consenso sobre o tempo durante o qual a razão Hg dissolvido/associado ao material particulado permanece preservada. As amostras podem ficar estáveis somente 1-2 dias ou semanas dependendo do tipo de água coletada.18 A concentração de oxigênio dissolvido na água que será coletada pode influenciar no tempo que esta amostra poderá ser armazenada até a filtração. Enquanto que amostras de água doce contendo oxigênio dissolvido ficaram estáveis por mais de uma semana, águas anóxicas e subóxicas perderam até 99% do Hg dissolvido para as paredes da garrafa 12 h após a coleta,18 portanto, estas últimas devem ser filtradas no momento da coleta, especialmente se o HgT na fração dissolvida for a espécie-alvo. Águas destinadas à filtração para determinação de MeHg ficaram estáveis por períodos variando entre 1 dia até semanas dependendo da atividade microbiana da amostra porque pode ocorrer a desmetilação mediada por micro-organismos.18 Portanto, tendo em vista que raramente o pesquisador terá informações sobre a atividade microbiana da água que está coletando, a filtração das amostras destinadas à determinação de MeHg deve ser realizada o mais rapidamente possível. Filtros feitos de diferentes materiais (e.g., PTFE, Nylon, acetato de celulose, fibra de vidro ou quartzo) e porosidades podem ser utilizados dependendo do objetivo da coleta. O método EPA-163112 recomenda que a água seja filtrada através de um filtro com porosidade de 0,45 µm para avaliar o Hg dissolvido. Para escolher o tipo de filtro, deve-se avaliar custo, disponibilidade com a porosidade necessária e como aquele filtro pode ser descontaminado antes do uso. A reutilização dos filtros não é recomendada porque o risco da limpeza e descontaminação não serem eficientes é maior que o custo de comprar filtros novos.27 Filtros de fibra de vidro e quartzo podem ser descontaminados aquecendo os mesmos a 400 ºC por algumas horas. No entanto, filtros de quartzo com o mesmo diâmetro e que retenham em média o mesmo tamanho de partícula são cerca de 10 vezes mais caros que os de fibra de vidro. Portanto, se não há uma necessidade específica para utilizar o quartzo, os filtros de fibra de vidro podem ser utilizados em substituição com um custo muito menor. Campos et al.28 verificaram que a descontaminação do filtro pela filtração de 50 mL de HCl 1 mol L-1 seguida de 100 mL de água ultrapura é eficiente para Cu. O Hg não foi testado, portanto, somente com a análise de amostras-branco poderá ser verificado se esta descontaminação pode também ser utilizada para filtração destinada à determinação de Hg. Este procedimento é prático porque pode ser feito em campo, sem a necessidade de um tratamento prévio do filtro como a calcinação. No entanto, se o objetivo for analisar o filtro contendo o material particulado, esta limpeza possivelmente não será eficiente, pois as bordas do filtro presas ao sistema de filtração não seriam lavadas adequadamente. Para a montagem do sistema de filtração, seja ela realizada em laboratório ou em campo, o ideal é utilizar materiais relativamente inertes como o PTFE e o vidro. Assim, evita-se a alteração das espécies mercuriais presentes na amostra e também a adsorção de Hg às paredes internas do sistema. Se a filtração será realizada em campo, o PTFE é um material indicado27 porque é mais resistente e maleável que o vidro, permitindo configurar o sistema de acordo com o espaço disponível dentro do barco. Para lavar este material, o mesmo deve permanecer imerso em uma solução de HCl 5-10% (v/v) por 8-24 horas.27 O material deve então ser lavado com água ultrapura e deixado em uma sala limpa para que seque.27 Para auxiliar no processo de secagem, especialmente de tubos, pode-se purgar ar livre de mercúrio.27 Apesar do polietileno não poder ser usado para estocar amostras de água, ele pode ser utilizado em um contato temporário com a amostra, como é o caso dos sistemas de filtração.18 Bisinoti38 recomenda uma lavagem da vidraria que será utilizada no processamento de amostras destinadas à determinação de mercúrio que consiste em: lavar no mínimo cinco vezes com água ultrapura; manter por 48 h imersa em uma solução de HCl 4 mol L-1 de alta pureza (70 ºC); lavar no mínimo cinco vezes com água ultrapura; manter imersa em solução de HCl 20% (v/v) de alta pureza e, antes da utilização, retirar desta solução, lavar o material no mínimo cinco vezes com água ultrapura e deixar secar em sala limpa. Todo o material do sistema de filtração deve ser transportado dentro de dois sacos plásticos novos. A filtração deve seguir a metodologia "mão suja"/"mão limpa".27 O "mão limpa" realiza todas as etapas de filtração e contato com a amostra e o filtro. O "mão suja" auxilia nos procedimentos que não tocam na amostra e filtros, como por exemplo, abrir o saco externo que contém a garrafa da amostra e manusear a bomba de filtração. No momento da filtração, se o interesse for o Hg dissolvido, é aconselhável filtrar aproximadamente 50 mL de água da amostra para enxaguar filtro, sistema de filtração e garrafa que armazenará a água filtrada; descartar esta água; e prosseguir com a filtração que será armazenada para análise.27 Este enxague não pode ser realizado quando objetiva-se analisar o filtro, pois qualquer água filtrada vai depositar partículas no filtro e, portanto, todo volume filtrado deve ser contabilizado no cálculo de concentração final. Após a filtração, a água deve ser preservada e armazenada de acordo com os procedimentos citados nas seções anteriores.12 Antes da filtração, nenhum preservante deve ser adicionado à amostra porque isto poderia causar a coagulação da matéria orgânica dissolvida, alterando a razão dissolvido/particulado. Quando o objetivo é analisar os filtros, estes devem ser armazenados congelados em sacos plásticos novos.
CONTROLE DE QUALIDADE O único meio de medir a eficiência da coleta sem contaminação é por meio da análise de amostras nomeadas como branco.27 Brancos são amostras-controle que seguem o mesmo protocolo de preparação das amostras, com a diferença de haver água ultrapura ao invés de amostra de água. A análise de brancos é um ponto importante na determinação de mercúrio em concentrações baixas, como aquelas presentes no ambiente.12 Inúmeras fontes como, por exemplo, poeira e fumaça, podem contaminar as amostras de água destinadas às determinações de Hg. Portanto, os laboratórios precisam estar sempre atentos à necessidade de mudar procedimentos e atitudes para evitar a contaminação desse tipo de amostra. O requerimento mínimo de brancos que devem ser feitos para validar a preparação das garrafas, coleta, preservação e armazenamento das amostras inclui o branco da garrafa, branco de equipamento e branco de campo.27 Estes brancos são independentes do método analítico empregado para a detecção e quantificação do mercúrio. Durante os procedimentos analíticos, é necessário fazer outros diferentes tipos de branco como forma de controle da contaminação sobre o método empregado como, por exemplo, o branco do sistema, de reagente e do método.12 Estes últimos não serão discutidos porque não fazem parte do escopo do presente trabalho, que discute todas as etapas anteriores à análise da amostra. O branco de garrafa foi discutido anteriormente; em resumo, ele visa verificar a limpeza da garrafa antes da coleta.11 O branco de equipamento é utilizado para verificar se o equipamento de coleta é livre de contaminação.27 Qualquer equipamento utilizado na coleta da água deve ser previamente testado.27 No laboratório, após preparar o equipamento de coleta, os coletores devem processar água ultrapura no equipamento utilizando exatamente os mesmos procedimentos que serão usados em campo, como por exemplo, manuseando água e equipamento por meio da técnica do "mão suja"/"mão limpa".27 Esta água não deve ter concentração maior ou igual que a concentração mínima de quantificação do método ou não deve ser maior que um quinto da concentração das amostras, o que for maior, para que o equipamento seja considerado próprio para o uso.27 O branco de campo é utilizado para verificar se houve contaminação da amostra durante a coleta e seu processamento. Para fazer um branco de campo, água ultrapura deve ser transportada para campo em um recipiente adequado e deve então passar pelas mesmas etapas que a amostra, como, por exemplo, ser manuseada no equipamento de coleta, armazenada em uma garrafa, pré-processada, preservada com os mesmos reagentes e temperatura, transportada nas mesmas condições e, por fim, analisada como se fosse uma amostra.27 O branco de campo para coleta de água de chuva pode ser feito expondo no campo o funil acoplado à garrafa de coleta por cerca de 1 min, visto que o tempo de exposição deve ser curto para evitar a deposição de material particulado da atmosfera e, em seguida, despejar água ultra-pura sobre todo o diâmetro do funil, no volume médio de chuva coletado para aquela região.28 Os limites aceitáveis de contaminação do branco de campo são os mesmos que os do branco de equipamento.27 Ao menos um branco de campo deve ser processado a cada 10 amostras coletadas em um local.12 Para avaliar a precisão da amostragem, réplicas de campo são necessárias.27 Estas consistem em duas amostras de água do mesmo local coletadas simultaneamente, ou em uma rápida sucessão27 para que as condições não mudem, evitando que tenhamos duas amostras naturalmente diferentes (e não por erro de amostragem, que é o que se quer avaliar). Ao menos uma réplica de campo deve ser feita a cada 10 amostras coletadas em um local.12 Uma importante ferramenta de avaliação da qualidade do processamento e análise de amostras pelos laboratórios são os programas de intercomparação lab, o, ratorial. A participação do laboratório neste tipo de programa é essencial para que se possa ter uma avaliação dos procedimentos empregados pelo laboratório na análise de uma espécie química de Hg em um tipo de matriz específica. Atualmente, existe um programa de intercomparação para análise de HgT e MeHg em água promovido por uma empresa fabricante de equipamentos.39 É importante que programas de intercalibração sejam desenvolvidos entre laboratórios brasileiros que utilizam técnicas diferentes para o processamento e análise das espécies mercuriais em água. Com isso, os laboratórios poderão avaliar e ajustar as condições para obter resultados confiáveis e livres de contaminação. Bastos et al.40 realizaram uma intercomparação entre diferentes laboratórios brasileiros para análise de Hg em amostras biológicas e geológicas; mas para água, não há atualmente nenhum programa brasileiro.
CONCLUSÃO Atualmente é possível analisar diferentes espécies mercuriais em águas naturais devidos aos baixos limites de detecção dos atuais equipamentos analíticos. Isto permite importantes avanços no entendimento do ciclo desse elemento, incluindo sua bioacumulação pela biota. Concomitantemente ao avanço das técnicas analíticas, houve o desenvolvimento de eficientes métodos de preservação de amostras destinadas à especiação química e do controle da contaminação das amostras, que permitiram a execução de resultados confiáveis mesmo em águas prístinas. É necessário escolher criteriosamente cada etapa a ser seguida, como a escolha do tipo de frasco de coleta e sua descontaminação, do tipo de preservação, de armazenamento e transporte, rotina de atividades em campo e no laboratório. Estas escolhas vão depender da qualidade da amostra de água que se objetiva analisar, das espécies mercuriais alvo, da dinâmica de coleta, e da disponibilidade de equipamentos, de pessoal e financeira. No Brasil, muitos trabalhos têm sido realizados nos últimos anos com a quantificação de diferentes espécies de Hg em água. Os laboratórios brasileiros que têm inserido a análise de Hg em água em sua rotina enfrentam desafios que ainda são importantes e que, muitas vezes, limitam a quantidade de amostras ou de espécies químicas possíveis de ser analisadas, como, por exemplo, a falta de estrutura laboratorial, de recursos financeiros e de pessoal qualificado, disponibilidade de alguns materiais no mercado brasileiro e elevados custos de importação.
AGRADECIMENTOS Os autores agradecem o suporte financeiro do CNPq, FAPEAM e CAPES.
REFERÊNCIAS 1. Kehrig, H. A.; Fernandes, K. W. G.; Malm, O.; Seixas, T. G.; Di Beneditto, A. P. M.; Souza, C. M. M. ; Quim. Nova 2009, 32, 1822. DOI: http://dx.doi.org/10.1590/S0100-40422009000700026 2. Kasper, D.; Botaro, D.; Palermo, E. F. A.; Malm, O.; Oecologia Brasiliensis 2007, 11, 228. DOI: http://dx.doi.org/10.4257/oeco.2007.1102.07 3. Bisinoti, M. C.; Jardim, W. F.; Quim. Nova 2004, 27, 593. 4. Leopold, K.; Foulkes, M.; Worsfold, P.; Anal. Chim. Acta 2010, 663, 127. DOI: http://dx.doi.org/10.1016/j.aca.2010.01.048 PMID: 20206001 5. Windom, H. L.; Byrd, J. T.; Smith, R. G.; Huan, F.; Environ. Sci. Technol. 1991, 25, 1137. DOI: http://dx.doi.org/10.1021/es00018a019 6. Mason, R. P.; Fitzgerald, W. F.; Nature 1990, 347, 457. DOI: http://dx.doi.org/10.1038/347457a0 7. Vandal, G. M.; Mason, R. P.; Fitzgerald, W. F.; Water, Air, Soil Pollut. 1991, 56, 791. DOI: http://dx.doi.org/10.1007/BF00342317 8. Marins, R. V.; Paraquetti, H. H. M.; Ayres, G. A.; Quim. Nova 2002, 25, 372. DOI: http://dx.doi.org/10.1590/S0100-40422002000300007 9. Gill, G. A.; Fitzgerald, W. F.; Mar. Chem. 1987, 20, 227. DOI: http://dx.doi.org/10.1016/0304-4203(87)90074-0 10. Yu, L. P.; Yan, X. P.; Trends Anal. Chem. 2003, 22, 245. DOI: http://dx.doi.org/10.1016/S0165-9936(03)00407-2 11. EPA-1630; Methyl mercury in water by distillation, aqueous ethylation, purge and trap, and CVAFS, Environmental Protection Agency: Washington, 2001. 12. EPA-1631; Method 1631, revision E: Mercury in water by oxidation, purge and trap, and Cold Vapor Atomic Fluorescence Spectrometry, Environmental Protection Agency: Washington, 2002. 13. Kasper, D.; Forsberg, B. R.; Amaral, J. H. F.; Leitao, R. P.; Py-Daniel, S. S.; Bastos, W. R.; Malm, O.; Environ. Sci. Technol. 2014, 48, 1032. DOI: http://dx.doi.org/10.1021/es4042644 PMID: 24397364 14. Stoeppler, M.; Matthes, W.; Anal. Chim. Acta 1978, 98, 389. DOI: http://dx.doi.org/10.1016/S0003-2670(01)84069-1 15. Bloom, N. S.; Fresenius' J. Anal. Chem. 2000, 366, 438. DOI: http://dx.doi.org/10.1007/s002160050089 16. Heiden, R. W.; Aikens, D. A.; Anal. Chem. 1979, 51, 151. DOI: http://dx.doi.org/10.1021/ac50037a042 17. Leermakers, M.; Lansens, P.; Baeyens, W.; Fresenius' J. Anal. Chem. 1990, 336, 655. DOI: http://dx.doi.org/10.1007/BF00331410 18. Parker, J. L.; Bloom, N. S.; Sci. Total Environ. 2005, 337, 253. DOI: http://dx.doi.org/10.1016/j.scitotenv.2004.07.006 PMID: 15626395 19. Copeland, D. D.; Facer, M.; Newton, R.; Walker, P. J.; Analyst 1996, 121, 173. DOI: http://dx.doi.org/10.1039/an9962100173 20. Fadini, P. S.; Jardim, W. F.; Analyst 2000, 125, 549. DOI: http://dx.doi.org/10.1039/a909623j 21. Brigham, M. E.; Wentz, D. A.; Aiken, G. R.; Krabbenhoft, D. P.; Environ. Sci. Technol. 2009, 43, 2720. DOI: http://dx.doi.org/10.1021/es802694n 22. Bisinoti, M. C.; Júnior, E. S.; Jardim, W. F.; J. Braz. Chem. Soc. 2007, 18, 544. DOI: http://dx.doi.org/10.1590/S0103-50532007000300008 23. Fu, X.; Feng, X.; Yin, R.; Zhang, H.; Environ. Toxicol. Chem. 2013, 32, 2256. DOI: http://dx.doi.org/10.1002/etc.2323 PMID: 23832677 24. Montgomery, S.; Mucci, A.; Lucotte, M.; Pichet, P.; Can. J. Fish. Aquat. Sci. 1995, 52, 2483. DOI: http://dx.doi.org/10.1139/f95-839 25. Sellers, P.; Kelly, C. A.; Rudd, J. W. M.; MacHutchon, A. R.; Nature 1996, 380, 694. DOI: http://dx.doi.org/10.1038/380694a0 26. Silva, G. S.; Jardim, W. F.; Fadini, P. S.; J. Braz. Chem. Soc. 2009, 20, 1549. DOI: http://dx.doi.org/10.1590/S0103-50532009000100026 27. EPA-1669; Sampling ambient water for trace metals at EPA water quality criteria levels, Environmental Protection Agency: Washington, 1996. 28. Campos, M. L. A. M.; Bendo, A.; Viel, F. C.; Quim. Nova 2002, 25, 808. DOI: http://dx.doi.org/10.1590/S0100-40422002000500017 29. Fitzgerald, W. F. Em The Role of Air-Sea Exchange in Geochemical Cycling; Buat-Ménard, P., ed.; D. Reidel Publishing: Dordrecht, 1986, cap. 3. 30. Mason, R. P.; Fitzgerald, W. F.; Water, Air, Soil Pollut. 1991, 56, 779. DOI: http://dx.doi.org/10.1007/BF00342316 31. Bisinoti, M. C.; Tese de Doutorado, Universidade Estadual de Campinas, Brasil, 2005. 32. Magarelli, G.; Fostier, A. H.; Quim. Nova 2005, 28, 968. DOI: http://dx.doi.org/10.1590/S0100-40422005000600007 33. O'Driscoll, N. J.; Beauchamp, S.; Siciliano, S. D.; Rencz, A. N.; Lean, D. R. S.; Environ. Sci. Technol. 2003, 37, 2226. DOI: http://dx.doi.org/10.1021/es025944y PMID: 12785529 34. Coquery, M.; Cossa, D.; Sanjuan, J.; Mar. Chem. 1997, 58, 213. DOI: http://dx.doi.org/10.1016/S0304-4203(97)00036-4 35. Tseng, C. M.; Balcom, P. H.; Lamborg, C. H.; Fitzgerald, W. F.; Environ. Sci. Technol. 2003, 37, 1183. DOI: http://dx.doi.org/10.1021/es025892c PMID: 12680673 36. Bloom, N. S. Em Mercury Pollution Integration and Synthesis; Watras, C.; Hackabee, J., eds.; Lewis: Boca Raton, 1994, cap. 2. 37. Patel-Sorrentino, N.; Benaim, J.-Y.; Cossa, D.; Lucas, Y.; Anal. Bioanal. Chem. 2011, 399, 1389. DOI: http://dx.doi.org/10.1007/s00216-010-4432-y PMID: 21107818 38. Bisinoti, M. C.; Tese de Doutorado, Universidade Estadual de Campinas, Brasil, 2005. 39. Creswell, J.; Engel, V.; Carter, A.; Davies, C.; 2013 Brooks Rand Labs Interlaboratory Comparison Study for Total Mercury and Methylmercury (Intercomp 2013), 1st ed., Brooks Rand Labs: Seattle, 2013. 40. Bastos, W. R.; Malm, O.; Pfeiffer, W. C.; Cleary, D.; Cienc. Cult. 1998, 50, 255. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access