Artigo
|
|
| Parâmetros termodinâmicos da casca de laranja desidratada Thermodynamic parameters of dehydrated orange peel |
|
Carolina M. Santos*; Leandro Cardoso de Morais
Departamento de Engenharia Ambiental, Universidade Estadual Paulista Recebido em 01/09/2014 *e-mail: s.carolmonteiro@hotmail.com The global energy scenario is currently a widely discussed topic, with growing concern about the future supplies. Thus, much attention has been dedicated to the utilization of biomass as an energy resource. In this respect, orange peel has become a material of great interest, especially to Brazil, which generates around 9.5 million tons of this waste per year. To this end, the authors studied the kinetics of the thermal processing of dried orange peel in inert and oxidizing atmosphere. The thermodynamic parameters were determined by the Ozawa-Flynn-Wall method for the global process observed during heating from the 25ºC up to 800ºC. The thermal analysis in air and nitrogen showed 3-2 stages of mass loss, respectively, with approximately 20% residual mass under a nitrogen atmosphere. The increase in the values of activation energy for the conversion points between 20% and 60% for thermal effects in air and nitrogen atmosphere was observed. The activation energy obtained in an oxidizing atmosphere was higher than that obtained under a nitrogen atmosphere. The fourier-transform infrared spectroscopy and X-ray diffraction analysis showed that the material has a high level of complexity with the presence of alkali and alkaline earth groups as well as phosphate, plus substances such as pectin, cellulose and lignin. INTRODUÇÃO A questão energética é um assunto atual e amplamente discutido, sendo cada vez mais crescente a preocupação sobre o futuro do abastecimento mundial. A utilização de resíduos agroindustriais como fonte energética pode auxiliar na resolução desse problema, especialmente para países como o Brasil, que possuem esses recursos em abundância, amenizando também os problemas ambientais decorrentes de sua disposição inadequada.1-4 A fruticultura consolidou-se como o principal segmento do Produto Interno Bruto (PIB) brasileiro, tornando o país líder na produção de Laranja Pêra (Citrus sinensis). O cultivo da fruta está presente em todos os Estados, sendo a fruta mais plantada no Brasil com uma área superior a 800 mil hectares.5 O país detém na atualidade mais da metade da produção mundial de seu suco, que é considerado de altíssima qualidade, exportando 98% da produção.6 Em consequência, têm-se uma elevada carga de resíduos, decorrentes em sua maioria do processo de industrialização do suco. Em 2011, segundo dados do Intituto Brasileiro de Geografia e Estatística (IBGE), os resíduos do processo industrial atingiram cerca de 9,5 milhões de toneladas. Dessa forma, a utilização desse resíduo em termoelétricas para complementar a capacidade energética do país pode ser uma alternativa viável, além de sustentável. Para elaborar um processo eficiente de conversão termoquímica, visando obter subprodutos de maior valor agregado como energia e biocombustíveis,7 é essencial compreender o comportamento térmico da matéria-prima utilizada. Dessa forma, o processo de decomposição da biomassa tem atraído cada vez mais atenção.8 Várias técnicas podem ser utilizadas, porém, através da termoanálise é possível a obtenção dessas informações de forma rápida e direta.9,10 Em particular, a análise termogravimétrica não-isotérmica (TGA) demonstrou ser o melhor método para o estudo e a compreensão da cinética da decomposição térmica, sendo amplamente utilizada a baixas razões de aquecimento e temperaturas até 900 ºC.11 Há diversas publicações que se preocuparam em analisar e descrever a análise de TGA e o comportamento de diferentes materiais durante a degradação térmica, tais como glicerol,12 plástico13 e diferentes biomassas.8,9,14 Kumar et al.15 e Conesa et al.16 estudaram a decomposição térmica de palha de milho por TGA em atmosferas de ar e nitrogênio. Kumar et al.15 concluíram que existem três fases distintas de perda de massa em ambas as condições, porém, os parâmetros cinéticos foram semelhantes apenas nas razões de aquecimento mais lentas. Nas razões de aquecimento mais altas a segunda etapa da degradação ocorreu mais rapidamente. Conesa et al.16 observaram que a energia de ativação em atmosfera de ar foi maior do que a em atmosfera de nitrogênio, observação realizada também por Kumar et al.15 Uma comparação do processo de degradação da biomassa em diferentes atmosferas pode fornecer informações úteis para a elaboração de um projeto mais eficiente de aproveitamento energético do material. São vários os métodos de análise que podem ser utilizados a partir dos dados cinéticos obtidos pela TGA.17,18 O método do ponto de isoconversão requer várias curvas para se realizar a análise. Cálculos realizados em curvas termogravimétricas de diferentas razões de aquecimento são realizados sobre o mesmo valor de conversão, permitindo o cálculo da energia de ativação para cada ponto de conversão.14 A vantagem de utilização desse método é referente a sua simplicidade e a possibilidade de se calcular a energia de ativação para um ponto qualquer de conversão de forma independente, podendo se obter um perfil da energia de ativação em função do ponto de conversão. A desvantagem desse método se dá pela necessidade da realização de medições em diferentes razões de aquecimento, com a mesma quantidade de amostra e mesmo fluxo de gás. Estes parâmetros podem variar, acarretando em erros.19 Há diversos trabalhos publicados sobre pirólise de biomassas, no entanto, publicações sobre combustão são escassos e poucos têm como foco a casca da laranja.20-22 Independente da atmosfera utilizada na análise termogravimétrica, os parâmetros de Arrhenius podem ser determinados através de diferentes métodos.23 Dessa forma, o presente estudo preocupou-se em comparar a eficiência energética da casca seca de laranja através da análise termogravimétrica em atmosfera oxidante e inerte pelo método isoconvencional de Ozawa-Flynn-Wall (OFW) a fim de gerar dados para a discussão da potencial aplicabilidade deste material como biocombustível.
PARTE EXPERIMENTAL Preparação e caracterização da biomassa As cascas de laranja utilizadas foram provenientes do Lar Educandário Bezerra de Menezes (Sorocaba, São Paulo), variedade Pêra (Citrus sinensis), que é caracterizada como a mais importante variedade cítrica brasileira.24 As cascas foram lavadas com água destilada e detergente, reduzidas a fragmentos de aproximadamente 5×5 cm e então dispostas em estufa de secagem e esterilização da marca Solab, modelo 100/42 (Piracicaba/Brasil), a 110 ºC durante três dias para a total secagem da amostra, até peso constante. Após a secagem as amostras foram trituradas em um moinho de facas seguido de peneiramento, passante em peneira ABNT nº. 200, a fim de diminuir o tamanho das partículas e aumentar a área superficial de contato, tornando a amostra mais homogênea, e, portanto, mais representativa.25 As análises foram realizadas a partir de um único lote com o intuito de minimizar possíveis divergências, visto que a variedade escolhida está presente em todo o território nacional. Para caracterizar quimicamente a amostra foi realizada a análise de difração de raios-X (DRX) em equipamento X'Pert PRO da PANalytical, radiação K-α do cobre, com valores de 2θ de 3º a 65º, com passo de 0,05º por 3 segundos de fonte de radiação. Os dados obtidos foram interpretados através do software X'PertHighScore Plus 2.2ª. Com a finalidade de identificar as estruturas cristalinas da amostra, foi feita a análise de espectroscopia de infravermelho (FTIR) em Espectofotômetro FT-IR da marca Varian modelo 660-IR. As pastilhas foram preparadas na proporção de 3% de amostra para 97% de KBr, e a faixa de coleta do espectro de 4000 a 400 cm-1 com 8 cm-1 de resolução espectral e 32 acumulações para cada amostra. Análises termogravimétricas Para realização das análises termogravimétricas (TG) foi utilizado o analisador TGA-DTA-DSC Simultâneo, modelo SDT-Q600 da TA Instruments (New Castle/Estados Unidos da América). Cerca de 2 mg das amostras foram colocados em cadinhos de alumina, utilizando ar ou nitrogênio como gás de arraste, com vazão de 100 mL min-1. As amostras foram aquecidas de 20 ºC até 800 ºC, com razões de aquecimento de 10, 15 e 20 ºC min-1. O software do equipamento forneceu as curvas termogravimétricas (TG) e de sua derivada (DTG). Parâmetros termodinâmicos e energia de ativação Para investigar os processos de decomposição dos diferentes constituintes do material, a energia de ativação (Ea) foi obtida através da equação de Ozawa-Flynn-Wall, equação (1):26 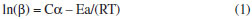 onde β é a taxa de aquecimento; Ea a energia de ativação; C (α) é a função do mecanismo; R é a constante universal dos gases; e T é a temperatura em Kelvin. O C (α) é um valor de estado, embora β seja diferente. Dessa forma, a Ea pode ser calculada a partir do declive da curva de log β por 1/T obtendo C (α). A vantagem na utilização deste método é que a Ea pode ser calculada diretamente, evitando assim possíveis erros. Além disso, este método cobre uma ampla faixa de graus de conversão. Os parâmetros termodinâmicos fatores pré-exponenciais (A), Entalpias (ΔHº), energias livres de Gibbs (ΔGº) e Entropias (ΔSº) foram calculados conforme as equações (2), (3), (4) e (5).12,26,27 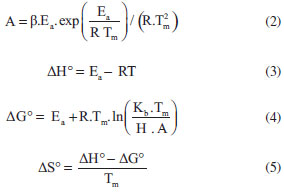 onde Kb é a constante de Boltzmann, H é a constante de Plank e Tm é a temperatura do pico máximo da DTG.
RESULTADOS E DISCUSSÃO Caracterização da amostra - Análises de DRX e FTIR O espectro do DRX (Figura 1S) não apresentou picos definidos, com exceção do pico entre 44 θ e 45 θ, atribuído como o metal ferro pelo software. Segundo a Associação Brasileira de Exportadores de Cítricos (Abecitrus),28 os resíduos da indústria da laranja são ricos em ferro, zinco, cobre, potássio, cálcio, fósforo, sódio e magnésio. Muitos desses componentes foram detectados na casca da laranja desidratada pela análise (Tabela 1). Silva Filho et al.29 realizaram a determinação de componentes minerais de diversas biomassas, onde a casca de laranja apresentou níveis elevados de ferro e sódio.

Observou-se uma maior ocorrência de elementos orgânicos a inorgânicos, com uma estrutura amorfa, o que se é esperado visto que o material é de origem orgânica.30 Foi detectada também a presença de alumínio e os óxidos de lítio e berílio. O difratograma obtido por FTIR (Figura 1) apresentou um grande número de picos, indicando um material de alta complexidade. A larga e extensa absorção da banda em torno de 3436 cm-1 corresponde a vibrações de alongamento de grupos O-H devido à interação inter e intra molecular da ligação do H dos compostos poliméricos, associações macromoleculares, tais como álcoois, fenóis e ácidos carboxílicos, como também em pectina, celulose e lignina,31 mostrando a presença de grupos hidróxido livres na superfície do adsorvente. Os picos a 2927 cm-1 são atribuídos às vibrações C-H de alongamento dos ácidos alifáticos.32 Os picos observados a 2360 cm-1, de acordo com Silverstein (1991),33 são referentes a grupos alcilas, nitrilas, sais de amina e, com médias e fortes absorções, grupos de fósforo. Os picos observados a 1697 cm-1 podem ser atribuídos às vibrações de alongamento das ligações de grupos carboxílicos não iônicos (-COOH, -COOCH3), característicos de ácidos carboxílicos ou seus ésteres.32 Os picos de 1543 e 1382 cm-1 correspondem às vibrações assimétricas e simétricas de C=O de grupos carboxílicos iônicos (-COO-), respectivamente.34 A vibração de grupos ácidos alifáticos no pico de 1193 cm-1 pode ser atribuída a deformação de grupos C=O e ao alongamento de formação de grupos -OH de ácidos carboxílicos e fenóis.35 Os picos observados na região de 1095 cm-1 podem ser referentes a vibração de alongamento de C-OH de álcoois e ácidos carboxílicos.35
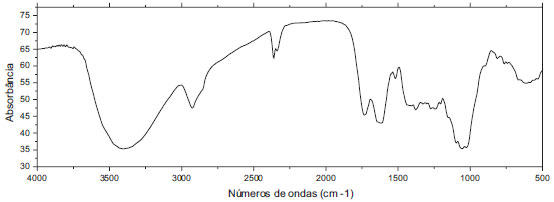 Figura 1. Difratogramada de análise por FTIR da casca seca de laranja
Análise da conversão termogravimétrica da biomassa A Figura 2a traz as curvas TG/DTG sob atmosfera oxidante. Nota-se uma perda de massa de aproximadamente 10% até a temperatura de 170 ºC, sendo associada à perda de água ainda presente na amostra, caracterizada também pelo pico da DTG. Seguem-se então três etapas facilmente identificadas de perda de massa: na primeira etapa, de 150 ºC até aproximadamente 320 ºC ocorreu a perda mais significativa de massa com a liberação dos componentes orgânicos mais voláteis, sendo o material reduzido a 40 % de sua massa inicial. Na segunda etapa, de 170 ºC até 420 ºC, a DTG mostra três picos diferentes, caracterizando um efeito sobreposto de perda de massa, o que sugere a presença de diferentes compostos com temperaturas de combustão próximas; de 420 ºC até 525 ºC nota-se uma perda de massa com grande liberação de energia caracterizada pelo pico da DTG, onde, ao seu término, têm-se apenas 3% da massa inicial, restando os componentes inorgânicos e menos voláteis da amostra.
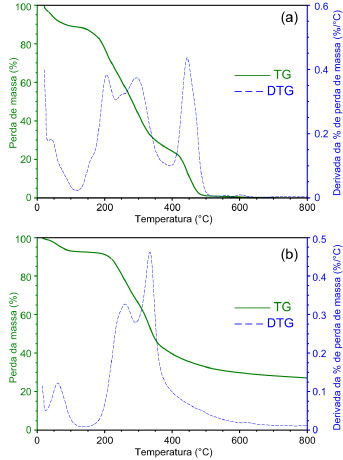 Figura 2. Curvas TG/DTG da casca seca de laranja, com razao de aquecimento de 10 °C min-1 até 800 °C em atmosfera oxidante (a) e inerte (b)
Na Figura 2b observa-se até a temperatura de 150 ºC a perda de água na amostra. Vê-se também a presença de um pico a 162 ºC na curva DTG, sutil, mas que se deve à provável presença de álcoois na amostra. Entre 190 ºC e 280 ºC notam-se dois picos exotérmicos na curva DTG, observando-se a seguir outro pico a aproximadamente 350 ºC, com efeitos sobrepostos. Observa-se a perda de massa até 580 ºC. Comparando as respectivas curvas TG da massa percentual residual após o término da última etapa de perda de massa, observada a 800 ºC, têm-se uma massa residual em nitrogênio de 20% enquanto que em ar foi de 3%. Isto é devido à presença de produto residual carbonoso decorrente da pirólise dos produtos orgânicos, presente a essa temperatura em atmosfera inerte.36 Cálculo das energias de ativação As energias de ativação foram determinadas com base no método de Ozawa-Flynn-Wall. As curvas TG da biomassa em atmosfera oxidante e inerte em diferentes razões de aquecimento são mostradas na Figura 3. Os parâmetros cinéticos da perda de massa, como a energia de ativação (Ea) e o fator pré-exponencial (A) estão dispostos na Tabela 2.
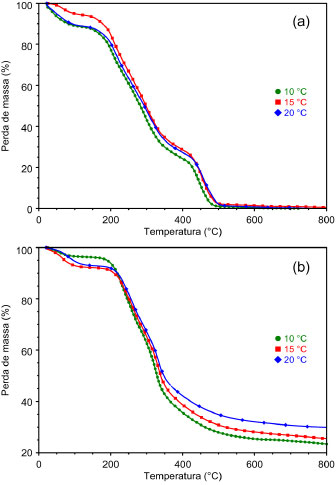 Figura 3. Curvas termogravimétricas da casca seca de laranja nas razoes de aquecimento de 10 °C, 15 °C e 20 °C por minuto em atmosfera oxidante (a) e inerte (b)
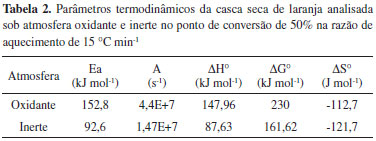
As alterações de Ea com o grau de conversão (α) da amostra nas diferentes atmosferas estão dispostas na Figura 4. Foram consideradas as conversões de massa entre 20 e 80% nesta análise.26
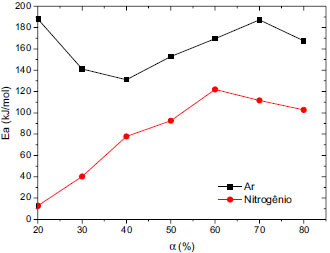 Figura 4. Mudanças observadas na energia de ativaçao da casca seca de laranja analisadas sob atmosfera oxidante e inerte durante o processo de perda de massa
O processo global de decomposição da amostra nas duas atmosferas apresentou diferentes estágios, onde cada etapa contribuiu parcialmente e individualmente para o mecanismo como um todo. A Ea encontrada para a casca seca de laranja desidratada analisada sob atmosfera oxidante é claramente mais elevada do que a Ea observada sob atmofera inerte. Isso se dá devido à presença de alguns elementos minerais presentes na casca seca de laranja, principalmente metais alcalinos e alcalinos terrosos, assim como outros elementos como, por exemplo, Na, K, Li, Mg, Ca e P, que agem como uma barreira para energia de ativação e consequentemente nos efeitos de combustão.37 A Ea é um obstáculo que deve ser superado antes que uma reação química seja gerada. Ela determina a reatividade e a sensibilidade da reação. Dessa forma, valores elevados de Ea significam maior dificuldade para que a reação ocorra. É provável que minerais presentes nesta biomassa seca tenham atuado como uma barreira para impedir a difusão do calor e a liberação de voláteis degradados no processo de carbonização e de combustão, causando um aumento nas energias de ativação, principalmente as realizadas em atmosfera oxidante. Nas taxas de conversão de 50%-80% encontrou-se os valores de 92,6 kJ mol-1 e 102,7 kJ mol-1 para corridas em atmosfera de nitrogênio e de 152,8 kJ mol-1 e 167,6 kJ mol-1 para corridas em atmosfera de ar. As Ea em atmosfera de ar apresentaram valores mais elevados quando se considerou o mesmo grau de conversão. Isso ocorreu devido à taxa de perda de massa Ym ser mais elevada em ar (7,113% ºC-1) ao se comparar com a taxa para a corrida em nitrogênio (0,4819% ºC-1), apresentando feitos térmicos mais acentuados já ao início do processo. Na Figura 4 pode-se perceber uma semelhança no perfil das curvas. Provavelmente isto ocorreu devido à composição ser parecida entre as amostras testadas, já que foram preparadas da mesma maneira e retiradas do mesmo lote. Porém, é importante notar que são efeitos diferentes de pirólise e combustão ocorrendo. Com excessão do grau de conversão a 20%, o qual apresentou uma Ea de 188,2 kJ mol-1, isso ocorreu provavelmente porque a esta temperatura em atmosfera de ar já há a formação de óxidos e carbonatos. As taxas de conversão de 30% a 50% apresentaram um aumento nas suas respectivas Ea, que em termos de valores variaram de 141,1 kJ mol-1 a 152,8 kJ mol-1 para corridas em ar e de 40,3 kJ mol-1 a 92,6 kJ mol-1 para corridas realizadas em nitrogênio. Isso se deve à composição da amostra que contém celulose, estágio característico para produtos desta natureza. Parâmetros termodinâmicos Os parâmetros termodinâmicos ΔHº, ΔGº e ΔSº foram calculados para a temperatura T = Tp, onde Tp é o pico da DTG, sendo esta temperatura caracterizada como a maior do processo.26 Os parâmetros termodinâmicos da decomposição térmica da casca de laranja desidratada sob atmosfera inerte e oxidante estão dispostos na Tabela 2. O fator pré-exponencial (A) é dependente do grau de conversão (α) e da Ea obtida. O valor de A encontrado para este caso, ou seja, considerando as análises em ar e nitrogênio, foi da ordem (grandeza) de 107, o que representa a presença de elementos complexos na biomassa estudada.38 Porém, quando se tem esta grandeza de valor, acredita-se que durante o processo de aquecimento da amostra este produto mais complexo não se desprendeu e/ou degradou totalmente.39 Um fator pré-exponencial dessa grandeza indica reações unimoleculares, e isto normalmente ocorre quando se têm superfícies de contato irregulares.40 Este fato também ocorreu provavelmente devido a fortes ligações químicas envolvendo esta(s) substância(s), já que o fator pré-exponencial depende também de uma reação superficial de interação do material que está sofrendo efeitos termodinâmicos em fase sólida e/ou raio atômico do(s) composto(s) contido(s) na amostra.23 O valor da entalpia para o processo realizado em atmosfera inerte foi mais baixo comparado com o realizado em atmosfera de ar. Isso se deve à dificuldade de ativação que ocorreu durante a queima, devido à presença de elementos minerais contidos na composição da amostra, elevando a entalpia. Outro detalhe importante é relacionado à degradação da celulose presente na biomassa, que é mais difícil do que a degradação da hemicelulose, a fim de dissociar as ligações entre as substâncias. A diferença na energia livre de Gibbs revelou um aumento total na energia do sistema, característico da formação de um complexo ativado que ocorreu durante o processo. A mudança de entropia para a formação do complexo ativado se dá através de reações de entropia, que reflete quão perto está o sistema do equilíbrio termodinâmico. Os valores de entropia serem todos negativos indica que o complexo ativado tem uma estrutura mais organizada quando comparada à substância inicial. Quando os valores de entropia são elevados, como o obtido, o material está distante do próprio equilíbrio termodinâmico. Neste caso, a reatividade é alta e o sistema pode reagir rápido para produzir um complexo ativado e, consequentemente, tempos curtos de reações.
CONCLUSÃO Este trabalho apresenta a caracterização dos parâmetros termodinâmicos da casca de Laranja Pêra (Citrus sinensis) a partir da aplicação do modelo isoconvencional de Osawa-Flynn-Wall aos resultados obtidos de análises termogravimétricas realizadas nas razões de aquecimento de 10, 15 e 20 ºC min-1 em atmosfera de ar sintético e nitrogênio. A análise térmica da casca de laranja desidratada realizada em atmosfera de ar mostrou três etapas distintas de perda de massa, já sua decomposição térmica se deu em duas etapas, com massa residual de aproximadamente 20%. A análise de DRX indicou a presença de elementos alcalinos e alcalinos terrosos na biomassa, elementos que dificultam o processo de combustão. Além disso, através do FTIR, detectou-se a presença de pectina, celulose e lignina, substâncias que também atuam dificultando o processo de combustão. Os valores da energia de ativação, fator pré-exponencial, assim como as mudanças de entropia, entalpia e energia livre de Gibbs para a formação dos complexos ativados foram calculados. Observou-se um aumento dos valores da Ea para os valores de conversão entre 20% e 60% para os efeitos térmicos em atmosfera de ar e nitrogênio, tendo a Ea em atmosfera oxidante apresentado o maior valor. Os parâmetros cinéticos da casca de laranja desidratada não estão disponíveis na literatura, e os dados obtidos sugerem que essa biomassa possui alto potencial de utilização como biocombustível sólido. Dessa forma, esses resultados tornam-se informações úteis para o processo de pirólise e gaseificação dessa biomassa para engenheiros e pesquisadores.
MATERIAL SUPLEMENTAR O difratograma da análise de FTIR obtido da casca de laranja desidratada encontra-se disponível em formato pdf, com acesso livre, a partir do website da revista Química Nova (http://quimicanova.sbq.org.br/).
AGRADECIMENTOS Os autores agradecem o suporte financeiro da Fundação de Amparo a Pesquisa do Estado de São Paulo - FAPESP. Projeto número 2013/06413-5.
REFERÊNCIAS 1. Loo, S. V.; Koppejan, J.; The Handbook of Biomass Combustion of Cofiring, Earthscan: London, 2008. 2. Goldemberg, J. Quím. Nova 2009, 32, 582. DOI: http://dx.doi.org/10.1590/S0100-40422009000300004 3. Ferreira-Leitao, V.; Gottschalk, L. M. F.; Ferrara, M. A.; Nepomuceno, A. L.; Molinari, H. B. C.; Bon, E. P. S.; Waste Biomass Valorization 2010, 1, 65. DOI: http://dx.doi.org/10.1007/s12649-010-9008-8 4. Kok, M. V.; Ozgur, E.; Fuel Process. Technol. 2013, 106, 739. DOI: http://dx.doi.org/10.1016/j.fuproc.2012.10.010 5. http://www.ibge.gov.br/home/estatistica/indicadores/agropecuaria/lspa/lspa_201301.pdf, acessada em Janeiro 2014. 6. Neves, M. F.; Trombin, V. G.; Milan, P.; Lopes, F. F.; Pereira, F. C.; Kalaki, R. B.; O Retrato da Citricultura Brasileira, 1. ed., Ribeirao Preto, 2010. 7. Shuping, Z.; Yulong, W.; Mingde, Y.; Chun, L.; Junmao, T.; Bioresour. Technol. 2010, 101, 359. DOI: http://dx.doi.org/10.1016/j.biortech.2009.08.020 PMID: 19720523 8. Damartzis, T. H.; Vamvuka, D.; Sfakiotakis, S.; Zabaniotou, A.; Bioresour. Technol. 2011, 102, 6230. DOI: http://dx.doi.org/10.1016/j.biortech.2011.02.060 PMID: 21398116 9. Vlaev, L. T.; Markovska, I. G.; Lyubchev, L. A.; Thermochim. Acta 2003, 406, 1. DOI: http://dx.doi.org/10.1016/S0040-6031(03)00222-3 10. Yang, Q.; Wu, S.; Lou, R.; J. Anal. Appl. Pyrolysis 2010, 87, 65. DOI: http://dx.doi.org/10.1016/j.jaap.2009.11.006 11. Saddawi, A.; Jones, J. M.; Williams, A.; Wojtowicz, M. A.; Energy Fuels 2010, 24, 1274. DOI: http://dx.doi.org/10.1021/ef900933k 12. Castelló, M. L.; Dweck, J.; Aranda, D. A. G.; J. Therm. Anal. Calorim. 2011, 105, 737. DOI: http://dx.doi.org/10.1007/s10973-011-1730-3 13. Ren, S.; Zhang, J.; Thermochim. Acta 2013, 561, 36. DOI: http://dx.doi.org/10.1016/j.tca.2013.03.040 14. Slopiecka, K.; Bartocci, P.; Fantozzi, F.; Appl. Energy 2012, 97, 491. DOI: http://dx.doi.org/10.1016/j.apenergy.2011.12.056 15. Kumar, A.; Wang, L.; Dzenis, Y.; Jones, D.; Hanna, M.; Biomass Bioenergy 2008, 32, 460. DOI: http://dx.doi.org/10.1016/j.biombioe.2007.11.004 16. Conesa, J. A.; Urueña, A.; Díez, D.; J. Anal. Appl. Pyrolysis 2014, 106, 132. DOI: http://dx.doi.org/10.1016/j.jaap.2014.01.010 17. Simon, P.; J. Therm. Anal. Calorim. 2004, 76, 123. DOI: http://dx.doi.org/10.1023/B:JTAN.0000027811.80036.6c 18. Sbirrazzuoli, N.; Vincent, L.; Bouillard, J.; Elegant, L.; J. Therm. Anal. Calorim. 1999, 56, 783. DOI: http://dx.doi.org/10.1023/A:1010110307418 19. Zhou, D.; Grant, D. J. W.; J. Phys. Chem. 2004, 108, 4239. DOI: http://dx.doi.org/10.1021/jp037917f 20. Aguiar, L.; Montesinos, F. M.; Gonzalo, A.; Sánchez, J. L.; Arauzo, J.; J. Anal. Appl. Pyrolysis 2008, 83, 124. DOI: http://dx.doi.org/10.1016/j.jaap.2008.06.009 21. Miranda, R.; Bustos-Martinez, D.; Blanco, C. S.; Villarreal, M. H. G.; Cantu, M. E. R.; J. Anal. Appl. Pyrolysis 2009, 86, 245. DOI: http://dx.doi.org/10.1016/j.jaap.2009.06.001 22. Lopez-Velazquez, M. A.; Santes, V.; Balmaseda, J.; Torres-Garcia, E.; J. Anal. Appl. Pyrolysis 2013, 99, 170. DOI: http://dx.doi.org/10.1016/j.jaap.2012.09.016 23. Koga, N.; Thermochim. Acta 1994, 244, 1. DOI: http://dx.doi.org/10.1016/0040-6031(94)80202-5 24. http://www.estacaoexperimental.com.br/documentos/BC_11.pdf, acessada em Julho 2014. 25. Brown, M. E; Gallagher, P. K.; Handbook of thermal analysis and calorimetry. Principles and practice, Elsevier Science: Amsterdam, 1998. 26. Kim, Y. S.; Kim, Y. S.; Kim, S. H.; Adv. Environ. Sci. Technol. 2010, 44, 5313. DOI: http://dx.doi.org/10.1021/es101163e 27. Xu, Y. L.; Chen, B. L.; Bioresour. Technol. 2013, 146, 485. DOI: http://dx.doi.org/10.1016/j.biortech.2013.07.086 PMID: 23958681 28. ASSOCIAÇAO BRASILEIRA DOS EXPORTADORES DE CITRICOS - ABECITRUS. Subprodutos da Laranja, 2003. Disponível em: <http://www.abecitrus.com.br/subprobr.html>. Acesso em Outubro 2014. 29. Silva Filho, J. C. S.; Armelin, M. J. A.; Silva, A. G.; Pesq. agropec. bras. 1999, 2, 235. DOI: http://dx.doi.org/10.1590/S0100-204X1999000200012 30. Mafra, M. R.; Igarashi-Mafra, L.; Zuim, D. R.; Vasques, É. C.; Ferreira, M. A.; Braz. J. Chem. Eng. 2013, 30, 657. DOI: http://dx.doi.org/10.1590/S0104-66322013000300022 31. Gnanasambandam, R.; Protor, A.; Adv. Food Biochem. 2000, 68, 327. 32. Li, F. T., Yang, H., Zhao, Y., Xu, R.; Chin. Chem. Lett. 2007, 18, 325. DOI: http://dx.doi.org/10.1016/j.cclet.2006.11.015 33. Silverstein, R. M.; Bassler, G. C.; Morrill, T. C.; Spectrometric Identification of Organic Compounds, 5th ed., John Wiley & Sons: New York, 1991. 34. Farinella, N. V.; Matos, G. D.; Arruda, M. A. Z.; Bioresour.Technol. 2007, 98, 1940. DOI: http://dx.doi.org/10.1016/j.biortech.2006.07.043 PMID: 17049231 35. Guibavd, G.; Tixier, N.; Bouju, A.; Baudu, M.; Chemosphere 2003, 52, 1701. DOI: http://dx.doi.org/10.1016/S0045-6535(03)00355-2 36. Otero, M.; Rozada, F.; Calvo, L. F.; García, A. I; Imorán, A.; Dyes Pigm. 2003, 57, 55. DOI: http://dx.doi.org/10.1016/S0143-7208(03)00005-6 37. McKendry, P.; Bioresour. Technol. 2002, 83, 37. DOI: http://dx.doi.org/10.1016/S0960-8524(01)00118-3 PMID: 12058829 38. Atanassov, A.; Genieva, S. D.; Vlaev, L. T.; Polym.-Plast. Technol. Eng. 2010, 49, 541. DOI: http://dx.doi.org/10.1080/03602550903532224 39. Turmanova, S. C.; Genieva, S. D.; Dimitrova, A. S; Vlaev, L. T.; eXPRESS Polym. Lett. 2008, 81, 253. 40. Georgieva, V.; Zvezdova, D.; Vlaev, L.; Chem. Cent. J. 2012, 6, 81. DOI: http://dx.doi.org/10.1186/1752-153X-6-81 PMID: 22857524 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





