Artigo
|
|
| Zingiber officinale (gengibre) como fonte enzimática na redução de compostos carbonílicos Zingiber officinale (ginger) as an enzyme source for the reduction of carbonyl compounds |
|
Leonardo A. AlvesI,II; Luciana M. BertiniI,II; Ayla Márcia C. BizerraI,III; Marcos Carlos de MattosI; Francisco José Q. MonteI; Telma L. G. LemosI,*
IDepartamento de Química Orgânica e Inorgânica, Universidade Federal do Ceará, 60021-970 Fortaleza - CE, Brasil Recebido em 22/08/2014 *e-mail: tlemos@dqoi.ufc.br Various vegetables as biological catalysts were evaluated in enantioselective reduction of carbonyl compounds. The stereoselectivity of the process was in agreement with Prelog's rule for twelve of the vegetables, whereas okra and green peppers formed anti-Prelog products. Zingiber officinale exhibited the best results with 30% conversion and 89% ee. The parameters of the reaction such as time, solvent and other substrates investigated, as well as the specie, showed good chemo- and enantioselectivity. INTRODUÇÃO Um expressivo número de moléculas biologicamente ativas contém um ou mais centros quirais, constituindo assim, a quiralidade, uma peculiaridade necessária para a atividade biológica. A síntese de compostos quirais enantiomericamente puros aplicando biocatalisadores enantiosseletivos é de interesse industrial para a produção de insumos farmacêuticos, cosméticos e agroquímicos.1-4 Consequentemente, diversos trabalhos foram produzidos no objetivo de transferir a quiralidade de um catalisador oticamente ativo para um substrato proquiral. Entre as transformações biocatalíticas usando plantas, pode-se citar o interesse na preparação de álcoois quirais a partir da redução de cetonas proquirais usando células de culturas de plantas ou células de partes de plantas. As enzimas oriundas de espécies vegetais, mesmo apresentando uma menor duplicação de biomassa quando comparadas aos sistemas microbianos, apresentam em sua matriz enzimas únicas que são responsáveis pela obtenção de inúmeros produtos de alto valor agregado como fármacos ou insumos farmacêuticos em suas formas enantioméricas ativa e elevada pureza ótica.5 Assim, a metodologia oferece uma oportunidade para a realização de obtenção de produtos de modo rápido e seguro, utilizando fontes locais com vantagens significativas do ponto de vista ecológico e econômico. A espécie Zingiber officinale, comumente conhecida como gengibre, mangaratá ou mangarataia, oriunda de regiões da China e da Índia, é reconhecida pelo seu interesse econômico e muito utilizado na culinária mundial. Além disso, o uso do gengibre é altamente valorizado na medicina popular por apresentar diversas propriedades farmacológicas no combate as inflamações, artrites e desconfortos gastrointestinais.6-10 Em nossas investigações sobre biocatalisadores oriundos de espécies cultivadas no Brasil, foram estudadas diversas espécies (Manihot sp.,11,12 Cocos nucifera L.,13 Saccharum officinarum,14,15 Passiflora edulis,16 Lentinus strigellus,17 Vigna unguiculata,18 Glycine max,19 Lens culinaris20), todas com resultados promissores. No presente trabalho, foram investigadas outras espécies vegetais encontradas facilmente no comércio da Região Nordeste do Brasil, com destaque para Zingiber officinale (gengibre), como biocatalisador em reações orgânicas de redução.
PARTE EXPERIMENTAL Materiais utilizados Os solventes utilizados foram adquiridos pela Synth e os substratos da Aldrich e Merck. Gel de sílica Merck 60 foi utilizada para cromatografia em coluna (CC) e folhas de poliéster pré-revestidas de gel de sílica (Kieselgel 60 F254, 0,20 mm Merck) para cromatografia em camada delgada (CCD). Uma solução de 5,0 g de vanilina com 100 mL de álcool etílico e 100 mL de ácido perclórico 0,75 mol L-1 foi utilizada para detecção dos produtos de reações (pulverização seguido de aquecimento a 120 ºC). Biocatalisadores As espécies vegetais com aspecto saudável (14), investigadas inicialmente foram: Zingiber officinale (gengibre), Colocasia esculenta L. (inhame), Curcuma longa (açafrão), Solanum tuberosum (batata), Cucumis anguria L. (maxixe), Abelmoschus esculentus (quiabo), Capsicum chinense (pimenta de cheiro), Capsicum annum (pimentão verde), Brassica oleracea (repolho), Cucumis sativum (pepino), vagens de Vigna unguiculata (feijão), Coriandrum sativum (coentro), Allium fistulosum L. (cebolinha), Lactuca sativa (alface). Todos os vegetais foram adquiridos no mercado local de Fortaleza, Estado do Ceará, Brasil. Métodos analíticos As substâncias de partida e os produtos de reações foram analisados por meio de cromatografia gasosa (CG), cromatografia líquida de alta eficiência (CLAE) e ressonância magnética nuclear de hidrogênio (RMN de 1H 500 MHz). Foi utilizado um cromatógrafo a gás Trace GC Ultra equipado com detector de ionização de chama (DIC) usando hidrogênio como gás carreador (1,0 mL/min); coluna capilar quiral Chirasil-Dex CB (β-ciclodextrina, 25 m × 0,25 mm × 0,25 µm) foi usada para a determinação dos rendimentos e excessos enantioméricos. As temperaturas do injetor e do detector foram mantidas em 220 e 200 ºC, respectivamente. A temperatura da coluna foi variada conforme a identificação de diferentes compostos: acetofenona (1) e 1-feniletanol (1a), 1 ºC/min de 100 ºC até 118 ºC e 0,5 ºC/min até 120 ºC; benzaldeído (2), 3-metoxibenzaldeído (3), cinamaldeído (4), furfural (5), 3-metoxiacetofenona (6), hexan-3-ona (8), hex-5-en-2-ona (9), octan-2-ona (10), ciclopentanona (11), cicloexanona (12), (-)-mentona (13), (-)-carvona (14), 3-oxobutanoato de etila (15), e os seus respectivos álcoois (2a-6a, 8a e 15a), 2 ºC/min de 100 ºC a 180 ºC; α-tetralona (7) e α-tetralol (7a), 5 ºC/min de 100 ºC a 149 ºC, 0,2 ºC/min para 155 ºC e 10 ºC/min até 180 ºC; acetatos de hexan-3-ila (8b), hex-5-en-2-ila (9b), octan-2-ila (10b) e 3-hidroxibutanoato de etila (15b), 1 ºC/min de 70 ºC a 100 ºC e 10 ºC/min até 200 ºC. As análises foram realizadas a partir da comparação dos tempos de retenção (T.R.) das substâncias com os respectivos padrões: 1 (T.R. = 6,9 min)/ 1a (T.R. = 13,5 min (R); 14,2 min (S)); 2 (T.R. = 4,1 min)/ 2a (T.R. = 11,3 min); 3 (T.R. = 13,6 min)/ 3a (T.R. = 19,9 min); 4 (T.R. = 16,7 min)/ 4a (T.R. = 24,1 min); 5 (T.R. = 3,5 min)/ 5a (T.R. = 5,6 min); 6 (T.R. = 14,9 min)/ 6a (T.R. = 22,5 min (R); 23,1 min (S)); 7 (T.R. = 6,9 min)/ 7a (T.R. = 10,4 min (S); 11,8 min (R)) - analisados por CLAE; 8 (T.R. = 3,3 min)/ 8b (T.R. = 6,1 min (R); 6,5 min (S)); 9 (T.R. = 3,5 min)/ 9b (T.R. = 6,6 min (S); 7,9 min (R)); 10 (T.R. = 10,0 min)/ 10b (T.R. = 16,5 min (S); 19,8 (R)); 11 (T.R. = 2,9 min)/ 11a (T.R. = 4,5 min); 12 (T.R. = 4,4 min)/ 12a (T.R. = 6,3 min); 13 (T.R. = 9,3 min); 13a (T.R. = 12,4 min (S); 13,7 (R)); 14 (T.R. = 14,9 min)/ 14a (T.R. = 17,7 min); 15 (T.R. = 13,5 min); 15b (T.R. = 17,1 min (S); 17,9 min (R)). Dados espectroscópicos incluindo RMN 1H dos produtos estão de acordo com a literatura.14-20 As análises de CLAE foram desenvolvidas em aparelho Shimadzu LC-10ADvp equipado com coluna quiral OD-H (150 x 4,6 mm) e por RMN 1H em espectrômetro Bruker Avance DRX-500 utilizando CDCl3 como solvente; os deslocamentos químicos foram registrados na escala δ tendo como referência o sinal residual do solvente CHCl3 (δH 7,27). Síntese de álcoois 1a -15a para correlação com os correspondentes álcoois obtidos via biorredução Os álcoois 1a-15a foram obtidos por redução com NaBH4 em metanol a partir dos correspondentes compostos carbonílicos 1-15, seguindo o procedimento da literatura.21 Todos os produtos foram analisados por RMN de 1H e CG-DIC. Procedimentos gerais de biorredução Os vegetais foram lavados separadamente com solução de hipoclorito de sódio 5% em água destilada por um período de 10 min e cortados em pequenos pedaços de aproximadamente 1 cm de comprimento em condições assépticas. Em experimentos individuais, os substratos 1 - 15 (200 mg) foram adicionados a uma suspensão do biocatalisador (23 g) em H2O destilada (100 mL) em erlenmeyer de 250 mL. Cada mistura foi colocada sob agitação mecânica (175 rpm) a temperatura ambiente durante 72 h. Cada suspensão foi filtrada, os resíduos lavados com água destilada e as soluções aquosas extraídas com EtOAc (3 × 80 mL). A fase orgânica foi seca sobre Na2SO4 anidro e evaporada sob pressão reduzida. Os resíduos foram filtrados em uma pequena coluna de gel de sílica usando CHCl3 como eluente (60 mL), obtendo-se: 1/1a (146 mg); 2/2a (141 mg); 3/3a (154 mg ); 4/4a (132 mg); 5/5a (133 mg); 6/6a (159 mg); 7/7A (122 mg); 8/8a (149 mg); 9/9a (136 mg); 10/10a (143 mg); 11/11a (155 mg); 12/12a (127 mg); 13/13a (123 mg); 14/14a (155 mg); 15/15a (134 mg). Os valores de conversão foram quantificados e analisados em CG-DIC, utilizando as áreas dos picos sem uso de fator de correlação,22 e RMN de 1H, a partir da comparação da integração de sinais de hidrogênios presentes nos substratos e seus respectivos produtos. Estudo do tempo de biorredução da acetofenona (1) Tendo em vista o estudo cinético, foi empregado o mesmo procedimento experimental na biorredução da acetofenona (1), porém, variando o tempo de reação em 12, 24, 36, 48 e 72 h. Foram realizados dois experimentos tendo o gengibre como biocatalisador. No primeiro, o meio reacional foi a água e, no segundo, tampão fosfato de pH 6,5. Os ensaios foram em triplicata e os produtos analisados e quantificados por CG e RMN de 1H.
RESULTADOS E DISCUSSÃO Redução de cetonas a aldeídos por biocatalisadores vegetais Considerando que álcoois quirais são importantes como precursores de vários produtos de interesse e tendo em vista sua obtenção empregando vegetais abundantes e comuns, uma série de reações foi realizada para verificar o potencial redutor dos vegetais selecionados, tendo como substrato modelo a acetofenona (1) (Esquema 1). Os produtos da reação foram analisados primeiramente por CCD (hexano/EtOAc 8:2, v/v) como eluente, sendo observado, praticamente em todos os casos, a formação do álcool 1a (Tabela 1). Na análise por CG-DIC foram observadas, na maioria dos casos, somente três picos, sendo um atribuído ao material de partida e dois aos álcoois formados. Na análise por espectroscopia de RMN 1H, para medida dos respectivos rendimentos, foi comparada a integração da área do sinal em δH 2,61 (3H, s) dos hidrogênios do grupo metila com a integração do sinal em δH 4,80 (1H, q) do hidrogênio carbinólico. Os valores de conversão para cada espécie são mostrados na Tabela 1.
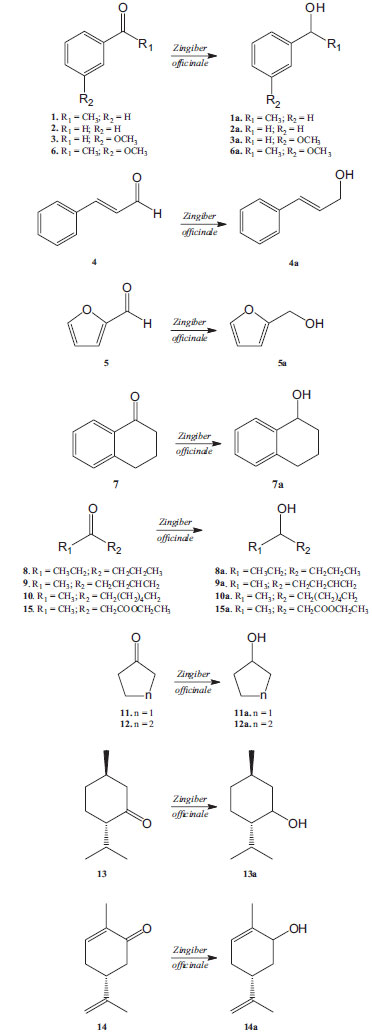 Esquema 1. Biorreduçao de compostos carbonílicos
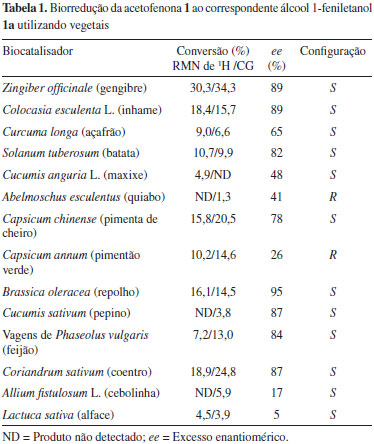
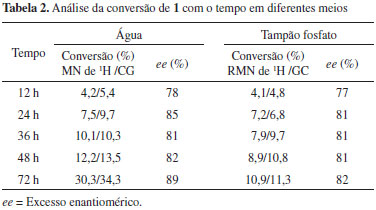
Conforme observado, todos os biocatalisadores apresentaram ação catalítica na reação de redução de 1, com valores de conversão aceitáveis medidos pelos dois métodos (RMN de 1H e CG-DIC), com pequenas variações. De quatorze espécies selecionadas para o "screening", doze formaram 1-feniletanol (S)-1a em acordo com a regra de Prelog23 e apenas duas (quiabo e pimentão verde) produziram o álcool (R)-1a (anti-Prelog). Vale ressaltar a obtenção dos produtos da reação utilizando os vegetais gengibre, inhame, couve, batata, feijão, coentro e pepino com excessos enantioméricos, relativamente, altos (82 a 95%). Os melhores valores de bioconversão foram obtidos com coentro (19%), mandioca (18%) e gengibre (30%), este último com valor superior ao relatado por Andrade et al.,24 que mostrou conversão de 8%. Em vista destes resultados, o gengibre foi selecionado como biocatalisador a ser utilizado em reações de biorredução a partir de vários outros compostos carbonílicos (Esquema 1). Avaliação do tempo de reação de 1 com gengibre Usando modelo adaptado da literatura verificou-se o estudo cinético em água e solução tampão.18 Em relação ao estudo cinético na biorredução de 1 em soluções aquosa e tampão fosfato de pH 6,5, o melhor resultado foi obtido no tempo de 72 h de reação tendo a água como solvente, com conversão de 30% e excesso enantiomérico de 89% [álcool (S)-1a]. No caso do meio reacional tampão fosfato de pH 6,5 após 72 h de reação, a conversão foi de apenas 11%, embora, com excesso enantiomérico de 83% (Figura 1, Tabela 2). Assim, o meio aquoso foi estabelecido para as demais reações.
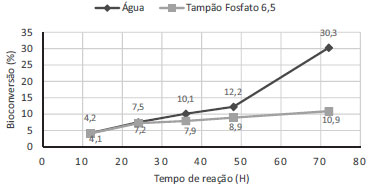 Figura 1. Bioconversao de 1 em funçao do tempo utilizando gengibre em água destilada ou tampao fosfato
Utilização do complexo enzimático do gengibre em outros compostos carbonílicos Tendo o gengibre como biocatalisador e a água como meio de reação, o estudo foi expandido para avaliar o potencial redutor do vegetal com relação a outros substratos: benzaldeído (2), 3-metoxibenzaldeído (3), cinamaldeído (4), furfural (5), 3-metoxiacetofenona (6), α-tetralona (7), hexan-3-ona (8), hex-5-en-2-ona (9), 2-octanona (10), ciclopentanona (11), ciclo-hexanona (12), (-)-mentona (13), (-)-carvona (14), 3-oxobutanoato de etila (15) (Esquema 1). A medida dos rendimentos na análise por RMN de 1H obedeceu o seguinte procedimento: comparação da integração do sinal do grupo metila de 6, 9, 10 e 15 com a do sinal do hidrogênio carbinólico de 6a, 9a, 10a e 15a; comparação da integração do sinal do hidrogênio aldeídico de 2, 3, 4 e 5 com a do sinal dos hidrogênios metilênicos dos álcoois 2a, 3a, 4a e 5a; comparação da integração do sinal dos hidrogênios metilênicos de 7, 8, 11, 12 e 13 com a do sinal do hidrogênio carbinólico de 7a, 8a, 11a, 12a e 13a.
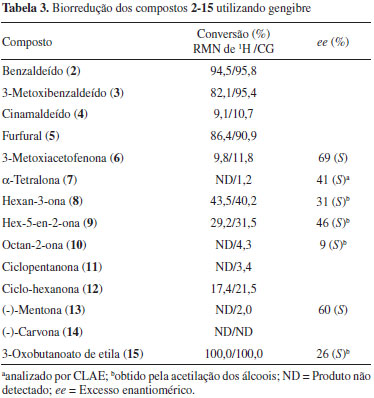
Observando o resultado das análises das reações com os aldeídos 2, 3 e 5 (rendimentos de 82 a 94%) o biocatalisador mostrou tratar-se de uma excelente fonte de redutases. Como esperado, de modo geral, os aldeídos foram mais reativos que as cetonas. Entretanto, no caso do aldeído 4 (cinamaldeído), um composto carbonílico α,β-insaturado, embora tenha sido obtido um baixo rendimento (9%) na produção do álcool 4a, vale ressaltar a quimiosseletividade observada com redução apenas no grupo carbonílico. Foi registrada na literatura a ocorrência de produtos resultantes de 4 não somente na carbonila, mas apenas na ligação dupla, como também em ambos os grupos simultaneamente.13,15,18-20 A reação com as cetonas aromáticas 6 e 7 produziu os respectivos álcoois quirais 6a (10%) e 7a (1%), com excessos enantioméricos de 69% e 41%, respectivamente, determinados por CLAE, para os álcoois de configuração S de acordo a regra de Prelog.23 As reações enzimáticas foram estendidas para as cetonas alifáticas 8-15 (Esquema 1). Rendimentos moderados a baixos foram observados para a redução das cetonas 8 (43%), 9 (29%) e 10 (4%); as cetonas cíclicas 11 (3%), 12 (17%) e 13 (2%) também foram pouco reativas apresentando baixos rendimentos, enquanto para a cetona 14 não foi observado nenhum produto de reação. Os valores do ee dos álcoois 8a, 9a e 10a foram determinados por análise (CG-DIC) de seus derivados acetilados com 31%, 46% e 9%, respectivamente, para os isômeros de configuração S. Já o álcool 13a apresentou um ee de 60% para a mesma configuração. Finalmente, na reação com o substrato 15, portador de dois grupos carbonílicos de funções diferentes, novamente foi observada reação quimiosseletiva com a redução apenas do grupo ceto (C-3), originando como único produto o álcool 15, um β-hidroxiéster com excelente conversão (100%), embora com baixo ee (26 %) do enantiômero de configuração S, determinado por análise de (CG-DIC) a partir do seu derivado acetilado. Algumas considerações teóricas puderam ser feitas de modo a justificar, em parte, os resultados práticos em relação a determinados substratos utilizados. Por exemplo, quando se compara os substratos 1 e 6, é compreensivo o maior rendimento na reação com a cetona 1, visto que, em 6, o grupo MeO, doador de elétrons, torna o carbono carbonílico menos eletrofilico, o mesmo podendo-se dizer em relação aos compostos 2 e 3. Na comparação entre as cetonas alifáticas 8, 9 e 10, o menor rendimento do álcool 10a (4%) seria justificado pelo maior impedimento estérico devido ao maior grupo alquil (hexil) em 10. No caso dos substratos 13 e 14, o baixo rendimento na formação de 13a poderia ser justificado pelo impedimento espacial do grupo isopropila, enquanto para 14 o impedimento devido ao grupo metila e, em adição, a conjugação, tornam o carbono carbonílico menos reativo, não sendo observada a formação de nenhum produto reacional. Reações biocatalíticas usando células vegetais são interpretadas como sendo produto de enzimas presentes naquela espécie ou da presença de fungos que estão associados a estes. O processo, entretanto, não invalida os resultados, levando-se em consideração que os mesmos são reprodutíveis. Reações de biorredução são relatadas com vegetais de diferentes plantas do planeta.25
CONCLUSÕES Este estudo fornece informações para eventual preparação de (S)-1-feniletanol por redução da acetofenona (1) usando biocatalisador vegetal adequado, com destaque Z. officinale (gengibre). Este vegetal mostrou-se o mais ativo para a reação em questão, além da capacidade em reduzir diversos outros compostos carbonílicos com relevante estereosseletividade. Outro aspecto importante do complexo enzimático de gengibre é a sua quimiosseletividade expressa nas reações com cinamaldeído (4) e 3-oxobutanoato de etila (15), o que o torna bastante promissor em reações de substâncias polifuncionais.
AGRADECIMENTOS Os autores agradecem às agências brasileiras CNPq, CAPES pelos apoios financeiros e ao CENAUREMN-UFC pelos dados de RMN.
REFERÊNCIAS 1. Laumen, K.; Ghisalba, O. Auer, K.; Biosci. Biotechnol. Biochem. 2001, 65, 1977. DOI: http://dx.doi.org/10.1271/bbb.65.1977 PMID: 11676008 2. Hanson, R. L.; Parker, W. L.; Brzozowski, D. B.; Tully, T. P.; Kotnis, A.; Patel, R. N.; Tetrahedron: Asymm. 2005, 16, 2711. DOI: http://dx.doi.org/10.1016/j.tetasy.2005.07.020 3. Patel, R. M.; Coord. Chem. Rev. 2008, 252, 659. DOI: http://dx.doi.org/10.1016/j.ccr.2007.10.031 4. Patel, R. N.; Biomolecules, 2013, 3, 741. DOI: http://dx.doi.org/10.3390/biom3040741 5. Cordell, G. A.; Lemos, T. L. G.; Monte, F. J. Q.; Mattos, M. C.; J. Nat. Prod. 2007, 70, 478. DOI: http://dx.doi.org/10.1021/np0680634 PMID: 17302457 6. Indu, M. N.; Hatha, A. A. M.; Abirosh, C.; Harsha, U.; Vivekanandan, G.; Braz. J. Microbiol. 2006, 37, 153. DOI: http://dx.doi.org/10.1590/S1517-83822006000200011 7. Justo, O. R.; Moraes, A. G.; Barreto, G. P. M.; Mercadante, A. Z.; Rosa, P. T. V.; Quim. Nova 2008, 31, 1699. DOI: http://dx.doi.org/10.1590/S0100-40422008000700019 8. Thomson, M.; Al-Qattan, K. K.; Al-Sawan, S. M.; Alnageeb, M. A.; Khan, I.; Ali, M.; Prostaglandins, Leukotrienes Essent. Fatty Acids 2002, 67, 475. DOI: http://dx.doi.org/10.1054/plef.2002.0441 9. Kim, D. S. H. L.; Kim, J. Y.; Bioorg. Med. Chem. Lett. 2004, 14, 1287. DOI: http://dx.doi.org/10.1016/j.bmcl.2003.12.041 PMID: 14980683 10. Rosa, C.; Machado, C. A.; Rev. Bras. Farmacogn. 2007, 88, 26. 11. Machado, L. L.; Sousa, J. S. N.; Mattos. M. C.; Sakata, S. K.; Cordell, G. A.; Lemos, T. L. G.; Phytochemistry 2006, 67, 1637. DOI: http://dx.doi.org/10.1016/j.phytochem.2006.02.008 PMID: 16603212 12. Machado, L. L.; Lemos, T. L. G.; Mattos, M. C.; Oliveira, M. C. F.; Gonzalo, G.; Gotor-Fernandez, V.; Gotor, V.; Tetrahedron: Asymm. 2008, 19, 1419. DOI: http://dx.doi.org/10.1016/j.tetasy.2008.05.018 13. Fonseca, A. M.; Monte, F. J. Q.; Oliveira, M. C. F.; Mattos, M. C.; Cordell, G. A.; Braz-Filho, R.; Lemos, T. L. G.; J. Mol. Catal. B 2009, 57, 78. DOI: http://dx.doi.org/10.1016/j.molcatb.2008.06.022 14. Assunçao, J. C. C.; Lemos, T. L. G.; Monte, F. J. Q.; Quim. Nova 2009, 32, 1549. DOI: http://dx.doi.org/10.1590/S0100-40422009000600036 15. Assunçao, J. C. C.; Machado, L. L.; Lemos, T. L. G.; Cordell, G. A.; Monte, F. J. Q.; J. Mol. Catal. B, 2008, 52, 194. DOI: http://dx.doi.org/10.1016/j.molcatb.2008.01.004 16. Machado, L. L.; Monte, F. J. Q.; Oliveira, M. C. F.; Mattos, M. C.; Gotor-Fernandez, V.; Gonzalo, G.; Gotor, V.; Lemos, T. L. G.; J. Mol. Catal. B, 2008, 54, 130. DOI: http://dx.doi.org/10.1016/j.molcatb.2007.12.008 17. Barros-Filho, B. A.; Oliveira, M. C. F.; Lemos, T. L. G.; Mattos, M. C.; Gonzalo, G.; Gotor-Fernandez, V.; Gotor, V.; Tetrahedron: Asymm. 2009, 20, 1057. DOI: http://dx.doi.org/10.1016/j.tetasy.2009.02.008 18. Bizerra, A. M. C.; Gonzalo, G.; Lavandera, I.; Gotor-Fernandez, V.; Mattos, M. C.; Oliveira, M. C. F.; Lemos, T. L. G.; Gotor, V.; Tetrahedron: Asymm. 2010, 21, 566. DOI: http://dx.doi.org/10.1016/j.tetasy.2010.03.005 19. Bertini, L. M.; Lemos, T. L. G.; Alves, L. A.; Monte, F. J. Q.; Oliveira, M. C. F.; Mattos, M. C.; Afr. J. Biotechnol. 2012, 11, 7766. 20. Ferreira, D. A.; Silva, R. C.; Assunçao, J. C. C.; Mattos, M. C.; Lemos, T. L. G.; Monte, F. J. Q.; Biotechnol. Bioprocess Eng. 2012, 17, 407. DOI: http://dx.doi.org/10.1007/s12257-011-0509-5 21. Vogel, A. I.; A Textbook of Practical Organic Chemistry, Longman: London, 1974. 22. Salvano, M. S.; Cantero, J. J.; Vàzquez, A. M.; Formica, S. M.; Aimar, M. L.; J. Mol. Catal. B 2011, 71, 16. DOI: http://dx.doi.org/10.1016/j.molcatb.2011.03.003 23. Vieira, M. R.; Dissertaçao de Mestrado, Universidade Regional de Blumenau, Brasil, 2006. 24. Andrade, L. H.; Utsunomiya, R. S.; Omori, A. T.; Porto, A. L. M.; Comasseto, J. V.; J. Mol. Catal. B 2006, 38, 84. DOI: http://dx.doi.org/10.1016/j.molcatb.2005.11.009 25. Misra, K.; Maity, H. S.; Chanda, S.; Nag, A.; J. Mol. Catal. B 2012, 82, 92. DOI: http://dx.doi.org/10.1016/j.molcatb.2012.06.004 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





