Revisão
|
|
| Curcumina, o pó dourado do açafrão-da-terra: introspecções sobre química e atividades biológicas Curcumin, the golden powder from turmeric: insights into chemical and biological activities |
|
Vitor Sueth-SantiagoI; Gustavo Peron Mendes-SilvaI; Débora Decoté-RicardoII; Marco Edilson Freire de LimaI,*
IDepartamento de Química, Instituto de Ciências Exatas, Universidade Federal Rural do Rio de Janeiro, BR 465, Km 07, 23897-000 Seropédica - RJ, Brasil Recebido em 01/08/2014 *e-mail: marco@ufrrj.br Turmeric, obtained from the dried rhizomes of Curcuma longa (Zingiberaceae), is a golden colored material, commonly used around the world for seasoning and coloring food dishes. Since antiquity, turmeric has been widely used in the treatment of several diseases in traditional Chinese and Indian medicine (Ayurveda), where it is also known by other names such as Kanchani (goddess gold) or also Gauri (having a bright and luminous face), a designation stemming from the gilded appearance of the plant material. Curcumin, the main chemical component of turmeric, is responsible both for its properties as dyes as well as its biological activities. This diarylheptanoid was first isolated almost two centuries ago and had its chemical structure determined in 1910 as being diferuloylmethane. Subsequently, more detailed and relevant data were obtained furthering the understanding of structural features of curcumin. The classical methodology for the synthesis of curcumin and other curcuminoids was described in 1960 by Pabon. Subsequently, different variations on this methodology have been developed, culminating with the synthesis of different curcuminoids. Several studies have been published in recent years on the biological activities exhibited by curcumin including its antioxidant, antitumor, anti-inflammatory, antiviral, antibacterial, antifungal, antimalarial and leishmanicidal activities. INTRODUÇÃO Desde a Pré-História partes de vegetais vêm sendo utilizadas por diversas populações com fins medicinais, seja na amenização de dores ou no tratamento de diferentes enfermidades. Primariamente, a utilização de plantas medicinais funcionava de maneira totalmente empírica e se baseava em descobertas acidentais.1 Nas últimas décadas, tentativas de se entender melhor os mecanismos de atuação de compostos naturais, a fim de aliá-los à medicina moderna, têm contribuído para o sucesso de pesquisas sobre a utilização farmacológica de princípios ativos de origem vegetal, colocando os produtos naturais em posição de destaque na área de desenvolvimento de fármacos.2 Curcuma longa (ou Curcuma domestica Valeton; Figura 1a) é um arbusto perene endêmico da Índia, havendo registros de seu uso desde o século I antes da Era Comum (AEC), embora haja referências à planta em manuscritos gregos do século IV AEC. Esta espécie desenvolveu relação com a expansão da civilização, sendo hoje encontrada apenas em regiões de cultivo humano, sem relato de espécimes crescendo em locais selvagens.3 A parte do vegetal com maior utilização é o rizoma (Figura 1b), que pode ser consumido fresco ou seco. Para fins de conservação, esse rizoma é desidratado e moído, gerando um pó de coloração dourada denominado turmérico (Figura 1c). A utilização do turmérico remete às primeiras descrições de C. longa, e historicamente tem aplicação na culinária, medicina e religião.
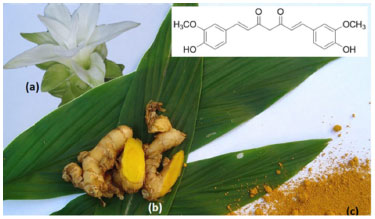 Figura 1. Espécime de Curcuma longa com inflorescência (a); Rizomas frescos (b); Turmérico: rizomas secos e moídos (c) (Imagens gentilmente cedidas por Neide Rigo; http://come-se.blogspot.com.br/)
A utilização de plantas medicinais como agentes terapêuticos remete à Antiguidade, e possui aplicação até os dias atuais. Apesar dessa extensa aplicação (primariamente baseadas em observações empíricas), a utilização desses princípios ativos como substâncias químicas isoladas, purificadas e caracterizadas só ocorreu a partir do século 19.4 Desde então, a participação de produtos naturais no escopo das substâncias bioativas que se tornam fármacos é marcante, a partir do isolamento direto da matriz natural, ou a partir da obtenção por síntese total ou semissíntese, ou ainda pela utilização dos padrões estruturais presentes nas substâncias de origem natural como inspiração para o planejamento de novos fármacos.5 Dessa forma, os produtos naturais apresentam-se como importante recurso na busca de novas substâncias com atividades biológicas relevantes. Diversos medicamentos utilizados atualmente derivam da medicina Ayurveda (sistema medicinal característico da Índia Antiga).6 Na prática ayurvédica, a curcumina é utilizada pelas suas ações digestivas, como carminativo, imunizante, antialérgico, antimicrobiano, estimulante, anti-inflamatório, cicatrizante, antioxidante, ou ainda pela sua atuação em doenças respiratórias (asmas, bronquites e alergias) e em outros transtornos, como anorexia, doenças hepáticas e sinusite.7 O turmérico, também conhecido na culinária como curry spice, é um dos temperos mais utilizados, especialmente na região continental da Índia. É consumido principalmente na forma de pó seco, utilizado para coloração alimentícia devido à sua forte coloração amarela, associada a efeitos terapêuticos e dietéticos.8 Há registros de atividades biológicas devidas ao consumo do turmérico, como anti-inflamatório, antimicrobiano, cicatrizante e digestivo. Além disso, o turmérico apresenta efeito potencial em diferentes enfermidades, como a doença de Alzheimer, doenças parasitárias e em alguns tipos de cânceres.9 A composição química do turmérico é bastante variada, tendo como principais classes de compostos os terpenos voláteis, presentes no óleo essencial de diferentes partes do vegetal (Tabela 1), além dos curcuminoides, componentes majoritários da fração não-volátil. Estes ocorrem em maior proporção nas rizomas da planta, com destaque para curcumina (CUR), desmetoxicurcumina (DMC) e bisdesmetoxicurcumina (BDMC), além de curcuminoides minoritários (1-7, Figura 2).
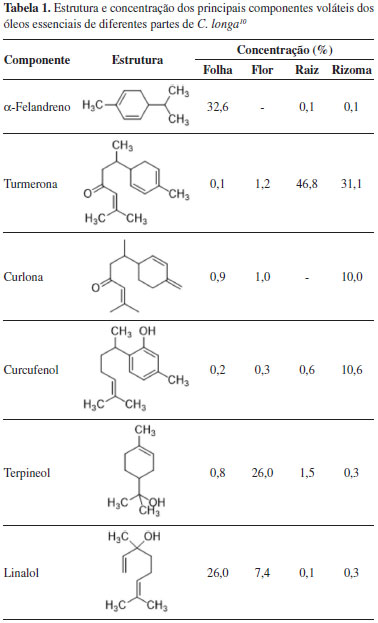
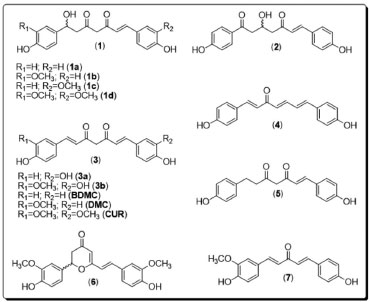 Figura 2. Estruturas de alguns curcuminoides, obtidos dos rizomas de C. longa11
A curcumina é o componente majoritário dos rizomas de C. longa, sendo responsável por cerca de 2% do peso seco dos rizomas. Atualmente a curcumina pode ser obtida comercialmente como uma mistura de três componentes: curcumina (CUR, ~77%); desmetoxicurcumina (DMC, ~17%); e bisdesmetoxicurcumina (BDMC, ~3%).2 Na Índia pode-se encontrar esta mistura de curcuminoides na forma de cápsulas, pomadas, unguentos, cremes e curativos para aplicação tópica, misturada ou não com outros componentes. Contudo, a principal utilização destas substâncias o redor do mundo é na culinária, como componentes do açafrão-da-índia. O tipo de efeito apresentado pela curcumina depende, em parte, da via de administração.7 Até o momento, nenhum estudo realizado em animais ou homens relatou toxicidade com relação ao uso da curcumina, mesmo quando ela é utilizada em doses até 12 g ao dia. Apesar disso, alguns efeitos adversos relatados em alguns estudos foram atribuídos à curcumina, como supressão da agregação plaquetária, surgimento de dermatites de contato e urticária.2 Biossíntese A estrutura da curcumina (CUR) e dos demais curcuminoides naturais sugerem que sua via biossintética esteja baseada na utilização de subunidades cinamoil (derivadas do ácido cinâmico, 9), como ocorre na biossíntese de alguns fenilpropenoides. Um primeiro trabalho, visando a elucidação da via metabólica responsável pela biossíntese da curcumina, foi desenvolvido por Roughley e colaboradores em 1973,12 no qual a administração de precursores, marcados com deutério e carbono-14 permitiu aos autores concluir que havia a união de dois fragmentos de ácido ferúlico (11) a um carbono central, originando o padrão estrutural denominado diferuloilmetano (curcumina, CUR). Este padrão era formado preferencialmente em detrimento dos outros curcuminoides devido à menor utilização de derivados do ácido caféico (10),12 que formariam outros curcuminoides, desmetoxicurcumina (DMC) e bisdesmetoxicurcumina (BDMC), respectivamente. Todavia, o trabalho de Kita e colaboradores13 utilizou diversos precursores metabólicos, marcados com carbono-13, e propôs que a via preferencial consiste na biossíntese do intermediário-chave dicinamoilmetano (12) e as substituições dos anéis aromáticos são realizadas a posteriori (Figura 3). Desta forma, pode-se inferir que os curcuminoides DMC e BDMC são, em verdade, intermediários biossintéticos da própria curcumina (CUR), e não produtos finais de uma via biossintética alternativa.
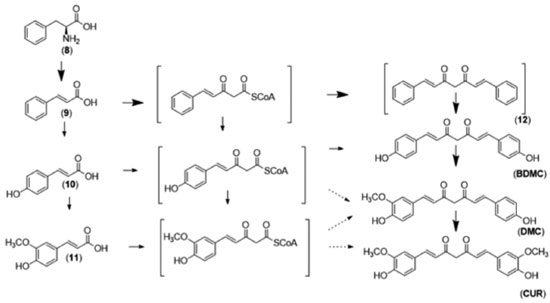 Figura 3. Via biossintética da curcumina13 (As reações que ocorrem em maior frequência são representadas por setas cheias, as que ocorrem em menor frequência são representadas por setas pontilhadas)
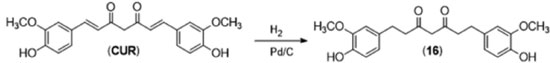
Metabolismo Um dos maiores problemas referentes à utilização clínica da curcumina é devido à sua baixa biodisponibilidade. Sua reduzida solubilidade em água faz com que ela seja pouco absorvida, e a presença de sítios lábeis ao metabolismo faz com que a mesma sofra metabolismo hepático de primeira passagem. A baixa eficácia da administração da curcumina in vivo é agravada pelo fato de seus metabólitos serem inativos, no que se refere à maioria das atividades biológicas associadas a seu uso.14 O tipo de metabolismo envolvido está diretamente ligado à via de administração da curcumina. Administração oral leva à formação direta de metabólitos de fase 2, como conjugação com ácido glicurônico (13) e com sulfato (14),15 ao passo que administrações intraperitoneais ou intravenosas geram preferencialmente metabólitos de redução, como tetraidrocurcumina (16) e hexaidrocurcuminol (18),16 conforme mostra a Figura 4.
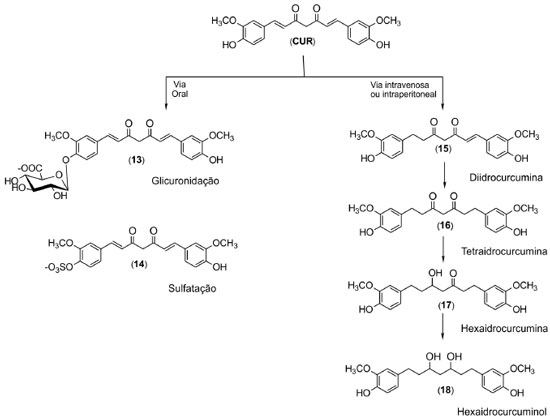 Figura 4. Representação dos principais metabólitos da curcumina formados nas diferentes vias de administração14
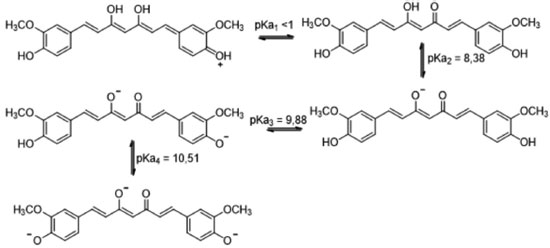
Propriedades físico-químicas O isolamento da curcumina foi realizado originalmente por Vogel em 1815,17 e sua estrutura foi definida por Milobedzka e Lampe em 1910.18 Desde então, a curcumina chamou a atenção de diversos grupos de pesquisa, com atuação em diferentes áreas, em razão de suas propriedades físico-químicas e biológicas particulares. A extensa conjugação eletrônica presente no esqueleto diarileptanoide da curcumina confere a mesma uma intensa absorção na região do visível, o que justifica a utilização desta como corante alimentício, classificado pela União Europeia como o primeiro corante (E100) da lista de aditivos alimentícios permitidos.19 Observações experimentais mostram que a curcumina sofre efeito solvatocrômico, já que ao modificar a polaridade do solvente existe uma alteração no comprimento de onda de máxima absorção (λmáx) da curcumina, sendo esta vermelha em metanol e amarela em diclorometano.20 Além da polaridade do solvente, o pH também interfere no λmáx da curcumina, já que em sua estrutura há três hidrogênios ácidos (Figura 5), sendo os hidrogênios adjacentes às duas carbonilas os mais ácidos deles (pKa = 8,38),21 que poderão ser abstraídos em função do pH do meio. Apesar da baixa solubilidade em água, a curcumina é solúvel em soluções aquosas básicas, e nestes casos a solução apresenta coloração avermelhada, devido ao efeito batrocrômico ocasionado pela retirada de um próton ácido, aumentando assim a densidade de elétrons na curcumina. A base conjugada da curcumina deve então funcionar como antioxidante doador de elétrons, haja visto que o enolato formado após a retirada do primeiro próton da curcumina gera uma espécie carregada negativamente. Entretanto, nesta faixa de pH a curcumina é facilmente degradada,22 sugerindo que a expressiva capacidade antioxidante da curcumina esteja relacionada a outro tipo de mecanismo.
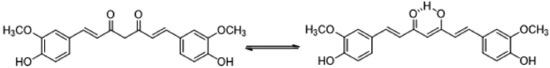
Em faixas de pH entre 3 e 7 existe um equilíbrio ceto-enólico da curcumina (Figura 6), deslocado preferencialmente para o sentido do enol, em razão da presença de uma ligação de hidrogênio intramolecular e de uma maior planaridade da molécula, o que favorece a conjugação na cadeia carbônica. Entretanto, a curcumina na forma 1,3-dicetônica (mesmo em baixa concentração quando comparada ao enol) possui um metileno bastante deficiente de elétrons em função da vizinhança eletrofílica, o que a torna um ótimo doador de hidrogênio. Essa hipótese foi confirmada por Jovanovic e colaboradores23 em um elegante estudo envolvendo experimentos de flash-fotólise e radiólise de pulso, que indicaram a transferência de um átomo de hidrogênio, proveniente do metileno alfa, como o mecanismo mais provável para as propriedades antioxidantes da curcumina, em detrimento dos elétrons provenientes do enolato, uma hipótese mais coerente com as condições fisiológicas onde essa atividade da curcumina foi verificada.23
O equilíbrio tautomérico da curcumina é sabidamente deslocado para a formação do enol na maioria dos casos. Todavia, a presença da subunidade 1,3-dicetona é de fundamental importância para grande parte das suas propriedades. A forma enólica é mais estável, devido não apenas à presença de uma ligação de hidrogênio intramolecular, como também devido à planaridade, que permite uma melhor sobreposição dos orbitais π e, consequentemente, uma melhor conjugação eletrônica. A forma 1,3-dicetônica apresenta como confôrmero mais estável aquele com as carbonilas orientadas em direções opostas (confôrmero C, Figura 7). Esse confôrmero é cerca de 30 kJ mol-1 mais estável do que o confôrmero A, devido ao maior distanciamento entre os orbitais não-ligantes dos átomos de oxigênio.24
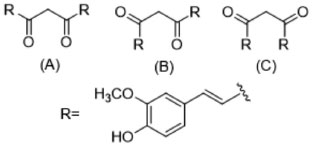 Figura 7. Confôrmeros possíveis para a forma 1,3-dicetônica da curcumina21
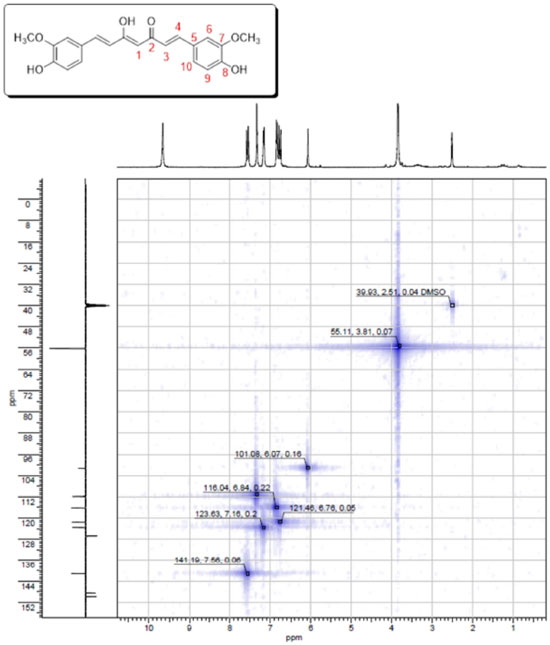
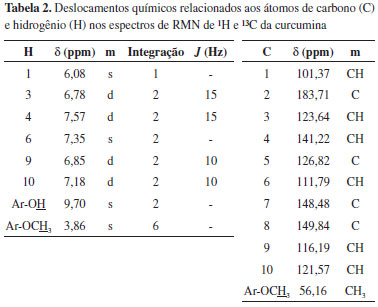
Casos onde a forma 1,3-dicetônica são termodinamicamente favoráveis são mais raros. Dutta e colaboradores verificaram estabilização desse tautômero na presença de surfactantes iônicos pré-micelares25 e Yanagisawa e colaboradores sugerem que a forma bioativa da curcumina sobre placa β-amiloides é a não-enolizada. Dessa forma, a inserção de substituintes alquil na posição quatro da cadeia espaçadora da curcumina (carbono alfa) desfavorece a enolização e, por consequência, aumenta a atividade de análogos da curcumina neste modelo.26 Arrieta e colaboradores observaram que em solventes orgânicos como dimetilsulfóxido (DMSO) a forma 1,3-dicetônica não é detectada, haja visto que nos espectros de RMN de 13C não é observado nenhum sinal referente ao metileno α às carbonilas, e sim um metino com deslocamento químico em δ 101,08 ppm.27 No espectro de RMN de ¹H aparece um simpleto com integração para um hidrogênio em δ 6,07 ppm e o espectro de HSQC mostra o acoplamento entre esses dois sinais (Figura 4). Entretanto, mesmo com a presença do enol comprometendo a simetria da curcumina (eixo C2), todos os outros sinais se mantém inalterados. O espectro de HSQC também permite elucidar inequivocamente a geometria das ligações duplas, devido à constante de acoplamento dos hidrogênios olefínicos (J 15 Hz, ligação dupla de geometria E). A ressonância presente no sistema também gera uma diferença significativa nos deslocamentos químicos dos hidrogênios olefínicos (H3 e H4). Como visto no espectro de HSQC, H4 encontra-se mais desblindado (δ 7,57 ppm) se comparado ao H3 α à carbonila (δ 6,78 ppm) (Figura 8). Isso pode ser explicado em função das estruturas de ressonância da carbonila α,β-insaturada, que torna a posição 4 mais eletrofílica (um aceptor de Michael).
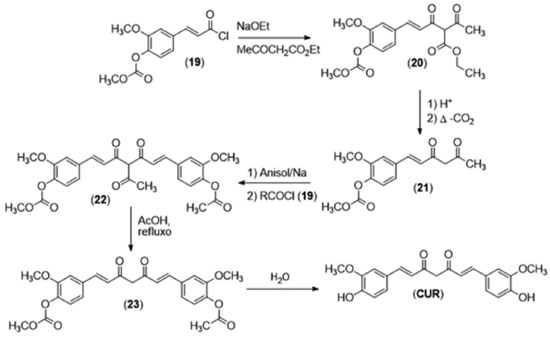
Metodologia sintética A primeira metodologia utilizada para a síntese da curcumina (Figura 9) foi publicada por Lampe e colaboradores em 1913,18 utilizando como material de partida o cloreto de carbometoxiferuloila (19). Neste trabalho, o cloreto de ácido (19) reagiu com acetoacetato de etila para formar o derivado (20), que foi descarboxilado para gerar o a dicetona (21). Essa dicetona foi novamente acilada pelo cloreto de ácido inicial (19) para formar o diarileptanoide (22). Em seguida, uma segunda descarboxilação fornece o derivado protegido (23) e a remoção dos grupos protetores geraram a curcumina e permitiram que sua estrutura fosse elucidada.
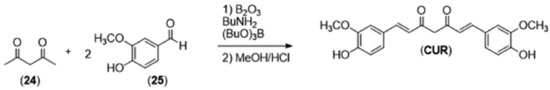
Esta metodologia, embora importante para a elucidação estrutural da curcumina, não possui aplicabilidade prática, devido ao número de etapas e baixo rendimento global. Em 1937, Pavolini e colaboradores28 descreveram então um método em uma etapa para a síntese da curcumina, utilizando como reagentes a vanilina, acetilacetona e anidrido bórico com aquecimento sobre chama. A despeito da facilidade operacional, quando comparado à metodologia de Lampe, a reação de Pavolini apresentou um baixo rendimento devido ao produto monossubstituído aparecer como principal subproduto da reação. Posteriormente, em 1964, Pabon e colaboradores desenvolveram uma metodologia que até hoje é a mais utilizada na síntese de diarileptanoides.29 Em seu trabalho, Pabon preparou a curcumina em duas etapas, iniciando o processo com a geração de um enolato de boro com o composto β-dicarbonílico (24), sobre o qual são adicionados a vanilina (25), n-butilamina e tributilborato. Em um segundo momento, o enolato de boro é desfeito através de hidrólise ácida, por adição de solução aquosa de HCl (Figura 10).
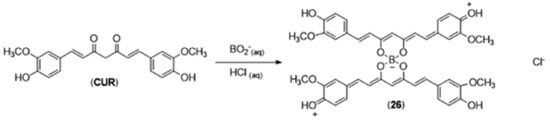
O método de Pabon tem como justificativa para a primeira etapa a formação do enolato de boro, que impede a condensação de Knoevenagel no carbono 3 da acetilacetona (24), já que o enolato de boro torna esse hidrogênio menos ácido que as metilas terminais. Essa característica da acetilacetona de complexação com ácidos de Lewis se estende à maioria dos compostos 1,3-dicarbonílicos, incluindo a curcumina. A pesquisa qualitativa de íons borato em Química Analítica, por exemplo, é realizada pelo método da curcumina,30 que consiste na utilização de solução alcoólica de curcumina (alaranjada) sobre o analito acidificado com ácido clorídrico. O aparecimento de colocação vermelha intensa indica a formação de rosocianina (26),31 que é definida como um complexo entre o boro e dois equivalentes de curcumina,32 como mostrado na Figura 11.
A conjugação das cargas formadas torna a molécula da rosocianina extremamente cromofórica, o que faz com que este seja um método colorimétrico bastante sensível para a detecção de boratos em solução. A presença dos átomos de oxigênio em distância adequada a configura como um potencial ligante bidentado para metais. Essa propriedade complexante da curcumina deu origem a diversos trabalhos envolvendo tanto a síntese de compostos de coordenação com metais a fim de incrementar as atividades biológicas associadas ao uso da curcumina quanto a utilização da mesma como agente quelante de metais relevantes em processos patológicos. Por exemplo, a presença de íons Cu2+ sabidamente acelera a formação das placas β-amiloides, que fazem parte do processo neurodegenerativo da doença de Alzheimer por meio do bloqueio das sinapses. Picciano e colaboradores33 verificaram que a curcumina pode funcionar como um quelante competitivo de íons cobre II na presença de fragmentos peptídicos formadores das placas β-amiloides, o que minimiza sua formação, já que os as constantes de formação dos complexos peptídeo:Cu2+ possuem constante de afinidade menor do que aquela encontrada no complexo CUR:Cu2+. A capacidade quelante de metais, associada às atividades antioxidante e antiinflamatória da curcumina, fazem da mesma uma alternativa interessante para o desenvolvimento de novas abordagens terapêuticas no tratamento da doença de Alzheimer.34 Ainda explorando suas propriedades como quelante, Mawani e Orvig35 sintetizaram uma série de complexos da curcumina com gálio e três lantanídeos (lutécio, európio e gadolínio), como potenciais substâncias úteis no tratamento da osteoporose, realizando ensaios de toxicidade frente a linhagens de osteoblastos MG-63. Os resultados mostraram que os complexos com a curcumina apresentam menor toxicidade quando comparados à cisplatina, que foi utilizada como padrão positivo neste estudo. Derivados, análogos e atividades relacionadas A estrutura da curcumina pode ser subdividida em 3 subunidades (Figura 12), passíveis de modificações estruturais, que viabilizam o acesso a diferentes derivados estruturalmente relacionados à curcumina. Estas transformações possibilitam a realização de estudos de REA (Relação Estrutura-Atividade) que fornecem informações sobre os requisitos estruturais relevantes para as diferentes atividades biológicas associadas a essa classe de substâncias.
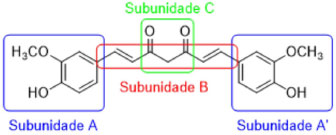 Figura 12. Subunidades passíveis de modificações estruturais na curcumina
Khan e colaboradores36 prepararam uma coleção de curcuminoides modificados nas subunidades A/A' com potencial atividade anti-inflamatória a partir da reação de Pabon com diferentes aldeídos aromáticos funcionalizados (Figura 13). Os derivados sintetizados foram ensaiados em modelos de inflamação in vitro e in vivo, sendo que alguns derivados apresentaram atividade superior à do produto natural.
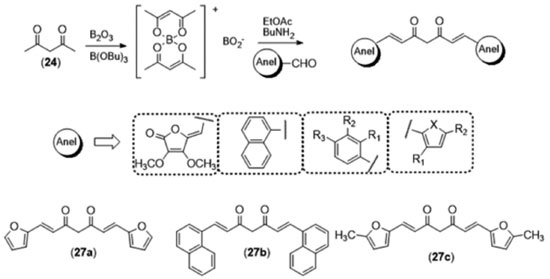 Figura 13. Síntese de curcuminoides apresentando diferentes núcleos aromáticos e estrutura dos derivados mais ativos36
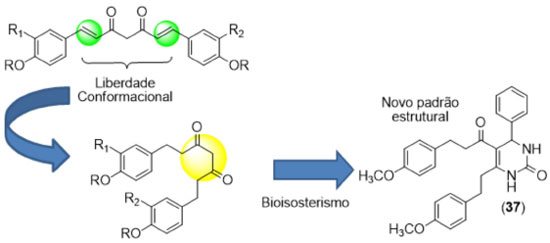
Os diferentes derivados sintetizados (Figura 13) foram utilizados em ensaios de atividade anti-edematogênica in vivo em ratas Wistar com edema de pata induzido por carragenina (modelo de inflamação aguda), atividade antiartrítica em ratas Wistar com poliartrite induzida (modelo de inflamação crônica) e anti-TNFα in vitro, em monócitos THP-1 tratados com LPS. Nos ensaios realizados pelo grupo, a curcumina apresentou baixa atividade antiedematogênica in vivo, provavelmente decorrente de aspectos cinéticos do modelo de inflamação aguda (baixa biodisponibilidade). Nos ensaios da carragenina, o derivado furânico (27a) apresentou expressiva atividade antiedematogênica, superior à fenilbutazona e ao ácido acetilsalicílico na primeira hora do experimento. O modelo de inflamação crônica (artrite) mostrou uma expressiva atividade anti-inflamatória da curcumina, embora o derivado mais ativo tenha sido o (27b). No ensaio in vivo, o derivado metil-furano (27c) foi o único que apresentou inibição da produção de TNFα nos monócitos estimulados por LPS, mostrando que mudanças sutis (como a inserção de duas metilas na subunidade A dos diarileptanoides) podem gerar derivados com perfis diferenciados de atividade biológica. A subunidade B, que corresponde à cadeia espaçadora de 7 carbonos entre os grupamentos aril da curcumina (Figura 12), pode ser modificada utilizando-se das estratégias de funcionalização, homologação e liberdade conformacional. A tetraidrocurcumina (16), por exemplo, é um metabólito da curcumina (Figura 4) que pode ser obtido em laboratório por hidrogenação catalítica das ligações duplas da subunidade B (Figura 14).
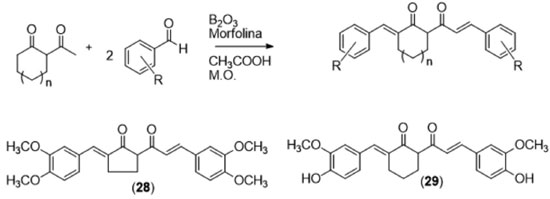
Após hidrogenação, a subunidade B da curcumina passa a ter um número maior de ligações passíveis de rotação, o que permite que ela assuma um maior número possível de conformações ao se ancorar no sítio receptor, o que ocorre com menos extensão no sistema conjugado rígido da curcumina. Outra vantagem da tetraidrocurcumina (16) sobre a curcumina é sua maior capacidade antioxidante.37 A hidrogenação das ligações duplas retira a planaridade da molécula da curcumina, o que impede que haja conjugação dos elétrons dos aneis aromáticos com a subunidade 1,3-dicetônica, o que favorece a formação e estabilização por ressonância de radicais formados pela remoção de um hidrogênio-radical do metileno entre as duas carbonilas.23 Além do aumento da liberdade conformacional, outra estratégia utilizada na otimização da atividade biológica de determinada classe de substâncias é a restrição conformacional, que consiste no aumento da rigidez de um sistema para aumentar a probabilidade de ancoramento no receptor da substância em sua suposta conformação bioativa. Uma forma de se aumentar a rigidez conformacional de diarileptanoides é a utilização de análogos carbocíclicos, a utilizando a reação de Pabon partindo da cetona correspondente (Figura 15). O trabalho de Youssef e colaboradores (Figura 15)38 consistiu na síntese de diversos análogos carbocíclicos da curcumina, contendo na subunidade B (Figura 12) um anel de 5 ou 6 átomos de carbono.
Os derivados sintetizados, conforme mostrado na Figura 15, foram avaliados em modelos in vitro contra células tumorais leucêmicas murinas (linhagem L1210) e células humanas (linfoblastos tumorais Molt 4C/8 e CEM). Os mais ativos nessas linhagens (derivados 28 e 29) foram ensaiados contra 57 linhagens tumorais humanas, representando nove diferentes condições neoplásicas (e.g. melanoma, leucemia, próstata, mama). O controle positivo utilizado foi o melphalan, fármaco antitumoral da classe dos agentes alquilantes. Os dois derivados previamente apresentados (28 e 29) apresentaram valores de CI50 inferiores à do controle positivo em todos os casos, com destaque para o derivado (29), que apresentou toxicidade seletiva para as células tumorais da ordem de 1500 vezes. É importante ressaltar que os derivados mais ativos foram aqueles que mantiveram o padrão de substituição no anel aromático de 3,4-bis-oxigenado, similar ao padrão presente no produto natural, e que a expressiva atividade foi atribuída à restrição conformacional decorrente da presença do sistema carbocíclico. A homologação inferior da subunidade B (Figura 12), gerando derivados contendo uma carbonila (diarilpentanoides e chalconas), é a estratégia mais utilizada na síntese de derivados curcuminoides. A síntese desses derivados é mais acessível, devido ao fato de não haver necessidade da formação do complexo de boro, o que normalmente permite sua síntese a partir de uma única etapa de condensação entre um aldeído e uma cetona. Dessa forma, Yamakoshi e colaboradores39 sintetizaram uma série de análogos estruturais da curcumina, contendo 5 átomos de carbono na subunidade B, denominados diarilpentanoides. Esses análogos foram preparados por meio da reação de condensação entre aldeídos aromáticos com diversos padrões de substituição e acetona, em etanol e meio básico. (Figura 16)
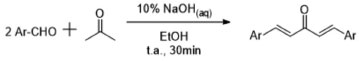 Figura 16. Metodologia sintética para a preparação de diarilpentanoides realizada por Yamakoshi e colaboradores39
O análogo direto da curcumina, denominado C5-curcumina, é um produto natural isolado dos rizomas de C. longa em uma concentração muito mais baixa do que a curcumina.40 Esse produto natural serviu como protótipo para a síntese dos outros diarilpentanoides, que foram testados por Yamakoshi39 em modelos de células tumorais com o intuito de funcionar tanto como um inibidor de crescimento celular quanto como um padrão estrutural passível de hibridação com sondas fluorescentes para detecção de tumores in vivo (e.g. 30). Os ensaios foram realizados em células tumorais humanas de câncer de cólon, linhagem HCT-116, e os resultados permitiram a construção de um modelo de REA. O estudo realizado pelo grupo sobre esse padrão estrutural mostrou que anéis aromáticos simétricos tetrassubstituídos ou anéis hexassubstituidos são aqueles que apresentam a maior atividade citotóxica. A hidroxila em para encontra-se em uma região pouco sensível a efeitos estéricos, o que permite a inserção de grupos que possam atuar como sondas. Sendo assim, o derivado (30) apresenta atividade dual, funcionando tanto como um composto citotóxico per si quanto um marcador de tumores, em decorrência da presença da sonda fluorescente destacada na estrutura (Figura 17).
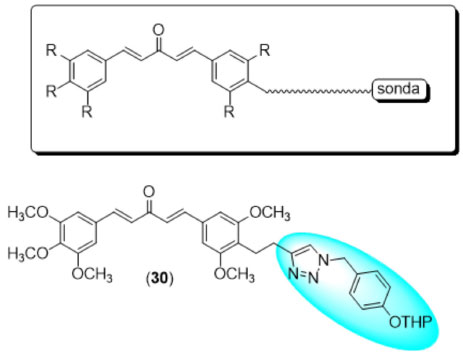 Figura 17. Padrão estrutural otimizado e derivado mais ativo na inibição do crescimento de células HCT-11639
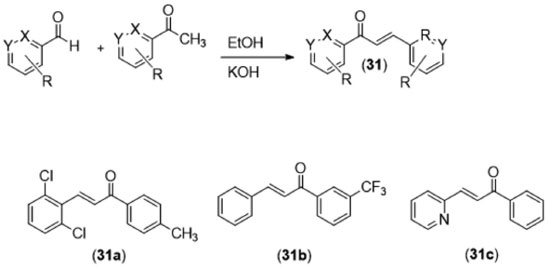
Ainda no que diz respeito à construção de análogos da curcumina, obtidos por homologação inferior, destaca-se a classe das chalconas, que possuem dois grupamentos aril, separados por três átomos de carbono (31). Robinson e colaboradores41 sintetizaram diversas chalconas por meio de um procedimento simples de condensação aldólica entre diversos aldeídos e acetofenonas (Figura 18), formando uma coleção de mais de 60 derivados.
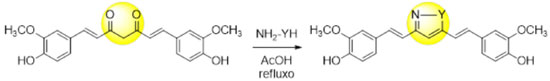
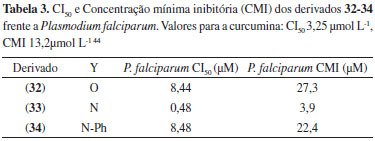
As chalconas obtidas foram avaliadas quanto à capacidade de inibição do crescimento de células tumorais nas concentrações de 1, 3 e 6 µg mL-1, e as maiores inibições foram registradas para os derivados (31a), (31b) e (31c), com percentuais de inibição de 98,1%, 96,9% e 96,9%, respectivamente. Esses derivados devem também possuir como vantagem, com relação à curcumina, uma maior estabilidade metabólica, haja visto que a aplicação da estratégia de simplificação molecular na estrutura do protótipo suprimiu dois sítios lábeis ao metabolismo microssomal: a hidroxila fenólica da subunidade A e o metileno da subunidade C (Figura 12). A síntese de derivados da curcumina com modificações estruturais na subunidade C normalmente é baseada nas relações isostéricas entre a 1,3-dicetona e heterociclos. O primeiro derivado da curcumina registrado é o isoxazol (32), que foi utilizado por Lampe para auxiliar na elucidação estrutural de seu produto de síntese, a própria curcumina, por derivatização.18 A facilidade de preparação desses derivados heterocíclicos, a partir da reação da curcumina com hidrazinas funcionalizadas ou com a hidroxilamina, gerou uma série de trabalhos publicados com essas moléculas. Essa relação bioisostérica foi observada primeiramente por Shim e colaboradores em 2002,42 que descreveu a preparação de pirazóis a partir de curcuminoides naturais, por meio da clássica reação de Knorr entre compostos 1,3-dicarbonílicos e hidrazinas.43 No escopo da quimioterapia de doenças negligenciadas, Mishra e colaboradores44 publicaram um estudo envolvendo a avaliação de derivados heterocíclicos da curcumina, como isoxazol e pirazóis funcionalizados (32-34, Figura 19) contra Plasmodium falciparum (Tabela 3). No modelo utilizado pelo grupo, a substituição da subunidade 1,3-dicetônica por um pirazol (33) aumentou a potência da substância, evidenciando a possibilidade de se otimizar as propriedades biológicas da curcumina por meio da utilização de ferramentas da Química Medicinal como, por exemplo, o bioisosterismo.45
A reação de Biginelli destaca-se como ferramenta de modificação estrutural da curcumina, devido principalmente ao seu potencial na geração de séries de derivados com grande diversidade estrutural. Trata-se de uma reação multicomponente, na qual um dos reagentes é um composto beta-dicarbonílico, utilizado na síntese de pirimidinonas substituídas.46 A curcumina foi utilizada como substrato para a reação de Biginelli na síntese de moléculas com atividade anti-colinesterásica, gerando produtos com potencial relevância no tratamento da doença de Alzheimer.47 Inicialmente a curcumina foi submetida à uma hidrogenação catalítica, gerando o seu derivado hidrogenado (16) no qual há maior liberdade conformacional após a saturação das ligações duplas na cadeia carbônica. O aumento da atividade (Tabela 4) mostra que nesse modelo o confôrmero bioativo encontra-se em um arranjo espacial prejudicado pela presença das insaturações, o que justifica o aumento da atividade da tetraidrocurcumina (16), quando comparada à curcumina.
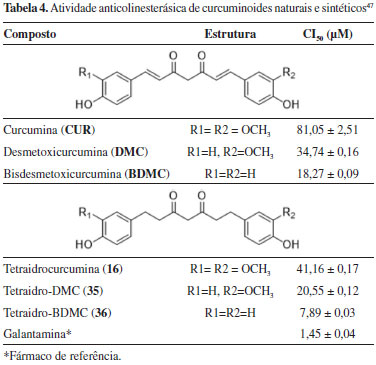
Desta forma, utilizando tetraidrocurcuminoides (16, 35-36) como compostos beta-carbonílicos, foi realizada uma série de reações de Biginelli com ureia e diversos benzaldeídos funcionalizados, gerando uma coleção de compostos que foram testados quando à sua capacidade de inibição da acetilcolinesterase (Figura 20), sendo um deles (37) mais potente do que o fármaco de referência, a galantamina.
Atividades biológicas A utilização dos rizomas de C. longa remetem à Antiguidade, e muitos dos seus usos tradicionais são atualmente corroborados pela ciência. Na quase totalidade dos casos, as atividades relacionadas ao consumo dos rizomas são decorrentes da curcumina, que é o componente com maior número de estudos farmacológicos realizados, dentre os metabólitos especiais do vegetal. Devido ao perfil estrutural da curcumina, relacionado à sua natureza fenólica e à extensão de conjugação existente, vários trabalhos têm explorado a sua ação como agente antioxidante em diferentes modelos. Esta atividade pode ser atribuída a duas subunidades estruturais: o metileno α às carbonilas23 e as hidroxilas fenólicas (Figura 21).48 Em ambos os casos, a atividade antioxidante está relacionada à doação de hidrogênio radicalar, que reage com espécies reativas de oxigênio (EROs) e neutraliza possíveis danos celulares, decorrentes da presença desses intermediários.
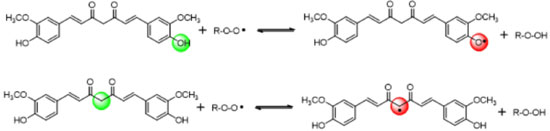 Figura 21. Principais propostas para o mecanismo antioxidante da curcumina, envolvendo a doação de hidrogênio radicalar
As duas propostas mostradas na Figura 21 são razoáveis, devido ao fato de em ambos os casos existir a estabilização do radical formado por ressonância, o que justifica a capacidade antioxidante da curcumina (Figura 22).
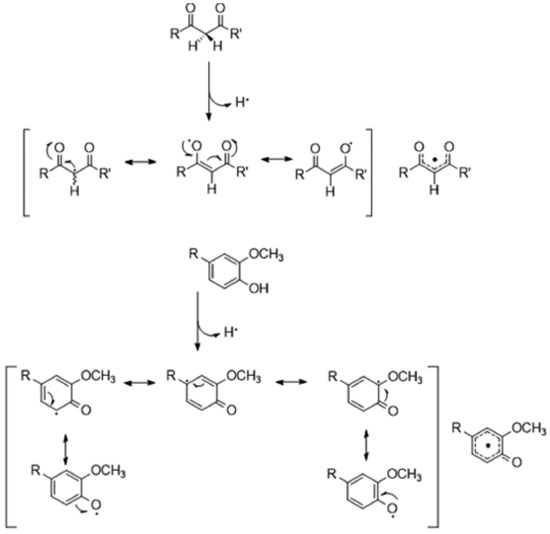 Figura 22. Estabilização do radical formado no metileno e no anel aromático, após doação de hidrogênio
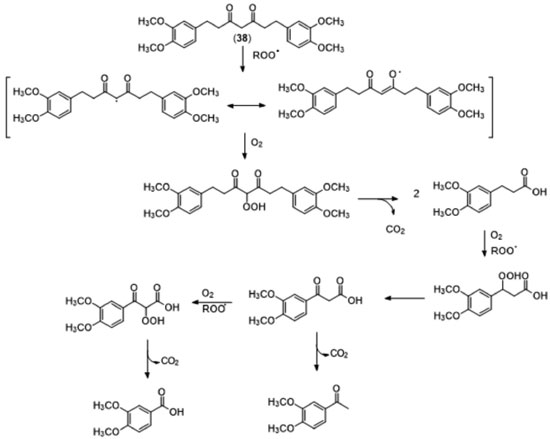
O trabalho de Jovanovic23 hierarquiza as propostas, colocando a subunidade metileno como sendo parte do mecanismo preferencial para a doação de hidrogênio. O ambiente químico desta subunidade faz com que a ligação C-H seja bastante enfraquecida, devido à presença de duas carbonilas vizinhas. Apesar do equilíbrio ceto-enólico da curcumina estar normalmente deslocado para a forma enólica, a forma dicetônica pode estar presente em quantidade relevante em locais com pH ácido, como é o caso de tecidos com processos inflamatórios ou de algumas organelas celulares. Desta forma, há uma maior população de moléculas na forma dicetônica, o que pode justificar o mecanismo proposto para a atividade antioxidante da curcumina. Esse estudo ajudou a confirmar a hipótese de Sugiyama e colaboradores,37 que sugeriu a participação da subunidade 1,3-dicetona no processo antioxidante, além da previsível atividade relacionada às hidroxilas fenólicas (Figura 23) Nesse trabalho, o autor sintetizou um derivado reduzido e metilado (dimetiltetraidrocurcumina, 38) no qual tanto a conjugação quanto as hidroxilas fenólicas foram suprimidas. Este derivado apresentou atividade antioxidante comparável à exibida pela curcumina.
Subsequentemente, em estudos teóricos realizados sobre as diferentes propostas mecanísticas para a atividade antioxidante da curcumina, os grupos de Ross48 e Sun49 mostraram que a energia associada à abstração do hidrogênio do metileno é bem mais alta do que aquela referente ao grupamento Ar-OH. Os autores realizaram a síntese de derivados onde houve a supressão do metileno alfa e redução das insaturações, e em ambos os casos houve manutenção da atividade antioxidante. A análise conjunta destes trabalhos permite inferir que a atividade antioxidante da curcumina decorre, provavelmente, do efeito conjunto dos grupos que compõem a sua estrutura. A curcumina foi utilizada em incontáveis modelos farmacológicos, in vitro e in vivo, sendo impraticável listar todas as propriedades biológicas atribuídas a esta substância. A Tabela 5 sumariza apenas as propriedades mais relevantes atribuídas à curcumina.
Alvos moleculares A análise da Tabela 3, na qual se encontram sumarizadas algumas das propriedades biológicas mais relevantes para a curcumina, permite concluir que o diarileptanoide natural age sobre diferentes alvos moleculares, possuindo assim uma variada gama de mecanismos de ação. Um importante alvo bioquímico da curcumina é o Fator Nuclear Kappa B (NF-κB),68 proteína envolvida no controle da transcrição do DNA, sendo encontrada em todas as células. A NF-κB tem participação em respostas inflamatórias,69 processos tumorais, além de algumas infecções parasitárias.70 A curcumina é sabidamente um inibidor da via do NF-κB, e essa inibição acontece simultaneamente em diversos pontos da via de ativação. Inicialmente, os estímulos extracelulares que ativam a cascata de formação do NF-κB dependem da presença de espécies reativas de oxigênio, que são decorrentes de lesões, processos inflamatórios e estresse oxidativo. A presença das hidroxilas fenólicas e da subunidade 1,3-dicetênica da curcumina conseguem capturar os radicais dessas espécies reativas, minimizando a ativação da via. Também é sabido que uma das proteínas quinases71 responsáveis pela fosforilação do complexo proteico que virá a se tornar o NF-κB é inibida pela ação da curcumina, mesmo após iniciação da sinalização celular em função das espécies reativas de oxigênio. A curcumina também inibe a óxido nítrico sintase72 e a ligação no DNA do fator de transcrição de c-jun/AP-1,73 que são pontos posteriores da via do NF-κB. A ativação de moléculas que culmina com a translocação do NF-κB para o núcleo das células representa uma etapa indispensável para a ativação, secreção de mediadores solúveis e ação efetora de uma grande variedade de células. Além de células da imunidade inata, a ativação do NF-κB também é de fundamental importância na ativação de linfócitos B, visto que já foi demonstrado que a curcumina atua inibindo a fosforilação de diferentes alvos moleculares como ERK, p38 e IκB, que resulta na diminuição da produção de anticorpos por essas células.67 Além do NF-κB, outro fator nuclear importante para a ativação celular, conhecido com AP-1, pode ser inibido pela curcumina de forma simultânea.74 A ação inibidora da curcumina sobre fatores de transcrição resulta na diminuição de uma grande variedade de citocinas e quimiocinas envolvidas na resposta inflamatória. Desse modo, já foi demonstrada a redução da produção de fator de necrose tumoral alfa (TNF-α), interleucina-6 (IL-6) e interferon gama (INF-γ) em monócitos e macrófagos alveolares estimulados com lipopolissacarídeo (LPS) e pelo éster de forbol PMA.75 Outros estudos mostraram também que a curcumina é capaz de induzir a diminuição da expressão de IL-5,76 IL-8,77 IL-1878 e IL-12.79 Em adição, a curcumina demonstrou ainda um efeito inibidor da fosforilação do Transdutor de Sinal e Ativador de Transcrição 4 (STAT4) induzida com IL-12 em linfócitos T humanos.79 Além de citocinas, as quimiocinas CXCL1, CXCL2 e MCP-1 são inibidas pela curcumina comprometendo a migração de monócitos.80 Vias importantes de sobrevivência também podem ser moduladas pela curcumina. A apoptose, mecanismo de morte programada pelas células, tem como finalidade o desenvolvimento e manutenção da homeostasia. Alterações nestes mecanismos podem levar ao surgimento de câncer, doenças auto-imunes e degenerativas. Por esse motivo vários estudos vêm sendo realizados com o intuito de caracterizar mecanismos indutores de apoptose. Um estudo utilizando microarray caracterizou genes apoptóticos regulados pela curcumina em células tumorais. Os resultados mostraram que a expressão de 104, entre os 214 genes associados a apoptose, foi alterada pelo tratamento com curcumina.80 Recentemente, foi demonstrado que várias moléculas envolvidas na sinalização intracelular da apoptose podem ser moduladas pela curcumina. Em células de câncer de próstata PC-3 e LNCaP, a curcumina leva ao aumento a expressão de proteínas pró-apoptóticas, como Bax, Bim, Bak, Puma, Noxa e receptores de morte (TRAIL-R/DR4 e TRAIL-R2/DR5).81 Outras moléculas que se mostraram passíveis de modulação pela curcumina foram da proteína de membrana Fas e seu ligante FasL. Estudos realizados em células de melanoma revelou que a curcumina levou a ativação do domínio de morte FADD, associado a caspase 8, após a interação Fas/FasL.82 Resultados descritos por Chakraborti e colaboradores,83 utilizando síntese de derivados e tendo como ferramenta a espectroscopia de fluorescência, evidenciaram que a curcumina e derivados reconhecem um sítio específico na molécula de tubulina, o qual, segundo estudos de ancoramento molecular, dista cerca de 32 Å do sítio de ligação da colchicina. Os resultados obtidos demonstraram que a curcumina e seu derivado benzilidênico (40) mais ativo (Figura 24) agem inibindo a organização estrutural da tubulina e, consequentemente, a formação dos microtúbulos, culminando na morte celular por apoptose. A curcumina gerou 16% de indução de apoptose em células de câncer epitelial pulmonar (A549), na concentração de 5 µmol L-1 e 48 h de tratamento, enquanto seu derivado benzilidênico (40), mais ativo, induziu 45% de apoptose no mesmo modelo.
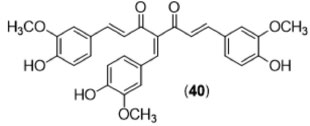 Figura 24. Estrutura do ligante de tubulina (40) sintetizado por Chakraborti e colaboradores83
A curcumina também tem mostrado resultados promissores como antiparasitário. Estudos realizados com o objetivo de avaliar a atividade antimalária do diarileptanoide natural demonstraram que os extratos aquosos de C. xantohorrhiza e C. aeruginosa Roxb. foram capazes de inibir em 40 e 90%, respectivamente, o crescimento de Plasmodium falciparum in vitro,84 entretanto, em uma dose relativamente alta, de 1 mg mL-1. CUR, DMC e BDMC, isoladas do rizoma de C. longa levaram a uma inibição de 50% do crescimento de Plasmodium falciparum in vitro, quando avaliadas em concentrações bem mais baixas (de 3 a 4.2 µg mL-1).53 O mecanismo de ação proposto envolveu a promoção da morte de eritrócitos pelo aumento de Ca2+ citoplasmático e formação de ceramidas, levando a alterações estruturais de membrana, que tornariam os eritrócitos alvos de fagocitose por macrófagos.85 A avaliação da atividade antiparasitária da curcumina contra agentes causadores de leishmaniose tem mostrado que diferentes espécies desse parasito apresentam inibição do crescimento. A Leishmania major quando tratada com curcumina (37,6 µmol L-1) foi inibida em 50% e resultados similares foram obtidos com promastigotas de L. amazonensis e que a dimetoxicurcumina (41, Figura 25) foi mais efetiva em concentrações menores (<5 µg mL-1). A administração de (41) em camundongos Balb/c (20 mg kg-1) infectados revelou uma redução de 65% do tamanho das lesões medidas 75 dias após a infecção. Adicionalmente, observou-se ausência de resposta inflamatória, provavelmente devido às propriedades anti-inflamatórias característica de estruturas análogas à curcumina.86 Outro tripanosomatídeo que apresentou inibição do crescimento quando tratado com a curcumina foi o Trypanosoma brucei. A curcumina, na concentração de 5 mg mL-1 foi capaz de inibir o crescimento de formas sanguíneas com maior eficiência do que as formas procíclicas de T. brucei.63 Mais recentemente, Changtam e colaboradores87 realizaram um estudo com 46 análogos curcuminoides, avaliados contra T. brucei e diferentes espécies de Leishmania, evidenciando o derivado monocarbonílico α,β-insaturado, 1,7-bis(4-hidroxi-3-methoxifenil)hept-4-en-3-ona (42), como o mais eficaz. Os dados de REA, obtidos neste estudo, permitiram aos autores atribuírem a maior atividade deste derivado (CI50 de 7 nmol L-1, frente a cepa de T. brucei) à enona presente em sua estrutura.87
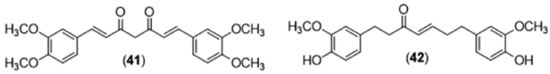 Figura 25. Estruturas dos análogos da curcumina com expressiva atividade antiparasitária frente a Leishmania amazonensis (41)86 e Trypanosoma brucei (42)87
Dessa forma, a curcumina, derivados e análogos participam da modulação de diferentes fenômenos biológicos, que vão da interferência na ativação de células do sistema imunitário, passando pela inibição de sinalizadores moleculares da resposta inflamatória, atividade antiparasitária, além da sua reconhecida ação antitumoral. Este conjunto de resultados elevam a curcumina ao status de uma molécula que pode servir de protótipo ao desenvolvimento de fármacos multialvo, podendo ser úteis tanto na prevenção quanto no tratamento de diferentes enfermidades, e mesmo de enfermidades complexas, que possuem causas multifatoriais como o câncer.88
CONCLUSÕES A curcumina é uma molécula de fácil acesso, tanto pelo isolamento da matriz natural quanto pela síntese total. Possui expressiva atividade em uma série de modelos biológicos in vitro, com as mais variadas aplicações. Entretanto, sua baixa biodisponibilidade por via oral e sua baixa solubilidade em água inviabilizam a administração intravenosa. Além disso, sua elevada afinidade pelas proteínas plasmáticas faz com que a curcumina ainda precise ultrapassar uma série de barreiras farmacocinéticas para a mesma se torne efetivamente uma molécula com relevância clínica sobre uma série de doenças que carecem de tratamento farmacológico adequado, como leishmaniose e doença de Alzheimer. Uma forma de tornar real esse cenário é através de modificações em sua estrutura, de modo que sejam implementadas melhorias nas propriedades farmacocinéticas, sem que sejam comprometidas as propriedades farmacodinâmicas deste produto natural que é utilizado desde a Antiguidade.
AGRADECIMENTOS Os autores agradecem à CAPES-PROCAD, ao CNPq e à FAPERJ pelos auxílios financeiros concedidos e à CAPES pela bolsa de doutorado de V. Sueth-Santiago.
REFERÊNCIAS 1. Lameira, O. A.; Pinto, J. E. B. P. Em Plantas Medicinais: do cultivo, manipulaçao e uso à recomendaçao popular. Editora EMBRAPA: Belém, 2008. p. 19-26. 2. Goel, A.; Kunnumakkara, A. B.; Aggarwal, B. B.; Biochem. Pharm. 2008, 75, 787. DOI: http://dx.doi.org/10.1016/j.bcp.2007.08.016 3. Dalby, A.; Dangerous tastes: the story of spices, 2nd ed., British Museum Press: London, 2000. 4. Liang, X. T.; Fang, W. S.; Medicinal chemistry of bioactive natural products, Wiley: New Jersey, 2006. 5. Crag, G. M.; Newmann, D. J.; Snader, K. M.; J. Nat. Prod. 1997, 60, 52; Newmann, D. J.; Cragg, G. M.; J. Nat. Prod. 2012, 75, 311. DOI: http://dx.doi.org/10.1021/np9604893 6. Mukherjee, P. K.; Wahile, A.; J. Ethnopharm. 2006, 103, 25. DOI: http://dx.doi.org/10.1016/j.jep.2005.09.024 7. Carneiro, D. M.; Ayurveda: saúde e longevidade na tradiçao milenar da India. Pensamento: Sao Paulo, 2009; Prasad, S.; Tyagi, A. K.; Aggarwal, B. B.; Can. Res. Treat. 2014, 46, 2. 8. Sony, D.; Latheef, L.; Kamath, K.; Khaled, M.; Wilkins, J.; Kochikuzhyil, B. M.; Baliga, M. S.; Polyphenols in Human Health and Disease, vol. 1, Academic Press: Waltham, 2014, p. 785; Dhanalakshmi, K.; Bhattacharya, S.; J. Food Eng. 2014, 120, 124. 9. Chakraborty, B.; Sengupta, M.; Cell. Immun. 2012 ,280, 92; Maniglia, B. C.; Domingos, J. R.; De Paula, R. L.; Tapia-Blácido, D. R.; LWT - Food Sci. Technol. 2014, 56, 269. DOI: http://dx.doi.org/10.1016/j.cellimm.2012.11.014 10. Parthasathy, V. A.; Chempakam, B.; Zachariah, T. J.; Chemistry of Spices, 1st ed., CAB International: Oxfordshire, 2008, p. 103. 11. Li, W.; Wang, S.; Feng, J.; Xiao, Y.; Xue, X.; Zhang, H.; Wang, Y.; Liang, X.; Magn. Reson. Chem. 2009, 47, 902. DOI: http://dx.doi.org/10.1002/mrc.2478 PMID: 19569074 12. Roughley, P. J.; Whiting, D. A.; J. Chem. Soc., Perkin Trans. 1973, 1, 2379. DOI: http://dx.doi.org/10.1039/p19730002379 13. Kita, T.; Imai, S.; Sawada, H.; Kumagai, H.; Seto, H.; Biosci. Biotechnol. Biochem. 2008, 72, 1789. DOI: http://dx.doi.org/10.1271/bbb.80075 PMID: 18603793 14. Anand, P.; Thomas, S. G.; Kunnumakkara, A. B.; Sundaram, C.; Harikumar, K. B.; Sung, B.; Thakaran, S. T.; Misra, K.; Priyadarsini, I. K.; Rajasekharan, K. N.; Aggarwal, B. B.; Biochem. Pharmacol. 2008, 76, 1590. DOI: http://dx.doi.org/10.1016/j.bcp.2008.08.008 PMID: 18775680 15. Asai, A.; Miyazawa, T.; Life Sci. 2000, 67, 2785. DOI: http://dx.doi.org/10.1016/S0024-3205(00)00868-7 PMID: 11105995 16. Anand, P.; Kunnumakkara, A. B.; Newman, R. A.; Aggarwal, B. B.; Mol. Pharmaceutics 2007, 4, 807; Heger, M.; van Golen, R. F.; Broekgaarden, M.; Michel, M. C.; Pharmacol. Rev. 2014, 66, 222. DOI: http://dx.doi.org/10.1021/mp700113r 17. Vogel, A.; Pelletier; Journal de Pharmacie 1815, I:289. 18. Milobedeska, J.; Kostanecki, V.; Lampe, V; Ber. Dtsch. Chem. Ges. 1910, 43, 2163; Lampe, V.; Milobedeska, J; Ber. Dtsch. Chem. Ges. 1913, 46, 2235. DOI: http://dx.doi.org/10.1002/cber.191004302168 19. EFSA; EFSA J. 2010, 8(9), 1679. 20. Jasim, F.; Ali, F.; Microchem. J. 1989, 39, 156. DOI: http://dx.doi.org/10.1016/0026-265X(89)90024-6 21. Priyadarsini, K.; J. Photochem. Photobiol. C: Photochem. Rev. 2009, 10, 81. DOI: http://dx.doi.org/10.1016/j.jphotochemrev.2009.05.001 22. Wang, Y.; Pan, M.; Cheng, A.; Lin, L.; Ho, Y.; Hsieh, C.; Lin, J.; J. Pharm. Biomed. Anal. 1997, 15, 1867. DOI: http://dx.doi.org/10.1016/S0731-7085(96)02024-9 PMID: 9278892 23. Jovanovic, S. V.; Steenken, S.; Boone, C. W.; Simic, M. G.; J. Am. Chem. Soc. 1999, 121, 9677. DOI: http://dx.doi.org/10.1021/ja991446m 24. Kolev, T. M.; Velcheva, E. A.; Stamboliyska, B. A.; Spiteller, M.; Int. J. Quantum Chem. 2005 ,102, 1069. DOI: http://dx.doi.org/10.1002/qua.20469 25. Dutta, A.; Boruah, B.; Manna, A. K.; Gohain, B.; Saikia, P. M.; Dutta, R. K.; Spectrochim. Acta A 2013, 104, 150. DOI: http://dx.doi.org/10.1016/j.saa.2012.11.048 26. Yanagisawa, D.; Shirai, N.; Amatsubo, T.; Taguchi, H.; Koichi, H.; Urushitan, M.; Morikawa, S.; Inubushi, T.; Kato, M.; Fuminori, K.; Morino, K.; Kimura, H.; Nakano, I.; Yoshida, C.; Okada, T.; Sano, M.; Wada, Y.; Wada, K.; Wamamoto, A.; Tooyama, I.; Biomaterials 2010, 31, 4179. DOI: http://dx.doi.org/10.1016/j.biomaterials.2010.01.142 PMID: 20181392 27. Arrieta, A. F.; Hjorthtonnensen, H.; Lerner, D.; Pharmazie 1995, 50, 689. 28. Pavolini, T.; Riv. Ital. Essenze, Profumi Piante Off. 1937, 19, 167. 29. Pabon, H. J. J.; Recl. Trav. Chim. Pays-Bas 1964, 83, 379. DOI: http://dx.doi.org/10.1002/recl.19640830407 30. Schlumberger, M. E.; Bulletin de la Société Chimique de Paris 1866, 5, 194. 31. Clarke, L.; Jackson, C. L.; Am. Chem. J. 1908, 39, 696. 32. Spicer, G. S.; Strickland, J. D.; J. Chem. Soc. 1952, 4644. DOI: http://dx.doi.org/10.1039/jr9520004644 33. Picciano, A. L.; Vaden, T. D.; Biophys. Chem. 2013, 184, 62. DOI: http://dx.doi.org/10.1016/j.bpc.2013.09.004 PMID: 24121531 34. Ansari, N.; Khodagholi, F.; Curr. Neuropharm. 2013, 11, 414. DOI: http://dx.doi.org/10.2174/1570159X11311040005 35. Mawani, Y.; Orvig, C.; J. Inorg. Biochem. 2014, 132, 52. DOI: http://dx.doi.org/10.1016/j.jinorgbio.2013.12.004 PMID: 24387940 36. Khan, M. A.; El-Khatib, R.; Rainsford, K. D.; Whitehouse, M. W.; Bioorg. Chem. 2012, 40, 30. DOI: http://dx.doi.org/10.1016/j.bioorg.2011.11.004 PMID: 22172598 37. Sugiyama, Y.; Kawakishi, S.; Osawa, T.; Biochem. Pharmacol. 1996, 52, 519; Prabhu, R.; Hegde, K.; Sharabaya, A. R.; Rao, M. N. A.; J. App. Pharm. Sci. 2011, 1, 114. DOI: http://dx.doi.org/10.1016/0006-2952(96)00302-4 PMID: 8759023 38. Youssef, D.; Nichols, C. E.; Cameron, T. S.; Balzarini, J.; De Clercq, E.; Jha, A.; Bioorg. Med. Chem. Let. 2007, 17, 5624. DOI: http://dx.doi.org/10.1016/j.bmcl.2007.07.079 39. Yamakoshi, H.; Ohori, H.; Kudo, C.; Sato, A.; Kanoh, N.; Ishioka, C.; Shibata, H.; Iwabuchi, Y.; Bioorg. Med. Chem. 2010, 18, 1083. DOI: http://dx.doi.org/10.1016/j.bmc.2009.12.045 PMID: 20060305 40. Masuda, T.; Jitoe, A.; Isobe, J.; Nakatani, N.; Yonemori, S.; Phytochemistry 1993, 32, 1557. DOI: http://dx.doi.org/10.1016/0031-9422(93)85179-U 41. Robinson, T. P.; Hubbard, R. B.; Ehlers, T. J.; Arbiser, J. L.; Goldsmith, D. J.; Bowen, J. P.; Bioorg. Med. Chem. 2005, 13, 4007. DOI: http://dx.doi.org/10.1016/j.bmc.2005.03.054 PMID: 15911313 42. Shim, J. P.; Kim, D. H.; Jung, H. J.; Kim, J. H.; Lim, D.; Lee, S.; Kim, K.; Ahn, J. W.; Yoo, J.; Rho, J.; Shin, J.; Kwon, H.; Bioorg. Med. Chem. 2002, 10, 2439. DOI: http://dx.doi.org/10.1016/S0968-0896(02)00116-5 PMID: 12057633 43. Knorr L.; Ber. Dtsch. Chem. Ges. 1884, 17, 1635. DOI: http://dx.doi.org/10.1002/cber.18840170220 44. Mishra, S.; Karmodiya, K.; Surolia, N.; Surolia, A.; Bioorg. Med. Chem. 2008, 16, 2894. DOI: http://dx.doi.org/10.1016/j.bmc.2007.12.054 PMID: 18194869 45. Lima, L. M.; Barreiro, E. J.; Curr. Med. Chem. 2005, 12, 23. DOI: http://dx.doi.org/10.2174/0929867053363540 PMID: 15638729 46. Biginelli P.; Ber. Dtsch. Chem. Ges. 1891, 24, 1317. DOI: http://dx.doi.org/10.1002/cber.189102401228 47. Arunkhamkaew, S.; Athipornchai, A.; Apiratikul, N.; Suksamrarn, A.; Ajavakom, V.; Bioorg. Med. Chem. Let. 2013, 23, 2880. DOI: http://dx.doi.org/10.1016/j.bmcl.2013.03.069 48. Ross, L.; Barclay, C.; Vinqvist, M. R.; Org. Lett. 2000, 2, 2841. DOI: http://dx.doi.org/10.1021/ol000173t 49. Sun, Y.; Zhang, H.; Chen, D.; Liu, C. Org. Lett. 2002, 4, 2909. DOI: http://dx.doi.org/10.1021/ol0262789 PMID: 12182586 50. Shah, B. H.; Nawaz, Z.; Pertani, S. A.; Roomi, A.; Mahmood, H.; Saeed, S. A.; Gilani, A. H.; Biochem. Pharmacol. 1999, 58, 1167. DOI: http://dx.doi.org/10.1016/S0006-2952(99)00206-3 PMID: 10484074 51. Martins, C. V. B.; da Silva, D. L.; Neres, A. T. M.; Magalhaes, T. F. F.; Watanabem, G. A.; Modolo, L. V.; Sabino, A. A.; de Fátima, A.; Resende, M. A.; J. Antimicrob. Agents Chemother. 2009, 63, 337. DOI: http://dx.doi.org/10.1093/jac/dkn488 52. Brouet, I.; Ohshima, H.; Biochem. Bioph. Res. Commun. 1995, 206, 533. DOI: http://dx.doi.org/10.1006/bbrc.1995.1076 53. Rasmussen, H. B.; Christensen, S. B.; Kvist, L. P.; Kirazami, A.; Planta Med. 2000, 66, 396. DOI: http://dx.doi.org/10.1055/s-2000-8533 PMID: 10865470 54. Chakrabarti, R.; Rawat, P. S.; Cooke, B. M.; Coppel, R. L.; Patankar, S.; PLoS One 2013, 8, e5732. 55. Sharma, O. P.; Biochem. Pharmacol. 1976, 25, 1811. DOI: http://dx.doi.org/10.1016/0006-2952(76)90421-4 PMID: 942483 56. Wilken, R.; Veena, M.; Wang, M. B.; Srivatsan, E. S.; Mol. Cancer 2011, 10, 12. DOI: http://dx.doi.org/10.1158/1535-7163.TARG-11-A12 PMID: 21299897 57. Xianchu, L. M. L.; Yuan, W.; Chang, H. ;Li, Y.; Chen, Z.; Deng, Y.; Li, R.; Wan, Y.; Jiang, Z.; Fan, X.; Wang, Y.; Wu, X.; Mo, X.; Cent. Eur. J. Immunol. 2013, 38, 328. 58. Thangapazham, R. L.; Sharad, S.; Maheshwari, R. K.; Biofactors 2013, 39, 141. DOI: http://dx.doi.org/10.1002/biof.1078 PMID: 23315856 59. Magalhaes, L. G.; Machado, C. B.; Morais, E. R.; Moreira, É. B. C.; Soares, C. S.; Silva, S. H.; Silva Filho, A. A.; Rodrigues, V.; Parasitol. Res. 2009, 104, 1187. 60. Sahebkar, A.; Nat. Rev. Cardio. 2014, 11, 123. DOI: http://dx.doi.org/10.1038/nrcardio.2013.140-c2 61. Gomes, D. C. E.; Alegrio, L. V.; Lima, M. E. F.; Leon, L. L.; Araújo, C. A. C.; Arzneim. Forsch. 2002, 52, 120; Gomes, D. C. E.; Alegrio, L. V.; Leon, L. L.; Lima, M. E. F.; Arzneim. Forsch. 2002, 52, 695. DOI: http://dx.doi.org/10.1055/s-0031-1299867 62. Kiuchi, F.; Goto, Y.; Sugimoto, N.; Akao, N.; Tsuda, Y.; Chem. Pharm. Bull. 1993, 41, 1640. DOI: http://dx.doi.org/10.1248/cpb.41.1640 PMID: 8221978 63. Nose, M.; Koidei, T.; Ogihara, Y.; Yabu, Y.; Ohta, N.; Biol. Pharm. Bull. 1998, 21, 643. DOI: http://dx.doi.org/10.1248/bpb.21.643 PMID: 9657056 64. Wang, Q.; Sun, A. Y.; Simonyi, A.; Jensen, M. D.; Shelat, P. B.; Rottighaus, E.; MacDonald, R. S.; Killer, D. K.; Lubahn, D. E.; Weisman, G. A.; Sun, G. Y.; Journal of Neurology Research 2005, 82, 138. 65. Agrawal, R.; Mishra, B.; Tyagi, E.; Nath, C.; Shukla, R.; Pharmacol. Res. 2010, 61, 247. DOI: http://dx.doi.org/10.1016/j.phrs.2009.12.008 PMID: 20026275 66. Ono, K.; Hasegawa, K.; Naiki, H.; Yamada, M.; Journal of Neurology Research 2004, 75, 742. 67. Decote-Ricardo, D.; Chagas, K. K.; Rocha, J. D.; Redner P.; Lopes, U. G.; Cambier, J. C.; Barros de Arruda, L.; Peçanha, L. M.; Phytomedicine 2009, 16, 982. DOI: http://dx.doi.org/10.1016/j.phymed.2009.01.004 PMID: 19303754 68. Singh, S.; Aggarwal, B. B.; J. Biol. Chem. 1995, 270, 24995. DOI: http://dx.doi.org/10.1074/jbc.270.42.24995 PMID: 7559628 69. Karin, M.; Greten, F. R.; Nat. Rev. Immunol. 2005, 5, 749. DOI: http://dx.doi.org/10.1038/nri1703 PMID: 16175180 70. Bonizzi, G.; Karin, M.; Trends Immunol. 2004, 25, 280. DOI: http://dx.doi.org/10.1016/j.it.2004.03.008 PMID: 15145317 71. Reddy, S.; Aggarwal, B. B.; FEBS Lett. 1994, 341, 19. DOI: http://dx.doi.org/10.1016/0014-5793(94)80232-7 PMID: 7511111 72. Bengmark, S.; JPEN, J. Parenter. Enteral Nutr. 2006, 30, 45. DOI: http://dx.doi.org/10.1177/014860710603000145 73. Huang, T.; Lee, S.; Lin, J.; Proc. Natl. Acad. Sci.U. S. A. 1991, 88, 5292. DOI: http://dx.doi.org/10.1073/pnas.88.12.5292 PMID: 1905019 74. Verma, I. M.; Stevenson, J. K.; Schwarz, E. M.; Van Antwerp, D. Myamoto S.; Genes Dev. 1995, 2723. DOI: http://dx.doi.org/10.1101/gad.9.22.2723 PMID: 7590248 75. Abe, Y.; Hashimoto, S.; Horie. T.; Pharmacol. Res. 1999, 39, 41. DOI: http://dx.doi.org/10.1006/phrs.1998.0404 PMID: 10051376 76. Kobayashi, T.; Hashimoto, S.; Horie, T.; Biochem. Pharmacol. 1997, 54, 819. DOI: http://dx.doi.org/10.1016/S0006-2952(97)00220-7 PMID: 9353136 77. Grandjean-Laquerriere, A.; Antonicelli, F.; Gangloff, S. C.; Guenounou, M.; Le Naour R.; Cytokine 2007, 37, 76. DOI: http://dx.doi.org/10.1016/j.cyto.2007.02.020 PMID: 17399992 78. Fahey, A. J.; Robins, R. A. Constantinescu, C. S.; J. Cell Mol. Med. 2007, 11, 1129. DOI: http://dx.doi.org/10.1111/j.1582-4934.2007.00089.x PMID: 17979888 79. Bachmeier, B. E.; Mohrenz, I. V.; Mirisola, V.; Schleicher, E.; Romeo, F.; Hohneke C.; Jochum, M.; Nerlich, A. G.; Pfeffer, U.; Carcinogenesis 2008, 29, 779. DOI: http://dx.doi.org/10.1093/carcin/bgm248 PMID: 17999991 80. Lim, J. H.; Kwon, T. K.; Food Chem. Toxicol. 2010. 48, 47.; Ramachandran, C.; Rodriguez, S.; Ramachandran, R.; Raveendra Nair, P. K.; Fonseca, H.; Khatib, Z.; Escalon, E.; Melnick, S.; J. Anticancer Res. 2005, 25, 3293. DOI: http://dx.doi.org/10.1016/j.fct.2009.09.013 PMID: 19766691 81. Shankar, S.; Chen, Q.; Sarva, K.; Siddiqui, I.; Srivastava, R. K.; J. Mol Signal. 2007, 4, 2. 82. Bush, J. A.; Cheung, K. J. Jr.; Li, G.; Exp. Cell Res. 2001, 271, 305. DOI: http://dx.doi.org/10.1006/excr.2001.5381 PMID: 11716543 83. Chakraborti, S.; Das, L.; Kapoor, N.; Das, A.; Dwivedi, V.; Poddar, A.; Chakraborti, G.; Janik, M.; Basu, G.; Panda, D.; Chakrabarti, P.; Surolia, A.; Bhattacharyya, B.; J. Med. Chem. 2011, 54, 6183. DOI: http://dx.doi.org/10.1021/jm2004046 PMID: 21830815 84. Murniqsih, T.; Subeki Matsuura, H.; Takahashi, K.; Yamasaki, M.; Yamato, O.; Maede, Y.; Katakura, K.; Suzuki, M.; Kobayashi, S.; Chairul Yoshihara, T.; J. Vet. Med. Sci. 2005, 67, 829. DOI: http://dx.doi.org/10.1292/jvms.67.829 85. Bentzen, P. J.; Lang, E.; Lang, F.; Cell Physiol. Biochem. 2007, 19, 153. DOI: http://dx.doi.org/10.1159/000099203 PMID: 17310109 86. Araujo, C. A.; Alegrio, L. V.; Gomes, D. C.; Lima, M. E.; Gomes-Cardoso, L.; Leon, L. L.; Mem. Inst. Oswaldo Cruz 1999, 94, 791. DOI: http://dx.doi.org/10.1590/S0074-02761999000600015 PMID: 10585657 87. Changtan, C.; de Koning, H. P.; Ibrahim, H.; Sajid, M. S.; Gould, M. S.; Suksamran, A.; Eur. J. Med. Chem. 2010, 45, 941. DOI: http://dx.doi.org/10.1016/j.ejmech.2009.11.035 88. Kunnumakkara, A. B.; Anand, P.; Aggarwal, B. B.; Cancer Lett. 2008, 269, 199. DOI: http://dx.doi.org/10.1016/j.canlet.2008.03.009 PMID: 18479807 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access