Revisão
|
|
| O papel dos ânions no comportamento voltamétrico de superfícies monocristalinas de platina THE ROLE OF ANIONS IN SINGLE CRYSTAL PLATINUM CYCLIC VOLTAMMOGRAMS |
|
Janaina Souza-Garcia; Camilo A. Angelucci*
Centro de Ciências Naturais e Humanas, Universidade Federal do ABC, Av. dos Estados, 5001, 09210-580 Santo André - SP, Brasil Recebido em 04/11/2014 *e-mail: camilo.angelucci@ufabc.edu.br This review examined the state of the art of electrochemical and thermodynamic studies involving characteristic features related to the adsorption of anions present in the electrolyte solutions in contact with platinum single crystals electrodes. INTRODUÇÃO Desde a publicação em 1980, por Clavilier,1,2 de um novo método de obtenção e manejo de eletrodos monocristalinos de platina, conhecido como tratamento térmico por chama, foi possível estudar de modo reprodutível o comportamento intrínseco de vários processos adsortivos nessas superfícies e observou-se que, inicialmente, muitas interpretações controversas haviam sido propostas em relação aos processos superficiais presentes nos voltamogramas cíclicos dos eletrodos de Pt(hkl). O emprego dessa nova técnica revelou perfis voltamétricos correspondentes aos planos de base de Pt notavelmente diferentes dos obtidos com as técnicas empregadas até então. Os aspectos mais surpreendentes foram obtidos nos voltamogramas correspondentes às superfícies Pt(111) e Pt(100), pela existência de estados de adsorção em uma região de potenciais relativamente altos, nunca observados na voltametria de platina policristalina. A novidade desses estados foi classificada por Clavilier de estados não-usuais ou anômalos.2,3 Em outras palavras, uma pergunta feita quando se começa a estudar os voltamogramas cíclicos de eletrodos monocristalinos de platina é: qual é o processo superficial responsável pelo perfil voltamétrico dos estados de adsorção não-usuais? A estes estados não-usuais foram inicialmente atribuidos, em Pt(111), o processo de adsorção/dessorção de 1/3 de uma monocamada de hidrogênio UPD (do inglês: Under Potential Deposition ), sujeito à adsorção específica do ânion presente.3 No entanto, a hipótese de hidrogênio fortemente adsorvido foi atacada com o argumento que a extraordinária energia de adsorção (ΔH~160 kJ mol-1, em Pt(111) em ácido perclórico) exigiria um valor muito acima aquele obtido em experimentos de ultra alto vácuo (46 kJ mol-1) para se explicar a contribuição voltamétrica.4-6 Em 1983, Wagner e Ross7 conseguiram, por primeira vez, obter um voltamograma satisfatório (tal como o entendemos atualmente) correspondente à superfície de Pt(111) preparada em ultra alto vácuo. Vale destacar que esses autores preferiram explicar os estados não-usuais como referentes a um processo redox sofrido por alguma contaminação adsorvida, ainda que não descartassem a possibilidade de adsorção de íons hidroxila (OH-). De fato, utilizando eletrodos preparados por técnicas de ultra alto vácuo e subsequente caracterização mediante LEED (Difração de Elétrons de Baixa Energia) e AES (Espectroscopia Eletrônica Auger) foi possível obter voltamogramas similares ao dos monocristais descontaminados termicamente.8 Estes resultados demonstraram que o tratamento térmico produz superfícies ordenadas e limpas e que o perfil voltamétrico observado é intrínseco a estas superfícies. A partir daí foi possível descartar os efeitos estruturais e as impurezas como causas da aparição dos estados não-usuais, o que deixou como alternativa para explicar esses processos não-usuais a adsorção de oxigênio (ou espécies oxigenadas), hidrogênio e finalmente os ânions presentes no meio eletrolítico.7,9 Al Jaaf-Golze e colaboradores9 atribuíram aos estados de adsorção não-usuais, e às referidas correntes voltamétricas, somente a adsorção de ânions (sulfato ou bissulfato) devido à não dependência do potencial com o pH em solução de ácido sulfúrico para Pt(111). A questão central nesta interpretação, baseada no processo simples que é a adsorção de ânions, está claramente em correlacionar os altos valores de densidade de carga e o reduzido intervalo de potencial que aparecem os estados não-usuais de adsorção. Geralmente a adsorção de uma espécie carregada ocorre em um largo intervalo de potencial devido a interações repulsivas entre as espécies adsorvidas. Assim, a única maneira de levar em conta o comportamento observado para os estados não-usuais seria aceitar a adsorção do ânion e consequente transferência de carga.9-11 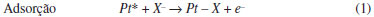 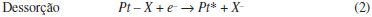 Onde a espécie carregada X- representa um ânion qualquer presente nas adjacências do sítio livre de platina (Pt*). É claro que a representação de X aqui é dependente da composição do eletrólito empregado, como, por exemplo, HSO4-, OH-, Cl-, entre outros. De um modo geral, a natureza e a concentração do eletrólito suporte tem um papel fundamental no perfil voltamétrico nos eletrodos monocristalinos, bem como na região de adsorção de hidrogênio, indicando a presença de competição das espécies pelos processos globais de adsorção sobre a superfície de platina.12 Os experimentos voltamétricos sozinhos não conseguem explicar e comprovar a presença das várias espécies envolvidas. Dessa maneira, muitas técnicas têm sido empregadas a fim de obter informações dos fenômenos responsáveis pelos estados não-usuais. Tem-se realizado medidas com marcadores radioativos,13,14 espectroscopia de infravermelho in situ (FTIRRAS),15-17 estudos com microscopia de tunelamento (STM)18-20 e deslocamento de carga com CO.21-23 Muitas técnicas geraram interpretações contraditórias, porém, o conjunto dos resultados permite compreender, ainda que não totalmente, os fenômenos que ocorrem na interface metal/solução quando um eletrodo de platina é colocado em contato com eletrólitos de diferentes composições. Independentemente dos aspectos fundamentais, a adsorção de ânions afeta a reatividade de processos com importância prática, como eletrossíntese e deposição de metais, e são efetivos na inibição/promoção de processos corrosivos.24 O processo de adsorção de ânions pode produzir mudanças dramáticas nas propriedades eletrocatalíticas de um determinado metal. Alguns exemplos são a acentuada diminuição na redução de oxigênio molecular ou nitrato em eletrodos de platina, como resultado da adsorção específica de ânions,25-27 ou a velocidade do processo de oxidação de CO que depende fortemente da presença de espécies oxigenadas na superfície do eletrodo (OH).28 As interações Ânion/Eletrodo monocristalino são também bons modelos para compreender o comportamento de nanopartículas metálicas frente a reações eletrocatalíticas e de importância fundamental em ciência e tecnologia.22,29 Frente a esses fatores, este trabalho nasceu da necessidade crescente de um material de apoio e revisão para uma área da eletroquímica que vem crescendo a passos largos no Brasil: Eletrocatálise (fundamental e aplicada). A análise e exposição da ampla literatura desenvolvida desde a década de 1980 abordará vários tópicos relacionados com a interface entre eletrodo e solução eletrolítica, envolvendo a adsorção específica de ânions e o estudo termodinâmico desses processos, além da influência dos mesmos na cinética e no mecanismo de algumas reações eletrocatalíticas.
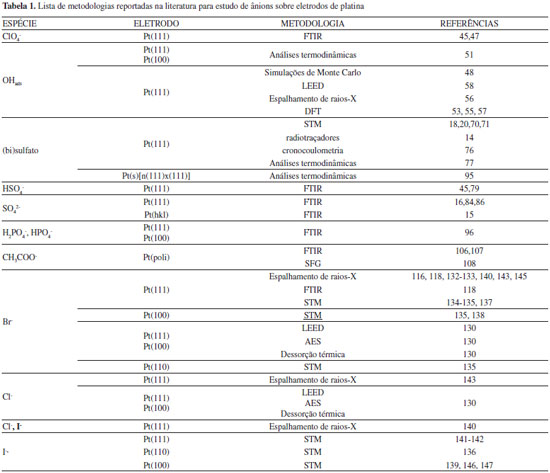
ÂNIONS POLIATÔMICOS Desde a descoberta do tratamento térmico por chama,1,2 o progresso da metodologia de preparação de monocristais de metais nobres tem sido contínua e, hoje, é possível obter superfícies monocristalinas com presença de cada vez menos defeitos influentes para experimentos eletroquímicos. Outro fato a ser destacado é que a pureza das soluções empregadas nestes experimentos também progrediu nessas últimas décadas e, como consequência, os perfis voltamétricos presentes hoje nos experimentos eletroquímicos exibem características cada vez mais nítidas, simétricas e reprodutivas. Com respeito à presença de picos voltamétricos associados à existência de defeitos de orientação (110) e (100) na região de adsorção de hidrogênio para eletrodos de Pt(111), os defeitos podem ser minimizados após polimento e subsequente tratamento da superfície. Apesar dos progressos apresentados nessas últimas décadas, o perfil voltamétrico de eletrodos monocristalinos de platina tem ainda algumas controvérsias que serão consideradas no decorrer deste trabalho. Não serão abordadas aqui a correlação entre a estrutura atômica superficial e o processo de adsorção-dessorção reversível de hidrogênio em eletrodos monocristalinos de Pt, fato que já foi elucidado por Santos et al.,30 e sim o papel dos ânions em toda a região voltamétrica na presença ou não de outros processos de adsorção. PERCLORATO (ClO4-) E SULFATO (SO42-) Uma ilustração de que a interação com a superfície metálica de diferentes ânions presentes no eletrólito suporte pode gerar perfis voltamétricos bastante distintos pode ser observada na Figura 1.
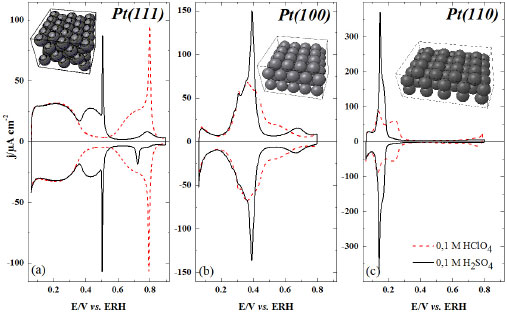 Figura 1. Estado da arte dos voltamogramas de (a) Pt(111), (b) Pt(100) e (c) Pt(110) em 0,1 mol L-1 H2SO4 (linha tracejada) e 0,1 mol L-1 H2SO4 (linha contínua). As estruturas referentes às geometrias superficiais foram obtidas a partir de Ref. 31. Velocidade de Varredura: 50 mV s-1
Dentre os oxiânions, o perclorato é considerado um ânion que não se coordena (ou possui fraca coordenação) à superfície eletródica,32 o que significa que esses ânions se mantêm na parte difusa da dupla camada elétrica em potenciais superiores ao potencial de carga zero.33 O perfil voltamétrico mostrado na Figura 1 (a) é conhecido como "borboleta". Outros ácidos, como o ácido fluorídrico (HF)7,34,35 e o ácido trifluorometanosulfônico (HCF3SO3),36 também apresentam o comportamento voltamétrico observado para o ácido perclórico. O interessante em utilizar ânions que não se adsorvem especificamente sobre a superfície de platina é que um componente diferente no eletrólito suporte com adsorção específica deve ser considerado presente na solução se o voltamograma se mostra distinto do que se vê para os perfis voltamétricos nos três planos de base de platina (veja Figura 1 (a), (b) e (c) para 0,1 mol L-1 HClO4). Por mostrar perfis tão característicos para cada geometria superficial, os voltamogramas cíclicos dessas superfícies são comumente relatados como a impressão digital do eletrodo. Não está claro porque o (bi)sulfato se adsorve especificamente e o perclorato não, particularmente por serem ambas espécies isoeletrônicas. Uma teoria proposta é que o enxofre no (bi)sulfato37 tem uma maior retrodoação que o cloro do perclorato junto ao metal da superfície. Esta retrodoação origina-se de uma menor diferença de energia entre os orbitais HOMO-LUMO no (bi)sulfato que no perclorato.38 Estudos mostraram que a densidade de carga ao redor do átomo de enxofre é maior que no cloro. A baixa densidade de carga sobre o cloro no perclorato tem sido usada para explicar a baixa energia de ligação do perclorato quando comparado ao (bi)sulfato.39 Este comportamento foi também observado por Attard et al.38 a partir de estudos teóricos, mostrando que as estruturas e a polarizabilidade de espécies isoeletrônicas como ClO4-, HSO4- e H2PO4- não são os fatores predominantes na força da adsorção específica para esses íons, e sim a diferença de energia entre os orbitais HOMO e LUMO. Pt(111) A discussão do perfil voltamétrico de um eletrodo de platina em solução de ácido perclórico será iniciada com a superfície Pt(111), cujo voltamograma pode ser facilmente dividido em três regiões: uma abrangendo potenciais abaixo de 0,4 V, conhecida como região de adsorção de hidrogênio, outra em potenciais acima de 0.5 V, chamada de região de estados não-usuais e, entre essas duas zonas, está a região de dupla camada elétrica, onde, geralmente, se aceita que a superfície esteja apenas recoberta por moléculas de água. A mesma interpretação não pode ser estendida para as superfícies de Pt(100) e Pt(110), já que os processos de adsorção de ânions e hidrogênio estão sobrepostos no mesmo intervalo de potencial (entre 0,2 - 0.7 V para Pt(100) e 0.05 - 0,35 V para Pt(110)). Note que a região de hidrogênio em Pt(111) não é afetada pela presença dos íons (bi)sulfato, fato que foi claramente comprovado com o uso da técnica de deslocamento de carga por monóxido de carbono, indicando um valor de 152 µC em 0,08 V para ambos os eletrólitos.40 A origem dos estados não-usuais em Pt(111) na presença de íons perclorato ainda é tema de muita discussão, o que, no entanto, contrasta com os poucos estudos que trazem informações mais detalhadas. O fato é que, acima de 0,35 V, experiências com deslocamento de carga mostram transientes de corrente negativa,23,41,42 indicando que a partir desse potencial espécies com carga negativa já estão adsorvidas sobre a superfície do eletrodo. No caso em questão, as espécies presentes no meio eletrolítico são íons perclorato, água e hidrônio. Para responder ao comportamento observado resta associar a presença de ClO4 e OH adsorvido proveniente da dissociação de água: 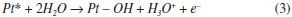 De fato, medidas de impedância mostraram que a adsorção de OH em Pt(111) envolve ao menos dois fenômenos adsortivos:43 um envolvendo uma resistência à transferência de carga e outro um comportamento limitado por difusão quando a concentração de H+ em solução decresce a 10-3 mol L-1, sugerindo que este fenômeno pode ser atribuído à adsorção de OH da dissociação da água . No entanto, uma vez que o íon ClO4- não se adsorve especificamente sobre Pt, é dada a responsabilidade aos estados não-usuais à oxidação da superfície de platina proveniente da formação de OH adsorvido . Isto está consistente com a dependência destes estados de adsorção com o pH, uma vez que se deslocam 60 mV por unidade de pH.9,44 No entanto, Ito et al.,45,46 utilizando espectroscopia de infravermelho in situ, alegam que o íon perclorato se adsorve em Pt(111) no intervalo de potencial entre 0,3 e 0,6 V, evidenciado por uma banda entre 1220 e 1250 cm-1. Da mesma forma, Markinovic et al.47 reportaram a co-adsorção de perclorato induzido pela deposição UPD de átomos de Tl sobre Pt(111). É possível observar que o formato borboleta dos voltamogramas de Pt(111) consiste em uma pré-onda seguido por um pico agudo: 0,8 V em 0,1 mol L-1 HClO4 e 0,49 V em 0,1 mol L-1 H2SO4. Muitos trabalhos relacionam este formato com a formação de uma estrutura bidimensional de longa ordem dos adsorbatos sobre a superfície de Pt(111) e, o pico agudo, seria a resposta de uma transição entre as fases desordenada/ordenada dos adsorbatos.48,49 No entanto, para Pt(111) em HClO4, a estrutura formada por OH adsorvido (OHads) é desconhecida. Hamm et al.,50 utilizando técnicas ex-situ, relataram muito brevemente em seu artigo a presença de estrutura (2×2) com cobertura de θOH=0,5 da superfície, mas nenhum detalhe mais específico foi encontrado em publicações futuras, como haviam mencionado. Climent et al.,51 por meio de análise termodinâmica de voltamogramas de Pt(111) em 0,1 mol L-1 HClO4, obtiveram o máximo de cobertura de OHads de θOH=0,45. Já Koper et al.,48,49 utilizando simulações de Monte Carlo, mostraram que, ao se usar um modelo de estrutura superficial p(2×2) com θOH=0,25 para OHads, o perfil voltamétrico se mostrava bastante similar ao da Pt(111) em ácido perclórico. Um fato a ser notado é que a concentração superficial dos adsorbatos é dependente do potencial aplicado ao eletrodo. Esta observação fica bastante clara ao se analisar a Figura 2, extraída da Referência52 que correlaciona a concentração superficial de diferentes adsorbatos com o potencial. Nota-se que a adsorção do íon hidroxila inicia-se em aproximadamente 0,55 V, mesmo potencial em que se dá início a formação dos estados não-usuais no voltamograma cíclico (Figura 1 (a)).
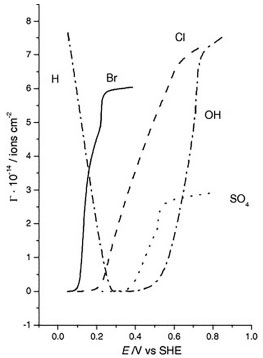 Figura 2. Excesso superficial de cloreto, brometo e (bi)sulfato em Pt(111) em 0,1 mol L-1 HClO4 calculado por análise termodinâmica. Esta Figura foi extraída da Ref. 52 com permissão de reprodução da Editora Elsevier
Diante dos resultados apresentados a respeito da cobertura superficial é de se esperar que a camada de adsorbatos formada na superfície de Pt(111) em HClO4 (acima de 0,4 V vs. ERH) seja formada por uma mistura de água e íons OHads.53-55 Estruturas adsorvidas por OH e co-adsorvidas água-OH foram estudadas tanto experimental (em condições de ultra-alto-vácuo)56-58 como teoricamente,53,55,59 mostrando que a estrutura superficial formada por OHads+H2O é energeticamente mais favorável comparada com as espécies segregadas, o que pode ser justificado pela habilidade de ambas as espécies de formar ligações hidrogênio.60,61 Por fim, em meio ácido, não é esperado que OHads seja formado a partir de OH- proveniente da solução, mas sim, muito provavelmente, a partir de moléculas de água adsorvidas que competem pelos mesmos sítios de adsorção linear. Outro ponto importante a ressaltar é o pico agudo presente em 0,8 V que, para alguns autores, está relacionado à presença de íons cloreto provenientes da própria decomposição de perclorato, mesmo em soluções de altíssima pureza.62-64 Contudo, em um trabalho mais recente de Berna et al.,65 utilizando considerações simples com respeito à limitação de transporte de massa, foi demonstrado que é possível descartar a adsorção específica de ânions, como o cloreto, como responsável por esse comportamento voltamétrico. Ainda com relação ao pico agudo em 0,8 V, este se mostra extremamente sensível à presença de de degraus, ou defeitos, na superfície eletródica. Um grande número de artigos devotou especial atenção à variação da extensão de terraços (111) com degraus monoatômicos de orientação (111) e (100).41,66-69 Todos eles apontam que, tanto os processos de adsorção de hidrogênio, como os de adsorção de ânions, são fortemente dependentes da densidade de defeitos nos eletrodos e que este pico agudo presente no perfil borboleta (tanto para sulfato quanto para perclorato) diminui com o aumento da densidade de degraus, desaparecendo quando os terraços são menores que 10 átomos de largura. Avaliando mais profundamente o voltamograma da Pt(111) na presença de íons (bi)sulfato, um íon que se considera possuir adsorção específica sobre a superfície de platina, deve-se considerar mais uma complexidade: este íon, assim como o fosfato (que abordaremos mais adiante), em solução aquosa, se apresenta com mais do que uma dissociação, ou seja, possui diferentes equilíbrios ácido-base em solução e, possivelmente, também junto à superfície do eletrodo, requerendo um cuidado especial na escolha das condições experimentais, como tem sido reportado em diversos trabalhos. Ao longo desse trabalho referencia-se o ânion presente na superfície eletródica como (bi)sulfato, uma vez que ainda não há um consenso de qual espécie - sulfato (SO42-) e/ou bissulfato (HSO4-) - está adsorvida. O interessante é que, enquanto para o perclorato a determinação da estrutura formada pelo adsorbato não foi ainda possível, para os íons (bi)sulfato em solução aquosa foi observado que estes se adsorvem em um grande número de superfícies metálicas (Pt,18,20,70,71 Pd,72,73 Au,74 Cu19 e Rh75) formando estruturas de longa ordem. Para tanto, estudos em STM (Scanning Tunneling Microscopy) mostraram que sobre essas superfícies é observado uma estrutura superficial de (√3x√7)R19.1º relacionado à adsorção ordenada de (bi)sulfato.18-20,70-72,74,75 A cobertura correspondente a esta camada de adsorbatos está relacionada à adsorção do (bi)sulfato através de três oxigênios com 0,2 espécie adsorvida por cada átomo de metal. A Figura 3 representa a cobertura de íons (bi)sulfato conforme sugerido pelas referências72,73,75.
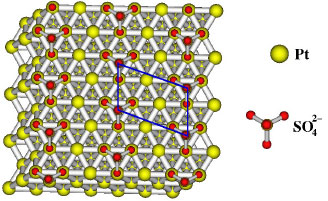 Figura 3. Modelo para representar a estrutura (√3x√7)R19.1º para adsorção de sulfato em uma superfície de geometria (111), como sugerido pelas Ref. 72, 73, 75
A partir da Figura 1 (a) nota-se que os estados não-usuais no voltamograma cíclico da Pt(111) em ácido sulfúrico estão deslocados para potenciais mais negativos quando comparados com ácido perclórico. Este deslocamento é característico da adsorção específica do ânion presente no eletrólito. Observa-se nitidamente a separação entre a região de adsorção de hidrogênio (entre 0,05 e 0,4 V) e a região dos estados não-usuais, caracterizada pelo formato borboleta, que compreende desde a pré-onda (<0,4 V) até o pico agudo em 0,49 V. Para avaliar a concentração superficial de (bi)sulfato em platina, dois métodos têm sido usados para medir sua concentração: método radioquímico e análise termodinâmica da densidade de carga superficial, levando a resultados distintos. Savich et al.76 mostraram que a maior concentração de (bi)sulfato monitorado por radiotraçadores foi de aproximadamente 2,5 × 1014 íons cm-2, enquanto a análise termodinâmica determinada por cronocoulometria resultou num máximo de concentração superficial de 5 × 1014 íons cm-2. Para analisar a cobertura dessa camada de adsorbato formada por (bi)sulfato deve-se lembrar que a densidade de átomos superficiais na Pt(111) é de 1,5 × 1015 átomos cm-2. Assim, a cobertura correspondente à adsorção de (bi)sulfato é de aproximadamente 0,15 monocamada (ML) a partir de radiotraçadores e 0,3 ML pela análise termodinâmica. Kolics e Wieckowski,14 repetindo as medidas de radiotraçadores, chegaram a um novo valor de concentração máxima de (bi)sulfato de 3,2 × 1014 íons cm-2 ou 0,2 ML. De fato, utilizando estudos termodinâmicos, Herrero et al.77 encontraram um valor muito similar a este, de aproximadamente 3,0 × 1014 íons cm-2, o que mostra ótima concordância com os valores encontrados a partir de análise de imagens de STM.18,20,70,71 Assim, como abordado para o ânion perclorato, o pico agudo presente em aproximadamente 0,5 V (Veja Figura 1(a)) no voltamograma de Pt(111) em H2SO4 está relacionado à transição de fase de um estado desordenado para um estado ordenado de (bi)sulfato e água adsorvidos.18,20,70,71 Este processo, que envolve aproximadamente 6 µC cm-2, seria responsável apenas pela corrente capacitiva proveniente da transição de fase.70 Koper e Lukkien78 associam o pico agudo à transição para a fase ordenada, o que levaria à acomodação de mais adsorbatos. De volta à Figura 2, é possível notar que a adsorção de (bi)sulfato sobre Pt(111) inicia-se logo após o término da região de hidrogênio, aumentando com o aumento do potencial até um valor máximo de aproximadamente 3 × 1014 íons cm-2. Vale ressaltar que a transição de fase associada ao pico agudo em 0,49 V se dá exatamente após a cobertura de (bi)sultafo alcançar seu valor máximo. Um fato importante a ser relatado é que, além da adsorção de (bi)sulfato sobre a superfície de Pt(111), estudos relatam que haveria também a co-adsorção de moléculas de água e cátions hidrônio (H3O+) na estrutura (√3x√7)R19.1º.16,17,70,79-82 Diante disso, é razoável assumir que ligações hidrogênio tem papel fundamental na estabilização da estrutura superficial formada pelos adsorbatos, reduzindo as forças coulômbicas entre as moléculas de (bi)sulfato adsorvidas.79,83 Mesmo que os cátions hidrônio não formem uma ligação forte com a superfície de platina, mas se mantenham dentro da dupla camada elétrica como espécies hidratadas, as fortes interações eletrostáticas entre os ânions adsorvidos especificamente e as cargas positivas do metal seriam minimizadas pela presença de uma espécie de carga positiva. Kolics e Wieckowski14 mostraram que o número de carga parcial formal para (bi)sulfato adsorvido seria de -1,7. O valor de carga restante de -0,3 estaria relacionado à co-adsorção do cátion hidrônio com o ânion sulfato (SO42-) e/ou devido à retrodoação da platina para o átomo de enxofre. Braunschweig e Daum18 encontraram valores de carga entre -1,4 e -1,6 por íon adsorvido. Já Herrero et al.,77 a partir de análise termodinâmica de voltamogramas cíclicos de Pt(111) em diferentes concentrações de H2SO4, obtiveram um valor de aproximadamente -2 para o número de carga por íon adsorvido. No entanto, apesar do uso de técnicas bastante poderosas, como: STM, análises termodinâmicas e radiotraçadores (apresentados até então), para o estudo da natureza e identidade das espécies adsorvidas, o uso de espectroscopia de infravermelho in situ (FTIR) pode ser considerado uma das melhores ferramentas para elucidar o problema. Deve-se considerar que, em sistemas complexos com mais de uma dissociação, como é o caso de soluções de ácido sulfúrico e ácido fosfórico (que abordaremos mais adiante), existem diferentes equilíbrios ácido-base em solução e, possivelmente, também junto à superfície do eletrodo. Apesar de os espectros infravermelho do (bi)sulfato e do sulfato em solução serem marcadamente diferentes, a determinação quando estes se encontram adsorvidos à superfície se torna mais complicada, dependendo se a ligação com a superfície envolve um, dois ou três átomos de oxigênio.15,16,79,81,83-86 Dessa forma, dos trabalhos publicados até então, ainda não há um consenso de qual espécie (HSO4- ou SO42-) compõe a camada de adsorção em Pt(111) em ácido sulfúrico. Os trabalhos de Faguy et al.79 e Sawatari et al.45 mostraram que os espectros de infravermelho correspondem à adsorção preferencial de bissulfato (HSO4-), enquanto que Nart et al.15,16,86 propuseram que sulfato seria o responsável pelo comportamento espectroscópico. Mais recentemente, Su et al.,84 utilizando infravermelho in situ, mostraram que em Pt(111) em soluções de ácido sulfúrico, no intervalo de pH entre 1 e 6, a espécie adsorvida preferencialmente é o sulfato. Esta afirmação está de acordo com os resultados obtidos a partir de análise termodinâmica87 e com radiotraçadores.14 Deve-se ressaltar também a presença do pequeno pico irreversível localizado em 0,75 V (varredura anódica). Sua natureza é controversa e seu perfil tem sido relacionado à oxidação dissociativa da água presente na camada de sulfatos. Não obstante, foi demonstrada a influência de cátions alcalinos em sua reversibilidade, o que mostra a complexidade estrutural da camada de ânions.88 Pt(100) e Pt(110) Para Pt(100) e Pt(110) (Figura 1 (b) e (c), respectivamente) nota-se claramente uma diferença no perfil voltamétrico em relação à Pt(111). Isso mostra a especificidade de processos de adsorção em função da estrutura cristalina superficial do eletrodo.21,89 O voltamograma cíclico correspondente à Pt(100) em 0,1 mol L-1 H2SO4 é dominado pela presença de um pequeno pico em 0,30 V, seguido de um pico agudo centrado em 0,39 V. De acordo com Rodes et al.,90 o pico em 0,30 V corresponde à adsorção de hidrogênio em defeitos presentes na superfície, causados pela adsorção de oxigênio durante o tratamento térmico do eletrodo. Já na presença de íons perclorato, o pico antes agudo se estende até 0,6 V. Na Figura 1 estão também os voltamogramas cíclicos correspondentes à superfície de Pt(110) em soluções de 0,1 mol L-1 H2SO4 e 0,1 mol L-1 HClO4. Observa-se que na presença do íon (bi)sulfato há um pico bastante agudo e reversível em 0,15 V e um ombro em 0,17 V seguido por uma densidade de corrente constante no intervalo de 0,3 e 0,6 V. Já na ausência de adsorção específica (0,1 mol L-1 HClO4), o pico antes agudo dá lugar a dois picos menos acentuados em 0,14 V e 0,24 V. A interpretação do voltamograma para essa superfície é menos controvertida que a da Pt(111), e experimentos com deslocamento de carga com monóxido de carbono mostraram que o perfil voltamétrico é devido a processos acoplados de adsorção/dessorção de uma monocamada de hidrogênio adsorvido junto com a dessorção/adsorção de ânions (bi)sulfato ou OH-, em meio H2SO4 ou HClO4, respectivamente.21,40,89,91 A partir dos voltamogramas cíclicos presentes na Figura 1 é possível analisar melhor a natureza da transferência de carga dos processos de adsorção. Para isso, uma alternativa é utilizar valores de densidade de carga obtidos através da integração dos voltamogramas, como está mostrado na Figura 4. Como habitual, a densidade de carga no eletrodo aumenta com o potencial. No entanto, a quantidade de hidrogênio adsorvido diminui até que cruza o eixo de potencial num valor que corresponde ao potencial de carga total zero (pctz). A partir deste ponto a adsorção de ânions passa a ser favorecida. Este ponto é definido quando a soma do excesso de carga superficial, da densidade de carga transferida no processo de adsorção e a densidade de carga livre é igual a zero.41,92
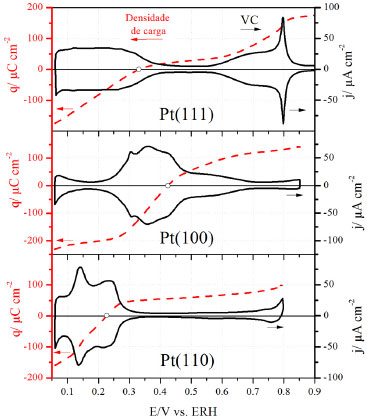 Figura 4. Densidade de carga total (eixo da esquerda) para Pt(hkl) em 0,1 mol L-1 HClO4 obtidos através da integração da varredura positiva dos voltamogramas (eixo da direita). Os valores de potencial que as curvas cruzam o eixo de q=0 são considerados como o potencial de carga total zero (pctz)
Em geral, na ausência de quimissorção de ânions, a formação de OHads em Pt(111), Pt(100) e Pt(110) se dá em uma larga região de potenciais acima do pctz dessas superfícies, mas antes do início da formação de fases óxido51. A partir dos pctz41,93 dessas superfícies identificam-se os potenciais onde ocorre a adsorção dos ânions e de hidrogênio. O perfil da densidade de carga mostra que, como discutido anteriormente, para Pt(111) as regiões de adsorção de hidrogênio e OH estão separadas enquanto que para Pt(100) e Pt(110) estes processos se sobrepõem. Analisando os valores de pctz, observa-se que a adsorção de OH ocorre em potenciais mais negativos para Pt(110), seguido por Pt(111) e Pt(100). Estudos mostram uma relação entre o pctz e a função trabalho da superfície. Como a função trabalho diminui para superfícies com defeitos, o pctz também diminui. Sendo Pt(110) uma escalonada de (111)×(111), isso explica seu menor pctz em relação à Pt(111). Contudo, essa correlação entre o pctz e a função trabalho deve ser tratada de forma qualitativa, visto que a precisão da determinação do primeiro é significativamente maior que do segundo, além do fato de um (pctz) ser determinado em ambiente eletroquímico e o segundo em ultra-alto vácuo. Sabe-se que a comparação entre resultados destes dois ambientes deve ser feita com cautela, visto que não está claro se as superfícies obtidas são idênticas, embora a temperatura e a pressão sejam bastante diferentes em cada caso.94 Em estudos termodinâmicos de adsorção de sulfatos em Pt(s)[n(111)x(111)], Mostany et al.95 mostraram que os ânions (bi)sulfato se adsorvem preferencialmente nos terraços. Esse fato pode ser explicado pela geometria de adsorção de sulfato nos sítios de Pt. Sabe-se que a estrutura dos sítios determina a geometria de adsorção. A simetria mais provável para (bi)sulfato em Pt(111) é a C3v, devido à boa correlação entre as distâncias oxigênio-oxigênio e os átomos de Pt no empacotamento hexagonal da face (111).16,69 Para Pt(110) e Pt(100) a adsorção via três átomos de oxigênio não é permitida e a adsorção via dois oxigênios se torna preferencial.15,68,69 De fato, em estudos com radiotraçadores,13 foi mostrada a vantagem estrutural da superfície de Pt(111) na adsorção de (bi)sulfato com respeito a Pt(100), o que explica a maior concentração superficial de ânions em Pt(111). ÍONS FOSFATO (PO43-), ACETATO (CH3COO-) e TETRAFLUOROBORATO (BF4-) A complexidade destes sistemas com mais do que uma dissociação e diferentes equilíbrios ácido-base em solução e, possivelmente, junto à superfície do eletrodo, requerem um cuidado especial na escolha das condições experimentais, como tem sido reportado em diversos trabalhos.15,96 As condições do equilíbrio ácido-base junto à superfície do eletrodo de Pt(111) são pouco convencionais, podendo adsorver espécies que, em meio ácido, não existem.97,98 Este resultado levaria à hipótese já sustentada anteriormente16 de que em Pt(111) o íon sulfato encontra-se completamente dissociado. Na Figura 5 estão presentes os voltamogramas cíclicos de Pt(111) na ausência e presença de íons fosfato. Ao comparar esses dois voltamogramas é possível ver claramente a região de estados não-usuais deslocados para potenciais mais negativos na presença de 0,1 mol L-1 de fosfato. A força de adsorção desse íon em Pt(111) é comparada à do íon sulfato, no entanto, por apresentar pelo menos três possíveis formas dissociadas em solução, os estudos que tratam desse ânion são sempre realizados na presença de pH bastante controlado, fato que o pico largo e reversível por volta de 0,45 V (pH<1, veja Figura 5) se desloca para potenciais mais positivos com o aumento do pH.96,99,100 A partir de resultados de infravermelho96 foi observado que, em valores de pH inferiores a 5, H2PO4- é a espécie predominante e, com o aumento do potencial, essa espécie tende a se dissociar a HPO42-. Realmente, estudos termodinâmicos para várias concentrações de fosfato em solução de 0,1 mol L-1 HClO4 corroboram este resultado mostrando que o número de carga parcial formal é próxima de 2, o que sugere que, nestas condições, a espécie adsorvida é o hidrogenofosfato.97
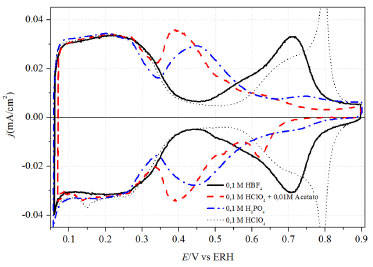 Figura 5. Voltamogramas cíclicos de Pt(111) na presença de diferentes ânions: 0,1 mol L-1 HBF4 (preto), 0,1 mol L-1 HClO4 + 0,01 mol L-1 acetato de sódio (vermelho), 0,1 mol L-1 H3PO4 (azul ) e 0,1 mol L-1 HClO4 (tracejado). Velocidade de Varredura: 50 mV s-1
Já o ânion acetato, que desperta um interesse especial por ser um importante subproduto da oxidação de etanol em platina,101,102 é um ânion que se adsorve sobre Pt com relativa força de adsorção e os mecanismos reacionais que envolvem a formação de ácido acético não são considerados favoráveis, uma vez que essas espécies não podem ser eletroxidadas. O ânion acetato em solução ácida se encontra majoritariamente em forma neutra (CH3COOH), o que pode deixar a discussão menos complicada se comparado a ânions com vários estados de ionização (sulfato e fosfato). A partir do voltamograma presente na Figura 5 é possível inferir, com base nos argumentos discutidos até agora, que a região de estados não-usuais é perturbada na presença de íons acetato, com comportamento bastante similar ao do fosfato. Fica confirmado que os estados não-usuais se mostram deslocados para potenciais mais negativos quando comparado com o voltamograma na presença apenas de íons perclorato. De fato, a presença de um íon com adsorção específica tende a deslocar os estados não-usuais para potenciais inferiores, e esta dependência está relacionada com a força de adsorção do ânion. No entanto, para se obter informações diretas a respeito da natureza do ânion adsorvido, alguns estudos foram realizados com ajuda de técnicas espectroscópicas como ATR SEIRAS101,103 e FTIRRAS.104,105 Shin et al.106 notou que o acetato se adsorve sobre superfícies de Pt(111) e Pt(335) durante a eletroxidação de etanol. O mesmo foi observado por Iwasita e colaboradores107 para uma banda de baixa intensidade por volta de 1402 cm-1, que foi relacionada com acetato adsorvido. Mais recentemente, estudos utilizando espectroscopia de geração de fótons de frequência soma (SFG) sugeriram que a formação da camada de adsorbatos na presença de acetato é menos ordenada que em Au, indicando que há uma camada de água interfacial que separa o eletrodo de platina e a camada de acetato.108 Esta camada seria formada pela primeira esfera de solvatação do íon acetato. Os autores também fazem uma correlação com resultados teóricos109 mostrando que íons em água podem compartilhar sua carga com toda a esfera de solvatação que o envolve, o que poderia levar à adsorção da espécie acetato junto com a sua camada de solvatação na superfície do eletrodo. O mesmo não ocorreria sobre superfície de Au, ao qual o ânion acetato estaria adsorvido pelos dois oxigênios (bidentado). Ao contrário de ânions que se adsorvem especificamente, para aqueles que não se coordenam à superfície o perfil voltamétrico (formato borboleta) revela contribuições nos estados não-usuais relacionado a adsorção de OH, como é visto para ácido perclórico, ácido fluorídrico7,34,35,110 e ácido trifluorometanosulfônico (HCF3SO3).36 Já o ânion tetrafluoroborato (BF4-) despertou algum interesse da comunidade eletroquímica nos últimos anos por possui caráter similar ao perclorato quando considerada a dispersão de carga negativa sobre todo o ânion. Alguns trabalhos utilizaram o BF4- como eletrólito suporte para experimentos, utilizando eletrodos policristalinos de platina.111-113 No entanto, o comportamento deste íon foi pouco estudado sobre eletrodos monocristalinos de platina. Angelucci et al.114 publicaram resultados mostrando o perfil voltamétrico de Pt(111), Pt(100) e Pt(110) na presença de BF4- em diferentes concentrações. Como mostra a Figura 5, o ânion BF4- se adsorve em Pt(111) com força suficiente para suprimir parte das características presentes no voltamograma obtido em presença de ácido perclórico. A adsorção desse ânion, no entanto, ocorre em uma extensão muito inferior que os relatados para outros ânions, como sulfato, acetato ou fosfato (veja Figura 1 e Figura 5). Em Pt(100) os resultados mostraram pouca influência do ânion BF4- no voltamograma em ácido perclórico. Dessa forma, a adsorção de tetrafluoroborato em platina pode ser considerada como um exemplo limite para uma pequena perturbação no comportamento observado para perclorato, fluoreto e trifluorometanosulfonato. Santos et al.,113 utilizando microbalança de quartzo, suportaram os resultados apresentados anteriormente bem como a utilização de ânion BF4- como eletrólito na oxidação de ácido fórmico. HALETOS (F-, Cl-, Br-, I-) A adsorção de haletos em metais monocristalinos é um exemplo modelar de competição entre as interações adsorbato/metal e adsorbato/adsorbato. Devido à sua fraca esfera de solvatação, esses ânions se adsorvem facilmente em superfícies metálicas, particularmente em potenciais mais positivos que o pctz.115 Os haletos são de longe a classe mais estudada de ânions que se adsorvem especificamente. Não somente devido à sua simplicidade estrutural (monoatômico e monovalente), mas também devido à importância fundamental em eletroquímica interfacial. Os haletos tem papel fundamental na análise da cinética de outros processos de adsorção que possam ocorrer simultaneamente, como deposição UPD de hidrogênio em metais,12,116 oxidação de monóxido de carbono28,117,118 e outros processos eletroquímicos.119,120 Um fato marcante que diz respeito ao Br- e ao I- adsorvidos em platina é que a camada de adsorbato formada é estável sob distintas condições experimentais e pode ser formada tanto pelo contato em soluções contendo esses ânions como pela exposição na sua fase vapor. O comportamento eletroquímico em eletrólitos suporte livres de sais desses haletos é o mesmo, independente do procedimento utilizado para a sua formação.121,122 Para os haletos, o grau da força da adsorção específica segue a ordem crescente de F-<Cl-<Br-< I-, refletindo o decréscimo da energia de solvatação dessas espécies;123 sendo o íon fluoreto considerado um adsorbato sem adsorção específica. A forte interação entre os haletos (Cl-<Br-<I-) e a superfície de platina formada durante a adsorção específica dos mesmos envolve a redistribuição da carga eletrônica do ânion para a superfície eletródica, um efeito conhecido como transferência parcial de carga.124 Nos estudos de adsorção de cloreto e brometo em Pt(111) o valor encontrado para o número de carga parcial formal está na ordem de lX- = -1 para ambas as espécies,23,52,125-127 em potenciais superiores a 0,4 V vs. ERH. Para potenciais abaixo de 0,3 V vs. ERH, região na qual o processo de adsorção de hidrogênio começa a ocorrer, os valores de lX- diminuem, indicando uma forte competição entre ânion e hidrogênio pelos sítios superficiais. Assim, a adsorção de hidrogênio passa a contribuir para a carga total medida durante o processo. O intervalo de potencial no qual a adsorção de cloreto ocorre é mais positivo que para o brometo e a sobreposição com a região de adsorção de hidrogênio é menos significante neste caso. Como resultado, lCl- ≈ -1 situa-se num intervalo mais amplo de potencial, 0,3 V a 0,65 V vs. ERH.52,125 As mudanças no número de carga parcial formal (lX-) podem também ser interpretadas em termos do dipolo formado entre o ânion adsorvido e a carga imagem produzida na superfície eletródica devido à polaridade da ligação metal/adsorbato.115,128 Para cloreto e brometo adsorvidos, o valor de lX- = -1 aponta que o dipolo formado é próximo de zero, indicando que a adsorção desses ânions sobre Pt(111) está associada à redistribuição da carga, de modo que as espécies podem ser consideradas como o átomo da espécie adsorvida. Esses resultados ficam facilmente visualizados na Figura 6 onde estão representados os voltamogramas cíclicos de Pt(111) na presença dos íons cloreto e brometo. Nota-se claramente uma simetria entre a varredura catódica e anódica, indicando uma considerável reversibilidade dos fenômenos de adsorção/dessorção. No voltamograma cíclico de Pt(111) em 0,1 mol L-1 HClO4, enquanto a região de adsorção de hidrogênio não é afetada pela presença dos ânions perclorato, ânions como cloreto e brometo levam à aparição de estados não-usuais de adsorção nessa região (> 0,35 V). Neste caso, a sobreposição de processos revela a competição pelos sítios livres superficiais entre ambas as reações.
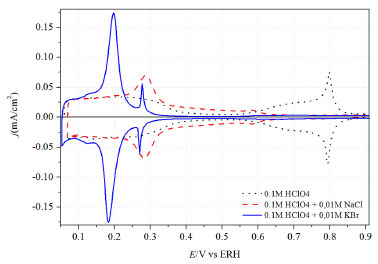 Figura 6. Voltamogramas cíclicos de Pt(111) na presença de diferentes ânions: 0,1 mol L-1 HClO4 (preto), 0,1 mol L-1 HClO4 + 0,01 mol L-1 NaCl (vermelho), 0,1 mol L-1 HClO4 + 0,01 mol L-1KBr (azul). Velocidade de Varredura: 50 mV s-1
Além do uso da voltametria cíclica, um grande número de técnicas ex situ sensíveis à estrutura superficial como AES (Auger Electron Spectroscopy),129 LEED (Low Energy Electron Diffraction),129-131 espalhamento de raios-X116,118,131-133 e microscopia eletrônica de tunelamento (STM, do inglês Scanning Tunneling Microscopy)134-139 foram também empregadas para obter informações estruturais sobre haletos adsorvidos em Pt. Os estudos empregando as técnicas citadas mostraram que, dentro de um intervalo de potencial, camadas ordenadas desses ânions são formadas sobre a superfície de Pt. Em geral, os resultados obtidos pelos vários grupos e diferentes técnicas estão em boa concordância. Em Pt(111), os haletos formam predominantemente camadas empacotadas hexagonalmente, refletindo que as interações laterais entres os adsorbatos ocorrem isotopicamente. Estruturalmente, as camadas de adsorbato formadas por brometo ou iodeto sobre Pt(111) são bastante similares. Para o iodeto, duas estruturas são observadas, (√7×√7)R19.1º e (3×3),140-142 sendo que a última possui uma cobertura ligeiramente superior e é formada em potenciais mais positivos. Uma estrutura muito similar é também encontrada para adsorção de brometo em Pt(111), classificada como uma formação (3×3). A célula unitária desta estrutura contém 4 átomos de brometo/iodeto sobre 9 átomos de Pt, levando a uma cobertura de 4/9 da superfície (θBr=4/9).116,132-136,141-143 Em baixos potenciais, o íon cloreto não forma uma camada compacta ordenada e nenhuma estrutura de longa ordem sobre Pt(111).140 Para a superfície de Pt(100), os estudos a respeito da adsorção de adsorbatos não são tão abundantes comparados com Pt(111)144. Estudos utilizando STM em Pt(100) foram apresentados para adsorção de CO e iodeto145 e em condições in situ.138,139,146,147 No caso do iodeto, duas estruturas foram observadas, (√2×5√2)R45º139,145-147 em potenciais mais positivos (1 V) e (√2×√2)145-147 em potenciais mais baixos (0,5 V). Com respeito à adsorção de brometo em Pt(100), Bittner et al.135 relataram a existência de apenas uma estrutura superficial parcialmente ordenada, enquanto que Orts et al.137 mostraram estruturas ordenadas descritas como (3×4) - 6Br (θBr=0,5). Para superfícies escalonadas, onde há uma variação da densidade de sítios monocristalinos, Garcia-Araez et al.,127 utilizando diferentes eletrodos monocristalinos de platina de orientação Pt(2n-1, 1, 1) e Pt(n,1,0), mostraram que sobre essas superfícies a formação de uma estrutura ordenada de brometo se apresenta na forma de c(2×2) com cobertura (θBr=0,5). A diferença na estrutura foi analisada pelas diferentes interações entre as espécies adsorvidas nessas superfícies, já que diferentes orientações de sítios superficiais levam a diferentes energias de adsorção. A Tabela 1 apresenta, de forma compactada, as metodologias utilizadas em trabalhos já reportados na literatura para estudar a influência de ânions sobre eletrodos de platina.
CONCLUSÃO As informações apresentadas neste trabalho mostram que os ânions possuem um papel fundamental na compreensão dos processos eletródicos que caracterizam a interface eletrodo/solução. Tais processos se mostram evidentes nos perfis voltamétricos de diferentes superfícies quando estes ânions estão presentes no eletrólito suporte. O intervalo de potencial de aparição dos estados anômalos de adsorção reflete a força de adsorção dos ânions sobre o eletrodo; enquanto que para o perclorato (cuja adsorção é fraca ou inexistente) os estados não-usais aparecem em potenciais mais altos, ânions como haletos e sulfato (que se adsorvem fortemente à superfície) apresentam estados anômalos que se sobrepõem à região de hidrogênio. No caso específico dos eletrodos monocristalinos, a sua especificidade na geometria superficial proporciona a obtenção de dados termodinâmicos e espectroscópicos que auxiliam na composição do conhecimento eletroquímico moderno.
AGRADECIMENTOS Este trabalho foi financiado pela FAPESP (2013/13749-0) e CNPq (Universal 2013 - 474590/2013-5). Agradecemos ao Prof. J. M. Feliu pelos comentários e contribuições ao trabalho.
REFERÊNCIAS E NOTAS 1. Clavilier, J.; Faure, R.; Guinet, G.; Durand, R.; J. Electroanal. Chem. 1980, 360, 325. DOI: http://dx.doi.org/10.1016/0022-0728(93)87025-Q 2. Clavilier, J.; J. Electroanal. Chem. 1980, 107, 211. DOI: http://dx.doi.org/10.1016/S0022-0728(79)80023-6 3. Clavilier, J.; Durand, R.; Guinet, G.; Faure, R.; J. Electroanal. Chem. 1981, 127, 281. DOI: http://dx.doi.org/10.1016/S0022-0728(81)80488-3 4. Jerkiewicz, G.; Electrocatalysis 2010, 1, 179. DOI: http://dx.doi.org/10.1007/s12678-010-0016-z 5. Christmann, K.; Ertl, G.; Pignet, T.; Surf. Sci. 1976, 54, 365. DOI: http://dx.doi.org/10.1016/0039-6028(76)90232-6 6. Markovic, N. M.; Schmidt, T. J.; Grgur, B. N.; Gasteiger, H. A.; Behm, R. J.; Ross, P. N.; J. Phys. Chem. B 1999, 103, 8568. DOI: http://dx.doi.org/10.1021/jp991826u 7. Wagner, F. T.; Ross Jr., P. N.; J. Electroanal. Chem. Interfacial Electrochem. 1988, 250, 301. DOI: http://dx.doi.org/10.1016/0022-0728(88)85172-6 8. Aberdam, D.; Durand, R.; Faure, R.; El-Omar, F.; Surf. Sci. 1986, 171, 303. DOI: http://dx.doi.org/10.1016/0167-2584(86)91147-3 9. Jaaf-Golze, K. A.; Kolb, D. M.; Scherson, D.; J. Electroanal. Chem. 1986, 200, 353. DOI: http://dx.doi.org/10.1016/0022-0728(86)90067-7 10. Scherson, D. A.; Kolb, D. M.; Electroanal. Chem. Interf. Electrochem. 1984, 176, 353. DOI: http://dx.doi.org/10.1016/S0022-0728(84)80330-7 11. Adzic, R. R.; Feddrix, F.; Nikolic, B. Z.; Yeager, E.; J. Electroanal. Chem. 1992, 341, 287. DOI: http://dx.doi.org/10.1016/0022-0728(92)80489-Q<, /p> 12. Garcia-Araez, N.; Lukkien, J. J.; Koper, M. T. M.; Feliu, J. M.; J. Electroanal. Chem. 2006, 588, 1. DOI: http://dx.doi.org/10.1016/j.jelechem.2005.11.034 13. Gamboa-Aldeco, M. E.; Herrero, E.; Zelenay, P. S.; Wieckowski, A.; J. Electroanal. Chem. 1993, 348, 451. DOI: http://dx.doi.org/10.1016/0022-0728(93)80151-7 14. Kolics, A.; Wieckowski, A.; J. Phys. Chem. B 2001, 105, 2588. DOI: http://dx.doi.org/10.1021/jp003536f 15. Iwasita, T.; Nart, F. C.; Rodes, A.; Pastor, E.; Weber, M.; Electrochim. Acta 1995, 40, 53. DOI: http://dx.doi.org/10.1016/0013-4686(94)00239-W 16. Nart, F. C.; Iwasita, T.; Weber, M.; Electrochim. Acta 1994, 39, 961. DOI: http://dx.doi.org/10.1016/0013-4686(94)85113-1 17. Shingaya, Y.; Ito, M.; Chem. Phys. Lett. 2001, 340, 425. DOI: http://dx.doi.org/10.1016/S0009-2614(01)00374-8 18. Braunschweig, B.; Daum, W.; Langmuir 2009, 25, 11112. DOI: http://dx.doi.org/10.1021/la901399j PMID: 19456179 19. Friebel, D.; Broekmann, P.; Wandelt, K.; physica status solidi (a) 2004, 201, 861. DOI: http://dx.doi.org/10.1002/pssa.200304371 20. Itaya, K.; Prog. Surf. Sci. 1998, 58, 121. DOI: http://dx.doi.org/10.1016/S0079-6816(98)00022-7 21. Souza-Garcia, J.; Climent, V.; Feliu, J. M.; Electrochem. Commun. 2009, 11, 1515. DOI: http://dx.doi.org/10.1016/j.elecom.2009.05.044 22. Chen, Q.-S.; Solla-Gullon, J.; Sun, S.-G.; Feliu, J. M.; Electrochim. Acta 2010, 55, 7982. DOI: http://dx.doi.org/10.1016/j.electacta.2010.03.050 23. Orts, J. M.; Gómez, R.; Feliu, J. M.; Aldaz, A.; Clavilier, J.; Electrochim. Acta 1994, 39, 1519. DOI: http://dx.doi.org/10.1016/0013-4686(94)85129-8 24. Abruña, H. D.; Feliu, J. M.; Brock, J. D.; Buller, L. J.; Herrero, E.; Li, J.; Gómez, R.; Finnefrock, A.; Electrochim. Acta 1998, 43, 2899. DOI: http://dx.doi.org/10.1016/S0013-4686(98)00030-9 25. Kuzume, A.; Herrero, E.; Feliu, J. M.; J. Electroanal. Chem. 2007, 599, 333. DOI: http://dx.doi.org/10.1016/j.jelechem.2006.05.006 26. Souza-Garcia, J.; Ticianelli, E. A.; Climent, V.; Feliu, J. M.; Electrochim. Acta 2009, 54, 2094. DOI: http://dx.doi.org/10.1016/j.electacta.2008.08.059 27. Tanaka, A.; Adzic, R.; Nikolic, B.; J. Serb. Chem. Soc. 1999, 64, 695. 28. Angelucci, C. A.; Nart, F. C.; Herrero, E.; Feliu, J. M.; Electrochem. Commun. 2007, 9, 1113. DOI: http://dx.doi.org/10.1016/j.elecom.2007.01.012 29. Rodríguez-López, M.; Solla-Gullón, J.; Herrero, E.; Tuñón, P.; Feliu, J. M.; Aldaz, A.; Carrasquillo Jr, A.; J. Am. Chem. Soc. 2010, 132, 2233. DOI: http://dx.doi.org/10.1021/ja909082s PMID: 20121124 30. Santos, V. P.; Tremiliosi Filho, G.; Quim. Nova 2001, 24, 856. DOI: http://dx.doi.org/10.1590/S0100-40422001000600024 31. http://surfexp.fhi-berlin.mpg.de/SXinput.html, acessada em Dezembro 2014 32. Strauss, S. H.; Chem. Rev. 1993, 93, 927. DOI: http://dx.doi.org/10.1021/cr00019a005 33. Calvente, J. J.; Marinkovic, N. S.; Kovacova, Z.; Fawcett, W. R.; J. Electroanal. Chem. 1997, 421, 49. DOI: http://dx.doi.org/10.1016/S0022-0728(96)04857-7 34. Markovic, N.; Hanson, M.; McDougall, G.; Yeager, E.; J. Electroanal. Chem. 1986, 214, 555. DOI: http://dx.doi.org/10.1016/0022-0728(86)80124-3 35. Yau, S. L.; Itaya, K.; Colloids Surf., A 1998, 134, 21. DOI: http://dx.doi.org/10.1016/S0927-7757(97)00309-9 36. Berná, A.; Feliu, J. M.; Gancs, L.; Mukerjee, S.; Electrochem. Commun. 2008, 10, 1695. DOI: http://dx.doi.org/10.1016/j.elecom.2008.08.042 37. O termo (bi)sulfato aqui utilizado refere-se aos ânions bissulfato (HSO4-) e sulfato (SO42-) que podem estar presentes na superfície do eletrodo. Maiores detalhes sobre essa diferenciaçao serao apresentados nos parágrafos seguintes. 38. Howard, S. T.; Attard, G. A.; Lieberman, H. F.; Chem. Phys. Lett. 1995, 238, 180. DOI: http://dx.doi.org/10.1016/0009-2614(95)00335-5 39. Olivera, P. P.; Parito, E. M.; Sellers, H. In Interfacial electrochemistry: theory, experiment, and applications; Wieckowski, A., ed.; Marcel-Dekker: New York, 1999, p 63. 40. Clavilier, J.; Albalat, R.; Gomez, R.; Orts, J. M.; Feliu, J. M.; Aldaz, A.; J. Electroanal. Chem. 1992, 330, 489. DOI: http://dx.doi.org/10.1016/0022-0728(92)80326-Y 41. Climent, V.; Gómez, R.; Feliu, J. M.; Electrochim. Acta 1999, 45, 629. DOI: http://dx.doi.org/10.1016/S0013-4686(99)00241-8 42. Climent, V.; Gómez, E.; Orts, J. M.; Feliu, J. M. In Hydrogen at surface and interfaces; Jerkiewicz, G.; Feliu, J. M.; Popov, B. N., eds.; The Electrochemical Society: Pennington, NJ, 2000; Vol. 2000-16. 43. Sibert, E.; Faure, R.; Durand, R.; J. Electroanal. Chem. 2002, 528, 39. DOI: http://dx.doi.org/10.1016/S0022-0728(02)00841-0 44. Garcia-Araez, N.; Climent, V.; Rodriguez, P.; Feliu, J. M.; Electrochim. Acta 2008, 53, 6793. DOI: http://dx.doi.org/10.1016/j.electacta.2007.12.086 45. Sawatari, Y.; Inukai, J.; Ito, M.; J. Electron Spectrosc. Relat. Phenom. 1993, 64-65, 515. DOI: http://dx.doi.org/10.1016/0368-2048(93)80117-5 46. Pirug, G.; Bonzel, H. P.; Surf. Sci. 1998, 405, 87. DOI: http://dx.doi.org/10.1016/S0039-6028(98)00055-7 47. Markinovic, N. S.; Fawcett, W. R.; Wang, J. X.; Adzic, R. R.; J. Phys. Chem. 1995, 99, 17490. DOI: http://dx.doi.org/10.1021/j100049a003 48. Koper, M. T. M.; Lukkien, J. J.; J. Electroanal. Chem. 2000, 485, 161. DOI: http://dx.doi.org/10.1016/S0022-0728(00)00109-1 49. Alvarez, B.; Feliu, J. M.; Clavilier, J.; Electrochem. Commun. 2002, 4, 379. DOI: http://dx.doi.org/10.1016/S1388-2481(02)00315-6 50. Hamm, U. W.; Kramer, D.; Zhai, R. S.; Kolb, D. M.; J. Electroanal. Chem. 1996, 414, 85. DOI: http://dx.doi.org/10.1016/0022-0728(96)01006-6 51. Climent, V.; Gómez, R.; Orts, J. M.; Feliu, J. M.; J. Phys. Chem. B 2006, 110, 11344. DOI: http://dx.doi.org/10.1021/jp054948x PMID: 16771405 52. Garcia-Araez, N.; Climent, V.; Herrero, E.; Feliu, J.; Lipkowski, J.; J. Electroanal. Chem. 2006, 591, 149. DOI: http://dx.doi.org/10.1016/j.jelechem.2006.04.008 53. Michaelides, A.; Ranea, V. A.; De Andres, P. L.; King, D. A.; Phys. Rev. Lett. 2003, 90, 2161021. 54. Wilke, S.; Natoli, V.; Cohen, M. H.; J. Chem. Phys. 2000, 112, 9986. DOI: http://dx.doi.org/10.1063/1.481645 55. Michaelides, A.; Hu, P.; J. Am. Chem. Soc. 2001, 123, 4235. DOI: http://dx.doi.org/10.1021/ja003576x PMID: 11457189 56. Nagy, Z.; You, H.; Electrochim. Acta 2002, 47, 3037. DOI: http://dx.doi.org/10.1016/S0013-4686(02)00223-2 57. Clay, C.; Haq, S.; Hodgson, A.; Phys. Rev. Lett. 2004, 92, 461021. 58. Held, G.; Clay, C.; Barrett, S. D.; Haq, S.; Hodgson, A.; J. Chem. Phys. 2005, 123, 1. 59. Ranea, V. A.; Michaelides, A.; Ramirez, R.; De Andres, P. L.; Vergas, J. A.; King, D. A.; Phys. Rev. Lett. 2004, 92, 136104. DOI: http://dx.doi.org/10.1103/PhysRevLett.92.136104 PMID: 15089633 60. Vassilev, P.; Louwerse, M. J.; Baerends, E. J.; Chem. Phys. Lett. 2004, 398, 212. DOI: http://dx.doi.org/10.1016/j.cplett.2004.09.056 61. Vassilev, P.; Louwerse, M. J.; Baerends, E. J.; J. Phys. Chem. B 2005, 109, 23605. DOI: http://dx.doi.org/10.1021/jp044751p PMID: 16375337 62. Arenz, M.; Stamenkovic, V.; Schmidt, T. J.; Wandelt, K.; Ross, P. N.; Markovic, N. M.; Surf. Sci. 2003, 523, 199. DOI: http://dx.doi.org/10.1016/S0039-6028(02)02456-1 63. Markovic, N.; Ross, P. N.; J. Electroanal. Chem. 1992, 330, 499. DOI: http://dx.doi.org/10.1016/0022-0728(92)80327-Z 64. Markovic, N. M.; Schmidt, T. J.; Grgur, B. N.; Gasteiger, H. A.; Behm, R. J.; Ross, P. N.; J. Phys. Chem. B 1999, 103, 8568. DOI: http://dx.doi.org/10.1021/jp991826u 65. Berná, A.; Climent, V.; Feliu, J. M.; Electrochem. Commun. 2007, 9, 2789. DOI: http://dx.doi.org/10.1016/j.elecom.2007.09.018 66. Clavilier, J.; El Achi, K.; Rodes, A.; Chem. Phys. 1990, 141, 1. DOI: http://dx.doi.org/10.1016/0301-0104(90)80014-O 67. Rodes, A.; El Achi, K.; Zamakhchari, M. A.; Clavilier, J.; J. Electroanal. Chem. 1990, 284, 245. DOI: http://dx.doi.org/10.1016/0022-0728(90)87077-W 68. Markovic, N. M.; Marinkovic, N. S.; Adzic, R. R.; J. Electroanal. Chem. 1988, 241, 309. DOI: http://dx.doi.org/10.1016/0022-0728(88)85134-9 69. Markovic, N. M.; Marinkovic, N. S.; Adzic, R. R.; J. Electroanal. Chem. 1991, 314, 289. DOI: http://dx.doi.org/10.1016/0022-0728(91)85443-S 70. Funtikov, A. M.; Stimming, U.; Vogel, R.; J. Electroanal. Chem. 1997, 428, 147. DOI: http://dx.doi.org/10.1016/S0022-0728(96)05051-6 71. Funtikov, A. M.; Linke, U.; Stimming, U.; Vogel, R.; Surf. Sci. 1995, 324, L343. DOI: http://dx.doi.org/10.1016/0039-6028(94)00774-8 72. Wan, L. J.; Suzuki, T.; Sashikata, K.; Okada, J.; Inukai, J.; Itaya, K.; J. Electroanal. Chem. 2000, 484, 189. DOI: http://dx.doi.org/10.1016/S0022-0728(00)00082-6 73. Kim, Y. G.; Soriaga, J. B.; Vigh, G.; Soriaga, M. P.; J. Colloid Interface Sci. 2000, 227, 505. DOI: http://dx.doi.org/10.1006/jcis.2000.6889 PMID: 10873339 74. Sato, K.; Yoshimoto, S.; Inukai, J.; Itaya, K.; Electrochem. Commun. 2006, 8, 725. DOI: http://dx.doi.org/10.1016/j.elecom.2006.03.001 75. Wan, L. J.; Yau, S. L.; Swain, G. M.; Itaya, K.; J. Electroanal. Chem. 1995, 381, 105. DOI: http://dx.doi.org/10.1016/0022-0728(94)03696-Z 76. Savich, W.; Sun, S. G.; Lipkowski, J.; Wieckowski, A.; J. Electroanal. Chem. 1995, 388, 233. DOI: http://dx.doi.org/10.1016/0022-0728(95)03987-R 77. Herrero, E.; Mostany, J.; Feliu, J. M.; Lipkowski, J.; J. Electroanal. Chem. 2002, 534, 79. DOI: http://dx.doi.org/10.1016/S0022-0728(02)01101-4 78. Koper, M. T. M.; Lukkien, J. J.; Surf. Sci. 2002, 498, 105. DOI: http://dx.doi.org/10.1016/S0039-6028(01)01681-8 79. Faguy, P. W.; Marinkovic, N. S.; Adzic, R. R.; Langmuir 1996, 12, 243. DOI: http://dx.doi.org/10.1021/la950115u 80. Cuesta, A.; Kleinert, M.; Kolb, D. M.; Phys. Chem. Chem. Phys. 2000, 2, 5684. DOI: http://dx.doi.org/10.1039/b006464p 81. Lachenwitzer, A.; Li, N.; Lipkowski, J.; J. Electroanal. Chem. 2002, 532, 85. DOI: http://dx.doi.org/10.1016/S0022-0728(02)00759-3 82. Shingaya, Y.; Ito, M.; J. Electroanal. Chem. 1999, 467, 299. DOI: http://dx.doi.org/10.1016/S0022-0728(99)00085-6 83. Shingaya, Y.; Ito, M.; Surf. Sci. 1997, 386, 34. DOI: http://dx.doi.org/10.1016/S0039-6028(97)00310-5 84. Su, Z.; Climent, V.; Leitch, J.; Zamlynny, V.; Feliu, J. M.; Lipkowski, J.; Phys. Chem. Chem. Phys., 12, 15231. DOI: http://dx.doi.org/10.1039/c0cp00860e PMID: 21046024 85. Nart, F. C.; Iwasita, T.; Weber, M.; Electrochim. Acta 1994, 39, 2093. DOI: http://dx.doi.org/10.1016/0013-4686(94)85094-1 86. Iwasita, T.; Nart, F. C.; Prog. Surf. Sci. 1997, 55, 271. DOI: http://dx.doi.org/10.1016/S0079-6816(97)00032-4 87. Garcia-Araez, N.; Climent, V.; Rodriguez, P.; Feliu, J. M.; Langmuir 2010, 26, 12408. DOI: http://dx.doi.org/10.1021/la101112b PMID: 20524623 88. García, N.; Climent, V.; Orts, J. M.; Feliu, J. M.; Aldaz, A.; ChemPhysChem 2004, 5, 1221. DOI: http://dx.doi.org/10.1002/cphc.200400047 PMID: 15446746 89. Souza-Garcia, J.; Angelucci, C. A.; Climent, V.; Feliu, J. M.; Electrochem. Commun. 2013, 34, 291. DOI: http://dx.doi.org/10.1016/j.elecom.2013.07.007 90. Rodes, A.; Clavilier, J.; Orts, J. M.; Feliu, J. M.; Aldaz, A.; J. Electroanal. Chem. 1992, 338, 317. DOI: http://dx.doi.org/10.1016/0022-0728(92)80431-3 91. Clavilier, J.; Orts, J. M.; Gómez, E.; Feliu, J. M.; Aldaz, A. In Electrochemistry and Materials Science of Cathodic Hydrogen Absorption and Adsorption; Conway, B. E.; Jerkiewicz, G., eds.; The Electrochemical Society: Pennington, NJ, 1994; Vol. 94-21. 92. Cuesta, A.; Surf. Sci. 2004, 572, 11. DOI: http://dx.doi.org/10.1016/j.susc.2004.08.014 93. Garcia-Araez, N.; Climent, V.; Feliu, J.; J. Phys. Chem. C 2009, 113, 9290. DOI: http://dx.doi.org/10.1021/jp900792q 94. Petrii, O. A.; Russ. J. Electrochem. 2013, 49, 401. DOI: http://dx.doi.org/10.1134/S1023193513050145 95. Mostany, J.; Herrero, E.; Feliu, J. M.; Lipkowski, J.; J. Phys. Chem. B 2002, 106, 12787. DOI: http://dx.doi.org/10.1021/jp026561p 96. Weber, M.; Nart, F. C.; De Moraes, I. R.; Iwasita, T.; J. Phys. Chem. 1996, 100, 19933. DOI: http://dx.doi.org/10.1021/jp960952k 97. Mostany, J.; Martínez, P.; Climent, V.; Herrero, E.; Feliu, J. M.; Electrochim. Acta 2009, 54, 5836. DOI: http://dx.doi.org/10.1016/j.electacta.2009.05.040 98. Berna, A.; Rodes, A.; Feliu, J. M.; Illas, F.; Gil, A.; Clotet, A.; Ricart, J. M.; J. Phys. Chem. B 2004, 108, 17928. DOI: http://dx.doi.org/10.1021/jp048082r 99. Ye, S.; Kita, H.; Aramata, A.; J. Electroanal. Chem. 1992, 333, 299. DOI: http://dx.doi.org/10.1016/0022-0728(92)80398-N 100. Gisbert, R.; García, G.; Koper, M. T. M.; Electrochim. Acta 2010, 55, 7961. DOI: http://dx.doi.org/10.1016/j.electacta.2010.04.009 101. Shao, M. H.; Adzic, R. R.; Electrochim. Acta 2005, 50, 2415. DOI: http://dx.doi.org/10.1016/j.electacta.2004.10.063 102. Colmati, F.; Tremiliosi-Filho, G.; Gonzalez, E. R.; Berná, A.; Herrero, E.; Feliu, J. M.; Phys. Chem. Chem. Phys. 2009, 11, 9114. DOI: http://dx.doi.org/10.1039/b907250k PMID: 19812831 103. Delgado, J. M.; Blanco, R.; Orts, J. M.; Perez, J. M.; Rodes, A.; J. Phys. Chem. C 2009, 113, 989. DOI: http://dx.doi.org/10.1021/jp807014f 104. Domke, K.; Herrero, E.; Rodes, A.; Feliu, J. M.; J. Electroanal. Chem. 2003, 552, 115. DOI: http://dx.doi.org/10.1016/S0022-0728(02)01471-7 105. Rodes, A.; Pastor, E.; Iwasita, T.; J. Electroanal. Chem. 1994, 376, 109. DOI: http://dx.doi.org/10.1016/0022-0728(94)03585-7 106. Shin, J.; Tornquist, W. J.; Korzeniewski, C.; Hoaglund, C. S.; Surf. Sci. 1996, 364, 122. DOI: http://dx.doi.org/10.1016/0039-6028(96)00615-2 107. Iwasita, T.; Pastor, E.; Electrochim. Acta 1994, 39, 531. DOI: http://dx.doi.org/10.1016/0013-4686(94)80097-9 108. Braunschweig, B.; Mukherjee, P.; Kutz, R. B.; Wieckowski, A.; Dlott, D. D. ; J. Chem. Phys. 2010, 133. PMID: 21186879 109. Dal Peraro, M.; Raugei, S.; Carloni, P.; Klein, M. L.; ChemPhysChem 2005, 6, 1715. DOI: http://dx.doi.org/10.1002/cphc.200500039 PMID: 16080223 110. Wagner, F. T.; Ross Jr., P. N.; J. Electroanal. Chem. 1983, 150, 141. DOI: http://dx.doi.org/10.1016/S0022-0728(83)80198-3 111. Santos, M. C.; Miwa, D. W.; Machado, S. A. S.; Electrochem. Commun. 2000, 2, 692. DOI: http://dx.doi.org/10.1016/S1388-2481(00)00102-8 112. Kumara Swamy, B. E.; Schell, M.; J. Phys. Chem. B 2006, 110, 5139. DOI: http://dx.doi.org/10.1021/jp055843x PMID: 16526758 113. Santos, A. L.; Nagao, R.; Oliveira, C. P.; de Lima, R. B.; Varela, H.; J. Electroanal. Chem. 2011, 660, 147. DOI: http://dx.doi.org/10.1016/j.jelechem.2011.06.023 114. Angelucci, C. A.; Souza-Garcia, J.; Herrero, E.; Feliu, J. M.; J. Electroanal. Chem. 2010, 646, 100. DOI: http://dx.doi.org/10.1016/j.jelechem.2010.03.017 115. Schmickler, W.; Interfacial electrochemistry, Oxford University Press: New York, Oxford, 1996. 116. Lucas, C. A.; Markovic, N. M.; Tidswell, I. M.; Ross, P. N.; Physica B 1996, 221, 245. DOI: http://dx.doi.org/10.1016/0921-4526(95)00933-7 117. López-Cudero, A.; Cuesta, A.; Gutierrez, C.; J. Electroanal. Chem. 2003, 548, 109. DOI: http://dx.doi.org/10.1016/S0022-0728(03)00229-8 118. Markovic, N. M.; Lucas, C. A.; Rodes, A.; Stamenkovic, V.; Ross, P. N.; Surf. Sci. 2002, 499, L149. DOI: http://dx.doi.org/10.1016/S0039-6028(01)01821-0 119. Wakabayashi, N.; Kitamura, F.; Ohsaka, T.; Tokuda, K.; Electrochemistry 1999, 67, 1181. 120. Schmidt, T. J.; Paulus, U. A.; Gasteiger, H. A.; Behm, R. J.; J. Electroanal. Chem. 2001, 508, 41. DOI: http://dx.doi.org/10.1016/S0022-0728(01)00499-5 121. Herrero, E.; Feliu, J. M.; Wieckowski, A.; Clavilier, J.; Surf. Sci. 1995, 325, 131. DOI: http://dx.doi.org/10.1016/0039-6028(94)00730-6 122. Hubbard, A. T.; Chem. Rev. 1988, 88, 633. DOI: http://dx.doi.org/10.1021/cr00086a004 123. Conway, B. E.; Solid State Ionics 1997, 94, 165. DOI: http://dx.doi.org/10.1016/S0167-2738(96)00602-9 124. Lorenz, W.; J. Electroanal. Chem. 1985, 191, 31. DOI: http://dx.doi.org/10.1016/S0022-0728(85)80004-8 125. Garcia-Araez, N.; Climent, V.; Herrero, E.; Feliu, J.; Lipkowski, J.; J. Electroanal. Chem. 2005, 576, 33. DOI: http://dx.doi.org/10.1016/j.jelechem.2004.10.003 126. Li, N.; Lipkowski, J.; J. Electroanal. Chem. 2000, 491, 95. DOI: http://dx.doi.org/10.1016/S0022-0728(00)00199-6 127. García-Aráez, N.; Climent, V.; Herrero, E.; Feliu, J. M.; Surf. Sci. 2004, 560, 269. DOI: http://dx.doi.org/10.1016/j.susc.2004.04.051 128. Koper, M. T. M.; J. Electroanal. Chem. 1998, 450, 189. DOI: http://dx.doi.org/10.1016/S0022-0728(97)00648-7 129. Markovic, N.; Ross, P. N.; Langmuir 1993, 9, 580. DOI: http://dx.doi.org/10.1021/la00026a037 130. Garwood Jr, G. A.; Hubbard, A. T.; Surf. Sci. 1981, 112, 281. DOI: http://dx.doi.org/10.1016/0039-6028(81)90376-9 131. Markovic, N. M.; Gasteiger, H. A.; Lucas, C. A.; Tidswell, I. M.; Ross Jr, P. N.; Surf. Sci. 1995, 335, 91. DOI: http://dx.doi.org/10.1016/0039-6028(95)00452-1 132. Adzic, R. R.; Wang, J. X.; Electrochim. Acta 2000, 45, 4203. DOI: http://dx.doi.org/10.1016/S0013-4686(00)00547-8 133. Lucas, C. A.; Markovic, N. M.; Ross, P. N.; Surf. Sci. 1995, 340, L949. DOI: http://dx.doi.org/10.1016/0039-6028(95)00710-5 134. Tanaka, S.; Yau, S. L.; Itaya, K.; J. Electroanal. Chem. 1995, 396, 125. DOI: http://dx.doi.org/10.1016/0022-0728(95)04062-S 135. Bittner, A. M.; Wintterlin, J.; Beran, B.; Ertl, G.; Surf. Sci. 1995, 335, 291. DOI: http://dx.doi.org/10.1016/0039-6028(95)00447-5 136. Bittner, A. M.; Wintterlin, J.; Ertl, G.; J. Electroanal. Chem. 1995, 388, 225. DOI: http://dx.doi.org/10.1016/0022-0728(95)03854-A 137. Orts, J. M.; Gomez, R.; Feliu, J. M.; Aldaz, A.; Clavilier, J.; J. Phys. Chem. 1996, 100, 2334. DOI: http://dx.doi.org/10.1021/jp952989v 138. Orts, J. M.; Gómez, R.; Feliu, J. M.; Aldaz, A.; Clavilier, J.; Langmuir 1997, 13, 3016. DOI: http://dx.doi.org/10.1021/la960932+ 139. Vogel, R.; Baltruschat, H.; Surf. Sci. 1991, 259, L739. DOI: http://dx.doi.org/10.1016/0167-2584(91)90302-8 140. Lucas, C. A.; Markovic, N. M.; Ross, P. N.; Phys. Rev. B 1997, 55, 7964. DOI: http://dx.doi.org/10.1103/PhysRevB.55.7964 141. Chang, S. C.; Yau, S. L.; Schardt, B. C.; Weaver, M. J.; J. Phys. Chem. 1991, 95, 4787. DOI: http://dx.doi.org/10.1021/j100165a036 142. Schardt, B. C.; Yau, S. L.; Rinaldi, F.; Science 1989, 243, 1050. DOI: http://dx.doi.org/10.1126/science.243.4894.1050 PMID: 17734808 143. Bonnefont, A.; Varela, H.; Krischer, K.; ChemPhysChem 2003, 4, 1260. DOI: http://dx.doi.org/10.1002/cphc.200300874 PMID: 14653011 144. Rodes, A.; Zamakhchari, M. A.; El Achi, K.; Clavilier, J.; J. Electroanal. Chem. 1991, 305, 115. DOI: http://dx.doi.org/10.1016/0022-0728(91)85206-5 145. Vitus, C. M.; Chang, S. C.; Schardt, B. C.; Weaver, M. J.; J. Phys. Chem. 1991, 95, 7559. DOI: http://dx.doi.org/10.1021/j100173a001 146. Baltruschat, H.; Bringemeier, U.; Vogel, R.; Faraday Discuss. 1992, 94, 317. DOI: http://dx.doi.org/10.1039/fd9929400317 147. Vogel, R.; Baltruschat, H.; Ultramicroscopy 1992, 42-44, 562. DOI: http://dx.doi.org/10.1016/0304-3991(92)90324-D |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access