Educação
|
|
| Craqueamento térmico da glicerina: uma proposta de experimento para química orgânica Thermal cracking of crude glycerin: an undergraduate organic chemistry experiment |
|
Valéria B. RiattoI,III,*; Mauricio M. VictorI,III; Sílvio CunhaI,III; Ana C. R. MagalhaesI; Fernanda T. CruzII,IV; Camila S. CarriçoII
IDepartamento de Química Orgânica, Instituto de Química, Universidade Federal da Bahia, 40170-115 Salvador - BA, Brasil Recebido em 08/10/2014 *e-mail: vriatto@ufba.br In this work, an undergraduate organic chemistry experiment based on thermal cracking of glycerin is proposed. The reagent is obtained as a by-product from the practice of biodiesel synthesis, and allows reduction of waste produced in the lab. The main product obtained from thermal cracking was characterized by GC analysis as acrolein. This substance was also identified by chemical derivatization as 2,4-dinitrophenylhydrazone, allowing a combined experiment of identification by synthesis of the derivative. INTRODUÇÃO A Química é um dos pilares atuais de nossa civilização. Desde a primeira transformação provocada pelo Homem sobre a Natureza, cada vez mais a Química vem contribuindo para as diversas conquistas da Humanidade. Desde os primórdios da civilização, da conquista do fogo, passando pela manipulação dos metais, até chegarmos aos dias atuais, com materiais inteligentes e fármacos mais eficientes e nano-estruturados, a Ciência Química está presente, permitindo a busca incessante de um desenvolvimento melhor e mais sustentável. No entanto, muitas práticas adotadas no desenvolvimento da Química, principalmente a partir do final do século XIX, não podem ser consideradas como práticas sustentáveis. Na busca da produção e utilização de novos produtos químicos sintéticos, degradamos e poluímos o meio ambiente mais nos últimos 200 anos do que em 10 mil anos de história da civilização. Felizmente, em um passado recente, a Ciência Química tem passado por uma transformação autocrítica e reflexiva, como parte de um movimento mais amplo e complexo de toda a sociedade. Este movimento de transformação da Química, ao qual é difícil precisar um marco,1 deu origem ao que hoje denominamos Química Verde.2 Esta nova concepção no modo de fazer Química, que passou a ter preocupação com os problemas ambientais decorrentes dos processos químicos tradicionais, levou a uma mudança completa na forma de se fazer ciência e pesquisa, seja no âmbito industrial ou seja no âmbito acadêmico. Esta nova sistemática de compreensão da Química Verde pode ser sintetizada nos 12 princípios,3 que precisam ser considerados quando se pretende implementar a Química Verde em alguma atividade. É tamanho o êxito da aplicação destes princípios em temáticas acadêmicas e industriais que inclusive uma análise mais pragmática, tomada à cabo por Winterton,4 levou à publicação dos "segundos 12 princípios", que tem por objetivo privilegiar a obtenção de vias de síntese mais inovadoras e sustentáveis, além da publicação de dados experimentais completos que permitam avaliar a característica inovadora do método em si.5 As atividades práticas dos cursos de Graduação em Química também vêm sofrendo a influência positiva dos preceitos da Química Verde.6 Experimentos químicos eficientes e ambientalmente seguros vêm sendo desenvolvidos,7-9 e estão se tornando rotineiros em laboratórios didáticos de Química Orgânica. Seguindo estes princípios, experimentos que buscam fontes renováveis como matérias-primas vêm sendo relatados em nossa literatura.10-12 Também são importantes experimentos nos quais o produto obtido de uma experiência possa ser empregado como matéria-prima para outra, permitindo uma reciclagem de materiais, minimizando a geração de resíduos e subprodutos nos laboratórios de graduação.13,14 Neste contexto, vimos por intermédio deste manuscrito propor um experimento onde o resíduo de glicerina em metanol, obtido em reação de preparação de biodiesel em laboratório de graduação,15 é submetido ao craqueamento térmico, e a mistura resultante é analisada tanto por métodos físico-químicos quanto por derivatização química.
RESULTADOS E DISCUSSÃO Craqueamento térmico da glicerina A preparação de biodiesel em laboratório15 é um experimento bastante simples de ser realizado, e tem sido executada rotineiramente na UFBA em aulas experimentais para os cursos de Química, Farmácia e Engenharia Química. Esta prática envolve a utilização de 100 mL de óleo vegetal, normalmente o de soja, o qual é tratado com uma solução metanólica de hidróxido de sódio à 45 ºC. Esta reação de transesterificação produz cerca de 15-22 mL de um "resíduo", o qual é separado como fração mais densa em funil de decantação. Esta fração é constituída principalmente de glicerina e metanol, com um pH superior a 13, e é armazenada como descarte em nossos experimentos com alunos. Em função dos preceitos aqui já descritos de minimização de geração de resíduos, propusemos utilizar esta solução metanólica alcalina de glicerina, em seu estado bruto, como matéria-prima para um experimento de craqueamento térmico para graduação. Apesar de relevante e de alto emprego industrial, são raras as descrições de experimentos práticos para aulas de graduação utilizando esta técnica. Cunha e colaboradores16 descreveram o craqueamento térmico de alcanos, e seu trabalho serviu de referência para o desenvolvimento de nosso experimento. Diferentemente do alcano empregado no experimento de Cunha e colaboradores, a glicerina utilizada como matéria-prima em nosso experimento não é uniforme. Ela vem de preparações de discentes de cursos e turmas distintas, e assim tem características que variam de amostra para amostra.17 Deste modo, em função da viscosidade variável da mistura, foi necessário avaliar a inclinação ideal para que o tempo de residência na área de aquecimento fosse suficiente para promover a reação de craqueamento de modo eficiente. Foram realizados testes com inclinações de 30º , 45º e 60º do tubo de craqueamento de cobre18 com relação ao plano da bancada. O funil foi preenchido com 30 mL da amostra e a torneira foi aberta completamente, fazendo-se o fluxo entrar na tubulação, medindo-se o tempo gasto para iniciar o gotejamento na extremidade inferior, ou seja, o tempo que a amostra demorava a escoar pelo tubo de 1 metro. As medidas do tempo de escoamento (em triplicata) foram praticamente idênticas para 30º, 45º e 60º: entre 12 e 14 s. Deste modo, como a zona de aquecimento foi ajustada para 15 cm, o tempo de residência na zona de aquecimento ficou entre 1,8 e 2,1 s. Como os tempos de escoamento obtidos foram muito próximos para as três inclinações avaliadas, por questões de facilidade da montagem do equipamento, optou-se por utilizar o sistema com ângulo de 30º (vide material suplementar, Figura 1S). O experimento do craqueamento térmico da glicerina é rápido, visto que a presença de metanol no resíduo diminui bastante a viscosidade da glicerina. A amostra de 30 mL escoa do funil em cerca de 1 minuto, e é importante destacar que o aquecimento do tubo pela chama deve ser iniciado entre 10 a 15 s antes de iniciar o gotejamento da amostra, e que os panos de resfriamento já estejam molhados com água gelada antes do início do aquecimento (vide material suplementar, Figuras 2S e 3S). Também é necessário tomar o cuidado de recolher e descartar inicialmente cerca de 10 mL de "cabeça de craqueamento", utilizando para os testes posteriores apenas o corpo central da amostra, também com cerca de 10 mL (frascos de amostras farmacêuticas de antibióticos são perfeitos para tal). Logo após a coleta da amostra central, a chama foi desligada por questões de economia e de segurança, e o último frasco foi colocado para recolher a amostra até total escoamento no tubo. A presença de um composto carbonilado no produto do craqueamento foi comprovada por meio do teste positivo com uma solução de 2,4-dinitrofenil-hidrazina (2,4-DNFH).19 O sólido obtido neste teste20 foi isolado, recristalizado em etanol/água e caracterizado por comparação do ponto de fusão determinado e do espectro na região do infravermelho (Figura 4S, material suplementar) com os dados das 2,4-dinitrofenil-hidrazonas (2,4-DNFHonas) preparadas de amostras autênticas de acroleína e acetaldeído21 (Figuras 5S e 6S, respectivamente, no material suplementar). A 2,4-DNFHona obtida a partir de uma amostra autêntica da acroleína apresentava-se como um sólido alaranjado, que após recristalização teve seu ponto de fusão determinado entre 162,8 ºC à 164,4 ºC (lit.19 165,0 ºC). O mesmo tratamento realizado com acetaldeído resultou em um sólido amarelado, com ponto de fusão 142,2 ºC à 143,4 ºC (lit.19,22 147 ºC). Majoritariamente a 2,4-DNFHona obtida a partir da amostra experimental apresentou cor alaranjada e, após recristalização em etanol, teve o ponto de fusão determinado entre 162,5 e 164,9 ºC, corroborando a formação de acroleína como produto majoritário no craqueamento térmico. Adicionalmente, foi realizada a análise de comparação com padrões autênticos por cromatografia em fase gasosa (para detalhes, ver procedimento experimental). Para preparação da amostra, 3 gotas da fração central foram diluídas em uma solução aquosa de hidroquinona a fim de estabilizar a amostra para as condições analíticas (guardadas em geladeira, as amostras mostraram-se estáveis por até 1 semana). Por comparação com os tempos de retenção das amostras autênticas (material suplementar, Figuras 7S à 9S), pode-se concluir também por esta análise que a acroleína é o produto majoritário da reação de craqueamento. Mecanismos de craqueamento da glicerina Em função da importância econômica alcançada pela glicerina, devido à sua grande disponibilidade como principal subproduto da preparação de biodiesel, o craqueamento térmico da glicerina tem sido objeto de estudo por parte da comunidade científica. No entanto, há uma grande dificuldade no conhecimento dos mecanismos que controlam o craqueamento, em muito devido à presença das hidroxilas adjacentes e dos fatores que controlam esta reação. A formação de acroleína, formaldeído e acetaldeído (principais produtos do craqueamento, e todos com grande interesse industrial) dependem da temperatura23 com que se realiza a transformação. Dentre estes, a acroleína é o merecedor de maior atenção, por ser altamente tóxica24 e considerada um importante poluente emitido por motores de combustão.25 Em se tratando da glicerina pura (ou neutra), estudos teóricos26 mostram que o mecanismo de decomposição térmica pode ser resumido em 4 diferentes etapas: i) formação do glicidol via eliminação de água; ii) conversão do glicidol à 3-hidróxi-propanal; iii) decomposição do 3-hidróxi-propanal em acroleína e água; ou iv) decomposição do 3-hidróxi-propanal em álcool vinílico e formaldeído (Esquema 1). A etapa lenta do processo, estimada neste trabalho, foi a de formação do glicidol (etapa 1), com valor de energia de ativação calculado em 66,8 kcal/mol.
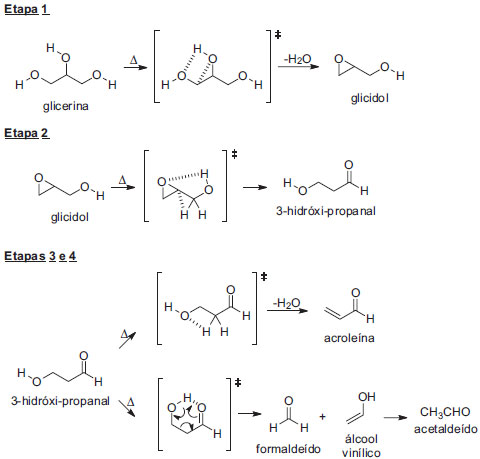 Esquema 1. Mecanismo proposto para o craqueamento térmico da glicerina neutra (adaptado da referência 26)
Contudo, a amostra empregada neste experimento para graduação não é de glicerina neutra, mas de uma solução metanólica alcalina. Neste caso, o alto pH do meio pode fazer com que mecanismos radicalares e mecanismos aniônicos possam atuar de modo competitivo e/ou paralelo, dependendo da temperatura em que acontece o craqueamento. No caso de apenas considerarmos um mecanismo aniônico, um dos possíveis mecanismos de fragmentação térmica da glicerina pode ser descrito como uma reação tandem: rearranjo alcalino do tipo pinacol, seguido de uma reação do tipo retro-aldol (Esquema 2).27 Nesta proposta, a glicerina desprotonada sofreria uma migração 1,2 de hidreto, que desloca o grupo hidroxila assistido por uma ligação de hidrogênio (etapa 2). O ânion resultante sofre então uma reação do tipo retro-aldol, para produzir acetaldeído e formaldeído.
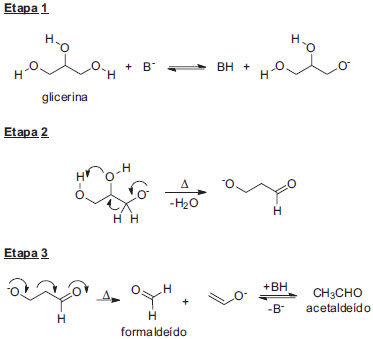 Esquema 2. Mecanismo "aniônico" proposto para o craqueamento térmico da glicerina (adaptado da referência 27)
No entanto, nosso principal produto de craqueamento é a acroleína, e não o acetaldeído. Neste caso, um mecanismo alternativo é postulado. As altas temperaturas internas do tubo poderiam incitar um mecanismo inicial do tipo radicalar,23,28 favorecendo a desidratação e a consequente formação do intermediário 3-hidróxi-propanal (Esquema 3). Este último composto, ao adotar a geometria Z do enol, pode adotar uma conformação de anel de seis membros pela ligação de hidrogênio intramolecular, levando a uma reação eletrocíclica concertada com eliminação de água e formação de acroleína. Por outro lado, a geometria E do enol não permite esta estabilização interna, o que permite o equilíbrio tautomérico. Nesta forma, o 3-hidróxi-propanal segue mecanismo já descrito de fragmentação do tipo retro-aldol, levando à formação de formaldeído e álcool vinílico, que tautomeriza para formar o acetaldeído. Como temos a formação preferencial de acroleína, este mecanismo "radicalar-aniônico" é adequado para explicar as transformações observadas em nossos experimentos, e fornece os mesmos compostos indicados nas etapas 3 e 4 no Esquema 1.
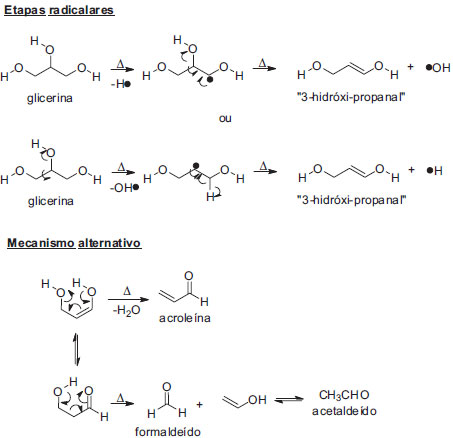 Esquema 3. Mecanismo alternativo "radicalar-aniônico" proposto para o craqueamento térmico da glicerina neutra (adaptado da referência 28)
PARTE EXPERIMENTAL Reação de craqueamento térmico (Obs: este experimento envolve a utilização de uma fonte de chama e um resíduo que contém metanol. Deve-se tomar as medidas de prevenção usuais em laboratório, como afastamento de produtos inflamáveis e, se possível, uso de capela de exaustão). Um tubo de cobre de 1 metro de comprimento e diâmetro de 3/8 de polegada18 teve suas duas pontas curvadas em direções contrárias e foi preso por duas hastes metálicas, fazendo um ângulo com o plano da bancada de aproximadamente 30º (Figura 1). Dois pedaços de panos com 10 cm (alternativamente podem ser empregados chumaços de algodão) foram presos por barbantes na região central do tubo, com um espaço entre si de 15 cm (zona de aquecimento), e foram umedecidos com água gelada com o auxílio de um frasco lavador. Um funil de adição foi preso na haste, de forma a ter sua saída coincidente com o orifício superior do tubo, e a amostra foi colocada no funil (~30 mL). Uma fonte de chama (maçarico ou bico de Bunsen) foi acesa e sua chama direcionada para a zona de aquecimento, com os panos previamente umedecidos e resfriados. Após 10-15 segundos, o funil foi aberto (tempo de escoamento total da amostra foi cerca de 1 minuto) e o produto do craqueamento foi coletado em frascos de 10 mL (frascos de penicilina ou outro recipiente qualquer), respeitando uma fração inicial, uma intermediária e uma final, sendo utilizada para fins de análise a amostra central (cerca de 10 mL, 1/3 do volume colocado no funil de adição). Após a coleta da fração central a chama foi desligada, e aguardou-se o escoamento total da fração final. Verificaram-se alterações de cor e de odor na amostra, e as mesmas foram registradas (para maiores detalhes da montagem, vide Figuras 1-3S no material suplementar).
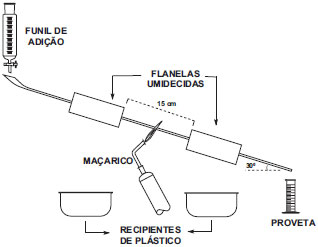 Figura 1. Representaçao esquemática da aparelhagem empregada no craqueamento térmico da glicerina
Análise cromatográfica com detector de ionização de chamas (CG-FID) Uma amostra de 3 gotas da fração central foi diluída em um frasco contendo 2 mL de uma solução aquosa de hidroquinona 1% m/v (recentemente preparada). O volume injetado foi de 1 µL, no modo splitless. Os cromatogramas foram obtidos em um aparelho Perkin Elmer Clarus 500, coluna DB-1 (60 m × 0,25 mm × 0,25 µm), detector de ionização de chama (CG-FID), temperatura 250 ºC, gases da chama H2 40 mL min-1 e ar sintético 400 mL min-1. As condições de análise foram: temperatura do injetor 230 ºC, temperatura inicial da coluna 85 ºC (5 min), final 300 ºC (2 min), gradiente 15 ºC min-1. Tempo total de análise de 21,33 min. Gás de arraste He (1 mL min-1). A análise qualitativa da fração intermediária do craqueamento térmico foi realizada pela comparação com cromatogramas de amostras autênticas injetadas nas condições descritas. A fração transformada em acroleína e acetaldeído foi avaliada entre 25-50% em área, e a fração não transformada de glicerina estimada entre 68 e 43% em área (para maiores detalhes ver Figuras 7-9S no material suplementar). Identificação do produto obtido através de derivatização19 Preparação da solução de 2,4-dinitrofenil-hidrazina (2,4-DNFH) 1,5 g de 2,4-DNFH foram adicionados sobre 7,5 mL de ácido sulfúrico concentrado e esta solução foi adicionada, sob agitação, sobre uma mistura de 10 mL de água destilada e 35 mL de etanol absoluto. Preparação das 2,4-dinitrofenil-hidrazonas (2,4-DNFHona) Em um tubo de ensaio, 15 gotas do produto foram diluídas em 5 mL de etanol absoluto, e sobre esta soluçao foram adicionados 2 mL de solução de 2,4-DNFH. O sólido obtido foi separado por filtração e recristalizado em etanol 95% à quente (em alguns casos onde não houve total dissolução, algumas gotas de acetato de etila foram adicionadas até completa dissolução). O sólido obtido por resfriamento por uma noite foi coletado por decantação e foi lavado com etanol 95% previamente gelado. Os sólidos obtidos foram deixados secar ao ar. Medidas dos pontos de fusão Os pontos de fusão foram obtidos em equipamento Microquímica MQAPF 301, com rampa de aquecimento de 2 ºC/minuto, por meio da técnica de lamínulas. Análise por espectroscopia no infravermelho O espectro vibracional na região do infravermelho foi registrado em Shimadzu Fourier Transform Infrared Spectrophotometer IRAffinitY-1, em pastilha de KBr confeccionada com 3-5 mg de amostra e 100 mg de KBr. Os valores para a absorção foram referidos em número de onda. Os espectros no IV das 2,4-DNFHonas da acroleína e do acetaldeído comerciais e de uma amostra experimental podem ser obtidos no material suplementar (vide Figuras 4-6S).
CONCLUSÕES Os experimentos aqui propostos abrangem diversas técnicas experimentais abordadas em disciplina experimental de química orgânica, tais como craqueamento e determinação de ponto de fusão, contemplando ainda elucidação estrutural por teste químico de caracterização de grupo funcional, preparação de derivado e espectroscopia na região do infravermelho, bem como uso de cromatografia gasosa para identificação por comparação com padrões. O curto tempo necessário para efetuar a reação de craqueamento térmico permite adotar a preparação do derivado e sua purificação por recristalização em uma mesma aula, ficando o aguardo da secagem da 2,4-DNFHona e determinação de seu ponto de fusão para uma aula subsequente. Dessa forma, dependendo dos objetivos específicos da disciplina, o professor pode adaptar o experimento para atender a diversos aspectos pedagógicos, mesmo que disponha de aulas experimentais de 2-3 h de duração. Tão ou mais importante quanto as características acima mencionadas, a preocupação do experimento em transformar a glicerina produzida em outra prática (produção de biodiesel), até então tratada como resíduo, em reagente para um experimento completamente diverso do anterior, contribui para inserir os princípios da Química Verde na formação experimental dos graduandos. Esta conexão entre experimentos, que leva à economia e redução de produção de rejeitos, deve ser preocupação constante na abordagem de ensino experimental aos nossos discentes.
MATERIAL SUPLEMENTAR O material suplementar contém fotos ilustrativas da aparelhagem empregada no craqueamento térmico, cromatogramas da mistura de padrões e de uma amostra experimental. Contém também espectros no infravermelho das 2,4-dinitrofenil-hidrazonas de padrões (acroleína e acetaldeído comerciais) e de amostra experimental. Este material está disponível em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com livre acesso.
AGRADECIMENTOS Os autores agradecem ao CNPq e INCT E&A pelo suporte.
REFERÊNCIAS E NOTAS 1. Alguns autores preferem citar o início da preocupaçao da Química com a temática ambiental e sustentabilidade com a publicaçao do livro Silent Spring (Primavera Silenciosa), de Rachel Carson, no ano de 1962. Algumas conferências internacionais posteriores, como a Conferência da Biosfera, em 1968, e a Conferência de Estocolmo, em 1972, também sao lembradas como marcos importantes na transformaçao dos paradigmas da Química. Mas é quase um consenso que a publicaçao da Lei de Prevençao da Poluiçao pela EPA (Environmental Protection Agency) nos Estados Unidos em 1990 é um marco na gênese da Química Verde. 2. Farias, L. A.; Fávaro, D. I. T.; Quim. Nova 2011, 34, 1089. DOI: http://dx.doi.org/10.1590/S0100-40422011000600030 3. Anastas, P. T.; Warner, J.; Green Chemistry: Theory and Practice; Oxford University Press: Oxford, 1998. 4. Winterton, N.; Green Chem. 2001, 3, G73. DOI: http://dx.doi.org/10.1039/b110187k 5. Machado, A. A. S. C.; Quim. Nova 2012, 35, 1250. DOI: http://dx.doi.org/10.1590/S0100-40422012000600034 6. Corrêa, A. G.; Zuin, V. G.; Química Verde: fundamentos e aplicaçoes, EdUFSCar: Sao Carlos, 2009. 7. Marques, M. V.; Bisol, T. B.; Sá, M. M.; Quim. Nova 2012, 35, 1696. DOI: http://dx.doi.org/10.1590/S0100-40422012000800034 8. Roesky, H. W.; Kennepohl, D. K.; Experiments in Green and Sustainable Chemistry, Wiley-VCH: Weinheim, 2009. 9. Kirchhoff, M.; Ryan, M. A.; Greener Approaches to Undergraduate Chemistry Experiments, Am. Chem. Soc.: Washington, 2002. 10. Cunha, S.; Lustosa, D. M.; Conceiçao, N. D.; Fascio, M.; Magalhaes, V.; Quim. Nova 2012, 35, 638. DOI: http://dx.doi.org/10.1590/S0100-40422012000300035 11. Ribeiro, P. R.; Carvalho, J. R. M.; Geris, R.; Queiroz, V.; Fascio, M.; Quim. Nova 2012, 35, 1046. DOI: http://dx.doi.org/10.1590/S0100-40422012000500033 12. Medeiros, M. A.; Lago, R. M.; Quim. Nova 2011, 34, 1079. DOI: http://dx.doi.org/10.1590/S0100-40422011000600028 13. Santos, A. P. B.; Gonçalves, I. R. C.; Pais, K. C.; Martinez, S. T.; Lachter, E. R.; Pinto, A. C.; Quim. Nova 2009, 32, 1667. DOI: http://dx.doi.org/10.1590/S0100-40422009000100026 14. Alves, P. B.; Victor, M. M.; Quim. Nova 2010, 33, 2274. DOI: http://dx.doi.org/10.1590/S0100-40422010001000042 15. Geris, R.; Santos, N. A. C.; Amaral, B. A.; Maia, I. S.; Castro, V. D.; Carvalho, J. R. M.; Quim. Nova 2007, 30, 1369. DOI: http://dx.doi.org/10.1590/S0100-40422007000500053 16. A demanda por aulas experimentais de craqueamento parece ser ainda importante, pois o referido trabalho é acessado mais de 700 vezes por semestre, em média, desde a sua publicaçao, o que sugere ser importante ampliar os experimentos de craqueamento térmico para a graduaçao, aliando à temática Química Verde: Cunha, S.; Beretta, M.; Santos, A. O.; Rodrigues Jr, M. T.; Bastos, R. M.; Quim. Nova 2005, 28, 364. 17. As amostras empregadas em nosso experimento sao de um frasco de descarte de resíduos do experimento de produçao de biodiesel marcado como "resíduo de glicerina". Deste modo, é uma mistura de descartes de vários experimentos e nao sofreu nenhum tipo de tratamento prévio para utilizaçao. 18. Este tubo (3/8 de polegada) pode ser facilmente adquirido em casas especializadas em refrigeraçao e/ou ar condicionado. Em Salvador, no mês de abril de 2014, o mesmo teve custo de R$ 8,19. 19. Shriner, R. L.; Hermann, C. K. F.; Morrill, T. C.; Curtin, D. Y.; Fuson, R. C.; The Systematic Identification of Organic Compounds, 7th ed., John Wiley: New York, 1998. 20. Observamos uma variabilidade no sólido obtido, provavelmente devido à falta de controle sobre a temperatura de craqueamento, sendo que em alguns casos houve a formaçao de um pó amorfo, nao cristalino, que apresentou uma faixa de ponto de fusao bastante ampla. A amostra com esta característica, quando deixada evaporar à temperatura ambiente, produzia dois sólidos diferentes, um de cor amarela e outro de cor laranja, caracterizando uma mistura, muito provavelmente das 2,4-DNFHonas derivadas do acetaldeído e da acroleína, respectivamente. 21. Acroleína marca Aldrich, pureza 99%; acetaldeído marca Vetec, pureza 99%. 22. Uma consulta à literatura básica (referência 19) mostrou dois valores de pontos de fusao bastante distintos (147 ºC e 169 ºC), o menor com valor próximo ao obtido experimentalmente por nós. Isso nos levou a consultar um banco de dados (SciFinder - https://scifinder.cas.org/scifinder - acessado em 10 de julho de 2014) onde encontramos inúmeros valores de ponto de fusao, desde 142 ºC até 168 ºC, a maioria das décadas de 1950 e 1960, com diferentes solventes empregados nas recristalizaçoes. Dados recentes(posteriores ao ano 2000) também mantém esta confusao de valores de ponto de fusao para esta 2,4-DNFHona (168 ºC: Chturvedi, G.; Hiran, B. L.; Oxid. Commun. 2003, 26, 553; 161-163 ºC: Barman, P.; Bhattacharjee, S. K.; Bhattacharjee, T.; Synth. Commun. 2011, 41, 2870; 146-147 ºC: Shi, Z.; Wang, L.; Gu, H.; Li, J.; Bai, Y.; Yang, B.; Sci. China Ser. B 2005, 48, 25; 145 ºC: Gosain, J.; Sharma, P. K.; Prod. Ind. Acad. Sci. 2003, 115, 135). Considerando apenas o isômero E na consulta ao banco de dados, os dados ficam mais restritos (161-162 ºC: Hurd, C. D.; Buess, C. M.; J. Am.Chem. Soc. 1956, 78, 5667; 160 ºC: Daniel, H.; Liebigs Ann. Chem. 1964, 673, 92). 23. Stein, Y. S.; Antal, M. J., Jr.; Jones, M., Jr.; J. Anal. Appl. Pyrolysis 1983, 4, 283. DOI: http://dx.doi.org/10.1016/0165-2370(83)80003-5 24. Ghilarducci, D. P.; Tjeerdema, R. S.; Rev. Environ. Contam. Toxicol. 1995, 144, 95. PMID: 8599034 25. Guarieiro, L. L. N.; Vasconcellos, P. C.; Solci, M. C.; Revista Virtual de Química 2011, 3, 434. 26. Laino, T.; Tuma, C.; Curioni, A.; Jochnowitz, E.; Stolz, S.; J. Phys. Chem. A 2011, 115, 3592. DOI: http://dx.doi.org/10.1021/jp201078e PMID: 21452849 27. Paine III, J. B.; Pithawalla, Y. B.; Naworal, J. D.; Thomas, C. E., Jr.; J. Anal. Appl. Pyrolysis 2007, 80, 297. DOI: http://dx.doi.org/10.1016/j.jaap.2007.03.007 28. Antal, M. J., Jr.; Mok, W. S. L.; T-Raissi, A.; Anderson, D. G. M.; J. Anal. Appl. Pyrolysis 1985, 8, 291. DOI: http://dx.doi.org/10.1016/0165-2370(85)80032-2 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





