Artigo
|
|
| Contaminação de ambientes aquáticos por "agrotóxicos urbanos": o caso dos rios Cocó e Ceará, Fortaleza - Ceará, Brasil Contamination of aquatic environments by "urban pesticides": the case of Cocó and Ceará rivers, Fortaleza - Ceará, Brazil |
|
Wersângela C. DuavíI; Allyne F. GamaI; Pollyana C. V. MoraisI; André H. B. de OliveiraI; Ronaldo F. do NascimentoII; Rivelino M. CavalcanteI,*
IInstituto de Ciências do Mar, Universidade Federal do Ceará, 60165-081 Fortaleza - CE, Brasil Recebido em 09/09/2014 *e-mail: rivelino@ufc.br Pesticides are used mostly in rural areas for agriculture, but urban pest control, public health campaigns, and household and veterinary products can also be important sources of these contaminants. This aim of this study was to estimate household pesticide contamination in sediments of two urban estuaries due to pest control: Cocó and Ceará rivers located in the metropolitan area of Fortaleza, Ceará, Brazil. Cypermethrin and malathion were found in both rivers. Cypermethrin levels had the same magnitudes as other studied urban areas and were highest in the estuary, while malathion was similar in both fluvial and estuarine zones. INTRODUÇÃO O crescimento desordenado dos grandes centros urbanos apresenta condições sócio-sanitárias favoráveis ao aparecimento de pragas, como: a introdução de espécies exóticas, a ausência de competidores, predadores, parasitas e patógenos, e a disponibilidade e abundância de abrigo e alimentos.1 As pragas ou pestes urbanas são espécies que infestam ambientes urbanos, podendo causar agravos à saúde, bem como prejuízos econômicos.2 Segundo a Lei nº 7.802/1989,3 agrotóxicos são produtos e agentes de processos físicos, químicos ou biológicos, destinados ao uso nos setores de produção, no armazenamento e beneficiamento de produtos agrícolas, nas pastagens, na proteção de florestas, nativas ou implantadas, e de outros ecossistemas, e também de ambientes urbanos, hídricos e industriais, cuja finalidade seja alterar a composição da flora ou da fauna a fim de preservá-las da ação danosa de seres vivos considerados nocivos. Também são considerados agrotóxicos as substâncias e produtos empregados como desfolhantes, dessecantes, estimuladores e inibidores de crescimento. Os agrotóxicos apresentam diferentes categorias de uso, classes (acaricidas, herbicidas, fungicidas, entre outros) e grupos químicos (organoclorados, carbamatos, piretroides, entre outros). Para cada classe de agrotóxico existe uma ampla variedade no grupo químico utilizado.4 A concessão do certificado de registro de agrotóxicos e afins é realizada, desde que sejam atendidas as diretrizes e exigências estabelecidas pelos três órgãos federais: Ministério da Agricultura, Pecuária e do Abastecimento (MAPA); Agência Nacional de Vigilância Sanitária (ANVISA) e Instituto Brasileiro de Meio Ambiente e dos Recursos Naturais Renováveis (IBAMA).5,6 No Brasil, para o controle de pragas, opta-se preferencialmente pelo uso de produtos químicos (p.ex.: agrotóxicos), seja na agricultura, nas campanhas sanitárias, em domicílios e em produtos veterinários.5,7,8 A aplicação desses produtos na agricultura previne ou elimina as pragas que prejudicam a produtividade nesse setor e, nos centros urbanos, visa evitar prejuízos econômicos e problemas relacionados à saúde pública.4,9 Os produtos usados no combate às pragas urbanas apresentam os mesmos princípios ativos dos produtos agrícolas usados no campo, entretanto recebem outra denominação: produtos domissanitários ou saneantes domissanitários. Os saneantes domissanitários são definidos, segundo a Lei nº 6.360/1976,10 como: substâncias ou preparações destinadas à higienização, desinfecção ou desinfestação domiciliar, em ambientes coletivos e/ou públicos, em lugares de uso comum e no tratamento da água, compreendendo: inseticidas; raticidas; desinfetantes e detergentes. Por não serem considerados agrotóxicos, os domissanitários são vendidos livremente no varejo sem qualquer restrição, e assim usado sem nenhum controle. Diversos domissanitários apresentam princípios ativos pertencentes às classes toxicológicas I (altamente tóxico e muito perigoso ao ambiente) e II (moderadamente tóxico e perigoso ao ambiente), considerando a Portaria SNVS nº 3/92 do Ministério da Saúde,11 a qual classifica os agrotóxicos usados no campo, entretanto essa classificação não é seguida quando o mesmo agrotóxico (princípio ativo) é utilizado em regiões não agrícolas, como exemplo as áreas urbanas. Agrotóxicos não agrícolas, pesticidas urbanos (urban pesticides), pesticidas residenciais (residential pesticides), bem como domissanitários, são as denominações aplicadas aos agrotóxicos usados em áreas urbanas, sejam no combate às pragas urbanas, para evitar epidemias/surtos, e no uso doméstico, para evitar proliferação de espécies indesejáveis nas residências. Apesar do consenso que a agricultura é uma das principais fontes de contaminação por agrotóxicos nos corpos hídricos,12-14 os domissanitários lançados nas regiões urbanas despontam como fonte potencial de contaminação ambiental, uma vez que houve um grande aumento em seu consumo em virtude das campanhas de saúde pública de combate à dengue, doença de Chagas, febre amarela, esquistossomose, malária. Além disso, são utilizados na manutenção de espaços públicos ou paisagísticos.9 O problema de identificar essa fonte como causadora de contaminação vem da carência de programas, estudos e trabalhos que relatem a presença desses contaminantes no meio ambiente. Na Califórnia, EUA, o programa "U.S. Geological Survey's National Water-Quality Assessment" (NAWQA) realiza o monitoramento da qualidade dos recursos hídricos, que incluem os domissanitários. Contudo, esse programa é restrito; não contempla estudos em diferentes matrizes ambientais, tampouco aborda todas as aplicações desses contaminantes no ambiente urbano.15 Devido ao grande uso nas atividades urbanas, mais de vinte riachos na Califórnia estão com altos níveis de domissanitários nos sedimentos, sendo essas regiões distantes de áreas agrícolas.15,16 Os estudos indicam também que o uso de domissanitários da classe dos piretroides são responsáveis pela contaminação do sedimento de rios a níveis de toxicidade aguda em invertebrados aquáticos sensíveis.15,16 Outro estudo na região do delta dos rios Sacramento e San Joaquin, Califórnia, EUA, mostrou que as fontes urbanas de piretroides foram maiores em termos de concentração e frequência de toxicidade do que a agricultura.17 Quando presentes no meio ambiente, esses contaminantes podem se deslocar entre diferentes compartimentos ambientais.18 Dessa forma, quando os resíduos de domissanitários são transportados por bueiros ou cursos de água oriundos de escoamento de águas pluviais ou escoamento urbano,19 podem causar efeitos adversos na biota aquática.20,21 Estes domissanitários podem alcançar e contaminar áreas de elevada importância econômica, social e ambiental, como os estuários e manguezais, levando a degradação dos recursos naturais desses ambientes. Isso porque estimativas indicam que menos de 0,1% dessas substâncias efetivamente aplicados alcançam as pragas, ou seja, 99,9% têm potencial para se deslocar para outros compartimentos ambientais,22 podendo resultar em efeitos adversos à saúde humana e ao ambiente.7,18 Apesar de serem utilizados há mais de meio século para controle de pragas e nas lavouras no Brasil, a maioria dos trabalhos sobre agrotóxicos está associada à saúde dos trabalhadores,9,23 à resistência dos organismos-alvo,24 à quantificação dos agrotóxicos em ambientes aquáticos12,25-27 e em alimentos,28,29 à mobilidade de agrotóxicos em solo30 e ao risco de contaminação ambiental.31 Recentemente, foram iniciados trabalhos sobre o impacto do uso de biocidas em tintas anti-incrustantes.32 Os rios Cocó e Ceará são importantes exemplos de rios urbanizados do nordeste brasileiro, uma vez que as suas regiões fluvioestuarinas, bem como de manguezais estão completamente inseridas na região metropolitana da cidade de Fortaleza, capital do Estado do Ceará. A maioria dos estudos sobre a influência urbana em ambos os rios relatam altos níveis de hidrocarbonetos oriundos do uso de combustíveis fósseis.33-35 Nilin e colaboradores36 avaliaram a toxicidade das águas do rio Ceará referente aos níveis de metais tóxicos e concluíram que os mesmos não atribuem toxicidade a esse recurso hídrico. Os autores sugerem que a alta toxicidade dessas águas seja proveniente de agrotóxicos ou sinergismo entre contaminantes orgânicos e inorgânicos. Desta forma, o objetivo geral desse trabalho é avaliar o impacto do uso de domissanitários no controle de pragas urbanas, para melhorar o entendimento a respeito da recente distribuição espacial, possíveis fontes e os fatores governantes na distribuição dessas substâncias nos sedimentos dos rios Cocó e Ceará. Adicionalmente, foi realizado um levantamento dos produtos vendidos no comércio e usados no combate às pragas endêmicas, a fim de conhecer os princípios ativos mais comuns presentes nesses produtos. O presente estudo foi motivado pela escassez de dados a respeito da contaminação por domissanitários nos ambientes aquáticos brasileiros. Os resultados serão úteis para futuras avaliações das consequências ambientais e elaboração de políticas públicas voltadas para regulação dos produtos químicos usados em campanhas de saúde pública.
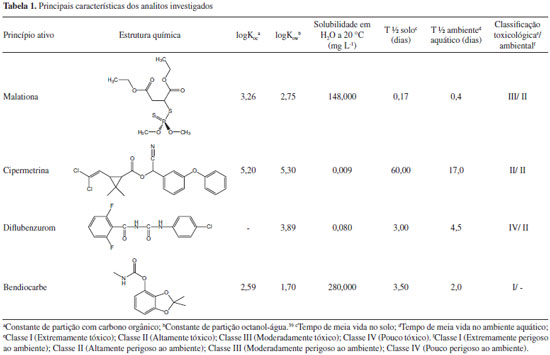
PARTE EXPERIMENTAL Área de estudo A bacia do rio Cocó faz parte do sistema Cocó/Coaçu. Sua nascente está localizada na vertente oriental da Serra da Aratanha, município de Pacatuba, Ceará, e sua bacia hidrográfica drena uma área de, aproximadamente, 517,2 km2. O curso do rio Cocó tem cerca de 45 km de extensão. Recebe em seu trecho final o rio Coaçu, seu principal afluente, e deságua no Atlântico, limite entre os municípios de Fortaleza e Eusébio. Neste último trecho, o rio Cocó sofre a influência das marés, que avançam até 13 km de sua foz, mantendo regime de escoamento perene e formando um estuário alongado e estreito, composto por 210 ha de manguezais.37,38 A bacia do rio Ceará faz parte do sistema Ceará/Maranguape, drena uma área de 555,9 km2; tem sua nascente localizada na serra de Maranguape, e totaliza 52,5 km de extensão. O estuário do rio Ceará está localizado entre os municípios de Fortaleza e Caucaia, apresenta fluviometria semi-perene, sendo formado pela junção dos rios Ceará e Maranguapinho. A sua desembocadura sofre influência das marés e possui uma área de manguezal de 640 ha.37 Ambos os rios têm quase 70% da sua área total inserida na zona urbana de Fortaleza, onde ficam sujeitos aos mais diversos tipos de ações antrópicas, tais como fonte de descarga de efluentes doméstico e industrial, deposição de lixo, desmatamento e aterro do manguezal.36 Reagentes e soluções Os solventes hexano, acetona, acetato de etila e diclorometano (DCM) usados nas etapas de extração, de purificação (clean up) e preparo das soluções padrões foram da marca TEDIA grau HPLC. As substâncias alfa-cipermetrina, bendiocarbe e diflubenzurom, usados como padrões, foram cedidos pela Secretaria de Saúde do Estado do Ceará (SESA - CE), enquanto o malationa foi obtido da AccuStandard®. A escolha dessas substâncias é justificada pelo conhecimento do seu uso na área de estudo. Os padrões deuterados (acenafteno deuterado, criseno deuterado e perileno deuterado) e o padrão interno (E-difenildiazeno) foram adquiridos da Sigma-Aldrich (EUA), apresentando entre 99,5 e 99,9% de pureza. O cobre em pó (Cu) e a alumina foram obtidos da Merck (EUA), enquanto o sulfato de sódio anidro (Na2SO4) e a sílica gel (70 a 230 mesh) da Vetec. As principais características dos analitos estudados estão apresentadas na Tabela 1, na qual estão sumarizados os nomes dos princípios ativos, estruturas químicas, constantes de partição com carbono orgânico (logKoc), constantes de partição octanol-água (logKow), solubilidades em H2O a 20 ºC (mg L-1), tempos de meia vida no solo em dias (T½ solo), tempos de meia vida no ambiente aquático em dias (T½ ambiente aquático) e classificações toxicológica e ambiental.
Amostragem Em cada rio (Cocó e Ceará), foram selecionados três pontos amostrais, distribuídos em um ponto na zona estuarina (CO 1 e CE 1), coletados em maré baixa, outro em área de manguezal (CO 2 e CE 2) e o último numa área mais afastada da zona urbana de Fortaleza (CO 3 e CE 3), mostrados na Figura 1. As amostras de sedimento superficial (aproximadamente 2 cm de profundidade) foram coletadas em novembro de 2012, em recipientes de alumínio (previamente limpos com solvente orgânico) e acondicionadas à baixa temperatura até a chegada ao laboratório onde foram congeladas até a etapa de preparo de amostra.
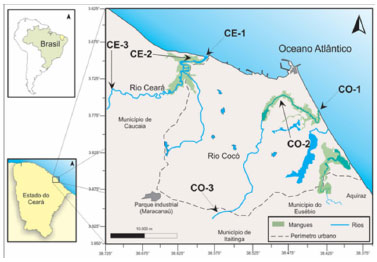 Figura 1. Mapa da área de estudo contendo os pontos de amostragem (CE= Rio Ceará e CO=Rio Cocó)
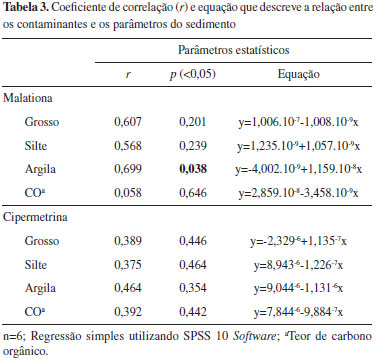
Preparo das amostras As amostras de sedimento superficial foram subdivididas, sendo uma parte seca em estufa (Medicate MD 12) a 65 ºC, para a determinação granulométrica, e outra liofilizada a -33 ºC e a 760 torr (Edwards do Brasil), para a caracterização do sedimento e extração dos domissanitários. A análise granulométrica foi realizada como descrita por Suguio.40 Uma alíquota de 100 g de amostra seca à temperatura ambiente e homogeneizada foi pesada para a realização do procedimento de peneiramento úmido e seco para separação das frações granulométricas. Os dados obtidos foram tratados estatisticamente no programa ANASED 5.0i, no qual foram determinados os teores de fração arenosa e fina. A determinação do teor de carbono orgânico total (CO) foi realizada conforme a descrição de Camargo e colaboradores.41 O método é conhecido por Walkley-Balck modificado e consiste na oxidação da matéria orgânica do sedimento com solução de dicromato de potássio (K2Cr2O7) em presença de ácido sulfúrico (H2SO4). A extração dos domissanitários em sedimento foi realizada utilizando o princípio de cromatografia de adsorção em fase sólida.33,42 Devido à complexidade da matriz ambiental e diferença das propriedades físico-químicas dos analitos, a escolha da fase extratora e do sistema de purificação foi baseada na constante eluotrópica (εº), índice de polaridade (Pº) e propriedades físico-químicas dos domissanitários estudados.42,43 A partir de 30 g de sedimento (liofilizado e passados em peneiras com abertura de 2 mm, para a retirada do material grosseiro), foram adicionados 50 µL de padrão deuterado e a extração ocorreu com auxílio de sonicação (ELMASONIC E 120 H) durante 20 min, sob temperatura ambiente. A mistura extratora foi selecionada por faixa decrescente de Pº: 30 mL de acetona, 30 mL de acetona e acetato de etila (1:1 v/v), 30 mL acetato de etila, 30 mL de acetato de etila e DCM (1:1 v/v), 30 mL de DCM, 30 mL de DCM e hexano (1:1 v/v) e 30 mL de hexano. Os extratos foram recolhidos em tubos de Falcon e centrifugados a 4000 rpm por 15 min (HermLe Z 360 K). O sobrenadante foi recolhido em balão de fundo redondo de 250 mL e rotaevaporado (FISATOM 801) até aproximadamente 1 mL, para a etapa seguinte. Antes da construção da coluna de purificação, a sílica gel e a alumina foram ativadas em estufa a 200 ºC por 12 h. O Cu foi ativado por lavagem com 40 mL de HCl 0,1 mol L-1, sendo o excesso sifonado; em seguida o mesmo foi feito com 40 mL de acetona, e finalmente, armazenado em hexano. A coluna de purificação foi preparada a partir da solução de 8 g de sílica gel, seguida de 4 g de alumina em hexano. Em seguida foi colocado 0,5 cm de Cu seguido de 3 cm de Na2SO4. Após a adição dos extratos oriundos da etapa de extração na coluna de purificação, ocorreu a eluição dos analitos. As misturas eluentes usadas foram: 20 mL de hexano, 30 mL de hexano e DCM (3:7 v/v) e 30 mL de hexano e acetato de etila (4:6 v/v). A escolha do sistema de solvente na etapa de purificação foi baseada na εº e Pº.42 Os extratos foram rotaevaporados a 1 mL, adicionados a eles 10 µL de padrão interno, finalmente estando prontos para serem quantificados por cromatografia gasosa acoplada ao detector de espectrometria de massa. Determinação e quantificação de domissanitários A determinação dos analitos de interesse foi realizada seguindo procedimento reportado por Duaví.42 Para a determinação dos analitos de interesse, foi utilizado um cromatógrafo a gás com espectrômetro de massa (GC-MS), Shimadzu, modelo QP2010. A coluna capilar (fase estacionária) usada na separação dos analitos de interesse foi obtida da J&W Scientific modelo DB-5 (30 m × 0,25 mm i.d × 0,25 µm espessura de filme). Foram injetados 2 µL no modo splitless, utilizando hélio como gás de arraste, a um fluxo de 4,6 mL min-1, 70 eV. As temperaturas do injetor e detector foram de 260 e 300 ºC, respectivamente. A programação de temperatura na coluna teve início a 100 ºC permanecendo por 1 min, aumentando para 300 ºC a uma taxa de 7 ºC min-1, permanecendo estável a 300 ºC por 5 min. O tempo total da corrida cromatográfica foi de 35 min. A quantificação dos analitos de interesse foi realizada por uma curva de calibração, usando padrão interno (E-difenildiazeno). Para a construção da curva de calibração, foram preparadas soluções estoques na concentração de 1000 mg L-1 individuais em acetona, hexano ou acetato de etila dos domissanitários estudados. A solução de trabalho foi preparada a partir das soluções estoques em uma mistura com concentração final de 10 mg L-1. A partir da solução de trabalho foram realizadas diluições para obtenção dos pontos da curva de calibração, variando de 50 a 1000 µg L-1. O coeficiente de correlação linear (r) variou de 0,9188 a 1,0000, os limites de detecção variaram de 0,0004 a 19,0776 µg L-1 e os limites de quantificação de 0,0013 a 57,8111 µg L-1.42 Tratamento estatístico dos dados O coeficiente de correlação (r), a equação que descreve a relação entre os contaminantes (malationa e cipermetrina) e os parâmetros do sedimento (frações granulométricas: grosso, silte e argila; e carbono orgânico) e o seu respectivo valor de p foram determinados por meio de regressão simples, utilizando SPSS 10 Software.
RESULTADOS E DISCUSSÃO Níveis e possíveis fontes dos domissanitários Domissanitários utilizados para o combate às pragas urbanas foram quantificados pela primeira vez nos sedimentos dos rios Cocó e Ceará, e os seus níveis estão sumarizados na Figura 2. Dos quatro analitos estudados, dois foram detectados em todos os locais estudados. A cipermetrina é um piretroide que possui oito isômeros óticos. Eles são representados nos cromatogramas como quatro picos seguidos, sendo que cada pico possui um par de enantiômeros.44 Para efeito de cálculo da concentração desse composto, foi considerada a soma de todos os picos. Os níveis de cipermetrina nos rios Ceará e Cocó variaram de 45,67 a 134,57 ng g-1 e 6,68 a 38,04 ng g-1, respectivamente. Já as concentrações de malationa nos rios Ceará e Cocó variaram entre 0,08 a 0,14 ng g-1 e 0,10 a 0,85 ng g-1, respectivamente, como pode ser verificado na Figura 2.
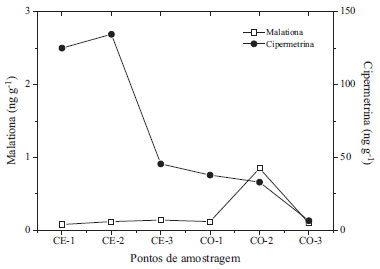 Figura 2. Distribuição da concentração dos domissanitários malationa e cipermetrina em cada ponto amostral (CE= Rio Ceará e CO=Rio Cocó)
Apesar de a agricultura ser reconhecida como uma importante fonte de agrotóxicos para contaminação dos recursos hídricos, e o Ceará ser um dos grandes usuários,45 não há áreas que possam ser caracterizadas como agrícolas no perímetro urbano da cidade de Fortaleza, dessa forma, acredita-se que a presença dos contaminantes investigados nos rios Cocó e Ceará seja predominantemente proveniente das atividades urbanas. Foi verificado que as principais fontes de domissanitários para ambos os rios são: o controle de pragas com produtos de venda livre (uso doméstico), o uso em campanhas de saúde pública e controle de pragas urbanas por empresas especializadas. Amweg e colaboradores15 consideram o uso residencial e em paisagismo (jardinagem) as principais fontes de piretroides em zonas urbanas do Estado da Califórnia, EUA. Weston e colaboradores17 relatam que as águas originadas de áreas agrícolas apresentaram concentrações de agrotóxicos da classe dos piretroides mais baixas e menor frequência de toxicidade do que de amostras de escoamentos urbanos e efluentes de tratamento de águas residuárias do delta de Sacramento-San Joaquin, Califórnia, EUA. O uso disseminado e indiscriminado nos peridomicílios e intradomicílios pode não só causar agravo à saúde humana como também contaminar corpos hídricos, por meio do escoamento de águas superficiais que contenham resíduos de contaminantes, semelhante ao que ocorre em áreas agrícolas.46,47 As altas concentrações de cipermetrina em áreas urbanas podem estar ligadas, principalmente, ao uso de produtos domésticos, conhecidos popularmente como "veneno". A cipermetrina é um dos princípios ativos mais usados nos produtos comercializados para uso doméstico, conforme levantamento mostrado na Figura 3. Estes dados foram compilados a partir da visita a três supermercados de diferentes redes da Região Metropolitana de Fortaleza, onde foram listadas a presença dos princípios ativos em trinta produtos de diversas marcas dos domissanitários disponíveis para venda livre.
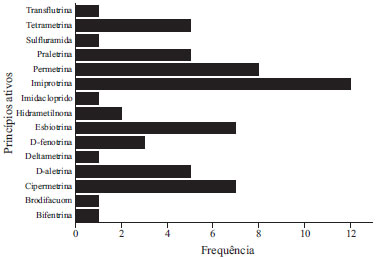 Figura 3. Frequência absoluta de princípios ativos em produtos comercializados na Região Metropolitana de Fortaleza
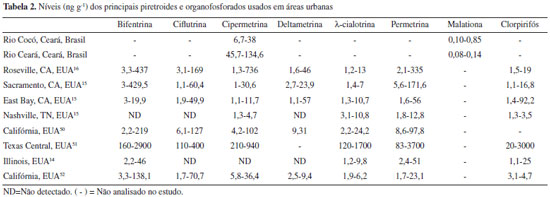
De maneira geral, os níveis de cipermetrina em sedimento dos rios Cocó e Ceará estão na mesma magnitude da maioria dos estudos realizados em rios e riachos dos EUA, nos quais o uso e ocupação do solo é basicamente residencial e comercial, com poucas áreas com cobertura natural (Tabela 2). Na maioria dos estudos, os autores atribuem a contaminação, sobretudo, ao uso de domissanitários para controle de pragas por aplicadores profissionais e uso residencial.15,16 Li e colaboradores48 reportam que, de todos os piretroides, a cipermetrina apresenta os maiores níveis nos sedimentos da região do Pearl River Delta, China, caracterizada como altamente urbanizada com leve influência agrícola, e justifica esses níveis devido ao baixo preço da substância. Em virtude do grande uso nas atividades urbanas, a cipermetrina e permetrina foram utilizadas como indicadores na diferenciação de aporte oriundo de escoamento urbano do escoamento rural em uma área em expansão na China.49
Apesar da baixa periodicidade, outra provável fonte de cipermetrina é sua aplicação em campanhas de saúde pública, na forma do isômero alfa-cipermetrina. A alfa-cipermetrina é utilizada no tratamento residual de mosquitos anofelinos, transmissores da malária, e no tratamento perifocal para combate ao Aedes aegypti. Esses tratamentos são modos de controle químico de insetos e visam a "borrifação" de determinadas superfícies onde supostamente o vetor irá frequentar. Dessa forma, devido ao espaçamento entre as aplicações, os inseticidas usados nesse tipo de tratamento devem apresentar estabilidade química.53 Essa estabilidade permite que resíduos de cipermetrina alcancem os corpos hídricos mais próximos, por meio da lavagem das superfícies que contenham os resíduos pela água da chuva. Essas águas são transportadas pela drenagem pluvial, bueiros e esgotos domésticos.19,54 O inseticida malationa é um inseticida organofosforado. Segundo a ANVISA,55 apresenta as mesmas utilizações da cipermetrina como domissanitário, diferenciando na formulação e na concentração máxima permitida, porém o malationa não foi catalogado como princípio ativo de produtos domissanitários de venda livre no levantamento realizado nesse trabalho (ver Figura 3). Na saúde pública, o malationa é usado como adulticida no tratamento espacial, que consiste em colocar gotículas micropulverizadas do inseticida na massa de ar de determinado local ou ambiente.53 A aplicação espacial é realizada em ultra baixo volume pelo equipamento nebulizador acoplado a veículos, popularmente conhecido como fumacê, ou costal, quando não é possível a passagem do veículo. Esse tipo de aplicação é solicitado quando os tratamentos preventivos (focal e residual) não são suficientes para evitar surtos de doenças.53,56 A demanda da aplicação espacial é solicitada de acordo com o número de casos por bairros. No Ceará, dentre as doenças transmitidas por vetores, a dengue apresenta os maiores números de casos de infecção. Os primeiros casos foram registrados em 1986 e desde que foi notificada pela primeira vez, a dengue tem se manifestado de forma endêmica, sendo que os anos de 1987, 1994, 2001, 2008 e 2011 foram registrados epidemias, tendo esse último ano o total de 56.714 de casos registrados.57 Nos anos 2009 a 2012, o uso do inseticida malationa foi intensificado, devido ao aumento do número de casos de dengue no Estado do Ceará, como mostra a Figura 4.
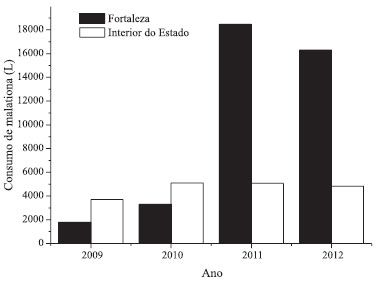 Figura 4. Consumo de malationa grau técnico 96% em campanhas sanitárias nos anos 2009 a 2012. Fonte: NUVET/SESA (2012)
A provável fonte de malationa para os rios Cocó e Ceará vem do uso na saúde pública. Os níveis se justificam em virtude do lançamento semestral periódico, bem como devido ao uso progressivo ano após ano, não dando tempo para o ambiente depurá-lo ou simplesmente o contaminante degradar conforme seu tempo de meia vida. Além do mais, os casos de dengue são acentuados nos bairros próximos dos rios estudados e seus afluentes, o que demanda mais campanhas de combate ao mosquito.57 A Organização Mundial da Saúde receita o malationa como método para aplicação espacial, no combate aos mosquitos transmissores de doenças. Apesar disso, não encontramos trabalhos que relatassem os níveis de malationa em sedimentos de ambientes aquáticos de áreas agrícolas e menos ainda em áreas urbanas. Isso deve-se provavelmente ao fato dos países que investem mais em pesquisa terem erradicado doenças transmitidas por mosquitos, como a dengue. Os valores de malationa quantificados nesse trabalho estão de 10 a 100 vezes menores que as concentrações de outros organofosforados e piretroides usados em atividades urbanas como domissanitários (ver Tabela 2). Hintzen e colaboradores51 encontraram, além de inseticidas piretroides, resíduos de outros inseticidas organofosforados usados em áreas urbanas como domissanitários. Entre eles foram detectados fipronil e seus metabólitos, indoxacarbe, diazinona e clorpirifós, sendo os dois últimos proibidos na formulação de produtos de venda livre nos EUA em 2004 e 2001, respectivamente. Os contaminantes orgânicos, incluindo os domissanitários, alcançam os ambientes aquáticos principalmente via escoamento urbano e sistema de drenagem urbana.15 Ao entrar nos ambientes aquáticos, os contaminantes orgânicos se distribuem entre a fração aquosa e a fração particulada. Em geral, os contaminantes orgânicos com logKow maior que 3 têm forte tendência em se ligarem com a fração apolar do material particulado suspenso (MPS) e/ou a matéria orgânica dissolvida (MOD) dos ambientes aquáticos.58,59 A fração orgânica do sedimento é responsável pela sorção da maioria dos contaminantes orgânicos em ambientes aquáticos.58 Outros estudos também apontam a fração inorgânica (p.ex.: minerais), como possível componente transportador de contaminantes orgânicos em ambientes aquáticos.60,61 Devido às características de uso esperava-se que fosse detectado mais malationa do que cipermetrina na área de estudo, uma vez que esta é lançada no ambiente aberto, antes, durante e pouco depois do período chuvoso, correspondendo a seis meses do ano.62,63 Já a cipermetrina tem seu maior uso em ambientes fechados, como os residenciais. Contudo, a justificativa para a cipermetrina apresentar concentrações em média mais de 200 vezes superiores que os níveis de malationa em ambos os rios deve-se ao fato da malationa apresentar propriedades físico-químicas favoráveis à partição da mesma para a fração aquosa. Diferentemente, a cipermetrina tem suas propriedades físico-químicas favoráveis à partição para o sedimento. A cipermetrina tem logKow igual a 5,3 e solubilidade em água a 20 ºC igual a 0,009 mg L-1, enquanto os valores para malationa são 2,75 e 148 mg L-1, respectivamente.39 Além disso, os T½ solo e T½ ambiente aquático da cipermetrina são infinitamente superiores aos da malationa (ver Tabela 1). Xue e colaboradores,64 estudando a partição ambiental da cipermetrina, justificaram as maiores concentrações em sedimento comparado a fração aquosa e água intersticial em ambientes aquáticos por meio das propriedades físico-químicas da mesma. Além disso, a cipermetrina é um piretroide que apresenta uma grande resistência a degradação em ambiente aquático.65 Os outros agrotóxicos estudados, bendiocarbe e diflubenzurom, não foram detectados e sua ausência pode estar relacionada à baixa persistência no ambiente ou às baixas quantidades de produtos aplicados em áreas urbanas. Estes agrotóxicos têm seu uso permitido apenas por entidades especializadas. O diflubenzurom é aplicado no tratamento focal como larvicida do vetor transmissor da dengue. Distribuição espacial de domissanitários nos rios Cocó e Ceará A distribuição dos contaminantes orgânicos nos ambientes aquáticos depende das propriedades físico-químicas de cada um deles, assim como das condições do ambiente.66 Brunk e colaboradores67 e Tremblay e colaboradores68 descreveram uma série de equilíbrios envolvendo contaminantes orgânicos, MOD e MPS em ambientes aquáticos. No caso dos sedimentos, características como teor da matéria orgânica, carbono negro, substâncias húmicas e fúlvicas são responsáveis por governar essa distribuição.18,68-70 O estudo da granulometria classifica o sedimento de ambos os rios como areia e areia-lamosa; com uma média de 76,6% para material grosso, seguido de silte (21,0%) e argila (2,3%). O CO teve média de 1,5% (Figura 5). Esses teores estão na mesma magnitude que outros trabalhos realizados nos rios Cocó e Ceará.34,36
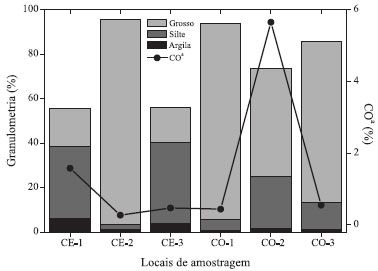 Figura 5. Parâmetros da caracterização sedimentológica em cada ponto amostral (CE= Rio Ceará e CO=Rio Cocó). ªTeor de carbono orgânico
Os pontos de coleta nos ambientes fluviais, mais a montante em ambos os rios estudados (CE 3 e CO 3), tiveram os menores níveis de concentração de cipermetrina (ver Figura 2). Isso é esperado uma vez que são os pontos localizados nas áreas menos urbanizadas, sofrendo assim menores pressões das atividades antrópicas. Os demais locais estudados (CE 1, CE 2, CO 1 e CO 2) em ambos os rios recebem intensa carga de efluentes, o que justifica as mais altas concentrações de cipermetrina. A distribuição da cipermetrina aumenta da região fluvial em direção a região estuarina (ver Figura 2). Quanto à malationa, não existe diferença nos níveis encontrados entre as zonas fluvial e estuarina no rio Ceará, tendo distribuição homogênea. Entretanto, no rio Cocó, o local de coleta CO 2 tem quatro vezes o nível médio do estudo (ver Figura 2). Segundo o Mapa da Incidência de Dengue por Bairros da Região Metropolitana de Fortaleza, em 2011, bairros que margeiam o rio nessa região tiveram os maiores índices de casos de dengue.71 Como o combate à dengue leva em consideração os casos de internação hospitalares por bairros, essa região foi uma das que mais recebeu aplicação do fumacê. A distribuição da cipermetrina em ambos os rios não é governada por nenhum parâmetro estudado no sedimento, pois não foi observada correlação significativa (p<0,05) com o CO e nem com nenhuma fração do sedimento (Tabela 3). Segundo Feo e colaboradores,72 em experimentos de laboratório, a cipermetrina apresentou uma relativa correlação com o CO, e foi observado que quanto maior o índice de aromaticidade e menor a polaridade da fração orgânica, maior a retenção de piretroides pela fase particulada.73 Isso é conivente com o fato da cipermetrina ter um alto logKoc, e dessa forma é esperado que a sua partição seja favorecida para a fração particulada nos ambientes aquáticos (Tabela 3). Por outro lado, a malationa apresentou correlação com argila (r=0,699; p=0,038) no estudo (Tabela 3) e com CO em estuários na Índia,74 apesar do seu baixo logKoc, bem como outras propriedades físico-químicas que favorecem sua partição no ambiente para a fração aquosa.
Em ambientes fluvio-estuarinos, as mudanças nas condições físico-químicas e hidrodinâmicas também são conhecidas por influenciarem na dinâmica e partição de substâncias orgânicas naturais e antrópicas, especialmente devido a vários mecanismos, tais como: mistura entre águas fluviais e marinhas com diferentes composições de solutos e material particulado; variação na distribuição do tamanho do grão; contribuição de componentes de água intersticial e remoção de substâncias do soluto para a fração particulada e processos inversos (dessorção).75-78 Processos desse tipo podem ocorrer independente e simultaneamente, além de variar com a hidrodinâmica, meteorologia e fatores biológicos, particulares de cada ambiente. O efeito final de toda a dinâmica do ambiente frente à partição de substâncias orgânicas é um padrão inesperado e de complexa distribuição.79 Alguns estudos apontam a mudança de pH e o aumento da salinidade como os parâmetros principais para os estuários se transformarem em verdadeiros sumidouros de contaminantes orgânicos, especialmente os hidrofóbicos.68,80 Zhou e Rowland78 reportam que a partição da permetrina, um piretroide com propriedades similares às da cipermetrina, é favorecida para a fração aquosa quando ocorre um aumento de pH, e de forma inversa, é favorecida para a fração particulada quando ocorre um aumento da salinidade, em ambientes estuarinos. Além disso, a presença de eletrólitos em ambientes costeiros de transição pode causar o efeito salting-out, que é responsável principalmente por diminuir a solubilidade de substâncias orgânicas.81 Em ambientes estuarinos, o efeito salting-out pode incrementar em até 22% a sorção de contaminantes orgânicos à fração particulada do sedimento.82 Isso ocorre pois alguns cátions, como Na+ e K+, agem como par-iônico, especialmente para substâncias sintéticas aniônicas, aumentando a sua hidrofobicidade devido à neutralização das cargas.83 Outra possibilidade é a presença de cátions bivalentes (Ca2+; Mg+2 e Cu2+), os quais podem servir de ligação entre os grupos funcionais da matéria orgânica (p.ex.: carbonilas, fenóis e hidroxilas) e os contaminantes orgânicos aniônicos.77 Entretanto, os processos existentes em zonas estuarinas podem não exercer nenhum efeito na retenção de contaminantes orgânicos, como pode ser visto para a malationa no estudo (ver Figura 2). Zulin e colaboradores84 mostraram que agrotóxicos organofosforados não tiveram correlação significativa com carbono orgânico dissolvido e nem com MPS, e que a partição deve ser provavelmente mais influenciada pelos processos hidrodinâmicos do estuário estudado. Diversos estudos apontam a inexistência da alteração na partição de substâncias sintéticas (p.ex.: hexaclorociclohexano, hexaclorobenzeno e pentaclorobenzeno) entre as zonas fluvial e estuarina, e outros reportam que não ocorre transição entre a fase aquosa e particulada em zonas estuarinas.75,76
CONCLUSÕES Pela primeira vez os domissanitários utilizados no combate às pragas urbanas foram quantificados em sedimentos de áreas urbanas. Dos quatro domissanitários investigados somente foram detectados cipermetrina e malationa. As fontes desses domissanitários para os ambientes estudados são provenientes da sua aplicação em controle de pragas com produtos de venda livre para uso doméstico, uso em campanhas de saúde pública e controle de pragas urbanas por empresas especializadas. A cipermetrina apresentou maiores níveis na zona estuarina quando comparada a zona fluvial, e a malationa teve a concentração mais uniforme entre as duas zonas, exceto o ponto CO 2 (rio Cocó). A informação gerada neste estudo mostra que as atividades domésticas e de controle de pragas urbanas estão contaminando os rios estudados. Assim, políticas de monitoramento nos ambientes aquáticos devem ser implementadas, a fim de avaliar os impactos ambientais promovidos por essas atividades.
AGRADECIMENTOS Os autores agradecem ao CNPq (processos: 484171/2010-0 e 480583/2012-9) e à FUNCAP (processo: 150.01.00/09) pelos recursos disponibilizados ao projeto: Agrotóxicos no Semiárido Cearense: desenvolvimento metodológico e mobilidade ambiental. O Prof. Dr. Rivelino Cavalcante agradece também pela bolsa de produtividade em pesquisa do CNPq. Agradecimentos especiais a A. Q. de Sousa e R. G. A. Gomes, do Núcleo de Controle de Vetores da Secretaria de Saúde do Estado do Ceará, e todos os agentes do núcleo UBV pela coleta de dados e pelo fornecimento de amostras de produtos usados no combate às pragas urbanas. Os autores agradecem à Profª. Dra. K. V. Mendonça pelo tratamento estatístico dos dados e ao MSc. V. P. Andrade da Silva pela arte gráfica.
REFERÊNCIAS 1. Alves Filho, J. P.; Uso de agrotóxicos no Brasil: controle social e interesses corporativos. Annablume: Sao Paulo, 2002, 188 p. 2. BRASIL. RDC N 18/2000. Ministério da Saúde/Agência Nacional de Vigilância Sanitária, de 29 de fevereiro de 2000. 3. http://www.planalto.gov.br/ccivil_03/leis/l7802.htm, acessada em Agosto 2014. 4. Azevedo, P. R. G.; Manual técnico do consultor agroquímico. Editora Icone, Sao Paulo, 1995 5. Londres, F.; Agrotóxicos no Brasil - um guia para açao em defesa da vida. Rio de Janeiro: AS-PTA - Assessoria e Serviços a Projetos em Agricultura Alternativa, 2011. 6. Ribas, P. P.; Matsumura, A. T. S.; Revista Liberato 2009, 10, 149. 7. Ribeiro, M. L.; Lourencetti, C.; Polese, L.; Navickiene, S.; Oliveira, L. C.; Holos Environment 2008, 8, 53. 8. Câmara Neto, H. F. Dissertaçao de mestrado, Fundaçao Oswaldo Cruz, Recife, Brasil, 2000. 9. Lima, E. P.; Lopes, S. M. B.; Amorim, M. I. M.; Araújo, L. H. S.; Neves, K. R. T.; Maia, E. R.; Ciência & Saúde Coletiva 2009, 14, 2221. DOI: http://dx.doi.org/10.1590/S1413-81232009000600031 PMID: 20069192 10. http://www.planalto.gov.br/ccivil_03/leis/l6360.htm, acessada em Agosto 2014. 11. http://www.aenda.org.br/fito/PortAnvisa3-92.pdf, acessada em Março 2015. 12. Nogueira, E. M.; Dores, E. F. G. C.; Pinto, A. A.; Amorim, R. S. S.; Ribeiro, M. L.; Lourencetti, C.; J. Braz. Chem. Soc. 2012, 23, 1476. DOI: http://dx.doi.org/10.1590/S0103-50532012005000008 13. Gonçalves, C. M.; Silva, J. C. G. E.; Alpendurada, M. F.; J. Agric. Food Chem. 2007, 55, 6227. DOI: http://dx.doi.org/10.1021/jf063663u PMID: 17608425 14. Ding, Y.; Harwood, A. D.; Foslund, H. M.; Lydy, M. J.; Environ. Toxicol. Chem. 2010, 29, 149. DOI: http://dx.doi.org/10.1002/etc.13 PMID: 20821430 15. Amweg, E. L.; Weston, D. P.; You, J.; Lydy, M. J.; Environ. Sci. Technol. 2006, 40, 1700. DOI: http://dx.doi.org/10.1021/es051407c PMID: 16568790 16. Weston, D. P.; Holmes, R. W.; You, J.; Lydy, M. J.; Environ. Sci. Technol. 2005, 39, 9778. DOI: http://dx.doi.org/10.1021/es0506354 PMID: 16475366 17. Weston, D. P.; Lydy, M. J.; Environ. Sci. Technol. 2010, 44, 1833. DOI: http://dx.doi.org/10.1021/es9035573 PMID: 20121184 18. Arias-Estévez, M.; López-Periago, E.; Martínez-Carballo, E.; Simal-Gándara, J.; Mejuto, J. C.; García-Río, L.; Agric., Ecosyst. Environ. 2008, 123, 247. DOI: http://dx.doi.org/10.1016/j.agee.2007.07.011 19. Guo, L.; Kelley, K.; Goh, K. S.; Environ. Toxicol. Chem. 2007, 26, 2274. DOI: http://dx.doi.org/10.1897/06-653R.1 PMID: 17941734 20. Gunasekara, A. S.; Truong, T.; Goh, K. S.; Spurlock, F.; Tjeerdema, R. S.; J. Pestic. Sci. 2007, 32, 189. DOI: http://dx.doi.org/10.1584/jpestics.R07-02 21. He, L.; Troiano, J.; Wang, A.; Goh, K.; Reviews of Environmental Contamination and Toxicology; Whitacre D. M., ed.; Springer: New York, 2008. 22. Younos, T. M.; Weigmann, D. L.; J. Water Pollut. Control Fed. 1988, 60, 1199. 23. Rigotto, R. M.; Int. J. Environ. Res. Public Health 2009, 6, 980. DOI: http://dx.doi.org/10.3390/ijerph6030980 PMID: 19440428 24. Barreto, C. F.; Revista Eletrônica Faculdade Montes Belos. 2005, 1, 62. 25. Zanella, R.; Primel, E. G.; Machado, S. L. O.; Gonçalves, F. F.; Marchezan, E.; Chromatographia 2002, 55, 573. DOI: http://dx.doi.org/10.1007/BF02492903 26. Primel, E. G.; Zanella, R.; Kurz, M. H. S.; Gonçalves, F. F.; Machado, S. O.; Marchezan, E.; Quim. Nova 2005, 28, 605. DOI: http://dx.doi.org/10.1590/S0100-40422005000400010 27. Ribeiro, M. L.; Lourencetti, C.; Pereira, S. Y.; Marchi, M. R. R.; Quim. Nova 2007, 30, 688. DOI: http://dx.doi.org/10.1590/S0100-40422007000300031 28. Heleno, F. F.; Queiroz, M. E. L. R.; Neves, A. A.; Oliveira, A. F.; Quim. Nova 2014, 37, 153. DOI: http://dx.doi.org/10.1590/S0100-40422014000100025 29. Chiaradia, M. C.; Collins, C. H.; Jardim, I. C. S. F.; Quim. Nova 2008, 31, 623. DOI: http://dx.doi.org/10.1590/S0100-40422008000300030 30. Queiroz, G. M. P.; Silva, M. R.; Bianco, R. J. F.; Pinheiro, A.; Kaufmann, V.; Quim. Nova 2011, 34, 190. DOI: http://dx.doi.org/10.1590/S0100-40422011000200004 31. Milhome, M. A. L.; Sousa, D. O. B.; Lima, F. A. F.; Nascimento, R. F.; Eng. Sanit. Ambient. 2009, 14, 363 32. Castro, I. B.; Westphal, E.; Fillmann, G.; Quim. Nova 2011, 34, 1021. DOI: http://dx.doi.org/10.1590/S0100-40422011000600020 33. Cavalcante, R. M; Lima, D. M.; Correia, L. M.; Nascimento, R. F.; Quim. Nova 2008, 31, 1371. DOI: http://dx.doi.org/10.1590/S0100-40422008000600019 34. Cavalcante, R. M.; Sousa, F. W.; Nascimento, R. F.; Silveira, E. R.; Freire, G. S. S.; J. Environ. Manage. 2009, 91, 328. DOI: http://dx.doi.org/10.1016/j.jenvman.2009.08.020 PMID: 19889496 35. Cavalcante, R. M.; Andrade, M. V. F.; Marins, R. V.; Oliveira, L. D. M.; Microchem J. 2010, 96, 337. DOI: http://dx.doi.org/10.1016/j.microc.2010.05.014 36. Nilin, J.; Moreira, L. B.; Aguiar, J. E.; Marins, R.; Abessa, D. M. S.; Lotufo, T. M. C.; Costa-Lotufo, L. V.; Mar. Environ. Res. 2013, 91, 89. DOI: http://dx.doi.org/10.1016/j.marenvres.2013.02.009 PMID: 23522752 37. Companhia de Gestao dos Recursos Hídricos - COGERH. Revisao do plano de gerenciamento das águas das bacias metropolitanas e elaboraçao dos planos de gerenciamento das águas das bacias do litoral, Acaraú e Coreaú, no Estado do Ceará. Fortaleza, 2010. Versao preliminar. 38. Sobrinho, M. F.; Monografia (Especializaçao em Direito Ambiental), Universidade Estadual do Ceará, Ceará, Brasil, 2008. 39. http://sitem.herts.ac.uk/aeru/iupac/, acessada em Agosto 2014. 40. Suguio, K.; Introduçao à Sedimentologia. EDUSP: Sao Paulo, 1973. 41. Camargo, O. A.; Moniz, A. C.; Jorge, J. A.; Valadares, J. M. A. S.; Métodos de Análise Química, Mineralógica e Física de Solos do Instituto Agronômico de Campinas. Instituto Agronômico: Campinas, 2009, 77 p. (Boletim técnico, 106, Ediçao revista e atualizada). 42. Duaví, W. C.; Monografia, Universidade Federal do Ceará, Ceará, Brasil, 2013. 43. Cavalcante, R. M.; Lima, D. M.; Fernandes, G. M.; Duaví, W. C.; Talanta 2012, 93, 212. DOI: http://dx.doi.org/10.1016/j.talanta.2012.02.015 PMID: 22483901 44. Pérez-Fernández, V.; García, M. A.; Marina, M. L.; J. Chromatogr., A 2010, 1217, 968. DOI: http://dx.doi.org/10.1016/j.chroma.2009.10.069 45. Gama, A. F.; Oliveira, A. H. B.; Cavalcante, R. M.; Quim. Nova 2013, 36, 462. DOI: http://dx.doi.org/10.1590/S0100-40422013000300017 46. Diel, C.; Facchini, L. A,; Dall'Agnol, M. M.; Rev. Saude Publica 2003, 37, 83. DOI: http://dx.doi.org/10.1590/S0034-89102003000100013 PMID: 12488924 47. Jiang, W.; Lin, K.; Haver, D.; Qin, S.; Ayre, G.; Spurlock, F.; Gan, J.; Environ. Toxicol. Chem. 2010, 29, 1203. PMID: 20821561 48. Li, H.; Mehler, W. T.; Lydy, M. J.; You, J.; Chemosphere 2011, 82, 1373. DOI: http://dx.doi.org/10.1016/j.chemosphere.2010.11.074 PMID: 21193221 49. Wang, J. Z.; Li, H. Z.; You, J.; Environ Pollut. 2012, 161, 128. DOI: http://dx.doi.org/10.1016/j.envpol.2011.09.038 PMID: 22230077 50. Holmes, R. W.; Anderson, B. S.; Phillips, B. M.; Hunt, J. W.; Crane, D. B.; Mekebri, A.; Connor, V.; Environ. Sci. Technol. 2008, 42, 7003. DOI: http://dx.doi.org/10.1021/es801346g PMID: 18853823 51. Hintzen, E. P.; Lydy, M. J.; Belden, J. B.; Environ. Pollut. 2009, 157, 110. DOI: http://dx.doi.org/10.1016/j.envpol.2008.07.023 PMID: 18799250 52. Ensminger, M.; Kelley, K.; Monitoring Urban Pesticide Runoff in Northern California, 2009 - 2010. Report 264. Sacramento, Califórnia, Estados Unidos 2011. 53. Silva, P. C.; Guimaraes, F. L.; Ferreira, R. N. C.; Controle de Vetores - Procedimentos de Segurança, 1 ed., Ministério da Saúde / Fundaçao Nacional da Saúde: Brasília, 2001. 54. Weston, D. P.; Holmes, R. W.; Lydy, M. J.; Environ. Pollut. 2009, 157, 287. DOI: http://dx.doi.org/10.1016/j.envpol.2008.06.037 PMID: 18676072 55. http://portal.anvisa.gov.br/wps/wcm/connect/716d18004b97a5e3ad53bfaf8fded4db/M01++Malationa.pdf?MOD=AJPERES, acessada em Agosto 2014. 56. Weston, D. P.; Amweg, E. L.; Mekebri, A.; Ogle, R. S.; Lydy, M. J.; Environ. Sci. Technol. 2006, 40, 5817. DOI: http://dx.doi.org/10.1021/es0601540 PMID: 17007146 57. http://salasituacao.saude.ce.gov.br/index.php/menu-principal/dengue, acessado em Agosto 2014. 58. Mechlińska, A.; Gdaniec-Pietryka, M.; Wolska, L.; Namieśnik, J.; TrAC, Trends Anal. Chem. 2009, 28, 466. DOI: http://dx.doi.org/10.1016/j.trac.2009.01.005 59. Weber, J.; Halsall, C. J.; Muir, D.; Teixeira, C.; Small, J.; Solomon, K.; Hermanson, M.; Hung, H.; Bidleman, T.; Sci. Total. Environ. 2010, 408, 2966. DOI: http://dx.doi.org/10.1016/j.scitotenv.2009.10.077 PMID: 19939436 60. Chi, F. H.; Amy, G. L.; J. Colloid Interface Sci. 2004, 274, 380. DOI: http://dx.doi.org/10.1016/j.jcis.2003.12.049 PMID: 15144809 61. Murphy, E. M.; Zachara, J. M.; Smith, S. C.; Phillips, J. L.; Wietsma, T. W.; Environ. Sci. Technol. 1994, 28, 1291. DOI: http://dx.doi.org/10.1021/es00056a017 PMID: 22176321 62. Donalísio, M. R.; Glasser, C. M.; Rev. Bras. Epidemiol. 2002, 5, 259. DOI: http://dx.doi.org/10.1590/S1415-790X2002000300005 63. Carvalho, M. S. L.; Caldas, E. D.; Degallier, N.; Vilarinhos, P. T. R.; Souza, L. C. K. R.; Yoshizawa, M. A. C.; Knox, M.B.; Oliveira, C.; Rev. Saude Publica 2004, 38, 623. DOI: http://dx.doi.org/10.1590/S0034-89102004000500002 64. Xue, N.; Xu, X.; Jin, Z.; Chemosphere 2005, 61, 1594. DOI: http://dx.doi.org/10.1016/j.chemosphere.2005.04.091 PMID: 15982717 65. Lutnicka, H.; Water Res. 1999, 33, 3441. DOI: http://dx.doi.org/10.1016/S0043-1354(99)00054-8 66. Sanches, S. M.; Silva, C. H. T. P.; Campos, S. X.; Vieira, E. M.; Pesticidas 2003, 13, 53. 67. Brunk, B. K.; Jirka, G. H.; Lion, L.W.; Environ. Sci. Technol. 1996, 31, 119. DOI: http://dx.doi.org/10.1021/es9602051 68. Tremblay, L.; Kohl, S. D.; Rice, A. J.; Gagné, J. P.; Mar. Chem. 2005, 96, 21. DOI: http://dx.doi.org/10.1016/j.marchem.2004.10.004 69. Hung, C. C.; Gong, G. C.; Chen, H. Y.; Hsieh, H. L.; Santschi , P. H.; Wade, T. L.; Sericano, J. L.; Environ. Pollut. 2007, 148, 546. DOI: http://dx.doi.org/10.1016/j.envpol.2006.11.036 PMID: 17395347 70. Souza, A. S.; Torres, J. P. M.; Meire, R. O.; Neves, R. C.; Couri, M. S.; Serejo, C. S.; Chemosphere 2008, 73, 186. DOI: http://dx.doi.org/10.1016/j.chemosphere.2007.04.093 71. http://diariodonordeste.globo.com/materia.asp?codigo=1045986, acessada em Agosto 2014. 72. Feo, M. L.; Corcellas, C.; Barata, C.; Ginebreda, A.; Eljarrat, E.; Barceló, D.; Sci. Total Environ. 2013, 442, 497. DOI: http://dx.doi.org, /10.1016/j.scitotenv.2012.10.033 PMID: 23201590 73. Zhou, J. L.; Rowland, S.; Mantoura, R. F. C.; Water Res. 1995, 29, 1023. DOI: http://dx.doi.org/10.1016/0043-1354(94)00240-8 74. Sujatha, C. H.; Chacko, J.; Malathion sorption by sediments from a tropical estuary. Chemosphere 1991, 23, 167. 75. Duinker, J.; Hillebrand, M. T.; Neth. J. Sea Res. 1979, 13, 256. DOI: http://dx.doi.org/10.1016/0077-7579(79)90006-1 76. Duinker, J. C.; Hillebrand, M. T. J.; Nolting, R. F.; Wellershaus, S.; Jacobsen, N. K.; Neth. J. Sea Res. 1980, 14, 237. DOI: http://dx.doi.org/10.1016/0077-7579(80)90002-2 77. Hong, S.; Khim, J. S.; Park, J.; Kim, M.; Kim, W. K.; Jung , J.; Hyun, S.; Kim, J. G.; Lee, H.; Choi, H. J.; Codling, G.; Giesy, J. P.; Sci. Total Environ. 2013, 445, 136. DOI: http://dx.doi.org/10.1016/j.scitotenv.2012.12.040 PMID: 23333509 78. Zhou, J. L.; Rowland, S. J.; Water Res. 1997, 31, 1708. DOI: http://dx.doi.org/10.1016/S0043-1354(96)00323-5 79. Duinker, J. C.; Hillebrand, M. T. J.; Nolting, R. F.; Wellershaus, S.; Neth. J. Sea Res. 1982, 15, 141. DOI: http://dx.doi.org/10.1016/0077-7579(82)90003-5 80. Murphy, P. P.; Bates, T. S.; Curl, H. C.; Feely, R. A.; Burguer, R. S.; Estuar Coast Shelf Sci. 1988, 27, 461. DOI: http://dx.doi.org/10.1016/0272-7714(88)90078-9 81. Xie, W. H.; Shiu, W. Y.; Mackay, D.; Mar. Environ. Res. 1997, 44, 429. DOI: http://dx.doi.org/10.1016/S0141-1136(97)00017-2 82. Hegeman, W. J. M.; Weijden, V. D.; Cornelis, H.; Loch, J. P. G.; Environ. Sci. Technol. 1995, 29, 363. DOI: http://dx.doi.org/10.1021/es00002a012 PMID: 22201382 83. Jeon, J.; Kannan, K.; Lim, H. K.; Moon, H. B.; Ra, J. S.; Kim, S. D.; Environ. Sci. Technol. 2010, 44, 2695. DOI: http://dx.doi.org/10.1021/es100151r PMID: 20230022 84. Zulin, Z.; Huasheng, H.; Xinhong, W.; Jianqing, L.; Weiqi, C.; Li, X.; Mar. Pollut. Bull. 2002, 45, 397. DOI: http://dx.doi.org/10.1016/S0025-326X(02)00094-2 PMID: 12398412 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access