Educação
|
|
| Análise da abordagem histórica para a tabela periódica em livros de química geral para o ensino superior usados no Brasil no século XX Analysis of historical approaches to the periodic table in general chemistry college textbooks used in Brazil in the twentieth century |
|
Helena S. A. Leite; Paulo A. Porto*
Departamento de Química Fundamental, Instituto de Química, Universidade de São Paulo, 05508-000 São Paulo - SP, Brasil Recebido em 01/10/2014 *e-mail: palporto@iq.usp.br The aim of this paper was to analyze the historical approaches to the periodic table in general chemistry textbooks used in Brazilian universities in the twentieth century. Textbooks were qualitatively analyzed according to the following criteria: position of the discussion about the periodic table in the book; presence or absence of a specific chapter on the subject; presentation of attempts to classify chemical elements before Mendeleev; presentation of the construction process of the periodic table by Mendeleev; identification of problems in the original table; discussion of Mendeleev's predictions about unknown elements; organization of the periodic table; periodic properties presented and discussed; and the enunciation of the periodic law. The analysis revealed different approaches at specific periods of the twentieth century, from more descriptive approaches to emphasis on attempts to explain the periodic table in terms of atomic orbitals. These changes point to different ways of understanding chemistry during the period studied. INTRODUÇÃO A tabela periódica é uma ferramenta de uso cotidiano dos químicos, a qual apresenta, de forma sistemática, várias informações a respeito das propriedades dos elementos. Sua criação data da segunda metade do século XIX, período no qual os químicos, seguindo o exemplo de ciências como a física e a biologia, começaram a procurar formas de sistematizar o conhecimento existente na área até aquele momento. Buscava-se, dessa forma, estabelecer princípios e leis que legitimassem a química como ciência moderna, afastando-a do empirismo e facilitando seu estudo.1 Esse trabalho de sistematização do conhecimento químico resultou dos esforços de muitos químicos durante muito tempo, e somente adquiriu a forma que conhecemos após o estabelecimento de alguns conceitos que se tornaram marcantes. Alguns personagens e conceitos podem ser destacados aqui, com a ressalva de que o processo de desenvolvimento histórico foi muito mais complexo do que este breve resumo pode esboçar, e de maneira nenhuma foi linear. Um ponto importante foi a definição de elementos químicos como substâncias simples, que apareceu nos trabalhos de Lavoisier, colocando a questão dos constituintes "últimos" da matéria em termos distintos daqueles a que a maioria dos químicos estava habituada.2,3 Dalton, por sua vez, associou as substâncias simples a átomos simples, e trabalhou na determinação de suas massas atômicas relativas, em esforço que teve prosseguimento com Berzelius.4-6 O consenso alcançado no Congresso de Karlsruhe (1860), em torno do conceito de massas atômicas e de sua determinação, também foi fundamental para possibilitar uma classificação dos elementos em função de suas massas atômicas.7 Conforme apontou o historiador da ciência, Michael Gordin, a teoria dos tipos, elaborada por Gerhardt para a classificação dos compostos orgânicos, também encorajou Dmitri Mendeleev (1834-1907) a buscar uma classificação para os elementos químicos.8 Outras tentativas de classificações precederam à de Mendeleev, como as de Döbereiner (lei das tríadas) e Newlands (lei das oitavas), que fizeram os primeiros trabalhos acerca da periodicidade das propriedades dos elementos químicos.9-12 É curioso observar que o trabalho de Mendeleev foi publicado quase simultaneamente ao do químico germânico Julius Lothar Meyer (1830-1895), que também apresentou uma classificação periódica dos elementos semelhante à do químico russo.13,14 Meyer teria chegado, em 1868, a uma classificação de 52 elementos químicos organizados em 15 colunas, mas um artigo seu a esse respeito somente foi publicado em 1870, após Meyer ter tomado conhecimento da tabela publicada por Mendeleev em 1869. Em seu artigo, Meyer admitiu que sua tabela era, fundamentalmente, a mesma que fora proposta por Mendeleev. Entretanto, o historiador Masanori Kaji considera que a tabela de Meyer seria "mais refinada do que a primeira tabela de Mendeleev, especialmente por mostrar, de forma clara, os assim chamados metais de transição".7 Embora os dois químicos tenham publicado trabalhos semelhantes e de maneira independente, a tabela elaborada pelo químico russo ficou mais conhecida e foi mais amplamente aceita. Entre as razões que já foram apontadas na literatura para justificar a primazia de Mendeleev está o fato de o trabalho do químico russo ter sido publicado alguns meses antes, e também por conter previsões a respeito de elementos que até então não eram conhecidos, e que deveriam preencher espaços deixados vazios na tabela (o que conferia um caráter preditivo para a classificação periódica). Além disso, o trabalho de Meyer não foi publicado em sua totalidade, sendo que alguns dados foram omitidos no artigo publicado. Por isso, pareceu aos cientistas da época que o trabalho de Meyer fora baseado na publicação de Mendeleev, um químico mais conhecido entre seus contemporâneos. Outro aspecto que diferencia os dois trabalhos, e que é mencionado por alguns estudiosos para explicar a maior importância do trabalho de Mendeleev, é o fato de a variação periódica ser mostrada pelo químico russo principalmente em termos das propriedades químicas dos elementos, como reatividade, valência e os tipos de compostos em que estavam presentes. Meyer, por sua vez, apontou a periodicidade em termos de propriedades físicas, como ponto de fusão e ebulição.7,9,15 Kaji também apontou o fato de Meyer haver incluído, em seu artigo, especulações a respeito da hipótese de Prout, um tema bastante controverso entre os químicos da época. De acordo com essa hipótese, haveria algum constituinte fundamental da matéria, do qual todos os elementos químicos seriam formados (fazendo com que os valores de todas as massas atômicas fossem múltiplos da massa atômica dessa hipotética matéria primordial). Mendeleev, porém, não concordava com a hipótese de Prout, e procurou enfatizar, em sua classificação, os dados experimentais disponíveis. Por isso, Kaji considerou que a comunidade química da época mostrou-se mais favorável à abordagem de Mendeleev.7 A construção da tabela periódica consumiu anos de esforços intelectuais de Mendeleev. Seu trabalho foi apoiado pela recém-criada Sociedade Russa de Química, que tinha entre seus objetivos difundir o ensino dessa ciência e, para tanto, incentivava a criação de materiais didáticos próprios. Nessa época, considerava-se que o ensino de química na Rússia era prejudicado pela necessidade de tradução de livros estrangeiros, o que implicaria em materiais desatualizados em relação a outros países - pois novos conhecimentos estavam sendo produzidos rapidamente no campo da química.7 Essa preocupação decorria do fato de que os profissionais de química eram considerados, pelas autoridades russas da época, de extrema importância para o desenvolvimento econômico do país, ainda majoritariamente rural.7,16 Entre as reflexões feitas por Mendeleev, presentes em sua obra didática, pode-se destacar a distinção entre o que seria um elemento químico e uma substância simples1,7 e também a analogia com o sistema solar para explicar a estrutura das moléculas.16 Apesar da referida distinção, por vezes Mendeleev intencionalmente identificava uma substância simples como elemento, no âmbito de seu trabalho de sistematização, com a finalidade de obter uma classificação mais adequada.1 Mendeleev utilizou as massas atômicas como critério para organizar os elementos químicos, logrando visualizar certa regularidade das propriedades químicas e físicas dos elementos, o que culminou na construção da tabela periódica. Esse processo requereu que Mendeleev propusesse alterações nos valores de algumas massas atômicas determinados em sua época, e também que supusesse a existência de elementos químicos até então desconhecidos. Incluindo algumas alterações na tabela periódica originalmente proposta, Mendeleev a inseriu, em 1879, em seu livro didático intitulado Princípios de Química, apresentando a tabela como uma forma de sintetizar o conteúdo exposto ao longo dos capítulos precedentes e como um guia para o estudo dos elementos químicos.13,14 A tabela periódica proposta por Mendeleev foi sendo modificada ao longo dos anos, tanto pelo próprio químico russo quanto por outros cientistas. A principal modificação foi a substituição da massa atômica, como critério para o ordenamento dos elementos, pelo chamado número atômico, que viria a ser identificado com o número de prótons do núcleo atômico do elemento. Tal mudança foi possível após os trabalhos de Henry Moseley (1887-1915), publicados em 1913 e 1914, com estudos sobre espectros de raios-X dos elementos que levaram à determinação dos números atômicos e os relacionaram ao número de cargas positivas nos núcleos atômicos.17,18 Outras modificações ocorreram, e ocorrem até os dias de hoje, pela inserção de novos elementos químicos que foram isolados ou sintetizados. Além disso, muitos autores se dedicaram a propor diferentes formas de apresentação da tabela periódica, buscando maneiras de mais bem representar as variações periódicas das propriedades dos elementos. Por isso, foram criadas ao longo do tempo centenas de maneiras de representar a tabela periódica.14,19,20 Atualmente, a tabela periódica tem presença obrigatória nos laboratórios e livros de química geral do mundo todo. A forma como é apresentada e explicada nos livros didáticos, porém, foi se modificando ao longo dos anos por diversas razões, que envolvem a abordagem dada à química em cada época e local, o contexto histórico, e a quantidade, importância e natureza dos temas incluídos nos cursos e livros de química geral. Nos últimos anos, diversos artigos foram publicados apresentando diferentes formas de se abordar a tabela periódica, como, por exemplo: o uso de atividades com cartões virtuais (isto é, no computador), que contêm o nome e algumas propriedades dos elementos químicos, visando proporcionar ao aluno a oportunidade de ele próprio construir a tabela periódica;21 o uso de uma combinação da rede neural de Kohonen com o conjunto de propriedades físico-químicas presentes na tabela periódica, permitindo compreendê-la melhor e prever novos elementos e suas propriedades, assim como fez Mendeleev;22,23 e o uso de técnicas de mapeamento para realçar cada uma das propriedades periódicas.24 O presente estudo visa investigar as modificações na forma de apresentação e discussão da tabela periódica em livros didáticos de química geral para o ensino superior usados no Brasil ao longo do século XX. A análise aqui proposta difere daquela feita por Brito et al.25 que, após apresentarem aspectos históricos e filosóficos da tabela periódica, classificaram 57 livros didáticos dirigidos para o ensino superior quanto à presença ou não de alguns critérios, e quanto à sua apresentação e discussão ser satisfatória ou não. Os critérios analisados abrangiam: a importância da acomodação dos elementos na tabela periódica e da previsão das propriedades de novos elementos; o papel das previsões feitas por Mendeleev; a discussão das propriedades periódicas; a importância do trabalho de Mendeleev; e o desenvolvimento da tabela periódica. O trabalho de Brito et al.25 não visava investigar a variação temporal desses critérios. No presente trabalho, porém, foram comparadas abordagens didáticas para a tabela periódica publicadas em diferentes períodos do século passado. Os livros didáticos para o ensino superior foram escolhidos como objeto de análise devido a sua reconhecida importância no processo de formação de novos cientistas e professores.26,27 Já foi observado que os livros didáticos exercem grande influência sobre os estudantes: são considerados "autoridades" no que se refere ao conteúdo, e muitos os vêem como inquestionáveis.28 Além disso, ainda há uma carência nas investigações científicas sobre livros didáticos para o ensino superior, quanto a aspectos ontológicos e epistemológicos dos conceitos químicos, e suas implicações para o processo de ensino-aprendizagem.29 De acordo com a concepção de Kuhn, os livros didáticos são responsáveis pela transmissão dos paradigmas aceitos e da linguagem usada pela comunidade cientifica da época em que foram publicados, exercendo, por isso, papel fundamental na formação de novos cientistas.26 Choppin, por sua vez, destaca que os livros didáticos são também responsáveis, além do suporte à transmissão dos conhecimentos considerados necessários, por permitir a prática de métodos didáticos, a construção de uma identidade de grupo, e pelo desenvolvimento do espírito crítico das novas gerações.30
ASPECTOS METODOLÓGICOS Para a seleção das obras a serem analisadas, foi feito um levantamento dos livros didáticos dirigidos para o ensino superior utilizados no Brasil ao longo do século XX. Procurou-se identificar a presença das obras simultaneamente nas bibliotecas da Universidade de São Paulo (USP) e da Universidade Federal do Rio de Janeiro (UFRJ), que representam as mais antigas e tradicionais escolas superiores de química do país, bem como no site Estante Virtual (www.estantevirtual.com.br), que reúne o acervo de um significativo número de sebos brasileiros. Esse levantamento resultou na lista de 31 livros de química geral apresentada em artigo de Souza e Porto.31 Dessa relação, foram analisados os 28 livros que constam da Tabela 1, sendo que algumas obras do levantamento de Souza e Porto31 não puderam ser consultadas devido a diversas dificuldades de acesso. Na Tabela 1 foi destacado o ano de publicação e, como muitos dos livros são traduções, destacou-se também o país de origem da obra original.
No presente artigo, cada livro foi analisado qualitativamente, de acordo com critérios fundamentados na história da ciência e em aspectos do ensino de química pertinentes à temática da tabela periódica. A proposição dos critérios levou em consideração aspectos da contemporânea historiografia da ciência que podem contribuir para a compreensão dos processos de construção do conhecimento científico, tais como: (i) o reconhecimento do caráter complexo (não linear, não acumulativo) desses processos; (ii) a importância do contexto histórico (em oposição a concepções puramente internalistas, como se uma ideia científica pudesse surgir "fora do tempo", dependendo apenas de sua relação com outras ideias da ciência); e (iii) a adoção de uma abordagem diacrônica (evitando o anacronismo de avaliar ideias do passado fazendo juízos de valor baseados em critérios fundamentados em ideias do presente, que não fariam sentido no contexto histórico original). Os critérios de análise pretendem contribuir para uma aproximação entre a história da ciência e o ensino de química, voltada para os objetivos educacionais da atualidade.32 Alguns dos critérios aqui propostos procuram dialogar com concepções inadequadas sobre a ciência que são compartilhadas pelo público em geral, por estudantes e mesmo por professores de ciências, e que foram sumarizadas por Cachapuz e colaboradores.33 A maneira como o processo de construção da tabela periódica é apresentado nos livros didáticos pode reforçar ou se contrapor a determinadas concepções inadequadas de ciência, conforme procuramos apresentar neste trabalho. Permite, ainda, discutir aspectos da filosofia da química, como o estatuto epistemológico das leis nesta área do conhecimento.14 Os critérios de análise encontram-se descritos na Tabela 2.
A análise referente a cada um desses tópicos propiciou a comparação entre os diferentes livros e entre diferentes períodos históricos do século XX. A tabela periódica nos livros didáticos: aspectos históricos e didáticos Os resultados obtidos permitem fazer uma série de reflexões, como as que serão expostas a seguir. A discussão aqui proposta encontra-se segmentada conforme os tópicos de análise descritos. Posição da discussão da tabela periódica no livro Observou-se que apenas Holmes (1946) apresenta a tabela ao final do livro: todos os demais trazem a tabela logo no ínicio (17 livros), ou no meio (10 livros), após discutir propriedades da matéria e dos elementos químicos. Desse modo, pode-se concluir que muitos autores do século XX consideraram a tabela como um ponto de partida e como um conceito básico da química e que, portanto, deveria ser apresentado inicialmente. Essa ideia difere, em alguma medida, da proposta de Mendeleev, que apresentava a tabela no meio do seu livro, como resultado da discussão das propriedades de alguns elementos químicos feita até aquele momento, e a usava como guia para a discussão dos demais elementos nos capítulos seguintes do livro. A tendência observada parece ser uma consequência natural da importância adquirida pela tabela periódica no contexto da química, como instrumento da sistematização de uma grande variedade de conhecimentos.


Presença de um capítulo específico para a discussão da tabela periódica A análise desse aspecto permite caracterizar uma modificação temporal interessante. Nos livros publicados no início do século (de 1904 até 1912), a tabela é discutida juntamente com os conceitos de elemento químico e molécula, e é apresentada como uma dentre várias formas de classificação dos elementos químicos. Alguns autores sugerem que a classificação periódica é menos importante do que outras, como, por exemplo, Maciel (1912), que argumenta ser a divisão entre metais e ametais a melhor para o estudo dos elementos. Em seguida, no período entre 1917 e 1939, alguns livros apresentam um capítulo específico e outros não. Em meados do século XX (de 1944 até 1965), todos os livros apresentam um capítulo exclusivo para o tema. Segue-se outro período (de 1967 até 1981) em que alguns livros trazem um capítulo específico e outros não. O livro de Pimentel (1974) se diferencia dos demais por não discutir a tabela periódica em um capítulo específico do livro, inserindo essa discussão em dois momentos distintos: ao apresentar algumas propriedades dos elementos, e ao mostrar sua periodicidade. Finalmente, no final do século (de 1986 a 1999), todos os livros voltam a não apresentar um capítulo exclusivo, mas discutem a tabela periódica junto com o modelo atômico contemporâneo. A modificação temporal observada pode ser fruto da consolidação da tabela periódica e das modificações dos conceitos de elemento químico e molécula, no início do século, devido ao surgimento de controvérsias e de novas teorias, como a proposição do conceito de número atômico e a teoria quântica.34 Após a consolidação da importância da tabela periódica, ocorre outro movimento, como consequência da ênfase nos conhecimentos sobre a estrutura atômica, na segunda metade do século, juntamente com o aumento da aceitação e do uso da mecânica quântica para explicar não só o modelo atômico, mas também a tabela periódica. Assim, no final do século, a tabela periódica parece adquirir um caráter subalterno, como se estivesse condicionada por uma teoria mais ampla e explicativa - embora ainda hoje se questione a insuficiência da teoria quântica para explicar as propriedades periódicas e a formação dos períodos da tabela.35 Apresentação do histórico anterior a Mendeleev e do trabalho de Meyer A Tabela 5 mostra os autores anteriores a Mendeleev citados nos livros didáticos como envolvidos, de alguma forma, nos antecedentes que permitiram a criação da tabela periódica. O histórico anterior a Mendeleev está presente na maioria (15 de 24) dos livros publicados no período de 1912 a 1981, enquanto os quatro livros do final do século XX não abordam esse aspecto, ou o tratam como curiosidade, de pouca importância para o estudo da química. Os nove livros do período de 1912 a 1981 que não discutem os antecedentes da criação da tabela periódica citam, porém, o trabalho de Meyer. Esse químico é apresentado, em 20 livros desse período, como autor independente de um trabalho semelhante ao de Mendeleev e publicado poucos meses depois. Essa mesma descrição do químico alemão está presente nos livros de Brady (1986) e Atkins (1999), sendo que este último traz um breve histórico, apresentado num quadro separado, com caráter de material suplementar.
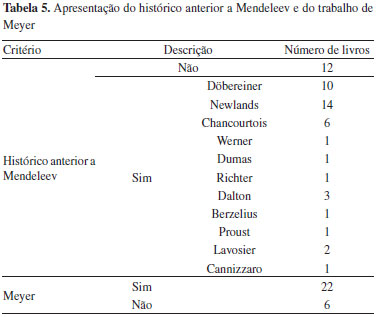
Entre os químicos anteriores a Mendeleev, cujos trabalhos contribuíram para a construção da tabela periódica, os mais citados são: J. A. R. Newlands (1837-1898), químico britânico que formulou a chamada "lei das oitavas"; J. W. Döbereiner (1780-1849), químico germânico que formulou a "lei das tríades"; e A.-E. B. de Chancourtois (1820-1886), químico francês que criou a "hélice dos elementos". De fato, esses autores são reconhecidos por historiadores da ciência por haverem se dedicado à questão da classificação dos elementos, embora outros pudessem também ser lembrados, como William Odling (1829-1921) e Gustavus Hinrichs (1836-1923),9 que não são citados por nenhum dos livros didáticos. A ênfase dada a Newlands, Döbereiner e de Chancourtois demonstra um exemplo da repetição comum em livros didáticos, ou seja, observa-se que muitos livros repetem os mesmos exemplos e anedotas, o que sugere que os autores baseiam suas obras nas anteriores. Assim, muitas histórias são narradas de forma semelhante e muitas discussões são feitas da mesma maneira em diferentes livros, como que "fossilizando" certas narrativas didáticas.36 Embora muitos livros tragam o histórico anterior à criação da tabela por Mendeleev, poucos são os que descrevem esse processo em detalhes. De modo geral, os livros trazem o processo de criação como tendo sido linear (um trabalho teria levado ao outro, numa sequência "progressiva"), sem realmente exprimir todos os conflitos característicos da produção de um trabalho científico, como apresentado, por exemplo, nos trabalhos de Van Sprosen12 e Cassebaum & Kauffman.9 Sua discussão poderia ser relevante para a formação científica dos alunos, permitindo reflexões sobre tentativas de classificação, escolha de critérios, aceitação ou não pela comunidade científica, fecundidade de propostas inovadoras, disputas por prioridade etc.. Apresentação do processo de construção da tabela periódica
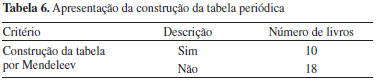
O processo de construção da tabela periódica é apresentada em 10 dos 28 livros analisados, nos quais se descreve, principalmente, a formação dos períodos e famílias, ressaltando o caráter empírico do processo e a genialidade de Mendeleev. Poucos livros citam que esse processo envolveu anos de trabalho até que o químico russo chegasse à versão final da tabela.37 Assim como na abordagem feita pelos livros em relação aos trabalhos que antecederam ao de Mendeleev, aqui também não são explicitados aspectos fundamentais de um trabalho científico, tais como a definição da situação-problema a ser investigada, as diferentes tentativas para lidar com ela, e o longo tempo e trabalho dedicado até se chegar ao trabalho final. Além disso, nenhum dos livros menciona que a tabela continuou sendo construída, pois novos elementos foram isolados e caracterizados após o trabalho de Mendeleev,38 nem que alguns aspectos da tabela periódica, como a localização do hidrogênio,39 a classificação dos elementos da família do zinco,40 o formato mais adequado para sua apresentação19,20 e a divisão em grupos de acordo com a configuração eletrônica dos elementos41-44 ainda são motivos de discussão no meio científico. Também é interessante observar que Brady (1986) é o único autor que cita a finalidade didática da criação da tabela periódica por Mendeleev. A superficialidade na abordagem histórica impede que os leitores vislumbrem aspectos importantes da complexidade do processo de consolidação da tabela periódica, como as dificuldades surgidas, por exemplo, por ocasião da caracterização de novos elementos. A compreensão dessa complexidade ajudaria os estudantes a entenderem a ciência como um processo em permanente transformação, e não como um corpo de conhecimentos já terminado. Identificação de problemas na tabela periódica de Mendeleev

Observou-se que os principais problemas apontados pelos autores dos livros didáticos na clasificação proposta por Mendeleev são a ausência de lugar para determinados elementos e a manipulação dos dados experimentais, caracterizada pela inversão, em alguns momentos, da ordem crescente de massas atômicas para conseguir posicionar alguns elementos nos lugares esperados (em função de suas propriedades químicas). Esses problemas são apresentados por alguns livros do início do século, o que está de acordo com a visão crítica que alguns químicos da época apresentavam em relação à tabela periódica. Tal aspecto pode ser relacionado à discussão, que ainda prossegue, sobre a relevância desses problemas para a aceitação do trabalho de Mendeleev na época em que foi proposto.15,45,46 Nos livros publicados após 1927, e após a difusão do trabalho de Moseley sobre os números atômicos, tais problemas são apresentados como tendo sido solucionados pela introdução desse novo conceito. Ou seja, os elementos que pareciam fora de lugar, quando eram ordenados de acordo com as massas atômicas, encontraram seu lugar na ordem dada pelos números atômicos. Devido a essa correção, os livros do período entre 1965 e 1977 apontam as duas características do trabalho de Mendeleev acima mencionadas (falta de lugar na tabela para certos elementos e inversão nas posições de outros), mas não as consideram como problemas. Nos livros posteriores a esse período, não aparecem mais menções a esses aspectos - o que pode ser relacionado ao fato de os livros didáticos do final do século XX darem pouca importância ao processo histórico de desenvolvimento da tabela periódica. Discussão acerca das previsões de novos elementos feitas por Mendeleev Apesar de haver controvérsia acerca da importância das previsões feitas por Mendeleev para a aceitação da tabela periódica,45,46 os livros didáticos dão grande destaque para essa característica do trabalho do químico russo, ressaltando a legitimidade que as previsões bem sucedidas conferiram à tabela periódica. Isso fica claro quando se observa que, dos 28 livros analisados, somente 6 não mencionam esse aspecto. A maioria dos livros cita as previsões a respeito das propriedades dos elementos que viriam a receber os nomes de gálio (chamado de eka-alumínio por Mendeleev), escândio (eka-boro) e germânio (eka-silício). Este último constitui o exemplo mais comum, sendo muitas vezes apresentado um quadro comparativo entre as propriedades previstas por Mendeleev e as observadas após o isolamento do germânio. Também aqui se observa um caso de repetição de exemplos fornecidos pelos livros didáticos, como já comentado anteriormente. Os três elementos que são dados como exemplos foram os primeiros a serem descobertos após a publicação da tabela periódica, ainda no século XIX (gálio em 1875, escândio em 1879, germânio em 1889), com o auxílio de métodos espectroscópicos recém criados e que estavam sendo aperfeiçoados.47

Entretanto, a análise histórica revela que Mendeleev fez muitas outras previsões, baseadas em relações numéricas entre os pesos atômicos dos elementos conhecidos e em sua disposição na tabela periódica, e que nunca se confirmaram. Podemos citar, como exemplos, a suposta existência de elementos mais leves que o hidrogênio, e de outros, como o eka-molibdênio (de massa 140) e o eka-iodo (de massa 170), que jamais foram observados.14 Essas previsões fracassadas não são mencionadas em nenhum dos livros analisados, o que novamente mostra que os autores de materiais didáticos não se preocupam em apresentar determinados aspectos da complexidade do processo de construção da ciência, preferindo focar descobertas individuais, neste caso chegando até a mostrar Mendeleev como um "gênio" capaz de prever propriedades de novos elementos com precisão. Uma abordagem mais equilibrada, mostrando que Mendeleev fez algumas previsões muito acertadas, e outras que não se confirmaram, daria uma dimensão mais humana à figura do cientista, e auxiliaria a compreensão de que o erro também é parte do empreendimento científico. Apresentação da tabela organizada conforme as massas atômicas ou os números atômicos, discussão da estrutura atômica e enunciação da lei periódica Esses aspectos da abordagem para a tabela periódica estão intimamente ligados a fatores históricos, pois se relacionam a conceitos que, em alguns casos, estavam sendo criados na época da produção dos livros didáticos investigados. O conceito de número atômico surgiu nos trabalhos de Moseley em 1913-1914, e as ideias sobre a estrutura atômica sofreram várias alterações ao longo da primeira metade do século XX. Além disso, por se tratarem de aspectos novos, há um período claro de transição entre a abordagem anterior e a consolidação dessas novidades nos livros didáticos. No caso da explicação da periodicidade das propriedades dos elementos, a transição entre a explicação pela ordem crescente de massa atômica para a de número atômico ocorreu no período de 1927 a 1967. Nesse período, ambas as abordagens aparecem nos livros, embora alguns deles somente mencionem a classificação pelas massas atômicas sob o ponto de vista histórico. Antes desse período, ou seja, de 1904 a 1917, a abordagem obviamente era apenas pelas massas atômicas, sendo Ostwald, em 1924, o primeiro a mencionar a lei de Moseley numa nota de rodapé, cuja função era explicar como foram solucionados os problemas apontados na elaboração da tabela periódica. Após o período de transição mencionado acima, ou seja, de 1968 até o final do século, a abordagem é feita somente pelo número atômico, exceto pelos livros que, ao focalizar a história da tabela periódica, mencionam o uso da massa atômica como critério inicial para classificar os elementos.
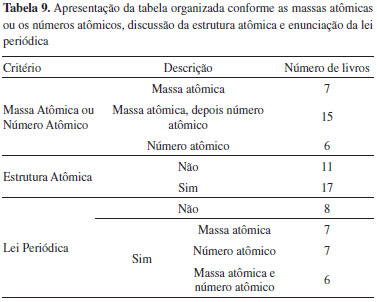
Quanto à apresentação da estrutura atômica, os livros do início do século não trazem nenhuma discussão, a qual começa a ser apresentada em 1927, com a introdução da lei de Moseley nos livros. Assim como foi visto em relação ao uso dos números atômicos, há um período de transição (entre 1927 e 1967) rumo à aceitação da apresentação da estrutura atômica como conteúdo didático importante, não só para o entendimento da tabela periódica, mas da química de maneira geral. No período seguinte (1968 a 1999), todos os livros passam a abordar esse tema, inicialmente em capítulos anteriores ao da tabela periódica, e posteriormente em capítulos únicos, nos quais a estrutura ganha papel de destaque e a tabela periódica é apresentada como consequência da estrutura atômica e como uma ferramenta da química que sumariza as propriedades periódicas. Este ponto adquire grande destaque nos livros mais recentes, do final do século XX. Esse aspecto ilustra um movimento histórico mais amplo no bojo do conhecimento químico: a tabela periódica, grande súmula de conhecimentos experimentais sobre as substâncias, passa a ser subordinada a teorias que buscam explicar a química em termos de entidades submicroscópicas. Quanto à lei periódica, pode-se observar uma modificação na forma de seu enunciado. Mendeleev a apresentou da seguinte forma: "as propriedades dos elementos são funções periódicas de seus pesos atômicos"; porém, após os trabalhos de Moseley, a lei foi reformulada, e onde se lia "pesos atômicos" passou-se a ler "números atômicos". Essa reformulação foi introduzida gradualmente nos livros, ou seja, há um período de transição (1939 a 1950) em que tanto a lei original quanto a reformulada são enunciadas. Após esse período, alguns livros não mais apresentam a lei na forma original, enquanto outros somente a mencionam ao abordar a história. Brinkley (1944) aponta para o fato de a lei periódica não ser enunciada em alguns livros didáticos em função de seu caráter empírico, ou seja, por não se tratar de uma lei matemática. Lamirand (1927) aponta essa razão para se referir à "classificação periódica dos elementos" e não a uma "lei periódica". Essa concepção aproxima a química da biologia, na qual predominam classificações, diferentemente das ciências exatas e da física, nas quais há teoremas e leis. Porém, todos os demais autores que a apresentam, utilizam o termo "lei periódica", o que sugere uma tentativa de aproximação, em especial, com a física, cujo ingresso na modernidade foi caracterizado, entre outros aspectos, pela matematização de suas leis. Conforme têm observado Scerri14 e outros filósofos da química contemporâneos, o estatuto epistemológico das leis em química é objeto de debate: "A periodicidade química pode aparentar um caráter não tão de lei como as leis da física... Pode-se argumentar que a periodicidade química oferece um exemplo de uma lei tipicamente química, aproximada e complexa, mas ainda exibindo, fundamentalmente, um comportamento de lei (p. 18)."14 Propriedades periódicas apresentadas e discutidas
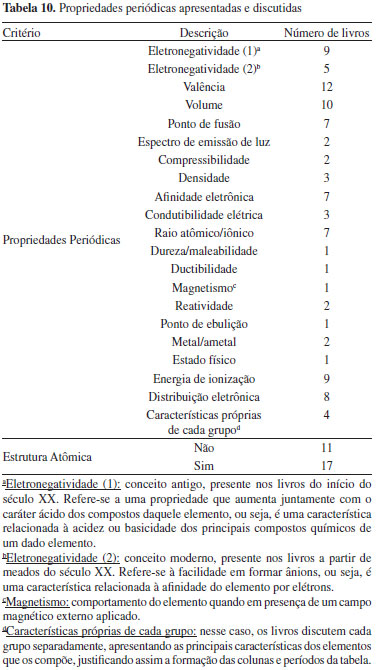
Ao analisar as propriedades periódicas apresentadas pelos livros, é possível observar diversos aspectos relevantes. Primeiramente, nota-se um aumento no número de propriedades que são mencionadas com o passar do tempo. Uma dessas propriedades é a eletronegatividade, que tem seu conceito modificado ao longo do século: no ínicio, esse termo se referia ao carater ácido ou básico dos compostos mais comuns formados pelos elementos, e posteriormente passou a se referir à capacidade do elemento de atrair um elétron para sua camada de valência, formando ânions. Outro aspecto que se observa é a modificação na qualidade das propriedades abordadas: no início do século, eram mencionadas mais características molares, e, com o passar do tempo, o enfoque se deslocou para características atômicas, que envolvem configurações eletrônicas e partículas subatômicas. Por fim, pode-se afirmar que a propriedade mais mencionada é a valência dos elementos, que, apesar dos problemas iniciais causados pela polivalência de alguns átomos (o que é apontado em alguns livros), é uma característica de fácil percepção pela análise das fórmulas químicas dos compostos existentes, e muito importante para explicar a organização dos grupos da tabela, isto é, sua própria construção. Mais uma vez, observa-se o movimento de transformação da química ao longo do século XX, da ciência das substâncias para a ciência das moléculas, átomos e orbitais.
CONSIDERAÇÕES FINAIS Pela discussão apresentada acima, percebe-se que a maior parte das alterações temporais na abordagem da tabela periódica em livros didáticos de química geral se deve à incorporação de novos conceitos (número atômico e estrutura atômica), que foram sendo desenvolvidos no século XX. A incorporação de novos conceitos aos livros didáticos não é, evidentemente, imediata, e o período decorrido entre sua proposição no âmbito da ciência e sua aparição nos livros pode variar. Por outro lado, a abordagem para aspectos do conhecimento químico apresentou diferentes ênfases ao longo do século passado, variando conforme as concepções mais gerais a respeito da própria química. No início do século XX, a química era tratada pelos livros didáticos como uma ciência mais prática e aplicada, na qual ainda havia espaço para apresentação de sua história e de diversos aspectos descritivos. A partir dos anos 1950, a química passou a ser apresentada como a ciência do mundo microscópico e invísivel, com ênfase em princípios generalizantes, o que gerou uma diminuição do espaço destinado para a história, considerada de menor importância nos livros didáticos. No final do século, a química passou a ser a ciência das interfaces com outras áreas do conhecimento, restando pouco espaço para a história e ganhando destaque as aplicações cotidianas e as relações da química com outras áreas da ciência e da tecnologia.28,31 O modo como a tabela periódica foi apresentada em livros de química geral, ao longo do século passado, reflete algumas dessas características: gradual perda de espaço dos aspectos históricos, descritivos e macroscópicos das propriedades das substâncias em favor de modelos submicroscópicos - especialmente do modelo de orbitais, proposto como explicação para a periodicidade das propriedades dos elementos. A pouca importância atribuída à abordagem histórica nos livros didáticos pode reforçar concepções inadequadas sobre a atividade científica entre seus leitores. A história do desenvolvimento da tabela periódica, se apresentada como um estudo de caso, pode propiciar o entendimento da ciência como uma construção coletiva e permanente, que envolve trabalho árduo e controvérsias, e que está sujeita às condições conceituais e sociais da época em que é produzida. Quando nos referimos a "estudo de caso", estamos propondo a superação da simples menção a nomes e datas de "grandes descobertas", organizadas na forma de uma sequência linear idealizada, em favor da apresentação das contribuições de diversos cientistas de modo a pelo menos delinear a complexidade do processo de construção da ciência.32 Acreditamos que isso poderia, por um lado, aumentar o interesse do estudante pela ciência, por ser apresentada como um esforço colaborativo e criativo, em vez de resultar da inspiração de "gênios", com quem a maioria dos estudantes não se identifica. Além disso, o processo histórico pode auxiliar na própria compreensão do conteúdo científico: no caso em questão, auxiliar o entendimento da periodicidade dos elementos, e quais os raciocínios químicos que levaram a sua proposição.
AGRADECIMENTOS Ao CNPq (Processos 308674/2011-1 e 304450/2014-6) e à FAPESP (Processo 2007/02542-4), pelo apoio financeiro.
REFERÊNCIAS 1. Bensaude-Vincent, B.; Br. J. Hist. Sci. 1987, 18, 3. 2. Hendry, R. F.; Found. Chem. 2005, 72, 31. DOI: http://dx.doi.org/10.1023/B:FOCH.0000042886.65679.4e 3. Hendry, R. F.; Found. Chem. 2006 ,73, 864. 4. Nash, L. K.; Isis 1956, 47, 101. DOI: http://dx.doi.org/10.1086/348480 5. Wisniak, J.; Chem. Educ. 2000, 5, 343. DOI: http://dx.doi.org/10.1007/s00897990357a 6. Zwier, K. R.; Philosophy of Science 2011, 78, 842. DOI: http://dx.doi.org/10.1086/662284 7. Kaji, M.; Found. Chem. 2003, 5, 189. DOI: http://dx.doi.org/10.1023/A:1025673206850 8. Gordin, M. D.; Hist. Stud. Phys. Biol. Sci. 2002, 32, 263. DOI: http://dx.doi.org/10.1525/hsps.2002.32.2.263 9. Cassebaum, H.; Kauffman, G. B.; Isis 1971, 62, 314. DOI: http://dx.doi.org/10.1086/350762 10. Dmitriev, I. S.; Hist. Stud. Phys. Biol. Sci. 2004, 34, 233. DOI: http://dx.doi.org/10.1525/hsps.2004.34.2.233 11. Scerri, E. R.; J. Chem. Educ. 2008, 85, 585. DOI: http://dx.doi.org/10.1021/ed085p585 12. Van Sprosen, J.; J. Chem. Educ. 1959, 36, 565. DOI: http://dx.doi.org/10.1021/ed036p565 13. Van Sprosen, J.; The Periodic System of Chemical Elements: a History of the First Hundred Years. Elsevier: Amsterdam, 1969. 14. Scerri, E. R.; The Periodic Table: Its Story and Significance. Oxford University Press: Oxford, 2007. 15. Brush, S.; Isis 1996, 87, 595. DOI: http://dx.doi.org/10.1086/357649 16. Baia, F. A. S. P.; Dissertaçao de Mestrado, Programa de Pós-Graduaçao Interunidades em Ensino de Ciências, Universidade de Sao Paulo, Brasil, 2010. 17. Moseley, H.; Philos. Mag. 1913, 26, 1024. DOI: http://dx.doi.org/10.1080/14786441308634968 18. Moseley, H.; Philos. Mag. 1914, 27, 703. DOI: http://dx.doi.org/10.1080/14786440408635141 19. Laing, M.; J. Chem. Educ. 2009, 86, 1183. DOI: http://dx.doi.org/10.1021/ed086p1183 20. Scerri, E. R.; J. Chem. Educ. 2009, 86, 1185. DOI: http://dx.doi.org/10.1021/ed086p1185 21. Wiediger, S. D.; J. Chem. Educ. 2009, 86, 1212. DOI: http://dx.doi.org/10.1021/ed086p1212 22. Chen, D. Z.; J. Chem. Educ. 2010, 87, 433. DOI: http://dx.doi.org/10.1021/ed800125v 23. Lemes, M. R.; Pino, A. D.; J. Chem. Educ. 2011, 88, 1511. DOI: http://dx.doi.org/10.1021/ed100779v 24. Winter, M. J.; J. Chem. Educ. 2011, 88, 1507. DOI: http://dx.doi.org/10.1021/ed1000203 25. Brito, A.; Rodriguez, M. A.; Niaz, M.; J. Res. Sci. Teach. 2004, 45, 84. 26. Kuhn, T. S.; A Estrutura das Revoluçoes Científicas. Perspectiva: Sao Paulo, 2009. 27. Rozentalski, E. F.; Dissertaçao de Mestrado, Programa de Pós-Graduaçao Interunidades em Ensino de Ciências, Universidade de Sao Paulo, Brasil, 2013. 28. Souza, K. A. F. D.; Tese de Doutorado, Programa de Pós-Graduaçao em Química, Instituto de Química, Universidade de Sao Paulo, Brasil, 2012. 29. Souza, K. A. F. D.; Mate, C. H.; Porto, P. A.; Enseñanza de las Ciências 2009, vol. extra, 1337. 30. Choppin, A.; Educaçao e Pesquisa 2004, 30, 549. 31. Souza, K. A. F. D.; Porto, P. A.; Science & Education 2012, 21, 705. DOI: http://dx.doi.org/10.1007/s11191-012-9442-z 32. Porto, P. A. In Ensino de Química em Foco; Santos, W. L. P.; Maldaner, O. A., orgs.; Editora Unijuí: Ijuí, 2010, p. 159-180. 33. Cachapuz, A.; Gil-Perez, D.; Carvalho, A. M. P.; Praia, J.; Vilches, A. In A Necessária Renovaçao do Ensino das Ciências Cachapuz, A.; Gil-Perez, D.; Carvalho, A. M. P.; Praia, J.; Vilches, A., orgs.; Cortez: Sao Paulo, 2005. 34. Kragh, H.; Studies in History and Philosophy of Science 2000, 31B, 435. DOI: http://dx.doi.org/10.1016/S1355-2198(00)00025-3 35. Scerri, E. R.; J. Chem. Educ. 1998, 75, 1384. DOI: http://dx.doi.org/10.1021/ed075p1384 36. Ramberg, P. J.; Ambix 2000, 47, 170. DOI: http://dx.doi.org/10.1179/amb.2000.47.3.170 PMID: 11640223 37. Laing, M.; J. Chem. Educ. 2008, 85, 63. DOI: http://dx.doi.org/10.1021/ed085p63 38. Hoffman, D. C.; J. Chem. Educ. 2010, 86, 1122. DOI: http://dx.doi.org/10.1021/ed086p1122 39. Cronyn, M. W.; J. Chem. Educ. 2003, 80, 947. DOI: http://dx.doi.org/10.1021/ed080p947 40. Jensen, W. B.; J. Chem. Educ. 2003, 80, 952. DOI: http://dx.doi.org/10.1021/ed080p952 41. Clark, R. W.; J. Chem. Educ. 2008, 85, 1493. DOI: http://dx.doi.org/10.1021/ed085p1493 42. Lavelle, L.; J. Chem. Educ. 2008, 85, 1491. DOI: http://dx.doi.org/10.1021/ed085p1491.2 43. Jensen, W. B.; J. Chem. Educ. 2008, 85, 1491. DOI: http://dx.doi.org/10.1021/ed085p1491.2 44. Stewart, P. J.; J. Chem. Educ. 2008, 85, 1490. DOI: http://dx.doi.org/10.1021/ed085p1490 45. Akeroyd, F. M.; Journal for General Philosophy of Science 2003, 34, 337. DOI: http://dx.doi.org/10.1023/B:JGPS.0000005277.60641.ca 46. Scerri, E. R.; Worrall, J.; Studies in History and Philosophy of Science 2001, 32, 407. DOI: http://dx.doi.org/10.1016/S0039-3681(01)00023-1 47. Spring, R. J.; Educ. Chem. 1975, 12, 134. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access