Artigo
|
|
| Eletrorrecuperação de cobre utilizando reator eletroquímico de leito de jorro Copper electrowinning using a spouted-bed electrochemical reactor |
|
Pedro H. Britto-Costa*; Luís A. M. Ruotolo
Departamento de Engenharia Química, Universidade Federal de São Carlos, 13565-905 São Carlos - SP, Brasil Recebido em 14/10/2014 *e-mail: britto_pedro@hotmail.com In this work, copper electrowinning using a three-dimensional spouted-bed electrode (SBE) was studied in order to investigate the effects of current density (i), concentration of supporting electrolyte (Cs), pH, electrolyte temperature, and bed thickness on the process current efficiency (EC), energy consumption (CE) and space-time yield (Y). The results indicated that the SBE may be successfully used for the electrowinning of copper when the copper ion concentration is high and the pH is between 1 and 2. In this case, 100% CE, 2.7 kWh kg-1 EC and 118 kg L-1 h-1 Y can be achieved. It was verified that an increase in the electrolyte temperature caused a decrease in the electrodeposition rate (from 3.97 g L-1h-1 to 1.17 g L-1 h-1), indicating that, despite the solution conductivity enhancement, temperature promoted the increase in the anodic dissolution kinetics. The results also showed that EC depends on the applied current density, whereby greater EC values can be obtained using high current densities. Finally, the copper particles were analyzed by scanning electron microscopy and it was confirmed that a smooth, uniform and compact electrodeposit can be obtained without using any chemical additives. INTRODUÇÃO As indústrias hidrometalúrgicas utilizam eletrodos planos em seus processos de metalurgia extrativa nos quais são aplicadas densidades de corrente da ordem de 300 A m-2.1-3 Devido à pequena área superficial específica deste tipo de eletrodo, células eletroquímicas extremamente grandes são requeridas para se obter uma elevada produtividade. Além destas limitações, existem outras desvantagens em se utilizar eletrodos planos, como a necessidade de remover o depósito do substrato, a intensa liberação de vapores ácidos devido ao tamanho das células eletroquímicas, que podem oxidar os contatos elétricos ou mesmo causar danos à saúde, além da necessidade de se utilizar um grande número de placas anódicas.2-8 Os eletrodos de PbO2, geralmente usados nos processos de eletrorrecuperação, têm como principal desvantagem a baixa resistência à corrosão, principalmente durante a manutenção da célula ou remoção do eletrodepósito em que a solução ácida ataca o eletrodo no momento em que não há passagem de corrente elétrica, diminuindo sua vida útil, além de contaminar o depósito catódico devido à incorporação de chumbo.9,10 Aditivos químicos geralmente são utilizados na tentativa de minimizar este problema. Neste contexto, o eletrodo tridimensional, em particular o eletrodo particulado, apresenta-se como uma alternativa para superar alguns dos problemas associados ao processo convencional. Altas densidades de corrente elétrica (até 4466 A m-2) poderiam ser aplicadas nestes reatores particulados3,6 sem prejudicar a qualidade do depósito, uma vez que estes eletrodos apresentam elevada área superficial, pela qual a corrente elétrica fornecida é distribuída no meio poroso.3,6,11 Além disso, caso as partículas sejam do mesmo material do metal a ser depositado, a etapa de remoção do depósito seria desnecessária, reduzindo bastante os custos com mão-de-obra e sem a necessidade de interrupções da produção.3 Devido à significativa redução do volume do reator, uma substituição do ânodo de chumbo por um que seja dimensionalmente estável poderia se tornar viável e reduzir, ou até mesmo eliminar, a necessidade de aditivos químicos.3,12 A utilização de reatores tridimensionais também soluciona o problema de vapores ácidos, que podem ser facilmente canalizados e neutralizados, evitando sérios danos à saúde dos operários. Dentre os eletrodos de leito particulado, o de leito fixo tem sido muito estudado, particularmente na área de tratamento de efluentes, em que a concentração de metais é baixa.13-16 As principais características do leito fixo são a alta condutividade elétrica da fase sólida e o elevado valor do coeficiente de transporte de massa. Essas características promovem altos valores de eficiência de corrente, fazendo com que o leito fixo seja a configuração mais eficiente para a eletrodeposição de metais.15-18 Entretanto, quando a concentração do metal é muito alta, o entupimento do eletrodo decorrente da deposição do metal nos seus poros ocorre muito rapidamente, impossibilitando a sua utilização em escala industrial.16 Visando a solucionar os problemas relacionados ao leito fixo, foram propostos eletrodos particulados em que o movimento do fluido resulta no movimento das partículas. Nessa classe de eletrodos encontra-se o de leito de jorro, o qual é caracterizado por um movimento ascendente das partículas no canal de jorro, promovendo então a circulação das partículas. Ao atingir a região da fonte, as partículas sofrem um movimento descendente devido à diminuição da velocidade do fluido, caindo na região do anulus e circulando por esta região por efeito da gravidade, atingindo novamente a região de entrada do canal de jorro e permanecendo então em um movimento circular que, além de promover altas taxas de transferência de massa, também evita a aglomeração das partículas do leito devido ao depósito. Uma descrição mais detalhada do reator de leito de jorro foi feita por Farinos et al. em 2012.19 Assim como no eletrodo de leito fluidizado, o qual já foi estudado por diversos autores,20-23 a taxa de reação no eletrodo de leito de jorro é bastante sensível às condições fluidodinâmicas, uma vez que a condutividade da fase sólida, principalmente na região de jorro, depende da frequência estatística de choque entre as partículas,21 a qual é diretamente influenciada pela expansão do leito. Por isso, zonas de dissolução dentro do cátodo poroso podem ocorrer, especialmente em soluções muito ácidas.11,24,25 Estes eletrodos tridimensionais são apresentados como alternativa promissora para a eletrodeposição de metais a partir de soluções diluídas, devido à elevada área superficial e por proporcionarem altas taxas de transferência de massa.3,6,11,14-16,19,21,26-28 Entretanto, pouco tem-se estudado a respeito de sua utilização nos processos hidrometalúrgicos. Embora a limitação destes processos não seja dada pela transferência de massa, devido às altas concentrações deste tipo de eletrólito, a elevada área superficial de eletrodos tridimensionais incrementa consideravelmente o rendimento espaço-tempo (Y) do reator.29 Desta forma, a utilização do leito de jorro constituído por partículas do mesmo metal a ser depositado representa uma grande vantagem no processo, uma vez que no método convencional o cobre, depositado nas placas planas, precisa ser removido por um processo demasiadamente trabalhoso, conhecido como colheita. Esta etapa do processo convencional pode ser realizada por equipamentos sofisticados e automatizados, porém, que necessitam de manutenção constantemente, ou ainda ser realizado por operadores, em um processo moroso. Neste trabalho, estudou-se a eletrorrecuperação de cobre em um eletrodo tridimensional de leito de jorro composto por partículas cilíndricas de cobre visando a determinar as condições experimentais em que se obtenha elevados valores de eficiência de corrente e rendimento espaço-tempo aliados a um baixo consumo energético.
PARTE EXPERIMENTAL Os experimentos de eletrorrecuperação de cobre foram realizados no sistema experimental esquematizado na Figura 1. O eletrólito foi preparado utilizando-se sulfato de cobre pentahidratado (CuSO4.5H2O) como fonte de íons cobre, sulfato de sódio (Na2SO4) como eletrólito suporte e ácido sulfúrico para ajuste do pH. Água deionizada foi utilizada no preparo de todas as soluções. Nenhum aditivo químico foi adicionado para melhorar as condições de eletrorrecuperação, comumente utilizados nos processos convencionais.
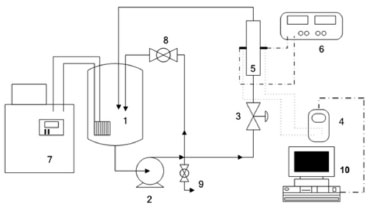 Figura 1. Representação esquemática do sistema experimental. 1) reservatório de eletrólito; 2) bomba centrífuga; 3) válvula de controle da vazão ao reator; 4) multímetro (Minipa ET-2076); 5) reator eletroquímico; 6) fonte de corrente contínua (Minipa, modelo 3006D); 7) banho termostático (Quimis - modelo Q214D2); 8) válvula do by-pass; 9) válvula de esgotamento do sistema e 10) computador para aquisição de dados
O procedimento experimental consistia em preparar o eletrólito, montar o reator eletroquímico e acoplá-lo ao sistema, ajustar a corrente elétrica e realizar as conexões elétricas. O experimento se iniciava quando era acionada a fonte de corrente. Amostras de eletrólito foram coletadas a cada 10 min, totalizando 7 amostras em 1 h de experimento. A concentração de cobre destas amostras foi determinada utilizando-se um espectrofotômetro UV-Vis modelo Ultrospec 2100 Pro, da Amersham Pharmacia, em λ=810 nm. A Figura 2 (a) mostra uma vista frontal do reator eletroquímico de leito de jorro montado e a Figura 2 (b), uma visão mais detalhada deste reator. O reator de leito de jorro era formado por placas retangulares que eram justapostas, vedadas por meio de mantas de silicone (3) e fixadas por meio de porcas e parafusos (Figura 2b). O contra-eletrodo (6) de Ti/Ti0,7Ru0,3O2 (De Nora do Brasil) era revestido por uma tela de polietileno recoberta com tecido de poliamida (7) para evitar o curto-circuito no reator. Utilizou-se uma placa de aço inoxidável AISI 316 como alimentador de corrente, ambos de dimensões 8 cm x 6 cm. As partículas eletroativas que constituíam o cátodo poroso eram de cobre e apresentavam geometria cilíndrica de 1 mm de diâmetro e 1 mm de comprimento. As partículas eram acondicionadas no interior da placa central (4), por onde também escoava o eletrólito, que entrava pela base e saía pelo topo do reator, retornando ao reservatório (Figura 1, item 1). Neste trabalho, foram realizados estudos utilizando duas espessuras de placas centrais, sendo elas de 2,1 cm e 1,3 cm. No centro da placa intermediária estava disposto também o draft ou canal central (2), composto por duas placas paralelas de acrílico com distância de 13 mm entre si e encaixadas nas duas placas laterais. Logo acima da entrada do eletrólito no reator e abaixo do leito de partículas eletroativas havia um meio poroso de partículas de polietileno cuja função era evitar caminhos preferenciais do fluxo de eletrólito (5).
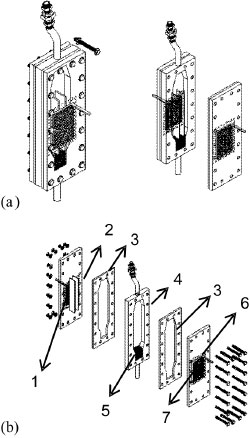 Figura 2. Reator eletroquímico de leito jorro. (a) Vistas frontal e lateral; (b) vista explodida. (1) alimentador de corrente; (2) draft ou canal central; (3) borrachas de silicone; (4) placa central com aberturas de entrada e saída de eletrólito; (5) distribuidor de fluxo; (6) tela de polietileno revestida por tecido de poliamida e (7) contra-eletrodo
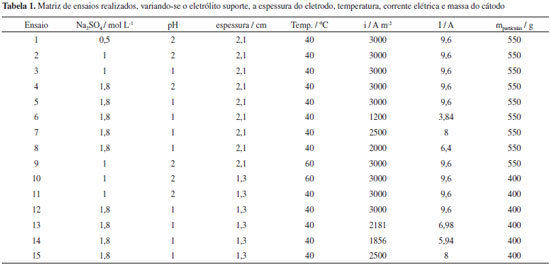
A Tabela 1 mostra a sequência de experimentos realizada neste trabalho, de forma que foram estudadas as variáveis concentração de sulfato de sódio, pH, espessura do eletrodo, temperatura do eletrólito, densidade de corrente e massa do cátodo poroso.
Os experimentos foram analisados com base nas variáveis eficiência de corrente (%), consumo energético (kWh kg-1) e rendimento espaço-tempo (kg m-3 h-1), calculados utilizando-se as Equações 1, 2 e 3, respectivamente.  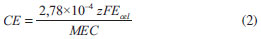 
RESULTADOS E DISCUSSÃO Eletrorrecuperação galvanostática de cobre Na Figura 3 são apresentadas as curvas de concentração normalizada de cobre em função do tempo para todos os experimentos realizados no reator de espessura 2,1 e 1,3 cm, nas quais C0 corresponde à média das concentrações iniciais de cada experimento e foi corrigida ao final de cada experimento para um valor aproximado de 40 g L-1. Verifica-se um comportamento linear do decaimento da concentração de cobre ao longo dos experimentos, evidenciando que a cinética do processo está sendo controlada pela transferência de carga, comportamento característico de eletrodeposição em soluções concentradas. Isto significa que existe uma quantidade suficiente de cátions metálicos adsorvidos na superfície do cátodo, de modo que um aumento da corrente elétrica aplicada provoca um aumento da taxa de eletrodeposição, uma vez que o elétron é o reagente limitante neste processo. Os experimentos 04 e 06 apresentaram, respectivamente, a maior e a menor cinética de reação (constantes cinéticas 4,43 g L-1 h-1 e 0,89 g L-1 h-1), entretanto, este último apresentou o menor potencial de célula, com valor de 2,12 V. O maior valor de potencial de célula obtido foi do experimento 04, devido a uma menor condutividade da solução, juntamente com elevada densidade de corrente aplicada, resultando em um Ecel de 3,54 V. Em processos controlados por transferência de carga, a Equação 4, de Butler-Volmer, é utilizada para descrever a relação entre a corrente elétrica e o sobrepotencial da reação. Nesta equação, a densidade de corrente elétrica (i) é função do sobrepotencial (η), da densidade de corrente de troca (i0) e dos coeficientes de transferência de carga (α). αa e αc correspondem aos coeficientes de transferência de carga anódico e catódico, respectivamente, R é a constante universal dos gases e T a temperatura do meio.
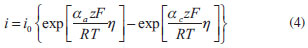
Nota-se na Equação 4 que na situação de controle por transferência de carga a corrente elétrica não depende da concentração da espécie iônica, nem de parâmetros de transferência de massa, como difusividade dos íons e espessura da camada limite, diferentemente da corrente limite, que é uma característica exclusivamente dependente dos parâmetros de transferência de massa. Assim, analisando-se os resultados mostrados na Figura 3 (a), pode-se inferir que a cinética de reação poderia ser aumentada por variações, dentro dos limites estudados, dos seguintes parâmetros: 1 - aumento da concentração do eletrólito suporte (conclusão da comparação dos experimentos 01, 02 e 04); 2 - aumento do pH (experimentos 02, 03, 04 e 05); 3 - redução para temperatura de 40 ºC (experimentos 02 e 09, com constantes cinéticas de 3,97 g L-1 h-1 e 1,17 g L-1 h-1, respectivamente) e 4 - aumento da densidade de corrente para 3000 A m-2 (experimentos 05, 06, 07 e 08). Concentrações mais elevadas de sulfato de sódio não puderam ser utilizadas devido à precipitação do sal.
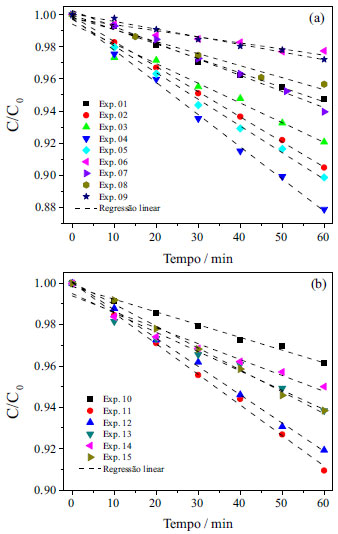 Figura 3. Concentraçao normalizada de cobre em funçao do tempo para os experimentos realizados. (a) Eletrorrecuperaçao em eletrodo de 2,1 cm de espessura, C0 = 40 g L-1; (b) eletrorrecuperaçao em eletrodo de 1,3 cm de espessura, C0 = 41 g L-1
Observando-se os resultados da Figura 3 (b) verifica-se que o reator de espessura de 1,3 cm também apresentou decaimento linear da concentração de cobre no tempo, porém com menor desempenho na cinética de reação (constantes cinéticas entre 1,65 g L-1 h-1 no experimento 10 e 3,73 g L-1 h-1 no experimento 11). A influência do aumento da temperatura na cinética de reação de redução de cobre foi verificada por Britto-Costa e Ruotolo29 na eletrorrecuperação de cobre em eletrodo de leito pulsante. De forma similar, a causa da diminuição da cinética de eletrodeposição em função do aumento da temperatura pode estar relacionada à competição entre duas reações eletroquímicas, dissolução anódica e eletrodeposição, em que o incremento na dissolução foi mais acentuado do que a influência na reação de eletrodeposição do metal, resultando na diminuição da eficiência do processo. Cifuentes e Simpson30 determinaram os parâmetros da equação de Butler-Volmer (Eq. 4) para a eletrodeposição de cobre em solução contendo 30 g L-1 de Cu2+ e 190 g L-1 de H2SO4, em diferentes temperaturas, e os autores verificaram que a temperatura não apresentava nenhuma influência no coeficiente de transferência de carga da eletrodeposição de cobre. No entanto, a temperatura causa um aumento da densidade de corrente de troca. Desta forma, pode-se afirmar que a temperatura está realmente ocasionando um aumento da taxa de eletrodeposição, porém, um aumento mais intenso da dissolução do metal na região do jorro faz com que a taxa líquida de eletrodeposição seja menor em temperaturas maiores. Pelo mesmo motivo, este reator apresenta-se pouco eficaz para soluções muito ácidas, uma vez que no canal central as partículas estão desprotegidas catodicamente e em situações em que o metal sofre dissolução acentuada.27 A partir dos dados de dC/dt, determinados a partir da regressão linear das curvas mostradas na Figura 3, foram calculadas as variáveis eficiência de corrente, consumo energético e rendimento espaço-tempo, utilizando as Equações 1, 2 e 3, respectivamente. Os resultados de EC, CE e Y são mostrados nas Figuras 4 (a), (b) e (c), respectivamente. Em processos de eletrodeposição controlados por transferência de carga, o decaimento da concentração do metal em função do tempo é linear, uma vez que a taxa de reação é constante e depende apenas da corrente elétrica aplicada, no caso de um processo galvanostático. Os valores do coeficiente de correlação ao quadrado (R2) obtidos das regressões lineares das curvas mostradas na Figura 3 variaram entre 0,928 e 0,999, o que evidencia a boa linearidade dos pontos experimentais e confirmando que o processo é realmente controlado pela transferência de carga.
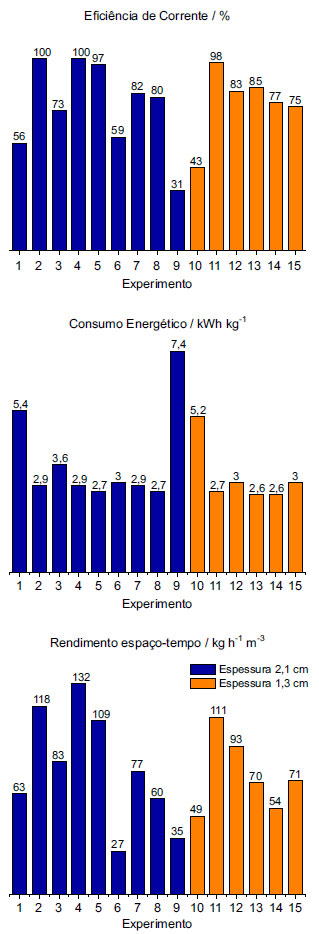 Figura 4. EC, CE e Y em função das condições operacionais para os reatores de espessura 2,1cm (em azul) e 1,3 cm (em laranja)
Os experimentos 01 a 05 foram realizados com o intuito de analisar a influência da concentração do eletrólito suporte e do pH da solução no processo de eletrodeposição. Verifica-se, analisando a Figura 4 (a), que o experimento 02 apresentou 100% de EC, o que implicou no consumo de 2,9 kWh kg-1, valor considerado um pouco elevado para a indústria hidrometalúrgica, por implicar diretamente no custo de produção do metal. Adicionalmente, nestes ensaios o reator apresentou rendimento espaço-tempo de 118 kg h-1 m-3 o que corresponde a um rendimento de aproximadamente 20 vezes superior ao de reatores convencionais de placas planas, que é de aproximadamente 5 kg h-1 m-3.29 Desta forma, do ponto de vista do consumo energético, o processo apresentou-se pouco satisfatório quando comparado com o processo convencional, em que os valores típicos de CE estão na faixa de 1,9 a 2,3 kWh kg-1.2,31 Por outro lado, os valores de EC e, principalmente, o Y foram bastante superiores aos valores encontrados no processo convencional (82 a 92% de EC).2,3,31 Diante disto, a partir do experimento 02 o foco do trabalho foi diminuir o consumo energético por meio da diminuição do potencial de célula. Assim sendo, a primeira tentativa foi direcionada à melhoria da condutividade da solução, seguida da diminuição da densidade de corrente elétrica, aumento da temperatura, para favorecer a condutividade da solução e, por último, a diminuição da espessura do eletrodo a fim de amenizar a distribuição do potencial de eletrodo.16 Verificou-se nos experimentos 05 a 08 que a EC sofreu influência da densidade de corrente, de forma que diminuindo-se i, diminui-se também a EC. Este mesmo comportamento foi observado por Britto-Costa e Ruotolo29 no estudo de eletrorrecuperação de cobre utilizando eletrodo de leito pulsante. Os autores concluíram que menores densidades de corrente causavam uma diminuição da proteção catódica das partículas, levando ao surgimento de zonas de dissolução anódica, resultando em um empobrecimento da cinética de reação global. Este resultado foi útil para se determinar a densidade de 3000 A m-2 como ótima, uma vez que densidades maiores que esta iriam apenas aumentar o CE do processo. Desejava-se com a redução da espessura do reator diminuir significativamente o CE do processo por meio da diminuição do potencial de célula e pela redução de possíveis zonas anódicas no interior do cátodo poroso. Entretanto, verificou-se que os resultados do reator de 1,3 cm de espessura não mostraram vantagem alguma comparado ao reator de 2,1 cm de espessura, ou seja, uma redução de 38% na espessura não foi suficiente para uma redução significativa do consumo energético do processo. As condições ótimas encontradas por Britto-Costa e Ruotolo29 na eletrorrecuperação de cobre em ELP foram 150 g L-1 de H2SO4, i = 3000 A m-2, 60 s de leito fixo, com fluidização de 2 s, obtendo 77% de EC, 2,5 kWh kg-1 de CE e 61 kg-1 h-1 m-3. Verifica-se que, apesar do ELP apresentar melhores resultados de CE, isso se deve ao fato de a condutividade da solução ser bastante superior à utilizada nestes estudos com ELJ, uma vez que a concentração de ácido sulfúrico utilizada nos ensaios do ELP foi muito maior do que a utilizada nestes experimentos. Os autores reportaram ainda problemas de eletrodeposição na tela de separação, o que não foi observado em nenhum experimento com o ELJ, mesmo operando com eletrólito muito menos condutivo. Isto se deve ao fato de que no ELJ as partículas eletricamente carregadas estão em constante movimento, formando um leito móvel que apresenta características semelhantes às do leito fixo, entretanto, não permite, dentro dos limites de i estudados, a criação de um depósito dendrítico, responsável por causar curtos-circuitos. Adicionalmente, em nenhum dos experimentos foi evidenciada uma quantidade excessiva de eletrodepósito no alimentador de corrente. Análise da qualidade do depósito por MEV Com o intuito de se verificar a qualidade do depósito obtido, foram realizadas microscopias eletrônicas de varredura (MEV) em partículas coletadas antes e após os experimentos de eletrodeposição de cobre. Os resultados são mostrados na Figura 5. As Figuras 5 (a) e (b) foram realizadas com uma partícula virgem, com aumentos de 250x e 5000x, respectivamente. Verifica-se que se trata de uma superfície que apresenta riscos decorrentes do próprio processo de usinagem do fio de cobre utilizado para a produção das partículas.
 Figura 5. Imagens MEV das partículas de cobre virgem e ao final de cada experimento. (a) Partícula virgem com aumento de 250x; (b) partícula virgem com 5000x; (c) exp 9; (d) exp. 4; (e) exp. 5; (f) exp. 12; (g) exp. 11
A Figura 5(c) apresenta a imagem de uma partícula ao final do experimento 9, que foi o ensaio com os piores resultados de EC e CE. Nota-se que o depósito apresentou grãos muito grandes, em concordância com experimentos de baixa eficiência em ELP. Este tipo de depósito também ocorre nos eletrodos planos convencionais utilizados em indústrias hidrometalúrgicas.29 As Figuras 5(d), (e) e (g), referentes aos experimentos 04, 05 e 11, respectivamente, apresentam características semelhantes entre si, como grãos pequenos e um depósito bastante uniforme, características de depósitos de alta qualidade. Adicionalmente, ao final destes três experimentos, as partículas eram brilhantes e com grande uniformidade entre elas. Com relação a essas três figuras, o depósito mais uniforme foi o do experimento 11, seguido do experimento 04 e por fim o de número 05, de forma que reator de menor espessura apresentou resultado melhor no quesito qualidade do depósito. Cabe ressaltar que não foi utilizado nenhum aditivo químico visando melhorar a qualidade do depósito ou proteger o contra-eletrodo, como ocorre no processo convencional. A Figura 5(f) apresenta a imagem aumentada da partícula ao final do experimento 12, que apesar de ter apresentado resultados satisfatórios, mostra uma piora na qualidade do depósito, devido à ocorrência de grãos maiores e com menor uniformidade quando comparada ao resultado do experimento 11. Esta diferença foi ocasionada pelo pH do eletrólito, de forma que o eletrólito menos ácido favoreceu a qualidade do depósito, independentemente da condutividade da solução, que foi 47% vezes maior no experimento 12.
CONCLUSÃO O ELJ apresentou boa adequação ao processo de eletrorrecuperação de cobre em solução concentrada, com resultados promissores de eficiência de corrente, rendimento espaço-tempo e qualidade do depósito formado. Apesar do consumo energético de 2,7 kWh kg-1 ser considerado relativamente elevado comparado com aquele do processo convencional (1,9 a 2,3 kWh kg-1), dependendo das condições, a economia com aditivos ou mesmo com processos de fundição controlados podem compensar esta diferença no consumo energético. Os melhores resultados obtidos neste trabalho foram nas condições experimentais de maior densidade de corrente (3000 A m-2), solução com maior condutividade (1,8 mol L-1 Na2SO4 e pH 1,0) e temperatura de 40 ºC. Nestas condições, foram obtidos valores de 100% de EC, 2,7 kWh kg-1 de CE e rendimento de 118 kg h-1 m-3, além de um depósito de alta qualidade. Estes resultados, quando comparados àqueles relatados para o processo convencional, mostram que o ELJ é bastante promissor para a eletrodeposição de cobre.
AGRADECIMENTOS Os autores agradecem ao CNPQ, à FAPESP e à CAPES pelo apoio financeiro que permitiu a realização deste trabalho.
REFERÊNCIAS 1. Panda, B.; Das, S. C.; Hydrometallurgy 2001, 59, 55. DOI: http://dx.doi.org/10.1016/S0304-386X(00)00140-7 2. Wiechmann, E. P.; Morales, A. S.; Aqueveque, P.; IEEE Trans. Ind. Appl. 2010, 46, 1264. DOI: http://dx.doi.org/10.1109/TIA.2010.2049818 3. Jiricny, V.; Roy, A.; Evans, J. W.; Metall. Mater. Trans. B 2002, 33, 669. DOI: http://dx.doi.org/10.1007/s11663-002-0019-0 4. Shakarji, R. A.; He, Y.; Gregory, S.; Hydrometallurgy 2011, 106, 113. DOI: http://dx.doi.org/10.1016/j.hydromet.2010.12.013 5. Cifuentes, L.; Ortiz, R.; Casa, J. M.; AIChE J. 2005, 51, 2273. DOI: http://dx.doi.org/10.1002/aic.10476 6. Evans, J. W.; Ding, R.; Doyle, F. M.; Jiricny, V.; Scand. J. Metall. 2005, 34, 363. DOI: http://dx.doi.org/10.1111/j.1600-0692.2005.00756.x 7. San Martin, R. M.; Otero, A. F.; Cruz, A.; Hydrometallurgy 2005, 77, 171. DOI: http://dx.doi.org/10.1016/j.hydromet.2004.11.006 8. Sigley, J. L.; Johnson, P. C.; Beaudoin, S. P.; Hydrometallurgy 2003, 70, 1. DOI: http://dx.doi.org/10.1016/S0304-386X(03)00077-X 9. Lafront, A. M.; Zhang, W.; Ghali, E.; Houlachi, G.; Electrochim. Acta 2010, 55, 6665. DOI: http://dx.doi.org/10.1016/j.electacta.2010.06.005 10. Moskalyk, R. R.; Alfantazi, A.; Tombalakian, A. S.; Valic, D.; Miner. Eng. 1999, 12, 65. DOI: http://dx.doi.org/10.1016/S0892-6875(98)00120-4 11. Coeuret, F.; J. Appl. Electrochem. 1980, 10, 687. DOI: http://dx.doi.org/10.1007/BF00611271 12. Lupi, C.; Pilone, D.; Hydrometallurgy 1997, 44, 347. DOI: http://dx.doi.org/10.1016/S0304-386X(96)00060-6 13. Stankovic, V. D.; Wragg, A. A.; J. Appl. Electrochem. 1995, 25, 565. DOI: http://dx.doi.org/10.1007/BF00573214 14. Olive, H.; Lacoste, G.; Electrochim. Acta 1979, 24, 1109. DOI: http://dx.doi.org/10.1016/0013-4686(79)85009-4 15. El-Shakre, M. E.; Saleh, M. M.; El-Anadouli, B. E.; Ateya, B. G.; J. Electrochem. Soc. 1994, 141, 441. DOI: http://dx.doi.org/10.1149/1.2054746 16. Ruotolo, L. A. M.; Gubulin, J. C.; Braz. J. Chem. Eng. 2002, 19, 105. DOI: http://dx.doi.org/10.1590/S0104-66322002000100008 17. Pletcher, D.; White, I.; Walsh, F. C.; Millington, J. P.; J. Appl. Electrochem. 1991, 21, 667. DOI: http://dx.doi.org/10.1007/BF01103822 18. Widner, R. C.; Sousa, M. F. B.; Bertazzoli, R.; J. Appl. Electrochem. 1998, 28, 201. DOI: http://dx.doi.org/10.1023/A:1003286810393 19. Farinos, R. M.; Britto-Costa, P. H.; Ruotolo, L. A. M.; Environ. Technol. 2012, 33, 1123. DOI: http://dx.doi.org/10.1080/09593330.2011.610361 20. Sabacky, B. J.; Evans, J. W.; J. Electrochem. Soc. 1979, 126, 1176. DOI: http://dx.doi.org/10.1149/1.2129238 21. Hadzismajlovic, D. Z. E.; Popov, K. I.; Pavlovic, M. G.; Powder Technol. 1996, 86, 145. DOI: http://dx.doi.org/10.1016/0032-5910(95)03031-X 22. Kazdobin, K.; Shvab, N.; Tsapakh, S.; Chem. Eng. J. 2000, 79, 203. DOI: http://dx.doi.org/10.1016/S1385-8947(00)00211-4 23. Thilakavathi, R.; Balasubramanian, N.; Ahmed Basha, C.; J. Hazard. Mater. 2009, 162, 154. DOI: http://dx.doi.org/10.1016/j.jhazmat.2008.05.021 PMID: 18562092 24. Hutin, D.; Coeuret, F.; J. Appl. Electrochem. 1977, 7, 463. DOI: http://dx.doi.org/10.1007/BF00616757 25. Bareau, J. Y.; Coeuret, F.; J. Appl. Electrochem. 1979, 9, 737. DOI: http://dx.doi.org/10.1007/BF00614968 26. Coeuret, F.; Paulin, M.; J. Appl. Electrochem. 1988, 18, 162. DOI: http://dx.doi.org/10.1007/BF01016221 27. Farinos, R. M.; Dissertaçao de mestrado, Universidade Federal de Sao Carlos, Brasil, 2010. 28. Tonini, G. A.; Farinos, R. M.; Prado, P. F. A.; Ruotolo, L. A. M.; J. Chem. Technol. Biotechnol. 2013, 88, 800. DOI: http://dx.doi.org/10.1002/jctb.3902 29. Britto-Costa, P. H.; Pereira-Filho, E. R.; Ruotolo, L. A. M.; Hydrometallurgy 2014, 144-145, 15. DOI: http://dx.doi.org/10.1016/j.hydromet.2014.01.014 30. Cifuentes, L.; Simpson, J.; Chem. Eng. Sci. 2005, 60, 4915. DOI: http://dx.doi.org/10.1016/j.ces.2005.04.031 31. Beukes, N. T.; Badenhorst, J.; J. South. Afr. Inst. Min. Metall. 2009, 109, 343. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access