Revisão
|
|
| Biomateriais: tipos, aplicações e mercado Biomaterials: types, applications, and market |
|
Ana Luiza R. Pires; Andréa C. K. Bierhalz; Angela M. Moraes*
Departamento de Engenharia de Materiais e de Bioprocessos, Faculdade de Engenharia Química, Universidade Estadual de Campinas, Av. Albert Einstein, 500, 13083-852 Campinas - SP, Brasil Recebido em 27/11/2014 *e-mail: ammoraes@feq.unicamp.br The types of compounds used in the production of biomaterials, namely metals, ceramics, synthetic and natural polymers, as well as composite materials, are discussed in the present work, together with details of their application and evolution from biocompatible to bioactive, biodegradable, and biomimetic clinical products. The chemical structure, the three-dimensional structure, and the molecular organization of compounds frequently used in the manufacture of relevant classes of biomaterials are discussed, along with their advantages and some of their major limitations in specific clinical applications. The main chemical, physical, mechanical, and biological requirements of biomaterials categories are presented, as well as typical tissular responses to implanted biomaterials. Reasons for the recent economic growth of the biomaterials market segment are addressed, and the most successful biomaterial categories are discussed, emphasizing areas such as orthopedic and cardiovascular implants, regenerative medicine, tissue engineering, and controlled drug release devices. Finally, the need for the development of innovative and more accessible biomaterials, due to the expected increase in the number of elderly people and the growing trend of personalized medical procedures, is pointed out. INTRODUÇÃO Os biomateriais compreendem uma representativa fração dos produtos utilizados na área de saúde, estimados em cerca de 300 mil há cerca de 10 anos.1 Dentre eles, podem ser citados como exemplos dispositivos biomédicos (como biossensores, tubos de circulação sanguínea, sistemas de hemodiálise), materiais implantáveis (como suturas, placas, substitutos ósseos, tendões, telas ou malhas, válvulas cardíacas, lentes, dentes), dispositivos para a liberação de medicamentos (na forma de filmes, implantes subdérmicos e partículas), órgãos artificiais (como coração, rim, fígado, pâncreas, pulmões, pele) e curativos, dentre muitos outros. O termo biomaterial vem sendo definido de diferentes formas por diferentes autores ao longo dos últimos anos. No escopo desta revisão, biomateriais são definidos como dispositivos que entram em contato com sistemas biológicos (incluindo fluidos biológicos), com aplicações diagnósticas, vacinais, cirúrgicas ou terapêuticas, podendo ser constituídos de compostos de origem sintética ou natural, assim como de materiais naturais quimicamente modificados, tanto na forma de sólidos quanto de géis, pastas ou mesmo líquidos, não sendo necessariamente fabricados, como válvulas cardíacas de porcos e retalhos de pele humana tratados para uso como implantes. Aspectos relevantes acerca da evolução em seu desenvolvimento, utilização e mercado serão abordados nos itens seguintes, assim como as principais características e requerimentos de biomateriais obtidos a partir de diferentes categorias de compostos químicos. Evolução no desenvolvimento e aplicação de biomateriais O uso de biomateriais não é recente, e sua aplicação na correção dos mais diversos tipos de problemas relacionados à saúde humana remonta à antiguidade.2 Há registro, por exemplo, do uso de suturas de linho e ouro no Antigo Egito (2000 AC) e de intestino de gatos, na Europa, durante a Idade Média, assim como de dentes artificiais feitos de conchas pelos maias (600 AC), de ferro pelos franceses (200 AC) e de ouro e madeira pelos romanos, chineses e astecas. Substitutos ósseos feitos de madeira também foram encontrados no Antigo Egito e na Europa, na Idade Média, tendo sido observada eficiente osseointegração. Inicialmente, e até o século retrasado, a abordagem adotada no desenvolvimento e aplicação dos biomateriais era fundamentalmente do tipo tentativa e erro, mas, mais recentemente, enfoques marcadamente sistemáticos têm sido a tônica nos estudos nesta área. No início do uso dos biomateriais de forma mais sistematizada, nas proximidades da década de 50, buscavam-se os materiais bioinertes (foco no material em si). Com o passar do tempo, a meta passou a ser a bioatividade dos biomateriais, e mais recentemente, o objetivo tem sido a regeneração de um tecido funcional de fato, com foco, então, no aspecto biológico.3 Ou seja, inicialmente tinha-se por objetivo a obtenção de materiais biocompatíveis que pudessem substituir um tecido danificado e prover suporte mecânico, com mínima resposta biológica do paciente. Com o passar do tempo, buscou-se aumentar a vida do implante por sua interação com a interface do tecido hospedeiro; em seguida, focou-se no desenvolvimento de materiais biodegradáveis, com capacidade de serem incorporados ou absorvidos (após dissolução) pelo tecido hospedeiro, e, mais recentemente, tem-se trabalhado com o conceito de biomimética, buscando-se materiais que participem de forma ativa no processo de recuperação, atuando no tecido de forma específica, com estimulação em nível celular. Tal conceito evolutivo no desenvolvimento e utilização de biomateriais é ilustrado na Figura 1, que indica também que os materiais mais usados clinicamente na atualidade são majoritariamente das categorias biocompatíveis, bioativos e biodegradáveis, e os mais pesquisados, os bioativos, os biodegradáveis e os biomiméticos.4
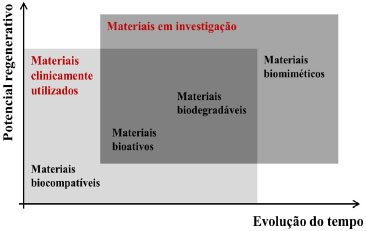 Figura 1. Evolução da funcionalidade e da capacidade regenerativa dos biomateriais ao longo de seu desenvolvimento (baseada na Ref. 4)
São várias as etapas envolvidas desde a identificação da necessidade de um biomaterial até a utilização e análise final do produto,3 como indicado na Figura 2.
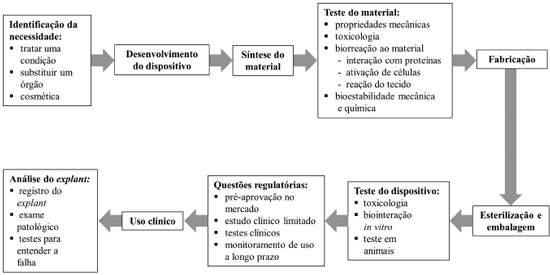 Figura 2. Etapas do ciclo de vida de um biomaterial, desde sua concepção baseada em uma necessidade específica até seu uso clínico e avaliação posterior (adaptada da Ref. 3)
O processo se inicia com a identificação da necessidade de um biomaterial para uma dada aplicação, que pode ser o tratamento de uma doença, a substituição de um órgão ou o uso meramente cosmético. A seguir, dá-se o projeto e síntese dos materiais para testes diversos (quanto à composição, estrutura, propriedades mecânicas, toxicologia, biorreação ao material, bioestabilidade) e, com base da escolha dos que se mostrarem mais apropriados, faz-se a fabricação seguida da esterilização e embalagem do biomaterial que é, então, encaminhado para testes mais detalhados de toxicologia, biointeração in vitro e in vivo. Em seguida, são enfocados aspectos regulatórios relacionados à pré-aprovação no mercado, aos estudos clínicos iniciais, à triagem clínica e ao acompanhamento de longo prazo. O desenvolvimento tem sequência mesmo após a aprovação e uso clínico do biomaterial, com a análise e registro de explants extraídos de pacientes visando o entendimento de eventuais falhas para sua correção. Em todas as etapas necessita-se de profissionais com variadas formações para que a análise possa ser feita de forma a abranger os vários aspectos requeridos, destacando-se o papel de químicos, farmacêuticos, engenheiros, físicos, biólogos, médicos e dentistas. Desta forma, pode-se seguramente afirmar que a abordagem para o desenvolvimento de biomateriais é, por natureza, multidisciplinar e que prioriza a convergência de metas. Embora não seja possível generalizar quais devam ser as características requeridas dos biomateriais, pois estas dependem fundamentalmente de sua aplicação, alguns tipos de propriedades são frequentemente avaliados para que o projeto do dispositivo possa ser realizado de forma efetiva e economicamente atraente. Neste sentido, destacam-se propriedades biológicas, como a biocompatibilidade, com frequência associada à hemocompatibilidade, citotoxicidade, alergenicidade, estimulação de adesão e proliferação celular; as propriedades físicas, como morfologia da superfície, energia superficial, encaixe anatômico, rugosidade, porosidade, cor, transparência e permeabilidade, propriedades mecânicas como tensão de ruptura, alongamento e flexibilidade e propriedades químicas, como densidade, estabilidade, resistência à esterilização e forma de degradação quando em contato com o organismo. No que se refere às propriedades biológicas, biomateriais implantáveis podem ser classificados em quatro categorias, de acordo com o tipo de reação que acarretam nas células com as quais entram em contato. São considerados como tóxicos aqueles que resultam na morte das células que circundam o implante e não tóxicos ou praticamente inertes os que causam a formação de um tecido fibroso em torno do implante. Os biomateriais que despertam reconhecimento biológico por apresentarem em sua constituição fatores de adesão, sítios polianiônicos similares aos de polissacarídeos regulatórios ou sítios para a clivagem enzimática envolvidos na migração celular, por sua vez, são considerados como não tóxicos e bioativos. Tais dispositivos podem também sofrer mudança de fase in situ por exemplo, incluindo transformações de precursores para sólidos.5 Na última categoria, dos biomateriais classificados como não tóxicos e degradáveis, tem-se os que possibilitam que as células saudáveis circundantes ou nele presentes cresçam e substituam a matriz que constitui o biomaterial. Mercado de biomateriais O mercado relacionado à área de biomateriais é expressivo tanto do ponto de vista do número de unidades comercializadas anualmente quanto da movimentação financeira observada, podendo ser segmentado convenientemente com base em dois diferentes critérios.6 O primeiro refere-se aos tipos de compostos a partir dos quais os biomateriais são constituídos, como metais, cerâmicas, polímeros e materiais de origem natural. O segundo critério baseia-se na forma de aplicação do biomaterial, como de uso ortopédico, cardiovascular, odontológico, oftalmológico, para cirurgia plástica, engenharia tecidual, tratamento de lesões, desordens neurológicas e do sistema nervoso central, além de incluir também dispositivos com outras aplicações, como gastrointestinais e urinárias, ou como sistemas de liberação de drogas e para cirurgia bariátrica. Com relação ao número de unidades dos diferentes tipos de biomateriais utilizados anualmente, de acordo com dados de Ratner et al.,3 é estimado, por exemplo, o emprego de cerca de 1 bilhão de catéteres, 150 milhões de lentes de contato e 7 milhões de lentes intraoculares por ano. Na faixa de 1 a 2,5 milhões de unidades por ano destacam-se as próteses de quadril, joelho e ombro, dispositivos para hemodiálise e oxigenação sanguínea, stents cardiovasculares, parafusos e placas de fixação óssea, tubos auriculares e dispositivos intrauterinos. Marca passos, implantes de mama, válvulas cardíacas, próteses para vasos sanguíneos, discos e dispositivos de fusão para coluna vertebral, desfibriladores implantáveis, prótese coclear e telas para cirurgia de hérnia, por exemplo, são utilizados na ordem de magnitude de 2 a 7 centenas de milhares de unidades anualmente. Nota-se expressiva expansão ao longo dos últimos anos no mercado global de biomateriais. Em 2008, este mercado movimentou US$ 25.6 bilhões mundialmente, tendo a seguinte distribuição: 43% nos USA, 33% na Europa, 3% na Ásia (Pacífico), 2% no Brasil e 19% no restante do mundo.7 Em 2012, este mercado atingiu a cifra de US$ 44 bilhões, tendo-se previsões de que atinja, em 2017, o total de 88,4 bilhões de dólares,6 com uma taxa de crescimento de 22,1% ao ano. Supostamente, este mercado continuará sendo liderado nos próximos anos pela América do Norte, Europa e Ásia. Globalmente, o segmento de maior sucesso em vendas é o de implantes ortopédicos, com perspectivas de atingir 57,9 bilhões de dólares em 2016.8 Apesar de haver registro conflitante de previsão com relação a este segmento (expectativa de gastos em 2019 excedendo 33 bilhões de dólares com a categoria de biomateriais implantáveis em geral),9 sem dúvida os biomateriais ortopédicos têm alta representatividade econômica. Outro ramo de destaque é o de biomateriais para aplicações cardiovasculares, com fração de mercado estimada em 34,5% (dados de 2012).10 Apesar de atualmente os biomateriais metálicos dominarem o mercado mundial em cerca de 50%, espera-se no futuro próximo o crescimento acentuado do mercado de biomateriais poliméricos, em decorrência de características mais apropriadas quanto à flexibilidade, elasticidade, inércia biológica, biocompatibilidade e longevidade. No Brasil, o mercado de biomateriais foi de 690 milhões de dólares em 2010, tendo-se a expectativa de que alcance 1,7 bilhões em 2015 (crescimento de 20%).11 Neste país, o ramo de maior movimento econômico é o de produtos ortopédicos (37,5% do mercado total em 2009), seguido do de biomateriais de uso cardiovascular (36% do total). Já em 2011 as cirurgias ortopédicas chegavam, no Brasil, a quase 300 mil por ano, de acordo com dados do Sistema Único de Saúde reportados no Portal Brasil,12 um número muito menor, entretanto, do que o dos procedimentos observados em adultos nos EUA, estimado em 1,9 milhões,13 possivelmente por limitação do acesso dos pacientes e hospitais a muitos dos dispositivos implantáveis em razão do alto custo. A área de tratamento de lesões tem crescimento esperado em torno de 24% no intervalo de 2010 a 2015, esperando-se também aumento de demanda de materiais e suprimentos de uso cirúrgico em função do aumento projetado do número de procedimentos clínicos futuros.11 O intenso crescimento observado no mercado de biomateriais é atribuído a três motivos principais: o envelhecimento da população mundial, com a elevação da expectativa de vida; o aumento do poder aquisitivo e do padrão de vida nos países em desenvolvimento, que facilitam o acesso ao tratamento de diversos tipos de enfermidades; e as melhorias tecnológicas na abordagem de doenças anteriormente vistas como não tratáveis. O aspecto do envelhecimento populacional demanda particular atenção, visto que, com base nas estimativas de que, no ano 2050, uma fração igual a 21,1% da população global terá mais que 60 anos, correspondendo a mais de 2 bilhões de pessoas,14 pode-se esperar, nos próximos anos, um aumento ainda mais apreciável da demanda de biomateriais e mesmo de novas e mais consolidadas abordagens terapêuticas para atender às necessidades destas pessoas. Neste sentido, espera-se apreciável avanço na área de engenharia tecidual visando às aplicações no campo de medicina regenerativa, o que certamente irá requerer melhorias significativas no projeto e execução dos suportes utilizados para o crescimento das células de tecidos normais ou mesmo de células tronco neles inoculados. Tais suportes, conhecidos pelo termo em inglês scaffolds, têm funções que vão muito além de prover uma matriz biocompatível com porosidade, rugosidade, estrutura tridimensional, degradabilidade, propriedades mecânicas e de transporte de massa adequadas, incluindo também a potencial estimulação do crescimento, migração, interação e diferenciação celular por meio de disponibilização às células de fatores de crescimento e outros sinais bioquímicos apropriados,15 que podem ser neles incorporados ou adsorvidos, de forma a propiciar um microambiente que remeta à matriz extracelular. Apenas no segmento de terapias baseadas no cultivo de células tronco estima-se que o mercado global atinja, no ano 2020, 330 milhões de dólares.16 Dentre as empresas que atuam no ramo de biomateriais no mundo, tanto na obtenção de matérias-primas quanto na fabricação dos produtos para uso na área de saúde, podem ser citadas: no Reino Unido, a Invibio Ltd.; no Japão, a Kyocera Corporation; na Alemanha, a Bayer, a CeramTec GmbH, a Evonik Industries e a Ticona GmbH; na Holanda, a Purac Biomaterials e a Cam Bioceramics e, nos Estados Unidos da América, a Berkeley Advanced Biomaterials Inc., a Biomet Inc., a Carpenter Technology Corporation, a Ceradyne Inc. (uma subdivisão da 3M), a Dentsply International Inc., as empresas da área ortopédica DePuy Inc., a DSM Biomedical Inc., a Heraeus Medical Components, a Johnson & Johnson, a Landec Corporation, a Materion Corporation, a Medtronic inc., a Stryker Corp., a Ulbrich Stainless Steel & Special Metals Inc. e a Wright Medical Technology Inc., dentre muitas outras. A discussão de áreas de importância com relação a investimentos futuros em biomateriais pode e deve ser fomentada por iniciativas como a da National Science Foundation dos EUA, que organizou em 2012 um workshop congregando empresas, profissionais de universidades e centros de pesquisa, além de representantes de agências de fomento governamentais. Relevantes orientações das atividades nesta área foram propostas,17 com a identificação de desafios, oportunidades, questões científicas, necessidades e recomendações na pesquisa de biomateriais enfocando materiais duros e compósitos, materiais moles, interações célula-material, sistemas dispersos, filmes finos e interfaces. Desta forma, a análise detalhada das categorias de compostos químicos usados na constituição dos biomateriais, de suas propriedades, vantagens, limitações e aplicabilidade são de grande importância. Metais Entre os diferentes tipos de matérias-primas disponíveis para a obtenção de biomateriais, a classe dos metais destaca-se por apresentar excelente desempenho mecânico, como alta resistência à fadiga e à fratura. Devido a estas características, os metais têm sido amplamente utilizados como componentes estruturais visando à substituição, reforço ou estabilização de tecidos rígidos, os quais são constantemente submetidos a altas cargas de tração e compressão. Neste âmbito, as aplicações mais comuns incluem fios, parafusos e placas para fixação de fraturas, implantes dentários e próteses para substituição de articulações.18,19 Além dos componentes estruturais, os metais podem ser empregados na confecção de válvulas cardíacas artificiais e endopróteses expansíveis (stents), que requerem, além de resistência mecânica apropriada, durabilidade e possibilidade de visualização em imagens de raios-X.18,20 A boa condutividade elétrica, outro atributo comum destes materiais, tem favorecido a obtenção de dispositivos de estímulo neuromuscular, como os marca-passos cardíacos.21 A grande versatilidade dos metais para o uso biomédico deve-se, também, à possibilidade de polimento e abrasão da superfície, bem como à facilidade de esterilização. Esta última característica torna-se responsável pela extensa aplicação dos metais em instrumentação cirúrgica (biomateriais de uso ultra-rápido), como tesouras, agulhas, fórceps, pinças e afastadores. Atualmente, os metais mais utilizados na área médica são os grupos dos aços inoxidáveis, as ligas de titânio e o titânio comercialmente puro, e as ligas à base de cobalto-cromo.4,18 Na Tabela 1 estão detalhados os principais tipos de metais ou ligas e exemplos de suas aplicações mais frequentes.
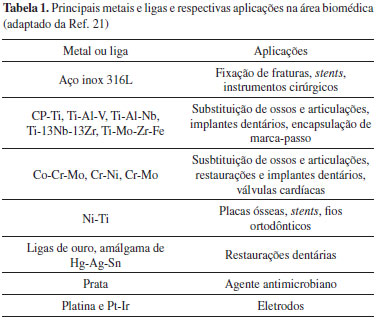
As propriedades dos metais são governadas basicamente pela sua estrutura em retículo cristalino e pela força das ligações. A alta densidade advém do agrupamento dos átomos em um padrão cristalino tridimensional, de forma ordenada e repetida. Os núcleos de íons carregados positivamente ficam imersos em uma nuvem de elétrons que podem movimentar-se livremente, sendo responsáveis pela boa condutividade térmica e elétrica dos metais. A resistência à tração é consequência da intensidade das ligações metálicas e a deformação plástica ocorre devido às ligações não-direcionadas, que permitem que a posição dos íons metálicos seja alterada sem destruir a estrutura cristalina.22,23 Para que possam ser aplicados com segurança no corpo humano, os metais ou ligas devem cumprir uma série de requisitos. Fundamentalmente, devem ser biocompatíveis, de forma a não produzir reações inflamatórias, tóxicas ou alérgicas.2 Ainda, devem ser quimicamente estáveis e apresentar apropriada resistência à corrosão, a fim de prevenir a degradação no ambiente biológico. No caso de implantes ósseos, alta força de adesão entre os osteoblastos e o implante é requerida. Adequadas propriedades mecânicas, como módulo de elasticidade similar ao do osso humano e resistência à fadiga, também devem ser consideradas. Uma vez implantados, os biomateriais permanecem em contato com o fluido corpóreo, que consiste em uma solução aquosa contendo oxigênio dissolvido, proteínas e vários íons, como cloreto e hidróxidos.23 No caso de implantes dentários ou materiais ortodônticos, as ligas metálicas estão, ainda, suscetíveis a variações de temperatura e pH, presença de biofilme microbiano e às propriedades físicas e químicas dos alimentos. Estes meios podem ser agressivos aos metais, provocando a sua corrosão. Adicionalmente a estes fatores, grande parte dos implantes trabalha sob a ação de cargas mecânicas que geram atrito, deslizamento e, consequentemente, a possível liberação de partículas metálicas.24,25 Como resultado destes mecanismos de desgaste e corrosão, a integridade mecânica e estrutural do implante pode ser comprometida, levando à sua falha prematura ou à fratura. Os produtos da degradação dos implantes têm sido associados a complicações como osteólise, inflamações, reações alérgicas e vasculites, podendo ainda ocasionar o acúmulo de íons metálicos em órgãos, teratogenicidade e câncer.26,27,18 Os metais nobres, como o ouro e a prata, não são suscetíveis a processos corrosivos. No entanto, outros de seus atributos, tais como a alta densidade, resistência insuficiente e o alto custo inviabilizam as aplicações ortopédicas destes.23 Todos os demais metais de uso médico são suscetíveis à corrosão quando em contato com os sistemas biológicos.28 De forma geral, a resistência a este processo advém de uma fina película de óxido formada espontaneamente pela exposição da superfície metálica ao ar. Esta película, na forma de camada de passivação, impede a troca de íons, protegendo a superfície. Alguns fatores, no entanto, podem comprometer a resistência à corrosão, como a falta de homogeneidade na microestrutura relacionada à variação na composição, deformação superficial, presença de impurezas, precipitados, segregações e inclusões. Assim, durante o processo de fabricação, visando melhorar a resistência à corrosão pelo fortalecimento da película protetora, os implantes podem ser submetidos a tratamentos e deposição adicional de óxidos em sua superfície.21 Uma vez rompida a camada de passivação, o processo de corrosão tem início e a liberação dos íons metálicos irá ocorrer até que o filme seja regenerado, se isto for possível. O tempo de repassivação, portanto, é decisivo para a determinação da taxa de corrosão e varia de acordo com o material. Ligas à base de titânio, por exemplo, apresentam menor tempo de repassivação do que os aços inoxidáveis.25 Entre as formas mais comuns de corrosão em implantes metálicos, destacam-se a corrosão por pites, em frestas e por desgaste. A corrosão por pites é extremamente localizada e caracteriza-se pela formação de cavidades profundas e de pequeno diâmetro nos metais que estão expostos a meios contendo íons agressivos, como o cloreto.19,24 A corrosão em frestas ocorre em fendas existentes entre o material metálico em contato com outro componente, metálico ou não. Pode ter início, por exemplo, no espaço criado na fixação de uma placa metálica por parafusos.19 Nestes ambientes, a difusão de espécies químicas é dificultada, porém, uma vez que estas ingressam, ficam estagnadas, promovendo alterações neste espaço. Se iniciado este processo, o oxigênio presente na fresta é consumido, acidificando a solução e originando a corrosão. Já a corrosão por desgaste é o resultado dos danos produzidos por componentes metálicos em contato físico direto, na presença de movimentos vibratórios e cargas repetitivas, danificando a superfície do material e favorecendo o aparecimento de fraturas.21 O lado favorável da corrosão dos implantes metálicos consiste em usar tal fenômeno para o desenvolvimento de materiais biodegradáveis com aplicações muito atrativas em cirurgias ortopédicas, pediátricas e cardiovasculares, nas quais se teria dificuldade de remoção do dispositivo sem danificar o tecido saudável. Um dos principais metais com potencial para esta aplicação é o magnésio, que apresenta boas propriedades mecânicas e baixa resistência à corrosão, sendo que os produtos de sua degradação são rapidamente excretados do organismo e não apresentam toxicidade apreciável.29 Ao se dispor de materiais com taxas controláveis de corrosão, pode-se ter implantes que dispensem a remoção posterior, como por exemplo, stents vasculares, parafusos e hastes usadas no tratamento de fraturas.30,31 Além da possível corrosão e liberação de íons metálicos, como já mencionado, outra limitação observada nos metais diz respeito à disparidade entre o valor do módulo de elasticidade dos metais e os ossos. O módulo de elasticidade dos ossos geralmente varia entre 3 e 20 GPa,29 enquanto que no aço inoxidável e nas ligas à base de cobalto este valor pode ser até 10 vezes superior. Em casos em que o módulo de elasticidade do implante for muito superior ao do osso, o implante assumirá a carga e o osso não receberá o estímulo necessário para manter sua massa,4 conduzindo ao fenômeno clínico conhecido como stress-shielding, com redução na densidade óssea e afrouxamento do implante. Modificações nos metais, como a inserção de poros, contribuem para a aproximação dos valores. Tal estratégia tem sido aplicada com sucesso no tântalo que, na forma porosa, apresenta módulo de elasticidade semelhante ao osso cortical, com valores de aproximadamente 3 GPa.32 Outra desvantagem dos metais relaciona-se aos possíveis ruídos resultantes do atrito em implantes compostos por dois metais em contato. A incidência deste problema em pacientes com implantes no quadril, por exemplo, pode chegar a 10% e costuma ter início entre 6 meses e 2 anos após a cirurgia.33 Além disso, a alta densidade dos metais pode implicar em implantes com alta massa, desconfortáveis ao paciente. Características específicas de algumas categorias de metais mais frequentemente utilizadas como componentes de biomateriais são descritas a seguir. Aço inoxidável Os aços inoxidáveis apresentam boas propriedades mecânicas, baixo custo em relação a outros metais, fácil processamento e alta disponibilidade.34,35 É um dos principais materiais utilizados em dispositivos de fixação. São ligas à base de ferro, cromo (mínimo de 12%) e outros elementos. A característica de não oxidável é obtida pela formação de uma camada passivadora de óxido de cromo na superfície do metal. Portanto, quanto maior o teor deste elemento na liga, maior a resistência à corrosão.18 As ligas de aço também apresentam carbono na estrutura, o qual pode formar precipitados de carbonetos de cromo nos contornos dos grãos, enfraquecendo a camada de passivação e resultando em menor resistência à corrosão.36 Em dispositivos biomédicos, portanto, são desejáveis baixos níveis deste elemento, como no aço austenítico 316L, que possui o máximo de 0,03% de carbono. Além do baixo teor de carbono, este tipo de aço é composto por cromo (16 a 18%), níquel (12 a 15%) e molibdênio (2 a 3%). O níquel é adicionado com a finalidade de estabilizar a estrutura austenítica do ferro e melhorar a resistência à corrosão. A adição de molibdênio em concentrações acima de 2% torna a camada de passivação mais resistente a meios corrosivos.18 Embora seja utilizado molibdênio e baixas concentrações de carbono, os implantes das ligas de aço 316L não são totalmente resistentes à corrosão por pites e por frestas. Consequentemente, seu uso tem sido contestado devido à presença de níquel e sua toxicidade, o que pode ocasionar problemas como alergias, câncer e atividades genotóxicas ou mutagênicas.18,36 Os efeitos adversos da liberação de níquel impulsionaram o desenvolvimento de novas ligas de aço inoxidável sem a presença deste elemento. A substituição é comumente feita pelo nitrogênio, que é um forte estabilizador da forma austenítica. A liga 316LN contém 0,10 a 0,16% de nitrogênio e apresenta superior resistência ao desgaste e à corrosão e ductilidade.35 Titânio e ligas de titânio O titânio e suas ligas têm sido largamente utilizados como biomateriais, especialmente em próteses, dispositivos para uso cardiovascular e para fixação de fraturas, devido à sua elevada biocompatibilidade, baixa densidade, baixo módulo de elasticidade e resistência à corrosão superior em comparação ao aço inoxidável. O titânio apresenta como vantagem adicional maior tendência de osseointegração, característica importante para implantes de longa duração. A reduzida ou inexistente reação do titânio com os tecidos que circundam o implante é decorrente da passivação, formada pelo filme de dióxido de titânio (TiO2), geralmente de espessura nanométrica, na superfície do metal.4,25,37 A desvantagem apresentada pelo titânio comercialmente puro (Ti-cp) está relacionada à fraca resistência ao desgaste por uso, o que o torna inadequado para aplicações que exijam elevada tensão.4 Por este motivo, o titânio tem sido utilizado como elemento base para a formação de ligas juntamente com outros elementos químicos, como o alumínio, o vanádio e o ferro, que têm a finalidade de melhorar as forças de tensão (liga Ti-6Al-4V). Para obtenção de ligas de titânio com propriedades variadas é feita a alteração das características cristalográficas por meio de adição de ligantes e processos termomecânicos. O titânio é um material alotrópico que apresenta uma estrutura cristalina hexagonal compacta (fase α) até 882 ºC. Acima desta temperatura ocorre alteração para a estrutura cúbica de corpo centrado (fase β). Alguns elementos, incluindo Al, Sn e Zr, estabilizam a fase α, enquanto elementos como Va, Mo, Nb, Mn estabilizam a fase β. Desta forma, as propriedades da liga irão depender da composição, das proporções relativas das fases α e β, dos tratamentos térmicos e das condições de processamento. As ligas de titânio do tipo α exibem boa resistência à corrosão, mas possuem limitada resistência mecânica em baixas temperaturas. Já as ligas estabilizadas na fase β possuem menor módulo de elasticidade, o que contribui para diminuir a diferença desta propriedade entre o biomaterial e o osso.37 Entre as diferentes ligas envolvendo o titânio, a liga equiatômica Ni-Ti, conhecida como Nitinol, tem elevado destaque em decorrência de suas notáveis propriedades de memória de forma, superelasticidade, e resistência à fadiga e à torção. A propriedade de memória de forma refere-se à capacidade do material em retomar a forma original após uma deformação pelo aumento da temperatura. O comportamento elástico do Nitinol permite que este possa ser deformado em até 20 vezes reavendo as dimensões originais após a liberação da tensão. Devido a estas propriedades únicas, a liga Nitinol é utilizada em arcos ortodônticos, fios-guia, stents, catéteres, clipes de aneurisma e grampos ortopédicos.23,38 Ligas à base de cobalto-cromo As ligas à base de cobalto e cromo para aplicações como biomateriais estão associadas, principalmente, a próteses ortopédicas para joelho, ombro e quadril bem como a dispositivos de fixação de fraturas, implantes maxilo-faciais e dentários.39,40 Estas ligas são não-magnéticas, altamente resistentes ao desgaste, calor e à corrosão, possibilitando sua aplicação por longos períodos. A resistência ao desgaste das ligas Co-Cr supera a dos aços inoxidáveis e das ligas de titânio. As desvantagens destas ligas estão relacionadas à baixa plasticidade e dificuldade na usinabilidade.38 Assim como no caso do aço inoxidável, a resistência à corrosão deve-se à formação da camada protetora de CrO2. A adição de pequenas quantidades de outros elementos, como ferro, molibdênio e tungstênio, contribui para a melhoria das propriedades em altas temperaturas e resistência à abrasão. Desta forma, as duas ligas predominantes para uso como biomateriais são a liga Co-Cr-Mo e a liga Co-Cr-Ni-Mo, denominada comercialmente de Vitallium. Outras ligas aprovadas para uso incluem o tungstênio (Co-Cr-Ni-W) e o ferro (Co-Cr-Ni-W-Fe).40 Cerâmicas As cerâmicas incluem uma ampla gama de compostos que tiveram papel essencial no desenvolvimento dos biomateriais. As aplicações englobam as mais diversas áreas, como instrumentos de diagnóstico (termômetros, fibras para endoscopia), próteses ortopédicas, dispositivos para a reconstrução odontológica e maxilo-facial, válvulas cardíacas, traqueias artificiais e preenchimentos ósseos. O vasto campo de aplicação se deve, em grande parte, às propriedades cristalográficas e à superior compatibilidade química das cerâmicas com o meio fisiológico e com tecidos rígidos, como ossos e dentes.24,41,42 Do ponto de vista químico, as cerâmicas são compostos inorgânicos, geralmente formados de elementos metálicos e não-metálicos unidos por ligações iônicas e/ou covalentes. Nestas ligações, os elétrons não estão livres como ocorre nos metais, mas localizados entre os íons/átomos. Com isto, as cerâmicas tendem a se comportar como materiais de baixa condutividade elétrica e térmica.22 De forma geral, as cerâmicas são menos densas do que a maioria dos metais e suas ligas. Estes materiais apresentam boa estabilidade dimensional, são resistentes ao desgaste e à compressão e estáveis em ambientes ácidos. No entanto, as fortes ligações interatômicas formam estruturas cristalinas tridimensionais com alto grau de compactação, tornando-os duros, quebradiços e suscetíveis a fraturas, com pouca ou nenhuma deformação plástica. Além disso, são muito sensíveis à presença de rachaduras e outros defeitos, que podem agir como pontos de início de fraturas e contribuir para a ruptura precoce do material durante o uso. Devido a estes fatores, as cerâmicas são pouco indicadas para aplicações em regiões submetidas a tensões elevadas e que requeiram sustentação.22,41 Os biomateriais cerâmicos podem ser classificados de acordo com a sua interação com o tecido hospedeiro como bioinertes, bioativas e bioreabsorvíveis. As bioinertes, como a alumina e a zircônia, mantêm suas propriedades físicas e mecânicas enquanto implantadas, são bem toleradas pelo organismo e não provocam resposta dos tecidos. As cerâmicas bioativas interagem com o tecido circundante, estimulam a cura e o sistema tissular a responder ao material como se este fosse um tecido natural. Como exemplos desta classe, destacam-se a hidroxiapatita, os biovidros e as vitrocerâmicas. Os materiais bioreabsorvíveis participam do processo metabólico do organismo e apresentam a característica de sofrerem degradação por ações químicas ou biológicas, sendo lentamente substituídos por células em crescimento. São também estáveis a longo prazo e minimizam a possibilidade de liberação do implante. O fosfato tricálcico e o gesso estão incluídos nesta classe de cerâmicas.42 As características e aplicações dos principais tipos de cerâmicas citados estão abordadas de forma mais detalhada nos próximos subitens. Alumina A alumina (Al2O3) apresenta uma estrutura cristalina hexagonal compacta, com características de elevada dureza, resistência à compressão e à abrasão, podendo ser polida com alto acabamento superficial. As fortes ligações iônicas e a alta proporção de oxigênio a tornam um material quimicamente inerte, com grande estabilidade em meios fisiológicos e corrosivos.43 A cerâmica constituída de alumina policristalina de alta densidade (α-Al2O3) e elevada pureza (>99,5%) é a mais utilizada em implantes. A tenacidade e resistência à tensão e à fadiga deste tipo de material estão associadas ao tamanho de grão e da sua pureza. Pequenas quantidades de MgO (<0,5%) são frequentemente adicionadas visando inibir o crescimento do grão durante a sinterização para melhorar as propriedades mecânicas. A alumina com tamanho médio de grão inferior a 4 µm e com pureza superior a 99,7% possui boa resistência à flexão e à compressão. Grãos com tamanho superior a 17 µm podem diminuir a resistência mecânica da alumina em até 20%.42,43 A principal aplicação da alumina está relacionada à confecção de acetábulos e cabeças femorais para artroplastias de quadril. Quando estas duas peças são polidas em conjunto e utilizadas como par, o coeficiente de atrito da junta diminui com o tempo e o valor tende a se aproximar ao da articulação normal. Com isto, o desgaste das superfícies alumina-alumina é aproximadamente 10 vezes menor que o das superfícies metal-polietileno, por exemplo. Outras aplicações clínicas da alumina incluem próteses de joelho e elementos para reconstrução maxilo-facial, parafusos para ossos, substitutos de ossículos do ouvido médio, próteses de córnea, substituições segmentares de ossos e implantes dentários.42 A alumina monocristalina (safira) apresenta resistência mecânica cerca de três vezes superior à da alumina policristalina, boa estética e possibilidade de obtenção de dispositivos com diferentes tamanhos e formas. Tal material teve ampla aplicação na confecção de próteses dentárias e coroas que, no entanto, seu uso decresceu em função da baixa resistência ao impacto.44 Atualmente, a alumina monocristalina é empregada como braquetes em aparelhos ortodônticos, devido à maior estética e superfície altamente polida. Para esta aplicação, no entanto, este material pode apresentar alguns inconvenientes como a possibilidade de fratura e alta fricção durante a mecânica de deslizamento, que pode gerar desconforto ao paciente.45 Zircônia A zircônia pertence ao grupo das cerâmicas inertes e apresenta uma estrutura polimórfica com três formas distintas de cristal: monoclínica (M), cúbica (C) e tetragonal (T). A estrutura monoclínica é observada em temperaturas de até 1170 ºC. Acima desta, ocorre a transformação para a fase tetragonal e à 2370 ºC, a zircônia adota a fase cúbica.46 Durante o resfriamento a partir da temperatura de processamento, a fase tetragonal transforma-se na fase monoclínica acompanhada por uma expansão de volume (3 a 4%) que provoca tensões internas na microestrutura do material, gerando trincas que o torna extremamente frágil. Com isto, as propriedades mecânicas e refratárias da zircônia pura são prejudicadas, limitando suas aplicações. De forma a aumentar a resistência mecânica e a tenacidade, as fases cristalinas tetragonal e cúbica podem ser estabilizadas em temperaturas baixas pelo uso de aditivos, como os óxidos de magnésio, cério, ítrio e cálcio. Dependendo da concentração de aditivos, este procedimento pode originar a zircônia tetragonal policristalina (TZP), a zircônia totalmente estabilizada (FSZ, geralmente em fase cúbica) e a zircônia parcialmente estabilizada (PSZ), em que finas partículas tetragonais metaestáveis estão dispersas em uma matriz cúbica.47,48 Dentre as diferentes formas modificadas, a cerâmica de zircônia tetragonal policristalina estabilizada com ítria (Y-TZP) destaca-se por apresentar grãos muito finos e baixa porosidade. Estes fatores possibilitam a obtenção de um material com elevada resistência à flexão, tenacidade e resistência ao desgaste erosivo, que pode ser utilizado com sucesso em aplicações sujeitas a tensões mecânicas.47 Em comparação com a alumina, esta cerâmica apresenta maior força, menor dureza e menor módulo elástico. As principais aplicações da zircônia são como material alternativo à alumina na confecção de cabeças femorais em próteses de quadril, próteses de joelho e ombro e materiais odontológicos.48,49 Há também crescente interesse na utilização conjunta da zircônia e da alumina visando à obtenção de dispositivos com propriedades mecânicas e de degradação ajustadas à aplicação desejada.42 Fosfatos de cálcio As cerâmicas de fosfato de cálcio têm elevado potencial para aplicações como biomaterial devido à similaridade química e estrutural com a apatita biológica, que está presente em grandes proporções na fase mineral de ossos e dentes. Estes materiais apresentam excelente biocompatibilidade e comportamento bioativo, possibilitando elevados níveis de osseointegração e osteocondução.50,41 Os fosfatos de cálcio têm sido amplamente estudados e empregados em aplicações abrangendo todo o sistema esquelético, como reconstruções crânio-maxilo-facial e tratamento de defeitos ósseos.50 As cerâmicas porosas de fosfatos de cálcio podem, inclusive, atuar como suportes úteis na liberação de diferentes compostos nelas incorporados, como hormônios,51 vacinas,52 antibióticos53 e agentes com atividade anticâncer, incluindo compostos radioativos54 e cisplatina.55,56 As principais limitações do uso dos fosfatos de cálcio advêm do fato dos mesmos serem muito quebradiços e apresentarem baixa resistência à fadiga. Com isto, recobrimentos densos ou porosos destas cerâmicas são frequentemente aplicados em implantes metálicos de sustentação para permitir a fixação biológica ou osseointegração. Os fosfatos de cálcio são basicamente constituídos de sais de ácido fosfórico ou ortofosfórico e podem ser sintetizados por precipitação a partir de soluções contendo íons Ca2+ e PO43-, sob condições alcalinas ou ácidas. A razão molar entre os átomos de cálcio e fósforo (Ca/P) varia entre 0,5 e 2,0 e é usualmente utilizada como forma de classificação dos diferentes fosfatos de cálcio. Compostos com maior razão Ca/P apresentam menor solubilidade em condições neutras e reduzida taxa de degradação.57,58 Entre os fosfatos de cálcio mais difundidos, destacam-se a hidroxiapatita (Ca10(PO4)6(OH)2) e o fosfato tricálcico nas formas polimórficas α e β (Ca3(PO4)2), cujas superfícies facilitam a adsorção de proteínas e têm elevado potencial osteoindutivo. A hidroxiapatita (HP) é um dos principais componentes minerais dos ossos, esmalte, dentina e também está presente em cálculos urinários e dentários.59 Como biomaterial, apresenta como vantagens a rápida adaptação óssea, não formação de tecido fibroso, reduzido tempo de cicatrização e íntima adesão implante/tecido. A limitação deste composto está relacionada à sua lenta biodegradação, que ocorre por mecanismos celulares gradualmente após 4 a 5 anos de implantação. Este comportamento pode ser atribuído à razão molar Ca/P de 1,67, que torna a HP praticamente insolúvel em meios neutros. Os fosfatos tricálcicos (TCP), que possuem Ca/P de 1,5, não são estáveis em soluções aquosas e em presença de umidade, sendo reabsorvidos entre 6 e 15 semanas após o implante, dependendo de alguns fatores, como a porosidade, cristalinidade, pureza química e rugosidade superficial do biomaterial.41,60 As formas alotrópicas α e β-TCP exibem a mesma habilidade de osteocondução, porém a fase α-TCP apresenta maior bioatividade, sendo este fato atribuído ao arranjo estrutural desta fase, que possibilita que maior quantidade de íons Ca2+ e PO43- seja trocada com o meio biológico.58 Ambos os fosfatos de cálcio descritos estão em estudos para aplicação como scaffolds na área de engenharia tecidual, porém, como o TCP se degrada mais rapidamente que a HA (sofre simultaneamente ação de mecanismos celulares e químicos), a predição e o controle de sua taxa de degradação são mais difíceis. Desta forma, a utilização do TCP juntamente com a HA tem sido uma alternativa viável para aumentar a velocidade de reabsorção da HA. Nestes casos, a velocidade de dissolução da mistura HA/TCP é controlada pela quantidade de TCP utilizado.58 Outra classe que tem despertado interesse na área biomédica são os cimentos de fosfatos de cálcio (CFC). Estes materiais são biodegradáveis e multicomponentes, constituídos por uma fase sólida inorgânica e uma fase líquida, os quais, ao serem misturados, formam uma pasta que enrijece espontaneamente à temperatura ambiente ou corporal, como resultado da precipitação de um ou vários fosfatos de cálcio. Durante a reação de precipitação, os cristais de CaP crescem e entrecruzam-se, proporcionando, assim, a rigidez mecânica do cimento.61 A fase inorgânica pode ser composta por um ou mais fosfatos de cálcio e a fase líquida é constituída de água ou soluções aquosas. Diversas características tornam os cimentos de fosfatos de cálcio atrativos para utilização como enxertos e substitutos ósseos, tais como a facilidade de manipulação e atoxicidade; a possibilidade de serem injetados, o que torna os processos cirúrgicos menos invasivos; a capacidade de apresentar solidificação in situ, sem geração de calor apreciável e o bom ajuste ao local do implante, mesmo em defeitos geometricamente complexos, garantindo maior contato do tecido com o biomaterial. Além disso, há a possibilidade de incorporação nestes materiais de fatores de crescimento para estimular reações biológicas específicas e de fármacos para a liberação controlada em locais pré-determinados do sistema esquelético.62-64 Entre as desvantagens deste material estão a baixa resistência mecânica em comparação com o osso normal e o fato de não apresentar microporosidade, o que dificulta o crescimento celular em seu interior. Biovidros e vitrocerâmicas O uso dos vidros bioativos teve início com o desenvolvimento inovador do Bioglass® 45S5 por Larry Hench, em 1969. Constituído por um sistema quaternário do tipo SiO2-CaO-Na2O-P2O5, este ainda é considerado o modelo-base para os biovidros, em que 45% em massa é constituído pelo SiO2 e a razão entre CaO e o P2O5 deve ser de 5:1 para que ocorra a ligação interfacial ao osso.42,65 Esta composição apresenta excelentes propriedades de interação com os tecidos vivos e osteoindução. Formulações que contêm de 52 a 60% em massa de SiO2 apresentam taxas de ligação mais lentas com o tecido ósseo. Acima de 60% de SiO2, não há formação de ligação com o tecido e o material adquire comportamento bioinerte.66 Quando implantado no organismo, forma-se na superfície desse material uma camada de hidroxiapatita carbonatada biologicamente ativa, responsável pela forte ligação interfacial ao tecido ósseo.57,66 A força de adesão interfacial resiste a esforços mecânicos substanciais e, em muitos casos, é maior do que a força de coesão do material de implante ou do tecido.42 O Bioglass® também pode apresentar interação com o tecido conjuntivo, desde que a interface esteja imóvel.66 Mais recentemente, foi observado que a dissolução iônica dos produtos do biovidro (Si, Ca, P) estimulam a expressão de diversos genes de células osteoblásticas e a angiogênese in vitro e in vivo.60 A formação da camada de hidroxiapatita se dá em um mecanismo químico envolvendo cinco fases distintas. No primeiro estágio ocorre uma rápida troca de íons Na+ da superfície do vidro com íons H+ e H3O+ na solução. No segundo estágio, a sílica solúvel (SiO2) do vidro é liberada na forma de Si(OH)4 para a solução, como o resultado da quebra das ligações siloxano (Si-O-Si) e da formação de grupos silinol (Si-OH) na interface. A terceira etapa é caracterizada pela policondensação dos grupos silanol formando uma camada porosa rica em sílica na superfície do material já deficiente de cátions alcalinos e alcalino-terrosos. Durante o estágio seguinte, íons Ca2+ e grupos (PO4)3- migram da superfície formando um filme rico em CaO-P2O6 que cresce de forma amorfa pela incorporação adicional de cálcio solúvel e fosfatos da solução fisiológica. Na última etapa, o filme amorfo é cristalizado pela incorporação de íons OH- e CO32- presentes na solução, dando origem à camada de hidroxiapatita carbonatada. O tamanho dos cristais formados na superfície do vidro bioativo tende a ser de escala nanométrica, equivalente à fase cristalina do osso.66,67 A capacidade dos biovidros em estimular o crescimento ósseo excede a dos implantes à base de hidroxiapatita. O índice de bioatividade, relacionado com o tempo para que mais de 50% da superfície do biomaterial esteja ligada às células do tecido, é de 12,5 para o Bioglass® 45S5 enquanto que o da hidroxiapatita é de 3,1.68 Dessa forma, enquanto o Bioglass® 45S5 levaria cerca de 8 dias para que 50% de sua superfície estivesse ligada às células do tecido, a HA levaria cerca de 32 dias, se utilizados sob as mesmas condições.66 As aplicações mais comuns dos vidros bioativos incluem o reparo e regeneração óssea, incluindo ortopedia, periodontia, reconstrução maxilo-facial, cirurgia da coluna vertebral e reconstruções otorrinolaringológias.67 As limitações deste composto advêm da baixa resistência mecânica, principalmente a resistência à fratura, e da restrita usinabilidade.66 Com o objetivo de melhorar estas propriedades, buscou-se o desenvolvimento de tratamentos térmicos para nucleação e crescimento de cristais nos vidros bioativos, dando origem às vitrocerâmicas. Desde então, diversos sistemas têm sido obtidos como o Ceravital (Na2O-K2O-MgO-CaO-SiO2-P2O5), Bioverit I (SiO2-Al2O3-MgO-CaO-P2O5) e o A-W Cerabone (MgO-CaO-SiO-P2O5-CaF2).66,69 O aumento da cristalinidade nos materiais modifica suas propriedades físicas e químicas, bem como tende a reduzir sua bioatividade. A produção de vitrocerâmicas a partir de composições semelhantes à do Bioglass® 45S5, com a microestrutura controlada, vem sendo analisada visando combinar as propriedades mecânicas superiores das vitrocerâmicas e a elevada bioatividade dos biovidros. Este novo material, denominado Biosilicato®, tem cristalinidade próxima a 100%, exibe alta bioatividade e seu módulo de elasticidade é mais próximo ao do osso cortical. Na forma particulada este material não exibe arestas cortantes e seu maior potencial de uso seria no tratamento de hipersensibilidade dentinária. Na presença dos fluidos bucais, quando depositado no interior dos túbulos dentinários, este material pode dar início ao processo de formação de HA, resultando em sua oclusão por meio de uma ligação química com o material.66 Polímeros Os biomateriais poliméricos estão dentre os mais empregados no âmbito médico.70 As principais vantagens dos biomateriais poliméricos em comparação com os materiais cerâmicos ou metálicos incluem a facilidade de fabricação para produzir formas variadas (partículas, filmes, fios, dentre outros), o processamento secundário, custo razoável e disponibilidade em encontrar materiais com propriedades mecânicas e físicas desejadas para aplicações específicas.71 Polímeros são macromoléculas de alta massa molar formadas pela ligação de unidades repetitivas menores (meros) ao longo da cadeia principal. As ligações entre os meros são covalentes, no entanto, ligações de hidrogênio entre diferentes cadeias, assim como interações de van der Waals e reticulação por meio de ligações covalentes podem também ocorrer.71,72 Os , polímeros do tipo termoplásticos, por exemplo, capazes de se fundir e solidificar repetidas vezes, são caracterizados por apresentar ligações químicas fracas de van der Waals entre as cadeias. Desta forma, sob aquecimento, as cadeias são capazes de deslizar entre si, podendo também ser observada a ruptura de interações intercadeias. Já os polímeros termorrígidos são caracterizados por uma estrutura tridimensional reticulada estabilizada por ligações covalentes fortes. Assim, estes materiais são insolúveis e as ligações são rompidas somente por elevadas quantidades de energia, com consequente degradação do polímero.70,73 As cadeias poliméricas podem ser lineares, como o poli(cloreto de vinila) (PVC) utilizado na produção de tubos de circulação sanguínea,74 ramificadas, como o polietileno utilizado para implante de queixo75 ou reticuladas, como o poli(2-hidroxietilmetacrilato) - poli(HEMA) usado em lentes de contato tipo gel.76 Diversos critérios devem ser considerados ao se selecionar um material polimérico, uma vez que cada polímero pode apresentar propriedades particulares que irão direcioná-lo para uma aplicação específica.77 Neste sentido, as formas que as cadeias podem assumir, a disposição das unidades monoméricas, a presença ou não de átomos ou grupos funcionais particulares, a rigidez estrutural, a polaridade da cadeia e a massa molar do polímero resultam em subclasses de compostos que podem apresentar comportamentos distintos e com potencial de aplicação visando diferentes finalidades.70 Os polímeros podem ser obtidos a partir de reações de polimerização ou por meio de organismos vivos, classificando-se, assim, respectivamente, como sintéticos e naturais, os quais podem ser também quimicamente modificados. Os mais utilizados são os sintéticos devido a sua maior estabilidade durante o uso, por possuírem propriedades bem definidas e reprodutíveis e baixo custo. Na Tabela 2 são mostradas as estruturas monoméricas e aplicações de alguns tipos de polímeros comumente utilizados na constituição de biomateriais.
O poli(cloreto de vinila), por exemplo, é um dos polímeros mais utilizados para a confecção de dispositivos médicos, abrangendo cerca de 40% de todos os materiais poliméricos aplicados para este fim. Seu amplo uso é devido a sua inércia, alta transparência, facilidade de esterilização e resistência.78 Já o poli(HEMA) é um hidrogel transparente, biocompatível, com boas propriedades mecânicas e com adequada estabilidade, absorção de água e permeabilidade ao oxigênio, o que o torna particularmente propício para a produção de lentes de contato ou de sistemas de liberação de fármacos.76 A análise da forma de degradação dos polímeros é também de grande importância no direcionamento de sua aplicação específica, devendo-se considerar não somente a cinética do processo (que define sua duração in vivo), mas também a alteração progressiva de sua funcionalidade, já que modificações ocorrem progressiva e irreversivelmente na estrutura e composição do biomaterial, além das propriedades dos produtos gerados ao longo de sua decomposição que podem, eventualmente, ser citotóxicos. Os polímeros sintéticos e naturais se degradam de formas distintas, por meio da clivagem hidrolítica e enzimática de suas ligações, respectivamente.84 Desta forma, a degradação de um biomaterial polimérico deve ser bem elucidada para que haja segurança quando de seu contato com os fluidos fisiológicos do paciente. Polímeros sintéticos Vários dos polímeros sintéticos utilizados na produção de biomateriais apresentam cinética de degradação conhecida e podem ser sintetizados de forma controlada e reprodutível. Estes materiais são facilmente adaptáveis para exercer uma grande variedade de propriedades funcionais, sendo possível manipular, por exemplo, a forma e o tamanho dos dispositivos, assim como suas propriedades mecânicas (como a viscoelasticidade). Nesta categoria, os principais tipos de polímeros constituintes de biomateriais são: poliamidas, polietileno, polipropileno, poliacrilatos, fluorocarbonos, poliésteres, poliéters, poliuretanos, entre outros.70,85 Apesar das adequadas propriedades funcionais, os polímeros sintéticos geralmente não apresentam grupos químicos favoráveis para interação celular e podem ainda liberar subprodutos tóxicos na corrente sanguínea durante sua degradação, o que poderia desencadear reações inflamatórias no paciente ao longo de sua utilização.70,77 A degradabilidade destes materiais está relacionada com as ligações químicas hidroliticamente instáveis na cadeia principal do polímero. Os grupos funcionais sensíveis à hidrólise incluem, por exemplo, os ésteres, carbonatos, amidas, uretanos, ureias e anidridos.84 Um exemplo deste caso é o poli(tereftalato de etileno) (PET) que foi originalmente desenvolvido para aplicações têxteis e alimentícias, mas é também utilizado para a confecção de suturas e enxertos vasculares.70,86 Por apresentar toxicidade durante a degradação, o PET necessita de um tratamento específico e rigoroso na limpeza e lavagem do biomaterial a fim de não desencadear efeitos deletérios durante sua utilização.70 O poli(metacrilato de metila) (PMMA) é outro exemplo de polímero sintético que pode causar efeitos tóxicos durante sua degradação. O PMMA é uma resina acrílica resultante da polimerização do metacrilato de metila (MMA) e tem sido utilizado com sucesso como cimento ósseo em cirurgias ortopédicas. Quando injetado, o PMMA/MMA se solidifica a partir do mecanismo de auto-polimerização e se adapta à forma para o qual foi direcionado. 2,87,88 Entretanto, a adesão deste polímero aos ossos é limitada se a área de contato não é suficientemente grande. Além disso, o mesmo não induz remodelação óssea e pode gerar toxicidade em função da conversão incompleta do metil metacrilato, o que pode resultar na presença de monômeros residuais que podem gerar uma resposta inflamatória ao paciente.87,89,90 O polietileno (PE) de alta densidade e alta massa molar é altamente estável, sendo caracterizado por ser não antigênico, não alergênico, não absorvível e por apresentar baixa taxa de desgaste. Tais propriedades fazem com que este material seja uma referência de substância inerte em termos de reação tecidual. O PE possui cadeia com estrutura linear e é o polímero base para outros materiais, tais como polipropileno e o politetrafluoretileno.75 As propriedades do PE de alta massa molar tornam este material propício para aplicação em próteses de joelho e quadril, porém, devido à apolaridade da cadeia polimérica, apresenta baixa reatividade química, o que restringe sua fixação ao tecido ósseo.91 Tal limitação pode ser contornada pela modificação da morfologia do polímero, por meio da inserção de poros no material,91 que melhor propicia e acomoda o crescimento celular na matriz. O aumento da porosidade possibilita não somente maior aplicabilidade do PE de alta massa molar, mas também a de outros tipos de polímeros tanto sintéticos quanto de origem biológica, que podem ser utilizados com sucesso como scaffolds na área Engenharia Tecidual. Para tal, os dispositivos devem ser produzidos de forma a mimetizar a matriz extracelular, permitindo a adsorção de compostos importantes, sendo suficientemente estáveis no meio de cultura das células neles inoculadas e no ambiente fisiológico no qual serão implantados, apresentando poros com arquitetura apropriada quanto ao formato e distribuição, ao tamanho (100 a 500 µm) e à interconectividade (>85%, 100 µm), dentre outras características de relevância.92-95 Especificamente na área de Engenharia Tecidual, os polímeros sintéticos mais utilizados são os biodegradáveis, como os poliésteres alifáticos saturados, incluindo o poli(ácido lático) (PLA) e o poli(ácido glicólico) (PGA), bem como o copolímero poli(ácido lático-co-ácido glicólico) (PGLA).96 Tais compostos sofrem degradação hidrolítica por meio da desesterificação. Após degradados, os componentes monoméricos de cada polímero são removidos por vias naturais, havendo no organismo mecanismos altamente regulados para remover completamente os componentes monoméricos dos ácidos lático e glicólico, por exemplo.92 Devido a essas propriedades, tais polímeros têm sido utilizados, além de na confecção de suportes tridimensionais para proliferação celular, como suturas biodegradáveis, dispositivos absorvíveis de fixação óssea e matrizes para a liberação de fármacos.85 Outro polímero da categoria dos sintéticos muito estudado é a poli(ε-caprolactona) (PCL), um poliéster alifático sintético linear, semi-cristalino, hidrofóbico e solúvel em uma grande variedade de solventes orgânicos. A PCL também possui baixa temperatura de fusão (59 a 64 ºC) e propriedades reológicas e viscoelásticas superiores a outros polímeros da mesma categoria, o que a torna fácil de manipular, permitindo obter uma ampla gama de produtos a um custo relativamente baixo. Estas características, associadas com a habilidade de formar blendas miscíveis, têm estimulado as aplicações deste polímero na área médica, como na obtenção de scaffolds e matrizes para liberação controlada de fármacos. Além destes fatores, muitos dos dispositivos de liberação produzidos com PCL já são aprovados pela FDA (Food and Drug Administration, EUA), facilitando a introdução de novos produtos originados desta matéria-prima no mercado. A degradação deste polímero ocorre em duas etapas, sendo que na primeira ocorre a hidrólise não enzimática dos grupos éster e, na segunda, macrófagos e fagossomos promovem sua degradação intracelularmente. Isso indica que a PCL pode ser completamente absorvida pelo organismo do paciente. A taxa de degradação pode ser alterada pela copolimerização da PCL com lactonas ou glicolídeos e lactídeos.97 Polímeros naturais Os polímeros de origem biológica são abundantes e seus produtos de degradação são biocompatíveis e não-tóxicos, o que os torna seguros para utilização na constituição de biomateriais. Além disso, apresentam custo acessível e são obtidos de fontes renováveis. No entanto, devido à complexidade dos meios dos quais estes são extraídos e à variabilidade por vezes intrínseca da matéria-prima, sua purificação pode se mostrar relativamente complexa. A variabilidade da matéria-prima, por exemplo, com relação às espécies biológicas das quais se extrai o material de partida ou ao local e época de coleta, pode afetar as propriedades do produto final. Notam-se, com frequência, diferenças nas características dos polímeros naturais de lote para lote, visto que os mesmos são extraídos de organismos vivos como algas, plantas, animais e microrganismos, ou são por eles expressos extracelularmente.77 Ainda assim, vários são os biopolímeros utilizados na produção de materiais com aplicações biomédicas, tendo destaque as proteínas (como colágeno, elastina e fibroína da seda) e os polissacarídeos (como quitosana, alginato, goma xantana, ácido hialurônico e pectina).98,99 As aplicações dos biopolímeros na medicina regenerativa incluem o tratamento de feridas e a liberação controlada de fármacos, entre outras. Isto se deve às características de biodegradabilidade, biocompatibilidade, semelhança com a matriz extracelular e por induzir e estimular o processo de cicatrização de feridas.100-102 Sua degradação depende de processos enzimáticos e por isso há maior propensão destes materiais serem metabolizados pelo organismo humano, porém, sua taxa de degradação pode variar de paciente para paciente. Além do mais, os polímeros naturais possuem grupos funcionais (como grupamentos amino, grupos carboxílicos e hidroxilas) disponíveis para modificações químicas (hidrólise, oxidação, redução, esterificação, ligações cruzadas, etc.) e enzimáticas e, também, para interagir com outras moléculas, o que permite a obtenção de uma vasta variedade de produtos com propriedades adaptáveis.103,104 Proteínas como o colágeno, elastina, fibrina e albumina podem oferecer uma vantagem adicional quando utilizadas como matéria-prima de um biomaterial, uma vez que podem ser capazes de interagir favoravelmente com as células através de domínios específicos de reconhecimento presentes na estrutura celular. O colágeno, proteína fibrosa mais abundante no organismo humano, é composto por três cadeias polipeptídicas unidas por pontes de hidrogênio e enroladas uma em torno da outra em um arranjo helicoidal, formando fibras. Estas hélices triplas apresentam, como significativa propriedade, elevada resistência à tração. O colágeno é o principal componente da matriz extracelular, sendo um substrato natural para as células, orientando e estimulando a formação tecidual. Estas características, juntamente com a biocompatibilidade e estabilidade do colágeno, o tornam atrativo para a confecção de biomateriais de diferentes formas e aplicações, como membranas e esponjas para revestimento de queimaduras, géis para hemostasia e suporte para o crescimento de células.104,105 Outra proteína que tem despertado grande interesse é a fibroína da seda. Esta proteína é composta por glicina, alanina e serina e, em menor quantidade, por tirosina, dispostas de maneira altamente organizada. Este material, há séculos, tem sido utilizado como sutura cirúrgica por apresentar alta resistência mecânica e biocompatibilidade. Atualmente, a fibroína da seda vem sendo investigada como um potencial biopolímero para a confecção de outros tipos de biomateriais, densos ou porosos. Isto se deve não somente às propriedades já mencionadas, mas também a sua alta resistência a microorganismos, à degradação controlada in vivo, a sua elevada permeabilidade a oxigênio e vapor d'água, à reduzida reação inflamatória quando em contato com fluidos corpóreos e por poder ser processada na forma de géis, filmes e esponjas.106,107 Adicionalmente, as cadeias laterais dos aminoácidos da fibroína podem ser quimicamente modificadas, tanto para alterar suas propriedades de superfície quanto para imobilizar fatores de crescimento celular. Devido a estas características, o uso desta proteína tem sido analisado na produção de scaffolds, lentes de contato, agentes de liberação de drogas e como matriz para imobilização enzimática.106,108 Os polissacarídeos também vêm ganhando apreciável interesse para uso no âmbito médico devido a várias de suas propriedades, tais como renovabilidade, biodegradabilidade e por mimetizar os componentes da matriz extracelular, o que os tornam elementos-chave em processos biológicos. Estes biopolímeros também são muito importantes devido a sua solubilidade e propriedades tecnológicas, como gelificação, emulsificação e efeito hidratante, dentre outras.101 Os polissacarídeos são obtidos a partir de fontes microbianas, animais, vegetais ou de algas e, assim como as proteínas, podem ser processados como géis, filmes, partículas e pós.77 O ácido hialurônico (AH) é um polissacarídeo linear de alta massa molar, encontrado nos tecidos conjuntivos de mamíferos, podendo ser extraído da pele, tendões, fluido sinovial, humor vítreo ocular e cordão umbilical. Tradicionalmente, o AH era extraído de cristas de galináceos, mas sua produção via processos fermentativos vem sendo extensivamente explorada atualmente. É composto por unidades dissacarídicas polianiônicas de ácido D-glicurônico e N-acetilglicosamina unidas por ligações β(1→3) e β(1→4). Este biopolímero é essencial na matriz extracelular da pele e tem como funções a hidratação, lubrificação e estabilização do meio circundante. Suas propriedades estruturais e biológicas auxiliam na mediação da sinalização celular, na reparação de feridas e no preenchimento de tecidos moles a fim de corrigir depressões, rugas e sulcos. Devido a estas características, hidrogéis baseados em ácido hialurônico vêm sendo amplamente utilizados na medicina reparativa, uma vez que podem ser injetados carreando fatores de crescimento celular, moléculas pequenas, anticorpos, micro e nanopartículas.109,110 A quitosana, formada por unidades de D-glicosamina e N-acetil-D-glicosamina unidas por ligações glicosídicas do tipo β(1→4), é um dos mais versáteis e promissores biopolímeros, possuindo propriedades intrínsecas atraentes, tais como biocompatibilidade, não toxicidade, biodegradabilidade, bioadesividade e atividade contra fungos, bactérias e vírus.111 Trata-se de um polissacarídeo linear derivado do processo de desacetilação da quitina, encontrada no exoesqueleto de crustáceos e na parede celular de fungos. Esta última fonte tem recebido crescente atenção devido ao melhor controle da qualidade e maior reprodutibilidade de lote para lote, entretanto, seu custo é ainda muito elevado em comparação à da quitosana de fontes animais. No campo biomédico, a quitosana vem sendo amplamente estudada por suas propícias interações específicas com componentes da matriz extracelular, o que tem levado ao aumento de sua utilização na área de engenharia tecidual, como no reparo da pele, osso e cartilagens.112 Segundo Chen et al.,113 a quitosana é um importante constituinte de biomateriais úteis para o tratamento de feridas, uma vez que é capaz de acelerar a cicatrização de lesões e a síntese de colágeno pelos fibroblastos na fase inicial de cicatrização, caracterizando-se como um polímero bioativo. No entanto, quando preparada na forma de filmes ou membranas, para utilização como curativos, por exemplo, sua resistência mecânica é baixa, assim como sua capacidade de absorver fluidos corpóreos. Uma alternativa para contornar tal limitação é a combinação de quitosana com outros materiais poliméricos.111,114 Outro polímero natural de interesse na área de biomateriais é o alginato, um polissacarídeo linear de alta massa molar que tem como principal fonte a parede celular de diversas espécies de algas marinhas marrons. Este biopolímero pode ser também sintetizado por algumas bactérias, como as espécies Pseudomonas e Azotobacter, originando um material de alta pureza e biocompatibilidade, com características e estrutura polimérica padronizáveis, de grande interesse em aplicações na área médica. A estrutura química do alginato consiste de resíduos do ácido α-L-gulurônico e ácido β-D-manurônico associados por ligações glicosídicas do tipo β(1→4) e distribuídos em diferentes proporções e combinações ao longo da cadeia.115 Devido à sua biocompatibilidade e à possibilidade de ajuste das propriedades por reticulação com íons divalentes como o cálcio, o alginato tem aplicações na forma de hidrogéis, membranas e micropartículas. Este polímero tem sido empregado em sistemas de liberação de fármacos e proteínas, na cicatrização de feridas, como matriz para cultivo celular e na engenharia tecidual visando a regeneração de ossos e vasos sanguíneos.70 A celulose, principal componente da parede celular de plantas, é um polissacarídeo formado por cadeias lineares não ramificadas de moléculas de β-D-glicose, unidas por ligação do tipo β(1→4) glicosídicas. A unidade estrutural de repetição da molécula de celulose é a celobiose, formada pela união de duas moléculas de glicose. Este polímero apresenta elevado grau de cristalinidade, baixa solubilidade e baixa degradação in vivo. As principais aplicações na área médica incluem membranas de diálise e scaffolds para engenharia tecidual.116 A celulose pode também ser sintetizada em abundância por bactérias, como as da espécie Acetobacter xylinum. O polímero microbiano apresenta a mesma estrutura química da celulose proveniente das plantas, porém, é superior em relação às propriedades mecânicas, pureza e uniformidade, permitindo obter dispositivos de maior qualidade. Este tipo de celulose apresenta grande potencial para o tratamento de lesões de pele e substituição de vasos sanguíneos de pequeno diâmetro.117 Blendas e complexos poliméricos A combinação entre dois ou mais polímeros, tanto na forma de complexos, como coacervados de polieletrólitos, quanto de blendas resultantes da mistura física de dois materiais distintos, tem grande importância na área de biomateriais, uma vez que por meio destas abordagens podem ser obtidos dispositivos com propriedades físico-químicas, mecânicas e biológicas melhoradas quando comparados aos polímeros isolados.70,98,118 A quitosana, como já mencionado anteriormente, é um biopolímero que possibilita a obtenção de membranas e filmes adequados para o tratamento de lesões de pele, porém, sua resistência mecânica é baixa, assim como sua capacidade de absorver fluidos corpóreos. Há vários relatos na literatura sobre a combinação de quitosana com outros compostos a fim de melhorar algumas de suas propriedades, tais como: heparina,119 xantana,102,120 colágeno118 e alginato,121-123 dentre outros. Quando misturados em fase aquosa, a quitosana e o alginato combinam-se espontaneamente por forte atração eletrostática, formando um complexo polieletrólito (PEC).124 Esta complexação possibilita a formação de membranas finas, transparentes, com apreciável absorção de fluidos fisiológicos e estabilidade a alterações de pH,121 além de permitir a incorporação de diversos compostos bioativos.125 O alginato auxilia na manutenção de um microambiente úmido na lesão, facilitando a re-epitelização e aliviando a dor do paciente.121 Apesar da melhora na absorção de soluções aquosas, estes dispositivos ainda apresentam baixa tensão na ruptura, o que dificulta sua aplicação, manipulação e estocagem. Neste sentido, Pires e Moraes125 propuseram a adição na mistura de 10% do gel de silicone Silpuran® 2130 A/B, um polímero sintético caracterizado por alta flexibilidade de suas cadeias, em membranas compostas de quitosana-alginato. A incorporação do agente siliconado contribuiu positivamente no aumento da tensão de ruptura e na flexibilidade do material, no entanto, devido à hidrofobicidade do polímero sintético, verificou-se diminuição na absorção de soluções aquosas, com aumento considerável na estabilidade do material em meios fisiológicos. A goma xantana também é uma boa alternativa para combinação com a quitosana, tendo-se em vista que é um polímero aniônico e, da mesma forma que o alginato, forma um PEC por atração eletrostática entre o grupamento amina da quitosana e o carboxílico da xantana. Este complexo é utilizado na imobilização de enzimas e na produção de micropartículas e membranas.126 Bellini et al.102 avaliaram a aplicabilidade de filmes de quitosana-xantana lamelares ou porosas como curativos dérmicos e suportes para a engenharia tecidual. As membranas apresentaram baixa citotoxicidade in vitro, resistência à tensão compatível com a da pele humana, alta capacidade de absorver elevadas quantidades de fluidos fisiológicos e adequada estabilidade.127 Matrizes baseadas somente em colágeno também apresentam baixas propriedades mecânicas. Assim, a escolha de combinar esta proteína com outro polímero, como por exemplo, a PCL é uma estratégia promissora, tendo-se em vista que este polímero sintético exibe elevada resistência mecânica.128 Nota-se, portanto, que misturas poliméricas vêm sendo amplamente pesquisadas a fim de melhorar propriedades que possam limitar a aplicação de um dado biomaterial. Nesta mesma perspectiva, muitos trabalhos vêm sendo realizados com o intuito de obter dispositivos melhorados a partir da combinação de polímeros com metais e cerâmicas, denominados assim de biomateriais híbridos ou compósitos. Compósitos Os compósitos são uma classe de materiais constituídos por uma fase contínua (matriz) e uma fase dispersa (componente de reforço ou modificador) separadas por interfaces, cujas características podem incorporar propriedades combinadas dos constituintes individuais. O material de reforço ou modificador pode ser utilizado na forma de fibras ou partículas e é adicionado com diversos objetivos, como, por exemplo, melhorar propriedades mecânicas, aumentar a taxa de degradação, melhorar a biocompatibilidade e bioatividade ou até mesmo, controlar o perfil de liberação de fármacos ou fatores de crescimento incorporados aos dispositivos.129,130 Os principais fatores que afetam as propriedades dos compósitos são as características dos materiais constituintes, o percentual, distribuição e orientação das fibras ou partículas na matriz e as interações interfaciais.129 A formação dos biomateriais compósitos pode se dar de diversas formas, sendo que as principais associações são do tipo polímero-cerâmica e metal-cerâmica. Em biomateriais poliméricos para implante ósseo, a adição de partículas de biovidro, hidroxiapatita e outros fosfatos de cálcio tem o intuito de aumentar a biocompatibilidade e o módulo elástico da matriz. Com isto, as propriedades mecânicas do compósito tornam-se mais próximas às do osso, contribuindo para a redução do fenômeno stress-shielding.131,132 Scaffolds para engenharia tecidual frequentemente associam biodegradabilidade, propriedades mecânicas e facilidade de processamento de alguns polímeros, como o PLLA, o PLGA e a PCL, com a osteocondutividade e a adsorção de proteínas das cerâmicas de fosfatos de cálcio.133 A adição de maiores quantidades de partículas de cerâmica pode ainda aumentar o grau de reticulação das cadeias de alguns polímeros, contribuindo para o controle da liberação de agentes ativos.132 Ainda em materiais para scaffolds, a combinação de cerâmicas de fosfatos de cálcio com proteínas, como a gelatina e o colágeno, resulta em compostos organoinorgânicos com características físicas, mecânicas e biológicas similares à dos ossos humanos.130 A quitosana pode ser associada aos cimentos de fosfato de cálcio visando melhorar as propriedades de coesão e de injeção in vivo. Ocasionalmente, polímeros naturais são aplicados para reforçar mecanicamente o cimento, resultando em uma microestrutura compacta. Nestes materiais, as propriedades de degradação e porosidade também podem ser alteradas pela adição de microesferas de polímeros que se degradam in vivo, como o PLGA.130 A combinação de vidros bioativos com materiais poliméricos, tais como o álcool polivinílico (PVA), o PMMA, a quitosana ou mesmo o colágeno, pode minimizar problemas como o baixo desempenho mecânico e a limitada usinabilidade destas matrizes.66 Com o intuito de aumentar a resistência à fratura de matrizes de fosfatos de cálcio, biovidros e vitrocerâmicas, fibras e partículas metálicas de titânio ou aço inoxidável, por exemplo, podem ser incorporadas como material de reforço.131 Em implantes metálicos ortopédicos e odontológicos, fosfatos de cálcio, principalmente a hidroxiapatita, têm sido utilizados como recobrimentos visando à obtenção de um microambiente condutivo para a formação e o crescimento ósseo na superfície do implante e, também, a fim de promover sua estabilização.58,134 Diversas técnicas de tratamento superficial têm sido propostas e empregadas comercialmente, como a técnica de plasma spray ou aspersão térmica, sol-gel, deposição eletrolítica e o método biomimético de recobrimento, que consiste em imergir o implante a ser recoberto em uma solução similar ao plasma sanguíneo contendo vidro bioativo para a formação de uma camada de hidroxiapatita carbonatada na superfície.37,58 Embora grande parte das aplicações dos compósitos metálicos esteja fundamentada nas propriedades mecânicas, a prata, por exemplo, tem se evidenciado por seu potencial efeito antimicrobiano, uma vez que pode ser eficiente contra uma grande variedade de bactérias, fungos, protozoários e vírus.135 Este metal é utilizado, principalmente, na forma de micro e nanopartículas incorporadas a materiais poliméricos, visando à prevenção de infecções em lesões de pele.125,136 Em dispositivos como catéteres, a prata pode prevenir a colonização bacteriana durante o uso.137 De forma geral, os compósitos apresentam grande potencial para aplicação como biomateriais e estão em crescente estudo e desenvolvimento, uma vez que possibilitam ajustar o desempenho mecânico e biológico para diversas situações clínicas específicas.
CONCLUSÃO Nas últimas décadas, o setor de biomateriais não só cresceu em número de produtos disponíveis e em desenvolvimento, mas também avançou economicamente de maneira significativa. Seu impacto na melhoria da qualidade da vida humana é inegável e sua contribuição futura deve ser numericamente mais elevada, tendo em vista a tendência bem estabelecida de envelhecimento populacional. Entretanto, apesar da grande disponibilidade atual de biomateriais, os desenvolvimentos nesta área são ainda uma necessidade, visto que boa parte dos dispositivos tecnologicamente mais avançados está restrita ao uso somente por uma pequena parcela da população mundial. Apesar do uso de biomateriais constituídos por metais, cerâmicas, polímeros, híbridos e compósitos já estar bem consolidado nas mais diversas aplicações, o desenvolvimento de biomateriais inovadores, diferentes em termos de composição e de características, como novos scaffolds para aplicação na área de engenharia tecidual e culturas de células tronco e dispositivos customizados, adaptáveis ou apropriados para o caso de indivíduos em crescimento, assim como de novas tecnologias para sua produção e caracterização, têm ainda papel de grande relevância na área e demandarão muitos esforços e investimentos.
AGRADECIMENTOS As autoras agradecem à Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) e à Rede Iberoamericana de Novos Materiais para o Projeto de Sistemas Avançados de Liberação de Fármacos para Enfermidades de Alto Impacto Socioeconômico (Rimadel) suportada pelo Programa Ibero-Americano de Ciência e Tecnologia para o Desenvolvimento (CYTED).
REFERÊNCIAS 1. http://www.redetec.org.br/publique/media/tr10_biomateriais.pdf, acessada em 23/11/2014. 2. Ratner, B. D. Em Biomaterials Science - An Introduction to Materials in Medicine; Ratner, B. D.; Hoffman, A. S.; Schoen, F. J.; Lemons, J. E., eds; Elsevier: Oxford, 2013, cap. History of Biomaterials. 3. Ratner, B. D.; Hoffman, A. S.; Schoen, F. J.; Lemons, J.E. Em Biomaterials Science - An Introduction to Materials in Medicine; Ratner, B. D.; Hoffman, A. S.; Schoen, F. J.; Lemons, J. E., eds; Elsevier: Oxford, 2013, cap. Biomaterials Science: An Evolving, Multidisciplinary Endeavor. 4. Holzapfel, B. M.; Reichert, J. C.; Schantz, J.-T.; Gbureck, U.; Rackwitz, L.; Nöth, U.; Jakob, F.; Rudert, M.; Groll, J.; Hutmacher, D. W.; Adv. Drug Deliv. Rev. 2013, 65, 581. DOI: http://dx.doi.org/10.1016/j.addr.2012.07.009 PMID: 22820527 5. Hubbell, J. A.; Cur. Opin. Biotechnol. 1999, 10, 123. DOI: http://dx.doi.org/10.1016/S0958-1669(99)80021-4 6. http://www.marketsandmarkets.com/Market-Reports/biomaterials-393.html, acessada em 23/11/2014. 7. http://www.biomatin.eu/pdf/Regional_analysis_of_the_biomaterial_market.pdf, acessada em 23/11/2014. 8. http://www.marketsandmarkets.com/Market-Reports/orthopedic-device-280.html, acessada em 23/11/2014. 9. http://www.researchandmarkets.com/research/733ct5/biomaterials, acessada em 23/11/2014. 10. http://www.marketsandmarkets.com/PressReleases/global-biomaterials.asp, acessada em 24/11/2014. 11. http://www.marketsandmarkets.com/Market-Reports/biomaterial-392.html, acessada em 23/11/2014. 12. http://www.brasil.gov.br/saude/2012/09/cinco-estados-recebem-mutirao-de-cirurgia-ortopedica, acessada em 24/11/2014. 13. http://www.hcup-us.ahrq.gov/reports/projections/2012-03.pdf, acessada em 24/11/2014. 14. http://www.un.org/en/development/desa/population/publications/pdf/ageing/WorldPopulationAgeing2013.pdf, acessada em 23/11/2014. 15. Meng, X.; Leslie, P.; Zhang, Y.; Dong, J.; SpringerPlus 2014, 3, 80. DOI: http://dx.doi.org/10.1186/2193-1801-3-80 PMID: 24570851 16. http://www.marketsandmarkets.com/Market-Reports/stem-cell-technologies-and-global-market-48.html, acessada em 23/11/2014. 17. http://nsfbiomatworkshop2012.caltech.edu/report/NSF%20BIOMATERIALS%20REPORT%20FINAL%20(3).pdf, acesso em 23/11/2014. 18. Sumita, M.; Hanawa, T.; Teoh, S. H.; Mat. Sci. Eng. 2004, 24, 753. DOI: http://dx.doi.org/10.1016/j.msec.2004.08.030 19. Poinern, G. E. J.; Brundavanam, S.; Fawcett, D.; Am. J. Biomed. Eng. 2012, 2, 218. DOI: http://dx.doi.org/10.5923/j.ajbe.20120206.02 20. Hanawa, T.; J. Artif. Organs 2009, 12, 73. DOI: http://dx.doi.org/10.1007/s10047-008-0456-x PMID: 19536623 21. Davis, J. R.; Handbook of Materials for Medical Devices, 1st ed.; ASM International, 2003. 22. Dee, K. C.; Puleo, D. A.; Bizios, R.; An introduction to tissue-biomaterial interactions. John Wiley & Sons: New Jersey, 2002. 23. Park, J. B.; Kim, Y. K. Em Biomaterials: Principles and Applications; Park, J. B.; Bronzino, J. D., eds.; CRC Press: Boca Raton, 2002, cap. 1. 24. Smith, W. F.; Hashemi, J.; Fundamentos de Engenharia e Ciência dos Materiais, 5ª ed., McGrawHill: Porto Alegre, 2012. 25. Manivasagam, G.; Dhinasekaran, D.; Rajamanickam, A.; Recent Pat. Corros. Sci. 2010, 2, 40. DOI: http://dx.doi.org/10.2174/1877610801002010040 26. Hanawa, T.; Mater. Sci. Eng. C 2004, 24, 745. DOI: http://dx.doi.org/10.1016/j.msec.2004.08.018 27. Okazaki, Y.; Gotoh, E.; Biomaterials 2005, 26, 11. DOI: http://dx.doi.org/10.1016/j.biomaterials.2004.02.005 PMID: 15193877 28. Hallab, N.; Merritt, K.; Jacobs, J. J.; J. Bone Joint. Surg. Am. 2001, 83, 428. DOI: http://dx.doi.org/10.1302/0301-620X.83B3.9674 PMID: 11263649 29. Staiger, M. P.; Pietak, A. M.; Huadmai, J.; Dias, G.; Biomaterials 2006, 27, 1728. DOI: http://dx.doi.org/10.1016/j.biomaterials.2005.10.003 PMID: 16246414 30. Heublen, B.; Rohde, R.; Kaese, V.; Niemeyer, M.; Hartung, W.; Haverich, A.; Heart 2003, 89, 651. DOI: http://dx.doi.org/10.1136/heart.89.6.651 31. Cha, P-R.; Han, H-S.; Yang, G-F.; Kim, Y-C.; Hong, K-H.; Lee, S-C.; Jung, J-Y.; Ahn, J-P.; Kim, Y-Y.; Cho, S-Y.; Cho, S-Y.; Byun, J. Y.; Lee, K-S.; Yang, S-J.; Seok, H-K.; Sci. Rep. 2013, 3, 2367, DOI: 10.1038/srep02367. DOI: http://dx.doi.org/10.1038/srep02367 PMID: 23917705 32. Levine, B. R.; Sporer, S.; Poggie, R. A.; Della Valle, C. J.; Jacobs, J. J.; Biomaterials 2006, 27, 4671. DOI: http://dx.doi.org/10.1016/j.biomaterials.2006.04.041 PMID: 16737737 33. Brockett, C. L.; Harper, P.; Williams, S.; Isaac, G. H.; Dwyer-Joyce, R. S.; Jin, Z.; Fisher, J.; J. Mater. Sci. Mater. Med. 2008, 19, 1575. DOI: http://dx.doi.org/10.1007/s10856-007-3298-9 PMID: 17990078 34. Disegi, J. A.; Eschbach, L.; Injury 2000, 31, D2. DOI: http://dx.doi.org/10.1016/S0020-1383(99)00256-9 35. Talha, M.; Behera, C. K.; Sinha, O. P.; Mater. Sci. Eng., C 2013, 33, 3563. DOI: http://dx.doi.org/10.1016/j.msec.2013.06.002 36. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Chromium, Nickel and Welding, vol. 49IARC, Lyon (1990). 37. Liu, X.; Chu, P. K.; Ding, C.; Mater. Sci. Eng. R 2004, 47, 49. DOI: http://dx.doi.org/10.1016/j.mser.2004.11.001 38. Hanawa, T.; J. Artif. Organs 2009, 12, 73 DOI: http://dx.doi.org/10.1007/s10047-008-0456-x PMID: 19536623 39. Marti, A.; Injury, 2000, 31, D18. DOI: http://dx.doi.org/10.1016/S0020-1383(00)80018-2 40. Paital, S. R.; Dahotre, N. B.; Mater. Sci. Eng. R 2009, 66, 1. DOI: http://dx.doi.org/10.1016/j.mser.2009.05.001 41. Kawachi, E. Y.; Bertran, C. A.; Reis, R. R.; Alves, O. L. Quim. Nova 2000, 23, 518. DOI: http://dx.doi.org/10.1590/S0100-40422000000400015 42. Hench, L. L.; Best, S. M.; Em Biomaterials Science: An introduction to Materials in Medicine. Ratner, B. D.; Hoffman, A. S.; Schoen, F. J.; Lemons, J. E., eds.; Academic Press: Oxford, 2013, cap. I.2.4. Ceramics, Glasses, and Glass-Ceramics: Basic Principles 43. Pezzoti, G.; Yamamoto, K.; J. Mech. Behav. Biomed. Mater. 2014, 31, 3. DOI: http://dx.doi.org/10.1016/j.jmbbm.2013.06.001 44. Haubenreich, J. E.; Robinson, F. G.; West, K. P.; Frazer, R. Q.; J. Long-Term Eff. Med. Implants 2005, 15, 617. DOI: http://dx.doi.org/10.1615/JLongTermEffMedImplants.v15.i6.50 PMID: 16393130 45. Pimentel, R. F.; Oliveira, R. S. M. F.; Chaves, M. G. A. M.; Elias, C. N.; Gravina, M. A.; Dental Press Journal of Orthodontics 2013, 18, 121. DOI: http://dx.doi.org/10.1590/S2176-94512013000500020 PMID: 23876959 46. Afzal, A.; Mater. Express 2014, 4, 1. DOI: http://dx.doi.org/10.1166/mex.2014.1148 47. Yoshimura, H. N.; Molisani, A. L.; Narita, N. E.; Gonçalves, M. P.; Campos, M. F.; Cerâmica 2007, 53, 116. DOI: http://dx.doi.org/10.1590/S0366-69132007000200003 48. Piconi, C.; Maccauro, G.; Biomaterials 1999, 20, 1. DOI: http://dx.doi.org/10.1016/S0142-9612(98)00010-6 PMID: 9916767 49. Thamaraiselvi, T. V.; Rajeswari, S.; Trends Biomater. Artif. Organs 2004, 18, 9. 50. Dorozhkin, S. V.; Biomaterials 2010, 21, 1465. DOI: http://dx.doi.org/10.1016/j.biomaterials.2009.11.050 51. Paul, W.; Sharma, C. P.; Trends Biomater. Artif. Organs 2001, 14, 37. 52. Sahdev, P.; Podaralla, S.; Kaushik, R. S.; Perumal, O.; J. Biomed. Nanotechnol. 2013, 9, 132. DOI: http://dx.doi.org/10.1166/jbn.2013.1545 PMID: 23627076 53. Kim, H-W.; Knowles, J. C.; Kim, H-E.; J. Mater. Sci. Mater. Med. 2005, 16, 189. DOI: http://dx.doi.org/10.1007/s10856-005-6679-y PMID: 15744609 54. Lacerda, K. A.; Lameiras, F. S.; Silva, V. V.; Quim. Nova 2009, 32, 1216. DOI: http://dx.doi.org/10.1590/S0100-40422009000500025 55. Netz, D. J. A.; Sepulveda, P.; Pandolfelli, V. C.; Spadaro, A. C. C.; Alencastre, J. B.; Bentley, M. V. L. B.; Marchetti, J. M.; Int. J. Pharm. 2001, 213, 117. DOI: http://dx.doi.org/10.1016/S0378-5173(00)00659-1 PMID: 11165099 56. Barroug, A.; Kuhn, L. T.; Gerstenfeld, L. C.; Glimcher, M. J.; J. Orthop. Res. 2004, 22, 703. DOI: http://dx.doi.org/10.1016/j.orthres.2003.10.016 PMID: 15183424 57. Best, S. M.; Porter, A. E.; Huang, J.; J. Eur. Ceram. Soc. 2008, 28, 1319 DOI: http://dx.doi.org/10.1016/j.jeurceramsoc.2007.12.001 58. Guastaldi, A. C.; Aparecida, A. H.; Quim. Nova 2010, 33, 1352. DOI: http://dx.doi.org/10.1590/S0100-40422010000600025 59. Aparecida, A. H.; Fook, M. V. L.; Santos, M. L.; Guastaldi, A. C.; Quim. Nova 2007, 30, 892. DOI: http://dx.doi.org/10.1590/S0100-40422007000400024 60. Hoppe, A.; Güdal, N. S.; Boccaccini, A. R.; Biomaterials 2011, 32, 2757. DOI: http://dx.doi.org/10.1016/j.biomaterials.2011.01.004 PMID: 21292319 61. Bohner, M.; Injury 2000, 31, D37. DOI: http://dx.doi.org/10.1016/S0020-1383(00)80042-X 62. Ginebra, M. P.; Traykova, T.; Planell, J. A.; J. Controlled Release 2006, 28, 102. DOI: http://dx.doi.org/10.1016/j.jconrel.2006.04.007 63. Ambard, A. J.; J. Prosthodont. 2006, 15, 321. DOI: http://dx.doi.org/10.1111/j.1532-849X.2006.00129.x PMID: 16958734 64. Zhang, J.; Liu, W.; Schnitzler, V.; Tancret, F.; Bouler, J-M.; Acta Biomater. 2014, 10, 1035. DOI: http://dx.doi.org/10.1016/j.actbio.2013.11.001 PMID: 24231047 65. Jones, J. R.; Acta Biomater. 2013, 9, 4457. DOI: http://dx.doi.org/10.1016/j.actbio.2012.08.023 PMID: 22922331 66. Siqueira, R. L.; Zanotto, E. D.; Quim. Nova 2011, 34, 1231. DOI: http://dx.doi.org/10.1590/S0100-40422011000700023 67. Hench, L.L.; Roki, N.; Fenn, M. B .; J. Mol. Struct. 2014, 1073, 24. DOI: http://dx.doi.org/10.1016/j.molstruc.2014.03.066 68. Hench, L. L.; J. Am. Ceram. Soc. 1991, 74, 1487. DOI: http://dx.doi.org/10.1111/j.1151-2916.1991.tb07132.x 69. Mundstock, K. B.; Oliveira, A. P. N.; Hotza, D.; Rogero, S. O.; Quim. Nova 2010, 33, 598. DOI: http://dx.doi.org/10.1590/S0100-40422010000300021 70. Heath, D. E.; Cooper, S. L.; Em Biomaterials Science: An Introduction to Materials in Medicine. Ratner, B. D.; Hoffman, A. S.; Schoen, F. J.; Lemons, J. E., eds.; Academic Press: Oxford, 2013, cap. I.2.2. Polymers: Basic Principles 71. Wong, J. Y.; Bronzino, J. D.; Biomaterials, Taylor & Francis Group: New York, 2007. 72. Park, J.; Lakes, R. S.; Biomaterials: An Introduction, 3th ed., Springer: New York, 2007. 73. Chanda, M.; Introduction to Polymer Science and Chemistry: A Problem-Solving Approach, 2th ed., Taylor & Francis Group: United States of America, 2013. 74. Takehisa, H.; Naoko, E.; Masahiko, S.; Katsuhide, T.; Moriyuki, O.; Keizoh, S.; Mutsuko, T.; Kenji, K.; Shin'ichiro, N.; Toshio, O.; Int. J. Pharm. 2005, 297, 30. DOI: http://dx.doi.org/10.1016/j.ijpharm.2005.02.015 PMID: 15907594 75. Maia, M.; Klein, E. S.; Monje, T. V.; Pagliosa, C.; Rev. Bras. Cir. Plást. 2010, 25, 566. DOI: http://dx.doi.org/10.1590/S1983-51752010000300029 76. Nogueira, N.; Conde, O.; Miñones, M.; Trillo, J. M.; Miñones Jr., J.; J. Colloid Interface Sci. 2012, 385, 202. DOI: http://dx.doi.org/10.1016/j.jcis.2012.06.015 PMID: 22841707 77. Angelova, N.; Hunkeler, D.; Trends Biotechnol. 1999, 17, 409. DOI: http://dx.doi.org/10.1016/S0167-7799(99)01356-6 PMID: 10481173 78. Chiellini, F.; Ferri, M.; Morelli, A.; Dipaola, L.; Latini, G.; Prog. Polym. Sci. 2013, 38, 1067. DOI: http://dx.doi.org/10.1016/j.progpolymsci.2013.03.001 79. Thomé, I. P. S.; Dagostin, V. S.; Piletti, R.; Pich, C. T.; Riella, H. G.; Angioletto, E.; Fiori, M. A.; Mater. Sci. Eng., C 2012, 32, 263. DOI: http://dx.doi.org/10.1016/j.msec.2011.10.027 80. Gupta, B.; Anjum, N.; Gulrez, S. K. H.; Singh, H.; J. Appl. Polym. Sci. 2007, 103, 3534. DOI: http://dx.doi.org/10.1002/app.24360 81. Halm, J. A.; Wall, L. L.; Steyerberg, E. W.; Jeekel, J.; Lange, J. F.; World J. Surg. 2007, 31, 423. DOI: http://dx.doi.org/10.1007/s00268-006-0317-9 PMID: 17180562 82. Jacchetti, E.; Tonazzini, I.; Meucci, S.; Beltram, F.; Cecchini, M.; Microelectron. Eng. 2014, 124, 26. DOI: http://dx.doi.org/10.1016/j.mee.2014.04.014 83. Lokendrakumar, C. B.; Chauhan, A.; Biomaterials 2013, 34, 2814. DOI: http://dx.doi.org/10.1016/j.biomaterials.2012.12.027 84. Nair, L. S.; Laurencin, C. T.; Prog. Polym. Sci. 2007, 32, 762. DOI: http://dx.doi.org/10.1016/j.progpolymsci.2007.05.017 85. Tian, H.; Tang, Z.; Zhuang, X.; Chen, X,; Jing, X.; Prog. Polym. Sci. 2012, 37, 237. DOI: http://dx.doi.org/10.1016/j.progpolymsci.2011.06.004 86. Singh, N.; Bridges, A. W.; Garcia, A. J.; Lyon, L. A.; Biomacromolecules 2007, 8, 3271. DOI: http://dx.doi.org/10.1021/bm700516v PMID: 17877399 87. Kim, S. B.; Kim, Y. J.; Yoon, T. L.; Park, S. A.; Cho, I. H.; Kim, E. J.; Kim, I. A.; Shin, J. W.; Biomaterials 2004, 25, 5715. DOI: http://dx.doi.org/10.1016/j.biomaterials.2004.01.022 PMID: 15147817 88. Lu, J. X.; Huang, Z. W.; Tropiano, P.; D'Orval, B. C.; Remusat, M.; Dejou, J.; Proust, J. P.; Poitout, D.; J. Mater. Sci.: Mater. Med. 2002, 13, 803. PMID: 15348569 89. Goto, K.; Tamura, J.; Shinzato, S.; Fujibayashi, S.; Hashimoto, M.; Kawashita, M.; Kokubo, T.; Nakamura, T.; Biomaterials 2005, 26, 6496. DOI: http://dx.doi.org/10.1016/j.biomaterials.2005.04.044 PMID: 15941580 90. Homlar, K. C.; Sellers, M. H.; Halpern, J. L.; Seeley, E. H.; Holt, G. E.; J. Arthroplasty 2013, 28, 406. DOI: http://dx.doi.org/10.1016/j.arth.2012.06.038 PMID: 23245392 91. Aparecida, A. H.; Guastaldi, A.; Fook, M. V. L.; Revista Polímeros 2008, 18, 277. DOI: http://dx.doi.org/10.1590/S0104-14282008000400004 92. Rezwan, K.; Chen, Q. Z.; Blaker, J. J.; Boccaccini, A. R.; Biomaterials 2006, 27, 3413. DOI: http://dx.doi.org/10.1016/j.biomaterials.2006.01.039 PMID: 16504284 93. Bueno, C. Z.; Dias, A. M. A.; Sousa, H. J. C.; Braga, M. E. M.; Moraes, A. M.; Mater. Sci. Eng., C 2014, 44, 117. DOI: http://dx.doi.org/10.1016/j.msec.2014.08.014 94. Kuo Y. C.; Lin, C. Y.; Biotechnol. Bioeng. 2006, 95, 132. DOI: http://dx.doi.org/10.1002/bit.21007 95. Ikada, Y.; J. R. Soc. Interface 2006, 3, 589. DOI: http://dx.doi.org/10.1098/rsif.2006.0124 PMID: 16971328 96. Gunatillake, P. A.; Adhikari, R.; Eur. Cells. Mater. 2003, 5, 1. 97. Woodruff, M. A.; Hutmacher, D. W.; Prog. Polym. Sci. 2010, 35, 1217. DOI: http://dx.doi.org/10.1016/j.progpolymsci.2010.04.002 98. Sionkowska, A.; Prog. Polym. Sci. 2011, 36, 1254. DOI: http://dx.doi.org/10.1016/j.progpolymsci.2011.05.003 99. Sell, A. S.; Wolfe, P. S.; Garg. K.; McCool, J. M.; Rodriguez, I. A.; Bowlin, G. L.; Polymers 2010, 2, 522. DOI: http://dx.doi.org/10.3390/polym2040522 100. Mogosanu, G. D.; Grumezescu, A. M.; Int. J. Pharm. 2014, 463, 127. DOI: http://dx.doi.org/10.1016/j.ijpharm.2013.12.015 PMID: 24368109 101. Rinaudo, M.; Polym. Int. 2008, 57, 397. DOI: http://dx.doi.org/10.1002/pi.2378 102. Bellini, M. Z.; Pires, A. L. R.; Vasconcelos, M. O.; Moraes, A. M.; J. Appl. Polym. Sci. 2012, 125, E421 103. Cheung, H. Y.; Lau, K. T.; Lu, T. P.; Hui, D.; Composites, Part B 2007, 38, 291. DOI: http://dx.doi.org/10.1016/j.compositesb.2006.06.014 104. Gomes, M.; Azevedo, H.; Malafaya, P.; Silva, S.; Oliveira, J.; Silva, G.; Mano, R. S. J.; Reis, R. Em Natural Polymers in Tissue Engineering Applications; Ebnesajjad, S., eds.; Elsevier: Kidlington, 2013, cap. 16. 105. Lacerda, C.; Plepis, A. M. G.; Goissis, G.; Quim. Nova 1998, 21, 267. DOI: http://dx.doi.org/10.1590/S0100-40421998000300006 106. Nogueira, G. M.; Rodas, A. C. D.; Leite, C. A. P.; Giles, C.; Higa, O. Z.; Polakiewicz, B.; Beppu, M. M.; Bioresour. Technol. 2010, 101, 8446. DOI: http://dx.doi.org/10.1016/j.biortech.2010.06.064 PMID: 20598877 107. Kundu, S.; Silk Biomaterials for Tissue Engineering and Regenerative Medicine, 1st ed., Elsevier: Kidlington, 2014. 108. Vepari, C.; Kaplan, D. L.; Prog. Polym. Sci. 2007, 32, 991. DOI: http://dx.doi.org/10.1016/j.progpolymsci.2007.05.013 PMID: 19543442 109. Prestwich, G. D.; J. Controlled Release 2011, 155, 193. DOI: http://dx.doi.org/10.1016/j.jconrel.2011.04.007 110. Salles, A. G.; Remigio, A. F. N.; Zacchi, V. B. L.; Saito, O. C.; Ferreira, M. C.; Rev. Bras. Cir. Plást. 2011, 26, 66. DOI: http://dx.doi.org/10.1590/S1983-51752011000100026 111. Avila, A.; Bierbrauer, K.; Pucci, G.; López-González, M.; Strumia, M.; J. Food Eng. 2012, 109, 752. DOI: http://dx.doi.org/10.1016/j.jfoodeng.2011.11.009 112. Khor, E.; Lim, L. Y.; Biomaterials 2003, 24, 2339. DOI: http://dx.doi.org/10.1016/S0142-9612(03)00026-7 PMID: 12699672 113. Chen, J. P.; Kuo, C. Y.; Lee. Wee. L.; Appl. Surf. Sci. 2012, 262, 95. DOI: http://dx.doi.org/10.1016/j.apsusc.2012.02.106 114. Dallan, P. R. M.; Moreira, P. L.; Petinari, L.; Malmonge, S. M.; Beppu, M. M.; Genari, S. C.; Moraes, A. M.; J. Biomed. Mater. Res., Part B 2007, 80, 394. DOI: http://dx.doi.org/10.1002/jbm.b.30610 115. Sacchetin, P. S. C.; Moraes, A. M.; Leal, C. A. G.; Figueiredo, H. C. P.; Quim. Nova 2010, 33, 263. DOI: http://dx.doi.org/10.1590/S0100-40422010000200006 116. Entcheva, E.; Bien, H.; Yin, L.; Chung, C-Y.; Farrel, M.; Kostov, Y.; Biomaterials 2004, 25, 5753. DOI: http://dx.doi.org/10.1016/j.biomaterials.2004.01.024 PMID: 15147821 117. Czaja, W.; Krystynowics, A.; Bielecki, S.; Brown Jr., R. M.; Biomaterials 2006, 27, 145. DOI: http://dx.doi.org/10.1016/j.biomaterials.2005.07.035 PMID: 16099034 118. Tonhi, E.; Plepis, A. M. G.; Quim. Nova 2002, 25, 943. DOI: http://dx.doi.org/10.1590/S0100-40422002000600011 119. He, Q.; Ao, Q.; Wang, A.; Gong, Y.; Zhao, N.; Zhang, X.; Tsinghua Sci. Technol. 2007, 12, 361. DOI: http://dx.doi.org/10.1016/S1007-0214(07)70054-8 120. Veiga, I. G.; Moraes, A. M.; J. Appl. Polym. Sci. 2012, 124, E154. DOI: http://dx.doi.org/10.1002/app.35526 121. Rodrigues, A. P.; Sanchez, E. M. S.; Costa, A. C.; Moraes, A. M.; J. Appl. Polym. Sci. 2008, 109, 2703. DOI: http://dx.doi.org/10.1002/app.28203 122. Bueno, C. Z.; Moraes, A. M.; J. Appl. Polym. Sci. 2011, 122, 624. DOI: http://dx.doi.org/10.1002/app.34192 123. Meng, X.; Tian, F.; Yang, J.; He, C. N.; Xing. N.; Li, F.; J. Mater. Sci.: Mater. Med. 2010, 21, 1751. PMID: 20101440 124. Verma, D.; Desai, M. S.; Kulkarni, N.; Langrana, N.; Mater. Sci. Eng., C 2011, 31, 1741. DOI: http://dx.doi.org/10.1016/j.msec.2011.08.005 125. Pires, A. L. R.; Moraes, A. M.; J. Appl. Polym. Sci. 2015, 132, 41686. 126. Bejenariu, A.; Popa, M.; Cerf, D. L.; Picton, L.; Polym. Bull. 2008, 61, 631. DOI: http://dx.doi.org/10.1007/s00289-008-0987-6 127. Bellini, M. Z.; Caliari-Oliveira, C.; Mizukami, A.; Swiech, K.; Covas, D. T.; Donadi, E. A.; Oliva-Neto, P.; Moraes, A. M.; J. Biomat. Appl. 2015, 29, 1155. DOI: http://dx.doi.org/10.1177/0885328214553959 128. Niu, G.; Criswell, T.; Sapoznik, E.; Lee. S. J.; Soker, S.; J. Sci. Appl.: Biomed. 2013, 1, 1. 129. Wang, M.; Biomaterials 2003, 24, 2133. DOI: http://dx.doi.org/10.1016/S0142-9612(03)00037-1 PMID: 12699650 130. Habraken, W. J. E. M.; Wolke, J. G. C.; Jansen, J. A.; Adv. Drug Delivery Rev. 2007, 59, 234. DOI: http://dx.doi.org/10.1016/j.addr.2007.03.011 131. Cao, W.; Hench, L. L.; Ceram. Int. 1996, 22, 493. DOI: http://dx.doi.org/10.1016/0272-8842(95)00126-3 132. Katti, K. S.; Colloids Surf., B 2004, 39, 133. DOI: http://dx.doi.org/10.1016/j.colsurfb.2003.12.002 133. Wie, G.; Ma, P. X.; Biomaterials 2004, 25, 4749. DOI: http://dx.doi.org/10.1016/j.biomaterials.2003.12.005 134. Almeida-Filho, E.; Assis, C. M.; Vercik, L. O.; Guastaldi, A. C.; Quim. Nova 2007, 30, 1129. DOI: http://dx.doi.org/10.1590/S0100-40422007000500034 135. Monteiro, D. G.; Gorup, L. F.; Takamiya, A. S.; Ruvollo-Filho, A. C.; Camargo, E. R.; Barbosa, D. B.; Int. J. Antimicrob. Agents 2009, 34, 103. DOI: http://dx.doi.org/10.1016/S0924-8579(09)70461-3 PMID: 19339161 136. Maneerung, T.; Tokura, S.; Rujiravanit, R.; Carbohyd. Polym. 2008, 73, 43. DOI: http://dx.doi.org/10.1016/j.carbpol.2007.07.025 137. Stevens, K. N. J.; Crespo-Biel, O.; van den Bosch, E. E. M.; Dias, A. A.; Knetsch, M. L. W.; Aldenhoff, Y. B. J.; van der Veen, F. H.; Maessen, J. G.; Stobberingh, E. E.; Koole, L. H.; Biomaterials 2009, 30, 3682. DOI: http://dx.doi.org/10.1016/j.biomaterials.2009.03.054 PMID: 19394689 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access