Revisão
|
|
| Vidros de oxicarbeto de silício obtidos a partir de polissiloxanos Silicon oxycarbide glasses from polysiloxane |
|
Marco A. SchiavonI,*; Jefferson L. FerrariI; Mirabbos HojamberdievII; Inez Valéria P. YoshidaIII
IDepartamento de Ciências Naturais, Universidade Federal de São João del-Rei, Campus Dom Bosco, Praça Dom Helvécio, 74, 36301-160 São João del-Rei - MG, Brasil Recebido em 23/03/2015 *e-mail: schiavon@ufsj.edu.br Silicon oxycarbide glasses (SiOC) are a class of amorphous materials with a similar silica glass structure, in which oxygen atoms are partially replaced by tetracoordenated carbon atoms. The presence of carbon atoms covalently bound to the silicon atoms creates a more interconnected structure with better strength, and excellent chemical stability than conventional silica. SiOCs are easily prepared by the pyrolysis of polysiloxanes and can potentially be implemented in several technological applications that require high temperatures. This paper mainly addresses the preparation, structure, and properties of SiOC. Furthermore, potential applications of SiOC are also introduced. INTRODUÇÃO A química tem dado uma importante contribuição à pesquisa, desenvolvimento e manufatura de materiais cerâmicos, tanto por meio da síntese de novas cerâmicas, quanto do ponto de vista do desenvolvimento de novas rotas de processamento destes materiais.1 Enquanto o método convencional de preparação de cerâmicas envolve reações no estado sólido entre pós reagentes, métodos químicos alternativos têm sido propostos para a síntese de cerâmicas, como: a deposição química de vapor, o processo sol-gel e a pirólise de polímeros. Particularmente este último têm despertado grande interesse, pois têm o potencial de produzir cerâmicas com propriedades desejadas e com desempenho superior ao obtido pelo método convencional.1,2 Outras vantagens adicionais deste método são: a produção de cerâmicas de alta pureza, a possibilidade de obtenção do material final em diferentes formas como filmes, fibras, monolitos ou mesmo pós com tamanhos de partículas controlados,2 e a possibilidade de manipular a composição e as propriedades do produto em função do precursor utilizado.3 O conceito de pirólise de precursores poliméricos para a preparação de cerâmicas covalentes foi inicialmente proposto por Chantrell e Popper4 na década de 60. No entanto, somente em 1975 é que o potencial deste método foi reconhecido por Yajima e colaboradores,5-7 na preparação de fibras cerâmicas de carbeto de silício não-cristalino, obtidas por meio da pirólise de precursores poliméricos, no caso, polissilanos. Desde então, iniciou-se uma intensa pesquisa nesta área, gerando patentes e produtos comercializáves.8 Um outro aspecto relacionado às propriedades dos materiais finais é a possibilidade de obtenção de materiais não-cristalinos e cristalinos. De modo geral, a manufatura de materiais cerâmicos a partir de polímeros precursores envolve os seguintes passos: síntese do polímero a partir de monômeros ou oligômeros; cura (geralmente entre 150 e 250 ºC), capaz de gerar polímeros altamente reticulados; pirólise sob atmosfera inerte ou reativa (entre 500 e 1600 ºC), envolvendo a transição orgânica/inorgânica entre 400 e 800 ºC; e a etapa de cristalização entre 1300 e 1600 ºC.9 A Figura 1 ilustra as principais transições moleculares e microestruturais envolvidas durante a manufatura de vidros de oxicarbeto de silício, a partir de precursores poliméricos de polissiloxanos.
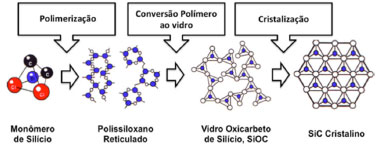 Figura 1. Esquema das transiçoes moleculares e microestruturais que ocorrem durante a preparaçao de vidros de oxicarbeto de silício, a partir de precursores poliméricos de polissiloxanos
Enquanto cerâmicas não-óxidas como SiC, Si3N4, ou mesmo aquelas de sistemas multi componentes baseados em Si-B-C-N, têm sido obtidas com sucesso a partir da pirólise de polímeros pré-cerâmicos adequados como polissilanos, policarbossilanos, polissilazanos e poliborossilazanos,10,11 sistemas óxidos baseados em Si-O-C têm sido basicamente produzidos por meio da pirólise de polissiloxanos.12 Neste contexto, as siliconas, que são polímeros formados de cadeias de átomos contendo sucessivas ligações Si-O em toda sua extensão, constituem-se num dos mais importantes precursores de cerâmicas covalentes como os vidros de oxicarbeto de silício.13,14 Oxicarbeto de silício é o termo usado para denotar uma estrutura química constituída de um arranjo aleatório de sítios de Si tetra-coordenados a átomos de oxigênio e a carbono, sem haver, entretanto, ligações entre átomos de oxigênio e carbono.12-16 A rota mais promissora de preparação de oxicarbeto de silício envolve a pirólise, em atmosfera inerte, de géis ou polímeros de siliconas. Em nosso laboratório tem sido estudado sistematicamente a obtenção de materiais cerâmicos a partir da pirólise de polímeros de silício, com especial atenção aos vidros de oxicarbeto de silício, como produtos da pirólise de siliconas.17-25 Assim, este trabalho analisa o estado da arte desta área, apresentando os principais aspectos relacionados à obtenção, caracterização estrutural, composição, propriedades e potenciais aplicações tecnológicas destes vidros, tanto na química quanto na engenharia de materiais, como também apresenta os resultados obtidos em estudos recentes relacionados à aplicação destes vidros derivados de polissiloxanos.
VIDROS DE OXICARBETO DE SILÍCIO Vidros de oxicarbeto de silício se constituem numa classe de materiais amorfos, no sistema Si-O-C, com estrutura similar à da sílica, na qual parte dos átomos de oxigênio bicoordenados são substituídos por átomos de carbono tetracoordenados. Estes vidros podem ser vistos como um sistema híbrido entre uma cerâmica não-óxida (SiC) e uma óxida (SiO2), tanto da perspectiva estrutural quanto em termos de suas propriedades.26,27 A substituição parcial de oxigênio por carbono na estrutura da sílica leva a uma maior interconexão, com uma maior densidade de ligações, resultando em melhores propriedades físicas e químicas para o vidro. Estudos desenvolvidos por Loehman28 em vidros de oxinitreto de silício confirmaram o aumento de densidade na substituição parcial de átomos de oxigênio por nitrogênio tricoordenado. Estes vidros apresentaram valores de dureza, módulo elástico, tenacidade à fratura e temperatura de transição vítrea maiores que àqueles à base de sílica. Além disso, quanto maior a quantidade de átomos de nitrogênio no retículo, maiores valores foram encontrados para as características citadas. Deste modo, pode-se esperar que a substituição de átomos de oxigênio por carbono acentue estes efeitos, graças ao maior grau de reticulação. No entanto, a introdução de átomos de carbono na estrutura de vidros, pela rota convencional que envolve o resfriamento rápido de fundidos, é difícil, porque na temperatura em que o processo é realizado o carbono é oxidado a CO e CO2, e não pode ser controlada a composição final do material.16 Este problema, entretanto, pode ser superado com a pirólise de precursores que contenham ligações Si-C e Si-O em sua estrutura molecular. A classe de materiais que apresentam estas características estruturais é a de poli(organossiloxanos), ou siliconas, que podem ser obtidos na forma de géis pelo processo sol-gel, ou na forma elastomérica, pela reticulação de precursores moleculares. Para se preparar vidros de oxicarbeto de silício por esta nova rota, é necessário que a pirólise dos precursores seja conduzida a uma temperatura na qual ocorra a mineralização do material, deixando apenas átomos de silício ligados de um a quatro átomos de carbono.29,30 A presença de atmosfera inerte e temperaturas próximas de 1000 ºC são suficientes para a preparação destes vidros, os quais são amorfos, de cor preta e brilhantes. No entanto, a principal característica de um vidro de oxicarbeto de silício, genericamente abreviado por SiOC, é a presença de sítios estruturais do tipo SiO4, CSiO3, C2SiO2 C3SiO e C4Si, distribuídos no material. Sua estequiometria pode ser expressa pela fórmula: SiCxO2(1-x) ou pela soma: xSiC + (1-x)SiO2, em que 0 < x < 1.27 Inúmeros materiais com diferentes propriedades e aplicações podem ser obtidos, variando o grau e a natureza dos grupos orgânicos diretamente ligados aos átomos de silício do polissiloxano precursor. Também é possível variar a temperatura e a atmosfera empregada durante a pirólise para a obtenção de materiais com composições distintas. Neste contexto, o termo oxicarbeto de silício pode englobar uma grande classe de materiais. Há, entretanto, uma certa dificuldade em se caracterizar estes materiais rigorosamente como vidros, pois apesar de serem amorfos, toda tentativa de se medir a temperatura de transição vítrea (Tg) leva inevitavelmente a uma mudança na estrutura do material.12 Por exemplo, um precursor pirolisado a 1000 ºC tem que ser aquecido a uma temperatura superior a esta para ser medida sua Tg. Isto, no entanto, causa mudanças químicas irreversíveis no material, como reações de redistribuição, de decomposição e até mesmo cristalização,29,30 não existindo uma temperatura distinta de pirólise que separa um precursor de um vidro. Além disso, os termos vítreo, amorfo e não-cristalino têm sido usados indistintamente para descrever fases sólidas de géis e silicatos organicamente modificados, e, portanto, neste contexto, materiais no sistema Si-O-C têm sido chamados na literatura específica como vidros de oxicarbeto de silício.12
HISTÓRICO Vários autores descreveram, a partir dos anos 50, a incorporação de carbono em vidro de sílica.31-33 Homeny et al.34,35 prepararam vidro de oxicarbeto a partir da fusão de uma mistura de MgO, Al2O3 e SiO2 e pó de SiC como fonte de carbono (sistema Mg-Al-Si-O-C), a uma temperatura de aproximadamente 1800 ºC em atmosfera de nitrogênio. Os vidros obtidos apresentaram teor máximo de carbono de 2,5%, foram caracterizados como não-cristalinos quando analisados por difração de raios X e mostraram propriedades mecânicas melhores que as da sílica ou de vidros de oxinitreto de silício. Entretanto, a presença de uma fase de oxicarbeto não foi comprovada experimentalmente. Na maioria dos trabalhos que têm sido descritos neste assunto, fontes distintas de sílica e carbono foram misturadas e pirolisadas a altas temperaturas com o objetivo de promover a reação destes componentes. Entretanto, a baixa solubilidade do carbono em sílica é um fator limitante à obtenção de vidros homogêneos de oxicarbeto de silício. Apesar de não terem sido caracterizadas fases termodinamicamente estáveis intermediárias entre SiC e SiO2, a presença de uma fase metaestável de oxicarbeto de silício foi confirmada em um grande número de estudos.12,16 Uma fase ternária constituída de Si-O-C, situada entre uma camada de sílica e SiC, foi evidenciada por Pampuch et al.36,37 Yurkov and Polyak38 estudaram a interface entre a sílica gerada na superfície do SiC, por oxidação, e o SiC, e novamente confirmaram a formação de uma fase metaestável de oxicarbeto de silício. A presença de oxicarbeto de silício também foi descrita nas fibras cerâmicas NICALON (Nippon Carbon Co., Japan), obtidas a partir do processamento de precursores poliméricos. Lipowitz et al39,40 desenvolveram um estudo estrutural destas fibras, descrevendo para estas uma microestrutura constituída de uma fase amorfa contínua de oxicarbeto de silício, na qual nanocristais de SiC estavam distribuídos. Chi,41 em 1983, descreveu a obtenção de vidros de oxicarbeto de silício, preparados a partir de precursores obtidos pelo processo Sol-gel, seguido de pirólise à 1200 ºC em atmosfera de argônio. O gel precursor foi obtido a partir da co-hidrólise de tetraetoxissilano (TEOS - Si(OC2H5)4) e metiltrimetoxissilano (MTMS - CH3Si(OCH3)3), e o produto da pirólise apresentou cor preta e excelente estabilidade térmica e resistência à oxidação. Somente no início de 1990 é que surgiram os primeiros trabalhos descrevendo a utilização de resinas de siliconas como precursores de vidros de oxicarbeto de silício.13,14,41-44 Desde então, os trabalhos utilizando estes precursores têm se multiplicado, com o objetivo de estudar a evolução estrutural do precursor ao material cerâmico, a estrutura, a estabilidade térmica dos vidros e a influência da quantidade de carbono nas propriedades do material. Sem duvida, a rota mais atrativa para a preparação de oxicarbeto de silício é a pirólise de um precursor pré-cerâmico, cuja estrutura já apresente além de ligações Si-O, as ligações Si-C. Neste sentido, siliconas se constituem na mais adequada fonte de precursores destes vidros.17,27
PRECURSORES DE OXICARBETO DE SILÍCIO Resinas ou géis de poli(organossiloxanos) são polímeros obtidos por reações de hidrólise/condensação de monômeros de cloro- ou alcoxissilanos, R4-xSiZx, em que R = grupo alquil, aril ou derivados, Z = Cl, OCH3, OC2H5, etc, em que x pode ser 1, 2, 3 ou 4,45 e que após pirolisados em temperaturas próximas a 1000 ºC, sob atmosfera inerte, geram oxicarbeto de silício, como apresentado no esquema da Figura 2.
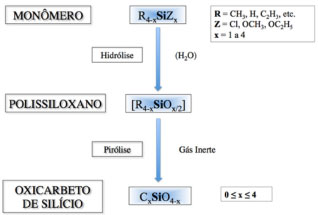 Figura 2. Esquema da preparaçao de vidros de oxicarbeto de silício (SiOC) por meio da pirólise de polissiloxanos
Particularmente, os metilclorossilanos são produzidos em larga escala pelo método Müller-Rochow, são baratos e facilmente purificados por destilação.46 Eles são usados para a fabricação das siliconas, num processo que envolve a hidrólise das ligações Si-Cl, produzindo intermediários Si-OH, os quais são rapidamente condensados gerando a cadeia de Si-O-Si. A equação (1) descreve a reação global deste processo: 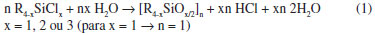 Quando x = 2, ocorre a formação de uma cadeia linear de silicona, enquanto que para x = 3, tem-se a formação de resinas de siliconas. Estes materiais apresentam considerável estabilidade térmica, excelentes propriedades elétricas e hidrofóbicas, baixa tensão superficial e baixa temperatura de transição vítrea, e por isso encontram numerosas aplicações industriais.46 Devido a sua estabilidade ao ar, e pelo fato de poderem ser facilmente manuseados e processados sob condições ambientes, têm recebido especial atenção como precursores de vidros de oxicarbeto de silício.17,27 Além disso, apresentam outras vantagens em relação aos precursores usualmente empregados no processo sol-gel, como disponibilidade comercial de uma variedade de reagentes com propriedades reológicas distintas, o que possibilita processamentos variados, como por infiltração, injeção, moldagem, extrusão, etc. Outra vantagem é a diversidade de rotas de cura dos materiais de partida, envolvendo processos químicos bem fundamentados.46,47 De maneira geral, polímeros de interesse como precursores de materiais cerâmicos são aqueles capazes de gerar altos rendimentos cerâmicos, os quais são obtidos por meio da pirólise de estruturas reticuladas, na qual a eliminação de moléculas de baixa massa molar, frequentemente responsáveis pela perda de peso em temperaturas baixas, é minimizada.48 A pirólise de polímeros lineares geralmente gera rendimentos cerâmicos próximos de zero. Isto é devido às reações de despolimerização, envolvendo reações de redistribuição de ligações Si-O/Si-O ou ataque nucleofílico de grupos silanóis terminais, levando à formação de oligômeros cíclicos voláteis como ciclotrissiloxanos [(CH3)2SiO]3 (D3) e ciclotetrassiloxanos [(CH3)2SiO] (D4).22,48 A Figura 3 apresenta um esquema com estes dois tipos de reações envolvendo o polidimetilsiloxano (PDMS), dando origem a ciclos do tipo D4.22,48,49 É interessante observar que não há modificação na funcionalidade das unidades siloxânicas. Contrário a esta situação, polissiloxanos reticulados conduzem a rendimentos cerâmicos altos, uma vez que reações de despolimerização são impedidas pela baixa mobilidade das cadeias. Além disso, várias etapas de despolimerização são necessárias para fragmentar o polímero e, se ocorre fragmentação das moléculas, os fragmentos formados são de baixa volatilidade remanescendo no próprio material.48,49
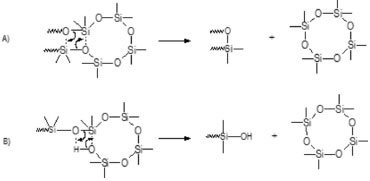 Figura 3. Reaçoes de despolimerizaçao de polissiloxanos lineares gerando ciclosiloxanos D4 por: A) reaçoes de redistribuiçao de ligaçoes Si-O; B) ataque nucleofílico de grupos silanóis terminais (ligaçoes Si-CH3 sao representadas por Si-)
A reticulação de siliconas é geralmente realizada à temperatura ambiente, dando origem às borrachas vulcanizadas RTV (Room Temperature Vulcanizing).45,46 Dentre os métodos disponíveis utilizados para promover a vulcanização de siliconas, a reação de hidrossililação é a mais utilizada, devido à sua versatilidade. Em contraste às demais reações de cura de siliconas, como aquelas envolvendo a reação de condensação, a hidrossililação não leva à formação de subprodutos, nem à liberação de compostos voláteis. Além disso, em muitos casos a reação pode ser realizada na ausência de solvente, facilitando a obtenção de materiais sem tricas ou rachaduras. A reação é bastante simples, envolve a adição de uma ligação silício-hidrogênio (Si-H) a uma ligação insaturada carbono-carbono (C=C), catalisada por um metal, geralmente Pt2+.47,50 Na prática, a reação de hidrossililação é utilizada para o acoplamento de grupos hidrossilanos (Si-H) e vinilsilanos (SiCH=CH2). Neste caso, há dois modos possíveis de adição à dupla ligação, como pode ser observado no esquema da Figura 4. A reação é bastante seletiva na formação do produto proveniente da adição β.50
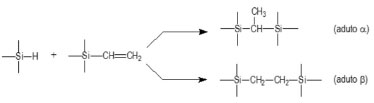 Figura 4. Reaçao de hidrossililaçao entre grupos Si-H e Si-CH=CH2, catalisada por PtII
Um dos primeiros trabalhos utilizando siliconas de composição (MeHSiO)0,3(MeSiO0,5)0,7 como precursores de vidros de oxicarbeto de silício foi desenvolvido por Laine et al.42 Este precursor foi obtido à temperatura ambiente pela reação de redistribuição catalisada por Cp2TiMe2, partindo seja do composto cíclico (CH3HSiO)x, com x = 4 ou 5, ou do siloxano linear de fórmula (CH3)3SiO(MeHSiO)xH, com massa molar de aproximadamente 2000 Da. Renlund et al.13,14 descreveram a obtenção de vidros de oxicarbeto a partir de uma resina de silicona comercial, SR 350 (General Electric Silicon Produts, Waterford, NY). Esta resina é sólida, dura e frágil a 20 ºC, flexível a aproximadamente 30 ºC, fluida a 90 ºC, e é solúvel em vários solventes polares e não-polares. Estruturalmente é uma mistura de cadeias de siloxanos lineares, parcialmente reticulados, com substituintes metila e rica em hidroxilas. As propriedades mecânicas, térmicas, elétricas e ópticas dos vidros SiOC obtidos foram descritas.14 Estes estudos estão ainda hoje entre os poucos disponíveis na literatura sobre estes materiais. Gharbi et al.44 prepararam precursores de vidros SiOC a partir da reticulação do polimetilssiloxano (PMHS) com grupos hexa-1,5-dieno ou hexan-1,6-diol, com o objetivo de se obter polímeros com a mesma arquitetura, porém com diferentes teores de carbono. Os vidros de SiOC obtidos foram caracterizados principalmente em função do teor de carbono. Em nosso grupo de pesquisa foram descritas preparações de redes policíclicas de siliconas,17-19, 22-25 por meio de reação de hidrossililação, as quais foram empregadas como precursoras de oxicarbeto de silício. Em todos os casos estudou-se a conversão estrutural da rede polimérica à cerâmica. Foi verificado que além da composição, a arquitetura molecular dos precursores possui algum papel na composição do material final. Finalmente, é importante salientar que uma grande variedade de géis obtidos pelo processo sol-gel tem sido explorada na obtenção de vidros de oxicarbeto de silício.26,30,41,51-77 Estes estudos contribuíram significativamente com o entendimento dos processos de obtenção e caracterização destes vidros.
ESTRUTURA MOLECULAR DE OXICARBETO DE SILÍCIO Uma das principais técnicas de análise de um vidro de oxicarbeto de silício é a ressonância magnética nuclear de 29Si e 13C. Particularmente, RMN de 29Si é capaz de detectar a presença dos diferentes ambientes químicos do átomo de silício, como: SiO4, CSiO3, C2SiO2, C3SiO e C4Si. Estas espécies constituem a estrutura básica de uma rede de oxicarbeto de silício e a distribuição dos sinais referentes a estes sítios é usualmente bem definida num espectro convencional. Estes sinais são geralmente designados por Q, T, D, M e C, respectivamente.44,67 A estrutura de um vidro SiOC foi evidenciada por meio desta técnica no final dos anos 80 por Babonneau et al.,51 em materiais obtidos por pirólise a 900 ºC de géis preparados a partir da co-hidrólise de TEOS e dimetildietoxissilano (MDES), em atmosfera inerte. Em seguida, Zhang e Pantano16 caracterizaram por RMN de 29Si os vidros obtidos por pirólise de géis contendo diferentes grupos orgânicos, como metila, etila, vinila e fenila. Nestes estudos o oxicarbeto de silício foi preparado por pirólise entre 800 e 1000 ºC de precursores contendo no mínimo uma ligação Si-C. Em ambos os casos observou-se a presença de sítios SiO4 nos produtos de pirólise, o que sugere a ocorrência de reações de redistribuição na esfera de coordenação do Si, durante o processo de pirólise, o que é acompanhado pela segregação de carbono livre da estrutura da rede. A Figura 5 compara os espectros de RMN de 29Si, obtidos usando a técnica de rotação no ângulo mágico (MAS - magic angle spinning), de um elastômero constituído de silicona policíclica obtido a 400 ºC, e do vidro obtido por pirólise deste material a 1000 ºC. Os detalhes da preparação foram descritos em outras publicações.22-24 Este elastômero, curado à temperatura ambiente, contém sítios do tipo D, R2SiO2/2, o qual é caracterizado por um pico em -18,9 ppm, associado à unidade da estrutura policíclica, e grupos reativos residuais caracterizados por um outro sinal em -33,1 ppm. No entanto, a 400 ºC, observa-se apenas o primeiro. É interessante observar a geração de novos sítios de Si durante o tratamento térmico, a partir de um polímero constituído por sítios do tipo D, conforme pode ser observado no espectro do vidro obtido por pirólise a 1000 ºC. Em muitos estudos de sistemas precursores de vidros SiOC, a caracterização detalhada do processo de conversão é limitada devido à complexidade estrutural do precursor utilizado, que geralmente contém um distribuição de diferentes sítios de Si, associados às unidades M, D e T. Isto é especialmente observado em géis obtidos pela co-hidrólise de diferentes alcoxissilanos.70
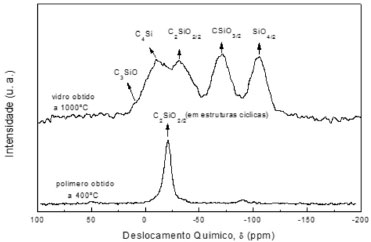 Figura 5. Espectros de RMN MAS de 29Si de uma silicona altamente reticulada (400 ºC) e de um vidro de oxicarbeto de silício obtido por pirólise a 1000 ºC
Usualmente, vidros de SiOC, obtidos por pirólise de géis derivados de alcoxissilanos, são ricos em sítios D, T, e Q, e raramente se observa a formação de C3SiO e C4Si.12 Por outro lado, materiais obtidos a partir da pirólise de resinas de siliconas exibem uma maior distribuição dos diferentes ambientes químicos possíveis para o átomo de Si22-24,44 quando comparado com aquelas derivadas da reticulação de alcoxissilanos.12-14 No precursor constituído de silicona policíclica as unidades D foram redistribuídas nas demais durante a pirólise, dando origem a um vidro de oxicarbeto que exibiu todos os possíveis sítios tetraédricos para o Si. Assim, pode-se constatar que a distribuição dos diferentes sítios de Si no vidro de SiOC depende da natureza do precursor utilizado. Além disso, a temperatura de pirólise exerceu um efeito marcante nesta distribuição. A Figura 6 ilustra o monitoramento da conversão do elastômero de silicona policíclica a oxicarbeto de silício por RMN de 29Si. Observou-se a formação de diferentes materiais contendo proporções relativas variadas de sítios de 29Si entre 600 e 1400 ºC. Para temperaturas acima de 1000 ºC ocorreu uma intensificação dos sinais referentes aos sítios SiO4 e C4Si, atribuída à redistribuição de sítios, que é intensificada nesta faixa de temperaturas. Este rearranjo estrutural foi observado também por outros autores,29,59 sendo uma etapa importante da redução carbotérmica dos sítios SiO4, a qual gera como único produto o β-SiC.
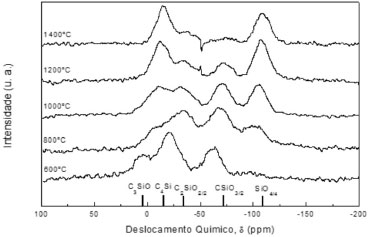 Figura 6. Espectros de RMN MAS 29Si de vidros SiOC em diferentes temperaturas de pirólise, de 600 a 1400 ºC
Com relação à transformação do precursor cerâmico ao SiOC, sendo o precursor vidro ou resina obtido pelo processo sol-gel,30,58-61 ou ainda siliconas,12,21 a pirólise é um processo relativamente complexo. Entretanto, os estudos nestes sistemas têm mostrado a ocorrência de basicamente dois estágios distintos: o primeiro envolvendo reações de redistribuição, entre 300 e 600 ºC, e o segundo associado às reações de mineralização ou ceramização, que ocorrem a temperaturas superiores a 600 ºC. O primeiro processo envolve um equilíbrio como ilustrado nas reações abaixo:30 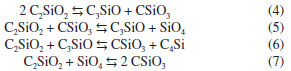 As reações de mineralização, por outro lado, envolvem além do equilíbrio, a quebra de ligações Si-C, C-C e C-H produzindo hidrocarbonetos voláteis e hidrogênio, gerando o material inorgânico SiOC. Além disso, estas reações são responsáveis pela produção de carbono livre e pela sua incorporação no material. A formação de hidrocarbonetos voláteis ocorre por clivagem homolítica de ligações gerando radicais livres, os quais podem se combinar entre si ou abstrair hidrogênio. A formação do resíduo cerâmico é mais complexa e difícil de ser interpretada.49 Em sua estrutura tridimensional aleatória também deve ser considerada a formação de defeitos como a ausência de átomos de oxigênio ou a presença destes átomos tri-coordenados, dando origem às ligações erráticas, comuns em materiais não cristalinos. Vidros SiOC são de cor preta, o que é uma evidência da presença de carbono livre neste material. Esta fase de carbono tem sido caracterizada por microscopia eletrônica de transmissão de alta resolução, RMN de 13C e espectroscopia Raman.12,63 Estes estudos evidenciaram que o carbono livre está disperso no vidro em uma escala nanométrica, com tamanho menor de 2,5 nm, nada podendo se afirmar sobre a associação estrutural desta fase com a rede de oxicarbeto de silício.11 Resultados de espectroscopia paramagnética eletrônica também confirmaram a presença da fase de carbono livre em matriz de oxicarbeto de silício. A análise da largura dos sinais em g=2,002, efetuada em diferentes temperaturas, indicou uma redistribuição do carbono de uma fase molecular amorfa a uma fase macromolecular, melhor organizada.78 Vidros SiOC contendo fases ricas em carbono também foram estudadas por espectroscopia Raman. Observou-se que nano aglomerados de carbono grafítico podem ser formados a partir da pirólise de precursores poli(dimetilsiloxano) e divinilbenzo na presença de íons Ni2+ como catalisador.79 Os resultados obtidos da análise efetuada por RMN MAS de 13C do produto de pirólise da rede de silicona policíclica (espectros não apresentados) indicou uma quantidade de carbono livre correspondente a aproximadamente 70% em massa relativa ao total de carbono na amostra. Uma quantidade significativa de hidrogênio, de aproximadamente 1% em massa, provavelmente associado a átomos de carbono, também foi determinada por análise elementar.25 Pantano et al.,12 analisando vidros de oxicarbeto de silício provenientes da pirólise de géis pela técnica de RMN 13C, observou uma quantidade significativa de hidrogênio, também associado a átomos de carbono. Estes autores propuseram uma estrutura provável para vidros de SiOC na qual átomos de carbono podem estar na forma de sítios terminais Si-CH3 ou envolvidos em pontes Si-CH2-Si, uma vez que estas espécies são evidentes nos espectros de RMN de 29Si e 13C. O ataque químico com ácido fluorídrico em vidros SiOC tem sido explorado para a formação de materiais mesoporosos ricos na fase de carbono,80 uma vez que ainda não é possível a preparação de vidros SiOC sem a presença dessa fase. O HF é capaz de dissolver os grupos contendo sílica, deixando a estrutura de carbono ativa. Estruturas de vidros de oxicarbeto de silício e boro (SiBOC) também têm sido exploradas em relação à estrutura resultante após ataque ácido.81 A estrutura amorfa do oxicarbeto de silício, obtido a 1000 ºC, pela pirólise da rede de silicona policíclica foi confirmada pelo difratometria de raios X. O padrão de difração é caracterizado por um halo largo de difração, de intensidade muito fraca, conforme pode ser observado na Figura 7. Entretanto, à medida que se aumentou a temperatura de pirólise, o material sofre um rearranjo nos sítios tetraédricos do Si, conforme já discutido anteriormente, por meio de reações de redistribuição, gerando como produto final, a 1600 ºC, a fase cristalina de β-SiC. A temperaturas superiores a 1400 ºC a reação de redução carbotérmica entre a sílica e carbono livre é um dos fatores responsáveis pela produção do β-SiC formado,23,27,59 contribuindo inclusive para o decréscimo observado no rendimento cerâmico. As reações abaixo descrevem este processo:65 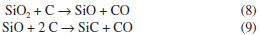 A reação global é: 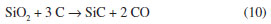
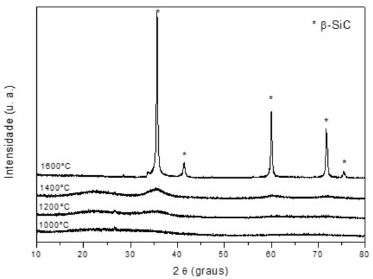 Figura 7. Difratogramas de raios X de vidros SiOC pirolisados em diferentes temperaturas
PROPRIEDADES DOS VIDROS DE OXICARBETO DE SILÍCIO O melhor desempenho térmico e mecânico de vidros de oxicarbeto de silício em relação a vidros de sílica tem sido associado à presença da fase de carbono livre dispersa no material.16,35 A incorporação do carbono resulta em aumento do módulo elástico, aumento da dureza, aumento da viscosidade, aumento da densidade e da temperatura de transição vítrea, além de menor tendência à devitrificação.14,41 Portanto, vidros de oxicarbeto de silício podem ser úteis em aplicações envolvendo altas temperaturas, nas quais o uso de SiO2 é limitado devido a sua alta velocidade de devitrificação, à baixa viscosidade, e consequentemente altas taxas de fluência. A viscosidade de um vidro de oxicarbeto de silício é de aproximadamente 10-103 vezes maior que a de sílica fundida.14,61,82 Relativamente poucos dados são disponíveis na literatura sobre as propriedades físicas de oxicarbeto de silício, principalmente em relação à estabilidade termoquímica e termomecânica.26,82-85 Este fato é, em parte, devido à dificuldade de obter corpos de prova provenientes da pirólise de precursores, géis ou polímeros, com características adequadas especialmente para a realização de testes mecânicos. Além disso, a natureza do precursor e das condições de pirólise influenciam a estrutura e a composição final do material e, portanto, afetam as suas propriedades. Como já mencionado anteriormente, o principal trabalho sobre as propriedades térmicas, químicas e ópticas de vidros de oxicarbeto de silício, obtidos pela pirólise de uma resina de silicona, foi descrito por Renlund et al.14 Estes dados comparados aos valores encontrados para vidros de sílica são apresentados na Tabela 1. Muitas propriedades apresentam valores comparáveis entre si, entretanto, as diferenças que existem indicam que o vidro de oxicarbeto de silício é um material mais refratário, mais duro, com uma estrutura mais compacta devido à substituição de carbono, características que justificam o grande interesse nesta nova classe de sólidos amorfos.
Sorarù et al.26 realizaram a caracterização mecânica de vidros de oxicarbeto de silício, obtidos via pirólise de géis precursores, contendo ligações Si-CH3 e Si-H, com o objetivo de observar o efeito de diferentes conteúdos de carbono nestes materiais. Foi concluído que as propriedades mecânicas foram significativamente melhoradas à medida que se aumenta o conteúdo de carbono. Os valores máximos para o módulo de flexão, resistência à flexão e microdureza Vickers foram 113 GPa, 550 MPa e ~9.3 GPa, respectivamente, e correspondem a valores cerca de 50% maiores que aqueles encontrados para a sílica fundida. O comportamento a altas temperaturas em relação ao coeficiente de expansão, viscosidade e elasticidade de vidros SiOC derivados de precursores géis, foi reavaliado,82 e os resultados obtidos foram similares àqueles apresentados na Tabela 1. A estabilidade térmica destes vidros, por outro lado, foi determinada como sendo uma complexa função de sua composição, particularmente da fase de carbono amorfo, da atmosfera de pirólise e também da própria dimensão da amostra.83 A resistência à oxidação de vidros de SiOC foi estudada por Brewer et al.84 e por Hurwitz e Meador.85 Observou-se que quanto menor é a quantidade de carbono livre, melhor é a resistência à oxidação do material, contrário ao efeito promovido pela presença de carbono ligado ao silício. Hurwitz e Meador85 examinaram o efeito da temperatura, do tempo e da atmosfera de pirólise sobre a oxidação de vidros SiOC preparados usando como precursor polímeros do sistema BlackglasTM (Allied Signal, Inc.). Polissiloxanos BlackglasTM são produzidos por polimerização termicamente induzida de ciclossiloxanos e vinilciclossiloxanos, por meio de reação de hidrossililação entre os grupos Si-H e SiCH=CH2.16,86,87 Estes materiais estão recebendo grande atenção devido a sua disponibilidade comercial, baixo custo e, principalmente, pela sua utilização potencial como matrizes na preparação de precursores de compósitos de matriz cerâmica. Os resultados deste trabalho apontaram que a estabilidade dos vidros do sistema BlackglasTM é influenciada pela sua estrutura, a qual por sua vez é determinada pela temperatura e atmosfera de pirólise. Como num processo típico de pirólise de siliconas, como o apresentado anteriormente, o tratamento térmico sob atmosfera inerte leva a uma mistura de diferentes sítios de Si no oxicarbeto de silício, com percentual dependente, principalmente, da temperatura. A variável tempo de pirólise é secundária. Neste material a porcentagem de unidades SiO4 e C4Si aumenta com o aumento da temperatura de pirólise, aumentando a sua resistência à oxidação, pois a unidade C4Si se oxida mais lentamente que C2SiO2 e CSiO3. Resultados semelhantes foram obtidos por Schiavon et al.23 no vidro de oxicarbeto obtido por pirólise de uma rede de silicona policíclica.
APLICAÇÕES DE VIDROS OXICARBETO DE SILÍCIO Usualmente vidros de oxicarbeto de silício apresentam propriedades mecânicas e estabilidade a altas temperaturas superiores aos da sílica. Deste modo, têm sido apontados como excelentes candidatos a várias aplicações tecnológicas. Como as propriedades intrínsecas destes materiais ainda não são bem estabelecidas, devido às dificuldades de se controlar a composição do produto, a distribuição dos diferentes sítios de Si e a quantidade de carbono não incorporada à rede do material, tem sido desenvolvida uma série de estudos com o objetivo de correlacionar propriedades com a composição. Vidros SiOC derivados de géis têm sido utilizados como modelos no estudo da composição e da estrutura destes materiais, devido à facilidade de se modificar os grupos orgânicos dos alcóxidos empregados como precursores. A principal aplicação dos vidros SiOC tem sido como matriz cerâmica na obtenção de compósitos reforçados por fibras, partículas ou "whiskers". Neste caso, as siliconas são precursores particularmente interessantes devido à facilidade de processamento dos corpos verdes por processos de moldagem,24,88 infiltração25 ou mesmo por injeção,89 e também por possibilitarem temperaturas mais baixas que aquelas usualmente praticadas no processamento convencional de pós cerâmicos. A obtenção de compósitos de matriz cerâmica (CMC) constituídos de pós cerâmicos, como SiC e Si3N4, e oxicarbeto de silício, proveniente da pirólise de siliconas, tem sido descrita.23,24 Neste caso, a fase cerâmica amorfa atua não somente como matriz mas também como agregante das partículas do pó. Monolitos cerâmicos com boas propriedades mecânicas foram obtidos usando esta tecnologia.23 Neste sistema é possível ainda controlar a microestrutura, a taxa de encolhimento e a porosidade final do material, variando-se a quantidade do polímero precursor ou a temperatura de processamento.24 Vários outros trabalhos na literatura têm utilizado siliconas como agregante de pós reativos. Greil88 ressaltou a utilização de fases metálicas capazes de reagir, a altas temperaturas, com os produtos da degradação do polímero como carbono grafítico e gases voláteis (CxHy), ou mesmo com as moléculas do gás utilizado na pirólise. Fases de Ti, Mo, Zn, CrSi2 e MoSi2 foram investigadas em sistemas contendo polissiloxanos como polímeros precursores.88,89 Nióbio90 e alumínio91 foram utilizados com sucesso para obtenção de fases cristalinas de nióbia e alumina em compósitos de matriz cerâmica. A principal característica destes sistemas é o controle da taxa de encolhimento e da porosidade, além da microestrutura ser caracterizada por uma rede tridimensional de fases interconectadas.24,88 Vidros SiOC podem ainda ser usados como suportes catalíticos, devido à estabilidade de sua estrutura porosa68 e à característica hidrofóbica, quando pirolisados a temperaturas relativamente baixas.74,92 Compósitos obtidos a partir da pirólise de misturas contendo casca de arroz e siliconas também mostraram-se promissores como uma alternativa para a utilização deste resíduo agroindustrial.93 Cerâmicas porosas derivadas de polímeros e obtidas pela pirólise de sistemas baseados em polissiloxanos/argila foram descritas recentemente do ponto de vista das alterações estruturais, texturais e morfológicas dos materiais finais. A presença de nanofios de SiOC foi atribuída à presença de níquel como indutor de estruturas nanométricas.94 Vidros SiOC foram utilizados com sucesso na formação de nanocompósitos envolvendo semicondutores como ZnO95 e TiO2.96 Estes materiais foram utilizados com sucesso em fotocatálise envolvendo corantes orgânicos visando a despoluição de águas contaminadas. Os resultados obtidos foram semelhantes aos encontrados na literatura para sistemas mais complexos. Uma aplicação de vidros SiOC que vem crescendo recentemente envolve a preparação de eletrodos anódicos para baterias recarregáveis de lítio.97 Foi demonstrado que, dependendo da composição do vidro, a capacidade reversível do ânodo pode atingir quase três vezes o valor de ânodos convencionais de grafite, geralmente usados em baterias comerciais.98 Algumas composições de vidros SiOC mostraram alta capacidade reversível para o íon lítio, acima de 600 mAh g-1.98 Recentemente, foi demonstrado que vidros SiOC podem ser aplicados como eletrodos supercapacitores99 e também como sensores de gases como NO2 e H2 a altas temperaturas. A sensibilidade de resposta como sensor de gases parece depender da porosidade e temperatura de preparação do vidro.100
CONSIDERAÇÕES FINAIS Um grande número de estudos têm contribuído para o desenvolvimento e aplicações de vidros metaestáveis de oxicarbeto de silício, os quais são facilmente preparados por meio da pirólise de híbridos orgânicos/inorgânicos ou de polímeros precursores à base de siliconas. Estes polímeros apresentam um custo relativamente baixo e encontram-se disponíveis no mercado com uma grande variedade de viscosidade e de funções que permitem diferentes processos de cura. O processo de transformação do polímero à cerâmica permitiu avanços tecnológicos significativos em ciência e tecnologia da área de vidros e cerâmicas, tais como o desenvolvimento de fibras cerâmicas, revestimentos, cerâmica estáveis a temperaturas extremamente altas em relação à decomposição, cristalização e separação de fases. Nos últimos anos, uma série de avanços importantes foram alcançados, tais como a descoberta de uma variedade de propriedades funcionais associados aos vidros SiOC. Além disso, novos estudos sobre sua estrutura em escala nanométrica têm contribuído para a compreensão fundamental dos vários aspectos úteis e únicos desses materiais. Apesar de a química dar uma contribuição importante no desenvolvimento dessa classe de materiais, esta é uma área altamente interdisciplinar, na vanguarda da nanociência e nanotecnologia, com conhecimentos específicos envolvendo químicos, físicos, mineralogistas, cientistas de materiais e engenheiros. Assim, no futuro próximo, as questões científicas relacionadas com a conversão de polissiloxanos a vidros SiOC deverão envolver procedimentos gerais de síntese para produzir polímeros com novas funcionalidades e arquiteturas moleculares; estudo dos aspectos microestruturais dos vidros; aprofundamento no estudo da microestrutura; estratégias de processamento para fabricar componentes cerâmicos; discussão e apresentação de vários exemplos de possíveis aplicações reais usando as características especiais dos materiais cerâmicos e vítreos derivados de polissiloxanos.101
AGRADECIMENTOS Os autores agradecem à CAPES, ao CNPq, à FINEP e à FAPEMIG pelo apoio recebido. M. Hojamberdiev agradece à Fundação Alexander von Humboldt (AvH) pela bolsa de pós-doutorado.
REFERÊNCIAS 1. Segal, D.; J. Mater. Chem. 1997, 7, 1297. DOI: http://dx.doi.org/10.1039/a700881c 2. Riedel, R.; Dressler, W.; Ceram. Int. 1996, 22, 233. DOI: http://dx.doi.org/10.1016/0272-8842(95)00097-6 3. Bill, J.; Aldinger, F.; Em Precursor-derived Ceramics: synthesis, structures and high temperature mechanical properties; Bill, J.; Wakai F.; Aldinger, F., eds.; Wiley-VCH: Weinhein, 1999, p. 33. 4. Chantrell, P. G.; Popper, P.; Em Special Ceramics; Popper, P., ed.; Academic Press: New York, 1965, p. 67. 5. Yajima, S.; Hayashi, J.; Omori, M.; Chem. Lett. 1975, 931. DOI: http://dx.doi.org/10.1246/cl.1975.931 6. Yajima, S.; Omori, M.; Hayashi, J.; Okamura, K.; Matsuzawa, T.; Liaw, C.F.; Chem. Lett. 1976, 551. DOI: http://dx.doi.org/10.1246/cl.1976.551 7. Yajima, S.; Shishido, T.; Kayano, H.; Nature 1976, 264, 237. DOI: http://dx.doi.org/10.1038/264237a0 8. Yajima, S.; Hayashi, J.; Omori, M.; US Pat. 4,052,430 1977. 9. Greil, P.; Adv. Eng. Mater. 2000, 2, 339. DOI: http://dx.doi.org/10.1002/1527-2648(200006)2:6<339::AID-ADEM339>3.0.CO;2-K 10. Laine, R. M.; Babonneau F.; Chem. Mater. 1993, 5, 260. DOI: http://dx.doi.org/10.1021/cm00027a007 11. Birot, M.; Pillot, J. P.; Dunoguès, J.; Chem. Rev. 1995, 95, 1443. DOI: http://dx.doi.org/10.1021/cr00037a014 12. Pantano, C. G.; Sing, A. K.; Zhang, H.; J. Sol-Gel Sci. Technol. 1999, 14, 25. DOI: http://dx.doi.org/10.1023/A:1008765829012 13. Renlund, G. M.; Prochazka, S.; Doremus, R. H.; J. Mater. Res. 1991, 6, 2716. DOI: http://dx.doi.org/10.1557/JMR.1991.2716 14. Renlund, G. M.; Prochazka, S.; Doremus, R. H.; J. Mater. Res. 1991, 6, 2723. DOI: http://dx.doi.org/10.1557/JMR.1991.2723 15. Leung, R. Y.; Porter, W. D.; Ceram. Eng. Sci. Proc. 1996, 17, 386. 16. Zhang, H.; Pantano, C. G.; J. Am. Ceram. Soc. 1990, 73, 958. DOI: http://dx.doi.org/10.1111/j.1151-2916.1990.tb05143.x 17. Sousa, B. F.; Yoshida, I. V. P.; Ferrari, J. L.; Schiavon, M. A.; J. Mater. Sci. 2013, 48, 1911. DOI: http://dx.doi.org/10.1007/s10853-012-6955-4 18. Schiavon, M. A.; Armelin, N. A.; Yoshida, I. V. P.; Mater. Chem. Phys. 2008, 112, 1047. DOI: http://dx.doi.org/10.1016/j.matchemphys.2008.07.041 19. Schiavon, M. A.; Ciuffi, K. J.; Yoshida, I. V. P.; J. Non-Cryst. Solids 2007, 353, 2280. DOI: http://dx.doi.org/10.1016/j.jnoncrysol.2007.03.004 20. Schiavon, M. A.; Gervais, C.; Babonneau, F.; Soraru, G. D.; J. Am. Ceram. Soc. 2004, 87, 203. DOI: http://dx.doi.org/10.1111/j.1551-2916.2004.00203.x 21. Schiavon, M. A.; Soraru, G. D.; Yoshida, I. V. P.; J. Non-Cryst. Solids 2004, 348, 156. DOI: http://dx.doi.org/10.1016/j.jnoncrysol.2004.08.240 22. Schiavon, M. A.; Redondo, S. U. A.; Pina, S. R. O.; Yoshida, I. V. P.; J. Non-Cryst. Solids 2002, 304, 92. DOI: http://dx.doi.org/10.1016/S0022-3093(02)01009-8 23. Schiavon, M. A.; Radovanovic, E.; Yoshida, I. V. P.; Powder Technol. 2002, 123, 232. DOI: http://dx.doi.org/10.1016/S0032-5910(01)00461-2 24. Schiavon, M. A.; Pardini, L. C.; Yoshida, I. V. P.; Adv. Powder. Technol. 2001, 189, 48. 25. Radovanovic, E., Gozzi, M. F.; Gonçalves, M. C.; Yoshida, I. V. P.; J. Non-Cryst. Solids 1999, 248, 37. DOI: http://dx.doi.org/10.1016/S0022-3093(99)00101-5 26. Sorarù, G. D.; Dallapiccola, E.; D'Andrea, G.; J. Am. Ceram. Soc. 1996, 79, 2074. DOI: http://dx.doi.org/10.1111/j.1151-2916.1996.tb08939.x 27. Nyczyk-Malinowska, A.; Wójcik-Bania, M.; Gumuła, T.; Hasik, M.; Cypryk, M.; Olejniczak, Z.; J. Eur. Ceram. Soc. 2014, 34, 889. DOI: http://dx.doi.org/10.1016/j.jeurceramsoc.2013.10.026 28. Loehman, R. E.; J. Am. Ceram. Soc. 1979, 62, 490. 29. Belot, V.; Corriu, R. J. P.; Leclerq, D.; Mutin, P. H.; Voiux A.; J. Polym. Sci., Part A: Polym. Chem. 1992, 30, 613. DOI: http://dx.doi.org/10.1002/pola.1992.080300413 30. Belot, V.; Corriu, R. J. P.; Leclercq, D.; Mutin P. H.; Vioux, A.; J. Non-Cryst. Solids 1994, 176, 33. DOI: http://dx.doi.org/10.1016/0022-3093(94)90208-9 31. Ellis, R.; US Pat. 2,556,616 1951. 32. Smith, C. F.; Crandall, W. B.; US Pat. 3,378,481 1968. 33. Elmer, R.; Meissner, H.; J. Am. Ceram. Soc. 1976, 59, 206. DOI: http://dx.doi.org/10.1111/j.1151-2916.1976.tb10934.x 34. Homeny, J.; Nelson, G.; Risbud, S.; J. Am. Ceram. Soc. 1988, 71, 386. DOI: http://dx.doi.org/10.1111/j.1151-2916.1988.tb05058.x 35. Homeny, S.; Nelson, G. G.; Paulik, S. W.; Risbud, S. H.; J. Am. Ceram. Soc. 1987, 70, C114. 36. Pampuch, R.; Ptak, W. S.; Jonas, S.; Stock, J.; Proceeding of the 9th International Symposium on Reactivity of Solids, Cracow, Poland, Elsevier, 1980, 2, 674. 37. Lavrenko, V. A.; Jonas, S.; Pampuch, R.; Ceram. Int. 1981, 2, 75. DOI: http://dx.doi.org/10.1016/0272-8842(81)90019-5 38. Yurkow, A. L.; Polyak, R. I.; J. Mater. Sci. 1996, 31, 2729. DOI: http://dx.doi.org/10.1007/BF00687308 39. Lipowitz, J.; Freeman, H. A.; Chen, R. T.; Prack, F. R.; Adv. Ceram. Mater. 1987, 2, 121. 40. Lipowitz, J.; Ceram. Bull. 1988, 70, 1991. 41. Chi, F. K.; Ceram. Eng. Sci. Proc. 1983, 4, 704. 42. Lanie, R. M.; Rahn, J. A.; Youngdahl, K. A.; Babonneau, F.; Hoppe, M. L.; Zhang, Z.; Harrod, J. F.; Chem. Mater. 1990, 2, 464. DOI: http://dx.doi.org/10.1021/cm00010a028 43. Colombo, P.; Paulson, T. E.; Pantano, C. G.; Ceram. Acta 1993, 3, 13. 44. Kalfat, R.; Babonneau, F.; Gharbi, N.; Zarrouk, H.; J. Mater. Chem. 1996, 6, 1673. DOI: http://dx.doi.org/10.1039/jm9960601673 45. Kendrick, T. C.; Parbhoo, B.; White, J. W.; Em The Chemistry of Organic Silicon Compounds; Patai, S.; Rappoport,Z., eds.; John Wiley & Sons: New York, Part II, 1989, ch. 21. 46. Moreto, H-H.; Schulze, M.; Wagner, G. In Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinhein, 1993, Vol. A24, 57. 47. Thomas, D. R.; Em Siloxane Polymers; Clarson, S. J.; Semlyen, J. A., eds.; Prentice Hall: New Jersey, 1993, ch. 12. 48. Michalczyk, M. J.; Farneth, E. E.; Vega, A. J.; Chem. Mater. 1993, 5, 1687. DOI: http://dx.doi.org/10.1021/cm00036a001 49. Mutin, P. H.; J. Sol-Gel Sci. Technol. 1999, 14, 27. DOI: http://dx.doi.org/10.1023/A:1008769913083 50. Ojima, I.; Em The Chemistry of Organic Silicon Compounds; Patai, S.; Rappoport, Z.; John Wiley & Sons: New York, 1989, Part II, ch. 25. 51. Babonneau, F.; Thorme, K.; Mackenzie, J. D.; Chem. Mater. 1989, 1, 554. DOI: http://dx.doi.org/10.1021/cm00005a017 52. Kamiya, K.; Yoko, T.; Sano, T.; Tanaka, K.; J. Non-Cryst. Solids 1990, 119, 14. DOI: http://dx.doi.org/10.1016/0022-3093(90)90235-E 53. Kamiya, K.; Yoko, T.; Tanaka, K.; Takeuchi, M.; J. Mater. Res. 1991, 6, 2716. DOI: http://dx.doi.org/10.1557/JMR.1991.2716 54. Singh, A. K.; Pantano, C. G.; Mater. Res. Soc. Symp. Proc. 1992, 271, 795. DOI: http://dx.doi.org/10.1557/PROC-271-795 55. Babonneau, F.; Sorarù, G. D.; D'Andrea, G.; Dirè, S.; Bois, L.; Mater. Res. Soc. Symp. Proc. 1992, 271, 789. DOI: http://dx.doi.org/10.1557/PROC-271-789 56. Zhang, H.; Pantano, C. G.; Mater. Res. Soc. Symp. Proc. 1992, 271, 783. DOI: http://dx.doi.org/10.1557/PROC-271-783 57. Zhang, H.; Pantano, C. G.; Em Ultrastructure Processing of Advanced Materials, Wiley: New York, 1992, p. 223. 58. Belot, V.; Corriu, R. J. P.;, Leclercq, D.; Mutin, P. H.; Vioux, A.; J. Non-Cryst. Solids 1992, 144, 287. DOI: http://dx.doi.org/10.1016/S0022-3093(05)80412-0 59. Belot, V.; Corriu, R. J. P.; Leclercq, D.; Mutin, P. H.; Vioux, A.; J. Non-Crystal. Solids 1992, 147, 52. DOI: http://dx.doi.org/10.1016/S0022-3093(05)80592-7 60. Babonneau, F.; Bois, L.; Livage, J.; J. Non-Cryst. Solids 1992, 147, 280. DOI: http://dx.doi.org/10.1016/S0022-3093(05)80630-1 61. Hammond, M.; Breval, E.; Pantano, C. G.; Ceram. Eng. Sci. Proc. 1993, 14, 947. 62. Bois, L.; Maquet, J.; Babonneau, F.; Mutin, H.; Bahloul, D.; Chem. Mater. 1994, 6, 796. DOI: http://dx.doi.org/10.1021/cm00037a012 63. Breval, E.; Hammond, M.; Pantano, C. G.; J. Am. Ceram. Soc. 1994, 77, 3012. DOI: http://dx.doi.org/10.1111/j.1151-2916.1994.tb04538.x 64. Liu, C.; Zhang, H.; Komarneni, S.; Pantano, C. G.; J. Sol-Gel Sci. Technol. 1994, 1, 141. DOI: http://dx.doi.org/10.1007/BF00490244 65. Bois, L.; Maquet, J.; Babonneau, F.; Bahloul, D.; Chem. Mater. 1995, 7, 975. DOI: http://dx.doi.org/10.1021/cm00053a025 66. Sorarù, G. D.; D'Andrea, G.; Campostrini, R.; Babonneau, F.; Marriotto, G.; J. Am. Ceram. Soc. 1995, 78, 379. DOI: http://dx.doi.org/10.1111/j.1151-2916.1995.tb08811.x 67. Corriu, R. J. P.; Leclercq, D.; Mutin, P. H.; Vioux, A.; J. Mater. Sci. 1995, 30, 2313. DOI: http://dx.doi.org/10.1007/BF01184579 68. Singh, A. K.; Pantano, C. G.; J. Am. Ceram. Soc. 1996, 79, 2696. DOI: http://dx.doi.org/10.1111/j.1151-2916.1996.tb07891.x 69. Liu, C.; Chen, H. Z.; Komarneni, S.; Pantano, C. G.; J. Porous Mater. 1996, 2, 245. DOI: http://dx.doi.org/10.1007/BF00488109 70. Campostrini, R.; D'Andrea, G.; Carturan, G.; Ceccato, R.; Sorarù, G. D.; J. Mater. Chem. 1996, 6, 585. DOI: http://dx.doi.org/10.1039/jm9960600585 71. Babonneau, F.; Bois, L.; Yang, C. Y.; Interrante, L. V.; Chem. Mater. 1994, 6, 51. DOI: http://dx.doi.org/10.1021/cm00037a012 72. Liu, Q.; Shi, W.; Babonneau, F.; Interrante, L. V.; Chem. Mater. 1997, 9, 2434. DOI: http://dx.doi.org/10.1021/cm970316e 73. Sorarù, G. D.; D'Andrea, G.; Glisenti, A.; Mater. Lett. 1996, 27. 74. Singh, A. K.; Pantano, C. G.; J. Sol-Gel Sci. Technol. 1997, 8, 371. DOI: http://dx.doi.org/10.1007/BF02436867 75. Sorarù, G. D.; Campostrini, R.; Maurina, S.; Babboneau, F.; J. Am. Ceram. Soc. 1997, 80, 999. DOI: http://dx.doi.org/10.1111/j.1151-2916.1997.tb02933.x 76. Hu, Y.; J. Mater. Sci. 2000, 25, 3155. DOI: http://dx.doi.org/10.1023/A:1004832305979 77. Manocha, L. M.; Yasuda, E.; Tanabe, Y.; Manocha, S.; Vashintha, D.; Bull. Mater. Sci. 2000, 23, 1. DOI: http://dx.doi.org/10.1007/BF02708602 78. Hahn, B.; Weissmann, R.; Greil, P.; J. Mater. Sci. Lett. 1996, 15, 1243. DOI: http://dx.doi.org/10.1007/BF00274388 79. Segatelli, M. G.; Pires, A. T. N.; Yoshida, I. V. P.; J. Eur. Ceram. Soc. 2008, 28, 2247. DOI: http://dx.doi.org/10.1016/j.jeurceramsoc.2008.03.001 80. Biasetto, L.; Pena-Alonso, R.; Soraru, G. D.; Colombo, P.; Adv. Appl. Ceram. 2008, 107, 106. DOI: http://dx.doi.org/10.1179/174367607X227963 81. Sorarù, G. D.; Pena-Alonso, R.; Leoni, M.; Microporous Mesoporous Mater. 2013, 172, 125. DOI: http://dx.doi.org/10.1016/j.micromeso.2013.01.026 82. Rouxel, T.; Massouras, G.; Sorarù, G. D.; J. Sol-Gel. Sci. Technol. 1999, 14, 87. DOI: http://dx.doi.org/10.1023/A:1008779915809 83. Sorarù, G. D.; Sutor, D.; J. Sol-Gel Sci. Technol. 1999, 14, 69. DOI: http://dx.doi.org/10.1023/A:1008779915809 84. Brewer, C. M.; Bujalski, D. R.; Parent, V. E.; Su, K.; Zhang, G. A.; J. Sol-Gel Sci. Technol. 1999, 14, 49. DOI: http://dx.doi.org/10.1023/A:1008723813991 85. Hurwitz, F. I.; Meador, M. A. B.; J. Sol-Gel Sci. Technol. 1999, 14, 75. DOI: http://dx.doi.org/10.1023/A:1008727914900 86. Leung, R. Y.; Gounzy, S. T.; Shum, M. S.; US Pat. 5,242,866 1993. 87. Leung, R. Y.; Gonzcy, S. T.; US Pat. 5,231,059 1993. 88. Greil, P.; J. Am. Ceram. Soc. 1995, 78, 835. DOI: http://dx.doi.org/10.1111/j.1151-2916.1995.tb08404.x 89. Walter, S.; Suttor, D.; Erny, T.; Hahn B.; Greil, P.; J. Eur. Ceram. Soc. 1996, 16, 387. DOI: http://dx.doi.org/10.1016/0955-2219(95)00120-4 90. Schiavon, M.A.; Yoshida, I. V. P.; Dantas, A. C. S.; Acchar, W.; Adv. Powder Technol. 2005, 498, 369. 91. Schiavon, M. A.; Yoshida, I. V. P.; Bressiani, J. C.; Acchar, W.; Adv. Powder Technol. 2005, 498, 375. 92. Jose, N. M.; Prado, L. A. S. A.; Schiavon, M. A.; Redondo, S. U. A.; Yoshida, I. V. P.; J. Polym. Sci., Part B: Polym. Phys. 2007, 45, 299. DOI: http://dx.doi.org/10.1002/polb.21053 93. Siqueira, E. J.; Yoshida, I. V. P.; Pardini, L. C.; Schiavon, M. A.; Ceram. Inter. 2009, 35, 213. DOI: http://dx.doi.org/10.1016/j.ceramint.2007.10.013 94. Segatelli, M. G.; Kaneko, M. L. Q. A.; Silva, V. P.; Yoshida, I. V. P.; J. Bras. Chem. Soc. 2014, 25, 716. 95. Hojamberdiev, M.; Prasad, R. M.; Koji, M.; Schiavon, M. A.; Riedel, R.; Microporous Mesoporous Mater. 2012, 151, 330. DOI: http://dx.doi.org/10.1016/j.micromeso.2011.10.015 96. Hojamberdiev, M.; Prasad, R. M.; Koji, M.; Zhu, Y.; Schiavon, M. A.; Gurlo, A.; Riedel, R.; Appl. Catal., B 2012, 115, 303. DOI: http://dx.doi.org/10.1016/j.apcatb.2011.12.036 97. Dibandjo, P.; Graczyk-Zajac, M.; Riedel, R.; Pradeep, V. S.; Sorarù, G. D.; J. Eur. Ceram. Soc. 2012, 32, 2945. 98. Ahn, D.; Raj, R.; J. Power Sources 2011, 196, 2179. DOI: http://dx.doi.org/10.1016/j.jpowsour.2010.09.086 99. Yan, X. J.; Tsotis, T. T.; Sahimi, M.; Microporous Mesoporous Mater. 2014, 190, 267. DOI: http://dx.doi.org/10.1016/j.micromeso.2014.02.001 100. Karakuscu, A.; Ponzoni, A.; Aravind, P. R.; Sberverglieri, G.; Sorarù, G. D.; J. Am. Ceram. Soc. 2013, 96, 2366. DOI: http://dx.doi.org/10.1111/jace.12491 101. Colombo, P.; Mera, G.; Riedel, R.; Soraù, G. D.; J. Am. Ceram. Soc. 2010, 93, 1. DOI: http://dx.doi.org/10.1111/j.1551-2916.2009.03485.x |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access






