Artigo
|
|
| Estudio teórico de la reactividad química del carbón activo Theoretical study of the chemical reactivity of activated carbon |
|
Cristian J. Guerra*; Jesús M. López; Said F. Figueredo; Adolfo E. Muñoz
Universidad de Córdoba, Departamento de Química, Cra 6 Nº 76-103, Montería, Córdoba - Colombia Recebido em 06/02/2015 *e-mail: guerracbn@gmail.com We used conceptual DFT to study global and local reactivity of both nonfunctionalized and functionalized activated carbons, with groups -OH,-CHO, -NH2, -COOH, and -CONH2. Electron-withdrawing groups were observed to increase the reactive surface, while electro-donating groups increase stability as reactivity of the activated carbon decreases. Descriptor groups were used to study the reactivity of structural fragments of activated carbons. The electrophilic and nucleophilic sites indicate that the carbon surface has an amphiphilic behavior that allows it to be used as an adsorbent material for a variety of molecules. INTRODUCCIÓN En las últimas décadas el uso de superficies carbonosas en procesos tecnológicos de adsorción ha venido en aumento debido a su aplicabilidad en la potabilización de aguas,1,2 remoción de contaminantes en aguas residuales,3 y tratamiento de emisiones atmosféricas por adsorción de gases.4 Así, algunos estudios realizados sobre la remoción de compuestos fenólicos en fase acuosa a través de carbones activos demuestran que la capacidad de adsorción se ve afectada por diversos factores incluyendo las condiciones de adsorción (pH, fuerza iónica, concentración del adsorbato), naturaleza del adsorbato y adsorbente, química superficial y la porosidad del carbón.5 De igual forma, la heterogeneidad de la superficie proporciona una mayor afinidad hacia el adsorbato en los procesos que involucran fisisorción y quemisorción. En el caso de la fisisorción las interacciones de no enlace entre los carbones activos y una molécula especifica se deben principalmente a fuerzas electrostáticas y no involucran cambios químicos en la superficie de carbón,6,7 por otro lado, la químisorcion requiere de un intercambio electrónico donde se forman enlaces en los que la superficie del carbón sufre cambios estructurales que regularmente son irreversibles.8 Estudios experimentales sostienen que la estructura del carbón activo está relacionada con la de los fullerenos indicando la presencia de arreglos hexagonales y pentagonales de átomos de carbono, sin embargo son pocas las investigaciones realizadas sobre el comportamiento químico de la superficie del carbón activo. No obstante, existen algunos estudios teóricos enfocados a entender la reactividad de los fullerenos.9 La química superficial de los carbones activos depende de la presencia de heteroátomos, grupos funcionales específicos10 y al carácter semiaromático de los átomos de carbono. Los grupos funcionales y heteroátomos le confieren al carbón activo un comportamiento especifico hacia un adsorbato en particular, y dependiendo de su acidez o basicidad, así mismo estarán determinadas propiedades como la carga superficial, hidrofobicidad y densidad electrónica.11 Así, los grupos ácidos como el carboxilo (-COOH) son responsables de la carga superficial negativa debido a que estas especies pueden disociarse en solución, la presencia de grupos -CH=O y -COOH (extractores de electrones)3 permiten que los anillos hexagonales presentes en el carbón activo adquieran un carácter electrofìlico ya que tienen a recibir densidad electrónica. Por otro lado, la carga superficial positiva no es debida a grupos específicamente determinados, las especies básicas como cromenos o pironas contribuyen a que la superficie carbonosa adopte carga positiva. La deslocalización electrónica de los anillos aromáticos que conforman el carbón activo y a otras estructuras carbonosas les confiere la capacidad de establecer interacciones electrostáticas o de intercambio electrónico por acción de los electrones π.12 Por lo tanto, resulta razonable modificar químicamente la superficie del carbón activo, debido a que se mejoran las propiedades de adsorción, en este contexto la funcionalización de los carbones activos se realiza principalmente empleando métodos de impregnación, gasificación y oxidación utilizando ácidos fuertes como HNO3 y bases como NH4OH o amoniaco gaseoso.10 Desde el punto de vista teórico, Terzyk y colaboradores13 estudiaron la adsorción de gases sobre estructuras tipo fullereno utilizando métodos de Monte carlo, revelando que estas estructuras simulan de manera adecuada el comportamiento del carbón activo. Ya que la reactividad de las superficies carbonosas es aún poco entendida, en el presente trabajo se estudió la reactividad química de los carbones activos funcionalizados y sin funcionalizar por medio de métodos de estructura electrónica utilizando descriptores locales y globales en el marco conceptual de la Teoría del Funcional de la Densidad (DFT, por sus siglas en inglés).
FUNDAMENTOS TEÓRICOS La DFT, fundamentada en los teoremas de Hohenberg y Kohn14 es de gran utilidad para estudiar la reactividad/selectividad de los sistemas químicos a nivel atómico y molecular. Para obtener expresiones matemáticas que representen los parámetros de reactividad y permitan su clara interpretación, el funcional de energía de la densidad electrónica E[ρ]15 es minimizado teniendo en cuenta las restricciones ∫ρ(r)dr = N y ρ(r) > 0 lo que conduce a la ecuación (1). 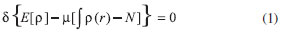 donde µ es un multiplicador de Lagrange conocido como potencial químico electrónico,16 relacionado con el concepto de electronegatividad propuesto por Pauling: µ = -χ.17 La ecuación (1) se resuelve por métodos variacionales conduciendo a la ecuación (2), llamada ecuación fundamental de la DFT. 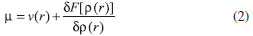 v(r) es el potencial externo debido al núcleo16 y F[ρ(r)] es el funcional universal, que es independiente del potencial externo, incluye los términos de energía cinética, energía de repulsión inter-electrónica e intercambio y correlación. La forma exacta del funcional universal es desconocida, debido a esto se utilizan funcionales aproximados.14 En DFT conceptual las variaciones de la energía E respecto a N y v(r) generan propiedades globales (reactividad del sistema) y locales (selectividad del sistema) respectivamente. El potencial químico µ y la dureza η se definen como:  En un sentido físico, el potencial químico mide la tendencia de los electrones a escapar de la nube electrónica, y la dureza puede ser entendida como la resistencia al cambio de la distribución electrónica del sistema.18 Desde el punto de vista práctico el potencial químico y la dureza pueden obtenerse a partir de la afinidad electrónica (AE) y la energía de ionización (EI) mediante las ecuaciones (5a) y (5b).9,14,17-27 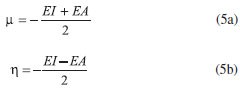 Mediante las energías de los orbitales HOMO (orbital ocupado de mayor energía) y LUMO (orbital desocupado de menor energía) se pueden obtener expresiones aproximadas para las ecuaciones (5a) y (5b) basadas en el teorema de Koopmans y la aproximación de diferencias finitas de tres puntos:27  εHOMO y εLUMO representan las energías de los orbitales HOMO y LUMO. La suavidad (S), es el concepto inverso de la dureza y constituye un concepto útil para la predicción de la reactividad química:26  Las moléculas blandas sufren cambios en su densidad electrónica más fácilmente que las moléculas duras y por ende son más reactivas.26 Un concepto más específico en cuanto a la reactividad global de un sistema fue introducido por Parr y colaboradores28,29 denominado índice de electrofilicidad global ω. Este índice mide la energía de estabilización cuando el sistema se encuentra saturado por electrones provenientes de los alrededores.30,31  El concepto de electrofilicidad puede extenderse al hablar de poder de electro-donación ω- y poder de electro-aceptación30ω+. 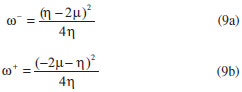 Los valores altos de ω+ indican una elevada capacidad para aceptar carga, mientras que valores bajos de ω+ hacen referencia a que el sistema se comporta como un buen donador de electrones.31 Los descriptores locales de la reactividad dan información sobre la selectividad de un sitio dentro de una molécula.16 La función de Fukui (FF) predice la capacidad de un sitio en una molécula para donar o aceptar electrones, por lo tanto, valores altos de f(r) dan cuenta de una mayor reactividad para un sitio determinado. FF es interpretada como una medida de la sensibilidad del potencial químico de un sistema ante un cambio en el potencial externo:29,32 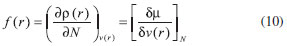 La ecuación (10) presenta un problema de discontinuidad al ser aplicada en átomos y moléculas, por lo tanto se recurre a una aproximación de diferencias finitas y de un esquema de condensación para cuantificar FF de manera práctica. Algunos esquemas de condensación utilizan análisis de población para obtener las FF, en este escenario, para una interacción con nucleófílos f+ = [qk(N + 1) - qk(N)], y para reacciones con electrófilos f- = [qk(N) - qk(N - 1)]. La selectividad de un sitio molecular hacia una reacción radicalaria se asocia con el término f0 = [qk(N + 1) - qk(N - 1)]. En estas expresiones qk representa la carga del átomo k en el sistema molecular. 9,14,17,18,24-29,32,33 En el presente trabajo, las funciones de Fukui nucleofílica y electrofílica condensadas fueron calculadas respectivamente por:34 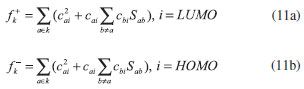 donde cai son los coeficientes de la combinación lineal de orbitales atómicos (LCAO, por sus siglas en inglés), y Sab son los elementos de la matriz de solapamiento. A partir de las funciones de Fukui, se define la suavidad local21 Skα, como:  donde α hace referencia a la naturaleza del ataque (nucleofílico (α = +), electrofílico (α = -), o radical (α = 0) y fkα es la función de Fukui descrita anteriormente. Por otro lado, los conceptos introducidos por Chattaraj,35 el índice de electrofilicidad local ωk+ y el índice de nucleofìlicidad local ωk-, fueron calculador por:  El valor más alto de ωk+ se atribuye al sitio más electrofílico de una molécula, mientras que los sitios con los valores más altos de ωk- son los más nucleofílicos. La funcionalización del carbón implica la presencia de grupos funcionales, debido a esto en el presente trabajo se utilizaron descriptores dentro del contexto de la aproximación de grupo:9,14,16-29,32,33,36-44  Aquí, ωgα y Sgαson la filicidad y suavidad de grupo respectivamente,45 n corresponde al número de átomos vecinos al centro de reacción y los superíndices α= +/-/0, se refieren al ataque nucleofílico, electrofílico y radical respectivamente.
MODELADO DE LA ESTRUCTURA DEL CARBON ACTIVO La estructura del carbón activo es un tema ampliamente discutido debido a que no se conoce con certeza cuál es su verdadera estructura atómica. Algunos estudios realizados por Franklin46 sugieren que el carbón activo se deriva de un tipo de carbón no-grafitizable (no puede ser convertido en grafito incluso si es calentado a 3000 ºC). Este carbón no grafitizable está compuesto por láminas grafíticas desordenadas y presenta un elevado grado de microporosidad. De igual manera, Harris y colaboradores47 estudiaron la superficie del carbón activo a través de microscopia electrónica de transmisión con aberración corregida, mostrando que el carbón no grafitizable está compuesto por arreglos pentagonales y hexagonales similares a los fullerenos. En este sentido, la evidencia experimental sugiere que el carbón activo posee una estructura similar a la de los fullerenos y por lo tanto este modelo permite entender de manera adecuada los fenómenos de adsorción en comparación con el modelo tradicional basado en láminas grafíticas.13,48 Sin embargo, en la literatura científica las investigaciones teóricas de procesos adsorción con carbón activo generalmente usan como sistema modelo para los cálculos computacionales anillos hexagonales fusionados tales como; pireno, coroneno, antraceno, naftaleno y grafeno (láminas grafíticas).49-53 En este trabajo se utilizó como sistema modelo para el carbón activo una estructura fullerénica (Figura 1a), formada por 16 fragmentos hexagonales y uno pentagonal (C48H16). En un estudio anterior Cam y colaboradores54 reportaron que el uso de una estructura del tipo fullereno para simular fenómenos de adsorción sobre carbón activo proporciona buenos resultados. De ahí que el uso de estructuras tipo fullereno en la simulación del comportamiento del carbón activo es adecuado.
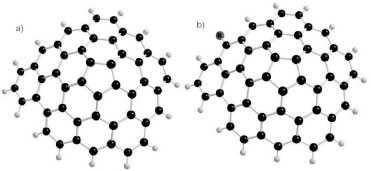 Figura 1. a) Modelo de la estructura de carbón activo. b) Plantilla funcionalizada con grupo genérico R, R1 = NH2, R2 = OH, R3 = H, R4 = CO-R3, R5 = CO-R2, R6 = CO-R1
METODOLOGÍA Para estudiar la química superficial del carbón activo se utilizaron los descriptores globales y locales de la teoría del funcional de la densidad (DFT, por sus siglas en ingles). El estudio de la reactividad de carbón activo se llevó a cabo funcionalizando la plantilla en la Figura 1 con los grupos funcionales unidos en los bordes de la plantilla como se muestra en la Figura 2, donde Rn (1<n<6) representa un grupo funcional y CO indica la presencia del grupo carbonilo en su estructura.
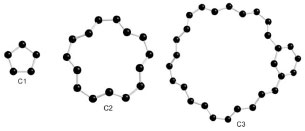 Figura 2. Secciones escogidas para el estudio de la reactividad a nivel local, sección interna (C1), sección intermedia (C2) y sección periférica (C3)
Los cálculos de optimización se llevaron a cabo empleando el paquete computacional Gaussian03 (rev E.01)55 el funcional de gradiente conjugado de Perdew, Burke, y Ernzerhof (PBE)56 que proporciona buenos resultados en el cálculo de las geometrías de equilibrio para compuestos tipo fullereno.57,58 Algunos estudios realizados sobre la reactividad de sistemas carbonosos del tipo fullereno utilizan conjuntos de bases gaussianas como 6-31G(d),59 no obstante en este estudio se utilizó la base doble ζ polarizada 6-31G (d, p) debido a que este tipo de bases han mostrado que describen adecuadamente la estructura electrónica de estos sistemas carbonosos.60 El tratamiento de la reactividad a nivel global se abordó bajo el esquema de koopmans donde las energías HOMO y LUMO fueron calculadas a punto simple utilizando el método de Hartree-Fock61 considerando los efectos del solvente a través del modelo del continuo polarizable (PCM, por sus siglas en inglés)62 usando una constante dieléctrica de 78.5 a una temperatura de 25 ºC, debido a que la mayoría de los procesos de adsorción sobre carbón activo se realizan en fase acuosa y estudios teóricos muestran resultados razonable cuando se utiliza este modelo de solvatación en sistemas fullerenicos y carbonosos.57,63
Los descriptores de grupo fueron utilizados para estudiar la reactividad del carbón activo a nivel local, utilizando el programa AOMix64 para calcular las funciones de Fukui, teniendo en cuenta los fragmentos presentes la sección interna de la estructura del carbón activo (C1), en la sección intermedia (C2) y en la sección periférica (C3) como los grupos escogidos para analizar la reactividad (Figura 3).
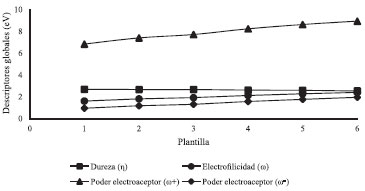 Figura 3. Descriptores globales de reactividad
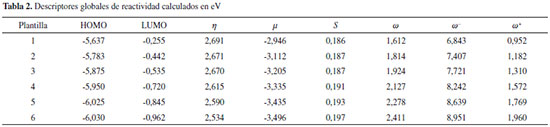
RESULTADOS Y DISCUSIÓN Parámetros geométricos de la plantilla utilizada A diferencia de los sistemas grafiticos cuya geometría es plana (es decir, Longitud de enlace C-C = 1,42 y ángulos de enlace 120º),65,66 la estructura carbonosa utilizada en este trabajo presenta una geometría levemente distorsionada con distancias de enlace C-C promedio de 1,4 y ángulos de enlace entre 116º y 122º, debido a la presencia del anillo pentagonal que ejerce una tensión anular sobre la estructura. Este sistema no presenta un carácter aromático pero si es resonante. En la Tabla 2, se muestran los descriptores globales de reactividad calculados para todas las plantillas de interés. Los descriptores que explican adecuadamente el comportamiento reactivo de estos sistemas se muestran en la Figura 3.
La funcionalización de las plantillas con los grupos R1 y R2 tiene un efecto considerable en la reactividad, como se observa en la Figura 3 los valores de dureza asociados a las estructuras donde R1 y R2 están presentes resultaron ser mayores en comparación con el valor obtenido para R3, lo que indica que la presencia de estos aumenta la estabilidad de la estructura del carbón activo. Por otro lado, los índices de electrofilicidad para las plantillas funcionalizadas con R1 y R2 presentan disminuciones apreciables en contraste con la plantilla que contiene R3, lo que supone que el carácter electrofílico asociado a la estructura donde R3 está presente es mayor comparado con la presencia de R1 y R2 en dicha estructura. Sin embargo, pese a su baja reactividad las plantillas que contienen grupos R1 y R2 poseen un comportamiento nucleofílico apreciable ya que para estos se observaron los menores valores de ω-, lo que permite decir que a nivel global el efecto de la funcionalización de las plantillas de carbón activo con R1 y R2 aumenta su carácter nucelofilico. La presencia de pares libres de electrones en los grupos R1 y R2 le da estos un carácter nucleofílico debido a que pueden donar fácilmente dichos pares electrónicos. El grupo R1 aporta un carácter nucleofílico mayor en comparación con R2 lo que indica que la tendencia nucleofilica de la plantilla de carbón activo a nivel global es mayor cuando se funcionaliza con R1 que con R2, sin embargo R2 presenta una reactividad mayor que R1. Los grupos R4, R5 y R6 se caracterizan porque contienen un grupo carbonilo en su estructura, dicho grupo está unido a R3, R2 y R1 respectivamente. La funcionalización del carbón activo con los grupos R4, R5 y R6 produce un aumento en la reactividad a nivel global, ya que para estos se observaron los menores valores de dureza. La plantilla que contiene a R6 es la más reactiva y la que tiene el carácter electrofílico más alto ya que su índice de electroflicidad es mayor en comparación con el resto de las plantillas. Las diferencias en la reactividad de las plantillas asociadas a estos sustituyentes puede explicarse teniendo en cuenta la naturaleza del grupo que está unido al carbonilo, el grupo R6 contiene a su vez un grupo R1 que aporta mucha más reactividad a la plantilla de carbón activo en comparación con R2 y R1 que tienen un efecto estabilizante sobre el grupo carbonilo en R5 y R4, por lo que su reactividad es menor que la del grupo R6. En resumen, la presencia del grupo carbonilo aumenta la reactividad de la estructura del carbón activo, haciéndolo más propenso a reaccionar con moléculas de naturaleza nucleófila, mientras que la presencia de grupos con pares de electrones libres como R1 y R2 disminuyen la reactividad de las plantillas, pero aumentan su selectividad hacia especies químicas eletrofilicas. En las Figuras 4 y 5 se muestran los descriptores de grupo calculados para las plantillas, se tuvieron en cuenta la electrofilicidad y la nucleofilicidad de grupo, también la suavidad de grupo hacia ataques electrofílicos y nucleofílicos.
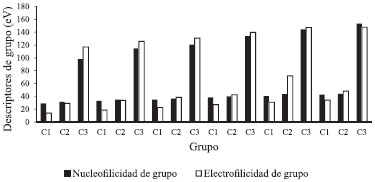 Figura 4. Descriptores nucleofilicidad y electrofilicidad de grupo para cada plantilla (desde 1 hasta 6)
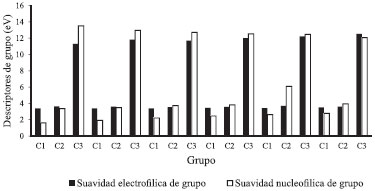 Figura 5. Descriptores de suavidad de grupo para cada plantilla (desde 1 hasta 6)
A nivel de grupo, la plantilla sin funcionalizar presenta tendencias similares a la descripción global de la reactividad. Las secciones C2 y C3 tienen un carácter electrofílico debido a que para estos se obtuvieron mayores valores de ωg+ en comparación con ωg-, sin embargo para C1 el comportamiento nucleofílico es predominante, lo que también se observa en los valores de suavidad de grupo obtenidos. Esta variedad de sitios electrofílicos y nucleofílicos le confiere propiedades interesantes a los carbones activos debido a que puede establecer interacciones con especies químicas de naturaleza nucleofilica o electrofilica. La funcionalización con R1 y R2 produce una disminución en los valores de ωg+ y ωg-lo que indica que el efecto estabilizante que producen estos grupos también es observado a nivel local. Sin embargo, las tendencias observadas a nivel global para R1 y R2 en cuestión de la nucleofilicidad de las plantillas, no son observadas a nivel local ya que la sección C1 aunque presenta un carácter nucleofílico, es menor cuando se compara con la plantilla sin funcionalizar, sin mencionar que C2 y C3 tienen un comportamiento electrofílico. Los valores de suavidad de grupo para las secciones C1 C2 y C3 en plantillas funcionalizadas con los grupos R4, R5y R6, resultaron ser mayores en comparación con los obtenidos para las plantillas sin funcionalizar, lo que indica que estos grupos funcionales aumentan la reactividad del carbón activo a nivel local, las secciones C2 y C3 presentan un carácter electrofílico y C1 un carácter nucleofílico, es decir que se conservan las tendencias obtenidas para la funcionalización con R1 y R2. Lo anterior supone que el efecto de la presencia del grupo carbonilo no es observable para la sección C1 debido a que esta posee un carácter nucleofílico y no electrofílico. No obstante para la plantillas funcionalizada con el grupo R4 se observa que Sg+<Sg-, lo que implica que en esta plantilla el grupo C3 es más propenso a establecer interacciones con moléculas de naturaleza electrofilica. La reactividad del carbón activo a nivel local muestra el efecto que tiene la adición de grupos funcionales a su estructura, el orden de reactividad observado tanto a nivel local como a nivel local fue R6> R5> R4> R3>R2> R1. Por un lado los grupos R1 y R2 que se comportan como donantes de electrones disminuyen la reactividad de las plantillas y tienen un efecto estabilizante sobre estas, los grupos R4, R5 y R6 que tienden a comportarse como extractores de electrones aumentan la capacidad del carbón activo de establecer interacciones de tipo covalente con una variedad de moléculas tanto electrofílicas como nucleofílicas.
CONCLUSIONES La reactividad química de carbones activados fue analizada mediante descriptores electrónicos calculados al nivel HF/6-31G (d, p). Los resultados obtenidos en el presente trabajo representan un esquema razonable para explicar el comportamiento químico de carbones activados a partir de los descriptores de la reactividad química.se encontró que la presencia de grupos -CHO, -COOH, y -CONH2 aumentan la reactividad carbón activo a nivel global, mientras que los grupos -NH2, y -OH tienden a reducirla produciendo un efecto estabilizante sobre estas. Cabe resaltar que el efecto del grupo carbonilo (CO) en los grupos -CHO, -COOH, y -CONH2 juega un papel importante en el aumento de la electrofilicidad de las plantillas donde estos grupos están presentes. Las tendencias de reactividad observadas a nivel global y local para los sistemas carbonosos investigados fueron similares, dado que el comportamiento electrofílico fue predominante sobre el comportamiento nucleofílico. Las secciones C2 y C3 presentaron un carácter electrofílico mientras que para C1 se observó un comportamiento netamente nuclefilico. A nivel local la funcionalización con los grupos -CHO, -COOH, y -CONH2 aumenta el comportamiento electrofílico de las secciones C2 y C3 y el comportamiento nucleofílico de C1, mientras que para las plantillas funcionalizadas con -NH2, y -OH esta tendencias disminuyeron. Al presentar características nucleofílicas y electrofílicas, el carbón activo puede potencialmente establecer interacciones covalentes con diversos tipos de adsorbato, convirtiéndolo en un material adsorbente versátil. La información reportada aquí a partir de los descriptores de reactividad de grupo, podría ayudar a entender el efecto de la funcionalización de los carbones activos, y por lo tanto a establecer el tipo de carbón activo más adecuado para absorber una molécula específica.
AGRADECIMIENTOS Al Centro de Investigación Universidad de Córdoba (CIUC) por la financiación de este proyecto y a todos mis amigos y compañeros que confiaron en mi dedicación.
REFERENCIAS 1. Brasquet, C.; Le Cloirec, P.; Carbon 1997, 35, 1307. DOI: http://dx.doi.org/10.1016/S0008-6223(97)00079-1 2. Lambert, T. W.; Holmes, C. F.; Hrudey, S. E.; Water Res. 1996, 30, 1411. DOI: http://dx.doi.org/10.1016/0043-1354(96)00026-7 3. Cam, L. M.; Van Khu, L.; Ha, N. N.; J. Mol. Model. 2013, 19, 4395. DOI: http://dx.doi.org/10.1007/s00894-013-1950-5 4. Xu, D.; Xiao, P.; Zhang, J.; Li, G.; Xiao, G.; Webley, P. A.; Zhai, Y.; Chem. Eng. J. 2013, 230, 64. DOI: http://dx.doi.org/10.1016/j.cej.2013.06.080 5. Dabrowski, A.; Podkościelny, P.; Hubicki, Z.; Barczak, M.; Chemosphere 2005, 58, 1049. DOI: http://dx.doi.org/10.1016/j.chemosphere.2004.09.067 PMID: 15664613 6. Amari, D.; Lopez Cuesta, J. M.; Nguyen, N. P.; Jerrentrup, R.; Ginoux, J. L.; J. Therm. Anal. 1992, 38, 1005. DOI: http://dx.doi.org/10.1007/BF01979434 7. Huang, W.; Zhai, H.-J.; Wang, L.-S.; J. Am. Chem. Soc. 2010, 132, 4344. DOI: http://dx.doi.org/10.1021/ja905756c PMID: 20218602 8. Minot, C.; Markovits, A.; J. Mol. Struct. THEOCHEM 1998, 1280, 119. DOI: http://dx.doi.org/10.1016/S0166-1280(97)00235-2 9. Martínez, J.; Moncada, J.; Larenas, J.; J. Mol. Model. 2010, 16, 1825. DOI: http://dx.doi.org/10.1007/s00894-009-0638-3 PMID: 20217163 10. Vargas, D. P.; Giraldo, L.; Moreno-Piraján, J. C.; Adsorption 2012, 19, 323. DOI: http://dx.doi.org/10.1007/s10450-012-9454-7 11. varrete, L. F.; Giraldo, L.; Moreno, J. C.; Rev. Colomb. Quim. 2006, 35, 215. 12. Pichler, T.; Knupfer, M.; Golden, M.; Fink, J.; Phys. Rev. Lett. 1998, 4729. 13. Terzyk, A. P.; Furmaniak, S.; Gauden, P. A.; Harris, P. J. F.; Wloch, J.; Kowalczyk, P.; J. Phys.: Condens. Matter 2007, 406208, 0. 14. Hohenberg, P.; Kohn, W.; Phys. Rev. 1964, 136, B864. DOI: http://dx.doi.org/10.1103/PhysRev.136.B864 15. Chermette, H.; J. Comput. Chem. 1999, 20, 127. DOI: http://dx.doi.org/10.1002/(SICI)1096-987X(19990115)20:1<129::AID-JCC13>3.0.CO;2-A 16. Parr, R.; Yang, W.; J. Am. Chem. Soc. 1994, 106, 4049. DOI: http://dx.doi.org/10.1021/ja00326a036 17. Lackner, K.; Zweig, G.; Phys. Rev. D 1987, 36, 562. DOI: http://dx.doi.org/10.1103/PhysRevD.36.562 18. Pearson, R.; Acc. Chem. Res. 1993, 26, 250. DOI: http://dx.doi.org/10.1021/ar00029a004 19. Maynard, A.; Huang, M.; Proc. Natl. Acad. Sci. U. S. A. 1998, 95, 11578. DOI: http://dx.doi.org/10.1073/pnas.95.20.11578 PMID: 9751708 20. Vivas-Reyes, R.; Núñez-Zarur, F.; Org. Electron. 2008, 9, 625. DOI: http://dx.doi.org/10.1016/j.orgel.2008.04.004 21. Broeckaert, L.; Moens, J.; Roos, G.; J. Phys. Chem. 2008, 112, 12164. DOI: http://dx.doi.org/10.1021/jp802846q 22. Fievez, T.; Weckhuysen, B.; J. Phys. Chem. C 2009, 11, 19905. DOI: http://dx.doi.org/10.1021/jp903913m 23. Ayers, P.; Morrison, R.; Roy, R.; J. Chem. Phys. 2002, 116, 8731. DOI: http://dx.doi.org/10.1063/1.1467338 24. Yang, W.; Mortier, W.; J. Am. Chem. Soc. 1986, 108, 5708. DOI: http://dx.doi.org/10.1021/ja00279a008 PMID: 22175316 25. Cárdenas, C.; Rabi, N.; Ayers, P.; J. Phys. Chem. A 2009, 113, 8660. DOI: http://dx.doi.org/10.1021/jp902792n PMID: 19580251 26. Kulkarni, B.; Tanwar, A.; Pal, S.; J. Chem. Sci. 2007, 119, 489. DOI: http://dx.doi.org/10.1007/s12039-007-0062-0 27. Moncada, J.; Morán, G.; Quim. Nova 2008, 31, 1255. DOI: http://dx.doi.org/10.1590/S0100-40422008000500057 28. Parr, R.; Szentpály, L.; Liu, S.; J. Am. Chem. Soc. 1999, 121, 1922. DOI: http://dx.doi.org/10.1021/ja983494x 29. Parr, R.; Yang, W.; J. Am. Chem. Soc. 1984, 106, 4049. DOI: http://dx.doi.org/10.1021/ja00326a036 30. Orozco-Valencia, Á. U.; Vela, A.; J. Mex. Chem. Soc. 2012, 56, 294. 31. Glossman-Mitnik, D.; Procedia Comput. Sci. 2013, 18, 816. DOI: http://dx.doi.org/10.1016/j.procs.2013.05.246 32. Dronskowski, R.; J. Am. Chem. Soc. 1992, 114, 7230. DOI: http://dx.doi.org/10.1021/ja00044a039 33. Galembeck, S.; Caramori, G.; Quim. Nova 2003, 26, 957. DOI: http://dx.doi.org/10.1590/S0100-40422003000600031 34. Martínez-Araya, J. I.; Salgado-Morán, G.; Glossman-Mitnik, D.; J. Chem. 2013, 2013, 1. DOI: http://dx.doi.org/10.1155/2013/959761 35. Chattaraj, P.; Maiti, B.; Sarkar, U.; J. Phys. Chem. A 2003, 107, 4973. DOI: http://dx.doi.org/10.1021/jp034707u 36. Krishnamurty, S.; Pal, S.; J. Phys. Chem. A 2000, 104, 7639. DOI: http://dx.doi.org/10.1021/jp0010280 37. Kolandaivel, P.; Praveena, G.; Selvarengan, P.; J. Chem. Sci. 2005, 117, 591. DOI: http://dx.doi.org/10.1007/BF02708366 38. Chattaraj, P.; Giri, S.; Annu. Rep. Prog. Chem., Sect. C: Phys. Chem. 2009, 5, 13. DOI: http://dx.doi.org/10.1039/b802832j 39. Mendez, F.; Gazquez, J.; J. Am. Chem. Soc. 1994, 116, 9298. DOI: http://dx.doi.org/10.1021/ja00099a055 40. Mendoza-Huizar, L.; Rios-Reyes, C.; J. Mex. Chem. Soc. 2011, 55, 142. 41. Cárdenas, C.; Tiznado, W.; J. Phys. Chem. A 2011, 115, 2325. DOI: http://dx.doi.org/10.1021/jp109955q PMID: 21351729 42. Li, Y.; Evans, J.; J. Am. Chem. Soc. 1995, 117, 7756. DOI: http://dx.doi.org/10.1021/ja00134a021 43. Singh, R.; Kumar, A.; Tiwari, R.; Spectochim Acta Part A Mol. 2012, 9, 295. DOI: http://dx.doi.org/10.1016/j.saa.2012.02.086 44. Parthasarathi, R.; Padmanabhan, J.; Chem. Phys. Lett. 2004, 394, 225. DOI: http://dx.doi.org/10.1016/j.cplett.2004.07.002 45. López, J. M., Ensuncho; Adolfo E, Robles, J. ;Quim Nova 2013, 36, 1308. DOI: http://dx.doi.org/10.1590/S0100-40422013000900006 46. Franklin, R. E.; Proc. R. Soc. A Math. Phys. Eng. Sci. 1951, 209, 196. DOI: http://dx.doi.org/10.1098/rspa.1951.0197 47. Harris, P. J. F.; Liu, Z.; Suenaga, K.; J. Phys.: Condens. Matter 2008, 20, 362201. 48. Harris, P. J. F.; J. Mater. Sci. 2013, 48, 565. DOI: http://dx.doi.org/10.1007/s10853-012-6788-1 49. Sasmaz, E.; Kirchofer, A.; Jew, A. D.; Saha, A.; Abram, D.; Jaramillo, T. F.; Wilcox, J.; Fuel 2012, 99, 188. DOI: http://dx.doi.org/10.1016/j.fuel.2012.04.036 50. Padak, B.; Wilcox, J.; Carbon 2009, 47, 2855. DOI: http://dx.doi.org/10.1016/j.carbon.2009.06.029 51. Hernández-Valdés, D.; Enriquez-Victorero, C.; Pizarro-Lou, L.; Turiño-Pérez, D.; Ducat-Pagés, L.; Arias, M.; Jáuregui-Haza, U.; J. Radioanal. Nucl. Chem. 2015. DOI: http://dx.doi.org/10.1007/s10967-015-4022-8 52. Wu, L.; Sitamraju, S.; Xiao, J.; Liu, B.; Li, Z.; Janik, M. J.; Song, C.; Chem. Eng. J. 2014, 242, 211. DOI: http://dx.doi.org/10.1016/j.cej.2014.02.067 53. Enriquez-Victorero, C.; Hernández-Valdés, D.; Montero-Alejo, A. L.; Durimel, A.; Gaspard, S.; Jáuregui-Haza, U.; J. Mol. Graph. Model. 2014, 51, 137. DOI: http://dx.doi.org/10.1016/j.jmgm.2014.05.004 PMID: 24907933 54. Cam, L. M.; Van Khu, L.; Ha, N. N.; J. Mol. Model. 2013, 19, 4395. DOI: http://dx.doi.org/10.1007/s00894-013-1950-5 55. Gaussian 03, Revision E.01, Frisch, M. J.; Trucks, G. W.; Schlegel, H. B.; Scuseria, G. E.; Robb, M. A.; Cheeseman, J. R.; Montgomery, Jr., J. A.; Vreven, T.; Kudin, K. N.; Burant, J. C.; Millam, J. M.; Iyengar, S. S.; Tomasi, J.; Barone, V.; Mennucci, B.; Cossi, M.; Scalmani, G.; Rega, N.; Petersson, G. A.; Nakatsuji, H.; Hada, M.; Ehara, M.; Toyota, K.; Fukuda, R.; Hasegawa, J.; Ishida, M.; Nakajima, T.; Honda, Y.; Kitao, O.; Nakai, H.; Klene, M.; Li, X.; Knox, J. E.; Hratchian, H. P.; Cross, J. B.; Bakken, V.; Adamo, C.; Jaramillo, J.; Gomperts, R.; Stratmann, R. E.; Yazyev, O.; Austin, A. J.; Cammi, R.; Pomelli, C.; Ochterski, J. W.; Ayala, P. Y.; Morokuma, K.; Voth, G. A.; Salvador, P.; Dannenberg, J. J.; Zakrzewski, V. G.; Dapprich, S.; Daniels, A. D.; Strain, M. C.; Farkas, O.; Malick, D. K.; Rabuck, A. D.; Raghavachari, K.; Foresman, J. B.; Ortiz, J. V.; Cui, Q.; Baboul, A. G.; Clifford, S.; Cioslowski, J.; Stefanov, B. B.; Liu, G.; Liashenko, A.; Piskorz, P.; Komaromi, I.; Martin, R. L.; Fox, D. J.; Keith, T.; Al-Laham, M. A.; Peng, C. Y.; Nanayakkara, A.; Challacombe, M.; Gill, P. M. W.; Johnson, B.; Chen, W.; Wong, M. W.; Gonzalez, C.; and Pople, J. A.; Gaussian, Inc., Wallingford CT, 2004. 56. Perdew, J. P.; Burke, K.; Ernzerhof, M.; Phys. Rev. Lett. 1996, 77, 3865. DOI: http://dx.doi.org/10.1103/PhysRevLett.77.3865 PMID: 10062328 57. Hassani, F.; Tavakol, H.; Sens. Actuators, B 2014, 196, 624. DOI: http://dx.doi.org/10.1016/j.snb.2014.02.051 58. Sabirov, D. S.; Khursan, S. L.; Bulgakov, R. G.; J. Mol. Graph. Model. 2008, 27, 124. DOI: http://dx.doi.org/10.1016/j.jmgm.2008.03.006 PMID: 18455456 59. Peng, S.; Li, X. J.; Spectrochim. Acta, Part A 2009, 73, 67. DOI: http://dx.doi.org/10.1016/j.saa.2009.01.016 60. Dawid, A.; Górny, K.; Gburski, Z.; Spectrochim. Acta, Part A 2015, 136, 1993. DOI: http://dx.doi.org/10.1016/j.saa.2014.08.023 61. Vargas, R.; Garza, J.; Cedillo, A.; J. Phys. Chem. A 2005, 109, 8880. DOI: http://dx.doi.org/10.1021/jp050080z PMID: 16834292 62. Tomasi, J.; Mennucci, B.; Cammi, R.; Chem. Rev. 2005. DOI: http://dx.doi.org/10.1021/cr020378a PMID: 16092826 63. Beheshtian, J.; Peyghan, A. A.; Bagheri, Z.; Appl. Surf. Sci. 2012, 258, 8980. DOI: http://dx.doi.org/10.1016/j.apsusc.2012.05.134 64. Gorelsky, S. I.; AOMix: Program for Molecular Orbital Analysis, 2014. 65. Charlier, J. C.; Michenaud, J. P.; Gonze, X.; Phys. Rev. B 1992, 46, 4531. DOI: http://dx.doi.org/10.1103/PhysRevB.46.4531 66. Comelli, G.; Stöhr, J.; Jark, W.; Pate, B. B.; Phys. Rev. B 1988, 37, 4383. DOI: http://dx.doi.org/10.1103/PhysRevB.37.4383 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access