Artigo
|
|
| Partição de proteínas de soro de leite em sistemas aquosos bifásicos baseados em líquidos iônicos Partitioning of whey proteins using aqueous two-phase systems with ionic liquids |
|
Benôit MichelI; Mateus Tomaz NevesI; Rita de Cássia Superbi de SousaI,*; Marcelo Martins das ChagasI; Bruna Amaral MartinsI; Jane Sélia dos Reis CoimbraII
IDepartamento de Química, Universidade Federal de Viçosa, 36570-000 Viçosa - MG, Brasil Recebido em 13/03/2015 *e-mail: rita.sousa@ufv.br In this work, we used an aqueous two-phase system (ATPS) consisting of the ionic liquid [C4mim][Cl] and the salt K2HPO4 to partition α-lactalbumin, β-lactoglobulin, and lactoferrin whey proteins. Extraction efficiency values above 87% indicate that the proteins primarily migrated to the ionic liquid-rich phase (top phase). Partition coefficient values ranged from 6.17 to 8.93 for a-lactalbumin, from 22.80 to 34.55 for β-lactoglobulin, and from 26.46 to 40.06 for lactoferrin. Therefore, the saline ATPS with the ionic liquid examined in this study can be considered to be a promising alternative for extracting whey proteins. INTRODUÇÃO O soro de leite é o coproduto mais abundante da indústria de laticínios e é rico em proteínas de alto valor nutricional, funcional e tecnológico. Entre essas, destacam-se a alfa-lactoalbumina (α-la), a beta-lactoglobulina (β-lg) e a lactoferrina (Lf). A β-lactoglobulina (β-lg) é a proteína presente em maior quantidade no soro de leite bovino (cerca de 50% do total das proteínas do soro) destacando-se por suas propriedades nutricionais, funcionais e técnicas de grande aplicação na indústria de alimentos, como capacidade de emulsificação, formação de espuma/retenção de ar, geleificação, ligação de aroma e sabor, formação de filmes e cápsulas protetoras.1 A alfa-lactalbumina (α-la), que também é encontrada no leite humano, pode atuar na prevenção de úlcera gástrica2 e possui elevado teor de triptofano, sendo então capaz de elevar o triptofano sanguíneo,3 entre outras vantagens e aplicações. A lactoferrina (Lf) é uma glicoproteína que pertence à família de transferrinas (transportadores de ferro), com propriedades antimicrobianas associadas à sua capacidade quelante de ferro. Em contextos clínicos pediátricos, tem potencial para atuar em diversas funções biológicas que incluem o transporte de íons, atividades antifúngica, anti-inflamatória e antiviral, efeitos de imunomodulação e a cicatrização de feridas.4 As indústrias farmacêutica e de alimentos usam proteína, com alto grau de pureza, para múltiplas aplicações. Com as técnicas tradicionais de extração e purificação, o custo final do composto purificado é elevado; em torno de 50 a 80% do preço de venda é devido aos custos dos processos de separação e purificação. Em adição, os sistemas usuais demandam longos tempos de extração e podem desnaturar algumas das biomoléculas, reduzindo a atividade biológica.5 Nos últimos anos, observa-se o aumento da procura por proteínas de soro de leite em função do interesse crescente da população por suplementos alimentares de alta qualidade. A recuperação e a valorização dessas proteínas são, portanto, de interesse nos campos acadêmico e industrial. A operação unitária extração líquido-líquido (ELL) é utilizada nos processos de separação e purificação de biomoléculas. No entanto, biomoléculas como proteínas, organelas e fragmentos celulares, podem sofrer danos quando submetidas a ELL, no caso do uso de solventes orgânicos. Logo, a vertente da ELL utilizando sistemas aquosos bifásicos (SAB) surgiu como uma técnica alternativa e aplicável à separação de compostos de origem biológica.6 Esta técnica apresenta vantagens como curto tempo de processo, baixo consumo de energia e possibilidade de aplicação em grande escala.7,8 Adicionalmente, as duas fases dos SAB são formadas majoritariamente por água, fornecendo assim um ambiente ameno para as biomoléculas, o que evita que ocorram mudanças em suas estruturas e perda das suas atividades biológicas.9 Os SAB se formam quando um polímero solúvel em água e uma substância de baixa massa molar (normalmente um sal inorgânico) ou dois tipos de polímeros solúveis em água se dissolvem em solução aquosa acima de suas concentrações críticas.10 No entanto, a maioria dos polímeros utilizados nos SAB convencionais apresenta alta viscosidade e as soluções formadas são geralmente opacas, interferindo nas técnicas de análises instrumentais usadas na quantificação dos compostos extraídos do sistema.11 Portanto, nos últimos anos, a utilização de SAB baseados em líquidos iônicos (LI) para substituir os solventes orgânicos convencionais constitui uma área de pesquisa em franco crescimento. Estudos iniciais foram conduzidos por Gutowski et al.,12 que demonstraram que a adição de sais inorgânicos (como o K3PO4) a soluções aquosas de LI (baseados no cátion imidazólio) induz a formação de SAB. Líquidos iônicos são sais compostos por íons de grandes dimensões, um cátion orgânico relativamente grande e um ânion orgânico ou inorgânico relativamente pequeno, que não formam uma rede cristalina bem definida, e assim permanecem líquidos à temperatura ambiente. Apresentam uma fraca interação interiônica, a qual resulta em uma baixa energia do retículo cristalino e baixa temperatura de fusão, o que os difere dos sais comuns.13 Os LI têm propriedades únicas, tais como: não-inflamáveis, pressão de vapor negligenciável, forte poder de solubilização e estabilidade química e térmica.14 Encontram aplicação química e bioquímica nas sínteses químicas, transformações biocatalíticas, projetos de dispositivos eletroquímicos e processos de separação.15,16 Assim, SAB baseados em LI estão sendo aplicados em processos de biopurificação e bioextração com as vantagens de maior estabilidade das biomóleculas alvo (normalmente proteínas e enzimas) e maiores taxas de recuperação em comparação aos SAB tradicionais formados por polímero e sal.5,7,8,17-21 A extração de proteínas em SAB baseados em LI foi primeiramente reportada por Du et al.,17 que empregaram SAB compostos por cloreto de 1-butil-3-metilimidazólio ([C4mim][Cl]) e sal de fosfato (K2HPO4) na extração de albumina de soro bovino (BSA) de fluidos biológicos. Pei et al.5 estudaram a partição de BSA e tripsina em SAB compostos por brometo de 1-butil-3-metilimidazólio [C4mim][Br] e K2HPO4. Ventura et al.7 avaliaram a influência dos tipos de LI (formados por diferentes ânions combinados ao cátion imidazólio) na extração do aminoácido L-triptofano. Ventura et al.8 estudaram a separação e purificação da enzima lipase B, de Candida antarctica, com SAB constituídos por [C4mim][Cl] e K2HPO4. Ruiz-Angel et al.18 analisaram a partição de ovalbumina da clara de ovo em SAB de mesma composição. O LI [C4mim][Cl] também foi utilizado para a separação de vanilina, que é uma biomolécula utilizada em alimentos, bebidas e produtos farmacêuticos para produzir aromas satisfatórios.19 Passos et al.20 avaliaram a partição do aminoácido L-triptofano em SAB constituídos por [C4mim][Cl] e sais de citrato de potássio. Dreyer et al.21 determinaram coeficientes de partição para tripsina, lisozima, mioglobina e álcool desidrogenase em sistemas constituídos pelo LI Ammoeng TM 110 e tampão fosfato (pH 7,0). LI baseados no cátion fosfônio e K3PO4 foram empregados por Louros et al.22 na extração de aminoácidos. Pereira et al.23 estudaram SAB compostos por LI baseados nos cátions amônio e fosfônio, combinados com solução tampão de citrato de potássio/ácido cítrico (pH 7,0), para extração de BSA. No entanto, sistemas compostos por [C4mim][Cl] e sais de fosfato ainda não foram usados para a partição das proteínas α-la, β-lg e lactoferrina do soro de leite. Portanto, o objetivo deste trabalho foi estudar a extração das proteínas α-la, β-lg e lactoferrina, presentes no soro de leite, em SAB constituídos pelo cloreto de 1-butil-3-metilimidazólio [C4mim][Cl], água e o sal inorgânico fosfato de potássio dibásico (K2HPO4). O cátion 1-butil-3-metilimidazólio foi escolhido pois é um modelo de cátion de LI para o qual se tem dados gerais descritos em literatura.24-27 Além disso, o sal inorgânico baseado em fosfato foi selecionado pois os íons fosfatos atuam em sistemas biológicos.28
PARTE EXPERIMENTAL Materiais O líquido iônico cloreto de 1-butil-3-metilimidazólio, [C4mim][Cl] e o sal inorgânico fosfato de potássio dibásico anidro (K2HPO4) foram adquiridos da Sigma Aldrich (EUA). As proteínas α-la e β-lg foram doadas pela Davisco Food Ingredientes International (Eden Praire, USA). A lactoferrina foi cedida pela DMV International (Veghel, Holanda). Curvas binodais e dados de equilíbrio As curvas de equilíbrio foram obtidas por meio da titulação turbidimétrica, metodologia que consiste em titular uma determinada quantidade de líquido iônico gotejando a solução aquosa de sal inorgânico até que a mistura final se torne turva.29 Para tanto, inicialmente, soluções estoque do LI a 70% m/m e de sal com concentração total 40% m/m foram preparadas. Aproximadamente 1 g de solução de LI foi então transferida para um tubo de ensaio de vidro, que foi colocado no interior de um banho termostático (170M020, Matoli, Brazil) à temperatura de trabalho (25 ºC). Após atingir a temperatura desejada, alíquotas de 20 µL da solução de sal foram adicionadas com auxílio de uma micropipeta ao tubo e o sistema foi misturado com a ajuda de um agitador de soluções tipo vortex (Phoenix Luferco, AP 56). Após, foi deixado em repouso durante alguns minutos dentro do banho até que o turvamento da solução final pudesse ser notado (região bifásica). Em seguida, alíquotas de água ultrapura foram adicionadas para que o sistema voltasse ao estado límpido (região monofásica). Para cada ponto de turvamento identificado, a composição global do sistema (concentração de LI, água e sal) foi determinada a partir da massa total do sistema e das quantidades de sal, LI e água adicionadas antes da observação do turvamento. Este processo de titulação foi repetido até a obtenção de uma quantidade suficiente de pontos para a formação da curva binodal, de maneira que os pontos de turvamento foram considerados como pontos da curva de equilíbrio. Posteriormente, as curvas binodais obtidas experimentalmente foram correlacionadas às Equações 1, 2 e 3 utilizando o software SAS (SAS versão 9.0, Cary, NC, SAS Institute, Inc., 1998, licenciado para uso pela Universidade Federal de Viçosa). A Equação 1 representa o modelo matemático de Merchuk et al.30 usado para correlacionar pontos experimentais em sistemas contendo polímeros. A Equação 231 é outro modelo empírico também utilizado para correlacionar os dados binodais de sistemas polímero-sal. A Equação 3 foi utilizada por Han et al.32 para correlacionar os dados das binodais de sistemas formados por LI baseados no cátion imidazólio e sais orgânicos. 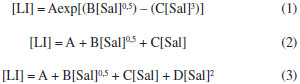 onde [LI] e [Sal] são as composições em fração mássica do líquido iônico e do sal, respectivamente; e A, B, C e D são os parâmetros de ajuste dos modelos. Linhas de amarração Após a determinação das curvas de equilíbrio, as linhas de amarração foram obtidas utilizando o método gravimétrico descrito por Merchuk et al.30 Foram utilizados quatro pontos globais. A partir das concentrações (% m/m) pré-definidas de sal, LI e água, quatro sistemas foram preparados através da pesagem dos componentes (BEL Engineering, M 214 A) para uma massa total de 10 g, em tubos de centrífuga graduados de volume de 15 mL. Os tubos foram agitados vigorosamente e então centrifugados (FANEM, Excelsa II 206 BL) a 3500 rpm por 5 minutos a fim de acelerar a separação de fases. Posteriormente, os tubos foram mantidos em repouso durante 12 horas em estufa (FANEM, 502, Brasil) a 25±1 ºC. Após o período especificado, os volumes das fases foram medidos e as fases foram, então, separadas e pesadas. Para determinação da concentração de cada componente (LI, sal e água) nas fases coletadas, um sistema de quatro equações (Equações 4-7) e quatro variáveis desconhecidas ([LI]LI, [LI]Sal, [LI]LI, [Sal]Sal) foi resolvido33 no software Engineering Equation Solver (EES), Comercial Version 6.883-3D (2003). 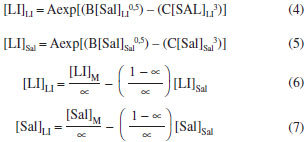 onde os índices subscritos LI, Sal e M representam a fase superior (rica em LI), a fase inferior (rica em sal) e a composição global da mistura, respectivamente. O parâmetro α é a razão entre a massa da fase superior e a massa total da mistura, característico da regra da alavanca. O comprimento da linha de amarração foi determinado por meio da Equação 8. 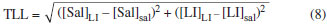 Partição das proteínas em SAB Os experimentos de partição foram realizados em tubos de centrífuga graduados de 15 mL para uma massa total de 12 g. Adicionou-se, aos tubos, uma massa de 10 mg de proteína. Os SAB foram preparados através da pesagem dos componentes e, então, agitados, centrifugados e mantidos em repouso em estufa (25±1 ºC), por 12 horas. Então as suas fases foram separadas, como descrito para o procedimento de determinação das linhas de amarração no item anterior. A temperatura de trabalho foi mantida a 25±1 ºC. Os experimentos foram realizados em duas repetições. O conteúdo de proteína em cada uma das fases foi determinado utilizando o método espectrofotométrico (Cary 50 Probe, Varian, EUA), por leitura direta da absorbância a 280 nm. No intuito de evitar a interferência do sal e do LI no método de quantificação das proteínas, amostras de controle (branco) constituídas apenas por LI, sal e água foram utilizadas em todas as leituras. Uma curva analítica foi previamente preparada para cada proteína. A distribuição da proteína nas fases do sistema foi determinada a partir do coeficiente de partição (Kp), resultado da razão entre as concentrações de proteína da fase superior e inferior (Equação 9). O coeficiente de partição foi utilizado para quantificar o grau de separação alcançado no processo de extração.  onde CLI e CSal são as concentrações de proteína na fase superior e inferior, respectivamente. Para que se possa selecionar o SAB com melhor capacidade de extração das proteínas estudadas, foi calculada a recuperação teórica (ysup, %) do sistema, utilizando-se a Equação 1034 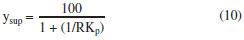 na qual R corresponde à razão entre os volumes da fase superior e inferior.
RESULTADOS E DISCUSSÃO Dados de equilíbrio de fases A Figura 1 apresenta a curva binodal, as linhas de amarração e o ponto crítico (Pc) obtidos para o SAB constituído por [C4mim][Cl], K2HPO4 e água, a 25±1 ºC. Os parâmetros de ajuste obtidos da correlação dos dados experimentais da binodal, juntamente com os coeficientes de correlação (R2) e os correspondentes desvios padrão (sd) das Equações 1-3 são apresentados na Tabela 1. A equação 1 mostrou melhor acurácia no ajuste dos dados da binodal para o sistema investigado.
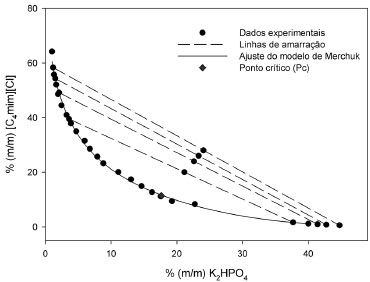 Figura 1. Diagrama de equilíbrio de fases o SAB formado por [C4mim][Cl] + K2HPO4 + água
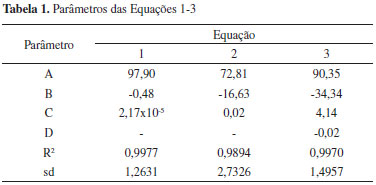
As linhas de amarração foram determinadas através da predição matemática da composição de cada fase dos sistemas bifásicos formados. As composições das fases superior e inferior, a composição das misturas iniciais e os comprimentos das linhas de amarração (TLL) estão dispostos na Tabela 2.
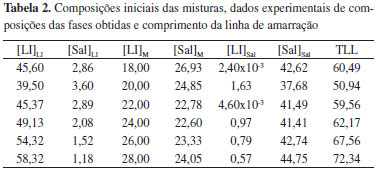
Analisando os dados da Tabela 2, observa-se um aumento do TLL com o aumento das composições globais de sal e LI para todas as combinações LI + sal consideradas. Quanto maior o conteúdo do composto formador de fase, mais distante é o ponto de mistura global da curva binodal e, portanto, espera-se uma maior diferença nas propriedades intensivas entre as fases formadas. Esse aumento do TLL também pode ser notado na Figura 1. Considerando a regra da alavanca, observa-se na Figura 1 que as composições de mistura definidas forneceram fases (superior e inferior) de volumes aproximadamente iguais, estando os pontos de mistura aproximadamente na metade das linhas de amarração. Partição de proteínas em SAB A partição das proteínas foi testada para os quatro diferentes pontos de mistura globais utilizados para determinação das linhas de amarração. A Tabela 3 apresenta os valores de coeficiente de partição e eficiência de extração para as proteínas do soro de leite estudadas.
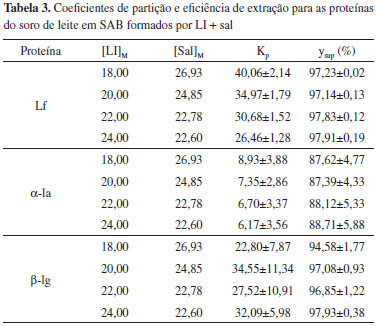
Os resultados apresentados na Tabela 3 mostram que, para todos os SAB estudados, foram obtidos altos valores de eficiência de extração, superiores a 87%. É, então, possível concluir que a variação da concentração dos componentes formadores de fase exerce pouca influência na migração das proteínas α-la e β-lg. Nos experimentos de extração, o pH do sistema foi igual a 9,0, estando, assim, acima dos valores de ponto isoelétrico (pI) das proteínas α-la e β-lg (4,2-4,8 e 5,2-5,4, respectivamente)35 que estão carregadas negativamente. Portanto, na interface, a carga positiva de [C4mim] atrai as proteínas para a fase superior, rica em LI.17 Os valores de recuperação téorica da Lf na fase superior, rica em LI, também foram elevados (acima de 97,14%). Entre as diferentes interações existentes entre as moléculas, as interações hidrofóbicas desempenham um papel importante no comportamento de proteínas em solução.36 A hidrofobicidade relativa do LI pode inferir em sua capacidade de extrair proteínas. As interações do LI com a biomolécula podem ser do tipo forças de van der Waals, interações eletrostáticas, ligações de hidrogênio e π...π entre o anel de imidazólio e o anel aromático de aminoácidos aromáticos.8,22 A Lf apresenta pI entre 8 e 8,5,37 próximo do pH do sistema (pH 9,0), o que resulta em um aumento do caráter hidrofóbico, criando uma maior afinidade da proteína pela fase rica em LI. Pei et al.5 encontraram resultados semelhantes estudando a partição de tripsina em sistemas constituídos por brometo de 1-butil-3-metilimidazólio ([C4mim][Br]). Lin et al.38 estudaram a extração das proteínas BSA, hemoglobina e lisozima em sistemas constituídos por brometo de 1-octil-3-metilimidazólio ([C8mim][Br]) e K2HPO4. Segundo os autores, devido às interações hidrofóbicas mais fortes que ocorrem no pI, os rendimentos de extração de hemoglobina e lisozima foram relativamente otimizados nessas condições. Verificou-se que o aumento das concentrações de sal promoveu o aumento dos valores de Kp. Em altas concentrações de K2HPO4 foi observada a redução da solubilidade da proteína na fase inferior como resultado de competição de um grande número de íons de sal com proteínas pelas moléculas de água39 (efeito salting out). Este fato induz a transferência da proteína para a fase superior do sistema.17 Alvarez-Guerra e Irabien40 estudaram a extração de Lf usando LI hidrofóbicos (1-butil-3-metilimidazólio bis[(trifluorometil)sulfonil]imida [C4mim][NTf2]) e 1-butil-3-metilimidazólio hexafluorofosfato [C4mim][BF6]). No entanto, as eficiências de extração obtidas não foram maiores que 20%. Os valores de Kp encontrados no presente trabalho foram similares a outros reportados na literatura para SAB compostos por polímero e sal. Chen41 estudou a partição e separação das proteínas α-la e β-lg em PEG (polietilenoglicol) utilizando um SAB com fosfato de potássio e obteve valores de coeficiente de partição na faixa de 1 a 7. Mokhtarani et al.,42 estudando a partição das mesmas proteínas em SAB de polivinilpirrolidona e fosfato de potássio, obtiveram valores na faixa de 1 a 7.
CONCLUSÃO Os valores de Kp variaram, aproximadamente, de 6,17 a 8,93 para a alfa-lactalbumina, de 22,80 a 34,55 para a beta-lactoglobulina e de 26,46 a 40,06 para a lactoferrina. Os valores de eficiência de extração maiores que 87% indicam uma elevada migração das proteínas para a fase superior rica em LI dos SAB. Dessa forma, a partir dos resultados obtidos e discutidos, os SAB baseados em LI sob investigação no presente trabalho podem ser considerados uma alternativa promissora para extração de proteínas do soro de leite.
AGRADECIMENTOS Os autores agradecem o apoio financeiro da Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) e do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
REFERÊNCIAS 1. Fox, P. F.; McSweeney, P. L. H; Dairy Chemistry and Biochemistry, Blakie Academic & Professional, 2001 2. Matsumoto, H.; Shimokawa, Y.; Ushida, Y.; Toida, T.; Hayasawa, H.; Biosci., Biotechnol., Biochem. 2001, 65, 1104. DOI: http://dx.doi.org/10.1271/bbb.65.1104 3. Heine, W. E.; Klein, P. D.; Reeds, P. J.; J. Nutr. 1991, 121, 277. PMID: 2002399 4. Bayeye, S.; Elass, E.; Nazuruier, J.; Spik, G.; Legrqnd, D.; Clin. Chem. Lab. Med. 1999, 37, 281. 5. Pei, Y.; Jianji, W.; Wu, K.; Xuan, X.; Lu, X.; Sep. Purif. Technol. 2009, 64, 288. DOI: http://dx.doi.org/10.1016/j.seppur.2008.10.010 6. Neves, C. M. S. S.; Ventura, S. P. M.; Freire, M. G.; Marrucho, I. M.; Coutinho, J. A. P.; J. Phys. Chem. B 2009, 113, 5194. DOI: http://dx.doi.org/10.1021/jp900293v PMID: 19309125 7. Ventura, S. P. M.; Neves, C.; Freire, M. G.; Marrucho, I. M.; Oliveira, J.; Coutinho, J. A. P.; J. Phys. Chem. B 2009, 113, 9304. DOI: http://dx.doi.org/10.1021/jp903613c PMID: 19518115 8. Ventura, S. P. M.; Sousa, S. G.; Freire, M. G.; Lima, A. S.; Coutinho, J. A. P.; J. Chromatogr. B 2011, 879, 2679. DOI: http://dx.doi.org/10.1016/j.jchromb.2011.07.022 9. Silva, L. H. M.; Loh, W.; Quim. Nova 2006, 29, 1345. DOI: http://dx.doi.org/10.1590/S0100-40422006000100029 10. Liu, Y.; Yu, Y. L.; Chen, M. Z.; Xiao, X.; Canadian Journal on Chemical Engineering & Technology 2011, 2. 11. Perumalsamy, M.; Bathmalakshmi, A.; Murugesan. T.; J. Chem. Eng. Data 2007, 52, 1186. DOI: http://dx.doi.org/10.1021/je060444w 12. Gutowski, K. E.; Broker, G. A.; Willauer, H. D.; Huddleston, J. G.; Swatloski, R. P.; Holbrey, J. D.; Rogers, R. D.; J. Am. Chem. Soc. 2003, 125, 6632. DOI: http://dx.doi.org/10.1021/ja0351802 PMID: 12769563 13. Cassol, C. C.; Dissertaçao de Mestrado, Universidade Federal do Rio Grande do Sul, Brasil, 2007. 14. Wei, D.; Ivaska, A.; Anal. Chim. Acta 2008, 607, 126. DOI: http://dx.doi.org/10.1016/j.aca.2007.12.011 PMID: 18190800 15. Pandy, S.; Anal. Chim. Acta 2006, 556, 38. DOI: http://dx.doi.org/10.1016/j.aca.2005.06.038 16. Wasserscheid, P.; Welton, T.; Ionic liquids in synthesis, Wiley-VCH: Weinheim, 2003. 17. Du, Z.; Yu, Y. L.; Wang, J. H.; Chem. Eur. J. 2007, 13, 2130. DOI: http://dx.doi.org/10.1002/chem.200601234 18. Ruiz-Angel, M. J.; Pino, V.; Carda-Broch, S.; Berthod, A.; J. Chromatogr. A 2007, 1151, 65. DOI: http://dx.doi.org/10.1016/j.chroma.2006.11.072 PMID: 17166506 19. Cláudio, A. F. M.; Freire, M. G.; Freire, C. S. R.; Silvestre, A. J. D; Coutinho, J. A. P.; Sep. Purif. Technol. 2010, 75, 39. DOI: http://dx.doi.org/10.1016/j.seppur.2010.07.007 20. Passos, H.; Ferreira, A. F.; Cláudio, A. F. M.; Coutinho, J. A. P.; Freire, M. G.; Biochem. Eng. J. 2012, 67, 68. DOI: http://dx.doi.org/10.1016/j.bej.2012.05.004 21. Dreyer, S.; Kragl, U.; Biotechnol. Bioeng. 2008, 99, 1416. DOI: http://dx.doi.org/10.1002/bit.21720 PMID: 18023057 22. Louros, C. L. S.; Claudio, A. F. M.; Neves, C. M. S. S.; Freire, M. G.; Marrucho, I. M.; Pauly, J.; Coutinho, J. A. P.; Int. J. Mol. Sci. 2010, 11, 1777. DOI: http://dx.doi.org/10.3390/ijms11041777 PMID: 20480041 23. Pereira, M. M.; Pedro, S. N.; Quental, M. V.; Lima, A. S.; Coutinho, J. A. P., Freire, M. G.; J. Biotechnol. 2015, in press. DOI: http://dx.doi.org/10.1016/j.jbiotec.2015.03.028 PMID: 25865275 24. Freire, M. G., Neves, C.; Silva, A. M. S.; Santos, L. M. N. B. F.; Marrucho, I. M.; Rebelo, L. P. N.; Shah, J. K.; Maginn, E. J.; Coutinho, J. A. P.; J. Phys. Chem. B 2010, 114, 2004. DOI: http://dx.doi.org/10.1021/jp9095634 PMID: 20088550 25. Canongia Lopes, J. N.; Costa Gomes, M. F.; Husson, P.; Pádua, A. A. H.; Rebelo, L. P. N.; Sarraute, S.; Tariq, M.; J. Phys. Chem. B 2011, 115, 6088. DOI: http://dx.doi.org/10.1021/jp2012254 26. Domanska, U.; Krolikowski, M.; J. Chem. Eng. Data 2010, 4817. DOI: http://dx.doi.org/10.1021/je100410k 27. Pei, Y. C.; Wang, J. J.; Xuan, J. X.; Fan, P.; Fan, M. H.; Environ. Sci. Technol. 2007, 41, 5090. DOI: http://dx.doi.org/10.1021/es062838d PMID: 17711228 28. Collins, K. D.; Biophys. Chem. 2006, 119, 271. DOI: http://dx.doi.org/10.1016/j.bpc.2005.08.010 PMID: 16213082 29. Albertsson, P. A.; Partition of Cell Particles and Macromolecules, 2nd edition, Wiley: New York, 1971. 30. Merchuk, J. C.; Andrews, B. A.; Asenjo, J. A.; J. Chromatogr. B 1998, 711, 285. DOI: http://dx.doi.org/10.1016/S0378-4347(97)00594-X 31. Raja, S.; Murty, V. R.; The Scientific World Journal 2013, doi: 10.1155/2013/819259. DOI: http://dx.doi.org/10.1155/2013/819259 32. Han, J.; Wang, Y.; Yu, C.; Li, Y.; Kang, W.; Yan, Y.; J. Chem. Thermodyn. 2012, 45, 59. DOI: http://dx.doi.org/10.1016/j.jct.2011.09.004 33. Hu, M.; Zhai, Q.; Liu, Z.; Xia, S.; J. Chem. Eng. Data 2003, 48, 1561. DOI: http://dx.doi.org/10.1021/je0301803 34. Picó, A.; Colavizza, D.; Benaissa, M.; Maes, P.; Tartar, A.; Montreuil, J.; Spik, G.; J. Chromatogr. B 2008, 830, 286. DOI: http://dx.doi.org/10.1016/j.jchromb.2005.11.008 35. Onwulata, C.; Huth, P. J.; Whey processing, functionality and health benefits, IFT Press, Wiley-Blackweel, USA, 2008. 36. Yaminsky, V. V.; Vogler, E. A.; Curr. Opin. Colloid Interface Sci. 2001, 6, 342. DOI: http://dx.doi.org/10.1016/S1359-0294(01)00104-2 37. Lonnerdal, B.; Iyer, S.; Annu. Rev. Nutr. 1995, 15, 93. DOI: http://dx.doi.org/10.1146/annurev.nu.15.070195.000521 PMID: 8527233 38. Lin, X.; Wang, Y.; Zeng, Q.; Ding, X.; Chen, J.; Analyst, 2013, 138, 6445. DOI: http://dx.doi.org/10.1039/c3an01301d 39. Zaslavsky, B. Y.; Miheeva, V.; Mesteckina, N. M.; Rogozhin, S. V.; J. Chromatogr. 1982, 253, 149. DOI: http://dx.doi.org/10.1016/S0021-9673(01)88373-4 40. Alvarez-Guerra, E.; Irabien, A.; Sep. Purif. Technol. 2012, 98, 432. DOI: http://dx.doi.org/10.1016/j.seppur.2012.08.010 41. Chen, J. P.; J. Ferment. Bioeng. 1992, 73, 140. DOI: http://dx.doi.org/10.1016/0922-338X(92)90579-J 42. Mokhtarani, B.; Mortaheb, H. R.; Mafi, M.; Amini, M. H.; J. Chromatogr. B 2011, 879, 721. DOI: http://dx.doi.org/10.1016/j.jchromb.2011.02.007 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





