Artigo
|
|
| Influência do catalisador em soluções poliméricas para o preparo de géis orgânicos de resorcinol-formaldeído Catalyst influence on polymeric solution used to prepare resorcinol-formaldehyde organic gels |
|
Thalita S. TaiariolI,*; Elizabete Y. KawachiI; Luiz C. PardiniI,II
IDepartamento de Química, Instituto Tecnológico de Aeronáutica, Praça Marechal Eduardo Gomes, 50, Vila das Acácias, 12228-900 São José dos Campos - SP, Brasil Recebido em 21/03/2015 *e-mail: thalitasani@yahoo.com.br Resorcinol-formaldehyde (RF) organic gels have been extensively used to produce carbon aerogels. The organic gel synthesis parameters greatly affect the structure of the resulting aerogel. In this study, the influence of the catalyst quantity on the polymeric solution sol-gel process was investigated. Sodium carbonate was used as a basic catalyst. RF gels were synthesized with a resorcinol to formaldehyde molar ratio of 0.5, a resorcinol to catalyst (R/C) molar ratio equal to 50 or 300, and a resorcinol to solvent ratio of 0.1 g mL-1. The sol-gel process was evaluated in situ by Fourier transform infrared spectroscopy using a universal attenuated total reflectance sensor and measurements of the kinematic viscosity. The techniques showed the evolution of the sol-gel process, and the results showed that the lower catalyst quantity induced a higher gel point, with a lower viscosity at the gel point. Differential scanning calorimetry was used to investigate the thermal behavior of the RF dried gel, and results showed that the exothermic event related to the curing process was shifted to higher temperatures for solutions containing higher R/C ratios. INTRODUÇÃO Aerogéis são estruturas sólidas que contém poros em escala nanométrica, resultando em um percentual de vazios em seu interior da ordem de 90 a 99,8%. Como consequência dessas caraterísticas peculiares, apresentam área superficial específica e volume de poros elevados (400 - 900 m2 g-1 e 0,25 a 1,25 cm3 g-1, respectivamente),1,2 além de baixa condutividade térmica (aproximadamente 0,012 W m-1K-1)3 e baixa massa específica (0,06 a 0,103 g cm-3),2 fazendo com que sejam aplicados com sucesso em diversos segmentos, tais como eletrodos para células combustíveis, tratamento para efluentes, filtros para água, peneiras moleculares e isolamentos térmicos.4 Existem três tipos de aerogéis, inorgânicos, orgânicos e híbridos. No caso dos aerogéis orgânicos, sua obtenção consiste da síntese de policondensação sol-gel entre resorcinol e formaldeído, na presença de um catalisador normalmente básico, que resultará, após cura, em um gel permeado pelo solvente com uma rede tridimensional originada pelo agrupamento de nanopartículas unidas por ligações cruzadas. Esse gel passará pela etapa de remoção da parte líquida por meio de secagem supercrítica e, finalmente, o material seco passará por tratamento térmico para eliminar os compostos orgânicos e resultar no aerogel de carbono.5-11 As reações de adição e condensação entre os precursores estão esquematizadas na Figura 1 a) e b), respectivamente.
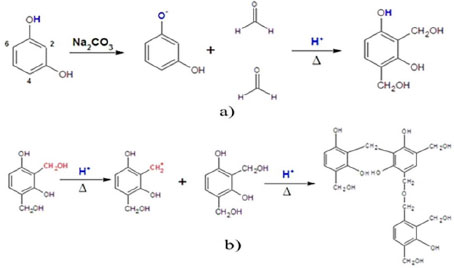 Figura 1. Etapas de preparo de géis RF: a) reaçoes de adiçao do formaldeído ao resorcinol, por catálise básica; b) reaçoes de condensaçao (adaptaçao)15,16
As propriedades do aerogel de carbono dependem diretamente das características do gel orgânico de partida, as quais estão relacionadas com o mecanismo da reação sol-gel. Para a reação de resorcinol e formaldeído, sabe-se que o pH da solução aquosa acelera a reação, modificando o mecanismo do processo, catalisando ora a substituição eletrofílica aromática por ativação do resorcinol (catálise básica), ora as moléculas de formaldeído (catálise ácida).12 Além disso, estudos mostraram que com pH abaixo de 6,0 e acima de 8,0, a solução RF não forma gel facilmente ou, se forma, gera um material pouco poroso.13,14 A Figura 1 ilustra o mecanismo da reação entre resorcinol e formaldeído, na presença de catalisador básico carbonato de sódio. A Figura 1 ilustra como o carbonato de sódio atua, num primeiro momento, para facilitar a adição do formaldeído no resorcinol e, posteriormente, para formar a rede tridimensional que irá compor a estrutura do gel úmido.16 De uma forma geral, os dois mecanismos de reação apresentados na Figura 1 são obtidos quando se utiliza um catalisador básico. Esse tipo de catalisador promove a remoção de H+ das hidroxilas do resorcinol, resultando no íon fenolato que é mais receptivo ao hidroximetil (-CH2OH).1,16 Nessa etapa, a desprotonação do resorcinol proporcionará uma acidificação do meio reacional por conta dos íons H+ que foram liberados, ainda que não tenha sido utilizado nenhum catalisador ácido.14,16-18 A partir daí, esses hidrogênios livres na solução promoverão a remoção de hidroxilas da estrutura formada na reação de adição, resultando no cátion benzílico (segunda estrutura da reação de condensação) que se unirá às moléculas substituídas por meio de ligações cruzadas, até que todo resorcinol seja consumido na reação. Também ocorrerá a formação de água, característica das reações de condensação.19 A estrutura dos aerogéis é sensível às etapas de síntese e processamento, de modo que a modificação dos parâmetros de síntese influencia fortemente nas propriedades finais do material. Os fatores que mais afetam as propriedades do aerogel são: natureza dos reagentes precursores, natureza do catalisador, tipo de solvente, quantidades relativas de reagentes, solvente e catalisador e pH inicial da solução, sendo este último considerado o principal determinante estrutural. Para o aerogel RF, reações estequiométricas R/F 1:2 são as mais comuns, pois é possível obter as melhores características texturais de área superficial e volume de poros; no entanto, a relação molar R/F pode variar dentro do intervalo de 0,4 a 0,7. Uma quantidade muito grande de formaldeído leva ao colapso da estrutura e diminuição do tamanho de poro formado.20-24 Caso seja usado o carbonato de sódio (Na2CO3) como catalisador, a razão molar R/C comumente varia entre 50 e 300. Razões R/C baixas geram partículas poliméricas pequenas (3 - 5 nm) interconectadas entre si, dando uma aparência fibrosa e com alta densidade. Altas proporções R/C produzem grandes partículas poliméricas (16 - 200 nm), conectadas por pescoços estreitos e aspecto de colar de pérolas.8,18 O solvente pode ser água destilada ou orgânico (acetona, metanol, etanol, dentre outros), de modo que aerogéis obtidos com água destilada são denominados de aquagéis ou hidrogéis, e os demais de liogéis ou alcogéis, caso o solvente seja álcool.8 Com valores muito baixos de pH, a quantidade de ânions fenolato formados é pequena, resultando em um menor número de moléculas substituídas, o que favorece a condensação. Em contrapartida, valores muito altos dificultam a policondensação dos monômeros e resultam em um gel com uma densidade de reticulação mais elevada. O intervalo usual de pH está na faixa de 5,4 a 7,6. Quanto maior o pH da solução, maiores serão a área superficial e o volume de poros dos aerogéis de carbono obtidos pela síntese de resorcinol-formaldeído. O aumento na quantidade de catalisador também leva à diminuição do tamanho de partículas e poros, bem como no aumento da velocidade de formação do gel. A síntese com duplo catalisador é considerada mais eficiente, uma vez que a adição de um catalisador ácido posterior proporciona a formação de mais ligações cruzadas provenientes de algum precursor que não tenha reagido durante a catálise básica anterior.1,14,17,18,25 Apesar do conhecimento que se tem sobre as características finais de aerogéis orgânicos e de carbono, o mecanismo de polimerização e de atuação do catalisador básico em reações de resorcinol-formaldeído ainda são pouco entendidos.26 Levando-se em consideração que grande parte dos trabalhos discute as características dos aerogéis em estado sólido e que, com exceção dos parâmetros principais de síntese, pouca informação é fornecida com relação às soluções poliméricas que determinam as propriedades de um aerogel de carbono,27-33 este trabalho tem por objetivo caracterizar estas soluções à base de resorcinol e formaldeído por meio do pH da solução, FT-IR in situ, viscosidade cinemática e DSC, com objetivo de avaliar a influência do catalisador.
PARTE EXPERIMENTAL Reagentes Foram utilizados como precursores formaldeído 36,5-38% em solução (LabSynth - CAS: 50-00-0) e resorcinol 99 a 100,5% (Vetec - CAS: 108-46-3), carbonato de sódio anidro 99,5% (LabSynth - CAS: 497-19-8) como catalisador e água bidestilada como solvente. Síntese e caracterização dos hidrogéis As soluções poliméricas foram preparadas com razão molar resorcinol/formaldeído (R/F) fixa e igual a 0,5, e com duas razões molares diferentes de resorcinol/catalisador (R/C): 50 e 300. Foi utilizada água bidestilada como solvente na razão massa/volume de resorcinol/água (R/A) igual a 0,1 g mL-1. Os reagentes foram adicionados na seguinte sequência: resorcinol, formaldeído, água bidestilada e, por fim, quantidade necessária de catalisador para alcançar as razões molares R/C estudadas. Cada solução preparada foi mantida sob agitação magnética vigorosa durante 45 minutos antes e as sínteses foram realizadas a temperatura de 25 ºC. Para avaliar a influência da quantidade de catalisador na reação, as soluções poliméricas foram inseridas em um reator encamisado adaptado com um medidor de pH e acoplado a um espectrômetro infravermelho com transformada de Fourier (FT-IR), da marca Mettler Toledo. Análise in situ do pH foi conduzida em temperatura ambiente, após 45 minutos de agitação mecânica (200 rpm) das soluções poliméricas. Essas soluções também foram analisadas por FT-IR, tendo como objetivo observar o andamento da reação em função do tempo. A viscosidade das soluções foi determinada com viscosímetro capilar Cannon-Fensk 50 imerso em um banho termostático da marca Quimis, modelo Q303SR, próprio para viscosímetros capilares. As soluções foram analisadas a 26 ºC, em triplicata, tendo sido obtido um valor médio do tempo de escoamento das soluções. Após análise em temperatura ambiente, foi programado aquecimento até cerca de 90 ºC, medindo-se o tempo de escoamento a cada cinco minutos. O valor da viscosidade foi determinado multiplicando-se o tempo de escoamento das soluções pela constante do viscosímetro utilizado (k = 0,004). Para avaliar a influência do catalisador sobre a cura do gel de RF, as soluções poliméricas foram inseridas em um béquer e mantidas sob agitação magnética vigorosa durante 45 minutos e, depois desse tempo, levadas a uma estufa de circulação mecânica para sua cura. Após a formação dos hidrogéis, pequenas porções foram moídas em almofariz de ágata e analisados por FT-IR (20 varreduras e resolução de 4 cm-1). Para esta análise, foi utilizado equipamento da Perking Elmer, Spectrum One FT-IR, modelo 660-IR, com acessório de Refletância Total Atenuada Universal (UATR), também da Perking Elmer. Análise por Calorimetria Exploratória Diferencial (DSC) foi realizada em um equipamento da marca Perkin Elmer, modelo Pyris 1, acoplado a um sistema de resfriamento Intracooler 2P. Cerca de 20 mg de cada solução líquida foi inserida numa panelinha de alta pressão. A análise foi realizada de 30 a 180 ºC, com taxa de aquecimento de 10 ºC min-1, sob atmosfera inerte de nitrogênio (N2) com fluxo a 50 mL min-1 durante todo o processo.31 Essa análise teve por objetivo verificar a temperatura na qual ocorreu a cura das soluções poliméricas.
RESULTADOS E DISCUSSÃO Caracterizações Análise de pH Como soluções de resorcinol e formaldeído apresentam pH baixo, a adição de catalisador básico tende a elevar o pH da solução. Os valores de pH obtidos para ambas as soluções estudadas são apresentados na Tabela 1. Observou-se, como esperado, um menor valor do pH em função do aumento da razão molar R/C, uma vez que a quantidade de catalisador básico diminui. O pH final das amostras diminui com o decorrer das reações, devido à liberação de H+ durante as etapas de reação apresentadas na Figura 1.
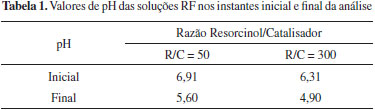
Foi observado que o inicio do processo de formação do gel de ambas as soluções ocorreu apenas após terem alcançado os seus valores mais baixos de pH. Com base nesses resultados, espera-se que os aerogéis formados com a solução que contém R/C igual a 300 apresentem partículas com diâmetros maiores, uma vez que a diminuição da quantidade de catalisador implicará em um tempo maior para que ocorra a cura e, dessa forma, haverá possibilidade de crescimento das partículas e dos aglomerados poliméricos. Em relação ao pH, de acordo com a literatura, aerogéis obtidos com a solução que contém R/C igual a 50 tendem a ter menor área superficial e volume de poros em relação à que contém R/C igual a 300. Essas partículas são caracterizadas pelos monômeros em estágio inicial da reação. Por sua vez, os aglomerados poliméricos, ou "clusters", são resultantes da união das partículas por meio de ligações químicas durante o estágio intermediário da reação. Esses aglomerados continuarão a se ligar e, ao final do processo, resultarão no reticulado tridimensional do gel. Calorimetria Exploratória Diferencial (DSC) A Figura 2 apresenta as curvas de DSC das duas soluções. Os dados relacionados com Tonset, Tpico (temperatura de cura) e Toffset estão listados na Tabela 2.
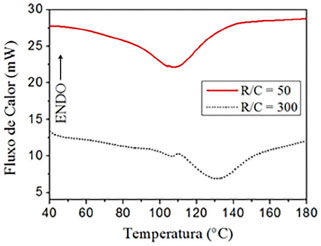 Figura 2. Curvas de DSC para as soluçoes RF

Analisando-se os dados da Tabela 2 e as curvas da Figura 2, houve um evento exotérmico relacionado com a cura das soluções poliméricas, cuja temperatura de pico é maior para a solução com menor quantidade de catalisador. Em outras palavras, o evento associado com a cura das soluções, uma vez que esta é acelerada pela presença de um catalisador, tende a ocorrer em temperaturas maiores para razões molares R/C maiores. Isto significa que, mantendo as soluções a 90 ºC em estufa, como realizado neste trabalho, a solução RF com R/C = 300 leva um tempo relativamente maior que a R/C = 50 para formar o gel. Reflectância Total Atenuada Universal (UATR) Os resultados da análise de FT-IR in situ das soluções são mostrados na Figura 3.
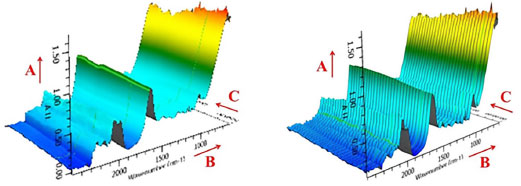 Figura 3. Espectros de UATR in situ das soluçoes com R/C igual a 50 (imagem à esquerda) e a 300 (imagem à direita)
Na Figura 3, os eixos A, B e C representam, respectivamente, a absorbância, o número de onda (cm-1) e o tempo de reação (segundos). A coloração indica a intensidade das bandas, sendo azul para as menos intensas e avermelhadas para as mais intensas. Comparando-se ambas as imagens, percebe-se que os espectros são semelhantes, havendo pequenas alterações nas bandas em torno de 2000, 1600, 1100 e 750 cm-1 com o aumento do tempo. Estas bandas podem ser atribuídas às vibrações CH2 alifáticos, C=C em anel aromático, C-O de carbono alifático e vibração de anel aromático 1,3-substituído, respectivamente. Todas estas bandas sofrem leve decaimento com o tempo, indicando a substituição das moléculas de formaldeído nos anéis aromáticos do resorcinol e condensação dos respectivos derivados. A Figura 4 apresenta os espectros de UATR dos hidrogéis. A posição das bandas e as atribuições estão relacionadas na Tabela 3.
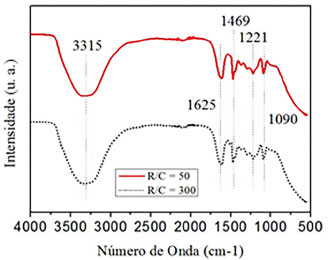 Figura 4. Espectros de FT-IR/UATR dos géis úmidos
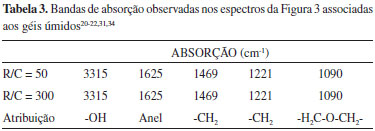
Em relação às vibrações O-H, a análise dos materiais de partida mostrou que a absorção da água bidestilada ocorreu em torno de 3318 cm-1, enquanto que a do formol e a do resorcinol ocorreu em 3331 cm-1 e 3192 cm-1, respectivamente. Desta forma, pode-se afirmar que a banda em 3315 cm-1 observada nos hidrogéis deve-se à água usada como solvente e que permeia a rede do gel. Além disso, todo o resorcinol e boa parte do formaldeído são consumidos durante as reações sol-gel, o que corrobora com esta atribuição. As bandas em 1469, 1221 e 1090 cm-1 são características, respectivamente, do dobramento angular (vibrações "tesoura") do metileno (-CH2), das vibrações fora do plano das ligações metilênicas e das oximetilênicas (H2C-O-CH2). Estas bandas caracterizam a estrutura do gel úmido como sendo formada de uma rede tridimensional composta, principalmente, por ligações metilênicas e oximetilênicas.20,33,34 Viscosidade cinemática A Figura 5 apresenta os resultados de viscosidade cinemática das amostras contendo razões molares R/C iguais a 50 e 300. A viscosidade inicial, a viscosidade associada ao tempo de gel (tg), o tg (aproximado), a temperatura associada ao tg e o tempo total (ttot: refere-se ao tg mais o tempo de agitação e o tempo da análise) de reação para cada solução estão resumidos na Tabela 4, levando-se em consideração que nos gráficos foi considerado apenas o tempo de análise da viscosidade. A determinação do tg só foi possível no caso da solução com R/C = 50, para a qual se observa um ponto mínimo na curva de viscosidade. Neste caso, tg foi determinado tomando-se a intersecção entre duas retas imaginárias tangentes ao lado direito da curva e ao ponto mínimo da parábola.
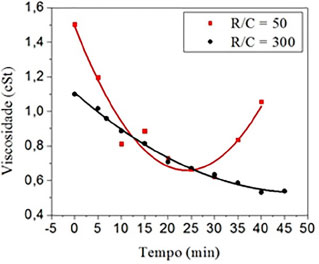 Figura 5. Variaçao da viscosidade cinemática com o tempo de reaçao para as soluçoes com R/C igual a 50 e 300
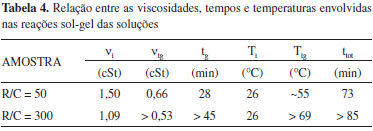
As curvas de viscosidade apresentam o comportamento das soluções em função do tempo de reação. Nota-se uma diminuição inicial da viscosidade, relacionada com a quebra de ligações químicas secundárias e aumento do volume livre durante o aquecimento. No caso da solução com R/C igual a 50, a curva de viscosidade apresenta um mínimo a partir do qual a viscosidade volta a aumentar, pois novas ligações químicas vão sendo criadas durante a reação. Em determinado momento (que não está retratado nos gráficos), esse aumento da viscosidade torna-se exponencial, caracterizado pela reticulação das cadeias poliméricas. Em virtude disso, para evitar danos ao viscosímetro, somente foram coletados os primeiros pontos após o mínimo da curva. Por meio da Figura 5, juntamente com os dados apresentados na Tabela 4, é possível visualizar o efeito do catalisador sobre o comportamento das soluções durante a reação. Para a amostra com R/C igual a 50, o tempo de gel é mais baixo que o da amostra com R/C igual a 300, indicando que a reação de cura dessa amostra ocorre mais rapidamente. Com isso, a temperatura em que começa haver aumento da viscosidade associada com a reticulação dos polímeros que vão sendo formados (lado direito de cada gráfico) é menor, justificando uma νtg maior para a amostra com R/C igual a 50. Outro fator importante de se observar é que a diminuição da quantidade de catalisador (ou aumento da razão molar R/C) vai gerar um alargamento da parábola, causado pelo retardamento da cura em relação à amostra com maior quantidade de catalisador. O ponto mínimo da viscosidade para a solução com R/C igual a 300 não pôde ser determinado, uma vez que o próximo ponto da parábola a partir de 45 minutos levou um tempo muito grande para ser gerado, resultando no início da cura da solução. Para evitar danos ao viscosímetro e erros nas medidas, optou-se por interromper a curva em 45 minutos. Esse comportamento foi observado todas as vezes em que foi feita a análise da solução com R/C igual a 300. Tendo isto em vista e, levando-se em consideração que ocorreu um aumento do tempo de queda do fluido pelo capilar (em decorrência do aumento da viscosidade do fluido), pode-se afirmar que a curva da solução com R/C igual a 300 terá um comportamento semelhante ao da parábola da solução com R/C igual a 50.
CONCLUSÃO O pH das soluções com R/C igual a 50 foi maior que com R/C igual a 300. Esse resultado, para as mesmas condições de síntese em ambos os casos, indica que essa condição básica favorece a etapa de substituição eletrofílica durante a reação sol-gel, formando mais compostos intermediários que no caso da solução com menor quantidade de catalisador. Dessa forma, serão obtidos aerogéis contendo maior número de estruturas que se ligarão entre si, formando estruturas mais firmes. A redução na quantidade de catalisador resultou em aumento no tempo de gel estimado por meio de viscosidade cinemática, na temperatura relacionada com o tempo de gel e na diminuição da viscosidade no ponto do tg. Também gerou redução na intensidade das bandas de UATR, de uma forma geral, em especial as associadas com os compostos intermediários responsáveis pela cura do polímero. A quantidade de catalisador também influenciou as curvas de DSC, resultando em um deslocamento do pico de cura para valores maiores de temperatura no caso da solução que contém R/C igual a 300. Em outras palavras, a redução de catalisador gerou aumento da temperatura e do tempo de cura da solução com R/C igual a 300 em relação à que possui R/C igual a 50. Também houve redução no valor de pH em função do aumento da razão molar R/C.
AGRADECIMENTOS Os autores gostariam de agradecer ao CNPq (Processo 560029/2010-1) pelo auxílio financeiro, bem como à AQI/IAE/DCTA e ao AMR/IAE/DCTA pelas análises de FT-IR e DSC.
REFERÊNCIAS 1. Pérez-Caballero, F.; Peikolanen, A.-L.; Koel, M.; Proc. Est. Acad. Sci., Chem. 2008, 57, 48. DOI: http://dx.doi.org/10.3176/proc.2008.1.05 2. Mirzaeian, M.; Hall, P. J.; J. Mater. Sci. 2009, 44, 2705. DOI: http://dx.doi.org/10.1007/s10853-009-3355-5 3. Dan, D.; Zhang, H.; Tao, W.-Q.; Appl. Therm. Eng. 2014, 72, 2. DOI: http://dx.doi.org/10.1016/j.applthermaleng.2014.02.052 4. Lermontov, S. A.; Malkova, A. N.; Yurkova, L. L.; Straumal, E. A.; Gubanova, N. N.; Baranchikov, A. Y.; Ivanov, V. K.; Mater. Lett. 2014, 116, 116. DOI: http://dx.doi.org/10.1016/j.matlet.2013.10.080 5. Pessanha, N. F. N.; Coelho, G. L. V.; Anais do VIII CBEQIC, Blumenau, Brasil, 2009. 6. Pauzauskie, P. J.; Crowhurst, J. C.; Worsley, M. A.; Laurence, T. A.; Kilcoyne, A. L. D.; Wang, Y.; Willey, T. M.; Visbeck, K. S.; Fakra, S. C.; Evans, W. J.; Zaug, J. M.; Satcher Jr., J. H.; Proc. Natl. Acad. Sci. U. S. A. 2011, 108, 8550. DOI: http://dx.doi.org/10.1073/pnas.1010600108 PMID: 21555550 7. Bryning, M. B.; Milkie, D. E.; Islam, M. F.; Hough, L. A.; Mikkawa, J. M.; Yodh, A. G.; Adv. Mater. (Weinheim, Ger.) 2007, 19, 661. DOI: http://dx.doi.org/10.1002/adma.200601748 8. Hüsing, N.; Schubert, U.; Angew. Chem. Int. Ed. 2007, 37, 22. DOI: http://dx.doi.org/10.1002/1521-3773(19980202)37:1/2<22::AID-ANIE22>3.3.CO;2-9 9. Wu, G.-P.; Yang, J.; Wang, D.; Xu, R.; Amine, K.; Lu, C-X; Mater. Lett. 2014, 115, 1. DOI: http://dx.doi.org/10.1016/j.matlet.2013.10.003 10. Czakkel, O.; Székely, E.; Koczka, B.; Gessler, E.; László, K.; Microporous Mesoporous Mater. 2012, 148, 34. DOI: http://dx.doi.org/10.1016/j.micromeso.2011.07.008 11. Moreno, A. H.; Arenillas, A.; Galvo, E. G.; Bermúdez, J. M.; Menéndez, J. A.; J. Anal. Appl. Pyrolysis 2013, 100, 111. DOI: http://dx.doi.org/10.1016/j.jaap.2012.12.004 12. Laskowski, J.; Milow, B.; Ratke, L.; Microporous Mesoporous Mater. 2014, 197, 308. DOI: http://dx.doi.org/10.1016/j.micromeso.2014.06.031 13. Zubizarreta, L.; Arenillas, A.; Dominguez, A.; Menéndez, J. A.; Pis, J. J.; J. Non-Cryst. Solids 2008, 354, 817. DOI: http://dx.doi.org/10.1016/j.jnoncrysol.2007.08.015 14. Rey-Raap, N.; Menéndez, J. A.; Arenillas, A.; Microporous Mesoporous Mater. 2014, 195, 266.DOI: http://dx.doi.org/10.1016/j.micromeso.2014.04.048 15. Lin, C.; Ritter, J. A.; Carbon 1997, 35, 1271. DOI: http://dx.doi.org/10.1016/S0008-6223(97)00069-9 16. Pekala, R. W.; Kong, F. M.; Rev. Phys. Appl. 1989, 50, C4-33. 17. Zapata-Benabithe, Z.; Carrasco-Marin, F.; Vicente, J. de.; Moreno-Castilla, C.; Langmuir 2013, 29, 6166. DOI: http://dx.doi.org/10.1021/la4007422 PMID: 23617279 18. Al-Mutahseb, A. S.; Ritter, J. A.; Adv. Mater. (Weinhein, Germany). 2003, 15, 101. DOI: http://dx.doi.org/10.1002/adma.200390020 19. Martins, D. de L.; Revista Virtual de Química 2009, 1, 186. 20. Li, J.; Wang, X.; Huang, Q.; Gamboa, S.; Sebastian, P. J.; J. Power Sources 2006, 158, 784. DOI: http://dx.doi.org/10.1016/j.jpowsour.2005.09.028 21. Zhang, L.; Liu, H.; Wang, M.; Chen, L.; Carbon 2004, 45, 1939. 22. Jirgolá, H.; Hódar, F. J. M.; Langmuir 2010, 26, 16103. DOI: http://dx.doi.org/10.1021/la102499h 23. Shariff, A. M.; Beshir, D. M.; Bustam, M. A.; Maitra, S.; Trans. Ind. Ceram. Soc. 2010, 69, 1. DOI: http://dx.doi.org/10.1080/0371750X.2010.11090822 24. Elkhatat, A. M.; Al-Muhtaseb, S. A.; Adv. Mater. (Weinhein, Germany) 2011, 23, 2887. DOI: http://dx.doi.org/10.1002/adma.201100283 25. Chaichanawong, J.; Kongcharoen, K.; Areerat, S.; Adv. Powder Technol. 2013, 24, 891. DOI: http://dx.doi.org/10.1016/j.apt.2013.05.014 26. Gaca, K.Z; Sefcik, J. J.; Colloid Interface Sci. 2013, 406, 51. DOI: http://dx.doi.org/10.1016/j.jcis.2013.05.062 27. Feng, J.; Feng, J.; Zhang, C.; J. Sol-Gel Sci. Technol. 2011, 59, 371. DOI: http://dx.doi.org/10.1007/s10971-011-2514-8 28. Berthon-Fabry, S.; Langohr, D.; Achard, P.; Charrier, D.; Djurado, D.; Ehrburger-Dolle, F.; J. Non-Cryst. Solids 2004, 350, 136. DOI: http://dx.doi.org/10.1016/j.jnoncrysol.2004.06.040 29. Berthon, S.; Barbieri, O.; Ehrburger-Dolle, F.; Geissler, E.; Achard, P.; Bley, F.; Hecht, A.-M.; Livet, F.; Pajonk, G. M.; Pinto, N.; Rigacci, A.; Rochas, C.; J. Non-Cryst. Solids 2001, 285, 154. DOI: http://dx.doi.org/10.1016/S0022-3093(01)00447-1 30. Zhao, J.; Yang, L.; Li, F.; Yu, R.; Jin, C.; Carbon 2009, 47, 744. DOI: http://dx.doi.org/10.1016/j.carbon.2008.11.006 31. Pekala, R. W.; J. Mater. Sci. 1989, 24, 3221. DOI: http://dx.doi.org/10.1007/BF01139044 32. Liang, C.; Sha, G.; Guo, S.; J. Non-Cryst. Solids 2000, 271, 167. DOI: http://dx.doi.org/10.1016/S0022-3093(99)00632-8 33. Job, N.; Panaricello, F.; Crine, M.; Pirard, J.-P.; Léonard, A.; Colloids Surf., A 2007, 293, 224. DOI: http://dx.doi.org/10.1016/j.colsurfa.2006.07.037 34. Job, N.; Pirard, R.; Marien, J.; Pirard, J.-P.; Carbon 2004, 43, 2481. DOI: http://dx.doi.org/10.1016/j.carbon.2005.04.031 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





