Revisão
|
|
| Métodos de extração de poli-hidroxialcanoatos a partir de biomassa bacteriana Methods of extraction of polyhydroxyalkanoates from bacterial biomass |
|
Luci K. M. Quines; Mélodi Schmidt; Kellen Zanfonato; Willibaldo Schmidell; Gláucia M. F. Aragao*
Departamento de Engenharia Química e Engenharia de Alimentos, Universidade Federal de Santa Catarina, 88040-900 Florianópolis - SC, Brasil Recebido em 25/04/2015 *e-mail: glaucia.aragao@ufsc.br Polyhydroxyalkanoates (PHAs) are biodegradable and biocompatible polyesters intracellularly accumulated by many bacteria as an energy reserve material and carbon source. These biopolymers may be extracted from cells after their production phase, and the extraction process involves various individual operations to ensure adequate removal of the biopolymer from the cells. During this process, the following aspects should be considered: reduction of product losses during different stages of the process to obtain a highly pure product, preservation of physical and thermal characteristics, and use of low toxicity chemicals to achieve sustainable production and avoid harming the environment. The impact of the costs of PHA extraction on the total cost of the production process may account for over 50% of the end-value of the product. Within this context, several methods of PHA extraction have been reported in the literature. These methods include the use of solvents, chemical digestion, enzymatic digestion, mechanical extraction with high-pressure homogenization and ultrasound, extraction using supercritical fluids, or a combination of these methods. The present review of the literature shows strategies for extraction processes of PHAs produced by bacteria involving cell destabilization and/or breakage, recovery, and purification of the biopolymer. INTRODUÇAO Inseridos no atual contexto de preocupaçao com o ambiente, plásticos biodegradáveis têm sido amplamente estudados, a fim de substituir parcialmente os plásticos sintéticos.1 Os poli-hidroxialcanoatos (PHAs) sao biopolímeros biodegradáveis que podem ser produzidos por inúmeros microrganismos como forma de reserva energética e de carbono, e podem ser sintetizados a partir de matérias-primas renováveis.2,3 Dependendo do substrato utilizado e do metabolismo do microrganismo, diferentes monômeros e, assim, diferentes polímeros e copolímeros podem ser obtidos.4 A estrutura dos PHAs é apresentada na Figura 1. Estes polímeros sao classificados de acordo com o número de átomos de carbono que compoe o grupo funcional R. Mais de 150 diferentes unidades monoméricas sao identificadas como constituintes dos PHAs, fazendo com que diferentes tipos de polímeros sejam criados aumentando a gama de utilizaçoes deste material.5 Na Figura 1 o valor de "n" representa o número de monômeros presentes na estrutura do polímero que, na estrutura geral dos PHAs, podendo variar de 100 a 30.000. Este valor está diretamente relacionado à massa molar do polímero e, consequentemente, às suas propriedades físicas.6
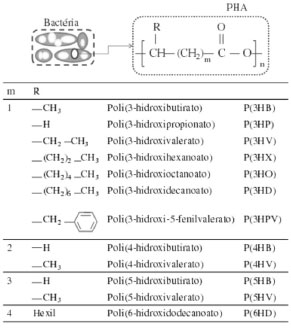 Figura 1. Estrutura molecular geral dos poli-hidroxialcanoatos (PHAs), com m = 1, 2, 3 e 4, n variando de 100 a milhares de unidades e R variável (Adaptado da ref. 5)
Os PHAs sao classificados em três grupos dependendo do número de átomos de carbono nas unidades monoméricas: PHAs constituídos por unidades de ácidos hidroxialcanóicos de cadeia curta (PHASCL), ou seja, aqueles que possuem cadeia carbônica constituída de 3 a 5 átomos de carbono, os PHAs constituídos por unidades de cadeia média (PHAMCL), apresentando de 6 a 14 átomos de carbono na cadeia e os de cadeia longa com mais de 15 átomos de carbono (PHALCL).7 Dentre os PHAs, o poli(3-hidroxibutirato) (P(3HB)) e seu copolímero o poli(3-hidroxibutirato-co-3-hidroxivalerato) (P(3HB-co-3HV)) sao os mais estudados, apresentando, além de biodegradabilidade e biocompatibilidade, algumas propriedades termoplásticas e mecânicas que permitem suas aplicaçoes como substitutos dos plásticos de origem petroquímica, produzidos a partir de fonte nao renovável.6,8-11 Apesar das atraentes características dos PHAs, a sua utilizaçao em embalagens de alimentos, em biomedicina, na área farmacêutica e outras aplicaçoes é limitada devido ao seu elevado custo de produçao.12,13 Por se tratar de um produto acumulado intracelularmente, no citoplasma das células bacterianas, os PHAs devem ser extraídos das células após a etapa de produçao (cultivo). O tratamento da biomassa, após o cultivo para a extraçao do PHA acumulado, é uma etapa de extrema importância, pois pode acarretar alteraçoes nas propriedades do produto final.14 O processo de extraçao de PHAs envolve, geralmente, as seguintes etapas: tratamento de desestabilizaçao e/ou rompimento celular (que pode ser aplicado ou nao), separaçao do meio de cultivo da biomassa, recuperaçao do biopolímero e purificaçao. A etapa de extraçao de PHAs envolve diferentes operaçoes unitárias que garantem a adequada remoçao do biopolímero do interior das células. Neste processo, deve-se considerar aspectos como: reduçao das perdas de produto nas diferentes etapas do processo, obtençao de um produto de elevada pureza e com características físicas e térmicas preservadas e obtençao sustentável do produto, utilizando-se produtos químicos de baixa toxicidade que nao comprometam o meio ambiente. Estima-se que a etapa de extraçao dos PHAs possa representar cerca de 50% no custo total do processo de produçao, dependendo de variáveis como processo de downstream e o conteúdo de PHA na biomassa.15,16 Segundo Chen et al.,17 para potencializar a produçao de P(3HB), é necessário que se desenvolvam novos processos de síntese e de extraçao de baixo custo, com impacto ambiental reduzido, a fim de tornar este polímero economicamente competitivo e, desta forma, potencializar a sua aplicabilidade. Dentre os métodos utilizados nos processos de extraçao de PHAs estao: aplicaçao de solventes orgânicos, tais como clorofórmio,18,19 carbonato de propileno,20,21 acetona,22 cloreto de metileno,23,24 acetato de etila19 e diclorometano;25,26 digestores químicos como dodecil sulfato de sódio (SDS),27 hipoclorito de sódio28,29 e hidróxido de sódio;30 fluidos supercríticos;31,32 digestor biológico (enzimas);33-36 aplicaçao de métodos mecânicos como homogeneizador à alta pressao, ultrassom, entre outros;37 métodos combinados como mecânico e químico38,39 e estudos de liberaçao espontânea de PHAs.40 A técnica de extraçao de PHAs com solventes orgânicos é a mais utilizada devido à sua facilidade de aplicaçao, baixa degradaçao e elevada pureza do produto extraído.41 Porém, o emprego de solventes tóxicos e voláteis para a extraçao de PHAs é contraditório à ideia de que estes biopolímeros possam representar alternativas para minimizar as agressoes ambientais causadas pelos polímeros produzidos a partir do petróleo.20 Diversos estudos na literatura propoem o desenvolvimento de metodologias de extraçao de PHAs, a partir de bactérias, que visam diminuir os custos de processo, substituir e/ou diminuir a aplicaçao de produtos químicos tóxicos por produtos atóxicos ou de baixa toxicidade, reduzir o tempo e as etapas de extraçao, diminuir a degradaçao das cadeias poliméricas e aumentar a recuperaçao do biopolímero. Neste contexto, esta revisao reporta algumas das estratégias de processos de extraçao de PHAs, produzidos por bactérias, que envolvem desde o tratamento de desestabilizaçao e/ou rompimento celular até a recuperaçao e obtençao do biopolímero purificado.
EXTRAÇAO DE PHAs A Figura 2 apresenta diferentes estratégias de extraçao de PHAs a partir de biomassa bacteriana.
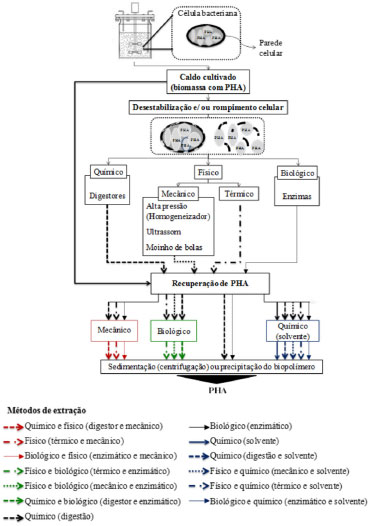 Figura 2. Estratégias de processos de extraçao de PHA produzido por bactérias e a definiçao do método de extraçao que envolve todas as etapas do processo, desde o tratamento da biomassa para desestabilizaçao e/ou rompimento da parede celular até a obtençao do biopolímero
O processo completo de extraçao de PHAs é composto por várias etapas, sendo a primeira, que pode ser realizada ou nao, de tratamento da biomassa com a finalidade de aumentar a recuperaçao polimérica por desestabilizaçao e/ou rompimento da parede celular microbiana.34 Esta primeira etapa é realizada após o cultivo. A biomassa pode ser tratada com métodos químicos (ácidos, álcalis, solvente e detergentes, fluido supercrítico), métodos biológicos (utilizaçao de enzimas), métodos físicos como elevaçao da temperatura ou mecânicos que sao subdivididos em homogeneizador à alta pressao, moinho de bolas, prensa francesa e ultrassom.21,38,42-45 Após o rompimento ou desestabilizaçao da parede celular obtém-se uma suspensao constituída por biopolímero (quando ocorre rompimento celular), meio de cultivo, células com biopolímero (células que tiveram a parede celular desestabilizada, mas nao rompida) e debris celulares (mistura de proteínas, ácidos nucleicos, lipídios e fragmentos de parede celular). No caso de um processo de extraçao sem tratamento prévio da biomassa, este inicia na etapa de separaçao do material sólido, composto por células com biopolímero intracelular, do caldo de cultivo, que geralmente é realizado por centrifugaçao. Para biomassa tratada, esta é a segunda etapa do processo de extraçao. A etapa seguinte é de recuperaçao do biopolímero que pode ser realizada com a utilizaçao de métodos químicos, biológicos e físicos ou com a utilizaçao de métodos combinados como físico e químico, biológico e químico, entre outros. O processo é finalizado após a recuperaçao do biopolímero por sedimentaçao (centrifugaçao) ou por precipitaçao. Nos itens seguintes serao descritos diferentes métodos de extraçao de PHAs. Métodos químicos Os métodos químicos de extraçao de PHAs, a partir de bactérias, envolvem a utilizaçao isolada ou combinada de solventes e digestores químicos. Solvente A técnica de extraçao de PHAs com solventes orgânicos é a mais utilizada devido à sua simplicidade, obtençao de polímeros com elevada pureza e reduzida reduçao da massa molar do produto.41,42,46,47 Define-se como solvente a substância capaz de dissolver o soluto, a fim de formar uma soluçao do soluto no solvente.48 A solubilizaçao do polímero por um determinado solvente é possível quando as interaçoes entre as moléculas do solvente e as cadeias poliméricas apresentam uma magnitude superior à magnitude das interaçoes entre as cadeias poliméricas.49 Na extraçao de PHAs utilizando solvente sob aquecimento, ocorre a modificaçao da permeabilidade da membrana celular pelo solvente e a solubilizaçao do polímero, formando uma suspensao dos debris celulares na soluçao de polímero e solvente.42 A solubilizaçao polimérica é um processo físico reversível, que nao altera a estrutura química polimérica. O polímero sólido em contato com o solvente tende a inchar devido à difusao das moléculas do solvente para dentro da massa polimérica, no volume livre existente entre as cadeias poliméricas, formando um gel.50 A solubilidade de um polímero em um determinado solvente é acrescida com a elevaçao da temperatura e/ou reduçao da massa molar da cadeia polimérica.50 De acordo com Fruet51 e Souza,52 polímeros termoplásticos sao caracterizados por possuírem ligaçoes covalentes entre os átomos nas macromoléculas e estas podem ser rompidas com a inserçao de energia. Portanto, quando os polímeros sao aquecidos, se a energia térmica imposta ao polímero for superior à energia das ligaçoes químicas, algumas dessas ligaçoes podem ser rompidas, causando reduçao na massa molar do polímero.53,54 Após a solubilizaçao do polímero no solvente, o polímero é separado dos debris celulares por filtraçao ou centrifugaçao e o produto final normalmente é obtido após a evaporaçao do solvente ou precipitaçao do polímero por meio da adiçao de um "nao-solvente", como alcoóis e água.55 Nao-solvente é definido como uma substância que é incapaz de dissolver o biopolímero fazendo com que ocorra a precipitaçao do mesmo por induçao e/ou por enfraquecer o poder de diluiçao do solvente.56 Os solventes mais utilizados nos processos de extraçao de PHAs a partir de bactérias sao: clorofórmio, acetona, metil isobutil cetona, cloreto de metileno, carbonato de propileno, acetato de etila e álcool isoamílico.19,21,22,48,57-59 De acordo com Mantellato e Durao48 e Quines et al.,60 o tempo de contato e a temperatura de aquecimento do polímero com o solvente e a eficácia das operaçoes unitárias empregadas na recuperaçao do biopolímero de bactérias sao determinantes na qualidade do produto final, bem como na viabilidade industrial do processo. Solventes halogenados como clorofórmio, dicloroetano, cloropropano e cloreto de metila sao amplamente reportados na literatura para a extraçao de PHAs a partir de bactérias, sendo o clorofórmio o mais estudado.18,21,38,59,61 Ramsay et al.9 realizaram ensaios de extraçao de P(3HB), a partir de Cupriavidus necator, com clorofórmio, cloreto de metileno e dicloroetano. As suspensoes de biomassa celular em solvente foram submetidas à agitaçao constante durante 12 h em temperatura ambiente. Os resultados de recuperaçao de P(3HB) para a extraçao com clorofórmio, cloreto de metileno e dicloro-1,2-etano foram de 27%, 26% e 0%, respectivamente. Os polímeros extraídos com os diferentes solventes apresentaram pureza de 95%. Um processo de extraçao com clorofórmio foi utilizado para a recuperaçao de P(3HB) de células de Zobellella denitrificans. Após 72 h de extraçao a 30 ºC, 85% do P(3HB) foi recuperado com pureza de 98,3%.57 Estes autores também testaram a utilizaçao de cloreto de metileno como solvente na extraçao de P(3HB) e obtiveram um produto com pureza de 98,8%, porém, a máxima recuperaçao de polímero obtida após 72 h de extraçao foi de 36%. Dalcanton18 e Fiorese et al.21 também estudaram a extraçao de PHA de C. necator DSM 545 com clorofórmio a 60 ºC, obtendo porcentagens de recuperaçao superiores a 94% e polímeros com purezas acima de 95%. Com a utilizaçao de solventes halogenados, pode-se obter elevadas porcentagens de recuperaçao de produto com elevada pureza. Porém, o emprego de solventes tóxicos e altamente voláteis para a extraçao de PHAs (como o clorofórmio) é contraditório à ideia de que estes polímeros vêm sendo amplamente estudados para minimizar as agressoes ambientais causadas pelos polímeros de origem petroquímica. Além disso, a utilizaçao destes solventes halogenados (tóxicos) em processos em grande escala exige um rigoroso controle, devido à segurança do processo (exposiçao dos operadores a riscos), utilizaçao de elevados volumes de solventes voláteis (com elevada porcentagem de perda por evaporaçao, aumentando o custo total de produçao) e geraçao de problemas ambientais.46,62,63 De acordo com McChalicher et al.,63 o solvente ideal para a extraçao de biopolímeros a partir de microrganismos, a pressoes atmosféricas, deve ser capaz de dissolver os PHAs abaixo da temperatura de degradaçao do polímero, minimizando a degradaçao de suas cadeias, ser reutilizável e apresentar baixos riscos ambientais. Neste contexto, dentre os solventes utilizados na extraçao de PHAs a partir de biomassa bacteriana, destaca-se o carbonato de propileno, por apresentar várias das propriedades requeridas para um bom solvente.20 O processo de extraçao de PHAs, a partir de bactérias, com carbonato de propileno se baseia nas seguintes etapas: aquecimento da suspensao formada por biomassa e solvente, filtraçao para separaçao da soluçao formada pelo solvente com o polímero solubilizado dos debris celulares, adiçao de um nao-solvente para a precipitaçao polimérica, separaçao do polímero da mistura composta por solvente e nao-solvente e, por fim, secagem do material polimérico.64 A maior porcentagem de recuperaçao de P(3HB) com carbonato de propileno encontrado por Lafferty e Heinzle,20 a partir de Azobacter chroococcum DSM 377, foi 87%, com aquecimento a 140 ºC e tempo de contato de 30 min. Fiorese et al.,21 utilizando este solvente para extraçao de P(3HB), a partir de C. necator, na temperatura e tempo de extraçao de 130 ºC e 30 min respectivamente, obtiveram recuperaçao de 95% e pureza de 84%. Riedel et al.19 testaram diferentes solventes nao halogenados para extraçao de poli(hidroxibutirato-co-hidroxiexanoato) [P(HB-co-HHx)], a partir de Ralstonia eutropha. Os solventes estudados foram metil-isobutil-cetona, metil-etil-cetona, acetato de butila, acetato de etila e álcool isoamílico, e os resultados mais elevados de recuperaçao polimérica obtidos foram com os solventes metil-isobutil-cetona e acetato de etila, de 84% e 93%, respectivamente. A PHB Industrial SA., produtora de PHA da marca BIOCYCLE® em escala industrial no Brasil, utiliza processo de extraçao patenteado, em que sao aplicados alcoóis superiores com cadeia superior a três carbonos e seus ésteres, como álcool isoamílico, acetato de amila, acetato de isoamila e óleo fúsel, resíduo do processo de produçao de etanol, como solventes para extraçao de PHA.65 Segundo Rossel et al.,65 este método de extraçao consiste em recuperar PHA de biomassa bacteriana com solvente nao halogenado, como propionato de isoamila, para solubilizaçao do polímero na fase orgânica. Os debris celulares sao separados da soluçao composta de polímero e solvente por filtraçao e, em seguida, o polímero é precipitado da soluçao por resfriamento, o solvente é removido, o polímero recuperado e submetido à secagem. As vantagens da aplicaçao deste método estao na utilizaçao de apenas um solvente, nao agressivo ao meio ambiente, como extrator e purificador no processo, nao requerendo a utilizaçao de um nao-solvente na etapa de precipitaçao polimérica. A precipitaçao do PHA da soluçao com o solvente é realizada por resfriamento da mesma até temperatura próxima a ambiente.66 Digestor químico A utilizaçao de digestao química para extraçao de PHAs produzido por bactérias envolve a solubilizaçao dos materiais da parede celular, deixando os grânulos de PHAs em suspensao. Os materiais nao poliméricos digeridos neste processo sao ácidos nucleicos, lipídios, fosfolipídios, peptidioglicano e materiais proteicos (debris).67,68 Vários estudos relatam a utilizaçao de digestores químicos para recuperaçao de PHAs, mas a eficácia do método depende da espécie microbiana da qual será realizada a extraçao.35,38,69 Os digestores mais utilizados sao o dodecil sulfato de sódio (SDS), hipoclorito de sódio (NaClO), hidróxido de sódio (NaOH) e o ácido sulfúrico (H2SO4).6,29,55,70 Hahn et al.,70 utilizando hipoclorito de sódio no processo de extraçao de P(3HB), obtiveram 86% e 93% de recuperaçao a partir de Alcaligenes eutrophus e E. coli recombinantes, respectivamente. Porém, durante essa digestao ocorreu degradaçao de P(3HB), resultando em uma reduçao da massa molar de 50% após o processo de extraçao. Segundo Yu,68 o hipoclorito de sódio é um agente oxidante nao seletivo que digere tanto o material nao polimérico como os grânulos poliméricos, resultando na elevada degradaçao da massa molar do biopolímero recuperado. Heinrich et al.71 desenvolveram um método simplificado para extraçao de P(3HB) em escala piloto (tanque de reaçao de 50 L), utilizando hipoclorito de sódio. Este método se baseia nas seguintes etapas: células secas suspensas em uma soluçao de hipoclorito de sódio 13% (v/v) com pH de 12,3 durante 1 h, precipitaçao do polímero com adiçao de água e lavagem do material polimérico com isopropanol para a remoçao do material lipídico. O P(3HB) foi extraído de células de Ralstonia eutropha H16 com resultados de 96% de pureza e recuperaçao de 87,03%. Estes autores compararam a degradaçao da massa molar do polímero extraído com hipoclorito de sódio ao extraído com clorofórmio e observaram uma reduçao da massa molar polimérica de até 70% quando se utilizou hipoclorito de sódio (460 kDa) em comparaçao com clorofórmio (1700 kDa). Yang et al.27 realizaram extraçao de PHA de R. eutropha H16 utilizando dodecil sulfato de sódio (SDS) como digestor e os resultados obtidos após 3 h de extraçao foram de 95% de recuperaçao e 83% de pureza. Embora o método de digestao com SDS seja simples e eficaz para a digestao dos materiais celulares e a liberaçao dos grânulos de PHA com elevadas purezas, este causa problemas de águas residuais.55,68,72,73 Mohammadi et al.30 propuseram um processo de extraçao de PHA sustentável, produzido por Cupriavidus necator, que envolve a utilizaçao de NaOH em baixa concentraçao. O uso do NaOH é baseado no fato que este reagente provoca a saponificaçao da camada lipídica da célula e aumenta a permeabilidade da membrana celular facilitando assim, a liberaçao do material polimérico.59 Os resultados de recuperaçao e pureza foram de 96,9% e 96,6%, respectivamente. Além dos resultados satisfatórios obtidos, este tratamento alcalino provocou uma baixa degradaçao da massa molar (13%). Yu68 utilizou H2SO4, NaOH e hipoclorito de sódio para a digestao do material nao polimérico e recuperaçao de PHA produzido por bactéria. O método baseia-se no fato de que ácidos inorgânicos, como o ácido sulfúrico, em baixas concentraçoes, sao agentes oxidantes seletivos que podem dissolver a massa celular (nao polimérica) em pequenos detritos causando poucos danos aos grânulos de PHA. O método abordado neste compreendeu as seguintes etapas: Primeiramente a biomassa seca foi tratada com soluçao de H2SO4 (0,1 mol L-1) a 100 ºC/2 h, para dissolver o material nao polimérico. Na sequência, o pH da suspensao (células e H2SO4) foi elevado de 7 para 10 com a adiçao de NaOH para a saponificaçao do material lipídico e, em seguida, submetida à centrifugaçao (4.000 g/20 min) para a separaçao dos debris celulares dissolvidos em soluçao do material polimérico. Após, o material polimérico foi ressuspenso em uma soluçao de NaClO (6%) durante 2 h para branqueamento e, por fim, o polímero foi submetido à secagem. Com este método a recuperaçao de PHA foi de 94,9% de com pureza de 99,9% e o autor verificou também que os PHAs sao vulneráveis à saponificaçao em soluçao alcalina, podendo ocorrer degradaçao polimérica, mas por outro lado, sao altamente resistentes à hidrólise ácida. Estudo semelhante foi desenvolvido por Yu et al.,29 que realizaram a digestao de células de Ralsthonia eutropha H16 para a recuperaçao de P(3HB). Os autores primeiramente realizaram hidrólise ácida do material nao polimérico com H2SO4 para solubilizaçao da massa celular. Posteriormente os grânulos poliméricos foram suspensos em água e o pH da suspensao foi elevado para aproximadamente 10 por meio da adiçao de NaOH. A suspensao foi mantida sob agitaçao durante 30 - 60 min e um branqueamento do material polimérico com hipoclorito de sódio foi realizado. Por fim, uma soluçao de SDS foi adicionada. A recuperaçao de P(3HB) foi de 92,6% com pureza de 99,4%. Segundo estes autores, a parede celular de R. eutropha torna-se porosa com o tratamento ácido, no qual ocorre a liberaçao de proteínas e de outros componentes biológicos do citoplasma, mas a estrutura da célula mantém os grânulos de P(3HB) em seu interior. Com o tratamento alcalino (NaOH), a parede celular é desestabilizada e o branqueamento com hipoclorito de sódio, nesse caso, realiza uma última etapa de digestao do material nao polimérico e eleva a pureza do P(3HB) obtido. Embora com esta técnica se obtenha elevadas porcentagens de recuperaçao polimérica e de pureza, isto nao compensa os altos custos dos reagentes como SDS e hipoclorito de sódio, devido aos elevados volumes de reagentes necessários e aos problemas ocasionados pela presença de surfactantes nas águas residuais.70 Método combinado digestor químico e solvente O método de extraçao de PHAs de microrganismos a partir do uso combinado de digestor químico e solvente é amplamente utilizado. O digestor químico digere o material celular (nao polimérico) para facilitar a solubilizaçao do polímero pelo solvente, sendo necessária ainda uma etapa de precipitaçao do polímero, que pode ser por meio da adiçao de um nao-solvente. Este método, quando comparado aos métodos que utilizam somente digestao química ou somente solvente, apresenta algumas vantagens, entre elas a obtençao de polímeros mais puros, com porcentagens de recuperaçao mais elevadas e, em alguns casos, reduzido tempo de contato da biomassa com o agente químico (solvente e/ou digestor).17,42,70,74-76 Porém, com este método tem-se um incremento de etapas no processo de extraçao e a aplicaçao de mais um produto químico no mesmo. Tamer et al.28 combinaram dois digestores químicos, SDS e hipoclorito de sódio, para extraçao de P(3HB) produzido por Alcaligenes latus. Após a digestao do material celular com SDS durante 1 h a 35 ºC, a suspensao foi centrifugada e o precipitado suspenso em hipoclorito de sódio durante 25 h. Este método, com algumas modificaçoes, foi aplicado por Kshirsagar et al.77 para a recuperaçao de PHA de Halomonas campisalis e apenas 16,5% do biopolímero foi recuperado. Samrot et al.76 obtiveram 94% de recuperaçao de PHAs de Enterobacter cloacae no processo de extraçao com clorofórmio e hipoclorito de sódio, e precipitaçao do polímero com a adiçao de etanol. Kshirsagar et al.77 também utilizaram hipoclorito de sódio (4% v/v) e clorofórmio puro para a recuperaçao de PHA a partir de células de Halomonas campisalis. Neste estudo, 300 mg de células foram ressuspensas em uma mistura contendo 50 mL de clorofórmio e 50 mL de hipoclorito de sódio. Esta suspensao foi aquecida a 35 ºC e mantida sob agitaçao a 150 rpm, durante 90 min e, após centrifugaçao, foi obtida recuperaçao polimérica de 47%. Hahn et al.,70 com um método de extraçao semelhante ao anterior, porém com uma soluçao de hipoclorito de sódio mais concentrada (30% v/v), obtiveram 91% de recuperaçao de P(3HB) produzido por Alcaligenes eutrophus. A extraçao de P(3HB) a partir de Bacillus megaterium MTCC 453 com digestao química e solubilizaçao do material polimérico em solvente foi descrita por Prasanna et al.78 O processo de extraçao envolveu três etapas. Na primeira foi adicionado clorofórmio e hipoclorito de sódio à biomassa, seguido de filtraçao para separaçao dos debris celulares da soluçao polimérica (polímero e clorofórmio). Na terceira e última, ocorreu a precipitaçao do P(3HB) por meio da adiçao de metanol e água. Ao final do processo, os autores obtiveram uma recuperaçao de P(3HB) de 84%. Bhattacharyya et al.79 descreveram um método de extraçao de P(3HB) da biomassa de Haloferax mediterranei com a utilizaçao de digestores e solvente. Nesse trabalho, a biomassa foi suspensa em SDS durante 24 h, em seguida foi centrifugada e, ao precipitado formado por polímero e resíduos celulares remanescentes, adicionou-se uma soluçao de hipoclorito de sódio (30% v/v). A mistura foi centrifugada e o precipitado lavado com água, acetona e etanol e posteriormente dissolvido em clorofórmio em ebuliçao. Finalmente, a suspensao de polímero composta por solvente e resíduo celular foi filtrada e o clorofórmio entao evaporado. A porcentagem de recuperaçao de P(3HB) a partir do método descrito foi de 97%. Acetona foi utilizada como solvente na extraçao de PHA de cadeia média, produzido por Pseudomonas putida KT2440. Neste estudo, foi avaliado o impacto do tratamento da biomassa com dois digestores, metanol e NaOH (0,1 mol L-1), sobre a porcentagem de recuperaçao e de pureza do polímero, após extraçao com acetona. O metanol se mostrou mais adequado para o tratamento desta biomassa e a porcentagem de recuperaçao obtida nesse processo de extraçao com metanol e acetona foi de 94%.80 Embora os resultados de recuperaçao e pureza de PHAs obtidos a partir da extraçao com a combinaçao de digestores químicos e solventes, de células microbianas, sejam elevados, eles nao compensam os problemas relacionados aos excessivos volumes de produtos químicos utilizados (muitas vezes com elevada toxicidade), tornando o processo caro e com geraçao de grandes volumes de águas residuais.38,70,75,81 Fluido supercrítico A aplicaçao de fluidos supercríticos (SCF) tem sido estudada para rompimento celular e extraçao de PHAs produzidos por bactérias.32,45,82 O dióxido de carbono (CO2) é o fluido supercrítico mais amplamente estudado devido à sua baixa toxicidade e reatividade, moderada temperatura e pressao crítica (31 ºC e 73 atm) e devido ao fato de nao ser inflamável e ao ser de baixo custo.31 Hejazi et al.31 desenvolveram um método de extraçao de P(3HB) de R. eutropha com fluido supercrítico e 89% de polímero foi recuperado nas seguintes condiçoes: CO2 como fluido supercrítico, tempo de 100 min, pressao de 200 atm e temperatura de 40 ºC. Khosravi-Darani et al.45 estudaram a extraçao de P(3HB), produzido por Cupriavidus necator, com um método que combina a aplicaçao de hidróxido de sódio e fluido supercrítico. NaOH (0,4% m/m) foi aplicado na biomassa úmida para a desestabilizar a parede celular e facilitar o rompimento das células na etapa de extraçao com fluido supercrítico (CO2, 200 bar, 30 ºC). Com este método, foi obtida uma recuperaçao polimérica de 81%. Segundo estes autores, as variáveis que influenciam na extraçao supercrítica de P(3HB), produzido por bactéria, sao estratégia de secagem da biomassa, tempo de cultivo, pressao e temperatura de operaçao. Esse método de extraçao apresenta algumas vantagens, pois utiliza produto químico atóxico, de baixo custo e temperatura de operaçao branda (30 ºC), possibilitando a obtençao de PHAs com elevada pureza e características térmicas e mecânicas mais preservadas.14,32,42 O maior obstáculo ao uso da tecnologia supercrítica na indústria é a viabilidade econômica do processo, devido ao alto investimento necessário para a instalaçao de uma unidade de extraçao com fluido supercrítico. Seu alto custo é devido principalmente aos equipamentos e acessórios em aço inoxidável e pela necessidade de serem resistentes às altas pressoes empregadas no processo.83,84 Métodos físicos Segundo Medeiros et al.,85 a ruptura celular pode ser o primeiro passo no processo de recuperaçao de produtos intracelulares, apresentando influência direta na porcentagem de recuperaçao e na qualidade do bioproduto obtido. O rompimento mecânico de células geralmente é um método eficaz, pois causa pequenos danos aos produtos intracelulares.85-88 A eficiência dessa técnica de rompimento celular para recuperaçao de bioprodutos está relacionada com algumas propriedades das células, como resistência física da parede celular e localizaçao intracelular do produto de interesse.89,90 No processo de extraçao de PHAs a partir de bactérias, o rompimento mecânico de células pode representar o processo de extraçao como um todo, em que, após o rompimento celular, é necessária apenas uma etapa de ultracentrifugaçao do caldo de cultivo para separar os debris celulares do material polimérico.38,91 Segundo Garcia,39 métodos mecânicos de extraçao, quando comparados aos químicos, conferem melhores propriedades térmicas ao polímero. Esses métodos surgem como uma alternativa interessante, por serem econômicos e, de acordo com Middelberg,92 sao amplamente aplicáveis a técnicas de extraçao em larga escala. A seguir estao descritos os métodos de extraçao de PHAs com homogeneizador, ultrassom e moinho de bolas. Homogeneizador à alta pressao A ruptura celular por homogeneizaçao à alta pressao pode ser utilizada em diversas aplicaçoes, como por exemplo, biotecnológica, farmacêutica, cosmética, entre outras, sendo amplamente utilizada para liberaçao de proteínas intracelulares e para inativaçao de microrganismos.93-96 Na homogeneizaçao à alta pressao, o rompimento celular está baseado na passagem da biomassa por uma válvula com orifício estreito, seguido de despressurizaçao e grande aumento da velocidade de escoamento, com consequente cavitaçao e alta tensao de cisalhamento ocasionando a deformaçao/rompimento das células em suspensao.97-100 Tamer et al.37 estudaram o rompimento celular de Alcaligenes latus com homogeneizador à alta pressao (pressao de operaçao de 900 bar) para recuperaçao de P(3HB). Estes autores avaliaram a eficiência do método com a variaçao da concentraçao celular do caldo cultivado e o número de passagens da suspensao pelo equipamento. Foi observado que o desempenho do homogeneizador depende da concentraçao da biomassa utilizada, ou seja, quanto mais concentrado o caldo cultivado, maior a eficiência da alta pressao no rompimento celular. O número de passagens pelo homogeneizador também apresentou influência no rompimento celular para recuperaçao de P(3HB). Van Hee et al.101 reportam a utilizaçao de homogeneizador à alta pressao para extraçao de PHA produzido por P. putida com recuperaçao polimérica de 46% e pureza de 80%. Nesse método, a biomassa foi submetida à pressao de 1600 bar, seguido de centrifugaçao do caldo a 30.000 g durante 3 h para a separaçao dos debris celulares do material polimérico. Segundo os autores, perdas de PHA podem ter ocorrido na etapa de centrifugaçao da biomassa, uma vez que nesse estudo os debris celulares (densidade de 1,085 kg m-3) foram sedimentados e o biopolímero (densidade de 1,000 kg m-3) foi recuperado do sobrenadante e, consequentemente, podem ter ocorrido perdas de material polimérico no precipitado. Um método de extraçao de P(3HB) a partir de E.coli recombinante, com homogeneizador à alta pressao, foi proposto por Ling et al.91 com pressao de operaçao de 550 bar, 4 passagens da biomassa pelo equipamento e posterior centrifugaçao para a recuperaçao do biopolímero do sedimentado. Os resultados obtidos neste trabalho foram 90,2% de pureza e 72% de recuperaçao. Segundo Ghatnekar et al.,38 a utilizaçao de digestor químico combinado com homogeneizador à alta pressao, na extraçao de P(3HB), facilita a liberaçao do polímero das células aumentando a porcentagem de recuperaçao. Os principais fatores que influenciam no rompimento celular com homogeneizador à alta pressao sao a pressao de operaçao, o número de passagens da suspensao celular pelo equipamento e a concentraçao celular da suspensao. A desvantagem do processo de homogeneizaçao na extraçao de PHAs é a possibilidade de degradaçao do produto e formaçao de detritos celulares muito finos que podem comprometer a pureza do biopolímero recuperado.37,38,102 A aplicaçao de homogeneizador à alta pressao para rompimento celular e recuperaçao de PHAs, produzidos por bactérias, resulta em porcentagens de recuperaçao inferiores a 72% devido a perdas de produto na etapa de separaçao dos debris celulares do material polimérico. Logo, a utilizaçao deste método combinado com a utilizaçao de produtos químicos como digestores e solventes pode aumentar a eficiência na recuperaçao polimérica de biomassa bacteriana.101 Ultrassom O rompimento celular por ultrassom tem sido aplicado em diversos processos de separaçao para obtençao de bioprodutos a partir de microrganismos.86,103-105 Esta técnica refere-se a um método de perturbaçao mecânica, em que as ondas ultrassônicas (alta frequência) sao transferidas por uma ponteira metálica e dissipadas em um sistema líquido (suspensao celular), por meio de bolhas de cavitaçao, formando uma espécie de campo, no qua ocorre aumento de massa e consequente transferência de calor para o meio líquido, produzindo um gradiente de velocidade e a criaçao de uma força capaz de desestabilizar a parede celular.88,106,107 Dados da literatura reportam a utilizaçao de tratamentos da biomassa com ultrassom como uma etapa do processo de extraçao de PHAs de bactérias para promover a desestabilizaçao da parede celular e, assim, facilitar a açao de solventes e digestores e, consequentemente, melhorar a recuperaçao do polímero obtido.108,109 De uma forma geral, o processo de ultrassonificaçao para recuperaçao de bioprodutos é bastante aplicado em escala laboratorial, porém, em grande escala seu uso ainda é limitado e de custo elevado, devido à necessidade de utilizaçao de uma grande quantidade de sondas e da instalaçao de um sistema de refrigeraçao eficiente.110 Moinho de bolas Neste método, utilizam-se pérolas de vidro em um recipiente contendo a suspensao celular. O rompimento celular com moinho de bolas ocorre a partir do choque de esferas com a biomassa, o que promove transferência de energia e consequente rompimento das células. O tamanho das esferas, a velocidade de agitaçao do moinho e a concentraçao celular sao alguns fatores que interferem neste processo.37 A eficiência do rompimento celular com moinho de bolas depende de vários parâmetros, como tempo de residência, forças de cisalhamento, tipo de microrganismo, concentraçao da suspensao celular e velocidade de agitaçao. A desvantagem deste método está no fato de haver uma grande quantidade de interferentes, como, por exemplo, geometria da câmara de rompimento, velocidade e tipo de agitador, tamanho das esferas, quantidade de esferas, diâmetro das esferas, concentraçao celular e temperatura, sua eficiência e a possibilidade de quebra das cadeias poliméricas.39 Este método é utilizado juntamente com a aplicaçao de produtos químicos, como solventes, no processo de recuperaçao de PHAs.39 Método combinado físico (mecânico) e químico A aplicaçao do método mecânico para extraçao de biopolímero terá seu potencial de recuperaçao aumentado se for associado a um método químico adequado, que possibilite elevada recuperaçao de PHA no processo de extraçao sem promover alteraçoes significativas nas suas características.56 Métodos mecânicos de ruptura celular para recuperaçao de PHAs vêm sendo aplicados em conjunto com solventes, digestores químicos ou enzimáticos e representam uma das etapas de um processo de extraçao (rompimento celular), sendo necessárias etapas posteriores para a recuperaçao e purificaçao do biopolímero.37,38,44 Porém, após o rompimento mecânico, a escolha criteriosa dos solventes e digestores e das condiçoes operacionais do processo de extraçao é fundamental para manter ao máximo a integridade do biopolímero, tendo em vista que as características do biopolímero dependem diretamente do tratamento da biomassa, do solvente ou digestor utilizado, da temperatura de aquecimento utilizada e do tempo de contato do polímero com o solvente.41,111 Homogeneizador à alta pressao e digestor químico Alguns autores desenvolveram tecnologias de extraçao de PHAs a partir de bactérias com homogeneizador à alta pressao associado a um tratamento químico e obtiveram resultados de recuperaçao e pureza elevados.28,38,91 Ghatnekar et al.38 utilizaram SDS (5% m/v) e homogeneizador à alta pressao (dois ciclos de 392 bar) para extraçao de P(3HB) produzido por Methylobacterium SP e obtiveram uma porcentagem de recuperaçao de biopolímero de 98% com pureza de 95%. O SDS foi aplicado para facilitar a permeabilidade das células e facilitar a liberaçao dos grânulos de P(3HB) na etapa de homogeneizaçao da biomassa. Segundo estes autores, o processo combinado de extraçao com aplicaçao de SDS na biomassa antes da homogeneizaçao à alta pressao apresenta-se como um método eficiente. Ling et al.91 realizaram extraçao de P(3HB) a partir de E.coli recombinante com homogeneizador à alta pressao (quatro ciclos de 550 bar) e obtiveram 72% de biopolímero recuperado. Quando estes autores acrescentaram uma etapa de digestao, do material nao polimérico com hipoclorito de sódio, no processo de recuperaçao de P(3HB) com homogeneizador, obtiveram 81% de recuperaçao de biopolímero, com pureza de 96,5%. Homogeneizador à alta pressao e solvente A influência da utilizaçao de homogeneizador à alta pressao em conjunto com a aplicaçao de solvente, carbonato de propileno, na extraçao de P(3HB) de Cupriavidus necator, visando o aumento da recuperaçao, foi estudada por Quines et al.60 Primeiramente, foi realizado o tratamento da biomassa à alta pressao com duas passagens em homogeneizador a 1300 bar, para rompimento celular, e, posteriormente, as células foram suspensas em solvente sob aquecimento. Por fim, o polímero foi precipitado com adiçao de um nao-solvente (água). Os resultados mais elevados de recuperaçao (94,4%) e pureza (99%) para este método combinado de extraçao foram obtidos com temperatura de extraçao de 150 ºC, tempo de contato das células com o solvente de 5 min, relaçao biomassa/solvente de 0,15 g mL-1. Segundo estes autores, o tratamento da biomassa sob alta pressao antes da aplicaçao do solvente foi eficiente nos resultados de extraçao, pois possibilitou a reduçao do tempo de extraçao de 45 min para 5 min e esta combinaçao de métodos pode proporcionar economia de energia e de tempo de processo e a obtençao de um polímero com a massa molar mais preservada.60 Prensa francesa e digestor químico Gözke et al.112 desenvolveram um método de recuperaçao de P(3HB), a partir de C. necator DSM 428, que envolveu tratamento da biomassa, para rompimento celular, com tris-(hidroximetil)-aminometano (Tris) / HCl a pH 9 e duas passagens da biomassa em prensa francesa com pressao de 2000 psi. Após o rompimento celular, estes autores propuseram a utilizaçao de eletrofiltraçao, processo híbrido que combina filtraçao e eletroforese, para a recuperaçao do biopolímero. Segundo os autores, é uma estratégia inovadora no processo de recuperaçao de P(3HB) com reduçao do tempo de processamento, de energia e dos custos de purificaçao. Moinho de bolas e solvente Garcia39 propôs um método mecânico alternativo para extraçao do P(3HB) usando para ruptura celular pérolas de vidro em moinho de bolas. Pérolas de vidro e clorofórmio foram adicionados à biomassa e a suspensao foi submetida a aquecimento e agitaçao constantes. Em seguida, foram centrifugadas, e formaram-se três fases distintas, sendo a fase inferior composta pelas pérolas de vidro, a fase intermediária contendo uma soluçao de polímero e clorofórmio e a fase superior formada pelos debris celulares. Este método mecânico e químico desenvolvido para extraçao de P(3HB) de C. necator apresentou uma recuperaçao de 64% de polímero com pureza de 89%. Ultrassom e solvente Um processo de extraçao de P(3HB), de Azohydromonas lata DSM 1123, com a utilizaçao de método físico e químico foi descrito por Penloglou et al.44 Este método envolveu duas etapas, sendo que a primeira consistiu no rompimento celular com ultrassom (60 pulsos de 30 s de sonicaçao e 5 s de pausa). Na segunda etapa, a solubilizaçao do biopolímero foi realizada com clorofórmio a 30 ºC durante 1,5 h sob agitaçao constante, e o polímero foi precipitado com a adiçao de metanol. Segundo os autores, esse método mostrou-se eficiente para a extraçao de P(3HB) de células de A. lata. Quines et al.109 utilizaram carbonato de propileno associado à aplicaçao de ultrassom para a extraçao de P(3HB), produzido por Cupriavidus necator DSM 545. Este método envolve a aplicaçao do ultrassom para desestabilizaçao e/ou rompimento da biomassa e para facilitar a açao do solvente no processo de solubilizaçao do material polimérico. A biomassa foi submetida a três ciclos de aplicaçao de ultrassom de 59 s e pausa de 30 s e recuperaçao polimérica com carbonato de propileno a 150 ºC por 45 min, e recuperou-se 92% de P(3HB), com 99% de pureza. Desta maneira, o método combinado de utilizaçao do ultrassom e carbonato de propileno para extraçao de P(3HB), produzido por C. necator, pode ser uma eficiente opçao de processo. Mesmo com a obtençao de resultados de recuperaçao elevados, este método de extraçao tem sua aplicaçao limitada, devido à dificuldade de implantaçao deste equipamento em grande escala.93,109 Método biológico Os métodos biológicos de extraçao de PHAs bacteriano sao uma alternativa aos métodos que utilizam reagentes químicos e baseiam-se na aplicaçao de enzimas, como lisozimas, nucleases e proteases, para a recuperaçao do biopolímero.34,35 Enzimático O método enzimático é um processo complexo para recuperaçao de PHAs. Este método consiste na adiçao de enzimas ao caldo cultivado para hidrolisar as células que contêm o PHA. Vários tipos de enzimas sao utilizados neste processo, principalmente as proteases. Essa técnica é atraente devido às condiçoes amenas de operaçao, pela alta seletividade das enzimas em hidrolisar proteínas da parede celular bacteriana e consequente lise, sem agir na degradaçao polimérica e pela qualidade do polímero recuperado.34,113 Kapritchkoff et al.34 estudaram diferentes enzimas para a recuperaçao e purificaçao de P(3HB) produzido por C. necator. Nesse método, inicialmente, o caldo cultivado foi tratado a 85 ºC durante 15 min e depois a 95 ºC durante 45 min, a fim de desnaturar as proteínas da parede celular e desestabilizar a membrana externa da bactéria. Este tratamento também desnatura a PHB-depolimerase, enzima presente na parede do grânulo polimérico, capaz de degradar o biopolímero.114 A biomassa foi submetida a tratamento enzimático, para lise celular, com variaçao da temperatura e tempo de reaçao. As enzimas testadas foram: quimiotripsina bovina, tripsina bovina, bromelina, papaina, lisozima, celulase e pancreatina bovina. O melhor resultado obtido por esses autores foi utilizando pancreatina, a 50 ºC durante 8 h, e obtiveram recuperaçao de P(3HB) de 90,3% com pureza de 62,2%. García et al.115 utilizaram este método para extraçao de P(3HB) de C. necator com a aplicaçao de bromelina. Após 10 h da açao enzimática na biomassa, os autores recuperaram 90% de P(3HB) com 88,8% de pureza. A empresa Zeneca BioProducts, produtora de PHAs da marca BIOPOL®, na Inglaterra, desenvolveu um processo de extraçao que envolve digestao enzimática para recuperaçao de PHA produzido por bactéria. Neste processo, primeiramente a biomassa contendo PHA é tratada termicamente a 100 ºC para que possa ocorrer a lise celular, a dissoluçao de ácidos nucleicos e a desnaturaçao de proteínas pelo aquecimento. Em seguida, a biomassa é submetida à digestao por uma mistura de várias enzimas hidrolíticas como lisoenzimas, fosfolipases, lecitinases, proteinases entre outras. A maior parte do material celular é hidrolisado por essas enzimas, enquanto o polímero permanece intacto.2,116 O método de recuperaçao de PHAs utilizando digestao enzimática é seletivo e eficiente em termos energéticos, conduz a bons níveis de recuperaçao polimérica e oferece menor risco de danos ao produto. Porém, a complexidade da técnica para aplicaçao em grande escala, o elevado custo das enzimas empregadas e a impossibilidade de sua reutilizaçao resultam no aumento do custo do processo, tornando este o principal inconveniente do método.34,42,65 Método biológico e químico Estudos reportados na literatura descrevem processos que envolvem a combinaçao da digestao enzimática com a aplicaçao de produtos químicos, como digestores e solventes, para a extraçao de PHAs produzidos por bactéria.36,87,117 Enzimas e digestor químico Yasotha et al.118 estudaram a combinaçao de alcalase, SDS e Etilenodiamino tetra-acético (EDTA) para digerir o material nao-polimérico na extraçao de PHA de Pseudomonas putida. Antes do tratamento enzimático, o caldo de cultivo foi tratado termicamente a 121 ºC durante 1 min em autoclave. A suspensao celular foi entao submetida à digestao com Alcalase e SDS a pH 8,5 e temperatura de 55 ºC, seguido da adiçao de EDTA e lisozima a pH 7 e temperatura de 30 ºC, por 15 min. Com este método, foi obtido um polímero com pureza de 92,6% e recuperaçao de 90%. Martino et al.119 também utilizaram o método que combina o tratamento da biomassa, de C. necator DSM 428, com SDS, EDTA e enzima alcalase. Segundo os autores, o SDS foi utilizado para romper as células, uma vez que penetra na bicamada lipídica, e o EDTA auxilia a açao do SDS por complexaçao de cátions bivalentes para a desestabilizaçao da membrana celular externa. Após a lise celular, os debris celulares foram solubilizados por meio da digestao com a enzima alcalase. O P(3HB) recuperado com este método de extraçao, sem a etapa de tratamento térmico anterior à digestao enzimática, apresentou pureza superior a 90%.113 Enzimas e solvente Neves e Müller36 desenvolveram um método de extraçao de P(3HB-co-3HV) produzido por C. necator envolvendo tratamento térmico, hidrólise enzimática e recuperaçao do polímero com clorofórmio. Estes autores avaliaram a açao de diferentes proteases e glicosidases para hidrólise do material celular, após tratamento térmico em autoclave durante 15 min a 121 ºC, para desestabilizar a parede celular e facilitar a hidrólise enzimática. Das nove enzimas avaliadas, a glicosidase, Celumax BC®, foi a que apresentou melhor resultado, quando o tratamento com esta enzima foi realizado a 60 ºC e pH 4,0. A recuperaçao de P(3HB-co-3HV) foi realizada com a adiçao de clorofórmio ao material hidrolizado e posterior centrifugaçao, em que obtiveram uma soluçao de polímero em solvente (clorofórmio). Com a evaporaçao do solvente, ocorreu a formaçao de um filme polimérico com recuperaçao de 94,5% de P(3HB-co-3HV) com 91% de pureza. O elevado custo das enzimas e a necessidade de etapas adicionais de digestao do material celular ou de solubilizaçao do biopolímero com uso de solventes tornam este processo complexo e dispendioso.42,120 Método físico, biológico e químico Enzimas, homogeneizador à alta pressao e digestor químico De acordo com Harrison,93 o processo de extraçao de PHA produzido por C. necator que envolve homogeneizaçao à alta pressao e digestao do material nao polimérico por enzimas e detergente é eficiente para ruptura celular e recuperaçao do biopolímero após a remoçao dos debris celulares. Horowitz e Brennan87 propuseram um método de extraçao de PHA com a combinaçao de rompimento celular com digestao enzimática e tratamento mecânico e digestao dos debris celulares com a adiçao de digestores químicos para a recuperaçao de PHA de Pseudomonas putida. Assim, a enzima Benzonase (uma nuclease comercial) foi adicionada ao caldo cultivado para desestabilizar a parede celular da bactéria e facilitar o processo de rompimento celular por homogeneizaçao à alta pressao (15.000 psi). Posteriormente, a suspensao com células lisadas foi submetida a um segundo tratamento enzimático com Lisozima, Alcalase e Flavourzyme para a digestao do material nao polimérico. Ao final desta etapa, uma soluçao de água e álcool cetoestearílico etoxilado (0,25%) foi adicionada ao polímero e, por fim, ozônio foi injetado na suspensao contendo PHA, álcool, e impurezas remanescentes, para a purificaçao do produto. Segundo estes autores, com a adiçao de ozônio no processo de extraçao de PHA pode-se obter um produto com elevada pureza, pois este solubiliza impurezas, e livre de odores. Síntese dos métodos de extraçao de PHAs produzidos por bactérias A Tabela 1 sintetiza alguns métodos de extraçao de PHAs, a partir de bactérias, reportados da literatura, com seus respectivos resultados de porcentagens de pureza e porcentagens de recuperaçao, microrganismo produtor do biopolímero e vantagens e desvantagens de cada processo de extraçao.
CONCLUSAO Neste artigo, diversos aspectos a cerca da extraçao de PHAs foram revisados, tais como o método químico, que faz uso de solventes e é extensivamente utilizado por proporcionar altos percentuais de recuperaçao de PHAs; a utilizaçao de digestores químicos também é bastante estudada por proporcionar resultados de recuperaçao polimérica significativos. A maioria dos estudos realizados com métodos químicos faz uso de solventes e digestores tóxicos e altamente voláteis, sendo contraditórios ao fato de que estes polímeros sao amplamente estudados para minimizar as agressoes ambientais causadas pelos polímeros de origem petroquímica. Adicionalmente, os métodos biológico e físico sao uma alternativa positiva para a extraçao de PHAs, pois nao há a necessidade de inserçao de produtos químicos ao processo, mas apresentam resultados de recuperaçao polimérica inferiores aos encontrados nos demais métodos. Por outro lado, estes métodos têm sua eficácia aumentada quando combinados aos químicos. A combinaçao de métodos de extraçao possui potencial neste contexto, pois facilita o rompimento celular, a recuperaçao polimérica e muitas vezes, reduz o tempo de processo, bem como a aplicaçao de produtos químicos tóxicos. As estratégias de extraçao de PHAs em desenvolvimento abordados neste artigo indicam claramente que a maioria dos métodos visa, sobretudo, a obtençao de elevados percentuais de recuperaçao e pureza de biopolímero. No entanto, é imprescindível a realizaçao de estudos que abordem os métodos de extraçao e relacionem a eficiência do processo à influência do mesmo nas características do produto final, como na massa molar, por exemplo. Esta característica polimérica é de extrema importância, pois está diretamente relacionada à aplicaçao do polímero e ao tempo de degradaçao do mesmo, quando descartado. Neste sentido, para tornarem-se competitivos com os plásticos petroquímicos, os PHAs necessitam ter os custos de produçao reduzidos, características semelhantes e/ou superiores às apresentadas por alguns plásticos convencionais e terem aplicaçoes de alto valor agregado, como o uso em aplicaçoes médicas. Para tanto, na etapa de produçao, além da busca por altas densidades celulares e produtividades de polímero, sao necessárias pesquisas com o propósito de desenvolvimento de estratégias de cultivo que proporcionem PHAs com elevados índices de massa molar, bem como o desenvolvimento de cepas geneticamente modificadas capazes de sintetizar PHAs com massas molares comparáveis às dos plásticos de origem petroquímica. Os PHAs sao potenciais substitutos aos plásticos de origem petroquímica, por possuírem propriedades semelhantes aos materiais termoplásticos, serem biodegradáveis e passíveis de produçao a partir de matérias-primas renováveis, porém, a sua aplicabilidade está diretamente ligada aos processos de produçao e de extraçao. Por essas razoes, na etapa de extraçao se deve buscar: reduzir as perdas de produto, obter um produto de elevada pureza e com suas características físicas e térmicas preservadas, obter um produto que se enquadre no termo sustentável, utilizando-se produtos químicos de baixa toxicidade que nao comprometam o meio ambiente, reduzir custos de processo por meio da reutilizaçao dos produtos químicos (solventes e nao-solventes) e desenvolver um processo possível de ser aplicado em escala industrial.
REFERENCIAS 1. Manangan, T.; Shawaphun, S.; ScienceAsia 2010, 36, 199. DOI: http://dx.doi.org/10.2306/scienceasia1513-1874.2010.36.199 2. Byrom, D.; Trends Biotechnol. 1987, 5, 246. DOI: http://dx.doi.org/10.1016/0167-7799(87)90100-4 3. Anderson, A. J.; Dawes, E. A.; Microbiol. Rev. 1990, 54, 450. PMID: 2087222 4. Squio, C. R; Aragao, G. M. F.; Quim. Nova 2004, 27, 615. DOI: http://dx.doi.org/10.1590/S0100-40422004000400016 5. Shrivastav, A.; Kim, H. Y.; Kim, Y. R.; BioMed Res. Int. 2013, 2013, 12. 6. Lee, S. Y.; Biotechnol. Bioeng. 1996, 49, 1. DOI: http://dx.doi.org/10.1002/(SICI)1097-0290(19960105)49:1<1::AID-BIT1>3.0.CO;2-P PMID: 18623547 7. Steinbuchel, A.; Hustede, E.; Liebergesell, M.; Pieper, U.; Timm, A.; Valentin, H.; FEMS Microbiol. Rev. 1992, 103, 217. DOI: http://dx.doi.org/10.1111/j.1574-6968.1992.tb05841.x 8. Madison, L. L.; Huisman, G. W.; Microbiol. Mol. Biol. Rev. 1999, 63, 21. PMID: 10066830 9. Ramsay, B. A.; Proceedings of the Symposium on Physiology, Kinetics, Production and Use of Biopolymers, Seggau, Austria, 1994. 10. Khanna, S.; Srivasta, A. K.; Biochem. Eng. J. 2005, 27, 197. DOI: http://dx.doi.org/10.1016/j.bej.2005.08.006 11. Hsu, K.; Tseng, M.; Don, T.; Yang, M.; Bot. Stud. 2012, 53, 307. 12. Penloglou, G.; Kretza, E.; Chatzidoukas, C.; Parouti, S.; Kiparissides, C.; Biochem. Eng. J. 2012, 62, 39. DOI: http://dx.doi.org/10.1016/j.bej.2011.12.013 13. Koller, M.; Appl. Food Biotechnol. 2014, 1, 1. 14. Madkour, M. H.; Heinrich, D.; Alghamdi, M. A.; Shabbaj, I. I.; Steinbüchel, A. Biomacromolecules (2013), doi: 10.1021/bm4010244. DOI: http://dx.doi.org/10.1021/bm4010244 15. Silva, L. F.; Gomez, J. G. C.; Rocha, R. C. S.; Taciro, M. K.; Pradella, J. G. C.; Quim. Nova 2007, 30, 1732. DOI: http://dx.doi.org/10.1590/S0100-40422007000100025 16. Ienczak, J. L.; Aragao, G. M. F.; In Handbook of Biodegradable Polymers: Isolation, Synthesis, Characterization and Applications, Wiley-VCH Verlag GmbH & Co. KGaA: Weinheim, 2011. 17. Chen, Y.; Yang. H.; Zhou, Q.; Chen, J.; Gu, G.; Process Biochem. 2001, 36, 501. DOI: http://dx.doi.org/10.1016/S0032-9592(00)00225-9 18. Dalcanton, F.; Dissertaçao de Mestrado, Universidade Federal de Santa Catarina, Brasil, 2006. 19. Riedel, S. L.; Brigham, C. J.; Budde, C. F.; Bader, J.; Rha, C.; Stahl, U.; Sinskey, A. J.; Biotechnol. Bioeng. 2012, 110, 461. DOI: http://dx.doi.org/10.1002/bit.24713 PMID: 22903730 20. Lafferty, R. M.; Heinsle, E.; US Pat. 4,140,741 1979. 21. Fiorese, M. L.; Freitas, F.; Pais, J.; Ramos, A. M.; Aragao, G. M. F.; Reis, M. A. M.; Eng. Life Sci. 2009, 9, 454. DOI: http://dx.doi.org/10.1002/elsc.200900034 22. Narasimhan, K.; Cearley, A. C.; Gibson, M. S.; Welling, S. J.; US Pat. 7378266 2008. 23. Zinn, M.; Weilenmann, H. U.; Hany, R.; Schmid, M.; Egli, T.; Acta Biotechnol. 2003, 23, 309. DOI: http://dx.doi.org/10.1002/abio.200390039 24. Mohammad, H. A.; Steinbüchel, A.; Appl. Environ. M icrobiol. 2009, 75, 6222. 25. Vanlautem, N.; Gilain, J.; US pat. 4310684-A 1982. 26. López-Cuellar, M.; Alba-Flores, J.; Rodríguez, J.; Pérez-Guevara, F.; Int. J. Biol. Macromol. 2011, 48, 74. DOI: http://dx.doi.org/10.1016/j.ijbiomac.2010.09.016 PMID: 20933541 27. Yang, Y. H.; Brigham, C.; Willis, L.; Rha, C. K.; Sinskey, A.; Biotechnol. Lett. 2011, 6. 28. Tamer, I. M.; Moo-Young, M.; Chist, Y.; Bioprocess. Eng. 1998, 19, 459. DOI: http://dx.doi.org/10.1007/s004490050548 29. Yu, J. B.; Porter, M.; Jarenko, M. In Generation and utilization of microbial biomass hydrolysates in recovery and production of poly(3-hydro-xybutyrate); Motovic, M. D., ed.; Creative Commons BY (2013), doi: 10.5772/52940. DOI: http://dx.doi.org/10.5772/52940 30. Mohammadi, M.; Hassan, M. A.; Phang, L. Y.; Shirai, Y.; Man, H. C.; Ariffin, H.; Amirul, A. A.; Syairah, S. N.; Environ. Eng. Sci. 2012, 29, 783. DOI: http://dx.doi.org/10.1089/ees.2011.0255 31. Hejazi, P.; Vasheghani-Farahani, E.; Yamini, Y.; Biotechnol. Prog. 2003, 19, 1519. DOI: http://dx.doi.org/10.1021/bp034010q PMID: 14524714 32. Javers, J. E.; Gibbons, F. H.; Raynie, D. E.; J. Am. Oil Chem. Soc. 2012, 2, 241. 33. Holmes, P. A.; Lim, G. B.; US Pat. 4.910.145 1990. 34. Kapritchkoff, F. M.; Viotti, A. P.; Alli, R. C. P.; Zuccolo, M.; Pradella, J. G. C.; Maiorano, A. E.; Miranda, E. A.; Bonomi, A.; J. Biotechnol. 2006, 122, 453. DOI: http://dx.doi.org/10.1016/j.jbiotec.2005.09.009 PMID: 16253372 35. Suzuki, D. V.; Carter, J. M.; Rodrigues, M. F. A.; Silva, E. S.; Maiorano, A. E.; J. Microbiol. Biotechnol. 2008, 24, 771. DOI: http://dx.doi.org/10.1007/s00253-008-1736-3 36. Neves, A.; Müller, J.; Biotechnol. Prog. 2012, 28, 1575. DOI: http://dx.doi.org/10.1002/btpr.1624 PMID: 22915526 37. Tamer, I. M.; Moo-Young, M.; Chisti, Y.; Ind. Eng. Chem. Res. 1998, 37, 1807. DOI: http://dx.doi.org/10.1021/ie9707432 38. Ghatnekar, M. S.; Pai, J. S.; Ganesh, M.; J. Chem. Technol. Biotechnol. 2002, 77, 444. DOI: http://d, x.doi.org/10.1002/jctb.570 39. Garcia, M. C. F.; Dissertaçao de Mestrado, Universidade Federal de Santa Catarina, Brasil, 2006. 40. Martínez, V.; García, P.; García, J. L.; Prieto, M. A.; Microb. Biotechnol. 2011, 4, 533. DOI: http://dx.doi.org/10.1111/j.1751-7915.2011.00257.x PMID: 21418544 41. Gumel, A. M.; Annuar, M. S. M.; Chisti, Y.; J. Polym. Environ. 2013, 21, 580. DOI: http://dx.doi.org/10.1007/s10924-012-0527-1 42. Jacquel, N.; Lo, C. W.; Wei, Y. H.; Wu, H. S.; Wang, S. S.; Biochem. Eng. J. 2008, 39, 15. DOI: http://dx.doi.org/10.1016/j.bej.2007.11.029 43. Mantellato, P. E.; Durao, N. A.; U.S Pat 8357508 B2 2013. 44. Penloglou, G.; Chatzidoukas, C.; Kiparissides, C.; Biotechnol. Adv. 2012, 30, 329. DOI: http://dx.doi.org/10.1016/j.biotechadv.2011.06.021 PMID: 21756991 45. Khosravi, D. K.; Vasheghani, F. E.; Shojaosadati, S. A.; Yamini, Y.; Biotechnol. Prog. 2004, 20, 1757. DOI: http://dx.doi.org/10.1021/bp0498037 46. Kunasundari, B.; Sudesh, K.; Express Polym. Lett. 2011, 5, 620. DOI: http://dx.doi.org/10.3144/expresspolymlett.2011.60 47. Lee, S. Y.; Choi, J. I.; Han, K.; Song, J. Y.; Appl. Environ. Microbiol. 1999, 65, 2762. PMID: 10347075 48. Mantellato, P. E.; Durao, N. A. S.; U.S Pat. 20080193987 A1 2008. 49. Galego, N.; Rozsa, C.; Sanchez, R.; Fung, J.; Anala, V.; Santo, T. J.; Polym. Test. 2000, 19, 485. DOI: http://dx.doi.org/10.1016/S0142-9418(99)00011-2 50. Canevarolo, S. V.; Técnicas de Caracterizaçao de Polímeros, 1ª ed., Artliber: Sao Paulo, 2007. 51. Fruet, G.; Dissertaçao de Mestrado, Universidade Federal do Rio Grande do Sul, Brasil, 2005. 52. Souza, D.; Dissertaçao de Mestrado, Universidade Estadual do Norte Fluminense, Brasil, 2006. 53. Navarro, R. F.; D'Almeida, J. R. M.; Rabello, M. S.; J. Mater. Sci. 2007, 42, 2167. DOI: http://dx.doi.org/10.1007/s10853-006-1387-7 54. Torres, A. U.; Almeida, J. R.; Habas, J. P.; Revista Polímeros 2011, 20, 331. DOI: http://dx.doi.org/10.1590/S0104-14282011005000001 55. Peng, Y. U.; Lo, C. C. W.; Wu, H. S.; The Canadian Journal of Chemical Engineering 2013, 91, 77. DOI: http://dx.doi.org/10.1002/cjce.20685 56. Noda, I.; Br PI 9507830-4, PCT US9506651, 1995. 57. Ibrahim, M. H. A.; Steinbüchel, A.; Appl. Environ. Microbiol. 2009, 75, 6222. DOI: http://dx.doi.org/10.1128/AEM.01162-09 PMID: 19666728 58. Budde, C. F.; Riedel, S. L.; Willis, L. B.; Rha, C.; Sinskey, A. J.; Appl. Environ. Microbiol. 2011, 77, 2847. DOI: http://dx.doi.org/10.1128/AEM.02429-10 PMID: 21398488 59. Rodriguez-Contreras, A.; Koller, M.; Dias, M. M. S.; Calafell, M.; Braunegg, G.; Marqués-Calvo, M. S.; Food Technol. Biotechnol. 2013, 51, 123. 60. Quines, L. K.; Schmidt, M.; Zanfonato, K.; Steffen, W.; Oliveira, S. M.; Schmidell, W.; Aragao, G. M. F.; XIX Simpósio nacional de bioprocessos, Foz do Iguaçú, Brasil, 2013. 61. Valappil, S. P.; Misra, S. K.; Boccaccini, A. R.; Keshavarz, T.; Bucke, C.; Roya, I.; J. Biotechnol. 2007, 132, 251. DOI: http://dx.doi.org/10.1016/j.jbiotec.2007.03.013 PMID: 17532079 62. Gorenflo, V.; Schmack, G.; Vogel, R.; Steinbuchel, A.; Biomacromolecules 2001, 2, 45. DOI: http://dx.doi.org/10.1021/bm0000992 63. McChalicher, C. W. J.; Srienc, F.; Rouse, D. P.; Am. Inst. Chem. Eng. 2009, 56, 1616. 64. Quines, L. K. M.; Ienczak, J. L.; Schmidt, M.; Zanfonato, K.; Rodrigues, M. I.; Schmidell, W.; Aragao, G. M. F.; Quim. Nova 2015, 38, 214. 65. Rossel, C. E. V.; Mantellato, P. E.; Bueno Netto, C. L.; Ribeiro, A. M. M.; Matsubara, R. M. S.; PI 9302312 2002. 66. Mantellato, P. E.; Tese de Doutorado, Universidade Federal de Sao Carlos, Brasil, 2011. 67. Choi, J., Lee, S.Y.; Appl. Microbiol. Biotechnol. 1999, 51, 13. DOI: http://dx.doi.org/10.1007/s002530051357 68. Yu, J.; U.S Pat. 0220505 A1 2008. 69. Kim, B. S.; Lee, S. C.; Chang, H. N.; Chang, Y. K.; Woo, S. I.; Biotechnol. Bioeng. 1994, 43, 892. DOI: http://dx.doi.org/10.1002/bit.260430908 PMID: 18615882 70. Hahn, S. K.; Chang, Y. K.; Kim, B. S.; Chang, H. N.; Biotechnol. Bioeng. 1994, 44, 256. DOI: http://dx.doi.org/10.1002/bit.260440215 PMID: 18618692 71. Heinrich, D.; Madkour, M. H.; Al-Ghamdi, M. A.; Shabbaj, I. I.; Steinbüchel, A.; AMB Express 2012, 2, 59. DOI: http://dx.doi.org/10.1186/2191-0855-2-59 PMID: 23164136 72. Lo, C. W.; Wu, H. S.; Wei, Y. H.; J. Taiwan Inst. Chem. Eng. 2011, 42, 240. DOI: http://dx.doi.org/10.1016/j.jtice.2010.03.009 73. Anis, S. N. S.; Nurhezreen, M. I.; Sudesh, K.; Amirul, A. A.; Sep. Purif. Technol. 2013, 102, 111. DOI: http://dx.doi.org/10.1016/j.seppur.2012.09.036 74. Roh, K. S.; Yeom, S. H.; Yoo, Y. J.; Biotechnol. Tech. 1995, 9, 709. DOI: http://dx.doi.org/10.1007/BF00159234 75. Salmiati, Z.U.; Salim, M. R. 8th International IWA Symposium Waste Management Problems in Agro-Industries, Çeşme, Turkey, 2011. 76. Samrot, A.; Avinesh, R.; Sukeetha, S.; Senthilkumar, P.; Appl. Biochem. Biotechnol. 2011, 163, 195. DOI: http://dx.doi.org/10.1007/s12010-010-9028-7 77. Kshirsagar, P. R.; Kulkarni, S. O.; Nilegaonkar, S. S.; Niveditha, M.; Kanekar, P. P.; Sep. Purif. Technol. 2013, 103, 151. DOI: http://dx.doi.org/10.1016/j.seppur.2012.10.007 78. Prasanna, T.; Babu, P. A.; Lakshmi, P. D.; Chakrapani, R.; Rao, R.; Int. J. Pharma Res. Rev. 2011, 1, 15. 79. Bhattacharyya, A.; Pramanik, A.; Maji, S. K.; Haldar, S.; Mukhopadhyay, U. K.; Mukherjee, J.; AMB Express 2012, 2, 34. DOI: http://dx.doi.org/10.1186/2191-0855-2-34 80. Jiang, X.; Ramsay, J. A.; Ramsay, B. A.; J. Microbiol. Methods 2006, 67, 212. DOI: http://dx.doi.org/10.1016/j.mimet.2006.03.023 PMID: 16753235 81. Chen, G. Q.; Zhang, G.; Park, S. J.; Lee, S. Y.; Appl. Microbiol. Biotechnol. 2001, 57, 50. DOI: http://dx.doi.org/10.1007/s002530100755 82. Hampson, J. W.; Ashby, R. D.; J. Am. Oil Chem. Soc. 1999, 76, 1371. DOI: http://dx.doi.org/10.1007/s11746-999-0152-x 83. Carrilho, E.; Tavares, M. C. H.; Lanças, F. M.; Quim. Nova 2001, 24, 509. 84. Aguiar, A. C.; Dissertaçao de Mestrado, Universidade Federal de Santa Catarina, Brasil, 2011. 85. Medeiros, F. O.; Alves, F. G.; Lisboa, C. R.; Martins, D. S.; Burkert, C. A. V.; Kalil, S. J.; Quim. Nova 2008, 31, 336. DOI: http://dx.doi.org/10.1590/S0100-40422008000200028 86. Gogate, P. R.; Kabadi, A. M.; Biochem. Eng. J. 2009, 44, 60. DOI: http://dx.doi.org/10.1016/j.bej.2008.10.006 87. Horowitz, D. M.; Brennan, E. M.; European Pat. (070):135 2010. 88. Klimek-Ochab, M.; Brzezińska-Rodak, M.; Żymańczyk-Duda, E.; Lejczak, B.; Kafarski, P.; Folia Microbiol. 2011, 56, 469. DOI: http://dx.doi.org/10.1007/s12223-011-0069-2 89. Sauer, T.; Robinson, C. W.; Glick, B. R. F.; Biotechnol. Bioeng. 1989, 33, 1330. DOI: http://dx.doi.org/10.1002/bit.260331016 PMID: 18587868 90. Kuboi, R.; Umakoshi, H.; Takagi, N.; Komasawa, I.; J. Ferment. Bioeng. 1995, 79, 335. DOI: http://dx.doi.org/10.1016/0922-338X(95)93991-R 91. Ling, Y.; Wong, H. H.; Thomas, C. J.; Williams, D. R. G.; Middelberg, A. P. J.; Bioseparation 1997, 7, 9. DOI: http://dx.doi.org/10.1023/A:1007900416356 PMID: 9615609 92. Middelberg, A. P. J.; Biotechnol. Adv. 1995, 13, 491. DOI: http://dx.doi.org/10.1016/0734-9750(95)02007-P PMID: 14536098 93. Harrison, S. T. L.; Biotechnol. Adv. 1991, 9, 217. 4. DOI: http://dx.doi.org/10.1016/0734-9750(91)90005-G 94. Lanciotti, R.; Patrignani, F.; Iucci, L.; Guerzoni, M. E.; Suzzi, G.; Belletti, N.; Gardini, F.; Food Chem. 2007, 104, 693. DOI: http://dx.doi.org/10.1016/j.foodchem.2006.12.017 95. Tribst, A. A. L.; Franchi, M. A.; Cristianini, M.; Innovative Food Sci. Emerging Technol. 2008, 9, 265. DOI: http://dx.doi.org/10.1016/j.ifset.2007.07.012 96. Chaves-López, C.; Lanciotti, R.; Serio, A.; Paparella, A.; Guerzoni, E.; Suzz, G.; Food Control 2009, 20, 691. DOI: http://dx.doi.org/10.1016/j.foodcont.2008.09.001 97. Maresca, P.; Dons, F.; Ferrari, G.; J. Food Eng. 2011, 104, 364. DOI: http://dx.doi.org/10.1016/j.jfoodeng.2010.12.030 98. Floury, J.; Legrand, J.; Desrumaux, A.; Chem. Eng. Sci. 2004, 59, 1285. DOI: http://dx.doi.org/10.1016/j.ces.2003.11.025 99. Keshavarz-Moore, E.; Hoare, M.; Dunnill, P.; Enzym. Microb. Technol. 1990, 12, 764. DOI: http://dx.doi.org/10.1016/0141-0229(90)90149-K 100. Masson, L. M. P.; Tese de Doutorado, Universidade Federal do Rio de Janeiro, Brasil, 2010. 101. Van Hee, P.; Middelberg, A. P. J.; Van der, L. R. G. J. M.; Van der Wielen, L. A. M.; Biotechnol. Bioeng. 2004, 88, 100. DOI: http://dx.doi.org/10.1002/bit.20343 PMID: 15449302 102. Kelly, W. J.; Muske, K. R.; Bioprocess Biosyst. Eng. 2004, 27, 25. DOI: http://dx.doi.org/10.1007/s00449-004-0378-9 PMID: 15480808 103. Chin, W. H.; Tsuey, K. C.; Tau, C. L.; Process Biochem. 2006, 41, 1829. DOI: http://dx.doi.org/10.1016/j.procbio.2006.03.043 104. Lemes, A. C.; Alvares, G. T.; Kalil, S. J.; Biochem. Biotechnol. (2012), doi:10.5433/2316-5200.2012v1n2p7 DOI: http://dx.doi.org/10.5433/2316-5200.2012v1n2p7 105. Michelon, M.; Borba, T. M.; Rafael, R. S.; Burkert, C. A. V.; Burkert, J. F. M.; Food Sci. Biotechnol. 2012, 21, 1. DOI: http://dx.doi.org/10.1007/s10068-012-0001-9 106. Chuan, C. W.; Nicholls, S. J.; Tuzcu, E. M.; Crowe, T.; Sipahi, I.; Schoenhagen, P.; Kapadia, S.; Hazen, S. L.; Wun, C. C.; Norton, M.; Ntanios, F.; Nissen, S. E.; J. Am. Coll. Cardiol. 2005, 7, 1967. 107. Bossio, J. P.; Harry, J.; Kinney, C. A.; Chemosphere 2008, 50, 858. DOI: http://dx.doi.org/10.1016/j.chemosphere.2007.06.088 108. Divyashree, M. S.; Shamala, T. R.; Rastogi, N. K.; Biotechnol. Bioprocess Eng. 2009, 14, 482. DOI: http://dx.doi.org/10.1007/s12257-008-0119-z 109. Quines, L. K.; Cunha, L. D.; Schmidt, M.; Zanfonato, K.; Soares, L. B.; Schmidell, W.; Aragao, G. M. F.; XIX Congresso brasileiro de engenharia química, Búzios, Brasil, 2012. 110. Harrison, S. T. L.; Dennis, J. S.; Chase, H. A.; Bioseparation 1991, 2, 95. PMID: 1368079 111. Chemat, F.; Zill-E-Huma.; Khan, M. K.; Ultrason. Sonochem. 2010, 18, 813. DOI: http://dx.doi.org/10.1016/j.ultsonch.2010.11.023 PMID: 21216174 112. Gözke, G.; Prechtl, C.; Kirschhöfer, F.; Mothes, G.; Ondruschka, J.; Brenner-Weiss, G.; Obst, U.; Posten, C.; Bioresour. Technol. 2012, 123, 272. DOI: http://dx.doi.org/10.1016/j.biortech.2012.07.039 PMID: 22940329 113. Kapritchkoff, F. M.; Bonomi, A.; Miranda, E. A.; Pradella, J. G. C.; Maiorano, A. E.; Zuccolo, M.; Schmidell, W.; XIII Simpósio Nacional de Fermentaçoes, Teresópolis, Brasil, 2000. 114. King, A. T.; Davey, M. R.; Mellor, I. R.; Mulligan, B. J.; Lowe, K. C.; Enzyme Microb. Technol. 1991, 13, 148. DOI: http://dx.doi.org/10.1016/0141-0229(91)90171-6 115. Garcia, I. L.; Perez, M. P. D.; López, J. A.; Villar, M. A.; Yanniotisc, S.; Koutinas, A.; International Congress on Engineering and Food, Athens, Greece, 2011. 116. Mohammad, H. A. I.; Steinbüchel, A.; Appl. Environ. Microbiol. 2009, 75, 6222. DOI: http://dx.doi.org/10.1128/AEM.01162-09 117. Zahari, M. A. K. M.; Ariffin, H.; Mokhtar, M. N.; Salihon, J.; Shirai, Y.; Hassan, M. A.; J. Biomed. Biotechnol. 2012, 2012, 8. 118. Yasotha, K.; Aroua, M. K.; Ramachandran, K. B.; Tan, I. K. P.; Biochem. Eng. J. 2006, 30, 268. 119. Martino, L. L.; Cruz, M. V.; Scomac, A.; Freitas, F.; Bertinc, L.; Scandola, M.; Reis, M. A. M.; J. Biol. Macromol. 2014, 71, 117. DOI: http://dx.doi.org/10.1016/j.ijbiomac.2014.04.016 120. Tan, G. Y. A.; Chen, C. L.; Li, L.; Ge, L.; Wang, L.; Razaad, I. M. N.; Li, Y.; Zhao, L.; Mo, Y.; Wang, J. Y.; Polymers 2014, 6, 706. DOI: http://dx.doi.org/10.3390/polym6030706 121. Wampfler, B.; Ramsauer, T.; Rezzonico, S.; Hischier, R.; Köhling, R.; Thöny-Meyer, L.; Zinn, M.; Biomacromolecules 2010, 11, 2716. DOI: http://dx.doi.org/10.1021/bm1007663 PMID: 20843062 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access