Revisão
|
|
| Preparo de amostras assistido por campo elétrico: fundamentos, avanços, aplicações e tendências Sample preparation assisted by electric fields: fundamentals, advances, applications, and trends |
|
Camila D. M. CamposI; Richard P. S. de CamposI; José A. Fracassi da SilvaI; Dosil P. JesusI; Ricardo M. OrlandoII,*
IInstituto de Química, Universidade Estadual de Campinas, CP 6154, 13084-971 Campinas - SP, Brasil Recebido em 07/05/2015 *e-mail: orlandoricardo@hotmail.com Sample preparation is commonly considered a key step to achieve selective, sensitive, and reliable chemical analyses, particularly those involving complex matrices. Although the application of electric fields to improve the speed and efficiency of sample preparation methods has been proven, this approach is still considered to be state-of-the-art; hence, further development is necessary to improve future applications. This review describes the fundamentals, advances, applications, and perspectives of using electric fields to enhance sample preparation techniques such as liquid-liquid and solid-liquid extractions in conventional and microscale devices. INTRODUÇÃO A maioria dos métodos analíticos requer que as amostras sejam previamente tratadas, visando a extração e pré-concentração de analitos, eliminação de compostos interferentes, limpeza (clean up) ou compatibilização química e/ou física das amostras com o sistema analítico empregado.1 Desta forma, o preparo de amostra contribui significativamente para o aumento da detectabilidade e da seletividade em análises químicas. No entanto, o preparo de amostras também é geralmente a etapa mais lenta e uma das principais fontes de erros em uma análise química. A importância desta etapa analítica contribuiu para que fossem desenvolvidas diversas técnicas e métodos de preparo de amostras, principalmente para amostras com matrizes complexas, tais como fluídos biológicos, amostras ambientais, alimentos, etc. Assim, foram desenvolvidas e consolidadas as tradicionais técnicas de extração líquido-líquido (liquid-liquid extraction - LLE) e a extração em fase sólida (solid phase extraction - SPE).2,3 No entanto, as chamadas técnicas de microextração em fase sólida (solid phase microextraction - SPME) e microextração líquido-líquido (liquid-liquid microextraction - LLME) vêm ganhando preferência, pois requerem menores volumes de amostra, proporcionam extrações mais rápidas, além de empregarem menor quantidade de solventes orgânicos. O emprego da energia proveniente de aquecimento, ultrassom e radiações eletromagnéticas (micro-ondas e ultravioleta) para aumentar a eficiência e reduzir o tempo de preparo de amostras vem sendo bastante explorado nas últimas décadas.4-7 O emprego de campo elétrico para auxiliar processos de extração ainda encontra-se em estágio de amadurecimento,8 porém vem ganhando bastante atenção nos últimos anos.9-12 A migração eletroforética de espécies eletricamente carregadas (íons), devido à aplicação de um campo elétrico em um sistema de extração, proporciona um aumento da cinética de transferência (extração) dos analitos entre uma solução doadora (amostra) e uma solução aceptora. Adicionalmente, a direção de migração das espécies positivas e negativas pode ser controlada pela orientação do campo elétrico, contribuindo para uma maior seletividade do processo de extração. A eletrodiálise foi um das técnicas pioneiras de eletroextração utilizada em preparo de amostras para fins analíticos.13 A extração líquido-líquido assistida por campo elétrico foi introduzida no início da década de 1990.14 No entanto, o emprego de campo elétrico em preparo de amostras ganhou um grande impulso a partir do trabalho de Pedersen-Bjergaard e Rasmussen,15 que propôs o emprego de campo elétrico em sistemas de microextração em fase líquida suportada (membranas líquidas) em fibras ocas de polipropileno. Desde então, diversos compostos ácidos, básicos e zwiteriônicos foram eletroextraídos de amostras complexas, tais como fluídos biológicos e amostras ambientais.9 O emprego de campo elétrico em preparo de amostras é uma área com grande potencial para desenvolvimento e aplicações. Assim, este artigo de revisão tem o objetivo de apresentar os fundamentos, aplicações e tendências das principais técnicas de extração assistidas por campo elétrico, tais como a eletrodiálise e as eletroextrações em fase sólida e líquido-líquido (com e sem uso de membrana). Adicionalmente, a tendência de miniaturização dos dispositivos de eletroextração também é abordada nesta revisão.
ASSOCIAÇÃO DE MEMBRANA E CAMPO ELÉTRICO NO PREPARO DE AMOSTRAS As técnicas de extração que empregam membranas porosas facilitam o preparo de amostras, principalmente quando matrizes complexas estão envolvidas. Ao utilizar uma membrana é possível, por meio de diversas estratégias, a extração de analitos, separando-os de compostos interferentes ou que possam danificar o sistema analítico. Adicionalmente, o desenvolvimento de técnicas de extração em menor escala, i.e. microextração, permite o preparo de amostra em volumes da ordem de microlitros, com vantagens tais como o uso de menor quantidade de solvente orgânico, maiores fatores de pré-concentração, com redução de tempo e possibilidade de automação.16 Técnicas de microextração em membrana incluem a microextração em fase sólida protegida por membrana (membrane-protected solid phase microextraction - MP-SPME) e as microextrações em fase líquida, que abrangem a microextração em fibra oca (hollow-fiber liquid phase microextraction - HF-LPME), extração em membrana líquida renovada (hollow-fiber renewal liquid membrane extraction - HFRLM), microextração em filme fino (thin film microextraction - TFME), eletrodiálise e a eletroextração em membrana (electromembrane extraction - EME).16 As duas últimas técnicas mencionadas envolvem o emprego de campo elétrico para auxiliar no processo de preparo de amostras e serão abordadas nas seções subsequentes desta revisão. Eletrodiálise A eletrodiálise vem sendo utilizada a mais de 50 anos em diversas aplicações, principalmente no tratamento de efluentes industriais e na dessalinização e purificação de águas.17 A eletrodiálise consiste em aplicar um campo elétrico a um sistema de diálise, como esquematizado na Figura 1. Cada eletrodo (cátodo e ânodo) é separado da solução a ser tratada por meio de uma membrana trocadora de íons, sendo essa do tipo catiônica no lado do cátodo e aniônica no lado do ânodo. Uma fonte de tensão é utilizada para estabelecer um campo elétrico entre os eletrodos. Sob o efeito da força eletrostática, promovida pelo campo elétrico, os íons migram e atravessam as membranas de troca iônica. Assim, o campo elétrico proporciona um transporte de massa mais rápido do que ocorreria apenas sob o efeito da difusão e evita o retorno destes íons para a solução tratada.
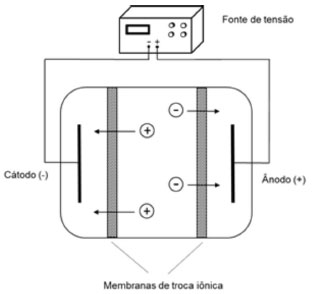 Figura 1. Esquema simplificado de um sistema de eletrodiálise
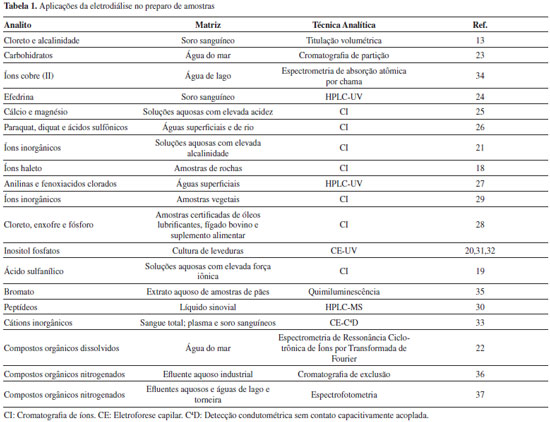
A eletrodiálise é considerada a técnica precursora de preparo de amostras assistida por campo elétrico, uma vez que em 1938 Joseph e Stadie13 reportaram o emprego da eletrodiálise para extração de cloreto e determinação de alcalinidade de soro sanguíneo. Desde então, como mostra a Tabela 1, a eletrodiálise vem sendo empregada tanto na limpeza de amostras (clean up)18-22 como na extração seletiva e pré-concentração de analitos, os quais são determinados principalmente por técnicas de separação, tais como cromatografia18,21,23-30 e eletroforese capilar.20,31-33 A capacidade da eletrodiálise em proporcionar fatores de pré-concentração da ordem de 50 vezes foi demonstrada por Buscher et al.20 na determinação de inositol trifosfato por eletroforese capilar. Em algumas configurações de sistemas de eletrodiálise emprega-se uma membrana de separação (geralmente de acetato de celulose), posicionada entre as membranas de troca iônica. Assim, como ocorre com a diálise, a escolha adequada da porosidade da membrana de separação possibilita a exclusão de moléculas com elevada massa molar.24 Desta forma, a eletrodiálise é interessante para extração de analitos a partir de amostras biológicas.13,24,30,33 A eficiência da eletrodiálise é afetada pelo pH e a força iônica das soluções da amostra (doadora) e aceptora, bem como pelo potencial aplicado e o tempo de extração. Portanto, estes parâmetros necessitam ser otimizados para a obtenção de boas taxas de recuperação dos analitos extraídos. Por exemplo, Doan et al.33 obtiveram recuperações entre 96,3 e 110% na extração de cátions inorgânicos em amostras biológicas.
Eletroextração em membrana A eletroextração em membrana (EME) tem se mostrado especialmente interessante em preparo de amostras, quando comparada a outras técnicas de microextração em fase líquida, devido ao reduzido tempo exigido para a obtenção de valores significativos de recuperação de analitos. Em adição, EME têm sido utilizada para a extração de drogas, metais pesados e peptídeos em diversos tipos de matrizes, desde as mais simples (aquosas) a fluídos corporais, como leite materno e sangue.38 EME pode ser facilmente automatizada e miniaturizada, além de proporcionar elevados fatores de pré-concentração de analitos, cujas soluções podem ser diretamente injetadas em sistemas analíticos de separação.9,39 Esta seção será focada nos fundamentos da EME, nos parâmetros relevantes que influenciam a extração, suas vantagens, limitações, aplicações e perspectivas futuras. Fundamentos A EME é uma técnica de microextração em fase líquida cuja força motriz é a diferença de potencial aplicada entre duas fases líquidas (doadora e aceptora), as quais são separadas por uma membrana líquida suportada (supported liquid membrane - SLM).9 Os primeiros trabalhos15 com EME foram publicados em 2006 e desde então, dentre vários avanços, esforços têm sido voltados para a modelagem teórica e melhor entendimento dos fundamentos da técnica. O aparato experimental empregado na EME é bastante similar ao utilizado na microextração em fibra oca (HF-LPME), como pode ser observado no esquema apresentado na Figura 2, que evidencia as similaridades entre as técnicas.
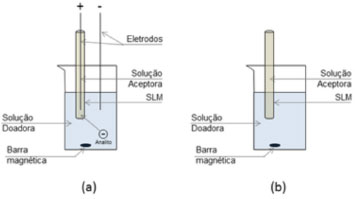 Figura 2. Aparato experimental utilizado em (a) EME e (b) HF-LPME
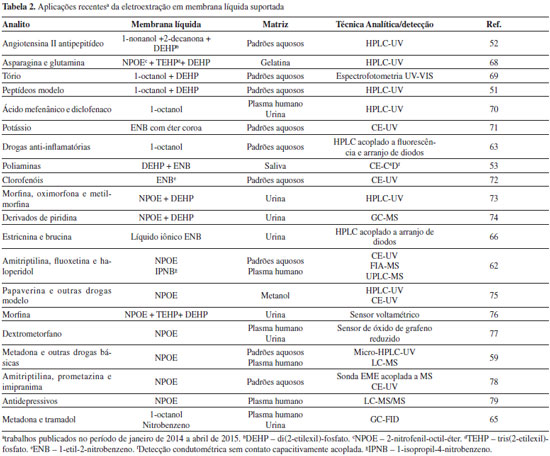
Em ambos os sistemas é empregada uma fibra oca com paredes porosas, geralmente de polipropileno, impregnada com um solvente orgânico (membrana líquida) imiscível em água que separa as soluções doadora (amostra) e aceptora. Em HF-LPME, os analitos são transferidos da fase doadora para a fase aceptora devido à ação de forças difusivas e convectivas.9 Em EME, com a adição do campo elétrico, os analitos carregados migram em direção ao polo de carga contrária, devido à suas respectivas mobilidades eletrocinéticas.40 Por exemplo, posicionando-se o polo negativo na fase aceptora, localizada no interior da fibra oca, é possível realizar a extração de analitos de carga positiva presentes na fase doadora. Sendo assim, um componente relativo à migração eletroforética do íon é adicionado ao fluxo de analitos através da membrana líquida suportada. Deste modo, a velocidade do processo de extração é aumentada e o fluxo de íons dependerá, dentre outros fatores, da composição da SLM e da diferença de potencial aplicada. Este comportamento é descrito pela equação de fluxo:11,41 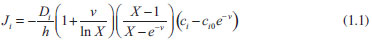 em que Ji representa o fluxo de um íon através da SLM, Di é o coeficiente de difusão para o íon na SLM, ci é a concentração deste íon na interface SLM/fase doadora, ci0 a concentração do íon na interface SLM/face aceptora, v é a força motriz (função do potencial elétrico) e X é o balanço de íons, definido como a razão entre as concentrações iônicas totais na fase doadora e na fase aceptora. Controlando-se a composição da SLM e o campo elétrico (direção e magnitude) é possível separar analitos de interferentes e minimizar os efeitos da matriz da amostra.9,39 Além disso, a composição da fase aceptora também pode ser utilizada como um parâmetro de seletividade adicional.39 Esta versatilidade permite o uso direto da fase aceptora em diversos sistemas analíticos, principalmente em instrumentos de espectrometria de massas e de separação, como cromatografia líquida, cromatografia a gás e eletroforese capilar.9 Parâmetros relevantes A recuperação, definida pela razão entre a quantidade de analito extraída pela quantidade total de analito presente na fase doadora, é um parâmetro fundamental para determinação da eficiência do processo de extração. Em EME, os fatores que podem afetar a recuperação e o fluxo de íons dos analitos incluem a taxa de agitação, a temperatura, o tempo de extração, a diferença de potencial aplicada ao sistema e o pH das soluções (doadora e aceptora).42 Além destes fatores, a composição da SLM também é extremamente importante e será tratada no próximo item desta revisão. Embora a extração possa ser realizada sem agitação mecânica e/ou aquecimento, estes parâmetros podem aumentar a eficiência do processo.42 A agitação promove a convecção dos analitos em solução e reduz a camada estagnada na interface com a SLM e, por este motivo, o seu emprego é sempre aconselhável.40 A elevação da temperatura gera um aumento no coeficiente de difusão dos compostos na SLM e facilita a partição dos analitos entre as fases aquosa e orgânica. Entretanto, a temperatura deve ser otimizada e controlada, uma vez que valores elevados podem causar a formação de bolhas na região dos eletrodos ou ainda desestabilizar a SLM.41 Tempos de extração prolongados, após o estabelecimento do equilíbrio entre as fases aquosa e orgânica, não são aconselháveis, pois a longa exposição ao campo elétrico pode gerar instabilidades no sistema, especialmente na SLM. O fluxo de analitos pela SLM é diretamente proporcional à intensidade da diferença de potencial aplicada, porém, este parâmetro também deve ser otimizado. Potenciais excessivos podem causar aquecimento por efeito Joule, levando à instabilidade e perda de eficiência da extração.42 Por fim, o pH das fases doadoras e aceptoras deve ser otimizado, de modo que os analitos apresentem carga (líquida) diferente de zero e o fenômeno de eletromigração entre as fases possa ocorrer. Membranas líquidas suportadas A membrana líquida suportada desempenha um papel fundamental em um sistema EME, no que se refere à eficiência da extração. Sua composição, que define o valor de , e sua espessura são fatores determinantes para a obtenção de boa seletividade e elevados valores de recuperação dos analitos.9 A SLM é preparada imobilizando-se um solvente orgânico em uma membrana porosa, usualmente de polipropileno.39,43 O solvente orgânico adentra os poros da fibra oca por capilaridade, formando uma membrana líquida. O solvente orgânico utilizado deve, idealmente, possuir as seguintes características: (1) ser imiscível em água, para minimizar perdas de solvente para a fase aquosa; (2) ter baixa volatilidade, evitando evaporação durante o processo de extração; (3) baixa viscosidade, para facilitar o transporte de íons; (4) ser líquido à temperatura ambiente, possibilitado o seu confinamento nos poros da fibra oca.38 Além disso, o solvente orgânico utilizado como SLM deve apresentar afinidade adequada pelos analitos, de maneira a propiciar alta porcentagem de recuperação, sendo este o fator mais difícil de ser previsto teoricamente. Desta forma, a falta de um estudo sistemático que pudesse correlacionar propriedades dos solventes orgânicos com o fator de recuperação em EME fez com que grande parte dos trabalhos apresentados na literatura utilizasse o método de tentativa e erro para determinar os solventes mais estáveis e eficientes para uso como SLM.39,44 Recentemente, Pedersen-Bjergaard et al.38,45,46 realizaram uma série de estudos de recuperação utilizando diversos solventes orgânicos como SLM na extração de drogas básicas não-polares (log P > 2,5), drogas básicas polares (log P < 2,5) e drogas ácidas. Nestes trabalhos foram obtidos bons resultados utilizando 2-nitrofenil octil éter (NPOE) puro, NPOE com adição de di-(2-etilexil)fosfato (DEHP) e octanol, respectivamente. Os autores concluíram que interações do tipo dipolo-dipolo e de ligações de hidrogênio são responsáveis pela transferência de analitos carregados da fase aquosa para a fase orgânica e utilizaram a classificação de solventes de Kamlet-Taft, baseada na polaribilidade (ϖ) e basicidade da ligação de hidrogênio (β), para categorizar os tipos de solventes eficientes para a extração das drogas estudadas.39 Estes avanços e a realização de estudos adicionais para um melhor entendimento das interações dos analitos com a SLM podem facilitar a etapa de escolha dos solventes usados na SLM. Instrumentação, configurações e aplicações De maneira clássica, EME pode ser realizada em sistemas bifásicos ou trifásicos. Em sistemas bifásicos, o analito é extraído de uma fase doadora aquosa para uma fase aceptora orgânica, localizada no interior da fibra oca.45 Já no sistema trifásico,15 a extração é realizada em um sistema líquido-líquido-líquido, formado por uma fase doadora aquosa, uma fase orgânica (SLM) e uma fase aceptora aquosa. Estes dois métodos vêm sendo utilizados no preparo de amostras para subsequentes análises por cromatografia gasosa (GC),45 cromatografia líquida de alta eficiência (HPLC),43,46,47 eletroforese capilar48,49 e espectrometria de massas (MS).50 Exemplos recentes de aplicações incluem a extração de proteínas e peptídeos,51,52 aminoácidos,48 poliaminas,53 metais,54 compostos zwiterionicos47 e vários tipos de drogas, como antidepressivos,45 estimulantes55 e anti-inflamatórios.46,56 A extração pode se dar a partir de matrizes simples, como soluções aquosas,9 e de matrizes complexas, como saliva,53 plasma humano,57-59 leite materno56 e urina.60 A fim de melhorar a eficiência e a velocidade do processo de extração com EME, novas abordagens têm sido implementadas, sejam na configuração do sistema em si, ou mesmo na composição da fibra que suporta a membrana líquida. Basheer et al.61 soldaram termicamente quatro folhas de uma membrana porosa de polipropileno, formando um arranjo contendo três compartimentos independentes, chamado de membrana envelope. Usando esta membrana os autores foram capazes de extrair simultaneamente drogas ácidas e básicas, de água de descarte, para posterior análise por GC-MS. Nesta abordagem, a SLM foi imobilizada na membrana envelope e os eletrodos foram posicionados nos compartimentos laterais, os quais foram preenchidos com soluções acidas e básicas. A solução aceptora (50 µL de 1-octanol) foi adicionada ao compartimento central, localizado no centro da membrana envelope. Deste modo, as drogas ácidas e básicas foram simultaneamente extraídas para as camadas exteriores da membrana e subsequentemente coletadas na fase aceptora, demonstrando a possiblidade de modificação da técnica para extração simultânea de compostos carregados positiva e negativamente. Adicionalmente, Safari et al.54 demonstraram a extração de cromo VI e III, utilizando duas fibras ocas, uma ao redor de cada eletrodo, em um modo de extração denominado eletroextração dual em membrana (DEME). Em outro trabalho relevante, Eibak et al.62 utilizaram o conceito de eletroextração em membrana planar, previamente reportado por Huang et al.,59 para o desenvolvimento de um sistema de extração simultâneo em uma placa com 96 reservatórios. Essa eletroextração em membrana em paralelo (Pa-EME) foi realizada utilizando vials de 200 µL, cuja base foi retirada e substituída por uma membrana planar contendo NPOE como SLM. Os vials foram imobilizados em um suporte e este foi posicionado sobre a placa de 96 reservatórios. Ambas as partes foram cobertas com uma folha de alumínio, a qual foi utilizada como eletrodo na extração. Os autores puderam realizar a extração em paralelo de drogas modelos, as quais foram analisadas por CE-UV, HPLC-MS e análise por injeção em fluxo com detecção por MS. Assim, a Pa-EME possibilitou a realização de extrações e análises paralelas com redução de tempo. O desenvolvimento de novas composições de SLM vem sendo explorado para melhorar a eficiência da extração. Por exemplo, Ramos-Payán et al.63 adicionaram nanopartículas de prata (AgNPs) aos poros de uma fibra oca de polipropileno para a extração de drogas anti-inflamatórias, como ibuprofeno e ácido salicílico. Os autores demonstraram que a presença de AgNPs proporcionou um aumento na taxa de transferência dos analitos através da SLM, levando a fatores de recuperação de 1,2 a 2 vezes maiores do que os obtidos com SLMs convencionais. Esta abordagem pode proporcionar ainda a funcionalização da membrana utilizando-se nanopartículas funcionalizadas. Em adição, Hidalgo et al.64 avaliaram a performance da SLM com AgNPs imobilizadas em ágar em comparação às membranas de polipropileno convencionalmente utilizadas. Pela extração também de drogas anti-inflamatórias, os autores puderam obter fatores de pré-concentração dos analitos de 10 a 30 vezes maiores, quando a extração foi realizada utilizando membrana agar-AgNP, evidenciando o aumento da migração de analitos para a fase aceptora. Hasheminasab et al.56 propuseram a introdução de nanotubos de carbono à SLM, aumentando a área superficial da membrana e proporcionando processos de adsorção e desorção em adição ao transporte eletrocinético, contribuindo assim para o aumento da recuperação dos analitos. Este método tem sido utilizado em sistemas bifásicos e trifásicos para a extração de compostos orgânicos e inorgânicos.56,65 Em outra abordagem relevante, Sun et al.66 substituíram a fase orgânica imobilizada na membrana por líquidos iônicos baseados em hexafluorfosfato de imidazólio na extração dos compostos bioativos stricnina e brucina de amostras de urina humana. Os líquidos iônicos têm propriedades físico-químicas que possibilitam sua utilização como SLM, tais como baixa volatilidade e toxicidade, polaridade ajustável e afinidade adequada para extração de compostos orgânicos e inorgânicos.66 A alta viscosidade destes líquidos é uma desvantagem em extrações sem a utilização do campo elétrico, mas em EME possibilitam extrações eficientes em tempos da ordem de 5-10 minutos. Os valores de recuperação obtidos para analitos em amostras de urina utilizando eletroextração em membrana com líquido iônico (IL-EME) foram da ordem de 90% e os limites de detecção foram semelhantes aos obtidos com o emprego de extração líquido-líquido e microextração em fase sólida.66 Estes resultados evidenciam que os líquidos iônicos são uma alternativa promissora para a confecção de SLMs e apontam para uma área com grande potencial de exploração em EME. No caso da extração de substâncias altamente hidrofílicas, como os aminoácidos asparagina (ASN) e glutamina (GLN), a EME apresenta dificuldades devido à baixa afinidade dessas substâncias à SLM orgânica. Rezazadeh et al.67 demonstraram que a aplicação de potenciais pulsados, ao invés de contínuos, aumenta consideravelmente a estabilidade e recuperação deste tipo de analito. Este modo é comumente referido como eletroextração pulsada em membrana (PEME). Em exemplo recente, Rezazadeh et al.68 utilizaram PEME para a extração de ASN e GLN em matriz de gelatina para posterior derivatização e determinação por HPLC-UV. Os autores reportam valores de recuperação acima de 92,5% para os analitos citados. Outras diversas aplicações da EME em preparo de amostras podem ser encontradas em artigos de revisão bastante abrangentes.10,16,39 Além disso, a Tabela 2 resume as aplicações da EME reportadas recentemente, no período de janeiro de 2014 a abril de 2015.
Finalmente, a simplicidade da instrumentação necessária à EME viabiliza o seu desenvolvimento em dispositivos microfluídicos, possibilitando a integração desta técnica de preparo de amostras a sistemas miniaturizados de análises químicas. As vantagens, limitações e avanços desta abordagem são tratados em seção específica deste artigo de revisão. Vantagens, limitações e perspectivas A EME é uma técnica de preparo de amostra rápida, que envolve instrumentação simples e que pode, mediante a seleção dos parâmetros que influenciam a extração, apresentar seletividade a determinados analitos ou grupo de analitos. Dentre todos os parâmetros relevantes ao processo, a composição da membrana líquida suportada é o mais importante, porém o conhecimento limitado sobre as propriedades dos compostos a serem escolhidos é ainda uma das limitações da EME. Felizmente, os recentes trabalhos voltados a este aspecto vêm contribuindo para que a comunidade científica se aproxime de um modelo teórico que possa auxiliar na escolha da SLM e, consequentemente, facilitar o uso da EME em aplicações específicas. O desenvolvimento de SLMs e membranas suporte alternativas pode também contribuir para o melhoramento da seletividade do processo. Uma limitação da EME decorre do fato desta técnica não ser adequada à extração e pré-concentração de compostos neutros. Por outro lado, esta desvantagem reverte-se em uma característica relevante quando os interferentes são espécies não iônicas. O desenvolvimento de sistemas para realização de extrações múltiplas e simultâneas (paralelas) é uma tendência que proporciona um aumento no número de amostras que podem ser analisadas em um determinado período de tempo (frequência analítica). Finalmente, o rápido desenvolvimento da EME e as vantagens desta técnica de preparo de amostras indicam que em breve haverá o surgimento dos primeiros dispositivos comerciais.
ELETROEXTRAÇÃO LÍQUIDO-LÍQUIDO SEM MEMBRANAS A extração líquido-líquido sem membranas,14,80 também conhecida pelos nomes de eletroforese bifásica e eletropartição,81 consiste na aplicação de um campo elétrico perpendicular à interface entre dois líquidos imiscíveis. Com isso, a distribuição final das espécies entre as fases é governada tanto pela mobilidade eletroforética do analito quanto por sua constante de distribuição entre as fases (Figura 3).
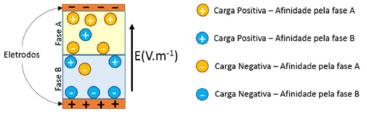 Figura 3. Diagrama da eletroforese bifásica. As moléculas são separadas de acordo com sua carga e a sua afinidade pelas fases presentes no sistema
Segundo relatos da literatura, os primeiros trabalhos utilizando duas fases líquidas e campo elétrico datam da primeira metade do século XX, com os dispositivos comerciais para desemulsificação ou remoção de solventes,82 enquanto os primeiros estudos da transferência de massa através de interfaces são das décadas de 1960 e 1970.83 Todavia, a eletroextração líquido-líquido impulsionada por campo elétrico foi apresentada pela primeira vez no fim da década de 1980, quando a segunda fase foi introduzida por Stichlmair et al.14 aos processos convencionais de eletroforese, na tentativa de minimizar o efeito do aquecimento (efeito Joule) na dispersão das moléculas.84,85 No entanto, o papel da interface no processo de separação só se tornou mais claro recentemente.84 De acordo com alguns autores, ocorrem mudanças na tensão superficial da interface devido ao aumento de cargas nesta região.85 Em um dos primeiros trabalhos publicados sobre o assunto, Stichlmair14 ressalta que a eletroneutralidade é condição necessária para o efeito desejado e que o transporte de íons na interface deve ser compensado pela geração de íons nos eletrodos. Além disso, alguns dos requerimentos da extração líquido-líquido se mantêm: as fases devem apresentar diferenças de densidade e tensão interfacial suficientes para formar uma interface definida, e baixa viscosidade, de maneira a melhorar a transferência de massa.14 Contudo, o principal requerimento para que a extração funcione nestas condições é que as duas fases escolhidas sejam imiscíveis e condutivas. Na composição da fase orgânica é possível utilizar solventes orgânicos que absorvam quantidades suficientes de água para que se tornem condutivos, como é o caso do n-butanol.14,86 Por outro lado, podem ser utilizados aditivos capazes de conduzir corrente, como a trioctilamina.87 Alternativamente, é possível utilizar sistemas aquosos bifásicos - constituídos por duas soluções aquosas imiscíveis.84,88,89 Outras duas possibilidades descritas na literatura,14 mas pouco usuais, são os sistemas ternários, em que a água se apresenta dissolvida em ambas as fases orgânicas, como glicerina-acetona-água e os sistemas água-surfactante não-iônico. Sistemas aquosos bifásicos Os sistemas aquosos bifásicos foram reportados pela primeira vez no final do século XIX, mas só foram introduzidos como ferramenta de separação algumas décadas depois.89-91 Estes sistemas ocorrem porque soluções aquosas contendo componentes hidrofílicos incompatíveis - como poli(etileno-glicol) (PEG) e dextrana - acima da concentração e temperatura críticas tendem a dividir-se, formando duas fases, cada uma delas rica em um dos polímeros. As tensões interfaciais destes sistemas são significativamente menores que as relatadas para sistemas envolvendo fases orgânicas.92,93 Estes sistemas apresentam maior biocompatibilidade e menor impacto ambiental, além de custo reduzido,94 tendo sido utilizados em alguns processos de eletroextração.88,89,95,96 Como consequência das diferenças nas composições das fases, os analitos apresentaram distribuição não equitativa entre elas,97 assim como observado em extrações água-óleo (Figura 4).
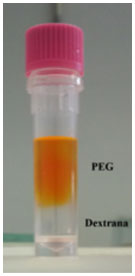 Figura 4. Distribuição do corante (amarelo VI) entre fases de PEG (superior) e dextrana (inferior)
Eletroextração a partir de gotas A extração a partir de gotas sob campo elétrico é, em parte, bastante semelhante ao discutido nos tópicos anteriores. Entretanto, uma complexidade adicional resulta dos efeitos de coalescência/ruptura, e de mudanças no fluxo no interior da gota, em sua geometria ou na estrutura de sua interface, induzidos pelo campo elétrico.85,98 Por esse motivo, é tratado na maior parte dos casos como uma técnica independente. Entre as peculiaridades induzidas no comportamento das gotas que auxiliam no aumento da transferência de massa, estão o aumento da velocidade das gotas através do meio e o aumento da circulação de fluido dentro e ao redor das gotas.85,98 Em alguns casos, o campo elétrico é utilizado simplesmente para promover a dispersão do líquido em gotas e sua posterior coalescência,99 não exercendo papel na transferência de massa. Nesse caso, o processo é mais próximo de uma extração líquido-líquido comum do que da eletroextração, não sendo, portanto, parte do escopo deste trabalho. Aplicações Batelada A eletroextração líquido-líquido em batelada foi inicialmente realizada em tubos com formato de U, em um esquema semelhante ao apresentado na Figura 5.
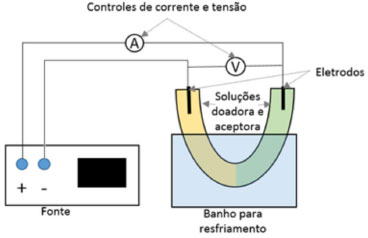 Figura 5. Esquema de um extrator em batelada utilizado para eletroforese bifásica
Um reator como esse foi utilizado no trabalho inicial de Stichlmair14 e por Zhai et al.88,95 para a extração de aminoácidos, utilizando soluções aquosas de poli(etileno-glicol) e dextrana. A configuração em U apresenta a desvantagem de proporcionar apenas uma pequena área de contato entre as fases. A alternativa para aumentar a área na qual ocorre a transferência de massa são sistemas em que as fases são colocadas uma sobre a outra, de maneira a aumentar a área interfacial. Um sistema semelhante foi utilizado no trabalho de Glitzenstein et al.100 para a transferência de ácido acético entre querosene e água. Devido a inexistência de uma membrana entre os líquidos, o uso em fluxo contínuo é usualmente feito em cocorrente, com os dois líquidos escoando paralelamente, facilitando o estabelecimento de regime laminar. Esta configuração pode ser vista no trabalho de Theos e Clark101 para separação de proteínas. Uma exceção é o trabalho de Luo et al.,86 no qual corantes são extraídos com fluxos de água e butanol em contra-corrente. Integração com outras técnicas Van der Vlis et al.102 propuseram em 1994 o acoplamento da eletroextração líquido-líquido com a separação por eletroforese capilar, por meio de um processo de três estágios. No primeiro, um capilar é preenchido com eletrólito iniciador e os primeiros 5% do comprimento são preenchidos hidrostaticamente com eletrólito terminador. A seguir, o capilar é posicionado em solução de acetato de etila contendo o analito. Em seguida, o potencial é aplicado, promovendo a eletroextração do analito para o eletrólito terminador. A solução de amostra original é removida utilizando-se pressão para minimizar a entrada do solvente no capilar. No segundo estágio, o capilar é posicionado no eletrólito terminador e o analito é concentrado por isotacoforese com contrapressão, enquanto o remanescente de acetato de etila é removido devido a aplicação de pressão. Na etapa final, o capilar é novamente posicionado no eletrólito de corrida e o processo de eletroforese capilar tem início. Neste caso, β-alanina foi utilizada como modificador no acetato de etila, de forma a promover o aumento de condutividade e manutenção da corrente. A técnica descrita foi mais tarde aperfeiçoada pelos autores, de maneira a acomodar o acoplamento com um espectrômetro de massas,103 resultando finalmente em um injetor desenvolvido de maneira que a eletroextração pudesse ser acoplada a técnicas que não envolvem o uso de potencial elétrico, como a cromatografia líquida de alta eficiência.104 Cerca de 20 anos mais tarde, Lindenburg et al.105-108 publicaram uma série de trabalhos empregando a eletroextração otimizada por Van der Vlis et al.,102 acoplada a HPLC-MS como ferramenta para estudos metabolômicos e peptidômicos.
EXTRAÇÃO EM FASE SÓLIDA ASSISTIDA POR CAMPO ELÉTRICO OU ELETROEXTRAÇÃO EM FASE SÓLIDA (E-SPE) Fundamentos Os primeiros trabalhos empregando a extração em fase sólida (SPE) convencional foram descritos no início da década de 1970 e alguns anos depois cartuchos de extração passaram a ser comercializados.109 A SPE está entre as principais e mais difundidas técnicas de preparo de amostras complexas, como fluidos biológicos, amostras ambientais (solo, sedimentos, efluentes e águas superficiais) e de alimentos.109 Os procedimentos de SPE empregando cartuchos são comumente realizados em quatro etapas principais (Figura 6): 1) preparação do sorvente para recebimento da amostra líquida; 2) aplicação da amostra e extração dos analitos; 3) remoção ou limpeza dos interferentes e 4) eluição dos analitos purificados e pré-concentrados. A passagem dos líquidos durante todas essas etapas pode ser promovida por uma diferença de pressão, exercida por uma bomba de vácuo ou bomba peristáltica.
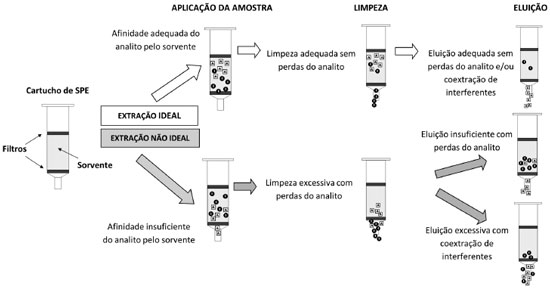 Figura 6. Esquema comparando uma extração ideal por SPE e uma extração real, em que a remoção de interferentes é insuficiente e/ou ocorre perdas do analito durante uma ou mais etapas. Círculos pretos e quadrados brancos representam interferentes e analitos, respectivamente
Um dos grandes desafios da SPE convencional continua sendo obter e empregar materiais sorventes nos quais os mais diferentes analitos tenham afinidade adequada, sem que haja coextração expressiva de interferentes (Figura 6). Na SPE nem sempre a otimização das condições (solvente, pH e força iônica) das amostras e das soluções de limpeza e de eluição final permite obter um extrato suficientemente livre de interferentes e sem perdas significativas dos analitos (Figura 6). Uma das frentes de desenvolvimento mais recente da SPE consiste na utilização de campo elétrico para que mecanismos eletroforéticos e cromatográficos possam simultaneamente proporcionar uma melhor seletividade e eficiência de extração. Esse procedimento de extração em fase sólida assistida por campo elétrico, também chamada de eletroextração em fase sólida, foi batizado pela sigla E-SPE por Orlando et al.110-112 Na E-SPE dois eletrodos são posicionados ao longo do cartucho de extração, sendo um acima e outro abaixo dos filtros que suportam o sorvente. Uma diferença de potencial elétrico é aplicada durante uma ou mais etapas (aplicação da amostra, limpeza ou eluição final) da extração, formando um campo elétrico ao longo do sorvente, de maneira que os efeitos eletroforéticos possam auxiliar no processo de extração. Os principais efeitos eletroforéticos provenientes da aplicação do campo elétrico em E-SPE são: 1) a migração eletroforética; 2) a eletrosmose; 3) o aquecimento (efeito Joule) e 4) a polarização de concentração (Figura 7). Nos procedimentos de E-SPE os efeitos eletroforéticos são os mesmos descritos para as técnicas de separação por eletroforese (em gel e capilar) e podem ser divididos em efeitos seletivos e não seletivos para a extração.113 Os efeitos eletroforéticos seletivos são a migração eletroforética (representada pela velocidade eletroforética, νep) e a polarização de concentração, pois dependem da carga do analito ou dos interferentes.113,114 A νep é um componente de movimento que pode ser explorada para promover a migração seletiva dos analitos e/ou dos interferentes carregados em contra ou pró-fluxo em relação ao movimento de convecção promovido pela diferença de pressão aplicada (Figura 7). Já a polarização de concentração é a expansão da dupla camada elétrica sobreposta no interior dos poros do sorvente que leva a um maior adensamento de contra-íons (íons de carga oposta ao potencial zeta desenvolvido na superfície do sorvente).114 No exemplo da sílica, na qual os grupos silanóis dissociados geram um potencial zeta negativo (-ζ), a polarização da concentração faz com que haja uma maior concentração de cátions no interior dos poros em relação a região externa da partícula de sorvente.114 Neste caso, como consequência, os cátions apresentam uma afinidade e sorção aparente maior pelo sorvente durante a aplicação do campo elétrico (Tabela 3). Para compostos neutros, tanto a νep como a polarização de concentração não apresentam efeitos apreciáveis (Figura 7, Tabela 3). Dois efeitos eletroforéticos não seletivos também contribuem para o procedimento de E-SPE, a eletrosmose (representada pela velocidade do fluxo eletrosmótico, νeo) e o aquecimento proveniente do efeito Joule. Esses efeitos podem ser considerados não seletivos, pois independentemente dos compostos (analitos ou interferentes) serem carregados ou neutros, o movimento e a sorção deles serão influenciados com a mesma intensidade pela νeo e pelo aquecimento (Figura 7, Tabela 3). Apesar do νeo não depender em geral da carga dos analitos ou dos interferentes, este parâmetro é fortemente dependentes de diversas características do sorvente e do ambiente químico da fase líquida, como potencial zeta, área superficial, porosidade, pH, constante dielétrica, entre outros.113 Já o efeito Joule depende do potencial aplicado, da corrente elétrica resultante e da vazão das soluções. Com o aquecimento durante a aplicação do campo elétrico a afinidade dos compostos pelo sorvente geralmente diminui, o que pode ser traduzido pela diminuição da constante de distribuição do analito pelo sorvente (KD) (Tabela 3).115
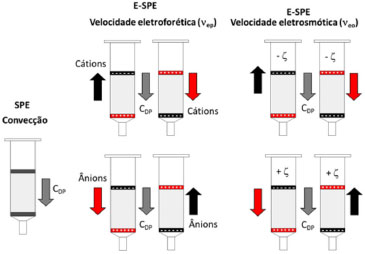 Figura 7. Representação do movimento de convecção presente em SPE associados aos movimentos eletroforéticos (eletrosmose, νeo e migração eletroforética, νep) em E-SPE. Movimento de convecção promovido por diferença de pressão presente em SPE e E-SPE, CDP (  ); Movimentos eletroforéticos em contrafluxo ( ); Movimentos eletroforéticos em contrafluxo ( ) ou pró-fluxo ( ) ou pró-fluxo ( ) da νep e νeo em função da carga do analito (cátion ou ânion) e do potencial zeta do sorvente (-ζ ou +ζ) presentes em E-SPE ) da νep e νeo em função da carga do analito (cátion ou ânion) e do potencial zeta do sorvente (-ζ ou +ζ) presentes em E-SPE
Em E-SPE tanto a νeo como a νep podem atuar no mesmo sentido ou em sentido contrário ao fluxo de convecção, dependendo principalmente da polaridade dos eletrodos, das cargas dos compostos e do potencial zeta (ζ) do sorvente empregado. Além disso, νeo e νep podem estar no mesmo sentido ou em sentidos contrários um em relação ao outro, dependendo da carga dos analitos e do ζ do sorvente (Figura 7).110-112 É fácil observar que a E-SPE possui uma série de recursos adicionais em comparação a SPE, que podem ser explorados para modular a seletividade da extração de analitos e interferentes carregados ou neutros durante as diferentes etapas do procedimento de preparo de amostras. Morales-Cid et al.,8 em uma das primeiras revisões na literatura sobre o emprego de campo elétrico em técnicas de preparo de amostras, resume os seguintes benefícios que podem ser explorados com essa abordagem em extração em fase sólida: 1) favorecimento dos processos sortivos devido à orientação das moléculas; 2) aumento da cinética de transferência de massa devido às νeo e νep; 3) maior eficiência da convecção também devido às νeo e νep. Instrumentação e configurações da E-SPE Os primeiros cartuchos do tipo seringa para E-SPE foram descritos e patenteados por Orlando e Rath116 em 2007 e apresentados posteriormente em um artigo científico.111 Não existiam cartuchos comerciais de E-SPE e sua montagem demandou, além das partes convencionais dos cartuchos de SPE (filtros, sorvente e corpo do cartucho), dois eletrodos de aço inoxidável (Figura 8).
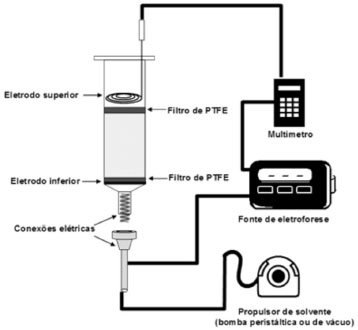 Figura 8. Dispositivos e cartuchos com eletrodos adaptados para E-SPE
Os cartuchos de E-SPE (Figura 8) receberam em sua montagem uma tela de aço inoxidável abaixo do filtro inferior que funcionou como eletrodo. Para a aplicação do campo elétrico, um segundo eletrodo removível (eletrodo superior) composto de uma espiral de aço inoxidável foi introduzido pela abertura superior do cartucho. Com os cartuchos adaptados para aplicação de campo elétrico o procedimento de extração é executado de maneira bastante semelhante ao procedimento convencional de SPE e, para tanto, é preciso empregar um sistema propulsor de solvente como bombas peristálticas ou bombas de vácuos. Um dos grandes diferenciais dos sistemas de E-SPE para os de SPE está na necessidade de empregar uma fonte de corrente ou tensão contínua ajustável, que é conectada aos eletrodos do cartucho. Durante a extração é de fundamental importância controlar e monitorar a corrente e o potencial elétrico. Nos trabalhos de Orlando et al.110-112,116 multímetros foram usados para esse propósito como mostra a Figura 8. Aplicações em preparo de amostra Morales-Cid et al.117 em 2008 empregaram pela primeira vez o termo extração em fase sólida assistida por campo elétrico. Neste trabalho foi construído um sistema de extração em fase sólida em fluxo empregando uma minicoluna de extração com 3 mm de diâmetro interno, contendo 14 mg de sorvente a base de sílica-C18, a qual foi acoplada a um equipamento de eletroforese capilar com detecção por espectrometria de massas. Esse sistema foi avaliado na determinação de três antimicrobianos (tetraciclina, clortetraciclina e oxitetraciclina) e de quatro aminas (propilamina, 3-metil-1-butanamina, 1-metilbutilamina e heptilamina) como compostos modelo. O campo elétrico para o dispositivo de E-SPE foi gerado pela mesma fonte de tensão de separação usada no equipamento de eletroforese capilar. Usando voltagens de -10 kV o campo elétrico foi capaz de aumentar o sinal da tetraciclina em até 7,5 vezes, o que foi atribuído tanto ao efeito de empilhamento (stacking) das moléculas em um menor volume de solvente de eluição como ao formato do pico, mais estreito e com melhor simetria. Resultados semelhantes também foram obtidos para os demais analitos. Apesar de utilizarem os mecanismos eletrocromatográficos no processo de extração, neste trabalho os autores empregaram um dispositivo que configura uma coluna de SPE e não um cartucho de SPE convencional do tipo seringa. Neste trabalho também foi necessário utilizar potenciais elétricos elevados para obter os resultados desejados, o que ocasionou problemas de escape de descargas elétricas sobre a bomba peristáltica utilizada. Esse sistema foi avaliado somente para soluções padrão e não foi demonstrado seu desempenho em amostras complexas. Em um dos primeiros trabalhos110 envolvendo E-SPE foram extraídos dois corantes catiônicos e seis aniônicos em solução tampão, além de três antimicrobianos em amostras de leite. Neste trabalho, um exemplo expressivo da maior eficiência da E-SPE em relação à SPE foi observado para os resultados de testes de recuperação para o corante catiônico azul de metileno, extraído de solução tampão (Figura 9). Neste exemplo foram avaliadas duas polaridades diferentes dos eletrodos durante a aplicação do campo elétrico na etapa de limpeza. Os resultados de recuperação evidenciaram que a E-SPE poderia ser empregada tanto para favorecer a permanência do corante no cartucho quanto para auxiliar a saída de compostos carregados (analitos ou interferentes).
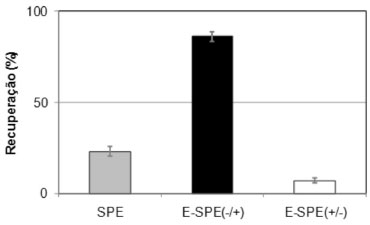 Figura 9. Recuperação média (n = 3) do corante catiônico azul de metileno em extrações empregando a SPE (coluna cinza) e a E-SPE (colunas preta e branca). Condições da etapa de limpeza: 5mL de tampão citrato 0,75 mmol L-1pH 4,68 adicionado de 30% (v/v) de 2-propanol; vazão de 1,5 mL min-1; 500 mg de sílica-C18 como sorvente; potencial elétrico de 200 V com eletrodo superior negativamente carregado (coluna preta)(contrafluxo) e positivamente carregado (coluna branca) (pró-fluxo). Barras de erro representando o desvio padrão110
Posteriormente, Orlando et al.111 avaliaram a E-SPE para a extração do antimicrobiano marbofloxacina em sua forma catiônica em amostras de leite. Dependendo da polaridade empregada nos eletrodos a recuperação dos analitos foi aumentada (2,3 vezes) ou diminuída (4,2 vezes) em relação à extração sem aplicação de campo elétrico. Estes resultados comprovaram, pela primeira vez, que a E-SPE possui grande potencial para ser empregada em amostras complexas. Em 2014, Ribeiro118 explorou a E-SPE visando melhorar a eliminação de interferentes e também elevar a recuperação de seis quinolonas e seis sulfonamidas em amostras de ovos. Os melhores resultados foram obtidos aplicando o campo elétrico tanto nas etapas de limpeza como na eluição. O objetivo desta estratégia foi forçar a permanência dos analitos aniônicos nos cartuchos na etapa de limpeza e posteriormente facilitar a saída destes durante a eluição, sem a necessidade de empregar grandes quantidades de solvente orgânico. Os resultados de recuperação obtidos coma E-SPE foram superiores a SPE para todas as quinolonas e sulfonamidas avaliadas. A maior diferença de recuperação observada foi para a quinolona enrofloxacina (84% E-SPE versus 1% SPE) ao passo que a menor diferença foi para a quinolona norfloxacina (69% E-SPE versus 37% SPE). Além dos resultados superiores de recuperação obtidos com o emprego da E-SPE, ficou comprovado que a presença de interferentes no extrato final foi diminuída por empregar menores teores de solvente orgânico para a eluição dos analitos. Outra recente abordagem de aplicação de campo elétrico em procedimentos envolvendo extração sólido-líquido foi apresentada em uma patente recente.119 Nessa patente o uso de campo elétrico foi avaliado pela primeira vez na dispersão da matriz em fase sólida (MSPD, do inglês matrix solid phase dispersion). A MSPD convencional é uma técnica de preparo de amostras baseada na sorção diferencial dos analitos e interferentes em um agente dispersante e, por isso, compartilha alguns princípios com a técnica de SPE.109 De forma geral, a extração MSPD em sua forma mais simplificada é realizada em duas etapas principais. A primeira é a etapa da dispersão que é realizada a partir da mistura e trituração da matriz (sólida, semi-sólida ou líquida) em um sorvente sólido capaz de sorver preferencialmente os interferentes. Nesta etapa, o agente dispersante é capaz de romper partículas e/ou tecidos em matrizes complexas, liberando os analitos e ao mesmo tempo promovendo a sorção seletiva dos interferentes. Após a dispersão da matriz com o dispersante a mistura resultante é introduzida em uma coluna de extração que pode ser um cartucho de SPE. A segunda etapa consiste na extração e coleta dos analitos de interesse com um solvente adequado capaz de promover a remoção seletiva dos analitos de interesse da matriz que são coletados em um tubo para posterior análise, ao passo que os interferentes permanecem retidos no material dispersante. Apesar da simplicidade e da facilidade de execução, algumas limitações, como o baixo poder de remoção de interferente e a baixa recuperação de analitos fortemente sorvidos, restringem as aplicações da MSPD para a determinação de analitos em amostras complexas. Visando contornar algumas destas limitações, Orlando et al.119 descreveram pela primeira a dispersão da matriz em fase sólida assistida por campo elétrico (E-MSPD). Nesta patente foram apresentados resultados de E-MSPD de duas quinolonas e uma sulfonamida em amostras de solo. Após a dispersão de 2 g de solo em 500 mg de sílica quimicamente modificada com um trocador aniônico forte, o material dispersado foi introduzido em um cartucho contendo 500 mg de sílica C18. Empregando um potencial elétrico de 70 V com polaridade positiva sobre o eletrodo superior os antimicrobianos em sua forma catiônica foram extraídos, percolando 30 mL de solução tampão Mcllvaine pH 4,0 e acetonitrila (1:1, v/v). Empregando essa estratégia os resultados de recuperação com a E-MSPD foram no mínimo 60% superiores aqueles obtidos com a MSPD convencional. Nesta avaliação ficou demonstrado que na E-MSPD as νeo e νep, atuando em pró-fluxo de convenção, foram capazes de auxiliar a extração dos analitos fortemente sorvidos no solo em comparação ao procedimento convencional, sem aplicação do campo elétrico. Essa estratégia não somente elevou a recuperação dos analitos como também reduziu a porcentagem de modificador orgâni, co e o volume total de solvente de extração. Perspectivas De forma geral, o uso de campo elétrico demonstra uma enorme capacidade para elevar a seletividade das técnicas de preparo de amostras baseadas na sorção líquido-sólido, como na E-SPE e na E-MSPD. Até o momento existem poucos trabalhos descritos empregando essas técnicas e, por esse motivo, as suas reais vantagens ainda não foram amplamente avaliadas. Como as técnicas de E-SPE e E-MSPD não estão limitadas a um tipo de matriz, sorvente ou classe de analitos, o escopo de aplicações destas técnicas pode ser estendido para a extração e pré-concentração de compostos inorgânicos, macromoléculas (proteínas, peptídeos, polímeros) em matrizes complexas, como alimentos, solos e amostras biológicas como plantas, tecidos e secreções (saliva, lágrima e suor). Além das muitas aplicações ainda não avaliadas, existe também a necessidade de estudos dos mecanismos eletrocromatográficos envolvidos no processo. Como a E-SPE e E-MSPD possuem características operacionais distintas, como intensidade do campo elétrico, vazão de soluções, tipos de materiais, densidade de recheio e tamanho dos poros das partículas, modelos próprios ou no mínimo ajustados a essas novas realidades precisarão ser propostos. É preciso destacar também que E-SPE e E-MSPD são inovações ambientalmente corretas, pois necessitam de menores quantidades de solventes orgânicos, quando comparadas as respectivas técnicas sem assistência de campo elétrico. Finalmente, apesar de empregar instrumentação simples e de baixo custo, ainda será preciso que dispositivos comerciais sejam desenvolvidos e estejam disponíveis comercialmente para que a E-SPE e E-MSPD possam se tornar acessíveis e sejam avaliadas e utilizadas por outros grupos de pesquisa.
MINIATURIZAÇÃO A partir do trabalho de Manz et al.120 em 1990, em que foram propostos os microssistemas (microchip) de análise, foram iniciadas pesquisas na tentativa de miniaturizar os processos realizados em laboratório, entre eles as técnicas de eletroextração. Os fundamentos, vantagens e limitações da miniaturização em si foram explorados de forma detalhada em diversos artigos de revisão publicados nos últimos anos,121-129 e não serão abordados em profundidade nesta revisão. Os chamados microdispositivos se caracterizam por possuir pelo menos umas das dimensões características abaixo dos 100 µm. Nessa escala, a influência de determinados fenômenos físicos é diferente da observada no cotidiano. Um exemplo dessa diferença é a predominância do regime laminar de escoamento, no qual a transferência de massa só é possível por difusão, não havendo mistura entre as correntes de fluido.130 Neste domínio microfluídico a aplicação de campo elétrico se torna uma poderosa ferramenta para o aumento da eficiência nos processos de extração.89 Além disso, no caso da extração em fase sólida, a possibilidade de usar potencial elétrico para o transporte da amostra através da fase estacionária131 (bombeamento eletrosmótico) diminui significativamente a complexidade do chip, pois elimina a necessidade de implementação de bombas e válvulas no dispositivo. Demandas Os materiais utilizados em microescala diferem um pouco daqueles empregados em processos convencionais, devido às demandas impostas pelos processos de fabricação. Um exemplo é o dispositivo para eletroextração através de membranas utilizado por Kim et al.132 Neste caso, o chip e a membrana foram fabricados em silício e alumínio, respectivamente. Estes materiais não representam uma escolha corriqueira nos processos de filtração convencionais, mas são bastante populares em dispositivos miniaturizados. Isso porque, por meio de técnicas derivadas da microeletrônica, é possível obter estruturas de alta qualidade em dimensões muito reduzidas. Além disso, o dispositivo e a membrana podem ser fabricados em etapas sucessivas de um mesmo processo, evitando a necessidade posterior de integração. Vidro é um outro material bastante utilizado como substrato em diversas técnicas de microfabricação da indústria eletrônica. Por isso e por sua semelhança com a sílica, esse material ainda é bastante comum em dispositivos de separação por campo elétrico. No entanto, os materiais poliméricos são atualmente a principal opção na fabricação de microssistemas de análise, devido ao baixo custo e a facilidade de fabricação.133,134 A principal consequência desta mudança é a diminuição do fluxo eletrosmótico e da hidrofilicidade das paredes, podendo provocar resultados bastante divergentes daqueles encontrados em mesoescala, além da menor resistência química a solventes orgânicos. Boa parte dos materiais poliméricos pode ser atacada ou entumecer em contato prolongado com solventes orgânicos,133,135 o que pode representar uma dificuldade adicional nas extrações envolvendo uma fase orgânica. No caso particular da eletroextração em fase sólida, a principal demanda é o posicionamento da fase estacionária na região desejada, no interior do chip. Algumas soluções apresentadas na literatura são o uso de pilares ou estrangulamento dos canais, de maneira a imobilizar as partículas do sorvente. Outra alternativa discutida é a polimerização da fase sólida dentro dos canais, principalmente por meio de radiação ultravioleta.136 Finalmente, pode-se mencionar a imobilização da fase sólida ao longo das paredes do capilar, ao invés de seu preenchimento completo.137 As pequenas dimensões do canal permitem que a eficiência de extração seja elevada, uma vez que a distância entre o centro do canal e a fase sólida é pequena e pode ser rapidamente percorrida pelos compostos em solução. Quanto às fases líquidas utilizadas, quase sempre são mantidas as condições otimizadas para as técnicas convencionais. Por exemplo, nos trabalhos em que a eletroextração líquido-líquido foi miniaturizada89,138,139 as condições de extração foram semelhantes às empregadas em trabalhos envolvendo sistemas de extração com dimensões convencionais. A escolha se deve, neste caso, à compatibilidade dos solventes com os analitos e pouco tem a ver com a miniaturização.140 Aplicações O dispositivo de eletroextração miniaturizado mais simples é o apresentado por Kerby et al.141 Neste dispositivo o campo elétrico é utilizado para separar íons por meio de uma bifurcação de microcanais e apenas uma solução é utilizada no processo. Estrutura semelhante foi utilizada por Shin et al.142 para a extração de nanotubos de carbono. Contudo, nesse segundo trabalho, ao invés da bifurcação foi utilizado um chip em forma de H, com duas entradas (eletrólito e amostra) e duas saídas (uma com solução contendo os nanotubos e outras contendo amostra limpa). No meio um canal permite o contato entre as duas soluções, beneficiando-se do fluxo laminar imposto pela microescala. Neste trecho o potencial para eletroextração é aplicado. O grupo de Hardt utilizou a extração líquido-líquido auxiliada por campo elétrico para separar moléculas de DNA e proteínas de acordo com seu tamanho.138,139,143 Schoonen et al.144 desenvolveram um microdispositivo para eletroextração líquido-líquido em que uma solução aquosa aceptora permanece estática e uma solução orgânica doadora é mantida em fluxo laminar. O campo elétrico é aplicado perpendicularmente ao fluxo, favorecendo a migração eletroforética dos analitos para a fase aceptora. Essa configuração permite uma elevada razão entre os volumes das soluções doadora e aceptora, o que resulta em elevados fatores de pré-concentração, como os obtidos (34 a 80 vezes) pelos autores para extração de carnitinas. Kuban et al.145 acoplaram um microdispositivo de eletroextração com membrana a um capilar, para a separação de biomoléculas de soro e plasma sanguíneo. Ramsey e Collins136 utilizaram a eletroextração em fase sólida como forma de pré-tratamento de amostras em microchips, previamente à separação por cromatografia eletrocinética micelar. Usando o mesmo princípio, Kutter et al.137 apresentaram um chip com canais em forma de cruz, semelhante ao utilizado para eletroforese capilar, com a fase estacionária C-18 imobilizada nas paredes do canal. Petersen et al.146 foram os primeiros a reportar um sistema de EME em chip, no qual uma membrana porosa de polipropileno (25 µm de espessura) foi imobilizada entre duas placas de acrílico, contendo canais microusinados. A solução doadora foi bombeada através dos microcanais com auxílio de uma bomba de seringa e um potencial elétrico de 15 V foi aplicado através da membrana durante a extração. Usando NPOE como membrana líquida suportada os autores avaliaram o chip em eletroextrações de drogas básicas, como petidina, nortriptilina, metadona, haloperidol e loperamida em urina humana. Após a eletroextração, a solução aceptora, composta por HCl 10 mmol L-1, foi analisada por eletroforese capilar e os valores de recuperação dos analitos variaram de 20 a 60%. Utilizando o mesmo chip em outro trabalho,147 as soluções doadora e aceptora foram bombeadas pelo chip, de maneira que a solução aceptora foi continuamente (em fluxo) analisada por espectrofotometria UV-vis e espectrometria de massas. Empregando os mesmos analitos do trabalho anterior, os autores obtiveram recuperações de 65 a 86% e fatores de pré-concentração acima de 75 vezes. Em uma nova versão do chip para EME, uma pequena câmara de reação foi integrada para monitoramento in vivo do metabolismo da droga amitriptilina.148 Nestes trabalhos descritos sobre EME em chip, a etapa de extração foi realizada separadamente, sendo necessária a transferência da amostra pré-concentrada para o sistema de separação e/ou detecção. Porém, uma perspectiva futura é a integração da EME e demais etapas de análises em uma mesmo dispositivo microfluídico. Neste sentido, Seidi et al.149 implementaram a EME em um dispositivo portátil para determinação de íons chumbo (II). Uma bateria de 9 V foi utilizada para aplicar o campo elétrico através de uma membrana líquida de 1-octanol imobilizada nos poros de uma membrana de polipropileno. A presença de iodeto de potássio (KI) na solução aceptora levou à formação do precipitado amarelo de PbI2. Usando a câmara de um telefone celular os autores relacionaram a intensidade da cor do precipitado com a concentração de íons chumbo (II) extraídos. Com uma eletroextração de 20 min foi possível alcançar um limite de detecção de 20 ng mL-1 e repetibilidades e reprodutibilidades de 3,8-7,0% e 9,8-11,9%, respectivamente.
CONSIDERAÇÕES FINAIS O desenvolvimento de métodos e técnicas de preparo de amostras continua sendo um assunto de grande relevância devido à necessidade de análises de amostras cada vez mais complexas, bem como em função da alta demanda por determinações seletivas de analitos em concentrações a níveis cada vez menores. Este artigo de revisão demonstrou que o emprego de campo elétrico em procedimentos de preparo de amostras pode contribuir de forma significativa para a redução de tempo e aumento da eficiência de extração de analitos ou remoção de interferentes. Além disso, um dos objetivos dessa revisão é mostrar que esse campo de pesquisa encontra-se em estágio de grande expansão e ainda com muitos desafios para serem superados. Por exemplo, a eletrólise em meio aquoso causa variações de pH ou pode levar a reações de oxirredução dos analitos, comprometendo a eficiência da eletroextração. Estudos teóricos fundamentais vêm contribuindo para um melhor entendimento do efeito do campo elétrico e de vários outros parâmetros nos processos de extração. A miniaturização dos processos de eletroextração segue uma tendência mundial em química analítica e traz as conhecidas vantagens, como a maior portabilidade, rapidez e menor consumo de amostras e reagentes. Além disso, a miniaturização pode trazer novos desafios ou soluções para os processos de eletroextração. Uma evolução do emprego de campo elétrico em preparo de amostras seria o desenvolvimento de estratégias que permitissem aplicações também para analitos eletricamente neutros. Neste sentido, a eletroextração em fase sólida e o emprego de carreadores carregados, como as ciclodextrinas catiônica e aniônica, apresentam um grande potencial para esta finalidade. Finalmente, o crescente número de grupos de pesquisa envolvidos, os avanços obtidos e, o mais importante, as vantagens do auxílio de campo elétrico em preparo de amostras levam-nos a acreditar que em breve surgirão os primeiros dispositivos comerciais para eletroextração. A confirmação desta possibilidade certamente traria uma maior visibilidade para a área, além de levar a novas demandas de desenvolvimento.
AGRADECIMENTOS Os autores agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, Proc. Nº 305318/2012-8 e 140486/2012-7) e à Fundação de Amparo à Pesquisa do Estado de São Paulo (FAFESP, Proc. Nº 2013/22485-6, 2011/02477-3) pela concessão de bolsas e projetos de pesquisa.
REFERÊNCIAS 1. Pawliszyn, J. Em Handbook of Solid Phase Microextraction; Pawliszyn, J.; ed. Elsevier: London, 2012, cap. 1. 2. Queiroz, S. C. N.; Collins, C. H.; Jardim, I. C. S. F.; Quim. Nova 2001, 24, 68. DOI: http://dx.doi.org/10.1590/S0100-40422001000100024 3. Caldas, S. S.; Goncalves, F. F.; Primel, E. G.; Prestes, O. D.; Martins, M. L.; Zanella, R.; Quim. Nova 2011, 34, 1604. DOI: http://dx.doi.org/10.1590/S0100-40422011000900021 4. Seidi, S.; Yamini, Y.; Cent. Eur. J. Chem. 2012, 10, 938. DOI: http://dx.doi.org/10.2478/s11532-011-0160-1 5. de Castro, M. D. L.; Priego-Capote, F.; Talanta 2007, 72, 321. DOI: http://dx.doi.org/10.1016/j.talanta.2006.11.013 6. Smith, F. E.; Arsenault, E. A.; Talanta 1996, 43, 1207. DOI: http://dx.doi.org/10.1016/0039-9140(96)01882-6 PMID: 18966599 7. Chen, Y.; Guo, Z. P.; Wang, X. Y.; Qiu, C. G.; J. Chromatogr. A 2008, 1184, 191. DOI: http://dx.doi.org/10.1016/j.chroma.2007.10.026 PMID: 17991475 8. Morales-Cid, G.; Cardenas, S.; Simonet, B. M.; Valcarcel, M.; TrAC, Trends Anal. Chem. 2010, 29, 158. DOI: http://dx.doi.org/10.1016/j.trac.2009.11.006 9. Gjelstad, A.; Pedersen-Bjergaard, S.; Anal. Methods 2013, 5, 4549. DOI: http://dx.doi.org/10.1039/C3AY40547H 10. Gjelstad, A.; Pedersen-Bjergaard, S.; Electrophoresis 2014, 35, 2421. DOI: http://dx.doi.org/10.1002/elps.201400127 PMID: 24810105 11. Yamini, Y.; Seidi, S.; Rezazadeh, M.; Anal. Chim. Acta 2014, 814, 1. DOI: http://dx.doi.org/10.1016/j.aca.2013.12.019 PMID: 24528839 12. Seidi, S.; Yamini, Y.; Rezazadeh, M.; Talanta 2015, 132, 339. DOI: http://dx.doi.org/10.1016/j.talanta.2014.08.059 PMID: 25476317 13. Joseph, N. R.; Stadie, W. C.; J. Biol. Chem. 1938, 125, 795. 14. Stichlmair, J.; Schmidt, J.; Proplesch, R.; Chem. Eng. Sci. 1992, 47, 3015. DOI: http://dx.doi.org/10.1016/0009-2509(92)87003-9 15. Pedersen-Bjergaard, S.; Rasmussen, K. E.; J. Chromatogr. A 2006, 1109, 183. DOI: http://dx.doi.org/10.1016/j.chroma.2006.01.025 PMID: 16445928 16. Carasek, E.; Merib, J.; Anal. Chim. Acta, no prelo. PMID: 26092333 17. Strathmann, H.; Desalination 2010, 264, 268. DOI: http://dx.doi.org/10.1016/j.desal.2010.04.069 18. Okamoto, Y.; Hayashi, K.; Kawahara, Y.; Kumamaru, T.; Bull. Chem. Soc. Jpn. 1993, 66, 1664. DOI: http://dx.doi.org/10.1246/bcsj.66.1664 19. Steiner, F.; Bohn, P.; Chromatographia 2003, 58, 59. 20. Buscher, B. A. P.; Tjaden, U. R.; van der Greef, J.; J. Chromatogr. A 1997, 788, 165. DOI: http://dx.doi.org/10.1016/S0021-9673(97)00707-3 21. Haddad, P. R.; Laksana, S.; Simons, R. G.; J Chromatogr. 1993, 640, 135. DOI: http://dx.doi.org/10.1016/0021-9673(93)80175-8 22. Chen, H. M.; Stubbins, A.; Hatcher, P. G.; Limnol. Oceanogr.: Methods 2011, 9, 582. 23. Josefsson, B. O.; Anal. Chim. Acta 1970, 52, 65. DOI: http://dx.doi.org/10.1016/S0003-2670(01)80042-8 24. Debets, A. J. J.; Kok, W. T.; Hupe, K. P.; Brinkman, U. A. T.; Chromatographia 1990, 30, 361. DOI: http://dx.doi.org/10.1007/BF02328498 25. Okamoto, Y.; Sakamoto, N.; Yamamoto, M.; Kumamaru, T.; J. Chromatogr. 1991, 539, 221. DOI: http://dx.doi.org/10.1016/S0021-9673(01)95378-6 26. Debets, A. J. J.; Hupe, K. P.; Kok, W. T.; Brinkman, U. A. T.; J. Chromatogr. 1992, 600, 163. DOI: http://dx.doi.org/10.1016/0021-9673(92)85544-4 27. Groenewegen, M. G. M.; Vandemerbel, N. C.; Slobodnik, J.; Lingeman, H.; Brinkman, U. A. T.; Analyst 1994, 119, 1753. DOI: http://dx.doi.org/10.1039/an9941901753 28. Novic, M.; Dovzan, A.; Pihlar, B.; Hudnik, V.; J. Chromatogr. A 1995, 704, 530. DOI: http://dx.doi.org/10.1016/0021-9673(95)00105-V 29. Haddad, P. R.; Laksana, S.; J. Chromatogr. A 1994, 671, 131. DOI: http://dx.doi.org/10.1016/0021-9673(94)80231-9 30. Kamphorst, J. J.; Tjaden, U. R.; van der Heijden, R.; DeGroot, J.; van der Greef, J.; Hankemeier, T.; Electrophoresis 2009, 30, 2284. DOI: http://dx.doi.org/10.1002/elps.200800500 PMID: 19569123 31. Buscher, B. A. P.; Hofte, A. J. P.; Tjaden, U. R.; van der Greef, J.; J. Chromatogr. A 1997, 777, 51. DOI: http://dx.doi.org/10.1016/S0021-9673(97)00449-4 32. Buscher, B. A. P.; Tjaden, U. R.; van der Greef, J.; J. Chromatogr. A 1997, 764, 135. DOI: http://dx.doi.org/10.1016/S0021-9673(96)00913-2 33. Thi, K. O. D.; Kuban, P.; Kuban, P.; Kiplagat, I. K.; Bocek, P.; Electrophoresis 2011, 32, 464. DOI: http://dx.doi.org/10.1002/elps.201000423 34. Cox, J. A.; Carlson, R.; Anal. Chim. Acta 1981, 130, 313. DOI: http://dx.doi.org/10.1016/S0003-2670(01)93008-9 35. Himata, K.; Warner, C.; Currie, D.; Graves, Q.; Diachenko, G.; J. AOAC Int. 2005, 88, 794. PMID: 16001854 36. Chon, K.; Lee, Y.; Traber, J.; von Gunten, U.; Water. Res. 2013, 47, 5381. DOI: http://dx.doi.org/10.1016/j.watres.2013.06.019 PMID: 23916154 37. Zhu, A. B.; Chen, B. Y.; Zhang, L.; Westerhoff, P.; Anal. Chem. 2015, 87, 2353. DOI: http://dx.doi.org/10.1021/ac504224r PMID: 25621718 38. Seip, K. F.; Faizi, M.; Vergel, C.; Gjelstad, A.; Pedersen-Bjergaard, S.; Anal. Bioanal. Chem. 2014, 406, 2151. DOI: http://dx.doi.org/10.1007/s00216-013-7418-8 PMID: 24136254 39. Huang, C.; Seip, K. F.; Gjelstad, A.; Pedersen-Bjergaard, S.; J. Pharmaceut. Biomed. 2015, 348, 1127. 40. Petersen, N. J.; Foss, S. T.; Jensen, H.; Hansen, S. H.; Skonberg, C.; Snakenborg, D.; Kutter, J. P.; Pedersen-Bjergaard, S.; Anal. Chem. 2011, 83, 44. DOI: http://dx.doi.org/10.1021/ac1027148 PMID: 21142026 41. Gjelstad, A.; Rasmussen, K. E.; Pedersen-Bjergaard, S.; J. Chromatogr. A 2007, 1174, 104. DOI: http://dx.doi.org/10.1016/j.chroma.2007.08.057 PMID: 17850807 42. Davarani, S. S. H.; Pourahadi, A.; Nojavan, S.; Banitaba, M. H.; Nasiri-Aghdam, M.; Anal. Chim. Acta 2012, 722, 55. DOI: http://dx.doi.org/10.1016/j.aca.2012.02.012 PMID: 22444534 43. Fotouhi, L.; Yamini, Y.; Molaei, S.; Seidi, S.; J. Chromatogr. A 2011, 1218, 8581. DOI: http://dx.doi.org/10.1016/j.chroma.2011.09.078 PMID: 22024341 44. Petersen, J. P.; Asmussen, K. E. ; Bjergaard, S. P.; Gjelstad, A.; Anal. Sci. 2011, 27, 965. DOI: http://dx.doi.org/10.2116/analsci.27.965 PMID: 21985919 45. Davarani, S. S. H.; Morteza-Najarian, A.; Nojavan, S.; Pourahadi, A.; Abbassi, M. B.; J. Sep. Sci. 2013, 36, 736. DOI: http://dx.doi.org/10.1002/jssc.201200838 PMID: 23339011 46. Payan, M. R.; Lopez, M. A. B.; Torres, R. F.; Navarro, M. V.; Mochon, M. C.; Talanta 2011, 85, 394. DOI: http://dx.doi.org/10.1016/j.talanta.2011.03.076 PMID: 21645715 47. Nojavan, S.; Pourahadi, A.; Davarani, S. S. H.; Morteza-Najarian, A.; Abbassi, M. B.; Anal. Chim. Acta 2012, 745, 45. DOI: http://dx.doi.org/10.1016/j.aca.2012.07.044 PMID: 22938605 48. Strieglerova, L.; Kuban, P.; Bocek, P.; J. Chromatogr. A 2011, 1218, 6248. DOI: http://dx.doi.org/10.1016/j.chroma.2011.07.011 PMID: 21824620 49. Hasheminasab, K. S.; Fakhari, A. R.; Anal. Chim. Acta 2013, 767, 75. DOI: http://dx.doi.org/10.1016/j.aca.2012.12.046 PMID: 23452789 50. Balchen, M.; Lund, H.; Reubsaet, L.; Pedersen-Bjergaard, S.; Anal. Chim. Acta 2012, 716, 16. DOI: http://dx.doi.org/10.1016/j.aca.2011.02.058 PMID: 22284872 51. Huang, C.; Gjelstad, A.; Pedersen-Bjergaard, S.; Anal. Chim. Acta 2015, 853, 328. DOI: http://dx.doi.org/10.1016/j.aca.2014.10.017 PMID: 25467476 52. Huang, C.; Gjelstad, A.; Pedersen-Bjergaard, S.; J. Membr. Sci. 2015, 481, 115. DOI: http://dx.doi.org/10.1016/j.memsci.2015.02.006 53. Liu, Y.; Zhang, X.; Guo, L.; Zhang, Y.; Li, Z.; Wang, Z.; Huang, M.; Yang, C.; Ye, J.; Chu, Q.; Talanta 2014, 128, 386. DOI: http://dx.doi.org/10.1016/j.talanta.2014.04.079 PMID: 25059176 54. Safari, M.; Nojavan, S.; Davarani, S. S. H.; Morteza-Najarian, A.; Anal. Chim. Acta 2013, 789, 58. DOI: http://dx.doi.org/10.1016/j.aca.2013.06.023 PMID: 23856230 55. Jamt, R. E. G.; Gjelstad, A.; Eibak, L. E. E.; Øiestad, E. L.; Christophersen, A. S.; Rasmussen, K. E.; Pedersen-Bjergaard, S.; J. Chromatogr. A 2012, 1232, 27. DOI: http://dx.doi.org/10.1016/j.chroma.2011.08.058 PMID: 21899849 56. Hasheminasab, K. S.; Fakhari, A. R.; Shahsavani, A.; Ahmar, H.; J. Chromatogr. A 2013, 1285, 1. DOI: http://dx.doi.org/10.1016/j.chroma.2013.01.115 PMID: 23473518 57. Balchen, M.; Halvorsen, T. G.; Reubsaet, L.; Pedersen-Bjergaard, S.; J. Chromatogr. A 2009, 1216, 6900. DOI: http://dx.doi.org/10.1016/j.chroma.2009.08.037 PMID: 19720379 58. Davarani, S. S. H.; Najarian, A. M.; Nojavan, S.; Tabatabaei, M. A.; Anal. Chim. Acta 2012, 725, 51. DOI: http://dx.doi.org/10.1016/j.aca.2012.02.048 PMID: 22502611 59. Huang, C.; Eibak, L. E. E.; Gjelstad, A.; Shen, X.; Trones, R.; Jensen, H.; Pedersen-Bjergaard, S.; J. Chromatogr. A 2014, 1326, 7. DOI: http://dx.doi.org/10.1016/j.chroma.2013.12.028 PMID: 24377737 60. Hasheminasab, K. S.; Fakhari, A. R.; J. Chromatogr. A 2015, 1378, 1. DOI: http://dx.doi.org/10.1016/j.chroma.2014.11.061 PMID: 25560453 61. Basheer, C.; Lee, J.; Pedersen-Bjergaard, S.; Rasmussen, K. E.; Lee, H. K.; J. Chromatogr. A 2010, 1217, 6661. DOI: http://dx.doi.org/10.1016/j.chroma.2010.04.066 PMID: 20488447 62. Eibak, L. E. E.; Rasmussen, K. E.; Øiestad, E. L.; Pedersen-Bjergaard, S.; Gjelstad, A.; Anal. Chim. Acta 2014, 828, 48. DOI: http://dx.doi.org/10.1016/j.aca.2014.04.038 63. Ramos-payán, M.; Fernández-torres, R.; Pérez-bernal, J. L.; Callejón-mochón, M.; Bello-lópez, M. Á.; Anal. Chim. Acta 2014, 849, 7. DOI: http://dx.doi.org/10.1016/j.aca.2014.08.020 PMID: 25300211 64. Hidalgo, C. R.; Ramos-Payán, M.; Ocaña-González, J. A.; Martín-Valero, M. J.; Bello-López, M. Á.; Anal. Bioanal. Chem. 2014, 407, 1519. DOI: http://dx.doi.org/10.1007/s00216-014-8375-6 PMID: 25519723 65. Hasheminasab, K. S.; Fakhari, A. R.; Koruni, M. H.; J. Sep. Sci. 2014, 37, 85. DOI: http://dx.doi.org/10.1002/jssc.201300480 PMID: 24243888 66. Sun, J.-n.; Chen, J.; Shi, Y.-p.; J. Chromatogr. A 2014, 1352, 1. DOI: http://dx.doi.org/10.1016/j.chroma.2014.11.008 PMID: 24925450 67. Rezazadeh, M.; Yamini, Y.; Seidi, S.; Esrafili, A.; J. Chromatogr. A 2012, 1262, 214. DOI: http://dx.doi.org/10.1016/j.chroma.2012.08.090 PMID: 22999198 68. Rezazadeh, M.; Yamini, Y.; Seidi, S.; Aghaei, A.; Talanta 2015, 136, 190. DOI: http://dx.doi.org/10.1016/j.talanta.2015.01.007 PMID: 25703002 69. Khajeh, M.; Pedersen-Bjergaard, S.; Barkhordar, A.; Bohlooli, M.; Spectrochim. Acta, Part A 2015, 137, 328. DOI: http://dx.doi.org/10.1016/j.saa.2014.08.103 70. Asl, Y. A.; Yamini, Y.; Rezazadeh, M.; Seidi, S.; Anal. Methods 2015, 7, 197. DOI: http://dx.doi.org/10.1039/C4AY02327G 71. Šlampová, A.; Kubáň, P.; Boček, P.; Electrophoresis 2014, 35, 3317. DOI: http://dx.doi.org/10.1002/elps.201400372 PMID: 25224742 72. Šlampová, A.; Kubáň, P.; Boček, P.; Electrophoresis 2014, 35, 2429. DOI: http://dx.doi.org/10.1002/elps.201400096 PMID: 24789309 73. Yamini, Y.; Pourali, A.; Seidi, S.; Rezazadeh, M.; Anal. Methods 2014, 6, 5554. DOI: http://dx.doi.org/10.1039/C4AY00480A 74. Arjomandi-Behzad, L.; Yamini, Y.; Rezazadeh, M.; Talanta 2014, 126, 73. DOI: http://dx.doi.org/10.1016/j.talanta.2014.02.066 PMID: 24881536 75. Seip, K. F.; Jensen, H.; Kieu, T. E.; Gjelstad, A.; Pedersen-Bjergaard, S.; J. Chromatogr. A 2014, 1347, 1. DOI: http://dx.doi.org/10.1016/j.chroma.2014.04.053 PMID: 24792700 76. Ahmar, H.; Tabani, H.; Hossein Koruni, M.; Davarani, S. S. H.; Fakhari, A. R.; Biosens. Bioelectron. 2014, 54, 189. DOI: http://dx.doi.org/10.1016/j.bios.2013.10.035 PMID: 24280048 77. Fakhari, A. R.; Koruni, M. H.; Ahmar, H.; Shahsavani, A.; Movahed, S. K.; Electroanalysis 2014, 26, 521. DOI: http://dx.doi.org/10.1002/elan.201300323 78. Dugstad, H. B.; Petersen, N. J.; Jensen, H.; Gabel-Jensen, C.; Honoré Hansen, S.; Pedersen-Bjergaard, S.; Anal. Bioanal. Chem. 2014, 406, 421. DOI: http://dx.doi.org/10.1007/s00216-013-7378-z PMID: 24196121 79. Eibak, L. E. E.; Parmer, M. P.; Rasmussen, K. E.; Pedersen-Bjergaard, S.; Gjelstad, A.; Anal. Bioanal. Chem. 2014, 406, 431. DOI: http://dx.doi.org/10.1007/s00216-013-7345-8 PMID: 24068169 80. Marando, M. A.; Clark, W. M.; Sep. Sci. Technol. 1993, 28, 1561. DOI: http://dx.doi.org/10.1080/01496399308018058 81. Clark, W. M.; CHEMTECH 1992, 22, 425. 82. Bailes, P. J.; Ind. Eng. Chem. Process Des. Dev. 1981, 20, 564. DOI: http://dx.doi.org/10.1021/i200014a030 83. Austin, L. J.; Banczyk, L.; Sawistowski, H.; Chem. Eng. Sci. 1971, 26, 2120. DOI: http://dx.doi.org/10.1016/0009-2509(71)80050-7 84. Hahn, T.; Münchow, G.; Hardt, S.; J. Phys.: Condens. Matter 2011, 23, 279502. 85. He, W.; Bazrd, M. H. I.; Can. J. Chem. Eng. 1993, 71, 366. DOI: http://dx.doi.org/10.1002/cjce.5450710305 86. Luo, G. S.; Jiang, W. B.; Lu, Y. C.; Zhu, S. L.; Dai, Y. Y.; Chem. Eng. J. 1999, 73, 137. DOI: http://dx.doi.org/10.1016/S1385-8947(99)00033-9 87. Pan, S.; Luo, G. S.; Liu, J. G.; Wang, J. D.; Sep. Sci. Technol. 2003, 38, 3731. DOI: http://dx.doi.org/10.1081/SS-120024226 88. Zhai, S. L.; Luo, G. S.; Liu, J. G.; Chem. Eng. J. 2001, 83, 55. DOI: http://dx.doi.org/10.1016/S1385-8947(00)00239-4 89. Campos, C. D. M.; Park, J. K.; Neuzil, P.; da Silva, J. A. F.; Manz, A.; Rsc. Adv. 2014, 4, 49485. DOI: http://dx.doi.org/10.1039/C4RA09246E 90. Willauer, H. D.; Huddleston, J. G.; Rogers, R. D.; Ind. Eng. Chem. Res. 2002, 41, 1892. DOI: http://dx.doi.org/10.1021/ie010598z 91. Rosa, P. A. J.; Ferreira, I. F.; Azevedo, A. M.; Aires-Barros, M. R.; J. Chromatogr. A 2010, 1217, 2296. DOI: http://dx.doi.org/10.1016/j.chroma.2009.11.034 PMID: 19962707 92. Xie, X.; Wang, Y.; Han, J.; Yan, Y.; Anal. Chim. Acta 2011, 687, 61. DOI: http://dx.doi.org/10.1016/j.aca.2010.12.012 PMID: 21241847 93. Simeone, M.; Alfani, A.; Guido, S.; Food Hydrocolloids 2004, 18, 463. DOI: http://dx.doi.org/10.1016/j.foodhyd.2003.08.004 94. Babu, B. R.; Rastogi, N. K.; Raghavarao, K. S. M. S.; Chem. Eng. Process. 2008, 47, 83. DOI: http://dx.doi.org/10.1016/j.cep.2007.08.006 95. Zhai, S. L.; Luo, G. S.; Liu, J. G.; Sep. Purif. Technol. 2001, 21, 197. DOI: http://dx.doi.org/10.1016/S1383-5866(00)00193-3 96. Münchow, G.; Hardt, S.; Kutter, J. P.; Drese, K. S.; Lab Chip 2007, 7, 98. DOI: http://dx.doi.org/10.1039/B612669N PMID: 17180211 97. Ferreira, L.; Madeira, P. P.; Mikheeva, L.; Uversky, V. N.; Zaslavsky, B.; Biochim. Biophys. Acta 2013, 1834, 2859. DOI: http://dx.doi.org/10.1016/j.bbapap.2013.07.014 PMID: 23920121 98. Weatherley, L. R.; Heat Recovery Syst. CHP 1993, 13, 515. DOI: http://dx.doi.org/10.1016/0890-4332(93)90004-F 99. Scott, T. C.; Wham, R. M.; Ind. Eng. Chem. Res. 1989, 28, 94. DOI: http://dx.doi.org/10.1021/ie00085a016 100. Glitzenstein, A.; Tamir, A.; Oren, Y.; Can. J. Chem. Eng. 1995, 73, 95. DOI: http://dx.doi.org/10.1139/v95-014 101. Theos, C. W.; Clark, W. M.; Appl. Biochem. Biotechnol. 1995, 54, 143. DOI: http://dx.doi.org/10.1007/BF02787916 102. van der Vlis, E.; Mazereeuw, M.; Tjaden, U. R.; Irth, H.; van der Greef, J.; J. Chromatogr. A 1994, 687, 333. DOI: http://dx.doi.org/10.1016/0021-9673(94)00776-4 103. van der Vlis, E.; Mazereeuw, M.; Tjaden, U. R.; Irth, H.; van der Greef, J.; J. Chromatogr. A 1995, 712, 227. DOI: http://dx.doi.org/10.1016/0021-9673(95)00366-U 104. van der Vlis, E.; Mazereeuw, M.; Tjaden, U. R.; Irth, H.; van der Greef, J.; J. Chromatogr. A 1996, 741, 13. DOI: http://dx.doi.org/10.1016/0021-9673(96)84622-X 105. Lindenburg, P. W.; Seitzinger, R.; Tempels, F. W. A.; Tjaden, U. R.; van der Greef, J.; Hankemeier, T.; Electrophoresis 2010, 31, 3903. DOI: http://dx.doi.org/10.1002/elps.201000347 PMID: 21064141 106. Lindenburg, P. W.; Tjaden, U. R.; van der Greef, J.; Hankemeier, T.; Electrophoresis 2012, 33, 2987. DOI: http://dx.doi.org/10.1002/elps.201200276 PMID: 23001993 107. Lindenburg, P. W.; Ramautar, R.; Hankemeier, T.; Bioanalysis 2013, 5, 2785. DOI: http://dx.doi.org/10.4155/bio.13.254 PMID: 24256359 108. Lindenburg, P. W.; Tempels, F. W. A.; Tjaden, U. R.; van der Greef, J.; Hankemeier, T.; J. Chromatogr. A 2012, 1249, 17. DOI: http://dx.doi.org/10.1016/j.chroma.2012.06.016 PMID: 22749583 109. Lanças, F. M.; Extração em Fase Sólida (SPE); RiMa: São Carlos, 2004. 110. Orlando, R. M.; Tese de Doutorado, Universidade Estadual de Campinas, Brasil, 2011. 111. Orlando, R. M.; Rath, S.; Rohwedder, J. J. R.; Talanta 2013, 116, 39. DOI: http://dx.doi.org/10.1016/j.talanta.2013.04.077 PMID: 24148370 112. Orlando, R. M.; Rohwedder, J. J. R.; Rath, S.; Chromatographia 2014, 77, 133. DOI: http://dx.doi.org/10.1007/s10337-013-2565-9 113. Tavares, M. F. M.; Quim. Nova 1996, 19, 173. 114. Nischang, I.; Spannmann, K.; Tallarek, U.; Anal. Chem. 2006, 78, 3601. DOI: http://dx.doi.org/10.1021/ac052133e PMID: 16737213 115. Snyder, L. R.; Kirkland, J. J.; Glajch, J. L.; Practical HPLC method development; 2nd ed., Wiley: New York, 1997. 116. Orlando, R. M.; Rath, S. Br PI 0703755-4, 2007. 117. Morales-Cid, G.; Simonet, B. M.; Cardenas, S.; Valcarcel, M.; Electrophoresis 2008, 29, 2033. DOI: http://dx.doi.org/10.1002/elps.200700565 PMID: 18409165 118. Ribeiro, C. C.; Tese de Doutorado, Universidade Estadual de Campinas, Brasil, 2014. 119. Orlando, R. M.; Maniero, L.; Rath, S. Br PI 102014 024585-5, 2014. 120. Manz, A.; Graber, N.; Widmer, H. M.; Sens. Actuators, B 1990, 1, 244. DOI: http://dx.doi.org/10.1016/0925-4005(90)80209-I 121. Whitesides, G. M.; Nature 2006, 442, 368. DOI: http://dx.doi.org/10.1038/nature05058 PMID: 16871203 122. Whitesides, G. M.; Lab Chip 2011, 11, 191. DOI: http://dx.doi.org/10.1039/C0LC90101F PMID: 21152593 123. Tabeling, P.; Curr. Opin. Biotechnol. 2014, 25, 129. DOI: http://dx.doi.org/10.1016/j.copbio.2013.11.009 PMID: 24484891 124. Sinton, D.; Lab Chip 2014, 14, 3127. DOI: http://dx.doi.org/10.1039/C4LC00267A PMID: 24820226 125. Temiz, Y.; Lovchik, R. D.; Kaigala, G. V.; Delamarche, E.; Microelectron. Eng. 2015, 132, 156. DOI: http://dx.doi.org/10.1016/j.mee.2014.10.013 126. Rios, A.; Zougagh, M.; Avila, M.; Anal. Chim. Acta 2012, 740, 1. DOI: http://dx.doi.org/10.1016/j.aca.2011.10.020 PMID: 22840644 127. Rios, A.; Zougagh, M.; TrAC, Trends Anal. Chem. 2013, 43, 174. DOI: http://dx.doi.org/10.1016/j.trac.2012.12.009 128. Coltro, W. K. T.; Cheng, C. M.; Carrilho, E.; de Jesus, D. P.; Electrophoresis 2014, 35, 2309. DOI: http://dx.doi.org/10.1002/elps.201400006 129. Coltro, W. K. T.; Piccin, E.; Carrilho, E.; de Jesus, D. P.; Fracassi da Silva, J. A.; Torres da Silva, H. D.; do Lago, C. L.; Quim. Nova 2007, 30, 1986. DOI: http://dx.doi.org/10.1590/S0100-40422007000800034 130. Tabeling, P.; Introduction to Microfluidics; Oxford Press: New York, 2005. 131. Oleschuk, R. D.; Shultz-Lockyear, L. L.; Ning, Y.; Harrison, D. J.; Anal. Chem. 2000, 72, 585. DOI: http://dx.doi.org/10.1021/ac990751n PMID: 10695146 132. Kim, Y.; Cha, M.; Choi, Y.; Joo, H.; Lee, J.; Chem. Phys. Lett. 2013, 561, 63. DOI: http://dx.doi.org/10.1016/j.cplett.2013.04.047 133. Ren, K. N.; Zhou, J. H.; Wu, H. K.; Acc. Chem. Res. 2013, 46, 2396. DOI: http://dx.doi.org/10.1021/ar300314s PMID: 24245999 134. Becker, H.; Gartner, C.; Anal. Bioanal. Chem. 2008, 390, 89. DOI: http://dx.doi.org/10.1007/s00216-007-1692-2 PMID: 17989961 135. Lee, J. N.; Park, C.; Whitesides, G. M.; Anal. Chem. 2003, 75, 6544. DOI: http://dx.doi.org/10.1021/ac0346712 PMID: 14640726 136. Ramsey, J. D.; Collins, G. E.; Anal. Chem. 2005, 77, 6664. DOI: http://dx.doi.org/10.1021/ac0507789 PMID: 16223254 137. Kutter, J. r. P.; Jacobson, S. C.; Ramsey, J. M.; J. Microcolumn Sep. 2000, 12, 93. DOI: http://dx.doi.org/10.1002/(SICI)1520-667X(2000)12:2<93::AID-MCS5>3.3.CO;2-G 138. Hahn, T.; Münchow, G.; Hardt, S.; J. Phys. Condens. Matter 2011, 23, 184107. DOI: http://dx.doi.org/10.1088/0953-8984/23/18/184107 PMID: 21508474 139. Hahn, T.; Hardt, S.; Soft Matter 2011, 7, 6320. DOI: http://dx.doi.org/10.1039/c1sm05309d 140. Hardt, S.; Hahn, T.; Lab Chip 2012, 12, 434. DOI: http://dx.doi.org/10.1039/C1LC20569B PMID: 21897979 141. Kerby, M. B.; Spaid, M.; Wu, S.; Parce, J. W.; Chien, R.-L.; Anal. Chem. 2002, 74, 5175. DOI: http://dx.doi.org/10.1021/ac0258103 PMID: 12403568 142. Shin, D. H.; Kim, J.-E.; Shim, H. C.; Song, J.-W.; Yoon, J.-H.; Kim, J.; Jeong, S.; Kang, J.; Baik, S.; Han, C.-S.; Nano Lett. 2008, 8, 4380. DOI: http://dx.doi.org/10.1021/nl802237m PMID: 19367931 143. Münchow, G.; Hardt, S.; Kutter, J. P.; Drese, K. S.; JALA 2006, 11, 368. 144. Schoonen, J. W.; van Duinen, V.; Oedit, A.; Vulto, P.; Hankemeier, T.; Lindenburg, P. W.; Anal. Chem. 2014, 86, 8048. DOI: http://dx.doi.org/10.1021/ac500707v PMID: 24892382 145. Kubáň, P.; Boček, P.; J. Chromatogr. A 2012, 1234, 2. DOI: http://dx.doi.org/10.1016/j.chroma.2011.10.046 PMID: 22055521 146. Petersen, N. J.; Jensen, H.; Hansen, S. H.; Foss, S. T.; Snakenborg, D.; Pedersen-Bjergaard, S.; Microfluid. Nanofluid. 2010, 9, 881. DOI: http://dx.doi.org/10.1007/s10404-010-0603-6 147. Petersen, N. J.; Foss, S. T.; Jensen, H.; Hansen, S. H.; Skonberg, C.; Snakenborg, D.; Kutter, J. P.; Pedersen-Bjergaard, S.; Anal. Chem. 2011, 83, 44. DOI: http://dx.doi.org/10.1021/ac1027148 PMID: 21142026 148. Petersen, N. J.; Pedersen, J. S.; Poulsen, N. N.; Jensen, H.; Skonberg, C.; Hansen, S. H.; Pedersen-Bjergaard, S.; Analyst 2012, 137, 3321. DOI: http://dx.doi.org/10.1039/c2an35264h PMID: 22679624 149. Seidi, S.; Rezazadeh, M.; Yamini, Y.; Zamani, N.; Esmaili, S.; Analyst 2014, 139, 5531. DOI: http://dx.doi.org/10.1039/C4AN01124D PMID: 25198358 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access