Artigo
|
|
| Caracterização e avaliação in vitro de nanocompósitos de poli (L-ácido lático) e nanotubos de carbono de paredes múltiplas purificados Characterization and in vitro evaluation of poly (L-lactic acid) and purified multiwalled carbon nanotubes nanocomposites |
|
Claudenete Vieira LealI,*; Diego Stéfani Teodoro MartinezII,III; Andréa Rodrigues EspósitoI; Bruna Antunes MásI,IV; Ana Carolina Mazarin MoraesII; Oswaldo Luiz AlvesII; Eliana Aparecida Rezende de DuekI,IV
IDepartamento de Engenharia de Materiais, Faculdade de Engenharia Mecânica, Universidade Estadual de Campinas, Campinas - SP, Brasil Recebido em 20/03/2015 *e-mail: claudi@fem.unicamp.br Carbon nanotubes (CNT) have been studied for biomedical applications due to their unique properties. However, pristine CNT have structural features and impurities that can cause toxicity to biological systems. In this work, we describe a method to purify multiwalled carbon nanotubes (MWCNT) by chemical modification and subsequent attachment of hydroxyl and carboxyl groups to improve dispersion and to decrease toxic effects. Nanocomposites from poly (L-lactic acid) (PLLA) and nanotubes were produced by the solvent casting method and characterized and evaluated for cytocompatibility with Vero cells. The nanocomposite interactions with Vero cells demonstrated that the cells were able to adhere and sustain proliferation and showed favorable cytocompatibility. In vitro studies also revealed an increase in fibroblast cell viability in the nanocomposites, compared with neat PLLA. INTRODUÇÃO Nanocompósitos poliméricos são materiais promissores para aplicações na área biomédica. São formados por um nanomaterial disperso em uma matriz polimérica e podem unir as propriedades dos dois componentes resultando em um material com propriedades mecânicas e funcionais superiores. Os nanomateriais apresentam uma grande área superficial, resultando em um volume maior de interface no nanocompósito quando comparado aos compósitos tradicionais, pois a interface de um compósito é que controla o grau de interação entre os componentes e também controla as propriedades finais do material.1 Os nanotubos de carbono (NTC) são nanomateriais muito pesquisados para aplicações em várias áreas, incluindo a área biomédica. Eles são formados por arranjos hexagonais de carbono que originam pequenos cilindros. Geralmente possuem uma faixa de diâmetros de poucos angstroms a dezenas de nanômetros e podem ter comprimento em centímetros.2 Os NTC podem ser divididos em nanotubos de carbono de parede simples (NTCPS), que são descritos como uma única folha de grafeno enrolada sobre si mesma formando um tubo cilíndrico e nanotubos de carbono de paredes múltiplas (NTCPM), que consiste em duas ou mais camadas cilíndricas concêntricas de folhas de grafeno arranjadas coaxialmente ao redor de um canal central3 Os NTC se aglomeram devido às forças de Van der Walls entre os nanotubos, tornando-os extremamente difíceis de dispersar em meio aquoso, solventes orgânicos e em matrizes poliméricas. A funcionalização dos NTC é uma forma efetiva de prevenir a agregação dos nanotubos, melhorando a dispersão e a estabilização dos NTC na matriz polimérica,4 além de reforçar a transferência de carga na interface matriz polimérica/NTC. Grupos funcionais contendo oxigênio (e.g. -COOH, -OH, =O, etc) são gerados na superfície dos NTC durante processos de oxidação utilizando ácidos inorgânicos (e.g. ácido sulfúrico, ácido nítrico, peróxido de hidrogênio e mistura destes ácidos).5,6 Estes grupos favorecem a dispersão dos nanotubos em meio aquoso, solventes e interação com polímeros. Adicionalmente, tratamentos químicos de nanotubos com ácidos inorgânicos favorecem a eliminação de resíduos metálicos (catalisadores), aumentando, assim, a pureza dos NTC. Todavia, resíduos carbonáceos (oxidation debris) podem ser gerados durante estes tratamentos oxidativos como consequência da degradação dos nanotubos.7 Os NTC podem ser materiais ideais para o desenvolvimento de novos biomateriais e geram expectativas pela introdução como reforço em arcabouços para engenharia tecidual. Um grande número de investigações tem sido conduzido sobre os NTC para produção de nanocompósitos, sendo avaliado diferentes concentrações de nanotubos, métodos de purificação e funcionalização e interações com vários tipos de células. Os resultados relatados na literatura apresentam grandes divergências em suas conclusões, enfatizando, em muitos casos, o efeito positivo da funcionalização dos NTC que induz uma adequada dispersão no ambiente biológico.8-12 As características dos NTC, como alta resistência mecânica e condutividade elétrica, fazem com que os nanocompósitos adquiram novas propriedades que podem ser aplicadas em engenharia tecidual, sensores, liberação controlada de fármacos, medicina regenerativa e dispositivos como pinos e parafusos em próteses.13-16 O poli (L-ácido lático) (PLLA) é um polímero biorreabsorvível, pertence à classe dos poliésteres alifáticos e sofre degradação hidrolítica via mecanismo de erosão em massa pela cisão aleatória das ligações éster. Degrada-se em ácido lático no corpo humano, produzindo água e dióxido de carbono via ciclo do ácido cítrico.17,18 É considerado um biomaterial para aplicações de suporte de carga, como dispositivo de fixação ortopédica e também em aplicações para suturas e em reparo de menisco.19 O PLLA, devido ao seu caráter hidrofóbico, possui um tempo longo de degradação, acima de 24 meses,19 entretanto, apresenta uma perda acentuada de propriedades mecânicas nas primeiras semanas de degradação.20 Por essa razão, a presença de um nanomaterial como reforço pode manter a integridade mecânica do polímero por mais tempo durante o processo de degradação e reabsorção. O objetivo deste trabalho foi a funcionalização e purificação dos nanotubos de carbono de paredes múltiplas (NTCPM) e posterior preparo de nanocompósitos de matriz de PLLA contendo NTCPM funcionalizados e purificados. Os nanocompósitos foram caracterizados e foram realizados testes biológicos de adesão e crescimento celular para avaliar a biocompatibilidade dos nanocompósitos e a eficiência do processo de purificação e funcionalização dos NTCPM.
PARTE EXPERIMENTAL Purificação dos nanotubos de carbono de paredes múltiplas Para esse trabalho foram utilizados nanotubos de carbono de parede múltiplas sintetizados pelo método de CVD e adquiridos comercialmente da empresa CNT Co. Ltd (Incheon, Coréia). Os NTCPM foram submetidos a três tratamentos químicos visando sua purificação e funcionalização, de acordo com experiência prévia dos trabalhos realizados no Laboratório de Química do Estado Sólido (LQES) do Instituto de Química da UNICAMP.7,21 Inicialmente, 1,0 g dos nanotubos foram dispersos em uma solução de HNO3 9 mol L-1 (200 mL) por 5 minutos em banho de ultrassom (Cole-Parmer 8891), e então colocados sob agitação e refluxo convencional por 3 horas a 150 ºC. Após o resfriamento, os nanotubos oxidados foram lavados com água deionizada até pH 6,0, utilizando sistema de microfiltração da Millipore® (membrana de PTFE 0,2 µm). Em seguida, os nanotubos oxidados foram submetidos ao tratamento com 200 mL de NaOH 0,1 mol L-1 (15 minutos em ultrassom de banho, seguido de 1 hora sob agitação magnética em temperatura ambiente) para remoção dos fragmentos de carbono carboxilados (oxidation debris). Após este tratamento com NaOH os nanotubos foram separados desta solução por meio de microfiltração e lavados com água deionizada até pH 6,0. Finalmente, os nanotubos foram submetidos ao tratamento com 200 mL de HCl 5 mol L-1 por 6 horas a 110 ºC sob agitação e refluxo convencional. Após o resfriamento, os nanotubos modificados (funcionalizados e purificados) foram lavados com água deionizada até pH 6,0, utilizando sistema de microfiltração, secos, utilizando sistema de vácuo, e armazenados em dessecadores em temperatura ambiente. Esta amostra foi denominada p-NTCPM (nanotubos de carbono paredes múltiplas purificados). Caracterização dos Nanotubos de Carbono de Paredes Múltiplas Purificados (p-NTCPM) Os p-NTCPM foram caracterizados utilizando as técnicas de microscopia eletrônica de transmissão (MET), Libra-120, Carl Zeiss e microscopia eletrônica de varredura por emissão de campo (FEG-MEV), Quanta 650, FEI. A área superficial dos p-NTCPM foi determinada por isotermas de adsorção de N2 pelo método BET no equipamento ASAP 2010 da Micromeritics Instruments. Análise de carga superficial (potencial-zeta) foi determinada utilizando o equipamento Zetasizer nano-ZS da Malvern Instruments. A temperatura de decomposição dos p-NTCPM foi determinada por análise termogravimétrica (TGA) em atmosfera de ar sintético com o equipamento STD600 da TA Instruments. Análise elementar qualitativa foi realizada utilizando a técnica de espectroscopia por energia dispersiva de raios-X (EDS) no MEV 660-LV da JEOL. O teor de resíduos metálicos final na amostra p-NTCPM foi estimado utilizando microbalança analítica AD-6 da Perkin-Elmer. Os grupamentos oxigenados superficiais foram quantificados por meio de espectroscopia de fóton elétrons excitados por raios-X (XPS) no equipamento K-alpha da Thermo. Para avaliação do comprimento, os p-NTCPM foram dispersos em água deionizada em banho ultrasom por 5 minutos (Cole-Parmer 8891). Foram retirados 100 µL dessa dispersão e adicionado 900 µL de álcool isopropílico e novamente dispersos por 5 minutos em banho ultrasom. A partir dessa dispersão, foi retirada uma alíquota de 2 µL e colocados sobre uma superfície silício. Os p-NTCPM foram observados por MEV (EVO MA15 - Zeiss). Foram realizadas 100 medidas aleatórias de diferentes nanotubos utilizando-se programa de análise de imagens Olympius Scandium para determinação do comprimento. Preparo das membranas de nanocompósitos poliméricos Os nanocompósitos foram obtidos pelo método de evaporação de solvente à temperatura de 25 ºC nas concentrações de 0,25 e 0,5% de p-NTCPM. O PLLA utilizado nesse trabalho foi sintetizado a partir da reação do diéster cíclico do L-ácido lático e foi conduzida pela polimerização em massa, utilizando como catalisador o 2-etil-hexanoato de estanho, conhecido como Sn(Oct)2. O PLLA apresentou massa molar média (Mw) de 150.000 g mol-1.17 Para a obtenção dos nanocompósitos, o PLLA foi dissolvido em clorofórmio (Merck, Alemanha) na concentração de 5% (m/v) e mantido em agitação por 2 horas para dissolução completa do polímero. Paralelamente foram preparadas soluções nas concentrações de 0,25 e 0,5% de p-NTCPM em clorofórmio. Essas soluções foram colocadas em ultrassom de ponta Hielscher UPS 200S para dispersão dos p-NTCPM. A solução dispersa de p-NTCPM foi misturada à solução de PLLA dissolvida e colocada em agitador magnético para homogeneização. A solução polímero/p-NTCPM foi vertida em molde de vidro dentro de uma cuba de vidro para evaporação do solvente e obtenção das membranas. Para comparação foram preparadas membranas de PLLA sem p-NTCPM. Caracterização dos nanocompósitos PLLA/p-NTCPM A morfologia da superfície de fratura do PLLA e nanocompósitos foi analisada em um microscópio eletrônico de varredura (MEV) Zeiss, modelo EVO MA15 em 10 kV. As fraturas dos polímeros foram obtidas após congelamento em nitrogênio líquido. A análise de Calorimetria Exploratória Diferencial (DSC) foi realizada em um equipamento marca Netzsch, modelo DSC 200 F3 Maia. As amostras foram submetidas a um aquecimento de 25 a 200 ºC e mantidas por 5 minutos nessa temperatura. Posteriormente foi realizado um resfriamento até -20 ºC, temperatura mantida por 5 minutos, e aquecimento até 200 ºC. Todos os seguimentos foram realizados com taxa de 10 ºC min-1. Ensaios in vitro de adesão e proliferação celular Para o estudo in vitro foi realizada cultura de células Vero provenientes do rim de Macaco Verde africano (Cercopithecus aethiops), obtidas no Instituto Adolfo Lutz, São Paulo, Brasil. Estas células consistem em uma linhagem celular padrão de fibroblastos usada em um amplo espectro de investigação industriais e aplicações biomédicas para estudo de funções celulares básicas importantes, recomendadas para estudos de citotoxicidade e para interações célula-substrato com biomateriais.22-25 Em todos os ensaios as amostras foram pré-incubadas a 37 ºC e 5% de CO2 por 24 horas, conforme ISO 10993-5 (1992),23 recebendo 100 µL de Meio Eagle Modificado por Dulbecco (DMEM) sem soro fetal bovino (SFB). Para o ensaio de adesão celular foi utilizado uma modificação do método descrito por Mosmann.25 As membranas foram colocadas no fundo de placas de cultura com 96 poços (TPP®). Em conjunto com as membranas, a própria placa de polipropileno foi utilizada como controle positivo e fenol (1%) como controle negativo (n = 6). Os poços foram semeados com aproximadamente 105 células mL-1 em meio DMEM com 10% de SFB. A placa foi incubada por 24 horas em estufa de CO2 a 37 ºC. Após a incubação, o meio foi retirado e os poços lavados rapidamente com o mesmo meio. Posterior a lavagem, adicionou-se a cada poço 100 µL de meio fresco sem SFB e 50 µL de meio contendo brometo de 3-(4,5-dimetiltiazol-2-il)-2,5 difenil tetrazolium MTT (5 mg mL-1), seguindo-se um período de incubação de 4 horas a 37 ºC no escuro. Após esse tempo, os 150 µL contendo MTT foram substituídos por uma solução de 100 µL de dimetilsulfóxido (DMSO). Em seguida, 100 µL das soluções contidas nos poços foram transferidas para uma nova placa e a absorbância do MTT foi lida em leitor de microplacas BioTek®, Elx 800, USA, com emprego de comprimento de onda de 570 nm. Foram realizadas análises estatísticas ANOVA e teste de Tukey (p<0,01). As mitocôndrias de células vivas, por meio da enzima succinato de hidrogenase, são capazes de reduzir a substância amarelada solúvel em água MTT convertendo-a em um composto insolúvel em água, o formazan, o qual é solubilizado pelo DMSO. A quantidade de formazan produzida, medida por espectrofotometria, é diretamente proporcional à atividade metabólica e ao número de células vivas. Para o estudo de proliferação celular foi utilizado um kit de quantificação de dsDNA PicoGreen (Molecular Probes®, Eugene, OR) para mensurar o montante de dsDNA presente nos lisados celulares depois de 48 horas, 5 e 10 dias de cultivo sobre as membranas de PLLA e nanocompósitos. Uma densidade de aproximadamente 105 células mL-1 foi diretamente semeada sobre as membranas (n=6), contendo o meio de cultura DMEM, suplementado com 10% SFB. As placas foram incubadas a 37 ºC em atmosfera saturada de vapor d'água e 5% de CO2. Após 48 horas, 5 e 10 dias, as amostras foram lavadas com tampão PBS (3x) e congeladas em 150 µL de Tampão TE (200 mmol L-1 Tris-HCl, 20 mmol L-1 EDTA). As amostras foram congeladas a -20 ºC e descongeladas a 37 ºC em três ciclos de 20 minutos, e submetidas a ultrassom por 5 minutos cada. Posteriormente, 100 µL da solução de PicoGreen foram adicionados a 100 µL de cada amostra e foram aguardados 5 minutos para a leitura. A fluorescência foi medida em um espectrofluorímetro de microplacas (LS 55, Perking Elmer®) com comprimentos de onda de emissão e excitação de 480 e 520 nm respectivamente. Para a determinação do número de células uma curva de calibração foi calculada a partir de cinco pontos contendo concentrações conhecidas de DNA padrão, por meio da equação: y = 0,1231x + 2,3977, conforme recomendado pelo protocolo do fabricante (Invitrogen®) (Figura 1S - material suplementar). A partir da curva de calibração (R² = 0,99982), a fluorescência encontrada e representativa da concentração de DNA celular total dos poços de cultivo foi convertida em concentração celular e expressa em número de células. Esta foi calculada assumindo-se a concentração DNA/células igual 7,7 pg.26 As médias dos valores das concentrações celulares presente nas membranas foram submetidas à análise de variância e teste de Turkey com nível de significância de p<0,01.
RESULTADOS E DISCUSSÃO Caracterização dos nanotubos de carbono de paredes múltiplos purificados (p-NTCPM) O desenvolvimento de uma integrada caracterização físico-química de nanotubos de carbono (e.g. tamanho e morfologia, pureza, carga superficial, área superficial, etc) é fundamental para avaliação da toxicidade e suas aplicações biomédicas.27 Nesse sentido, os principais resultados obtidos na caracterização físico-química do p-NTCPM utilizado neste trabalho estão apresentados na Tabela 1.
Os gráficos relativos à análise de TGA podem ser visualizados no material suplementar (Figuras 2SA e 2SB). As Figuras 1 e 2 são imagens de microscopia eletrônica de varredura (FEG-MEV) e microscopia eletrônica de transmissão (MET) que foram realizadas para estimar a morfologia e distribuição de diâmetro dos p-NTCPM, respectivamente.
 Figura 1. Imagens de microscopia eletrônica de varredura (FEG-MEV) dos p-NTCPM
 Figura 2. Imagens de microscopia eletrônica de transmissao (TEM) dos p-NTCPM
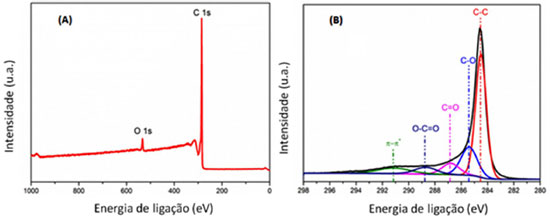
A composição química da superfície do p-NTCPM foi investigada por meio de análises de espectroscopia XPS, nas quais o espectro survey dos nanotubos exibiu linhas em energias de ligação 285,1 e 533,2 eV, as quais correspondem aos picos C1s e O1s, respectivamente (Figura 3A).
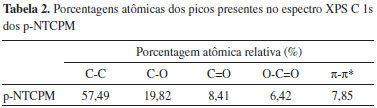
O espectro de alta resolução C1s dos p-NTCPM mostra a presença dos diferentes grupos funcionais. A deconvolução espectral do sinal C1s (Figura 3B) indica cinco picos correspondentes às ligações C-C (C sp2 e Csp3, 285,5 eV), C-O (grupos hidroxila, 285,4 eV), C=O (grupos carbonílicos, 286,8 eV), O-C=O (grupos carboxílicos, 288,7 eV) e pico satélite π-π* (shake up, 291,1 eV). A composição química dos NTC, em termos de porcentagens atômicas, está representada quantitativamente na Tabela 2.
A purificação é uma etapa importante e deve ser aplicada antes da utilização dos NTC em dispositivos biomédicos e implantes.28 Os contaminantes metálicos (Fe, Y, Ni, Mo, Co) remanescentes do processo de obtenção dos NTC são um dos principais fatores de toxicidade, pois, em ambientes biológicos, in vitro ou in vivo, as impurezas metálicas podem ser liberadas da estrutura dos NTC e acentuar os possíveis efeitos tóxicos.29,30 O processo de purificação e funcionalização, além da eliminação de contaminantes, tem como propósito aumentar a dispersão dos NTC em meio biológico, reduzindo a toxicidade, porém, a literatura estabelece que nem todo método de funcionalização é apropriado para tratamento de nanoestruturas de carbono para ser utilizado em aplicações biomédicas.28,31-33 O processo de purificação utilizado nesse trabalho alcançou um bom resultado, com índice abaixo de 2,0% de resíduos metálicos, sendo que o único resíduo metálico encontrado foi o ferro. Os NTC apresentavam, antes do processo de purificação, concentração de resíduo metálico em torno de 3,5%, que estão descritos no trabalho de Andrade e colaboradores.7 Muitos trabalhos publicados na literatura utilizaram NTC com maior porcentagem de contaminantes. Armentano e colaboradores desenvolveram nanocompósitos de PLLA e NTCPS não funcionalizados e funcionalizados (5-8% de impurezas metálicas, diâmetro 4-5 nm e comprimento 0,5-1,5 µm). Os resultados indicaram melhor adesão de células osteoblásticas nos nanocompósitos com NTCPS funcionalizados, indicando boa compatibilidade.34 Lizundia et al. estudou o comportamento de células tronco mesenquimais em nanocompósitos com NTCPM não purificados (10% de contaminantes baseados em óxidos de alumínio e de ferro, diâmetro de 15 a 30 nm e comprimento entre 270 a 460 nm). Os ensaios de viabilidade e diferenciação celular apresentaram resultados satisfatórios.35 Em outro trabalho, PLLA foi recoberto com NTCPM funcionalizado (pureza>95%, diâmetro 10-20 nm, comprimento 1-5 µm) e foi realizada cultura de células de osteosarcoma humano. A adesão celular em estágios iniciais foi melhor no PLLA com NTCPM funcionalizado quando comparado ao PLLA sem NTCPM.36 Estudos in vivo em camundongos com NTCPM puros e funcionalizados com tempos diferentes de oxidação (1 a 8 horas) mostraram efeito hepatotóxico nos NTCPM puros, sem funcionalização. Os autores concluíram que o efeito tóxico dos NTCPM depende diretamente do grau de funcionalização, quanto maior a densidade de grupos carboxílicos na superfície dos NTCPM, menor os efeitos tóxicos.29 O comprimento dos NTC é outro parâmetro muito discutido em relação à toxicidade e seus efeitos. Segundo Vardharajula et al., quando os NTC ultrapassam a 20 µm de comprimento, eles não são fagocitados e, consequentemente, podem induzir a produção de espécies reativas de oxigênio (ROS) e processos inflamatórios indesejáveis.31 Todavia, em outro trabalho, foi relatado que nanotubos com comprimentos de 10 µm são mais biocompatíveis.37 Em estudo de Yamashita et al., NTCPM com comprimento entre 5 e 15 µm induziram maiores danos às moléculas de DNA quando aplicados em camundongos.38 Sato et al. concluíram em seu trabalho com ratos que o grau de inflamação induzido por NTC de 825 nm foi maior que o induzindo por NTC de 220 nm.39 Caracterização dos nanocompósitos de PLLA/p-NTCPM Microscopia Eletrônica de Varredura (MEV) As imagens da superfície de fratura evidenciam as estruturas de nanotubos de carbono no PLLA. É possível observar uma morfologia densa, independente da presença dos p-NTCPM (Figuras 4A e 4B).
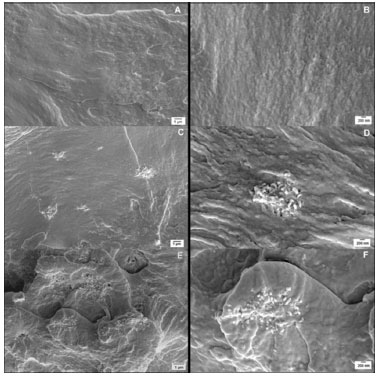 Figura 4. Micrografias da superfície de fratura obtidas por MEV: A, B - PLLA; C, D - PLLA/p-NTCPM 0,25%; E, F - PLLA/p-NTCPM 0,5%
A afinidade entre os tubos ocorre por força de Van der Walls que são difíceis de serem rompidas e o processo de oxidação pode auxiliar na dispersão dos mesmos, contribuindo para boa interface entre o p-NTCPM e a matriz polimérica.40 Porém, o método de obtenção dos nanocompósitos também pode causar aglomeração dos NTC. O processo de evaporação de solvente, utilizado nesse trabalho, é um processo lento e, provavelmente, causou uma nova aglomeração dos p-NTCPM na matriz polimérica, claramente observados nas Figuras 4C a 4F.41 Outro parâmetro citado na literatura que influencia na dispersão dos NTC é a viscosidade da solução. Trabalhos publicados relatam que o aumento da viscosidade diminui a aglomeração dos NTC.42,43 A aglomeração dos NTC pode influenciar na formação da região de interface dos nanocomósitos, afetando suas propriedades finais. Segundo Lin e colaboradores,44 a interface está diretamente ligada ao efeito de reforço dos NTC, porém, os processos de funcionalização são importantes para que grupos funcionais (-OH e -COOH) possam formar ligações com o polímero, melhorar a adesão interfacial e aumentar a região de interface entre o NTC e a matriz polimérica. Calorimetria Exploratória Diferencial (DSC) O comportamento térmico do PLLA e nanocompósitos foi avaliado pela análise de DSC. Para uma análise completa, foi realizado o estudo do primeiro aquecimento, resfriamento e segundo aquecimento das amostras. A Figura 5 mostra as curvas de DSC obtidas para o PLLA e nanocompósitos.
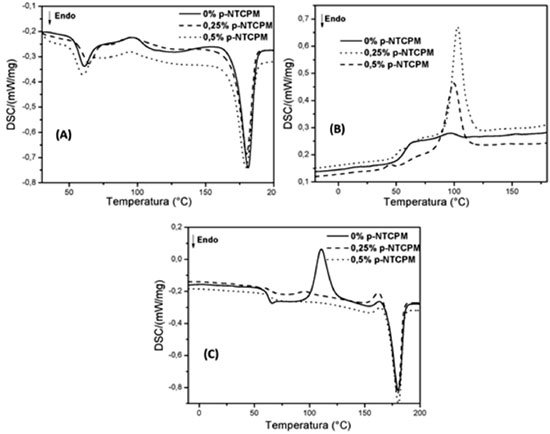 Figura 5. Curvas de DSC para PLLA; PLLA/p-NTCPM 0,25%; PLLA/p-NTCPM 0,5%, - (A) primeiro aquecimento, (B) resfriamento, (C) segundo aquecimento
O grau de cristalinidade χc (%) das amostras foi determinado de acordo com a equação 1: 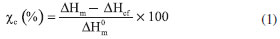 na qual ΔHm e ΔHcf são, respectivamente, as entalpias de fusão e cristalização a frio das amostras, ΔH0m é a entalpia teórica do PLLA 100% cristalino (93 J g-1).45 Para o cálculo do grau de cristalinidade (χ%), no primeiro e no segundo aquecimento, foi descontado a valor da entalpia de cristalização a frio (ΔHcf).46 O fenômeno de cristalização a frio ocorre durante o aquecimento do polímero a partir do estado sólido. Em temperaturas acima da temperatura de transição vítrea (Tg), as cadeias adquirem mobilidade e podem se rearranjar e formar regiões cristalinas.47 O PLLA apresenta cristalização a frio devido à sua estrutura cristalina. De acordo com o método de obtenção, o PLLA pode apresentar três estruturas cristalinas diferentes, as formas α, β e γ. A forma α, utilizada nesse trabalho, cresce a partir da fusão, da cristalização a frio ou a da solução. Possui estrutura ortorrômbica com parâmetros de rede a=1.066 nm, b=0,616 nm, c=2,888 nm.48 É importante a análise do primeiro aquecimento, pois ele reflete as condições de processamento das amostras, a influência dos p-NTCPM na matriz polimérica de PLLA. As curvas de DSC apresentaram a transição vítrea (Tg1), a fusão (Tm1) e um pequeno pico de cristalização a frio (Tcf1) nas amostras (Figura 5A). Os resultados indicam, de acordo com a Tabela 3, que não houve mudanças nas Tg1, Tm1 e nas entalpias de cristalização a frio (ΔHcf1) e de fusão (ΔHm1). O grau de cristalinidade também não se alterou após a adição de p-NTCPM. Porém, Tcf1 diminuiu com a adição de p-NTCPM. Uma explicação é o fato do p-NTCPM acelerar a habilidade de cristalização do PLLA, aumentando a velocidade de formação de núcleos cristalinos após a Tg.
As curvas de cristalização das amostras podem ser observadas na Figura 5B. O valor baixo de entalpia de cristalização do PLLA (Tabela 4) ocorre devido à taxa de resfriamento ter sido muito rápida, não havendo tempo suficiente para que a cristalização ocorresse e, no aquecimento posterior, originou-se a cristalização a frio (Figuras 5B e 5C). A Tabela 4 revela um aumento na temperatura cristalização (Tc) e na entalpia de cristalização (ΔHc) dos nanocompósitos em relação ao PLLA.
Os p-NTCPM atuam como agentes nucleantes, promovendo a formação de uma quantidade maior de núcleos ativos na matriz polimérica e fazendo com que sua cristalização inicie antes nos nanocompósitos em comparação ao PLLA. Em estudos anteriores foram relatados que esse fenômeno pode ser atribuído à diminuição da energia de ativação e ao aumento da densidade de nucleação, conduzindo à aceleração da cristalização.49,50 A Figura 5C mostra as curvas de DSC relativas ao segundo aquecimento, após apagar a história térmica das amostras. Segundo Ahmed et al., o comportamento térmico das polilactides depende da história térmica das amostras e da taxa de aquecimento utilizada na análise.51 No segundo aquecimento, a entalpia de cristalização a frio (ΔHcf2) do PLLA foi maior em comparação ao primeiro aquecimento. O nanocompósito com 0,25% p-NTCPM apresentou um pico de cristalização a frio pequeno, como pode ser observado na Figura 5C. Porém, na concentração de 0,5% de p-NTCPM, a cristalização a frio desapareceu completamente. Esse resultado se deve à ação nucleante do p-NTCPM, que facilita a cristalização completa do polímero no ciclo de resfriamento e aumenta o grau de cristalinidade (χc) dos nanocompósitos.52 A temperatura de cristalização a frio (Tcf2) diminuiu no nanocompósito com 0,25% p-NTCPM comparado ao PLLA, como no primeiro aquecimento. Os resultados obtidos de temperatura de transição vítrea (Tg2), temperatura de fusão (Tm2) e entalpia de fusão (ΔHm2) indicam que essas propriedades não se modificaram com a adição de p-NTCPM. No segundo aquecimento, o grau de cristalinidade (χc2) aumentou devido às condições em que foi realizada a cristalização (Tabela 4). Além da cristalização, a adição de um agente nucleante pode afetar outras propriedades térmicas de um polímero, como o grau de cristalinidade e a temperatura de transição vítrea, devido às alterações na mobilidade das cadeias poliméricas.53,34 Nesse trabalho, a adição de p-NTCPM não alterou o grau de cristalinidade e a temperatura de transição vítrea, como foi observado no primeiro aquecimento do DSC (Tabela 3). Uma das causas pode ser a aglomeração dos p-NTCPM na matriz de PLLA (Figura 4), que pode ter comprometido a formação da região de interface e o grau de interação entre a matriz polimérica e o p-NTCPM.44 Todavia, há trabalhos que relatam que, devido ao fato do PLLA possuir alta cristalinidade, processos inflamatórios podem ocorrer durante a degradação, comprometendo a biocompatibilidade do implante.54-56 O fato de não ter ocorrido aumento no grau de cristalinidade após a adição de p-NTCPM pode ser considerado um resultado favorável em termos de degradação e biocompatibilidade dos nanocompósitos. Ensaios in vitro de adesão e proliferação celular As imagens obtidas por MEV evidenciam que as membranas de PLLA, independentemente da presença de p-NTCPM, permitiram que as células Vero se estabelecessem nas superfícies, por meio da adesão e espraiamento celular (Figura 6), não havendo, contudo, diferenças morfológicas salientes entre as membranas de PLLA e as concentrações de p-NCTPM utilizadas.
 Figura 6. Micrografias de cultura de células obtidas por MEV: (A)(B)(C) PLLA após 48h, 5 dias e 10 dias respectivamente, (D)(E)(F) PLLA/p-NTCPM 0,25% após 48h, 5 dias e 10 dias respectivamente, (G)(H)(I) PLLA/p-NTCPM 0,5% após 48h, 5 dias e 10 dias respectivamente
Nas imagens de MEV após 48 horas (Figuras 6A, 6D, 6G), as células apresentam distribuição uniforme e morfologia fibroblástica, predominantemente alongada e achatada, espraiadas sobre as membranas, emitindo prolongamentos citoplasmáticos que facilitam a adesão e a comunicação celular. Após 5 dias de cultivo (Figuras 6B, 6E, 6H), são visualizados depósitos de material particulado, possivelmente provindos da síntese de matriz extracelular durante o cultivo, de metabólitos celulares ou até do precipitado de componentes do meio de cultura. A presença de material particulado entre projeções das superfícies celulares, os quais se assemelham a microvilos e vesículas, sugerem a manutenção da atividade metabólica das células. Estas características ultra-estruturais são consideradas como sendo resultante da capacidade de células Vero secretarem componentes da matriz extracelular.57 Com a progressão dos tempos de cultivo, após o tempo de 10 dias, a identificação celular tornou-se difícil, uma vez que as células apresentam-se em estágio de confluência, formando um tapete celular contínuo sobre as membranas poliméricas (Figuras 6C, 6F, 6I). O padrão morfológico irregular achatado com fenótipo espraiado em íntimo contato com o substrato condiz com os resultados exibidos por outros tipos celulares quando cultivados em materiais compósitos com nanotubos de carbono como cardiomiócitos e células nervosas,58 osteosarcoma Saos2 e ROS 17/2.8 e células fibroblásticas.24,59,60 A citocompatibilidade das amostras de PLLA contendo porcentagens de 0,25% e 0,5% de p-NTCPM foi avaliava pelos ensaios de adesão e proliferação celular, obtidos pelo teste do MTT e ensaio do PicoGreen, respectivamente. O fenômeno da adesão celular é uma etapa fundamental no processo de interação célula-biomaterial e está, comumente, associada à capacidade das células em reconhecer, ligar-se e interagir com um substrato, portanto, apresentarem afinidade celular. Somente depois de aderidas, as células iniciam seu processo de espraiamento, proliferação, produção de matriz extracelular nova e manutenção do fenótipo celular.61,62 Na Figura 7A são apresentados os valores médios de absorbância obtidos pelo teste do MTT, proporcionais à quantidade de células viáveis aderidas sobre as amostras após 24 de cultura. É possível observar que todas as amostras apresentaram-se atóxicas quando comparadas ao controle negativo (p<0,01), permitindo que as células aderissem à superfície das membranas de PLLA.
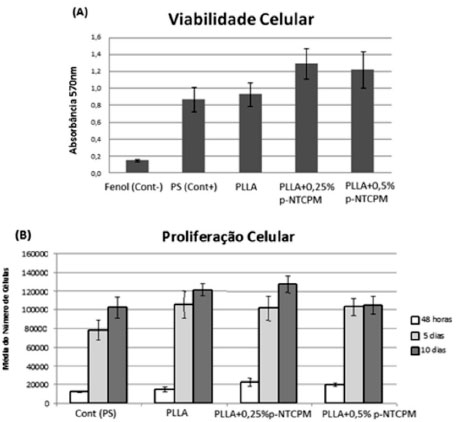 Figura 7. Resultados obtidos após cultura de células: (A) Viabilidade celular, (B) Proliferaçao celular
Em comparação com a membrana de PLLA, os resultados revelam que a adição de p-NTCPM à matriz polimérica, independente das concentrações avaliadas, é capaz de promover a afinidade celular, estimulando significativamente o processo de adesão sobre a superfície das membranas (p<0,05). Não há diferença significativa entre os índices de adesão celular apresentados pelas amostras de PLLA/0,25% p- NTCPM e PLLA/0,5% p-NTCPM (p>0,05). Paralelamente ao estudo de adesão, a taxa de proliferação celular exibida pelas células Vero cultivadas por 48 horas, 5 e 10 dias sobre as membranas de PLLA, PLLA/0,25% p- NTCPM, PLLA/0,5% p-NTCPM e controle (placa de poliestireno, PS), foi avaliada pelo ensaio do PicoGreen. Na Figura 7B são apresentados os valores do número médio de células presente nas diferentes amostras em função do tempo de cultivo. Condizente com os resultados obtidos no teste do MTT, após 48 horas de cultivo ambas as amostras de PLLA acrescidas de p-NTCPM foram capazes de estimular significativamente o processo de adesão celular em comparação ao controle e membranas de PLLA sem p-NTCPM (p<0,05). Além disso, a análise estatística dos resultados confirmou que independente das porcentagens de p-NTCPM (0,25% e 0,5%) adicionadas ao PLLA, o índice de adesão celular nas amostras não é influenciado (p>0,05) A partir do 5º dia de cultura, os níveis de densidade celular encontrados entre a amostra de PLLA e nanocompósitos tornaram-se semelhantes entre si (p>0,05). Entretanto, a análise dos dados estatísticos revela que entre o período de 5 e 10 dias de cultivo o número de células presente em todas as amostras, com exceção da membrana de PLLA/0,5% p-NTCPM no último tempo (p>0,05), aumentou progressivamente, com taxa de crescimento celular estatisticamente significativa (p<0,01). A diminuição da taxa de proliferação observada nas membranas de PLLA/0,5% p-NTCPM após o tempo de 10 dias de cultivo não deve ser atribuída ao fato de uma maior concentração de nanotubos estar presente no material, mas sim ao comportamento natural que células aderentes exibem em sistemas de cultivo celular quando atingem o limiar máximo de densidade, desencadeando o processo de inibição por contato, desprendimento e apoptose celular. Resultados semelhantes aos apresentados no presente estudo são demonstrado pelos pesquisadores Lizundia et al. e Montesano et al.35,63 Os autores relatam que a adição de porcentagens entre 0,1% e 3% de p-NTCPM à matriz polimérica de PLLA não interferem na citocompatibilidade de células mesenquimais humanas de medula óssea e mioblastos murinos, permitindo que os níveis de atividade metabólica celular e taxa de proliferação sejam muito semelhantes aos encontrados no polímero PLLA sem p-NTCPM. Segundo Berry et al., as células fibroblásticas são sensíveis a alterações na topografia, influenciando na motilidade celular e possivelmente na proliferação celular.64 Esta capacidade de adesão dos fibroblastos é considerada como modelo de adesão para investigação de outros tipos celulares sobre os substratos.65,66 Alguns autores descrevem o comportamento de não respeitar os limites do contato célula/célula e continuar proliferando como sendo apresentado por células que sofreram transformação.67 Células Vero que passaram por estresse quando atingiram a confluência podem continuar se desenvolvendo indefinidamente, crescendo muitas vezes em múltiplas camadas e formando agregados celulares, não mantendo a característica de inibição de crescimento por contato. No entanto, apesar da morfologia achatada propiciada pelo substrato neste estudo, após atingirem a confluência, as células Vero mantiveram o comportamento padrão, com presença de células arredondadas ou com inúmeros prolongamentos sobre o tapete celular, sugerindo células em processo apoptótico com desprendimento, evidente após 10 dias de cultivo (Figura 6C, F e I). A realização de estudos que visam avaliar o processo de adesão e proliferação de células cultivadas sobre um composto ou substrato representa a etapa inicial do processo de caracterização biológica e certificação de biomateriais voltados à aplicação biomédica. Estes contribuem para uma melhor compreensão do comportamento físico-químico, estabilidade e compatibilidade do material de interesse que entrará em contato com o tecido biológico. No presente trabalho, a citocompatibilidade de nanocompósitos de PLLA contendo porcentagens de 0,25% e 0,5% de nanotubos de carbono de parede múltiplas (p-NTCPM) foi avaliada qualitativamente e quantitativamente por meio de ensaios que permitiram analisar o comportamento e morfologia de células Vero cultivadas sobre as amostras em função de diferentes tempos de cultivo. Os resultados obtidos mostram que ambas as concentrações de p-NTCPM empregadas na obtenção de membranas nanocompósitos de PLLA não apresentam qualquer toxicidade ou efeito negativo sobre o cultivo de células Vero. Independente da porcentagem de p-NTCPM utilizado, adequados índices de adesão e taxa de proliferação celular podem ser obtidos com o uso desses materiais na engenharia tecidual, sugerindo seu potencial de aplicação como biomaterial.
CONCLUSÃO O processo de purificação dos nanotubos foi eficiente para obtenção de uma amostra com baixo teor de resíduo metálico (i.e. ferro), livre de resíduos carbonáceos (oxidation debris) e comprimento abaixo de 6,0 µm. A purificação/funcionalização e tamanho (comprimento) dos NTC são uns dos parâmetros mais relacionados na literatura sobre os efeitos tóxicos dos mesmos em sistemas biológicos. Além da purificação, o processo empregado gerou grupamentos oxigenados na superfície dos nanotubos de carbono, melhorando assim sua capacidade de dispersão no solvente (i.e. clorofórmio). O método de evaporação de solvente utilizado para a produção dos nanocompósitos causou uma aglomeração dos p-NTCPM na matriz polimérica, levando a formação de ilhas de p-NTCPM. Pela avaliação biológica, demonstrada pelas imagens de MEV, ensaio de viabilidade e de proliferação celular, pode-se inferir que a presença de p-NTCPM apresentou resultados favoráveis para adesão e proliferação de células fibroblásticas, como também demonstrou que estes materiais foram capazes de sustentar o crescimento celular de forma progressiva em membranas de PLLA. O desempenho satisfatório dos nanocompósitos foi devido às propriedades já conhecidas dos NTC somando-se ao processo de purificação e funcionalização, que minimizaram os possíveis efeitos tóxicos dos NTC. Neste sentido, os nanocompósitos contendo NTC purificados e caracterizados colabora para o desenvolvimento de novas terapias teciduais, dispositivos e materiais para implantes e próteses.
MATERIAL SUPLEMENTAR A curva de calibração do PicoGreen (Figura 1S) e as curvas TG e DTG para o p-NTCPM (Figura 2S) estão disponíveis em http://quimicanova.sbq.org.br em formato pdf, com acesso livre.
AGRADECIMENTOS CNPq, INCT-Inomat, FAPESP, Rede Nacional de Pesquisa em Nanotubos de Carbono, Rede Nacional de Nanotoxicologia (Cigenanotox/MCTI) e ao LNNano pelas facilidades e competência técnica para realização das análises de MEV e XPS.
REFERÊNCIAS 1. Schadler, L. Nat. Mater. 2007, 6, 257. DOI: http://dx.doi.org/10.1038/nmat1873 PMID: 17401415 2. Iijima, S.; Nature 1991, 353, 56. DOI: http://dx.doi.org/10.1038/354056a0 3. Harris, P. J. F.; Carbon Nanotube Science, Synthesis, Propertiers and Application, 1th ed., Cambridge University Press: Cambridge, 2009. 4. Sahoo, N. G.; Rana, S.; Cho,J. W.; Li, L.; Chan, S. H.; Prog. Polym. Sci. 2010, 35, 837. DOI: http://dx.doi.org/10.1016/j.progpolymsci.2010.03.002 5. Zhang, X.; Sreekumar, T. V.; Liu, T.; Kumar, S.; J. Phys. Chem. B 2004, 108, 16435. DOI: http://dx.doi.org/10.1021/jp035850q 6. Souza Filho, A. G.; Fagan, S. B.; Quim. Nova 2007, 30, 1695. DOI: http://dx.doi.org/10.1590/S0100-40422007000100035 7. Andrade, N. F.; Martinez, D. S. T.; Paula, A. J.; Silveira, J. V.; Alves, O. L.; Souza Filho, A. G.; J. Nanopart. Res. 2013, 15, 1761. DOI: http://dx.doi.org/10.1007/s11051-013-1761-8 8. Dumortier, H.; Lacotte, S.; Pastorin, G.; Marega, R.; Wu, W.; Bonifazi, D.; Nano Lett. 2002, 6, 1522. DOI: http://dx.doi.org/10.1021/nl061160x PMID: 16834443 9. Newman, P.; Minett, H. A.; Ellis-Behnke, R.; Zreiqat, H.; Nanomedicine: Nanotechnology, Biology and Medicine 2013, 9, 1139. DOI: http://dx.doi.org/10.1016/j.nano.2013.06.001 10. Okamoto, M.; John, B.; Prog. Polym. Sci. 2013, 38, 1487. DOI: http://dx.doi.org/10.1016/j.progpolymsci.2013.06.001 11. Fraczeka, A.; Menaszekb, E.; Paluszkiewicz, C.; Blazewicz, M.; Acta Biomater. 2008, 4, 1593. DOI: http://dx.doi.org/10.1016/j.actbio.2008.05.018 12. Liu, Z.; Chen, K.; Davis, C.; Sherlock, S.; Cao, Q.; Chen, X.; Daí, H.; Cancer Res. 2008, 68, 6652. DOI: http://dx.doi.org/10.1158/0008-5472.CAN-08-1468 PMID: 18701489 13. Tran, P. A.; Zhang, L.; Webster, T. J.; Adv. Drug Delivery Rev. 2009, 61, 1097. DOI: http://dx.doi.org/10.1016/j.addr.2009.07.010 14. Fortunatti, E.; D'Angelo, F., Martini, S., Orlacchio, A., Kenny J. M., Armentano, I.; Carbon 2011, 49, 2370. DOI: http://dx.doi.org/10.1016/j.carbon.2011.02.004 15. Ciombor, D. M.; Aaaron, R. K.; J. Cell. Biochem. 1993, 52, 37. DOI: http://dx.doi.org/10.1002/jcb.240520106 PMID: 8320273 16. Goldman, R.; Pollack, S.; Bioelectricomagnetics 1996, 17, 450. DOI: http://dx.doi.org/10.1002/(SICI)1521-186X(1996)17:6<450::AID-BEM4>3.0.CO;2-2 17. Motta, A. C.; Duek, E.; Polímeros 2006, 16, 26. DOI: http://dx.doi.org/10.1590/S0103-73312006000100003 18. Maurus, P. B.; Kaeding C, C.; Oper. Tech. Sport. Med. 2004, 12, 158. DOI: http://dx.doi.org/10.1053/j.otsm.2004.07.015 19. Nair, L. S.; Laurencin, C. T.; Prog. Polym. Sci. 2007, 21, 762. DOI: http://dx.doi.org/10.1016/j.progpolymsci.2007.05.017 20. Duek, E. A. R.; Zavaglia, C. A. C.; Belangero, W. D.; Polymer 1999, 40, 6465. DOI: http://dx.doi.org/10.1016/S0032-3861(98)00846-5 21. Martinez, D. S. T.; Paula, A. J.; Vaz, B. G.; Silva, R. A.; Andrade, N. F.; Souza Filho, A. G.; Justo, G. Z.; Ferreira, C. V.; Eberlin, M. N.; Alves, O. L.; J. Hazard. Mater. 2011, 189, 391. DOI: http://dx.doi.org/10.1016/j.jhazmat.2011.02.050 22. ASTM International; ASTM F813-83. Standard practice for direct contact cell culture evaluation of materials for medical devices, 1983. 23. ISO 10993-1/5: 1992 (E). Biological evaluation of medical devices - Part.5 - Test for cytotoxicity: in vitro methods. Geneva; 1992. 24. Rodrigues, A. A.; Batista, N. A.; Bavaresco, V. P.; Baranauskas, V.; Ceragioli, H. J.; Peterlevitz, A. C.; Santos Jr., A. R.; Belangero, W. D.; Carbon 2012, 50, 450. DOI: http://dx.doi.org/10.1016/j.carbon.2011.08.071 25. Mosmann, T.; J. Immunol. 1983, 65, 55. 26. Blumenstein, R.; Dias, M.; Russo, I. H.; Tahin, Q.; J. Int. Oncol. 2002, 21, 447. 27. Pinto, N. V.; Andrade, N. F.; Martinez, D. S. T.; Alves, O. L.; Souza Filho, A. G.; Mota, M. R. L.; Nascimento, K. S.; Cavada, B. S.; Assreuy, A. M. S.; J. Nanosci. Nanotecnol. 2013, 13, 01. DOI: http://dx.doi.org/10.1166/jnn.2013.6733 28. Tavangarian, F.; Li, Y.; Ceram. Int. 2012, 38, 6075. DOI: http://dx.doi.org/10.1016/j.ceramint.2012.05.038 29. Jain, S.; Thakare, V. S.; Das, M.; Godugu, C.; Jain, A. K.; Mathur, R.; Chuttani, K.; Mishra, A. K.; Chem. Res. Toxicol. 2011, 24, 2028. DOI: http://dx.doi.org/10.1021/tx2003728 PMID: 21978239 30. Liu, Y.; Zhao, Y.; Sun, B.; Chen, C.; Acc. Chem. Res. 2012, 46, 702. DOI: http://dx.doi.org/10.1021/ar300028m PMID: 22999420 31. Vardharajula, S.; Ali, S. Z.; Eroglu, E.; Vig, K.; Dennis, V. A.; Singh, S. R.; Int. J. Nanomed. 2012, 7, 5361. DOI: http://dx.doi.org/10.2147/IJN.S35832 32. Bottini, M.; Bruckner, S.; Nika, K.; Bottini, N.; Bellucci, S.; Magrini, A.; Bergamaschi, A.; Mustelin, T.; Toxicol. Lett. 2006, 160, 121. DOI: http://dx.doi.org/10.1016/j.toxlet.2005.06.020 PMID: 16125885 33. Magrez, A.; Kasas, S.; Salicio, V.; Pasquier, N.; Seo, J.W.; Celio, M.; Catsicas, S.; Schwaller, B.; Forro, L.; Nano Lett. 2006, 6, 1121. DOI: http://dx.doi.org/10.1021/nl060162e PMID: 16771565 34. Armentano, I.; Marinucci, L.; Dottori, M.; Balloni, S.; Fortunati, E.; Pennachi, M.; Becchetti, E.; Locci, P.; Kenny, J. M.; J. Biomater. Sci. 2011, 22, 541. DOI: http://dx.doi.org/10.1163/092050610X487873 35. Lizundia, E.; Sarasua, J. R.; D'Angelo, F.; Orlacchio, A.; Martino, S.; Kenny, J. M.; Armentano, I.; Macromol. Biosci. 2012, 12, 870. DOI: http://dx.doi.org/10.1002/mabi.201200008 PMID: 22711658 36. Hirata, E.; Akasaka, T.; Uob, M.; Takita, H.; Watari, F.; Yokoyama, A.; Appl. Surf. Sci. 2012, 262, 24. DOI: http://dx.doi.org/10.1016/j.apsusc.2012.01.012 37. Firme III, C. P.; Bandaru, P. B.; Nanomedicine 2010, 6, 245. DOI: http://dx.doi.org/10.1016/j.nano.2009.07.003 38. Yamashita, K.; Yoshioka, Y.; Higashisaka, K; Morishita, Y.; Yoshida, T.; Fujimura, M.; Kayamuro, H.; Nabeshi, H.; Yamashita, T.; Nagano, K.; Abe, Y.; Kamada, H.; Kawai, Y.; Mayumi, T.; Yoshikawa, T.; Itoh, N.; Tsunoda, S.; Tsutsumi, Y.; Infflamation 2010, 33, 276. DOI: http://dx.doi.org/10.1007/s10753-010-9182-7 39. Sato, Y.; Yokoyama, A.; Shibata, K.; Akimoto, Y.; Ogino, S.; Nodasaka, Y.; Kohgo, T.; Tamura, K.; Akasaka, T.; Uo, M.; Motomiya, K.; Jeyadavan, B.; Ishiguro, M.; Hatakeyama, R.; Watari, F.; Tohji, K.; Mol. Biosyst. 2005, 1, 176. DOI: http://dx.doi.org/10.1039/b502429c PMID: 16880981 40. Schadler, L. S. Em Polymer-based and Polymer-filler Nanocomposite; Ajayan, P. M.; Schadler, L. S.; Braun, P. V., eds.; Wiley: Weinheim, 2003, cap. 2. 41. Park, S. J; Seo, M. K.; Interface Science and Composite, 1th ed., Academic Press: Amsterdam, 2011. 42. Ma, P.; Mo, S.; Tang, B.; Kim, J.; Carbon 2010, 48, 1824. DOI: http://dx.doi.org/10.1016/j.carbon.2010.01.028 43. Dumée, L.; Sears, K.; Schutz, J.; Finn, N.; Duke, M.; Gray, S.; Nanomaterials 2013, 3, 70. DOI: http://dx.doi.org/10.3390/nano3010070 44. Lin, C.; Wang, Y.; Lai, Y.; Yanga, W.; Jiao, F.; Zhang, H.; Yea, S.; Zhang, Q.; Colloids Surf., B 2011, 83, 367. DOI: http://dx.doi.org/10.1016/j.colsurfb.2010.12.011 45. Harris, A. M.; Lee, E. C.; J. Appl. Polym. Sci. 2008, 2246. DOI: http://dx.doi.org/10.1002/app.27261 46. Morales, A. R.; Pereira, R. B.; Polímeros 2014, 24, 198. DOI: http://dx.doi.org/10.4322/polimeros.2014.042 47. Machado, L. D. B.; Matos, J. R.; Em Análise Térmica Diferencial e Calorimetria Exploratória Diferencial; Canevarolo, S. V., ed.; Artliber Editora: Sao Paulo, 2007, cap. 12. 48. Lorenzo, M. L.; Cocca, M.; Malinconico, M.; Thermochim. Acta 2011, 522, 110. DOI: http://dx.doi.org/10.1016/j.tca.2010.12.027 49. Li, S.; J. Biomed. Mater. Res. 1999, 48, 342. DOI: http://dx.doi.org/10.1002/(SICI)1097-4636(1999)48:3<342::AID-JBM20>3.0.CO;2-7 PMID: 10398040 50. Gao, Y.; Wang, Y.; Shi, J.; Bai, H.; Song, B.; Polym. Test. 2008, 27, 179. DOI: http://dx.doi.org/10.1016/j.polymertesting.2007.09.012 51. Ahmed, J.; Zhang, J. X.; Varshney, S. K.; J. Therm. Anal. Calorim. 2008, 95, 957. DOI: http://dx.doi.org/10.1007/s10973-008-9035-x 52. Li, B.; Dong, F.; Wang, X.; Yang, J.; Wang, D.; Wang, Y.; Eur. Polym. J. 2009, 45, 2996. DOI: http://dx.doi.org/10.1016/j.eurpolymj.2009.08.015 53. Rabello, M.; De Paoli, M. A.; Aditivaçao de Termoplásticos, 1ª ed., Artliber: Sao Paulo, 2013. 54. Beslikas, T.; Gigis, I.; Goulios, V.; Christoforides, J.; Papageorgiou, G. J.; Bikiaris, D. N.; Int. J. Mol. Sci. 2011, 12, 6597. DOI: http://dx.doi.org/10.3390/ijms12106597 PMID: 22072906 55. Minata, M. K.; Motta, A. C.; Barbo, M. L. P.; Rincon, M. C. A.; Duek, E.; Polímeros 2013, 23, 242. DOI: http://dx.doi.org/10.4322/polimeros.2013.074 56. Kong, L.; Liu, W.; Yan, G.; Li, Q.; Yang, H.; Yu, F.; Song, H.; Int. J. Clin. Exp. Med. 2014, 7, 5317. PMID: 25664037 57. Santos Jr., A. R.; Dolder, H.; Wada, M. L.; J. Submicrosc. Cytol. Pathol. 2003, 35, 35. PMID: 12762650 58. Stout, D. A.; Basu, B.; Webster, T. J.; Acta Biomater. 2011, 7, 3101. DOI: http://dx.doi.org/10.1016/j.actbio.2011.04.028 PMID: 21571106 59. Zanello, L. P.; Zhao, B.; Hu, H.; Haddon, R. C.; Nano Lett. 2006, 9, 562. DOI: http://dx.doi.org/10.1021/nl051861e 60. Shi, X.; Sitharaman, B.; Pham, Q. P.; Spicer, P, .; Hudson, ,, J. L.; Wilso, n, L. J.; Tour, J. M.; Raphael, R. M.; Mikos, A. G.; J. Biomed. Mater. Res. A, 2008, 86, 813. DOI: http://dx.doi.org/10.1002/jbm.a.31671 PMID: 18041725 61. Santos, A.R.; Ferreira, B. M. P.; Duek, E. A. R.; Dolder, H.; Wada, R. S.; Wada, M. L. F.; Artif. Organs 2004, 28, 381. DOI: http://dx.doi.org/10.1111/j.1525-1594.2004.47199.x PMID: 15084200 62. Barbanti, S. H.; Zavaglia, C. A. C.; Duek, E. A. R.; Polímeros 2005, 15, 13. DOI: http://dx.doi.org/10.1590/S0104-14282005000100006 63. Montesano, S.; Lizundia, E.; D'Angelo, F.; Fortunati, E.; Mattioli, S.; Morena, F.; Bicchi, I.; Naro, F.; Sampaolesi, M.; Sarasua, J.; Kenny, J. N.; Orlacchio, A.; Armentano, I.; Martino, S.; ISRN Tissue Eng. 2013, 2013, 1. DOI: http://dx.doi.org/10.1155/2013/825912 64. Berry, C.; Camppbell, G.; Spadaccino, A.; Robertson, M.; Curtis, A. S. G.; Biomaterials 2004, 25, 5781. DOI: http://dx.doi.org/10.1016/j.biomaterials.2004.01.029 PMID: 15147824 65. Fletcher, B. L.; Hullander, C. D.; Melechko, A.V.; McKnight, T. E.; Klein, K. L.; Henskey, J. L.; Morrell, J. L.; Simpson, M. I.; Doktycz, M. J.; Nano Lett. 2004, 4, 1809. DOI: http://dx.doi.org/10.1021/nl0493702 66. Riviere, B. L.; Nemanich, R. J.; Inman, A. O.; Wang, Y. Y.; Riviere, J. E.; Toxicol. Lett. 2005, 155, 377. DOI: http://dx.doi.org/10.1016/j.toxlet.2004.11.004 67. Genari, S. C.; Dolher, M. A. H.; Wada, M. L. F.; J. Submicrosc. Cytol. Pathol. 1996, 28, 565. PMID: 8933740 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access