Revisão
|
|
| Microemulsões: componentes, características, potencialidades em química de alimentos e outras aplicações Microemulsions: components, characteristics, potentialities in food chemistry and other applications |
|
José Dilson F. da SilvaI,II; Yara P. da SilvaIII; Clarisse M. S. PiatnickiIII; Wolmir José BöckelIV; Carla R. B. MendonçaI,*
ICentro de Ciências Químicas Farmacêuticas e de Alimentos, Universidade Federal de Pelotas, Campus Universitário, CP 354, 96010-900 Pelotas - RS, Brasil Recebido em 16/01/2015 *e-mail: carlaufpel@hotmail.com Microemulsions (MEs) are thermodynamically stable systems consisting of nanosized droplets dispersed in a solvent continuous medium (known as pseudo-phase), which is immiscible with the dispersed phase. These systems consist of water, a hydrophobic solvent called "oil," an amphiphile and often, a co-surfactant that is normally a medium chain alcohol. A large number of publications describe the importance of MEs in many branches of chemistry, and there is an intensive search for new applications. In addition, MEs have been applied in many areas, including oil extraction, removal of environmental pollutants from soils and effluents, dissolution of additives in lubricants and cutting oils, cleaning processes, dyeing and textile finishing, as nanoreactors to obtain nanoparticles of metals, semiconductors, superconductors, magnetic and photographic materials, and latex. However, only some studies indicate the potential applications of MEs in food and even fewer evaluate their chemical behavior. Potential applications of MEs in food comprise dissolution of lipophilic additives, stabilization of nutrients and biologically active compounds, using as an antimicrobial agent and to maximize the efficiency of food preservatives. This work consists of a literature review focusing on composition and physical and chemical characteristics of microemulsions. Despite the small number of studies on the subject reported in the literature, we demonstrate some potential applications of MEs in food chemistry. INTRODUÇAO Microemulsoes (MEs) sao sistemas termodinamicamente estáveis, opticamente transparentes, isotrópicos e de baixa viscosidade, constituídos por gotículas de tamanho nanométrico dispersas em uma fase contínua de um solvente imiscível com a fase dispersa. Elas sao formadas por água, um solvente hidrofóbico que é chamado de "óleo", um tensoativo e, frequentemente, também um co-tensoativo, normalmente um álcool de cadeia média.1,2 Estudos recentes descrevem o preparo de microemulsoes denominadas livres de surfactante, em que a fase óleo, formada por moléculas com propriedades tensoativas, faz, provavelmente, esse duplo papel.3 As microemulsoes têm sido alvo de numerosos estudos durante as últimas décadas, principalmente devido ao seu elevado poder de solubilizaçao.4 Em razao da baixa tensao interfacial entre as fases contínua e dispersa, normalmente menor do que 0,001 dina cm-1, há uma efetiva mistura das microfases água ou óleo com a fase dominante, tornando possível a dissoluçao de espécies apolares, polares e iônicas, desde que sua composiçao seja adequadamente ajustada.5-7 Esta propriedade é similar à de soluçoes micelares, porém, a capacidade de solubilizaçao simultânea de substâncias hidrofóbicas e hidrofílicas das microemulsoes é muito maior do que a das micelas.8 Em razao de suas propriedades especiais, aliadas à preocupaçao em preservar o meio ambiente, como alternativas para o uso de solventes orgânicos,5,8,9 o número de publicaçoes abordando o tema tem crescido continuamente, assim com seu campo de aplicaçao, tanto na pesquisa como na indústria. Ainda, em razao do aumento da condutividade elétrica do sistema, principalmente em consequência da presença de água, as microemulsoes sao capazes de viabilizar procedimentos eletroanalíticos em amostras de óleos vegetais.10-12 Estudos revelam potencialidades de aplicaçoes tecnológicas de microemulsoes na área de alimentos, destacando-se: promoçao da mistura de compostos imiscíveis,13-15 aumento da estabilidade de nutrientes16-18 e de compostos biologicamente ativos,19-21 aumento da eficiência de conservantes22-24 e otimizaçao de métodos analíticos.9,10,11,25 Este trabalho consiste de uma revisao bibliográfica sobre microemulsoes, enfocando suas características, descriçao de seus componentes, aplicaçoes e potencialidades na química de alimentos.
BREVE HISTORICO A mistura de um líquido orgânico e de um composto tensoativo com água forma, geralmente, uma emulsao leitosa-turva que, após algum tempo, separa-se em duas fases. Em 1943, Hoar e Schulman26 observaram que essa emulsao turva e instável podia ser convertida em um líquido opticamente transparente e termodinamicamente estável por adiçao de um álcool. No entanto, somente em 1959 o termo microemulsao foi empregado pela primeira vez para designar este sistema.27,28 A açao detergente dos tensoativos é conhecida há séculos, mas o uso doméstico de uma mistura de água, óleo de eucalipto, flocos de sabao e aguarrás (mistura de orgânicos voláteis) data dos primórdios do século 20; já a primeira microemulsao comercial foi a cera líquida,27 que data de 1928. No entanto, o mecanismo pelo qual ocorre a remoçao de resíduos por esses sistemas só foi esclarecido quando o processo de auto-organizaçao dos surfactantes foi progressivamente elucidado. O primeiro registro de um agregado de surfactante em soluçao aquosa remonta ao trabalho de McBain,29 que, em 1913, sugeriu a existência de íons em meio coloidal de palmitato de sódio. Já o modelo esférico de auto-organizaçao micelar dos surfactantes foi proposto em 1936 por Hartley,30 que considerou uma micela como um objeto esférico caracterizado por uma interface carregada constituída pela dupla camada elétrica. Por outro lado, desenvolvimentos importantes sobre as forças intermoleculares, que constituem a base para o conceito do efeito hidrofóbico e da auto-organizaçao dos surfactantes, foram primeiramente publicados em 1923 por Debye e Hückel31 e os primeiros trabalhos sobre a estabilidade de coloides,32-35 entre 1934 e 1948. Estas obras foram a base do livro de Tanford36 "O efeito hidrofóbico: Formaçao de micelas e membranas biológicas" publicado em 1973 e re-editado em 1980, o qual, segundo Clarke37 "... introduz a ideia inicial para a curvatura espontânea da interface polar-apolar e, consequentemente, a forma e o tamanho do agregado supramolecular". Outras descobertas, como a existência de uma organizaçao de longo alcance nos cristais líquidos formados por surfactantes,38 avanços na técnica de difraçao de raios-X a baixo ângulo39 e os estudos de Ekwall e Mandell40,41 sobre sistemas ternários, constituídos por água, surfactante e solvente apolar, deram origem à Escola Escandinava de ciência dos colóides e dos surfactantes, de fundamental importância na área. Modernamente, a auto-organizaçao do surfactante, como proposta por Tanford, baseia-se nos estudos de Israelachvili et al.42 e Mitchell et al.,43 que estabeleceram as restriçoes termodinâmicas, tanto de equilíbrios de energia livre como de forças intermoleculares (reciprocidade entre interaçoes de forças eletrostáticas e de Van der Waals), para a curvatura interfacial dos surfactantes que precede o conceito de auto-organizaçao.
DEFINIÇAO, CONSTITUINTES E TEORIA DE FORMAÇAO DAS MES Definiçao O termo "microemulsao" foi empregado pela primeira vez na literatura em 1959.28 A definiçao mais amplamente aceita considera que esses sistemas representam soluçoes termodinamicamente estáveis, opticamente transparentes e isotrópicas, constituídas de água, óleo e um surfactante.44 Segundo Danielsson e Lindman,44 o termo designa a) soluçao aquosa de um surfactante na qual é solubilizado um lipídeo (microemulsao óleo/água, O/A); b) soluçao nao aquosa de um surfactante na qual é solubilizada água (microemulsao água/óleo, A/O); c) sistemas que apresentam uma transiçao contínua entre soluçao aquosa e soluçao nao aquosa do surfactante (microemulsao bicontínua) e d) sistemas característicos de surfactantes nao iônicos os quais, dependendo da temperatura, podem apresentar uma continuidade tanto com a fase aquosa como com a fase nao aquosa. Nas microemulsoes, a fase dispersa pode adotar diferentes formatos, em funçao das proporçoes dos seus componentes e de fatores físico-químicos,2,45 conforme mostra a Figura 1.
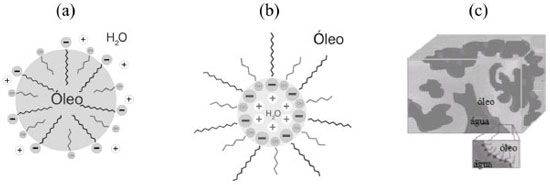 Figura 1. Representaçao esquemática das três microestruturas de microemulsoes mais comumente encontradas: (a) ME óleo em água (O/A) e (b) ME água em óleo (A/O), empregando surfactante aniônico e álcool de cadeia média, e (c) ME bicontínua
No entanto, apesar do progresso contínuo nos campos da ciência e tecnologia das microemulsoes, há equívocos na literatura relacionados ao uso do termo, em razao, principalmente, do prefixo "micro" utilizado para denotar esses sistemas e ao crescente uso do prefixo "nano" para este mesmo fim.46 Outra razao é o fato de haver algumas semelhanças entre as microemulsoes e as nanoemulsoes. Na realidade, as dimensoes que caracterizam as microemulsoes encontram-se nao em escala micrométrica, mas sim em escala nanométrica.47 Ainda, apesar de ambas apresentarem componentes (uma fase aquosa, uma fase oleosa, um agente surfactante e um co-surfactante) e estruturas semelhantes, as microemulsoes diferem das nanoemulsoes por apresentarem maior estabilidade termodinâmica, enquanto as nanoemulsoes sao cineticamente estáveis. Além disso, as proporçoes dos constituintes utilizados sao diferentes (a proporçao de surfactante nas microemulsoes é maior) e podem ou nao apresentar a fase dispersa em formato esférico.46,48 Adicionalmente, microemulsoes sao sistemas translúcidos e apresentam partículas com dimensoes menores do que as formadas nas nanoemulsoes.45 Diferenças marcantes entre microemulsoes e nanoemulsoes estao relacionadas às suas propriedades físicas e físico-químicas, sendo um aspecto relevante a diferença de comportamento dos dois sistemas em relaçao à diluiçao e/ou às variaçoes de temperatura. Estes fatores afetam mais expressivamente as microemulsoes do que as nanoemulsoes, sendo relevante considerá-los segundo a aplicaçao desejada. Por exemplo, no caso de administraçao parenteral de medicamentos, em que ocorre diluiçao pela corrente sanguínea, apenas nanoemulsoes sao adequadas para uso, uma vez que as gotículas permanecem estáveis frente às mudanças ambientais sofridas.45 Por outro lado, com a manutençao da composiçao, as microemulsoes apresentam vantagem pela maior estabilidade temporal.45 Outro ponto fundamental, muitas vezes negligenciado para determinar se um sistema constitui uma nanoemulsao ou uma microemulsao, é a influência da ordem com que os diferentes componentes sao misturados durante a formulaçao. Nas nanomulsoes inicialmente o surfactante é misturado com o óleo, pois a razao óleo/surfactante controla o tamanho da nanoestrutura.45 Por outro lado, uma microemulsao será idêntica, após o tempo de equilíbrio, qualquer que seja a ordem com que os componentes sao misturados. Por fim, observa-se na literatura que o termo "microemulsao" vem sendo utilizado, principalmente, face à consagraçao do termo desde sua introduçao,46,47 ainda que em contradiçao com as dimensoes nanométricas do sistema disperso. Nesta revisao o termo microemulsao designa sistemas termodinamicamente estáveis. Constituintes das microemulsoes Comumente, as microemulsoes sao constituídas de água, óleo, surfactante e, frequentemente, de um co-surfactante. Além de água, soluçoes salinas diversas também podem ser empregadas em seu preparo, como fase aquosa. Dependendo da aplicaçao, esta fase pode conter diversos aditivos, como tampoes, bactericidas e agentes isotônicos.49 Nas microemulsoes denominadas livres de surfactante, a fase óleo é formada por compostos com natureza anfifílica que desempenham, portanto, dupla funçao, dispensando a adiçao suplementar de surfactante.3 A seguir, sao abordadas as características dos componentes das microemulsoes. Agua A água é um solvente anfiprótico neutro estruturado, caracterizado por apresentar auto associaçao entre as moléculas via ligaçao hidrogênio, mantendo a estrutura cristalina do estado sólido a distâncias da ordem de grandeza molecular.50 No estado líquido, as moléculas de água estao ordenadas na forma de "gaiolas", cavidades em cujo interior solutos podem ser retidos sem que haja quebra de ligaçoes de hidrogênio. O volume da cavidade é, aparentemente, variável e ajusta-se ao tamanho da molécula do soluto. Assim, em uma soluçao diluída de um composto hidrofóbico, como por exemplo, n-pentanol, a estrutura do agregado das moléculas de água é realçada e acompanhada de uma diminuiçao da entropia. Com o aumento da concentraçao de solutos aparecem novas estruturas na soluçao aquosa, influenciadas pela natureza daqueles. Embora essas modificaçoes de estrutura nao estejam completamente esclarecidas, elas sao evidenciadas pela alteraçao de propriedades volumétricas como a densidade e a viscosidade.51 Segundo Tanford,36 no estado líquido, as estruturas das moléculas de água em torno de moléculas nao polares devem apresentar distorçoes aleatórias que se sobrepoem às ligaçoes hidrogênio e levam à formaçao de redes poliédricas de moléculas de água. No entanto, ainda que a cadeia apolar de um anfifílico (composto cujas estruturas moleculares apresentam duas regioes, uma polar e hidrofílica e outra apolar e hidrofóbica)52,53 nao dê origem a uma cavidade completamente fechada no solvente, suas propriedades termodinâmicas devem ser semelhantes às de um hidrocarboneto. Assim, a estrutura da água nas cavidades será perturbada por variaçoes de qualquer ordem que ocorram no seu entorno, como por exemplo, a presença de um anfifílico competindo pelas ligaçoes hidrogênio entre as moléculas de água. A piscina de água no núcleo de micelas reversas de bis (2-etil) sulfossucinato (AOT) foi investigada por Bharat Baruah et al.54 A formaçao de micelas reversas e a solubilizaçao da água no solvente foram evidenciadas em um sistema água/AOT/iso-octano, mostrando estruturas de água cercada por grupos polares do surfactante. Variando a quantidade de água ([H2O] / [AOT]) varia também o tamanho da piscina de água no interior das micelas. Para micelas pequenas, as características físicas da água intramicelar diferem substancialmente das da água pura. No entanto, quando o tamanho da piscina de água aumenta, as propriedades da água intramicelar se aproximam das propriedades da água pura. Estes exemplos evidenciam que as propriedades físicas e químicas da água contribuem, juntamente com as dos tensoativos, co-tensoativos e óleos para definir as características das microemulsoes. Oleos O tamanho da cadeia alquílica do óleo influencia fortemente a distribuiçao do co-surfactante nas fases óleo e água, bem como a composiçao e as propriedade físico-químicas das microemulsoes.52,55 Relatos da literatura mostram que, em presença de surfactantes nao iônicos e catiônicos, a partiçao do álcool (co-surfactante) na interface das gotículas é favorecida pelo emprego de óleos com cadeias carbônicas longas.52,55 As substâncias mais empregadas como fase oleosa sao: n-alcanos, em geral com cadeias contendo de 6 a 12 átomos de carbono; compostos aromáticos, como benzeno e tolueno;52,56 álcoois de cadeia média, como octanol e decanol;56 ainda, substâncias como ácidos graxos e triacilgliceróis também sao exemplos de fase oleosa em microemulsoes.57 No preparo de microemulsoes biocompatíveis os óleos totalmente apolares, como triacilgliceróis de cadeia média ou longa sao preferidos ao invés de óleos com certa polaridade, pois solubilizam melhor os princípios ativos. Os óleos vegetais, como o de soja e rícino, também sao bastante usados.10,11,12,25,52 Para aplicaçoes em alimentos, álcoois e ácidos graxos, acilglicerois e óleos vegetais representam bons exemplos de componentes possíveis de serem utilizados. Surfactantes Surfactantes ou tensoativos sao compostos anfifílicos, orgânicos ou organometálicos, ou seja, substâncias caracterizadas pela presença em suas estruturas moleculares de duas regioes, uma polar e hidrofílica e outra apolar e hidrofóbica,52,53 que possibilitam a interaçao entre meios que apresentam polaridades diferentes como, por exemplo, água e óleo. Os representantes mais importantes desse tipo de sistema sao as moléculas de surfactantes e alguns polímeros.58,59 No entanto, nem todo anfifílico é surfactante. Para isso, é necessário haver certo equilíbrio entre a hidrofobicidade e a hifrofilicidade da molécula.60 A estrutura dos surfactantes iônicos, de uma forma geral, pode ser expressa como R-X, na qual R é uma cadeia de hidrocarboneto variando de 8-18 átomos (normalmente linear) e X é o grupo cabeça (polar ou iônico). Dependendo da natureza de X, os tensoativos podem ser classificados como nao iônicos, catiônicos, aniônicos ou anfóteros.53,61 Um surfactante catiônico apresenta, em geral, a fórmula RnXm+Ym-, na qual R representa uma ou mais cadeias hidrofóbicas, X é um elemento ou um grupo de elementos capaz de formar uma estrutura catiônica e Y é um contra íon. Em princípio, X pode ser N, P, S, As, Te, Sb, Bi ou um halogênio.62 Os sais de amônio quaternário formam uma das classes mais conhecidas de surfactantes catiônicos, como por exemplo: brometo de cetiltrimetil amônio (CTAB), brometo de dodeciltrimetil amônio (DTAB), cloreto de cetilpiridínio (CICP) e cloreto de benzalcônio (BKC).63,64 Entre os surfactantes aniônicos mais frequentemente utilizados estao os sais de ácidos carboxílicos (graxos), monopróticos ou polipróticos, com metais alcalinos ou alcalino-terrosos e ácidos como sulfúrico, sulfônico ou fosfórico, contendo um substituinte de hidrocarboneto saturado ou insaturado. Exemplo destes surfactantes sao: dodecil sulfato de sódio (SDS), dodecil benzeno sulfonato de sódio (DDBS), bis (2-etil hexil) sulfosuccinato sódico (Aerossol OT) e di-hexadecil fosfato (DHF)64 e os sais biliares como colato de sódio (CS) e deoxicolato de sódio (SDC).65 Os surfactantes anfóteros apresentam ambos os grupos, aniônico e catiônico e, dependendo do pH da soluçao e da estrutura química, pode prevalecer tanto a espécie aniônica como a catiônica ou a neutra. Os tensoativos anfóteros mais comuns incluem N-alquil e C-alquil betaína e sultaína, como também álcool amino fosfatidil. Exemplos desta categoria sao: 3-(dodecildimetil amônio) propano-1-sulfato (SB-12), 4-(dodecildimetil amônio) butirato (DAB), bem como diversas lecitinas.64,66 Os tensoativos nao iônicos sao derivados do polioxietileno e polioxipropileno (de compostos com alquil fenol e álcool, ésteres de ácidos graxos, alquilaminas, amidas e mercaptanas) ou polialcoois, ésteres de carbohidratos, amidas de álcoois graxos e óxidos de amidas graxas. Exemplos destes compostos sao: polioxietileno (9-10) p-tercotil fenol (Triton® X-100), polioxietileno (23) dodecanol (Brij® 35), polioxietileno-10-dodecil éter (C12E10), polioxidoetileno-10-oleil éter (C18:1E10 ou Brij® 97), N,N-dimetildodecilamina-N-óxido (DDAO) e N,N-dimetiloctilamina-N-óxido (DOAO), polissorbatos, como polioxietileno (20) mono-oleato de sorbitano (Tween® 80) e polioxietileno (20) monoestearato de sorbitano (Tween® 60).64,67 Já entre os surfactantes usados no preparo de microemulsoes biocompatíveis citam-se os fosfolipídios (lecitinas), que podem ser administrados a pacientes por via parenteral, cutânea, oral ou ocular. Triton® X-100, Span® 20, Tween® 80 e Tween® 60 também sao outros exemplos de surfactantes fisiologicamente aceitáveis.68,69 Cabe considerar que os surfactantes anfóteros, como as lecitinas e os nao iônicos, como alguns polissorbatos, os ésteres de ácidos graxos e de carbohidratos, bem como os monoglicerídeos, mostram boas potencialidades para aplicaçoes em microemulsoes alimentares. Mais detalhes sobre estas aplicaçoes e características estruturais destes compostos serao abordadas no item "aplicaçoes de microemulsoes em alimentos". As principais características do uso de surfactantes estao relacionadas à formaçao de ambientes organizados.62 Em funçao da presença dos grupos hidrofílico e hidrofóbico na mesma molécula, os surfactantes tendem a se distribuir nas interfaces entre fases fluidas com diferentes graus de polaridade (óleo/água e água/óleo). A formaçao de um filme molecular ordenado nas interfaces reduz a tensao interfacial e superficial, que é a responsável pelas propriedades únicas dos surfactantes.53 Desta maneira, é possível formar microemulsoes do tipo água em óleo (A/O) ou óleo em água (O/A), as quais sao definidas principalmente pelo equilíbrio entre as partes polar e apolar da molécula do surfactante, denominado tecnicamente de balanço hidrofílico-lipofílico (BHL).70,71 O BHL é numericamente representado em uma escala de valores, introduzida para caracterizar os tensoativos nao iônicos, em funçao do tamanho da cadeia polar do surfactante; valores inferiores a dez indicam a predominância da parte apolar, tornando-os adequados para o preparo de microemulsoes do tipo A/O: por outro lado, valores superiores a dez apontam a prevalência da regiao polar, indicando o emprego dessas substâncias na obtençao de microemulsoes O/A.62,63 Surfactantes iônicos como dodecil sulfato de sódio, que apresentam BHL maior do que 20, frequentemente requerem a presença de um co-surfactante para reduzir o BHL efetivo, o que possibilita o enquadramento dentro da faixa requerida para a formaçao de microemulsoes.63 Apesar do recurso do balanço hidrofílico-lipofílico, é muito difícil prever com exatidao quais combinaçoes de surfactante/co-surfactante e óleo serao capazes de produzir microemulsoes. Além disto, o método do BHL nao considera os efeitos da temperatura, da presença de eletrólitos no meio e da contribuiçao dos outros constituintes, além de falhar ao predizer a quantidade de surfactante necessária e apresentar limitaçoes para os tensoativos iônicos.62,68,72 Co-surfactantes Os co-surfactantes sao responsáveis pela reduçao adicional da tensao interfacial, necessária para a formaçao e estabilidade termodinâmica das microemulsoes, além de promoverem a fluidificaçao do filme interfacial formado pelo surfactante, que impede a elevaçao significativa da viscosidade do sistema.52 Adicionalmente, a presença de um álcool pode influenciar a solubilidade das fases aquosa e oleosa, devido à sua partiçao entre ambas.12,63 Por outro lado, a repulsao das cargas dos grupos polares nos surfactantes iônicos impede a existência de um empacotamento eficiente, já que a tensao superficial nao está suficientemente reduzida. A adiçao de um co-surfactante reduz a tensao superficial do sistema a quase zero, levando à formaçao de uma camada interfacial mais estável e, consequentemente, aumenta a estabilidade das microemulsoes.52,73 Os principais co-surfactantes utilizados no preparo de microemulsoes sao álcoois e glicois, de massa molecular pequena ou média, que apresentam uma cadeia contendo entre dois e dez carbonos.52,73,74 Os álcoois mais usados sao: 1-butanol, 2-butanol, 2-metil-1-butanol, 1-pentanol e 1-hexanol.12,65 Entretanto, destaca-se que para emprego em sistemas alimentares, o etanol e alguns glicois sao os que apresentam menores restriçoes. Há três teorias que explicam a formaçao de uma microemulsao: a teoria da solubilizaçao, a teoria da tensao interfacial e a teoria termodinâmica. Esta última descreve mais claramente o comportamento das microemulsoes. Sendo assim, a formaçao e estabilidade desses sistemas têm sido suficientemente explicadas com base na termodinâmica.63 A transformaçao de um sistema em uma microemulsao (assim como qualquer processo) é acompanhada pela variaçao da energia livre de Gibbs, ΔG. Numericamente, essa funçao prediz a tendência da sua espontaneidade. Um processo espontâneo ocorrerá na direçao da diminuiçao da energia livre do sistema, ou seja, o processo será espontâneo quando ΔG < 0.75 A energia livre de formaçao de uma microemulsao (ΔGf) pode ser representada como ΔGf = γ ΔA − T ΔS. Nessa equaçao, ΔGf depende da capacidade do surfactante de reduzir a tensao superficial na interface água-óleo (γ), da variaçao da entropia (ΔS) do sistema (neste caso, entropia de dispersao) e da variaçao da área superficial da gotícula (ΔA), à temperatura (T) constante. A formaçao de uma microemulsao é acompanhada por um grande aumento da entropia (S) do sistema e (pela formaçao de um grande número de gotículas, ao mesmo tempo, da ΔA (em funçao do aumento da área superficial das gotículas). A tensao superficial será, portanto, o principal parâmetro que definirá a formaçao da microemulsao, devendo, assim, apresentar um valor baixo (no caso de gotículas maiores, pela otimizaçao do balanço hidrofílico-lipofílico). Na maioria dos casos faz-se necessário o uso de surfactantes e co-surfactantes para minimizar a tensao superficial da gotícula. Neste caso, observadas as concentraçoes suficientes desses agentes, o processo será termodinamicamente espontâneo e estável.63 Deve-se recordar que ΔG é um parâmetro físico-químico que prevê apenas se o processo ocorrerá espontaneamente, mas nao com que rapidez ele ocorre. De fato, o processo de formaçao de microemulsoes é tao lento, devido à ocorrência de barreiras cinéticas e/ou transporte de massa que, na prática, ele nao é consolidado. A fim de se superar tais barreiras, aplica-se energia ao sistema, tal como, energia mecânica ou térmica.46 Diagrama de fases Formulaçoes de microemulsoes sao geralmente desenvolvidas utilizando diagramas de fase pseudoternários.76 Por meio deles, é possível identificar os componentes mais adequados e suas proporçoes relativas para a obtençao de sistemas fisicamente estáveis.76 Diagramas de fases pseudoternários apresentam a forma de um triângulo equilátero, sendo representados nos vértices cada um dos componentes, e em cada um dos lados as variaçoes nas concentraçoes dos componentes (de 0 a 100%). Sua análise possibilita encontrar as regioes de transiçao entre emulsoes, fases separadas e microemulsoes O/A e A/O e, consequentemente, determinar as concentraçoes mínimas de cada componente para obter uma microemulsao.77 A formulaçao ideal de uma microemulsao corresponde àquela necessária para que o sistema resultante tenha as propriedades físico-químicas desejadas, tais como viscosidade, estabilidade, pH e área específica da fase dispersa, com aplicaçao eficiente do ponto de vista tecnológico76,77 e, evidentemente, que demande custos mínimos.78 A Figura 2 apresenta um diagrama de fases típico de uma mistura pseudoternária composta por água, óleo, surfactante e co-surfactante. Por meio destes diagramas os autores avaliaram a influência da concentraçao de etanol (co-surfactante) sobre a eficiência do surfactante, na formaçao de microemulsoes de triacilgliceróis formados por ácidos graxos de cadeia média em água (O/A), e verificaram que, quanto maior a concentraçao de etanol no sistema, menor a quantidade do surfactante necessária, e que a microemulsao se formava somente na presença do co-surfactante.79
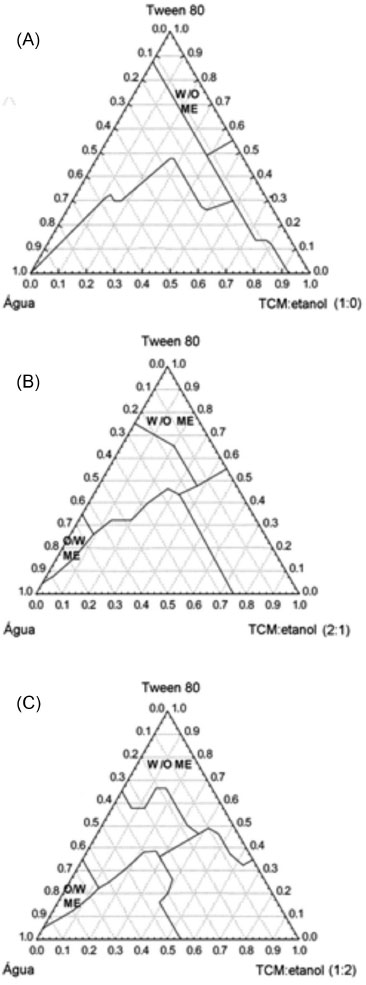 Figura 2. Diagramas de fases de diferentes sistemas pseudoternários (A, B e C), demonstrando a influência da concentraçao de um co-surfactante (etanol, neste caso) sobre as regioes de formaçao de microemulsoes óleo em água (O/A ME) e água em óleo (A/O ME). TCM: triglicerídeos de cadeia media79
A construçao desses gráficos requer o delineamento de um amplo número de amostras, resultando numa tarefa demorada, o que torna necessária a busca de métodos alternativos que contornem tais problemas e que, ao mesmo tempo, sejam tao eficientes quanto o método tradicional. Sugeriu-se, entao, o método do "Desenvolvimento Experimental de Misturas", em que formulaçoes com diferentes balanços de massa sao submetidas à análise de superfície de resposta.76 A resposta, ou seja, a intensidade do parâmetro que se busca no sistema, é uma funçao das proporçoes dos diferentes componentes na mistura. O resultado é expresso em um mapa de superfície de resposta e, a partir de sua análise, é possível identificar as proporçoes de cada componente e as condiçoes que resultem em um sistema com as características tecnológicas mais adequadas.80 Essa metodologia, como instrumento para se determinar regioes estáveis de microemulsoes foi aplicada pela primeira vez em 2011, demonstrando eficácia, semelhantemente à metodologia de diagrama de fases. Neste caso, a principal vantagem observada foi a rapidez na definiçao das melhores proporçoes dos componentes para obter um sistema estável, além de economia no delineamento experimental, já que o número necessário de amostras é significativamente menor.76
APLICAÇOES DE MICROEMULSOES EM ALIMENTOS Determinadas etapas de fabricaçao de alimentos requerem comumente a solubilizaçao de ingredientes lipofílicos, dada a sua importância nutricional e funcional (do ponto de vista fisiológico e tecnológico), tais como vitaminas lipossolúveis, ácidos graxos essenciais e carotenoides, aditivos de baixa polaridade, representados por aromas, corantes, conservantes e antioxidantes.15,19,46,81 Sabe-se, entretanto, da dificuldade enfrentada pela indústria em incorporar esses ingredientes em formulaçoes de caráter preponderantemente hidrofílico. Outros problemas enfrentados pela indústria sao a baixa estabilidade química desses compostos, já que muitos deles sao importantes substratos às reaçoes oxidativas,82 e a necessidade de métodos químicos de análise altamente sensíveis, de baixo custo, rápidos e ambientalmente corretos.9 Esses entraves revelam-se como razoes para se aplicar a tecnologia de microemulsoes à área de alimentos.14,83 O interesse em aplicar microemulsoes à indústria de alimentos é recente, quando comparado a outros campos, tal como a indústria farmacêutica. Data do início da década de 1990, quando se discutiam "As microemulsoes de grau alimentício e emulsoes".19 Ao longo desses anos, as pesquisas se concentraram na busca de melhorar a solubilizaçao e a estabilidade de ingredientes, problemas diariamente enfrentados por essa indústria. O que chama atençao, porém, é que, apesar de mais de duas décadas de estudos, há um número limitado de trabalhos em que se avalia o comportamento dessas microemulsoes em sistemas alimentares propriamente ditos. Ao invés disso, utilizam-se sistemas com uma composiçao controlada e com propriedades físico-químicas que, em muitos casos, nao se aproximam daquelas que caracterizam muitos alimentos.13,19,84,85 No entanto, nao se pode contestar o mérito desses trabalhos, muitos deles inéditos, e que têm servido e servirao como fundamentos para o estudo sobre o comportamento de microemulsoes em alimentos. A seguir serao apresentadas as potencialidades apontadas até o momento. Solubilizaçao e estabilidade de nutrientes e compostos bioativos Microemulsoes do tipo O/A têm demonstrado ser um eficiente veículo para a incorporaçao de nutrientes lipofílicos em sistemas aquosos, devido ao aumento de solubilidade que proporcionam.17 Estudos têm relatado a adiçao de vitamina E,12,14 retinol,43 óleo de peixe e ômega 3,15,58 beta-caroteno86 e outros carotenoides nestes sistemas.86,87 A solubilidade e estabilidade de compostos bioativos e de vitaminas em microemulsoes têm sido estudadas. Licopeno pode ser solubilizado em concentraçao até 10 vezes maior em microemulsao, comparativamente a sua dissoluçao em sistema estritamente lipofílico.64 Foi também demonstrado que a estabilidade do composto foi aumentada: quando microemulsionado apresentou percentual de degradaçao entre 34,5 a 52%, após 72 dias de armazenamento, enquanto que, no mesmo período, o controle (licopeno nao microemulsionado) apresentou 100% de degradaçao.88 Em água, a solubilidade da luteína nas formas nao esterificada ou esterificada é menor que 10 ppm; em contrapartida, a capacidade de solubilizaçao desse carotenoide em uma microemulsao chegou a 1520 ppm (forma esterificada) e 390 ppm (forma nao esterificada) em um sistema com 64% de fase hidrofílica composta por água e glicerol.87 A adiçao de curcumina, pigmento amarelo natural, oriundo do açafrao da India (Curcuma longa L.), foi possível em uma microemulsao do tipo O/A contendo água, oleato de etila (fase oleosa) e Tween® 80 + lecitina (ambos surfactantes), até a concentraçao de 4,1 mg mL-1.20 Uma microemulsao de vitamina E, do tipo O/A, contendo água, butirato de etila (fase oleosa), polioxil 35 (surfactante) e etanol (co-surfactante), apresentou estabilidade física e resistência a variaçoes da temperatura, sendo indicada como um potencial veículo de liberaçao desta vitamina em alimentos.18 Demonstrou-se também que a estabilidade oxidativa da vitamina E é ampliada quando esta é preparada na forma de microemulsao (O/A), obtida com o uso de surfactantes nao iônicos (polioxietileno mono-n-alquil éter - ClOEX e CllEX), comparativamente a emulsoes obtidas com surfactante aniônico (dodecil sulfato de sódio - SDS); no preparo destes sistemas adicionou-se a vitamina E em soluçoes aquosas dos surfactantes, alternando-se a concentraçao do tensoativo, o tipo e o tempo de agitaçao, sendo o acompanhamento da estabilidade da vitamina E realizado por espectroscopia de absorçao molecular no UV, entre 200 e 400 nm.16 Recentemente, relatou-se a solubilizaçao de até 25% de óleo de peixe em microemulsao com liberaçao controlada do tipo O/A, contendo água, oleato de etila como fase oleosa e Tween® 80 como surfactante. O sistema proporcionaria um possível aumento da estabilidade à oxidaçao e da biodisponibilidade, bem como o mascaramento do off-flavor, efeito sensorial típico de óleo de peixe.81 Microemulsoes do tipo A/O compostas de ômega 3 de óleo de peixe (na forma de etil ésteres e triglicerídeos), propilenoglicol e Tween® 80 apresentaram elevada solubilidade em água, reforçando o potencial das microemulsoes como um sistema de liberaçao dessas substâncias bioativas em alimentos.19 Apesar dessas vantagens, sao extremamente escassos os estudos sobre microemulsoes aplicadas a ácidos graxos insaturados, tais como ácidos graxos essenciais85 e óleo de peixe.81 Liberaçao de compostos flavorizantes e conservantes A tecnologia de microemulsoes têm sido aplicada à solubilizaçao de aditivos alimentares lipofílicos.15 Além da solubilizaçao, outras vantagens foram relatadas, tais como racionamento e substituiçao de solventes em preparaçoes de aromas,13 estabilidade química de flavorizantes89 e aumento da eficiência de antimicrobianos.22-24 Estudos sobre microemulsoes aplicadas a compostos flavorizantes têm se concentrado na solubilizaçao de óleos cítricos, importantes flavorizantes utilizados na indústria de bebidas.15 Outros compostos flavorizantes, tais como óleo de menta90 e aroma de banana13 foram estudados. Apesar de escassos, esses estudos sugerem que essas aplicaçoes resultam no aumento da estabilidade química, diminuiçao de perdas por volatilizaçao desses compostos90 e reduçao do uso de solventes, necessários à sua solubilizaçao.13 Quanto ao aumento da atividade antimicrobiana de conservantes em microemulsoes, a literatura reporta testes realizados com monolaurato de glicerol22,24 e lactato de sódio,24 importantes aditivos utilizados em alimentos. Esses aditivos apresentaram maior atividade antimicrobiana quando incorporados em microemulsoes do que na sua forma livre.22,24 Tal efeito pode estar relacionado à sua maior solubilizaçao e difusao e, consequentemente, maior contato com os micro-organismos.23,24 Sugeriu-se, também, que esse incremento é resultante da induçao de alteraçoes na permeabilidade da membrana plasmática do micro-organismo pelo surfactante, melhorando a adsorçao do antimicrobiano na superfície celular.22 Além do surfactante, álcoois utilizados como co-surfactante na formulaçao dessas microemulsoes contribuem para induzir modificaçoes estruturais e funcionais na membrana. Entretanto, sugerem-se estudos mais aprofundados quanto à contribuiçao de surfactantes e co-surfactantes sobre a atividade antimicrobiana de microemulsoes.90 Microemulsoes como sistemas antimicrobianos A atividade antimicrobiana de microemulsoes foi relatada na década de 1980, apesar de, nesse período, existirem poucas evidências que apoiassem tal teoria. Sugeriu-se, entao, o desenvolvimento de pesquisas que fundamentassem esse fenômeno, sendo os sistemas farmacêuticos inicialmente utilizados como modelo91 e, mais recentemente, sistemas alimentícios. Apesar de um pequeno número de estudos,92,93 tem-se comprovado a eficácia das microemulsoes contra uma gama de micro-organismos de interesse da saúde pública, incluindo bactérias, bolores e leveduras.92-96 A atividade antimicrobiana de microemulsoes O/A à base de água, oleato de etila, Tween® 80 e álcoois de baixo peso molecular (pentanol ou ciclo-hexanol) foi testada contra uma cultura de Pseudomonas aeruginosa e de Staphylococcus aureus, tendo-se verificado que o sistema foi altamente eficaz contra ambas as culturas, resultando numa reduçao de 90% da populaçao por um tempo de 15 s. Esses resultados sugerem que as microemulsoes sao agentes antimicrobianos altamente eficazes que atuam sobre a integridade estrutural da membrana plasmática causando sua desestruturaçao.92 Os autores estenderam os estudos desse efeito à formaçao de biofilmes de Pseudomonas aeruginosa, observando a diminuiçao dessa capacidade,95 sendo o foco desses estudos direcionados inicialmente para preparaçoes farmacêuticas e cosméticas.92,95 Mais tarde, a partir de 2007, esses estudos passaram a ser voltados para a indústria de alimentos. O mesmo sistema de microemulsao92 foi também testado contra micro-organismos comumente encontrados em alimentos e em equipamentos de processamento de alimentos, tais como Salmonella spp., Escherichia coli 0157:H7, Staphylococcus aureus e Listeria monocytogenes, e para impedir a formaçao de biofilmes de Salmonella typhimurium, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus e Listeria monocytogenes. Imediatamente após a exposiçao desses patógenos aos sistemas, houve uma reduçao de 99% da viabilidade, confirmando a alta atividade antimicrobiana. Em relaçao ao potencial de diminuir a formaçao de biofilmes, verificou-se que as microemulsoes reduziram aqueles formados por Salmonella typhimurium, Escherichia coli, Pseudomonas aeruginosa e Staphylococcus aureus, enquanto que o biofilme formado por Listeria monocytogenes apresentou resistência.93 A avaliaçao antimicrobiana de microemulsoes demonstrou que esses sistemas apresentaram eficiência semelhante à de agentes antimicrobianos convencionalmente utilizados na indústria de alimentos.94 Como citado anteriormente, a açao antimicrobiana das microemulsoes parece ocorrer em nível da membrana plasmática das bactérias.92,94,97 Provavelmente, a interaçao entre a microemulsao e a referida membrana resulta na desestruturaçao da sua bicamada fosfolipídica, afetando, assim, sua fluidez, o que levaria à morte celular.97 A exposiçao de micro-organismos a esses sistemas causa aumento da permeabilidade da membrana plasmática e da sua hidrofilicidade, conduzindo à perda de soluto para o meio extracelular94,97 e à consequente perda de viabilidade bacteriana.97 O surfactante e o co-surfactante, componentes das microemulsoes, parecem ser os responsáveis pelo aumento da permeabilidade da membrana,24,91 apesar de ainda haver poucas evidências nesse sentido.91 Quanto ao mecanismo de açao contra fungos, tem-se observado resultado semelhante ao que ocorre em bactérias. No entanto, estudos evidenciam que o efeito antimicrobiano contra fungos é menor. A ruptura e disfunçao das membranas biológicas e paredes celulares foi observada em estudos com fungos, resultando em perda de conteúdo celular (C. albicans, A. niger e P. expansum), semelhantemente ao que foi observado para bactérias.94 Um recente estudo propôs como mecanismo de açao a perturbaçao e disfunçao da estrutura da membrana citoplasmática, seguindo-se modificaçoes da parede celular, coagulaçao do citoplasma, interrupçao do metabolismo intracelular e morte celular.96 Aplicaçoes de microemulsoes na análise química de alimentos Dados na literatura revelam que uma das razoes pelas quais as microemulsoes têm sido aplicadas em análise de alimentos é devido ao aumento da sensibilidade de métodos analíticos, tais como métodos espectrométricos9,97,98 e cromatográficos.99-101 Esse fato está relacionado à capacidade com que microemulsoes conseguem extrair o analito da amostra, de modo mais eficientemente do que solventes convencionalmente usados para esse fim e/ou sem o uso de qualquer procedimento em condiçoes drásticas (tais como altas temperaturas ou meio ácido) ou demorados,9 que resultam em menores perdas do analito por evaporaçao ou destruiçao térmica (no caso de compostos termolábeis).102 O uso de microemulsoes como método de separaçao do analito dispensa quaisquer outros procedimentos anteriores de pré-tratamento da amostra, implicando em menores fontes de erro.10,11,101 A análise, assim, torna-se simples e rápida, além de dispensar o consumo de solventes orgânicos como diluentes.9 Ao contrário destes, os componentes que constituem as microemulsoes representam menor impacto ambiental, já que, geralmente, sao de baixo custo, biodegradáveis, atóxicos e menos inflamáveis.9,101 O preparo de amostras na forma de microemulsao tem possibilitado o aumento da sensibilidade, otimizaçao e reprodutibilidade de análises de traços de metais e aditivos em óleos vegetais,9,10,11,101 metais em chocolates101 e contaminantes, aditivos e compostos bioativos em bebidas.100,102 Cabe considerar que muitas das limitaçoes do emprego de microemulsoes na área de alimentos, especialmente para fins tecnológicos, sao dadas pelas restriçoes impostas aos ingredientes e suas quantidades, que devem ser adequados ao consumo humano. Neste contexto, verifica-se um aumento recente nas pesquisas aplicando compostos que cumpram estes requisitos. Como exemplo citam-se o emprego de fosfolipídios,20,78,103 ésteres de sacarose,13,83,104 ésteres de ácidos graxos,105 monoglicerídeos,105 polissorbatos,78,79,105 compostos derivados de óleos naturais e saponinas,53 que atuam eficientemente como surfactantes, além de propilenoglicol, ácidos graxos de cadeia média, citronelol e limoneno, que podem atuar com êxito como co-surfactantes.103,106 Os fosfolipídeos ou lecitinas, polissorbatos, alguns ésteres de ácidos graxos, acilgliceróis e ésteres de sacarose (Tabela 1), sao aprovados como aditivos ou ingredientes por órgaos regulamentadores de referência mundial como Food and Drug Administration (FDA) e Autoridade Europeia para a Segurança dos Alimentos (AESA), bem como pela Agência Nacional de Vigilância Sanitária (ANVISA). Pela legislaçao brasileira, com exceçao dos polissorbatos e dos ésteres de sacarose, os demais surfactantes citados, em grande parte dos produtos alimentícios, podem ser utilizados em quantidade necessária para se alcançar o efeito desejado (qsp).107-109
Entretanto, a quantidade de surfactante requerida para estabilizar microemulsoes em sistemas alimentícios, propriamente ditos, tem sido raramente discutida nas pesquisas levantadas. Portanto, essas informaçoes práticas merecem ser mais exploradas. Salienta-se que os estudos têm reportado o comportamento de microemulsoes em sistemas com uma composiçao controlada e com propriedades físico-químicas que, em muitos casos, nao se aproximam daquelas que caracterizam muitos alimentos.13,19,84,85
OUTRAS APLICAÇOES DAS MICROEMULSOES As microemulsoes preparadas com componentes biocompatíveis têm sua principal aplicaçao nas indústrias farmacêutica e de cosméticos. A utilizaçao das microemulsoes na tecnologia farmacêutica é relativamente recente e tem despertado grande interesse como sistema de liberaçao de drogas no organismo.52,68,73,110,111 Este interesse justifica-se, entre outras razoes, pelas facilidade de sua preparaçao e por apresentarem elevadas taxas de difusao e penetraçao na pele além da maximizaçao da estabilidade dos fármacos e cosméticos na estocagem.5 A principal desvantagem das microemulsoes em relaçao às emulsoes é a utilizaçao de concentraçoes elevadas de surfactantes e co-surfactantes, possibilitando a ocorrência de irritaçao local.52 Entretanto, esta limitaçao varia dependendo do uso pretendido para a preparaçao em questao, havendo maior disponibilidade de substâncias para produtos que visam a administraçao cutânea, sendo mais restritivas as aplicaçoes parenterais e oftálmicas.73 Entre as demais aplicaçoes importantes das microemulsoes, citam-se as análises de combustíveis, biocombustíveis e lubrificantes, evidenciadas pela estabilizaçao da amostra na determinaçao de, por exemplo: metais em gasolina;112 análise direta de Cd, Pb e Tl em biodiesel;113 estudos eletroanalíticos para monitoramento da estabilidade de biocombustíveis114 e na extraçao de petróleo, baseada na baixa tensao interfacial e boa propriedade emoliente das microemulsoes, que aumenta consideravelmente a mobilizaçao das gotículas de óleo aprisionadas nos poros dos reservatórios.115 Destaca-se também: a extraçao líquido-líquido e extraçao em duas fases de metais nobres de minérios com baixo teor, com extratores orgânicos dissolvidos na microemulsao;5,116 pesquisa de poluentes ambientais em amostras de solo e efluentes, por extraçao com microemulsoes;117 emprego como aditivos em lubrificantes e óleos de corte. Neste caso, dois efeitos benéficos sao potencializados, a inibiçao na corrosao, em funçao da presença do surfactante, e a elevaçao da capacidade térmica sem alterar a estabilidade termodinâmica do meio, devido ao incremento do conteúdo de água proporcionado pelas microemulsoes. O primeiro sistema utilizado para esta finalidade foi patenteado em 1930,5 sendo empregado em processos de limpeza de tecidos ou superfícies sólidas, em razao da baixa tensao interfacial favorecer a remoçao de contaminantes57,71,73 com ótimos resultados, bem como a melhoria na qualidade dos processos de tingimento e acabamento têxtil, devido a fatores como economia de corante, maior fixaçao e uniformidade do tingimento.118 Já nas áreas de produçao de nanopartículas de materiais como metais, supercondutores, materiais magnéticos e fotográficos, látex, entre outros, utilizando microemulsoes como nanoreatores,119-123 estudos vêm sendo desenvolvidos desde a década de 80. Por outro lado, devido à estrutura polifásica, microemulsoes quando usadas como fase móvel representam uma ferramenta poderosa para a cromatografia líquida. O uso de microemulsao como eluente fornece um sistema de partiçao adicional, representado pelas gotículas de microemulsao e o meio contínuo e, portanto, oferece maior capacidade de separaçao dos componentes da mistura. Por exemplo, no caso de microemulsao óleo em água, as substâncias insolúveis em água irao se distribuir e solubilizar nas gotículas de óleo, enquanto as substâncias hidrofílicas permanecerao na fase aquosa contínua. Vemić e colaboradores estudaram os aspectos físico-químicos que regulam a partiçao de Pramipexol e sua impurezas por cromatografia líquida, utilizando microemulsao como fase móvel, e observaram que a retençao de impurezas foi influenciada pela composiçao da fase móvel.124
CONSIDERAÇOES FINAIS As numerosas aplicaçoes, bem como o aumento do número de grupos de pesquisa engajados no estudo de microemulsoes, demonstram sua importância em muitos ramos da química, com uma expectativa de intensificaçao de seu uso em um futuro próximo. A aplicaçao de microemulsoes na ciência e tecnologia de alimentos é temática bastante sugerida pela literatura, porém a maior parte dos trabalhos testando essas aplicaçoes reporta dados incompletos, ou mesmo parciais, evidenciando a necessidade de novos estudos. A influência de parâmetros físico-químicos, tais como temperatura, composiçao química, concentraçao, salinidade, condutividade elétrica, pressao osmótica e pH sobre a estabilidade de microemulsoes tem sido relatada na literatura, entretanto, em condiçoes diferentes das encontradas nos alimentos. Neste caso, uma vez fazendo parte das formulaçoes, as microemulsoes devem resistir às diferentes variaçoes físicas e químicas que um produto pode experimentar ao longo das etapas de processamento, tais como flutuaçoes de pressao e temperatura, forças mecânicas de agitaçao, fluxo e vibraçoes, variaçoes no pH, força iônica, interaçoes entre ingredientes, exposiçao ao oxigênio e a micro-organismos. Há, portanto, a necessidade de se verificar a influência de diferentes operaçoes unitárias sobre a estabilidade e comportamento de microemulsoes quando essas se encontram dissolvidas em alimentos. Do ponto de vista de segurança alimentar, a aplicaçao de microemulsoes em alimentos requer o uso de ingredientes de grau alimentício. Esse fato é bastante desafiador, visto que raros sao os surfactantes e co-surfactantes biocompatíveis disponíveis no mercado. Buscando-se contornar esse problema, houve, ao longo dos últimos anos, um crescente número de pesquisas sobre a aplicaçao de novos ingredientes com essas funçoes. Adicionalmente, merecem atençao estudos que esclareçam melhor o mecanismo de açao de microemulsoes e de conservantes microemulsionados como agentes antimicrobianos, que elucidem o sinergismo entre microemulsoes e conservantes alimentares, e que demonstrem a estabilidade de nutrientes e aditivos alimentares microemulsionados frente a diferentes variáreis. A soluçao desses questionamentos é fundamental à otimizaçao da aplicaçao de microemulsoes no desenvolvimento e processamento de produtos alimentícios.
AGRADECIMENTOS Ao CNPq e à FAPERGS.
REFERENCIAS 1. Solans, C.; Pons, R.; Kunieda, H.; Industrial Applications of Microemulsions, Dekker: New York, 1997. 2. Fanun, M.; Curr. Opin. Colloid Interface Sci. 2012, 17, 306. DOI: http://dx.doi.org/10.1016/j.cocis.2012.06.001 3. Xu, J.; Yin, A.; Zhao, J.; Li, D.; Hou, W.; J. Phys. Chem. B 2013, 117, 450. DOI: http://dx.doi.org/10.1021/jp310282a PMID: 23231078 4. Gullón, J. S.; Montiel, V. R.; Clavilier, A.; J. Electroanal. Chem. 2003, 554-555, 273. DOI: http://dx.doi.org/10.1016/S0022-0728(03)00214-6 5. Schwuger, M. J.; Schomäcker, R.; Chem. Rev. 1995, 95, 849. DOI: http://dx.doi.org/10.1021/cr00036a003 6. Klier, J.; Tucker, C. J.; Kalantar, T. H.; Green, D. P.; Adv. Mater 2000, 12, 1751. DOI: http://dx.doi.org/10.1002/1521-4095(200012)12:23<1751::AID-ADMA1751>3.0.CO;2-I 7. Gradzielski, M.; Hoffmann, H.; J. Phys. Chem. 1994, 98, 2613. DOI: http://dx.doi.org/10.1021/j100061a019 8. Romero, J. S. E.; Afonso, E. F. S.; Alvarez-Coque, M. G. G.; Ramos, G. R.; Anal. Chim. Acta 1990, 235, 317. DOI: http://dx.doi.org/10.1016/S0003-2670(00)82089-9 9. Burguera, J. L.; Burguera, M.; Talanta 2012, 96, 11. DOI: http://dx.doi.org/10.1016/j.talanta.2012.01.030 PMID: 22817921 10. Mendonça, C.R.B.; Bica, C. I. D.; Piatnicki, C. M. S.; Simó-Alfonso, E. F.; Ramis-Ramos, G.; Electrophoresis 2005, 26, 858. DOI: http://dx.doi.org/10.1002/elps.200410141 PMID: 15714551 11. Mendonça, C. R. B.; Bica, C. I. D.; Simó-Alfonso, E. F.; Ramis-Ramos, G.; Piatnicki, C. M. S.; J. Braz. Chem. Soc. 2008, 19, 775. DOI: http://dx.doi.org/10.1590/S0103-50532008000400023 12. Mendonça, C. R.B.; Silva, Y. P.; Böckel, W. J.; Simó-Alfonso, E. F.; Ramis-Ramos, G.; Piatnicki, C. M. S.; Bica, C. I. D.; J. Colloid Interface Sci. 2009, 337, 579. DOI: http://dx.doi.org/10.1016/j.jcis.2009.04.091 PMID: 19564025 13. Edris, A. E.; Malone, C. R.; Procedia Food Sci. 2011, 1, 1821. DOI: http://dx.doi.org/10.1016/j.profoo.2011.09.267 14. Rao, J.; McClements, D. J.; Food Hydrocolloids 2012, 26, 268. DOI: http://dx.doi.org/10.1016/j.foodhyd.2011.06.002 15. Ziani, K.; Fang, Y.; McClements, D. J.; Food Res. Int. 2012, 46, 209. DOI: http://dx.doi.org/10.1016/j.foodres.2011.12.017 16. Chiu, Y. C.; Yang, W. L.; Colloids Surf. 1992, 63, 311. DOI: http://dx.doi.org/10.1016/0166-6622(92)80253-X 17. Drach, M.; Narkiewicz-Michałek, J.; Sienkiewicz, A.; Szymula, M.; Bravo-Diaz, C.; Colloids Surf., A 2011, 379, 79. DOI: http://dx.doi.org/10.1016/j.colsurfa.2010.11.073 18. Feng, J. -L.; Wang, Z. -W.; Zhang, J.; Wang, Z. -N.; Liu, F.; Colloids Surf., A 2009, 339, 1. DOI: http://dx.doi.org/10.1016/j.jcis.2009.07.006 19. Deutch-Kolevzon, R.; Aserin, A.; Garti, N.; Chem. Phys. Lipids 2011, 164, 654. DOI: http://dx.doi.org/10.1016/j.chemphyslip.2011.06.010 PMID: 21723268 20. Lin, C.-C.; Lin, H.-Y.; Chen, H.-C.; Yu, M.-W.; Lee, M.-H.; Food Chem. 2009, 116, 923. DOI: http://dx.doi.org/10.1016/j.foodchem.2009.03.052 21. Loveday, S. M.; Singh, H.; Trends Food Sci. Technol. 2008, 19, 657. DOI: http://dx.doi.org/10.1016/j.tifs.2008.08.002 22. Fu, X.; Feng, F.; Huang, B.; Int. J. Pharm. 2006, 321, 171. DOI: http://dx.doi.org/10.1016/j.ijpharm.2006.05.019 PMID: 16797893 23. Gaysinsky, S.; Davidson, P. M.; Food Biophysics 2008, 3, 54. DOI: http://dx.doi.org/10.1007/s11483-007-9048-1 24. Zhang, H.; Shen, Y.; Bao, Y.; He, Y.; Feng, F.; Zheng, X.; Food Res. Int. 2008, 41, 495. DOI: http://dx.doi.org/10.1016/j.foodres.2008.02.006 25. Mendonça, C. R. B.; Bica, C. I. D.; Piatnicki, C. M. S.; J. Braz. Chem. Soc. 2003, 4, 628. DOI: http://dx.doi.org/10.1590/S0103-50532003000400021 26. Hoar, T. P.; Schulman, J. H.; Nature 1943, 152, 102. DOI: http://dx.doi.org/10.1038/152102a0 27. Langevin, D.; Acc. Chem. Res. 1988, 21, 255. DOI: http://dx.doi.org/10.1021/ar00151a001 28. Schulman, J. H.; Stoeckenius, W.; Prince, L. M.; J. Phys. Chem. 1959, 63, 1677. DOI: http://dx.doi.org/10.1021/j150580a027 29. McBain J. W.; Trans. Faraday Soc. 1913, 9, 99. 30. Hartley G. S.; Aqueous solutions of paraffin-chain salts: a study in micelle formation, Hermann & Cie: Paris, 1936. 31. Debye P., Huckel E.; Phys. Z. 1923, 24, 185. 32. Derjaguin, B. V.; Kolloid-Z. 1934, 69, 155. DOI: http://dx.doi.org/10.1007/BF01433225 33. London, F.; Trans. Faraday Soc. 1937, 33, 8b. DOI: http://dx.doi.org/10.1039/tf937330008a 34. Levine, S; Dube, G. P; Trans. Faraday Soc. 1939, 35, 1125. DOI: http://dx.doi.org/10.1039/tf9393501125 35. Verwey, E. J. W.; Overbeek, J. T. G.; Theory of the stability of lyophobic colloids, Elsevier Publishing Co: New York, 1948. 36. Tanford, C.; The hydrophobic effect: formation of micelles and biological membranes, 2th ed., John Wiley: New York, 1980. 37. Clarke, S.; J. Chem. Educ. 1981, 58, A246. DOI: http://dx.doi.org/10.1021/ed058pA246.3 38. Rosevear, F. B.; J. Am. Oil Chem. Soc. 1954, 31, 628. DOI: http://dx.doi.org/10.1007/BF02545595 39. Mandell, L.; Fontell, K.; Ekwall, P. In Ordered Fluids and Liquid Crystals; Porter, R. S.; Johnson, J. F., eds.; American Chemical Society: Washington, 1967, p. 89-124. 40. Ekwall, P.; Mandell, L.; Kolloid Z. Z. Polym. 1969, 233, 938. DOI: http://dx.doi.org/10.1007/BF01508019 41. Ekwall, P.; Mandell, L.; Fontell, K.; Liquid crystals, Gordon and Breach: London, 1969. 42. Israelachvili, J. N.; Mitchell, D. J.; Ninham, B. W.; J. Chem. Soc. Faraday Trans. 1976, 72, 1525. DOI: http://dx.doi.org/10.1039/f29767201525 43. Mitchell, D. J.; Ninham, B. W.; J. Chem. Soc. Faraday Trans. 1981, 77, 601. DOI: http://dx.doi.org/10.1039/f29817700601 44. Danielsson, I.; Lindman, B.; Colloids Surf. 1981, 3, 391. DOI: http://dx.doi.org/10.1016/0166-6622(81)80064-9 45. Anton, N.; Vandamme, T. F.; Pharm. Res. 2011, 28, 978. DOI: http://dx.doi.org/10.1007/s11095-010-0309-1 PMID: 21057856 46. McClements, D. J.; Soft Matter 2012, 8, 1719. DOI: http://dx.doi.org/10.1039/C2SM06903B 47. Solans, C.; Aramaki, K.; Curr. Opin. Colloid Interface Sci. 2008, 13, 195. DOI: http://dx.doi.org/10.1016/j.cocis.2008.02.003 48. Bruxel, F.; Laux, M.; Wild, L. B.; Fraga, M.; Koester, L. S.; Teixeira, H. F.; Quim. Nova, 2012, 35, 1827. DOI: http://dx.doi.org/10.1590/S0100-40422012000900023 49. Vandamme, T. F.; Prog. Retinal Eye Res. 2002, 21, 15. DOI: http://dx.doi.org/10.1016/S1350-9462(01)00017-9 50. Popovych, O.; Tomkins, R.; Nonaqueous Solution Chemistry, John Wiley: New York, 1981. 51. Chodzinska, A.; Zdziennicka, A.; Janczuk, B.; J. Solution Chem. 2012, 41, 2226. DOI: http://dx.doi.org/10.1007/s10953-012-9935-z PMID: 23243326 52. Kalaitzaki, A.; Emo, M.; Stébé, M. J.; Xenakis, A.; Papadimitriou, V.; Food Res. Int. 2013, 54, 1448. DOI: http://dx.doi.org/10.1016/j.foodres.2013.08.010 53. Yang, Y.; McClements, D. J.; Food Chem. 2013, 141, 473 DOI: http://dx.doi.org/10.1016/j.foodchem.2013.03.033 PMID: 23768382 54. Baruah, B.; Roden, J. M.; Sedgwick, M.; Correa, N. M.; Crans, D. C.; Levinger, N. E.; J. Am. Chem. Soc. 2006, 128, 12758. DOI: http://dx.doi.org/10.1021/ja0624319 PMID: 17002370 55. Watarai, H.; J. Chromatogr. A 1997, 780, 93. DOI: http://dx.doi.org/10.1016/S0021-9673(97)00444-5 56. Lopez-Quintela, M. A.; Tojo, C.; Blanco, M. C.; Garcıa-Rio, L.; Leis, J. R.; Curr. Opin. Colloid Interface Sci. 2004, 9, 264. DOI: http://dx.doi.org/10.1016/j.cocis.2004.05.029 57. Nitschke, M.; Pastore, G. M.; Quim. Nova 20, 02, 25, 772. DOI: http://dx.doi.org/10.1590/S0100-40422002000500013 58. Solomons, T. W. G.; Fryhle, C. B.; Química Orgânica, Vol. 1, 7a ed., LTC Editora: Rio de Janeiro, 2001. 59. Atkins, P. W.; Físico-Química, Vol. 1, LTC, Editora: Rio de Janeiro, 1999. 60. Salager, J. L. In Emulsions and emulsion stability; Johan Sjoblom, ed.; CRC Press: Boca Raton, 2006, cap. 4. 61. West, C. C.; Harwell, J. H.; Environ. Sci. Technol. 1992, 26, 2324. DOI: http://dx.doi.org/10.1021/es00036a002 62. Maniasso, N.; Quim. Nova 2001, 24, 87. DOI: http://dx.doi.org/10.1590/S0100-40422001000100015 63. Lawrence, M. J.; Rees, G. D.; Adv. Drug Deliv. Rev. 2000, 45, 89. DOI: http://dx.doi.org/10.1016/S0169-409X(00)00103-4 PMID: 11104900 64. Moulik, S. P.; Digout, L. G.; Alylward, W. M.; Palepu, R.; Langmuir 2000, 16, 3101. DOI: http://dx.doi.org/10.1021/la991028v 65. Herrero-Martínez, J. M.; Simó-Alfonso, E. F.; Mongay-Fernández, C.; Ramis-Ramos, G.; J. Chromatogr. A 2000, 895, 227. DOI: http://dx.doi.org/10.1016/S0021-9673(00)00592-6 PMID: 11105866 66. Fattal, E.; Couvreur, P.; Puisieux, F. Em Méthodes de préparation des liposomes; Delattre, J.; Couvreur, P.; Puisieux, F.; Phillipot, J. R.; Schuber, F., eds; Les liposomes, Les Editions INSERM: Paris, 1993, Cap. 2. 67. Warisnoicharoen, W.; Lansley, A. B.; Lawrence, M. J.; Int. J. Pharm. 2000, 198, 7. DOI: http://dx.doi.org/10.1016/S0378-5173(99)00406-8 PMID: 10722947 68. Radomska, A.; Dobrucki, R.; Int. J. Pharm. 2000, 196, 131. DOI: http://dx.doi.org/10.1016/S0378-5173(99)00436-6 PMID: 10699703 69. Kalaitzaki, A.; Poulopoulou, M.; Xenakis, A.; Papadimitriou, V.; Colloid. Surf. A 2014, 442, 80. DOI: http://dx.doi.org/10.1016/j.colsurfa.2013.05.055 70. Capek, I.; Adv. Colloid Interface Sci. 2004, 110, 49. DOI: http://dx.doi.org/10.1016/j.cis.2004.02.003 PMID: 15142823 71. Li, X.; Kunieda, H.; Curr. Opin. Colloid Interface Sci. 2003, 8, 327. DOI: http://dx.doi.org/10.1016/S1359-0294(03)00081-5 72. Davis, H.T.; Colloids Surf. A 1994, 91, 9. DOI: http://dx.doi.org/10.1016/0927-7757(94)02929-6 73. Altria, K. D.; J. Capillary Electrophor. Microchip Technol. 2002, 7, 11. 74. Singh, H. N.; Prasad, Ch. D.; Kumar, S.; J. Am. Oil Chem. Soc. 1993, 70, 69. DOI: http://dx.doi.org/10.1007/BF02545370 75. Atkins, P.; Jones, L.; Chemical Principles: The Quest for Insight, Freeman: New York, 1999. 76. Furlanetto, S.; Cirri, M.; Piepel, G.; Mennini, N.; Mura, P.; J. Pharm. Biomed. Anal. 2011, 55, 610. DOI: http://dx.doi.org/10.1016/j.jpba.2011.01.008 PMID: 21295935 77. Singla, M.; Patanjali, P. K.; Ind. Crops Prod. 2013, 44, 421. DOI: http://dx.doi.org/10.1016/j.indcrop.2012.10.016 78. Lin, C.-C.; Lin, H.-Y.; Chi, M.-H.; Shen, C.-M.; Chen, H.-W.; Yang, W.-J.; Lee, M.-H.; Food Chem. 2014, 154, 282. DOI: http://dx.doi.org/10.1016/j.foodchem.2014.01.012 PMID: 24518344 79. Santana, R. C.; Fasolin, L. H.; Cunha, R. L.; Colloids Surf., A 2012, 398, 54. DOI: http://dx.doi.org/10.1016/j.colsurfa.2012.02.009 80. Furlanetto, S.; Orlandini, S.; Marras, A. M.; Mura, P.; Pinzaut, S.; Electrophoresis 2006, 27, 805. DOI: http://dx.doi.org/10.1002/elps.200500507 PMID: 16470626 81. Zheng, M.-Y.; Liu, F.; Wang, Z.-W.; Baoyindugurong, J.-H.; Colloid J. 2011, 73, 319. DOI: http://dx.doi.org/10.1134/S1061933X11030197 82. Fennema, O. R.; Química de alimentos, 4ª ed., Artmed: Porto Alegre, 2010. 83. Rao, J.; McClements, D. J.; Food Hydrocolloids 2011, 25, 1413. DOI: http://dx.doi.org/10.1016/j.foodhyd.2011.02.004 84. Liu, F.; Wang, Z. W.; Chin. Chem. Lett. 2010, 21, 105. DOI: http://dx.doi.org/10.1002/cjoc.20030210203 85. Szymula, M.; J. Dispersion Sci. Technol. 2004, 25, 129. DOI: http://dx.doi.org/10.1081/DIS-120030659 86. Amar, I.; Aserin, A.; Garti, N.; J. Agric. Food Chem. 2003, 51, 4775. DOI: http://dx.doi.org/10.1021/jf026222t PMID: 14705912 87. Spernath, A.; Yaghmur, A.; Aserin, A.; Hoffman, R. E.; Garti, N.; J. Agric. Food Chem. 2002, 50, 6917. DOI: http://dx.doi.org/10.1021/jf025762n PMID: 12405797 88. Garti, N.; Yaghmur, A.; Aserin, A.; Spernath, .; Elfakess, R.; Ezrahi, S.; Colloids Surf., A 2004, 230, 183. DOI: http://dx.doi.org/10.1016/j.colsurfa.2003.09.020 89. Zhong, F.; Yu, M.; Luo, C.; Shoemaker, C. F.; Li, Y.; Xia, S.; Ma, J.; Food Chem. 2009, 115, 539. DOI: http://dx.doi.org/10.1016/j.foodchem.2008.12.048 90. Ferreira, J. P.; Alves, D.; Neves, O.; Silva, J.; Gibbs, P. A.; Teixeira, P. C.; Food Control 2010, 21, 227. DOI: http://dx.doi.org/10.1016/j.foodcont.2009.05.018 91. Al-Adham, I. S. I.; Khalil, E.; Al-Hmoud, N. D.; Kierans, M.; Collier, P. J.; J. Appl. Microbiol. 2000, 89, 32. DOI: http://dx.doi.org/10.1046/j.1365-2672.2000.01078.x PMID: 10945776 92. Teixeira, P. C.; Leite, G. M.; Domingues, R. J.; Silva, J.; Gibbs, P.; Ferreira, J. P.; Int. J. Food Microbiol. 2007, 118, 15. DOI: http://dx.doi.org/10.1016/j.ijfoodmicro.2007.05.008 PMID: 17610974 93. Zhang, H.; Cui, Y.; Zhu, S.; Feng, F.; Zheng, X.; Int. J. Pharm. 2010, 395, 154. DOI: http://dx.doi.org/10.1016/j.ijpharm.2010.05.022 PMID: 20580790 94. Al-Adham, I. S. I.; Al-Hmoud, N. D.; Khalil, E.; Kierans, M.; Collier, P. J.; Lett. Appl. Microbiol. 2003, 36, 97. DOI: http://dx.doi.org/10.1046/j.1472-765X.2003.01266.x PMID: 12535129 95. Al-Adham, I. S. I.; Ashour, H.; Al-Kaissi, E.; Khalil, E.; Kierans, M.; Collier, P. J.; Int. J. Pharm. 2013, 454, 226. DOI: http://dx.doi.org/10.1016/j.ijpharm.2013.06.049 PMID: 23830945 96. Zhang, H.; Shen, Y.; Weng, P.; Zhao, G.; Feng, F.; Zheng, X.; Int. J. Food Microbiol. 2009, 135, 211. DOI: http://dx.doi.org/10.1016/j.ijfoodmicro.2009.08.015 PMID: 19717202 97. Ieggli, C. V. S.; Bohrer, D.; Nascimento, P. C.; Carvalho, L. M.; Gobo, L. A.; J. Food Compos. Anal. 2011, 24, 465. DOI: http://dx.doi.org/10.1016/j.jfca.2010.12.011 98. Nunes, L. S.; Barbosa, J. T. P.; Fernandes, A. P.; Lemos, V. A.; Santos, W. N. L.; Korn, M. G. A.; Teixeira, L. S. G.; Food Chem. 2011, 127, 780. DOI: http://dx.doi.org/10.1016/j.foodchem.2010.12.147 PMID: 23140735 99. Huang, H.-Y.; Chuang, C.-L.; Chiu, C.-W.; Yeh, J.-M.; Food Chem. 2005, 89, 315. DOI: http://dx.doi.org/10.1016/j.foodchem.2004.05.036 100. Noguera-Ortí, J. F.; Villanueva-Camañas, R. M.; Ramis-Ramos, G.; Anal. Chim. Acta 1999, 387, 127. DOI: http://dx.doi.org/10.1016/S0003-2670(99)00045-8 101. Romero, L.; Keunchkarian, S.; Reta, M.; Anal. Chim. Acta 2006, 565, 136. DOI: http://dx.doi.org/10.1016/j.aca.2006.02.054 102. Liotta, E.; Gottardo, R.; Seri, C.; Rimondo, C.; Miksik, I.; Serpelloni, G.; Tagliaro, F.; Forensic Sci. Int. 2012, 220, 279 DOI: http://dx.doi.org/10.1016/j.forsciint.2012.03.015 PMID: 22497701 103. Ting, Y.; Jiang, Y.; Ho, C. -T.; Huang, Q.; J. Funct. Foods 2014, 7, 112. DOI: http://dx.doi.org/10.1016/j.jff.2013.12.010 104. Fisher, S.; Wachtel, E. J.; Aserin, A.; Garti, N.; Colloids Surf., B 2013, 107, 35. DOI: http://dx.doi.org/10.1016/j.colsurfb.2013.01.036 105. Zhang, H.; Shen, Y.; Bao, Y.; He, Y.; Feng, F.; Zheng, X.; Food Res. Int. 2008, 41, 495. DOI: http://dx.doi.org/10.1016/j.foodres.2008.02.006 106. Klossek, M. L.; Marcus, J.; Touraud, D.; Kunz, W.; Colloids Surf., A 2014, 442, 105. DOI: http://dx.doi.org/10.1016/j.colsurfa.2012.12.061 107. Brasil. Resoluçao RDC nº 45, de 03 de novembro de 2010. Disponível em http://portal.anvisa.gov.br/wps/wcm/connect/11707300474597459fc3df3fbc4c6735/Resolu%C3%A7%C3%A3o+da+Diretoria+Colegiada++RDC+n++45+de+03+de+novembro+de+2010.pdf?MOD=AJPERES. Acesso em 29 de julho de 2015. 108. Brasil. Resoluçao RDC nº 33, de 09 de março de 2001. Disponível em http://portal.anvisa.gov.br/wps/wcm/connect/ee559000474595999d72dd3fbc4c6735/RDC_33_2001.pdf?MOD=AJPERES. Acesso em 29 de julho de 2015. 109. Brasil. Resoluçao RDC nº 8, de 06 de março de 2013. Disponível em http://portal.anvisa.gov.br/wps/wcm/connect/1cac3e004edacb17a9e8ab8a610f4177/RDC+N+08++2013+Aditivos+frutas+e+vegetais.pdf?MOD=AJPERES. Acesso em 29 de julho de 2015. 110. Silva, J. A.; Santana, D. P.; Bedor, D. G. C.; Borba, V. F. C.; Lira, A. A. M.; Egito, E. S. T.; Quim. Nova 2009, 32, 1389. DOI: http://dx.doi.org/10.1590/S0100-40422009000100022 111. Oliveira, A. G.; Scarpa, M. V.; Correa, M. A.; Cera, L. F. R.; Formariz, T. P.; Quim. Nova 2004, 27, 131. DOI: http://dx.doi.org/10.1590/S0100-40422004000100011 112. Santos, D. S. S.; Korn, M. G. A.; Guida, M. A. B.; Santos, G. L.; Lemos, V. A.; Teixeira, L. S. G.; J. Braz. Chem. Soc. 2011, 22, 552. DOI: http://dx.doi.org/10.1590/S0103-50532011000300020 113. Silva, J. S. A.; Chaves, E. S.; Santos, É. J.; Saint'Pierre, T. D.; Frescura, V. L. A.; Curtius, A. J.; J. Braz. Chem. Soc. 2010, 21, 620. DOI: http://dx.doi.org/10.1590/S0103-50532010000400006 114. Silva, Y. P.; Dalmoro, V.; Ruiz, Y. P. M.; Capeletti, L. B.; Mendonça, C. R. B.; Santos, J. H. Z.; Piatnicki, C. M. S.; Anal. Methods 2014, 6, 9212. DOI: http://dx.doi.org/10.1039/C4AY01047G 115. Bera, A.; Kumar, T.; Ojha, K.; Mandal, A.; Fuel 2014, 121, 198. DOI: http://dx.doi.org/10.1016/j.fuel.2013.12.051 116. Zhu, T.; Hydrometallurgy 1991, 27, 231. DOI: http://dx.doi.org/10.1016/0304-386X(91)90069-X 117. Dantas Neto, A. A.; Dantas, T. N. de C.; Moura, M. C. A.; J. Hazard. Mater. 2004, 114, 115. DOI: http://dx.doi.org/10.1016/j.jhazmat.2004.07.007 118. Paul, R.; Solans, C.; Erra, P.; Colloids Surf., A 2005, 253, 175. DOI: http://dx.doi.org/10.1016/j.colsurfa.2004.11.003 119. Gutiérrez-Becerra, A.; Martínez-Martínez, F.; Bárcena-Soto, M; Casillas, N.; Ceja, I.; Prévost, S.; Gradzielski, M.; Escalant, J. I.; Colloids Surf., A 2014, 444, 63. DOI: http://dx.doi.org/10.1016/j.colsurfa.2013.12.038 120. Pillai, V.; Kumar, P.; Hou, M. J.; Ayyub, P.; Shah, D. O.; Adv. Colloid Interface Sci. 1995, 55, 241. DOI: http://dx.doi.org/10.1016/0001-8686(94)00227-4 121. Pulišová, P.; Kováč, J.; Voigt, A.; Raschman, P.; J. Magn. Magn. Mater. 2013, 341, 93. DOI: http://dx.doi.org/10.1016/j.jmmm.2013.04.003 122. Husein, M. M.; Rodil, E.; Vera, J. H.; J. Colloid Interface Sci. 2005, 288, 457. DOI: http://dx.doi.org/10.1016/j.jcis.2005.03.023 PMID: 15927613 123. Fernandes; M. T. C.; Kawachi, E. Y.; Quim. Nova 2010, 33, 1242. DOI: http://dx.doi.org/10.1590/S0100-40422010000600004 124. Vemić, A. M.; Malenović, A. M.; Rakić, T. M; Kostić, N. M.; Jančić-Stojanović, B. S.; Ivanović, D. P.; Medenica, M. B.; J. Braz. Chem. Soc. 2012, 23, 2084. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access