Artigo
|
|
| Nanocristais de celulose a partir de celulose bacteriana Cellulose nanocrystals from bacterial cellulose |
|
Lais R. LimaI; Daniele B. SantosI; Molíria V. SantosI; Hernane S. BarudI,II,*; Mariana A. HenriqueIII; Daniel PasquiniIII; Edison PecoraroI; Sidney J. L. RibeiroI
IInstituto de Química, Universidade Estadual Paulista, Araraquara - SP, Brasil Recebido em 03/03/2015 *e-mail: hernane.barud@gmail.com Bacterial cellulose produced from Gluconacetobacter xilinus was used to produce cellulose nanocrystals by sulfuric acid hydrolysis. Hydrolysis was performed with 64% sulfuric acid at 50 ºC with the hydrolysis time ranging between 5 and 90 min. The production of nanocrystals was observed to have size distributions that were dependent on hydrolysis times up to 10 min, after which time the suspensions showed distributions closer in size. Results from thermal analysis and X-ray diffraction showed that the amorphous cellulose was removed, leaving only the crystalline portion. Self-supported films were formed from the suspension of nanocrystals and had iridescence characteristics. The films were characterized by microscopy measures and specular reflectance. INTRODUÇÃO A celulose, (C6H10O5)n é o polímero natural mais abundante da terra obtido a partir de fontes renováveis, e que consiste de um homopolissacarídeo linear composto de unidade de β-D-glicopiranose unidas entre si por ligações β-1,4-glicosídicas.1 A fonte natural de celulose mais explorada comercialmente é a madeira, devido sua grande disponibilidade que atende as demandas da indústria do papel. Porém, uma variedade de plantas também contêm grande quantidade de celulose, como o cânhamo, linho, juta, rami e algodão. Além dessas fontes, a celulose pode ser produzida por algas marinhas, musgos, animais marinhos como os tunicados e por algumas espécies de bactérias, como por exemplo, bactérias do gênero espécie Gluconacetobacter.2,3 Neste último caso a celulose bacteriana é também conhecida na literatura como biocelulose ou celulose microbiana. A celulose bacteriana tem fórmula molecular idêntica à celulose das plantas, porém suas propriedades mecânicas e físicas emergem de sua estrutura única que difere significativamente da celulose das plantas.4,5 As cadeias nascentes da celulose bacteriana se agregam para formar longas subfibrilas, que têm largura de aproximadamente 1,5 nm. As nanofibrilas de celulose bacteriana têm maior área superficial comparando-se com as fibrilas da celulose das plantas. Por inferência, a celulose bacteriana tem uma maior capacidade de retenção de água, ao mesmo tempo em que apresenta grande elasticidade, alta resistência e flexibilidade.5 As subfibrilas são posteriormente cristalizadas em microfibrilas e depois formam feixes de microfibrilas ou microfitas. As microfitas são ultrafinas com largura de 1 a 9 nm, formando uma estrutura reticulada densa estabilizada por várias ligações de hidrogênio. Essas redes apresentam um elevado índice de cristalinidade (60 - 90%) e elevado grau de polimerização, geralmente em torno de 2000 a 6000.5,6 Outra vantagem da celulose bacteriana em relação à celulose das plantas refere-se à sua pureza. A celulose bacteriana não contém lignina, hemiceluloses e outros constituintes dos materiais lignocelulósicos. Consequentemente, a celulose bacteriana é facilmente purificada utilizando NaOH.5 Além disso, a celulose bacteriana possui alta resistência à tração, elasticidade, durabilidade, capacidade de retenção e absorção de água, é biodegradável, atóxica e biocompatível. Com essas propriedades singulares, a celulose bacteriana é aplicada nas mais diversas áreas, como na medicina, meio ambiente, alimentos e cosméticos.1,4 Membranas de celulose bacteriana também se configuram como fonte alternativa para extração de nanocristais de celulose. Nanocristais de celulose são os domínios cristalinos de fibras celulósicas isolados por meio de hidrólise ácida ou enzimática.5,6 Nos últimos anos tem havido um crescente interesse no estudo de nanocristais de celulose, pois eles podem se comportar como cristais líquidos liotrópicos.7-9 As suspensões estáveis de nanocristais de celulose podem ser obtidas por meio de hidrólise de material celulósico com ácido sulfúrico a partir de um número de diferentes fontes de celulose incluindo plantas,10-13 celulose microcristalina14 e tunicados.15 Acima de certo valor crítico de concentração de nanocristais em suspensão aquosa estes formam uma ordenação nemática quiral que pode ser preservada durante lenta secagem, resultando assim em filmes iridescentes.16,17 O emprego de nanocristais de celulose, obtidos a partir de tunicados, vêm sendo favorecidos devido ao seu comprimento e elevada cristalinidade, entretanto, a difusão da sua utilização é restrita devido ao alto custo da colheita e disponibilidade limitada.18 Nanocristais obtidos a partir da madeira e do algodão também possuem algumas restrições. A madeira, apesar de ser a principal fonte de celulose devido a sua abundância natural, e o algodão, apesar de possuir ampla disponibilidade e elevada quantidade de celulose (94%), ao serem utilizados com fonte para a extração de nanocristais, requerem um pré-tratamento de purificação para retirada de lignina e hemiceluloses e esse processo é poluente e de alto custo. Neste caso a celulose bacteriana surge como excelente alternativa, pois como citado é livre de impurezas, além de ser altamente cristalina e obtida em escalas comerciais.18,19 Alguns exemplos de nanocristais de celulose bacteriana com elevada cristalinidade e razão de aspecto têm sido relatados na literatura,20-24 porém estes trabalhos não apresentam estudos a respeito da influência das condições de hidrólise no controle da extração dos nanocristais de celulose e a utilização dos mesmos para a preparação de filmes iridescentes. O presente trabalho apresenta o estudo da influência do tempo de hidrólise ácida na extração de nanocristais de celulose bacteriana, assim como a preparação de suspensões e filmes com organização líquido-cristalina nemática quiral. Suspensões de nanocristais de celulose bacteriana foram produzidas com diferentes tempos de hidrólise. Os nanocristais obtidos apresentaram formato de agulhas com alta razão de aspecto. As dimensões, estabilidade térmica e cristalinidade dos nanocristais mostraram-se dependentes do tempo de hidrólise até 10 min, após esse tempo estas características não apresentam variação significativa. As suspensões de nanocristais de celulose bacteriana obtidas apresentaram organização líquido-cristalina nemática quiral, que foi preservada quando na forma de filmes auto-suportados, levando assim à obtenção de filmes iridescentes.
PARTE EXPERIMENTAL Produção da celulose bacteriana (CB) Primeiramente, uma alíquota da bactéria Gluconacetobacter xylinum (ATCC 23760, Lote 30.05, Manitol) foi replicada para uma placa de meio HS sólido estéril (Hestrim-Schramm) contendo glicose, extrato de levedura (Merck), peptona (Synth), Na2HPO4 (Synth), ácido cítrico (Synth), ágar (Synth) e água milli-Q. Após o tempo de crescimento o microrganismo foi inoculado em um meio de cultura líquido estéril constituído por glicose (Synth), extrato de levedura (Merck), MgSO4.7H2O (Synth), KH2PO4 (Synth), etanol e água e mantido por 24 h dentro de uma estufa com circulação de ar com temperatura constante em 28 ºC. Este inóculo de microrganismo foi chamado de caldo 1. O meio de cultivo permaneceu em estufa com circulação de ar com temperatura constante em de 28 ºC por 72 h para a produção de mantas hidratadas de CB com espessura média de 3,0 mm. Posteriormente, iniciou-se o procedimento de purificação, no qual as membranas de CB produzidas foram mergulhadas em água e submetidas a trocas de água cinco vezes por dia, durante 3 dias. Após as trocas de água, as membranas foram aquecidas em água à temperatura de 80 ºC durante 50 min. Em seguida, para remoção das bactérias, as mantas foram submetidas a um tratamento com solução de NaOH 0,1 mol L-1 em banho-maria, à temperatura de 80 ºC durante 50 min e então lavadas novamente com água milli-Q até pH 7,0. Para secagem foram utilizados bastidores de 30 cm x 18 cm e estufa com circulação de ar com temperatura de 28 ºC, durante 12 h.25 Suspensões de nanocristais de celulose bacteriana (NCCB) Membranas secas de CB foram trituradas em moinho de facas IKA A11 basic. As fibras trituradas foram hidrolisadas em ácido sulfúrico (H2SO4) 64% (Synth) à 50 ºC sob agitação constante durante intervalos de tempo diferentes, a saber, 5, 10, 15, 30, 50, 70 e 90 minutos. Sete amostras foram preparadas por meio da adição de 17,5 mL de H2SO4 por grama de CB. Cada amostra apresentou concentração de CB em relação à suspensão de aproximadamente 1% (m/m). Esta concentração foi calculada por meio da evaporação da água e formação de um filme puro de CB. As massas das suspensões e dos filmes foram relacionadas e os valores próximos a 1% foram então obtidos. As amostras foram nomeadas segundo a Tabela 1.
A reação de hidrólise foi cessada diluindo-se a mistura dez vezes com água gelada. A suspensão foi centrifugada à 6000 rpm durante 10 min e o precipitado resultante foi colocado em membranas de acetato de celulose para diálise contra água milli-Q até pH 7. As suspensões de NCCB foram sonificadas durante 10 min (pulso: 5 s ligado e 2 s desligado) em um ultrassom de ponteira da Brenson, modelo VC 505 500 W 20 kHz, em banho de gelo. A energia acústica aplicada foi em torno de 15000 J. Filmes de NCCB 8,0 mL das suspensões foram espalhados em placas de petri de poliestireno com 4,5 cm de diâmetro e, em seguida, foram deixados à temperatura ambiente durante 12 h para total evaporação do solvente e formação de filmes iridescentes de NCCB, com espessura de aproximadamente 100 µm. Equipamentos utilizados As medidas de Espectroscopia de Correlação de Fótons (PCS) foram realizadas em um espectrofotômetro PCS-100 Brookhaven Instruments, com goniômetro modelo BI-200SM, laser de 25 MW, comprimento de onda de 532 nm, índice de refração real 1,480 e índice de refração imaginário igual a 0,100. Foram realizadas 10 medidas de 30 s, totalizando 5 min. As imagens de microscopia eletrônica de varredura (MEV) foram obtidas no microscópio modelo Hitachi SU -70. As amostras foram colocadas em um suporte de cobre, recoberta com uma camada de carbono com espessura de 1 - 10 nm, operando na faixa de tensão de 3-10 kV. A suspensão de NCCB foi caracterizada por microscopia eletrônica de transmissão (MET) utilizando o microscópio Philips modelo CM 200 Super Twin operando em uma potência de feixe de 120 kV. As amostras foram preparadas com antecedência, nas quais uma gota da suspensão 0,005% m/v foi depositada sobre uma grade de microscopia revestida com filme de carbono ultrafino do tipo Lacey carbon (400 mesh, TED PELLA). Uma solução de 1% m/v de ácido fosfotúngstico (PWA) foi utilizada como contraste. A análise elementar foi realizada com o objetivo de verificar a presença de enxofre nos NCCB após a reação de hidrólise. As medidas foram realizadas em um equipamento modelo EA 1108 da FISONS. As curvas termogravimétricas (TG) foram obtidas por um equipamento TA Instruments usando uma célula SDT Q600. As condições utilizadas nos experimentos foram nitrogênio com vazão de 100 mL min-1 e razão de aquecimento de 10 ºC min-1. A temperatura inicial foi de 30 ºC e a temperatura final de 550 ºC. Foram pesados em média 3,0 mg de cada amostra, utilizando-se cadinho de alumina como referência. Os difratogramas de raios X (DRX) foram obtidos utilizando-se um difratômetro Siemens Kristalloflex, com filtro de níquel e radiação CuKα, entre os ângulos 2θ de 4º a 70º, tempo de contagem de 10 s e passo de 0,01. As amostras foram fixadas sobre um suporte de vidro. Medidas de reflectância especular foram realizadas em um espectrofotômetro UV/visível Varian, modelo Cary 500 e as imagens de microscopia óptica de luz polarizada (MOLP) foram obtidas em um microscópio óptico modelo Olympus BX-41, em aumento de 50× e entre polarizadores cruzados a 90º.
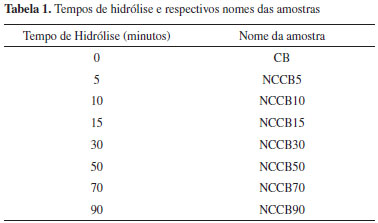
RESULTADOS E DISCUSSÕES Suspensões estáveis de nanocristais de celulose (NCC) foram obtidas através da hidrólise ácida sulfúrica da celulose bacteriana (CB) em diferentes tempos de reação. Com o intuito de avaliar as dimensões dos NCCB extraídos em diferentes tempos de hidrólise foram realizadas medidas de espectroscopia de correlação de fótons (PCS) sobre as suspensões. A Figura 1 apresenta as distribuições de tamanho obtidas das medidas de PCS para o raio hidrodinâmico das partículas. Essencialmente duas distribuições de tamanho puderam ser observadas, provavelmente devido às duas dimensões principais (comprimento e espessura) para os cristais em forma de agulha. Para 5 min de hidrólise (NCCB5 - Figura 1(a)), a primeira distribuição de tamanho varia de poucos nanômetros a centenas de nanômetros e a segunda distribuição de 1,5 a 3,5 µm. Para 10 min de hidrólise (amostra NCCB10 - Figura 1(b)), os tamanhos diminuem, sendo a primeira de alguns poucos nanômetros a 300 nm e a segunda de 500 nm a 1,5 µm. A partir de 15 min até 90 min não se observam variações significativas no comprimento dos NCCB. O que vale ressaltar é que para o tempo de hidrólise de 90 min observa-se uma distribuição mais homogênea de tamanhos, assim como uma diminuição da espessura média dos nanocristais.
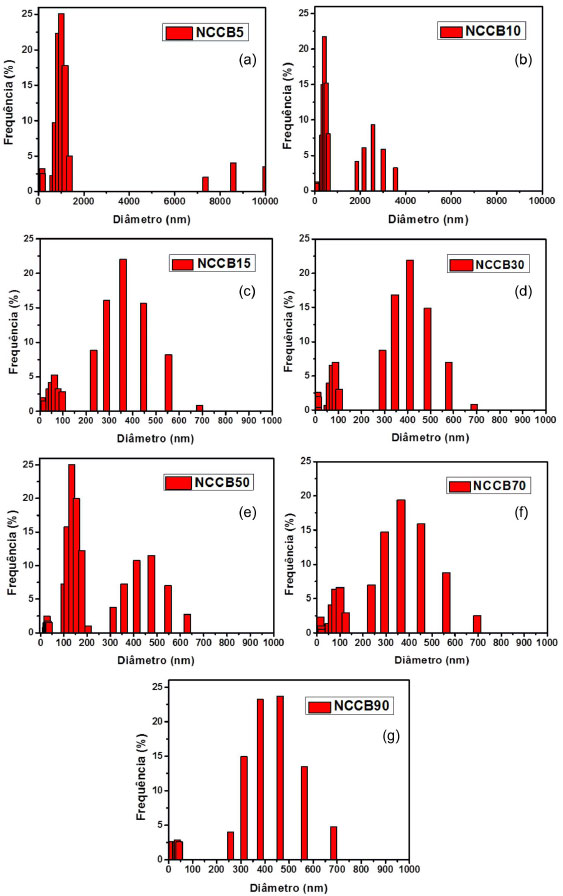 Figura 1. Distribuiçoes de tamanhos das amostras das suspensoes de nanocristais de CB obtidos em diferentes tempos de hidrólise ácida: (a) NCCB5, (b) NCCB10, (c) NCCB15, (d) NCCB30, (e) NCCB50, (f) NCCB70 e (g) NCCB90

A Figura 2 (a) apresenta uma foto representativa de uma das suspensões de NCCB em diferentes tempos de reação. Todas as suspensões de NCCB apresentaram aspecto homogêneo, coloração branca e concentração em torno de 1% em massa.
 Figura 2. a) Fotografia da suspensao de nanocristais de celulose bacteriana de concentraçao 1% (m/v) b) Imagem de MET da suspensao de NCCB30
A morfologia e dimensões dos NCCB30 puderam ser confirmadas por meio de microscopia eletrônica de transmissão (MET). A imagem apresenta os NCCB obtidos com formato uniforme de agulha. As dimensões dos NCCB estão de acordo com os valores observados na literatura que variam de 10 nm a 50 nm de espessura e de 100 nm a vários micrômetros de comprimento.20-24,26 Aplicando o software Image J na Figura 2 (b) foi possível calcular a razão de aspecto, ou seja, a razão entre o comprimento e a espessura dos NCCB30. O valor encontrado foi de aproximadamente 7.5, resultado que corrobora com os valores observados nas medidas de PCS. O decréscimo no tamanho dos NCCB nos tempos iniciais de hidrólise segue o modelo proposto por Millet et al., em que os autores relatam que nos estágios iniciais da reação de hidrólise, o ácido difunde preferencialmente nas porções não cristalinas da celulose e hidrolisa as ligações glicosídicas mais acessíveis. Depois que essas regiões mais acessíveis ao ataque ácido foram hidrolisadas, mais reações ocorrem, porém mais lentamente, na terminação redutora da celulose e na superfície das regiões cristalinas, isto é, nos NCCB. Dessa forma, as dimensões dos NCCB tornam-se relativamente estáveis após certo tempo de hidrólise, no caso, após 15 min de hidrólise à 50 ºC.27 A hidrólise ácida da celulose provoca clivagem hidrolítica das ligações glicosídicas entre duas unidades de anidroglucose. Esse processo rende fragmentos com pequenas cadeias preservando a estrutura básica da celulose. Na celulose, as regiões amorfas são mais acessíveis aos íons hidrônio e suscetíveis à ação hidrolítica do que na região cristalina. Na presença de H2SO4 e aquecimento brando (50 ºC) a maioria das regiões amorfas é digerida rapidamente produzindo NCCB em suspensão.28,29 Além da cisão da cadeia, a hidrólise da celulose com H2SO4 envolve a introdução de grupos sulfato à superfície dos NCCB. Esses grupos sulfatos deixam a superfície das nanopartículas carregadas negativamente em pH ácido, resultando em suspensões aquosas estáveis. Essa estabilização aniônica por via das forças de repulsão é muito eficiente na prevenção da agregação dos NCCB impulsionado pelas ligações de hidrogênio.30 A Tabela 3 apresenta os resultados obtidos para análise elementar. Observa-se que a quantidade de enxofre aumenta com o tempo de reação para os primeiros 30 min. A partir de 30 min essa quantidade permanece constante em torno de 1%. Esses resultados indicam a incorporação gradativa de grupos sulfatos na superfície dos NCCB conforme o tempo de reação é aumentado e que depois de 30 min não ocorre mais a esterificação da celulose bacteriana pelo H2SO4.
A Figura 3 apresenta as curvas termogravimétricas da CB pura e das amostras de NCCB.
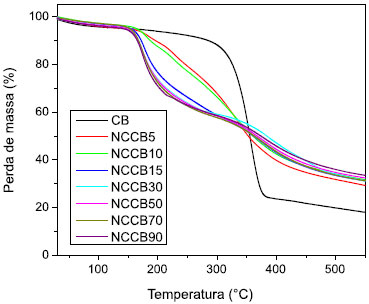 Figura 3. Curvas TG da CB pura e das amostras de NCCB obtidas em diferentes tempos de hidrólise ácida
Para todas as amostras, observa-se um evento com perda de massa de 2 a 2,5% que se inicia em torno de 50 ºC até 150 ºC devido à vaporização da umidade. A curva TG da CB apresenta um perfil típico esperado para materiais celulósicos com temperatura de degradação acima de 300 ºC, decorrente do processo de despolimerização, desidratação e decomposição das unidades glicosídicas, com perda de massa de 62%. A degradação da celulose que compreende a desidratação do biopolímero leva à decomposição das unidades de anidroglicose com a formação de dióxido de carbono (CO2) e monóxido de carbono (CO), restando cerca 18% de resíduos carbonáceos em 550 ºC.31 As curvas obtidas para as amostras de NCCB mostram que a temperatura inicial da degradação térmica diminuiu gradativamente, de 300 ºC, observados para a CB, para 150 ºC conforme o aumento do tempo de hidrólise. De acordo com Roman e Winter, o H2SO4 diminui a termoestabilidade dos NCCB. Assim, a diminuição gradual da temperatura de degradação nos tempos iniciais de hidrólise pode ser devida ao aumento da quantidade de grupos sulfatos introduzida à superfície dos NCCB, como confirmado na análise elementar.29 Para os NCCB, após o primeiro evento relacionado à perda de água adsorvida, os eventos térmicos podem ser divididos em duas etapas principais. Primeiramente ocorre a reação de degradação da celulose nas unidades de cadeia que contém grupos sulfatos. Estes promovem as reações de desidratação da celulose, liberando água e catalisando, portanto, as suas reações de degradação. Em altas temperaturas (> 280 ºC) ocorrem reações de degradação das cadeias de celulose com menores quantidades de grupos sulfatos e/ou cadeias de celulose que não tiveram contato com o H2SO4. Observa-se também que o resíduo observado é aproximadamente 10% maior que o observado para a CB, devido ao efeito catalítico do H2SO4 nas reações de desidratação da celulose. A remoção do oxigênio da celulose para a formação de água indispõe oxigênio para formação de CO e CO2 em altas temperaturas, aumentando, portanto, a quantidade de resíduos de carbono.32-34 A Figura 4 apresenta os difratogramas de raios X (DRX). Três picos característicos da celulose I são observados para todas as amostras em 2θ = 14,7º, 16,4º e 22,6º.18,21 O pico 2θ = 22,6º do plano (200) dos NCCB torna-se relativamente mais intenso do que da CB pura confirmando a cristalinidade acentuada nesta direção para os NCCB em relação ao observado para a CB.29
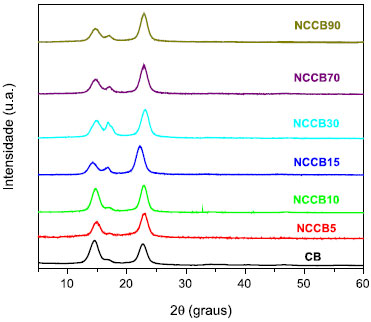 Figura 4. DRX da CB pura e dos NCCB obtidos em diferentes tempos de hidrólise ácida
A partir dos difratogramas de raios X foi possível calcular o índice de cristalinidade de cada amostra segundo a equação de Segal: 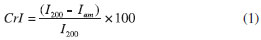 na qual CrI expressa o índice de cristalinidade relativo, I200 é a intensidade máxima (em unidades arbitrárias) do pico referente ao plano (200) e Iam é a intensidade de difração nas mesmas unidades em 2θ = 18 º.35 Os índices de cristalinidade são apresentados na Tabela 4.
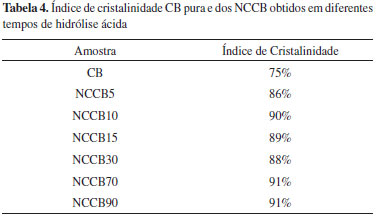
Observa-se o aumento gradual da cristalinidade até tempo de hidrólise de 10 min em comparação ao índice da CB pura. Este aumento também é explicado pelo fato das regiões amorfas da cadeia de CB terem sido reduzidas com o ataque ácido. A partir de 10 min a cristalinidade dos NCCB não varia significativamente, indicando que as regiões amorfas foram majoritariamente removidas. Em geral, observa-se nitidamente a diferença entre o comportamento térmico e a cristalindade referentes aos NCCB5 e NCCB10 frente às outras amostras. Essa diferença provavelmente deve-se ao fato de que o tempo de hidrólise até 10 min é insuficiente para a remoção completa da porção amorfa das cadeias da CB, ou seja, supõe-se que as amostras sejam mais heterogêneas quanto às porções amorfas e cristalinas, levando a um comprtamento diferenciado quando comparadas aos NCCB obtidos a partir de 15 min de hidrólise ácida. Suspensões birrefringentes e filmes iridescentes de NCCB Conforme já mencionado, quando o H2SO4 é usado como agente de hidrólise, a superfície dos NCCB é negativamente carregada, o que promove uma dispersão uniforme dos mesmos em água. A remoção constante da fase aquosa leva a auto-organização dos cristais de maneira a minimizar as repulsões eletrostáticas existentes. É conhecida a formação de fases nemáticas quirais nestes sistemas,27,36,37 a partir de uma concentração crítica. Segundo Hirai et al.,26 os NCC formam fase líquido-cristalina em concentrações acima de 0,42%. As partículas em forma de bastão dos NCCB se arranjam em pseudocamadas com seus eixos paralelos ao longo do plano da camada. A média da direção do eixo das partículas em cada camada (o eixo diretor) é girada em um pequeno ângulo para a camada acima e abaixo, produzindo uma distribuição helicoidal das pseudocamadas. A Figura 5 (a) apresenta uma suspensão de NCCB30 1,0% m/m vista entre polarizadores cruzados. A birrefringência é facilmente observada. Após evaporação da água das suspensões de NCCB30, os nanocristais podem produzir filmes sólidos iridescentes que retém a auto-organização líquido-cristalina nemática quiral formada na suspensão. A Figura 5 (b) apresenta uma fotografia do filme formado a partir da evaporação do solvente da suspensão NCCB30, e a Figura 5 (c) mostra um esquema da organização dos NCCB em mesofases nemáticas quirais. O passo nemático quiral (P) é definido como a distância requerida para o eixo diretor fazer uma volta completa sobre o eixo colestérico. Os filmes de NCCB são iridescentes devido ao ordenamento nemático quiral das partículas, que refletem luz em uma estreita faixa de comprimento de onda determinada pelo passo nemático quiral da estrutura líquido-cristalina. O comprimento de onda refletido dá origem à iridescência quando o passo da hélice é da ordem do comprimento de onda da luz visível.16-17,38
 Figura 5. (a) Suspensao de NCCB30 (concentraçao 1 % m/m) observada entre polarizadores cruzados (b) Filme obtido através da evaporaçao da água da suspensao de NCCB30 (c) Esquema do arranjo estrutural de uma mesofase colestérica líquido-cristalina
A morfologia dos filmes foi avaliada por meio de medidas de microscopia óptica de luz polarizada (MOLP) e microscopia eletrônica de varredura (MEV). A Figura 6 (a) apresenta a imagem de MOLP da superfície do filme obtido a partir da evaporação da água da suspensão de NCCB30. Nesta imagem observa-se claramente a textura característica da fase nemática quiral com estruturas semelhantes a impressões digitais. Essa característica foi observada em todos os filmes obtidos nos diferentes tempos de hidrólise. A distância entre as linhas da textura é igual a P/2. A partir desta distância foi possível calcular o P.39 O valor de P calculado foi igual a 2,69 µm ± 0,04 µm.
 Figura 6. (a) Imagem de MOLP da superfície do filme NCCB30, (b) e (c) Imagens de MEV de uma fratura da borda do filme NCCB30 (d) Imagem de MEV da secçao transversal do filme NCCB30
As Figuras 6 (b) e (c) mostram imagens da borda do filme NCCB30, nas quais pode ser observado que o filme é formado por uma estrutura com organização de longo alcance constituída por camadas rotacionadas no sentido anti-horário. Estas estruturas são características dos filmes de NCC e referem-se a planos que formam uma hélice e giram à esquerda. A interpretação desta textura está de acordo com a normal do arranjo helicoidal nemático quiral.39 A Figura 6 (d) apresenta a secção transversal da fratura do filme. A orientação do eixo nemático quiral é novamente observada, neste caso, com a posição perpendicular à superfície do filme. A microscopia revela as camadas regularmente espaçadas formadas pela automontagem dos NCCB. A estrutura periódica está presente ao longo de toda a sua espessura, e cada banda de repetição corresponde a uma rotação 180º entre planos da estrutura nemática quiral (P/2). Recentemente Andrews e colaboradores demonstraram uma boa correlação entre a periodicidade da estrutura observada em MEV de secções transversais e o valor de P/2 dos filmes de NCC.40 A Figura 7 (a) apresenta os espectros de reflectância especular dos filmes obtidos em função do ângulo de incidência (θ) para o filme NCCB30. A Figura 7 (b) mostra o gráfico que apresenta a variação da posição do comprimento de onda máximo das bandas dos espectros de reflectância do filme em função do cos θ. Os espectros de reflectância dos filmes mostram a difração de Bragg com um comprimento de onda característico máximo (λ0), que obedece a relação de Vries (equação 2), na qual a reflectância desloca para comprimentos de onda mais curtos com o aumento no ângulo de visão em relação ao eixo normal do filme. 
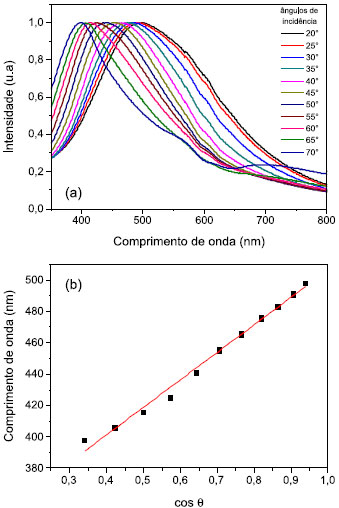 Figura 7. (a) Reflectância especular do filme produzido a partir da suspensao de NCCB30; (b) Variaçao da posiçao do λ0 da banda de reflectância dos espectros da figura (a) em funçao dos valores de cos θ
na qual θ é o ângulo de incidência entre o raio incidente e normal à superfície, P é o passo de estrutura nemática quiral, (nm) é o índice de refração médio. Usando a equação de Vries, o λ0 do espectro de reflectância da Figura 7 (a) e o coeficiente angular do gráfico da Figura 7 (b), o P da estrutura nemática quiral do filme NCCB30 pôde ser determinado com valor de 239,4 ± 12,2 nm. Este valor é comparável ao valor observado nas imagens de MEV da secção transversal do filme. A análise da Figura 6 (d) mostra que os espaçamentos entre as camadas correspondentes a P/2 é igual a 120,9 ± 2,7 nm. No entanto, verifica-se claramente pela imagem da superfície da amostra obtida por MOLP que o passo é da ordem de mícrons. Estas aparentes contradições foram discutidas recentemente por Lagerwall e colaboradores.38 Os autores propuseram que esta diferença entre o interior e a superfície do filme é criada durante o processo de secagem, na qual a superfície da amostra entra em um estado de empacotamento dos cristais, levando rapidamente a um aumento da concentração de NCCB na interface líquido-vapor. Com a evaporação da água e secagem inicial na superfície, desenvolve-se então uma hélice no plano do filme com P da ordem de mícrons, porém, a maior parte da amostra encontra-se ainda em um estado líquido-cristalino. Ou seja, o aumento da concentração dos cristais no interior do filme é muito mais lento do que na superfície, o que faz com que os NCCB tenham a possibilidade de se organizarem em um P suficientemente mais curto, na ordem do comprimento de onda da luz visível, o que consequentemente produz a iridescência. Devido ao alinhamento dos NCCB e à possibilidade de controlar o passo nemático quiral, estes filmes podem ser utilizados para diversas aplicações, tais como documentos de segurança, passaportes, notas de banco e certificados, lasers e sensores. Eles também podem ser usados como reforço para preparação de materiais compósitos e aplicados como novos pigmentos para revestimentos e tintas em que a cor depende do ângulo de visão, não podendo ser reproduzida por impressões comuns.35,38
CONCLUSÃO A celulose bacteriana (CB) foi utilizada como fonte para a preparação de nanocristais de celulose (NCC). As principais vantagens desta fonte de celulose frente às outras, como celulose vegetal, madeira e algodão, referem-se à sua alta pureza, alta cristalinidade e principalmente ao seu processo de produção ser livre de poluentes e possuir baixo custo. A partir destas considerações, foram obtidas suspensões de nanocristais de celulose bacteriana (NCCB) pela reação de hidrólise ácida com ácido sulfúrico 64%, à temperatura de 50 ºC. A influência do tempo de hidrólise sobre a formação dos NCCB foi estudada entre 5 a 90 minutos de reação. Por meio de medidas de espectroscopia de correlação de fótons (PCS) observou-se que não houve mudanças significativas na distribuição do tamanho de partículas com o aumento do tempo de hidrólise. Mais precisamente, observou-se que as dimensões dos NCCB tornam-se relativamente estáveis após 15 min de hidrólise ácida. A partir deste tempo foram observadas também mudanças no perfil térmico, relacionadas à quantidade de enxofre presentes nos NCCB. A cristalinidade dos NCCB apresentou aumento gradual até 10 min de hidrólise ácida e a partir de 15 min, o índice de cristalinidade estabilizou-se, indicando que as regiões amorfas foram majoritariamente removidas desses materiais, o que corrobora com os resultados de PCS e TG. A imagem obtida entre polarizadores cruzados confirmou que as suspensões de NCCB formam domínios birrefringentes devido à anisotropia óptica da CB. A auto-orientação dos NCCB e as texturas líquido-cristalinas nemáticas quirais, observadas reespectivamente por imagens de microscopia eletrônica de varredua (MEV) e microscopia óptica de luz polarizada (MOLP), confirmaram que este ordenamento foi mantido após a evaporação do solvente, com passo (P) na ordem do comprimento de onda da luz visível, resultando em filmes auto-suportados e iridescentes.
AGRADECIMENTOS Agradecemos à FAPESP, ao CNPq, à CAPES e ao LMA-IQ pela disponibilidade de utilização do microscópio eletrônico de varredura.
REFERÊNCIAS 1. Silva, R.; Haraguchi, S. K.; Muniz, E. C.; Rubira, A. F.; Quim. Nova 2009, 32, 661. DOI: http://dx.doi.org/10.1590/S0100-40422009000100022 2. Eichhorn, S. J.; Dufresne, A.; Aranguren, M.; Marcovich, N. E.; Capadona, J. R.; Rowan, S. J.; Weder, C.; Thielemans, W.; Roman, M.; Renneckar, S.; Gindl, W.; Veigel, S.; Keckes, J.; Yano, H.; Abe, K.; Nogi, M.; Nakagaito, A. N.; Mangalam, A.; Simonsen, J.; Benight, A. S.; Bismarck, A.; Berglund, L. A.; Peijs, T.; J. Mater. Sci. 2010, 45, 1. DOI: http://dx.doi.org/10.1007/s10853-009-3874-0 3. Donini, I. A. N.; De Salvi, D. T. B.; Fukumoto, F. K. Lustri, W. R.; Barud, H. S; Marchetto, R.; Messaddeq, Y.; Ribeiro, S. J. L.; Eclet. Quím. 2010, 35, 165. DOI: http://dx.doi.org/10.1007/s10853-009-3874-0 4. Barud, H. S.; Tese de Doutorado, Universidade Estadual Paulista "Júlio de Mesquita Filho", Brasil, 2010. 5. Wang, J.; Zhu, Y.; Du, J.; J. Mech. Med. Biol. 2011, 11, 285. DOI: http://dx.doi.org/10.1142/S0219519410003691 6. Klemm, D.; Heublein, B.; Fink, H.; Bohn, A.; Angew. Chem. Int. Ed. 2005, 44, 3358. DOI: http://dx.doi.org/10.1002/anie.200460587 7. Klemm, D.; Kramer, F.; Moritz, S.; Lindstrom, T.; Ankerfçrs, M.; Gray, D.; Doris, A.; Angew. Chem. Int. Ed. 2011, 50, 5438. DOI: http://dx.doi.org/10.1002/anie.201001273 8. Eichhorn, S. J.; Soft Matter 2011, 7, 303. DOI: http://dx.doi.org/10.1039/C0SM00142B 9. Habibi, Y.; Lucia, L. A.; Rojas, O. J.; Chem. Rev. 2010, 110, 3479. DOI: http://dx.doi.org/10.1021/cr900339w PMID: 20201500 10. Dong, X. Min.; Revol, J.-F.; Gray, D. G.; Cellulose 1998, 5, 19. DOI: http://dx.doi.org/10.1023/A:1009260511939 11. Habibi, Y.; Goffin, A.-L.; Schiltz, N.; Duquesne, E.; Dubois, P.; Dufresne, A.; J. Mater. Chem. 2008, 18, 5002. DOI: http://dx.doi.org/10.1039/b809212e 12. Siqueira, G.; Bras, J.; Dufresne, A.; Biomacromolecules 2008, 10, 425. DOI: http://dx.doi.org/10.1021/bm801193d PMID: 19113881 13. Beck-Candanedo, S.; Roman, M.; Gray, D. G.; Biomacromolecules 2005, 6, 1048. DOI: http://dx.doi.org/10.1021/bm049300p PMID: 15762677 14. Domingues, R. M.; Gomes, M. E.; Reis, R. L.; Biomacromolecules 2014, 15, 2327. DOI: http://dx.doi.org/10.1021/bm500524s PMID: 24914454 15. Favier, V.; Chanzy, H.; Cavaille, J. Y.; Macromolecules 1995, 28, 6365. DOI: http://dx.doi.org/10.1021/ma00122a053 16. Revol, J-F; Bradford, H.; Giasson, J.; Marchessault, R. H.; Gray, D. G.; Int. J. Biol. Macromol. 1992, 14, 170. DOI: http://dx.doi.org/10.1016/S0141-8130(05)80008-X PMID: 1390450 17. Revol, J.-F.; Godbout, L.; Gray, D. G.; J. Pulp Pap. Sci. 1998, 24, 146. 18. Klemm, D.; Kramer, F.; Moritz, S.; Lindström, T.; Ankerfors, M.; Gray, D.; Dorris, A.; Green Nanomaterials 2011, 50, 2. 19. George, J.; Ramana, K. V.; Bawa, A. S.; Siddaramaiah; Int. J. Biol. Macromol. 2011, 48, 50. DOI: http://dx.doi.org/10.1016/j.ijbiomac.2010.09.013 PMID: 20920524 20. Araki, J.; Kuga, S.; Langmuir 2001, 17, 4493. DOI: http://dx.doi.org/10.1021/la0102455 21. Beck-Candanedo, S.; Roman, M.; Gray, D. G.; Biomacromolecules 2005, 6, 1048. DOI: http://dx.doi.org/10.1021/bm049300p PMID: 15762677 22. Hirai, A.; Inui, O.; Horii, F.; Tsuji, M.; Langmuir 2008, 25, 497. DOI: http://dx.doi.org/10.1021/la802947m PMID: 19055323 23. George, J.; Carbohydr. Polym. 2012, 87, 2031. DOI: http://dx.doi.org/10.1016/j.carbpol.2011.10.019 24. Roman, M.; Winter, W. T.; Biomacromolecules 2004, 5, 1671. DOI: http://dx.doi.org/10.1021/bm034519+ PMID: 15360274 25. Pecoraro, E.; Manzani, D.; Messadeq, Y.; Ribeiro, S. J. L. Em Monomers, Polymers and Composites from Renewable Resources; Belgacem, M. N.; Gandini, A., eds.; ScienceDirect, 2008, cap. 17. 26. Hirai, A.; Inui, O.; Horii, F.; Tsuji, M.; Langmuir 2009, 25, 497. DOI: http://dx.doi.org/10.1021/la802947m PMID: 19055323 27. Dong, X. M.; Revol, J.; Gray, D.; Cellulose 1998, 5, 19. DOI: http://dx.doi.org/10.1023/A:1009260511939 28. Lima, M. S.; Borsali, R.; Macromol. Rapid Commun. 2004, 25, 771. DOI: http://dx.doi.org/10.1002/marc.200300268 29. Lu, P.; Hsieh, Y.; Carbohydr. Polym. 2010, 82, 329. DOI: http://dx.doi.org/10.1016/j.carbpol.2010.04.049 30. Li, Y.; Ragauskas, A. J.; Adv. Diverse Ind. Appl. Nanocompos. 2011, 1, 17. 31. De Salvi, D. T. B.; Barud, H. S.; Caiut, J. M. A.; Messaddeq, Y.; Ribeiro, S. J. L.; J. Sol-Gel Sci. Technol. 2012, 63, 211. DOI: http://dx.doi.org/10.1007/s10971-012-2678-x 32. Roman, M.; Winter, W. T.; Biomacromol. 2004, 5, 1671. DOI: http://dx.doi.org/10.1021/bm034519+ 33. Teixeira, E. M.; Corrêa, A. C.; Manzoli, A.; Leite, F. L.; Oliveira, C. R.; Mattoso, L. H. C.; Cellulose 2010, 17, 595. DOI: http://dx.doi.org/10.1007/s10570-010-9403-0 34. Martínez-Sanz, M.; Lopez-Rubio, A.; Lagaron, J. M.; Carbohydr. Polym. 2011, 85, 228. DOI: http://dx.doi.org/10.1016/j.carbpol.2011.02.021 35. Segal, L.; Creely, J. J.; Martin Jr., A. E.; Conrad, C. M.; Text. Res. J. 1959, 29, 786. DOI: http://dx.doi.org/10.1177/004051755902900103 36. Fleming, K.; Gray, D. G.; Matthews, S.; Chem. - Eur. J. 2001, 7, 1831. DOI: http://dx.doi.org/10.1002/1521-3765(20010504)7:9<1831::AID-CHEM1831>3.3.CO;2-J 37. Mu, X.; Gray, D. G.; Langmuir 2014, 30, 9256. DOI: http://dx.doi.org/10.1021/la501741r PMID: 25069681 38. Lagerwall, J. P.; Schütz, C.; Salajkova, M.; Noh, J.; Park, J. H.; Scalia, G.; Bergström, L.; NPG Asia Mater. 2014, 6, 80. DOI: http://dx.doi.org/10.1038/am.2013.69 39. Majoinen, J.; Kontturi, E.; Ikkala, O.; Gray, D. G.; Cellulose 2012, 19, 1599. DOI: http://dx.doi.org/10.1007/s10570-012-9733-1 40. Zhang, Y. P.; Chodavarapu, V. P.; Kirk, A. G.; Andrews, M. P.; Sens. Actuators, B 2013, 176, 692. DOI: http://dx.doi.org/10.1016/j.snb.2012.09.100 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access






