Artigo
|
|
| Otimização do processo de transesterificação em duas etapas para produção de biodiesel através do planejamento experimental doehlert Otimization of transesterification double step process (TDSP) to the production of biodiesel through doehlert experimental design |
|
Carla F. C. RuschelI,*; Marco F. FerrãoI,II; Francisco P. Dos SantosI; Dimitrios SamiosI
IInstituto de Química, Universidade Federal do Rio Grande do Sul, 91501-970 Porto Alegre - RS, Brasil Recebido em 10/07/2015 *e-mail: carlaruschel@gmail.com In this work, Doehlert experimental design was used to optimize the Transesterification Double Step Process (TDSP) method of methyl soybean oil biodiesel production which starts with a basic catalysis followed by an acidic catalysis. The conversion values were calculated from NMR spectra. Response surface was used to show the results of the interactions between the variables. This experimental design evaluated variables like catalyst and alcohol amount for the basic catalysis and time and temperature for the acidic catalysis. According to results obtained after Doehlert design application the alcohol amount was the main factor that influenced on the basic catalysis but for the acidic catalysis both time and temperature are important and their effects are opposite. It resulted on excellent conversions for both steps obtaining for the basic catalysis about 100% when was used like optimal conditions catalyst amount equal to 0.40 g and volume of methanol equal to 60 mL and for the acidic catalysis about 99% when was used like optimal conditions temperature of 65 ºC and 90 minutes for reaction time. INTRODUÇÃO A produção de biodiesel, já bem consolidada no Brasil e no mundo, há mais de uma década, é um assunto que continua a atrair interesse de vários setores, especialmente da indústria de biocombustíveis e dos pesquisadores em geral, uma vez que sempre há o objetivo de aumentar a qualidade e aprimorar o processo de produção deste combustível ainda muito valorizado.1 Este tema é um setor importante para a economia nacional que ainda necessita tanto do desenvolvimento de novas tecnologias quanto soluções para questões econômicas e sociais.2 Neste sentido, atualmente, há necessidade de pesquisas para diversas finalidades: diversificar fontes de matéria-prima, incluindo renováveis3 ou óleos residuais,4 diminuir custos de produção, criar novas metodologias de produção,5 melhorar características físico-químicas,6 qualidade e consequente rendimento e emissões do motor,7 entre outros. O processo de transesterificação em duas etapas (TDSP - Transesterification Double Step Process) utilizado neste estudo foi inicialmente desenvolvido por Samios et al. para produzir biodiesel metílico a partir de alguns óleos clássicos no Brasil como girassol e linhaça, por ser um método simples e rápido de síntese, que facilita o procedimento de separação dos produtos e resulta em ótima eficiência de conversão.8 Ao longo dos anos também vem sendo aprimorada desde a sua criação, resultando na aplicação para produção de biodiesel etílico também,9 além de possibilitar o uso de outras fontes de matéria-prima, como banha, sebo e a reutilização de óleo de fritura por exemplo.10 Neste estudo é proposta a inserção do planejamento experimental Doehlert,11 que foi desenvolvido por David H. Doehlert em 1972, como um instrumento para otimizar as condições de síntese do biodiesel produzido pelo método TDSP. Modelos multivariados, como é o caso do planejamento Doehlert, são mais completos que os univariados, pois permitem o estudo de várias variáveis simultaneamente. Este modelo reduz o número de experimentos a ser realizados e seu uso em conjunto com a metodologia de superfícies de resposta são muito utilizados para otimizar condições reacionais.12,13 A literatura mostra, entre inúmeras aplicações, o uso de planejamentos experimentais como outra forma eficiente de avaliar e aprimorar métodos de síntese de biodiesel. Em 2009, Valle et al. utilizaram planejamento Doehlert aliado ao fatorial fracionado na produção de biodiesel por etanólise de Raphanus sativus L. var. óleo Oleiferus Stokes catalisada por etóxido de sódio.14 Em outro trabalho, Borges et al. utilizaram o planejamento experimental fatorial fracionado para estabelecer as condições experimentais que melhoraram a eficiência de transesterificação de óleo de soja por rotas etílica e metílica.15 Já Hamze et al. estudaram a transesterificação do óleo de fritura. Nesse trabalho a metodologia de superfície de resposta com base no planejamento Box-Behnken foi utilizada para investigar os efeitos dos principais parâmetros de operação, obtendo bom rendimento de reação.16
PARTE EXPERIMENTAL Materiais e métodos Reagentes Este estudo utilizou o óleo de soja comercial Leve (Cambé, Brasil), além de álcool metílico (MeOH) (P.A.) - Neon (São Paulo, Brasil) e os catalisadores foram o hidróxido de potássio (KOH) (P.A.) - Synth (Diadema, Brasil) e o ácido sulfúrico (H2SO4) (P.A.) - Proquímios (Rio de Janeiro, Brasil). Também foram empregados sulfato de sódio - (P.A.) - Dinâmica (Diadema, Brasil) e clorofórmio deuterado (99,8% D com 0,05% (v/v) de TMS) - Cambridge Isotope Laboratories, Inc. (Andover, USA). Planejamento Doehlert Na Figura 1 são apresentados os níveis para os parâmetros estudados em cada fase da síntese do biodiesel metílico de óleo de soja. Primeiramente foram estudadas as variáveis julgadas como mais importantes para a primeira etapa da reação que corresponde à catálise básica: a massa de catalisador (g de KOH) e o volume de álcool (mL de CH3OH). Dentre essas duas variáveis a quantidade de catalisador foi variada em 5 níveis e a de metanol em 3, como mostrado na Figura 1. Assim a massa de KOH utilizada foi de 0,30 a 0,70 g e o volume de CH3OH variou entre 20 e 60 mL. Na segunda etapa da reação, que corresponde à catálise ácida, foram estudadas as variáveis: tempo (min.) e temperatura de reação (ºC). Para estas variáveis o tempo foi estudado em 5 níveis e a temperatura em 3, conforme apresentado na Figura 1. Desta forma, o tempo de reação variou de 30 a 150 min e a temperatura de 55 a 75 ºC. Foram realizadas ainda reações em triplicata referentes ao ponto central do planejamento Doehlert.
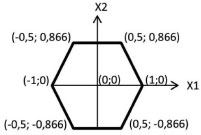 Figura 1. Valores codificados para planejamento Doehlert com ponto central em triplicata
Produção do biodiesel Para este estudo foram produzidas, no total, 18 amostras de acordo com o planejamento experimental Doehlert e com base na metodologia TDSP para produção de biodiesel metílico. Para avaliar as condições da primeira parte da reação de transesterificação (catálise básica) e da segunda parte (catálise ácida) foram sintetizadas no total 9 amostras, para cada etapa, estando incluídas as 3 replicatas referentes ao ponto central. No geral, independentemente das quantidades e condições de reação utilizadas, o processo de produção segue um padrão estabelecido pelo método TDSP. O óleo é primeiramente aquecido até temperatura de refluxo do metanol. Em seguida, é adicionada a mistura de KOH e metanol que originam a espécie ativa do catalisador (metóxido) e são mantidos na primeira etapa da reação a 65 ºC por 30 min. Após este tempo, é adicionado o ácido sulfúrico e mais metanol, utilizado em excesso para garantir o deslocamento da reação no sentido dos produtos, conforme Figura 2. Ao final, o produto é colocado no evaporador rotativo para retirada do metanol excedente, é transferido para um funil de separação para retirada do glicerol formado e são feitas sucessivas lavagens para neutralizar o pH. O biodiesel é seco em sulfato de sódio e, por fim, passa por um processo de aquecimento para evaporação de resquícios de água, é filtrado e envasado.
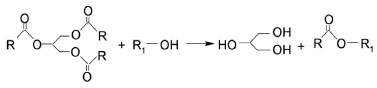 Figura 2. Esquema representativo da reação geral de transesterificação do óleo de soja com álcool primário (metanol) produzindo biodiesel e glicerol como subproduto
É importante observar que para os experimentos da catálise básica, a segunda parte da reação foi mantida constante, com quantidades de ácido sulfúrico e metanol iguais a 0,30 mL e 20 mL, respectivamente. Já para as variáveis tempo e temperatura, na segunda etapa da reação, foram analisados os resultados de conversão obtidos por espectros de ressonância magnética nuclear de hidrogênio (RMN 1H) da primeira etapa. Assim, as quantidades de catalisador e metanol que resultaram na maior conversão foram fixadas para o segundo estudo (catálise ácida). Caracterização do biodiesel por ressonância magnética nuclear de hidrogênio (RMN 1H) Os produtos finais da síntese do biodiesel foram caracterizados por ressonância magnética nuclear de hidrogênio (RMN 1H). Para a análise foram colocados 15 µL de biodiesel em um tubo de RMN e adicionado 550 µL de CDCl3. As amostras foram analisadas num espectrômetro Bruker AVANCE operando na freqüência de 400 MHz para 1H e 100 MHz para 13C, equipado com uma sonda de 5 mm com detecção direta. Os espectros foram obtidos selecionando-se alguns parâmetros na aquisição e no processamento para fornecer uma melhor resolução digital com base nos parâmetros. As condições de análise foram 16 scans e td = 256k, janela espectral de 5,5 ppm, lb = 0,30 Hz; si = 256k fornecendo uma resolução digital de 0,017 Hz/ponto. Esta técnica é rápida e simples em comparação com análises cromatográficas que exigem preparação da amostra e/ou purificação. Na análise de RMN 1H, as informações são obtidas sem necessitar derivatização ou causar inutilização da amostra, além de ser necessária uma quantidade muito pequena do material. Uma avaliação dos espectros de óleo de soja e do biodiesel metílico de óleo de soja permite inicialmente avaliar o teor residual de tri, di e monoglicerídeos nos ésteres metílicos resultantes através do sinal correspondente aos hidrogênios metilênicos da sequência glicerídica (-CH2-CH-CH2). Estes sinais localizados entre 4,1 e 4,3 ppm correspondem a quatro átomos de hidrogênio. Já o sinal referente ao grupo metino está localizado a 5,2 ppm, juntamente com sinais de átomos de hidrogênio das duplas ligações. Os sinais de mono e diglicerídeos, formados como intermediários da reação exibem sinais dos hidrogênios glicerídicos na mesma região que hidrogênios glicerídicos de triglicerídeos da matéria-prima, Figura 2. Como pode ser visto no exemplo da Figura 3, não há nenhum resíduo de mono, di ou triglicerídeos, o que fica evidenciado a partir do desaparecimento total de sinais entre 4,1 e 4,3 ppm. Assim, para avaliar a conversão de óleos em ésteres metílicos de ácidos graxos, é observado o aparecimento de um novo sinal a 3,6 ppm. Este sinal indica a formação de biodiesel, porque está na região do espectro correspondente aos átomos de hidrogênio do grupo éster metílico (COOCH3). A conversão foi analisada pelo surgimento deste sinal além da comparação com os sinais que desaparecem relacionados com o óleo de partida, em virtude de outros produtos secundários poderem ter se formado nesta mesma região do espectro de RMN. Para avaliar a conversão em éster metílico (CME), utilizou-se o sinal do hidrogênio do grupo metileno adjacente ao grupo carbonila (α-CH2) em 2,3 ppm. Este sinal foi escolhido como referência para o cálculo, uma vez que está presente em todas as moléculas de derivados de triglicerídeos, incluindo o óleo que não reagiu, mono e diglicerídeos e todas as outras espécies de cadeia longa que podem ser formados durante o procedimento. A Equação 1 mostra o cálculo da conversão da reação, pela relação dos valores da integral dos sinais de RMN de hidrogênio a partir dos hidrogênios do éster metílico (ME) e dos átomos de hidrogênio no grupo metileno adjacente (α-CH2) à carbonila, mostrados na Figura 4. 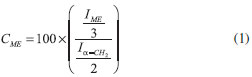
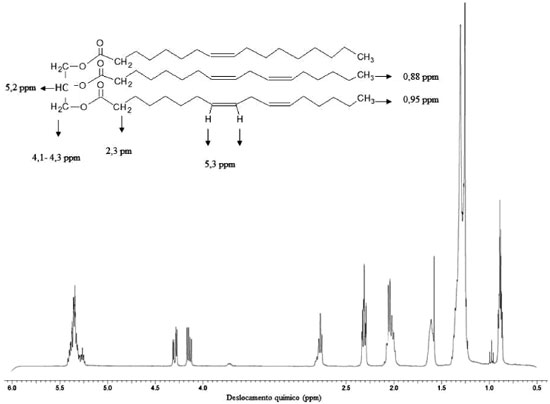 Figura 4. Espectro de RMN de 1H de biodiesel de óleo de soja produzido pelo método TDSP (experimento 2 da etapa 1)
IME é o valor da integral do sinal do éster metílico e Iα-CH2 é o valor da integral do grupo metileno adjacente ao grupo éster. Assim, a integral do éster metílico foi dividida pelo fator 3 e a integral do grupo metileno foi dividida pelo fator 2, uma vez que o éster metílico tem três hidrogênios em cada sinal -OCH3 em 3,6 ppm e dois hidrogênios do sinal referente ao grupo metileno adjacente a carbonila (α-CH2) em 2,3 ppm.10
RESULTADOS E DISCUSSÃO Ressonância magnética nuclear de hidrogênio Utilizando a Equação 1, para o cálculo da conversão do óleo de soja em ésteres metílicos, tem-se como exemplo, para o experimento número 1, o seguinte resultado: 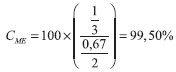 Para os demais experimentos as conversões foram calculadas da mesma forma, gerando os dados apresentados nas Tabelas 1 e 2, com as variáveis estudadas na catálise básica e na catálise ácida, respectivamente.
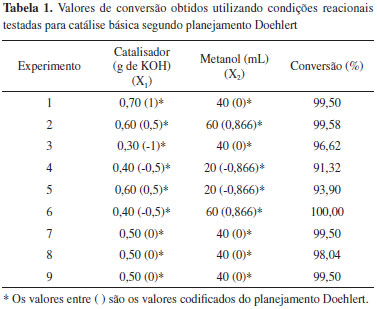
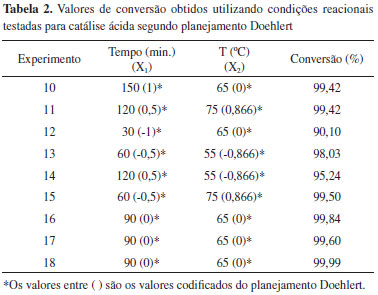
Análise da conversão para catálise básica segundo planejamento Doehlert Segundo artigo de Samios et al. para a catálise básica, a quantidade estequiométrica ideal dos reagentes é de 0,10 mols de óleo: 1 mol de álcool: 0,001 mols de catalisador, aproximadamente, ou seja, para 100 mL de óleo utilizados, deveriam ser adicionados 40 mL de metanol e 0,5 g de catalisador,8 que foram as condições utilizadas para o ponto central do planejamento. Analisando os dados da Tabela 1, iniciando pelos experimentos 7, 8 e 9, referentes ao ponto central do planejamento Doehlert, foram obtidos, em média, valores de conversão em torno de 99%. Partindo do ponto central, no qual foi utilizado 40 mL de metanol, pode-se observar também os experimentos 1 e 3, que utilizaram a mesma quantidade de metanol porém variando a quantidade de catalisador que foi diminuída para 0,30 no experimento 3 e foi aumentada para 0,70 no experimento 1. Esta variação resultou em valores de conversão maiores quando a quantidade de catalisador foi aumentada e em conversões menores quando a quantidade de catalisador foi diminuída, mostrando a sua influência na conversão. Quando o volume de metanol foi fixado em 60 mL, que é o volume máximo testado, nos experimentos 2 e 6, a conversão aumentou para 100% (maior valor obtido entre todos os experimentos) quando a massa de catalisador utilizada foi de 0,40 g e permanece praticamente igual à conversão do ponto central quando a massa de catalisador é de 0,60 g, o que também mostra a maior relevância da quantidade de metanol em relação à quantidade de catalisador. Da mesma forma, quando foi diminuído o volume de metanol para 20 mL, independentemente da quantidade de catalisador utilizada, o percentual de conversão da reação de transesterificação diminuiu consideravelmente. Além disso, nota-se também que quando se soma a redução do valor da outra variável, isto também contribui para a diminuição da conversão como é observado no experimento 4. Quando analisamos do ponto de vista da mesma quantidade de catalisador, nos experimentos 4 e 6, confirmamos que o volume de metanol é primordial para uma boa conversão da reação. Assim como no experimento 3, em que é diminuída ainda mais a quantidade de catalisador, a quantidade de metanol aumenta, o que aumenta também a conversão. Já analisando os experimentos 2 e 5, que utilizam maiores quantidades de catalisador, verificamos também que a conversão é muito maior quando o volume de metanol utilizado também é alto. Além disso, quando a quantidade de catalisador é a maior, como no experimento 1, porém se diminui a de metanol, como acontece no restante dos experimentos, a conversão é boa. As observações anteriores comprovam que o metanol, como é um reagente que participa da reação de transesterificação, é fundamental para a produção de biodiesel, e que a sua quantidade mínima ideal, para 100 mL de óleo, é de 60 mL para obtenção de uma conversão ótima de 100%. Já a quantidade mínima de catalisador para 100 mL de óleo é de 0,40 g. Análise da conversão para catálise ácida segundo planejamento Doehlert Segundo artigo de Samios et al. para a catálise ácida, a temperatura ideal de reação, que é a temperatura de refluxo do solvente (metanol), é de aproximadamente 65 ºC e o tempo de reação necessário é de 90 minutos.8 Analisando os dados da Tabela 2, os experimentos 16, 17 e 18 são referentes às condições determinadas para o ponto central do planejamento experimental Doehlert, ou seja, tempo de uma hora e meia e temperatura de 65 ºC. Nessas condições, foram obtidos ótimos valores de conversão, em média, de 99,8%, mostrando que a combinação desta temperatura e tempo de reação para a catálise ácida é suficiente para a obtenção de biodiesel. Além disso, foram estudados outros tempos de reação enquanto se manteve constante a temperatura em 65 ºC. Nessas condições, nos experimentos 10 e 12, foi observado que quando o tempo foi reduzido 3 vezes houve uma queda na conversão e quando o tempo foi aumentado consideravelmente não houve grande melhora na conversão. Quando a temperatura de reação foi reduzida em 10 ºC, ou seja, passou para 55 ºC, nos experimentos 13 e 14, foram estudadas tempos de reação de uma e duas horas. Foi observado que com o aumento do tempo de reação houve diminuição na conversão. Por fim, foi avaliada a condição de temperatura fixada em 75 ºC, 10 ºC a mais que o ponto central, com tempos de reação de uma e duas horas, nos experimentos 11 e 15. Nestes casos, independentemente do tempo de reação, obtiveram-se valores de conversão muito próximos. Quando se observa os dados a partir da variação da temperatura, fixando o tempo para fins de comparação, como nos experimentos 13 e 15, em que o tempo de reação é de uma hora e a temperatura foi aumentada de 55 para 75 ºC, verificou-se um aumento pequeno na conversão. Já para o caso dos experimentos 11 e 14, nos quais o tempo foi fixado em duas horas e a temperatura foi aumentada de 55 para 75 ºC, observou-se também uma redução do valor de conversão obtido. Conclui-se que, em geral, para os experimentos de variação de temperatura e tempo de reação da catálise ácida, há um efeito sobre o equilíbrio dessa reação, no qual o aumento de uma das variáveis avaliadas, combinado com a redução da outra, resultam em melhores valores de conversão. Tempos e temperaturas de reação muito altos não favorecem necessariamente a reação, deslocando o equilíbrio da reação no sentido dos reagentes, como no caso do experimento 11. Assim, se necessitamos, por exemplo, a otimização do estudo para tempos menores, devemos utilizar uma temperatura mais elevada de reação. De maneira geral, uma boa condição é a que foi utilizada no ponto central, com temperatura de 65 ºC e tempo de 90 minutos, obtendo valores satisfatórios de conversão. Além disso, houveram resultados não esperados, como é o caso dos valores de conversão dos experimentos 13 e 14, e que podem ser explicados pelo fato de que possivelmente a influência da variação de 10 ºC na temperatura estudada não tenha sido suficientemente grande para gerar diferenças significativas nos valores de conversão. Análise do gráfico de probabilidade normal e da superfície de resposta Após terem sido calculados os valores de conversão através dos espectros de RMN 1H, os dados foram processados utilizando planilhas eletrônicas desenvolvidas pelo Laboratório de Quimiometria Teórica e Aplicada da Universidade Estadual de Campinas (UNICAMP).17 Estas planilhas geram o gráfico de probabilidade normal que apresenta as variáveis que mais influenciam na reação em estudo, considerando o planejamento Doehlert para um modelo quadrático utilizando duas variáveis. No caso da catálise básica, como pode ser visto na Figura 5, a variável que mais influencia é a variável 2, ou seja, o volume de metanol utilizado; em seguida a variável 1, ou seja, a quantidade de catalisador (KOH) é a segunda mais importante para a reação. Na sequência, é mostrado que o efeito de segunda ordem para a variável 1 é o terceiro mais importante e que a combinação das variáveis 1 e 2 e o efeito de segunda ordem para a variável 2 não apresentam influência sobre a reação.
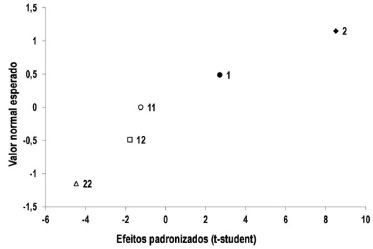 Figura 5. Gráfico de probabilidade normal para a massa de catalisador (g) e volume de metanol (mL) na primeira parte da reação
Além dos gráficos de probabilidade normal, os resultados dos experimentos realizados com base nos planejamentos Doehlert, como a conversão em ésteres metílicos (%) determinada a partir do RMN 1H, possibilitam também gerar uma superfície de resposta, que está apresentada na Figura 6. Foram testados modelos lineares e quadráticos, porém, apesar de ambos os modelos apresentarem homocedasticidade para os resíduos e uma regressão significativa com uma falta de ajuste não significativa, o modelo linear apresentou, para a catálise básica, um percentual de variância explicada somente de 78,95%. Desta forma, o modelo quadrático foi escolhido por representar melhor o comportamento dos dados e a função matemática ajustada para a catálise básica é apresentada na equação 2 gerando a superfície de resposta mostrada na Figura 6. Para esta equação foi obtida uma variância explicada de aproximadamente 98%. Para ambos os modelos foi considerado um nível de significância de 0,05, sendo os resultados da análise da variância apresentados na tabela 3. 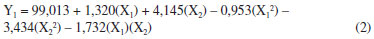
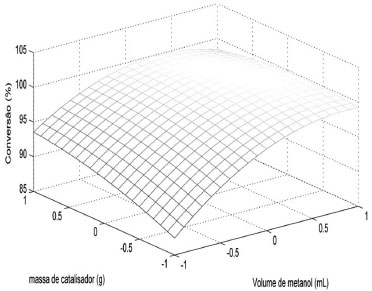 Figura 6. Superfície de resposta do planejamento Doehlert para a massa de catalisador (g) e volume de metanol (mL) na primeira parte da reação
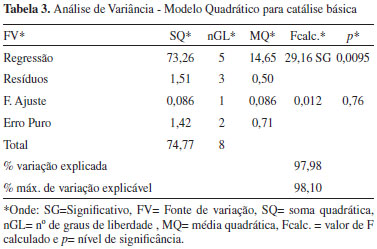
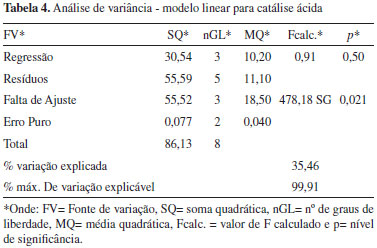
sendo Y1 é a conversão, X1 é a massa de catalisador e X2 é o volume de metanol. Como pode ser visto na Tabela 3 o modelo quadrático proposto para a catálise básica apresenta uma regressão significativa e uma falta de ajuste não significativa. Desta forma, observa-se ainda que a maior parte da variação é descrita pela equação de regressão e o restante pelos resíduos. Da variação contida nos resíduos, a maior parte é devido ao erro puro que é relativo ao erro experimental e o restante é descrito pela falta de ajuste que está diretamente relacionada com o modelo. Como pode ser visto nas Tabelas 4 e 5, tanto o modelo linear quanto o quadrático propostos para a catálise ácida apresentaram falta de ajuste significativa.
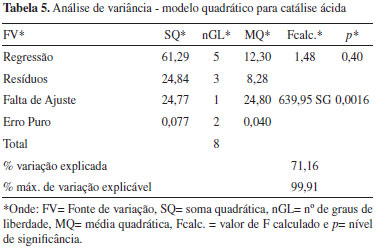
Como pode ser observado na Figura 6, o resultado obtido para a superfície de resposta confirma os resultados obtidos tanto experimentalmente quanto no gráfico de probabilidade normal (Figura 5), ou seja, a maior influência do volume de metanol no aumento da conversão da etapa básica da reação de transesterificação em relação à massa de catalisador.
CONCLUSÃO A aplicação do planejamento experimental Doehlert possibilitou a otimização da reação de transesterificação do óleo de soja com álcool metílico através da metodologia Transesterification Duble Step Process (TDSP) para a produção de biodiesel. Para a catálise básica foi obtido um bom modelo, com intervalo de confiança de 95%, uma vez que a regressão obtida foi significativa (p<0,05) e o valor de F calculado é aproximadamente 3 vezes maior que o F teórico. Além disso, não houve falta de ajuste significativo e a maior parte da variação descrita pelos resíduos é devido ao erro puro (experimental), o que é o ideal. A melhor conversão (100%) foi obtida utilizando 0,40 g de catalisador e 60 mL de metanol. A variável metanol apresentou maior influência sobre o sistema seguida da variável catalisador. Para a catálise ácida não foi possível obter um modelo linear ou quadrático adequado para a variação de temperatura (de 10 ºC) e de tempo (de 30 minutos) propostos para o estudo, uma vez que ambos apresentaram falta de ajuste, embora as condições descritas pelo ponto central já sejam suficientes para se obter ótimas conversões do ponto de vista da catálise ácida.
AGRADECIMENTOS Agradecimentos ao CNPq e ao INCT-Bioanalítica.
REFERÊNCIAS 1. Cremonez, A. P.; Feroldi, M.; Cézar Nadaleti, W.; De Rossi, E.; Feiden, A.; De Camargo, M. P.; Cremonez, F. E.; Klajn, F. F.; Renewable Sustainable Energy Rev. 2015, 42, 415. DOI: http://dx.doi.org/10.1016/j.rser.2014.10.004 2. Rico, J. A. P.; Sauer, I. L.; Renewable Sustainable Energy Rev. 2015, 45, 513. DOI: http://dx.doi.org/10.1016/j.rser.2015.01.028 3. Aransiola, E. F.; Ojumu, T. V.; Oyekola, O. O.; Madzimbamuto, T. F.; Ikhu-Omoregbe, D. I. O.; Biomass Bioenergy 2014, 61, 276. DOI: http://dx.doi.org/10.1016/j.biombioe.2013.11.014 4. Zhang, H.; Aytun Ozturk, U.; Wang, Q.; Zhao, Z.; Renewable Sustainable Energy Rev. 2014, 38, 677. DOI: http://dx.doi.org/10.1016/j.rser.2014.07.048 5. Nurfitri, I.; Maniam, G. P.; Hindryawati, N.; Yusoff, M. M.; Ganesan, S.; Energy Convers. Manage. 2013, 74, 395. DOI: http://dx.doi.org/10.1016/j.enconman.2013.04.042 6. Yaakob, Z.; Narayanan, B. N.; Padikkaparambil, S.; Unni K, S.; Akbar P, M.; Renewable Sustainable Energy Rev. 2014, 35, 136. DOI: http://dx.doi.org/10.1016/j.rser.2014.03.055 7. Shahir, V. K.; Jawahar, C. P.; Suresh, P. R.; Renewable Sustainable Energy Rev. 2015, 45, 686. DOI: http://dx.doi.org/10.1016/j.rser.2015.02.042 8. Samios, D.; Pedrotti, F.; Nicolau, A.; Reiznautt, Q. B.; Martini, D. D.; Dalcin, F. M.; Fuel Process. Technol. 2009, 90, 599. DOI: http://dx.doi.org/10.1016/j.fuproc.2008.12.011 9. Guzatto, R.; Defferrari, D.; Reiznautt, Q. B.; Cadore, Í. R.; Samios, D.; Fuel 2012, 92, 197. DOI: http://dx.doi.org/10.1016/j.fuel.2011.08.010 10. Guzatto, R.; de Martini, T. L.; Samios, D.; Fuel Process. Technol. 2011, 92, 2083. DOI: http://dx.doi.org/10.1016/j.fuproc.2011.06.013 11. Doehlert, D. H.; Klee, V. L.; Discrete Mathematics 1972, 2, 309. DOI: http://dx.doi.org/10.1016/0012-365X(72)90011-8 12. Ferreira, S. L. C.; Dos Santos, W. N. L.; Quintella, C. M.; Neto, B. B.; Bosque-Sendra, J. M.; Talanta 2004, 63, 1061. DOI: http://dx.doi.org/10.1016/j.talanta.2004.01.015 PMID: 18969534 13. Depoi, F. S.; Bentlin, F. R. S.; Ferrão, M. F.; Pozebon, D.; Anal. Methods 2012, 4, 2809. DOI: http://dx.doi.org/10.1039/c2ay25375e 14. Valle, P. W. P. A.; Rezende, T. F.; Souza, R. A.; Fortes, I. C. P.; Pasa, V. M. D.; Energy Fuels 2009, 23, 5219. DOI: http://dx.doi.org/10.1021/ef900468p 15. Borges, K. A.; Squissato, A. L.; Santos, D. Q.; Neto, W. B.; Batista, A. C. F.; Silva, T. A.; Vieira, A. T.; de Oliveira, M. F.; Hernández-Terrones, M. G.; Energy 2014, 67, 569. DOI: http://dx.doi.org/10.1016/j.energy.2014.02.012 16. Hamze, H.; Akia, M.; Yazdani, F.; Process Saf. Environ. Prot. 2015, 94, 1. DOI: http://dx.doi.org/10.1016/j.psep.2014.12.005 17. Teófilo, R. F.; Ferreira, M. M. C.; Quim. Nova 2006, 29, 338. DOI: http://dx.doi.org/10.1590/S0100-40422006000200026 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





