Artigo
|
|
| Síntese e propriedades de sílicas híbridas contendo surfactantes cetiltrialquilamônio Synthesis and properties of hybrid silicas containing cetyltrialkylammoniun surfactants |
|
Ana Flavia P. de Campos; Aurélia Retiella O. Ferreira; Dilson Cardoso*
Departamento de Engenharia Química, Universidade Federal de São Carlos, 13565-905 São Carlos - SP, Brasil Recebido em 12/08/2015 *e-mail: dilson@ufscar.com This work presents the synthesis of silicas containing cetyltrialkylammoniun surfactants in their mesopores. Initially, the aqueous dispersions of these surfactants were characterized by small-angle X-ray scattering (SAXS). The hybrid silicas obtained from these dispersions were evaluated by X-ray diffractometry (XRD) and nitrogen physisorption. The XRD showed that, increasing the head size, there is a shift of the peak corresponding to the (100) diffraction plane to smaller 2θ angles, which indicates an increase in the silicas porous diameter. The increasing of the silicas porous diameter was confirmed by nitrogen physisorption. The base catalytic properties of these hybrid silicas were evaluated in the transesterification reaction showing that those containing the cations C16Et3+ and C16Pr3+ showed better performance. INTRODUÇÃO Os primeiros materiais mesoporosos ordenados à base de sílica foram obtidos em 1992, pelo grupo de pesquisadores da Mobil,1 por meio da agregação das moléculas de surfactante em micelas, sendo estas capazes de atuar como direcionadores de estrutura, levando à formação das diferentes sílicas pertencentes aos materiais da família M41S.2 Dentre as estruturas dessa família de materiais, destaca-se a MCM-41, formada por um arranjo mesoporoso hexagonal, com sistema de poros unidimensionais. Em geral, esta estrutura apresenta elevadas áreas superficiais (> 1000 m2 g-1), alta porosidade e estreita distribuição de diâmetro de poros.3 Além dessas características, a simplicidade para sua obtenção e fácil ajuste do diâmetro de seus poros (ajustáveis entre 1,5 - 10 nm)2 fazem com que essa estrutura seja empregada em diversos processos, como catálise, adsorção, membranas, entre outros.3 O ajuste do diâmetro de poros da MCM-41 tem sido amplamente estudado desde o seu desenvolvimento. Dentre os métodos utilizados para o controle do diâmetro dessa estrutura, destaca-se o emprego de tratamentos hidrotérmicos pós-síntese,4,5 a utilização de aditivos orgânicos como agentes expansores de micelas (swelling agents)6,7 e também o emprego de surfactantes catiônicos quaternários, usualmente, surfactantes alquiltrimetilamônio com diferentes comprimentos de cauda hidrofóbica.5,7-10 Segundo Huo et al.,5 por meio do tratamento hidrotérmico pós-síntese (100 ºC) da MCM-41 preparada através da mistura dos surfactantes diquaternários C18-3-1Br e C16-7-16Br foi possível a obtenção desta sílica com diâmetro de poros de 6,0 nm. Adicionalmente, a MCM-41, além de apresentar maiores valores de área superficial e volume de poros, apresentou boa estabilidade térmica comparada à MCM-41 preparada por métodos convencionais. No entanto, quando as sílicas MCM-41 e MCM-48, obtidas a partir de surfactantes com cabeça contendo três grupos metila (CnMe3Br), foram submetidas ao mesmo tratamento hidrotérmico pós-síntese, verificou-se que apesar de apresentarem maior ordenação estrutural, não apresentaram um aumento considerável no diâmetro de seus poros. A utilização de agentes expansores de micelas, tais como compostos aromáticos, hidrocarbonetos, aminas, entre outras, de fato contribuem para o aumento do diâmetro micelar. Devido à hidrofobicidade destas moléculas, essas podem ser incorporadas ao núcleo das micelas permitindo o aumento do diâmetro micelar.11 De acordo com Beck et al.,12 é possível a obtenção da MCM-41 com diâmetro de poros de 7,5 nm através da adição de 20% em massa do 1,3,5-trimetilbenzeno no sistema reacional. Entretanto, salienta-se que a introdução de grandes quantidades de moléculas orgânicas para expansão das micelas não é considerada um procedimento viável, não somente por requerer uma quantidade razoável do composto orgânico e, consequentemente, um maior volume reacional, mas também por necessitar de procedimentos físicos adicionais para a separação dos agentes expansores além de seu reciclo para o sistema reacional.13 O emprego de surfactantes com diferentes cargas e geometrias representa também uma maneira efetiva de controlar o diâmetro micelar e, consequentemente, de obter sílicas mesoporosas com maior diâmetro de poros.11 Segundo Beck et al.,8 a preparação da MCM-41 a partir de surfactantes com cabeça contendo três grupos metila e diferentes comprimentos de cauda hidrofóbica (CnMe3Br, n = 8-16) proporcionou o aumento do diâmetro de poros da MCM-41 de 2,7 (C8Me3Br) para 3,5 nm (C16Me3Br). De acordo com Huo et al.,5 surfactantes com cabeça contendo três grupos metila com comprimento de cauda superior à 18 átomos de carbono não são bons direcionadores de estrutura para a formação da MCM-41. Além disso, a utilização desses surfactantes com comprimento de cauda superior à 22 átomos de carbono para obtenção de sílicas mesoporosas não é acessível comercialmente e o seu precursor é inviável economicamente. Em ambiente alcalino, Huo et al.5 avaliaram ainda a influência do tamanho da cabeça hidrofílica de surfactantes com comprimento de cauda de 16 átomos de carbono (C16) na formação das sílicas mesoporosas. De acordo com os autores, surfactantes com maior tamanho de cabeça, como os brometos de cetildimetilbenzilamônio (C16Me2Bz1Br), cetiltrietilamônio (C16Et3Br) e cetiltripropilamônio (C16Pr3Br) não são bons direcionadores de estrutura para obtenção da MCM-41. No entanto, em ambiente ácido, os surfactantes com maior cabeça hidrofílica, C16Et3Br e C16Pr3Br, podem ser utilizados como direcionadores de estrutura para obtenção das sílicas mesoporosas, SBA-1 e SBA-3, respectivamente.14 Lin et al.9 estudaram a influência de surfactantes com diferentes tamanhos de cabeça hidrofílica e com comprimento de cauda de 16 átomos de carbono (C16) na formação da MCM-41. Assim como Huo et al.,5 os autores observaram que a presença de um grupo etila (C16Me2Et1Br) ou um grupo benzila (C16Me2Bz1Br) na cabeça do surfactante C16 promoveu a diminuição da ordenação estrutural e do diâmetro de poros da MCM-41 de 4 nm (C16Me3Br e C16Me2Et1Br) para 3,6 nm (C16Me2Bz1Br). Segundo Lin et al.,9 a perda de ordenação estrutural da MCM-41 obtida com os surfactantes com maior tamanho de cabeça está relacionada com maiores impedimentos estéricos comparados ao surfactante C16Me3Br. Alterações tanto no tamanho da cabeça hidrofílica, como no comprimento da cauda hidrofóbica dos surfactantes, além de provocar mudanças no diâmetro das micelas e, possivelmente, dos poros da sílica mesoporosa, pode ocasionar também transição de fases dessa sílica,5 decorrente das alterações no fator de empacotamento, representado pela Equação 1:  em que: V é o volume total da cauda hidrofóbica, A0 é a área efetiva da cabeça hidrofílica localizada na superfície micelar e l é o comprimento da cauda hidrofóbica. A previsão da fase mesoporosa que será obtida em função de g, pode ser feita de acordo com os valores da Tabela 1.15

De acordo com Huo et al.,5 para surfactantes com cabeça contendo três grupos metila e diferentes comprimentos de cauda (CnMe3Br, n = 8-18), o valor da razão entre o volume e o comprimento da cauda hidrofóbica, V/l, praticamente não se altera com o aumento do comprimento da cauda hidrofóbica desse surfactante, uma vez que ambas as variáveis são diretamente dependentes do número de átomos de carbono (o valor dessa razão para a cabeça contendo o grupo trimetila é, em média A0 = 0,21 nm2). No entanto, quando o comprimento da cauda é superior a 20 átomos de carbono, ela pode se enrolar formando um helicoide e levando à diminuição do comprimento l, enquanto seu volume não muda significantemente. Sendo assim, tem-se um aumento no valor de g e a formação de micelas com menor curvatura, como é o caso dos surfactantes C20Me3Br e C22Me3Br que levaram à formação de fases mesoporosas lamelares, enquanto surfactantes alquiltrimetilamônio com comprimento de cauda igual ou inferior a 18 átomos de carbono favoreceram a formação da MCM-41.5 Posteriormente, Ryoo et al.10 demonstraram que há um aumento da ordenação estrutural da MCM-41 sintetizada com uma mistura de surfactantes com cabeça contendo três grupos metila (CnMe3Br) e etila (CnEt3Br) e com diferentes comprimentos de cauda (n = 12-22). Assim como Huo et al.,5 esses autores encontraram que o aumento da cauda hidrofóbica dos surfactantes com cabeça contendo três radicais metila favoreceu a formação de estruturas micelares com menor curvatura e a transição da formação de estruturas micelares cúbicas para estruturas micelares lamelares, sendo possível então a obtenção de uma sílica mesoporosa lamelar a partir do surfactante C22Me3Br. Já o emprego da mistura dos surfactantes com mesmo comprimento de cauda e diferentes tamanhos de cabeça C22Me3Br e C22Et3Br proporcionou novamente a formação da sílica mesoporosa hexagonal, MCM-41, o que sugere que a utilização de razões ótimas entre os surfactantes alquiltrimetilamônio e alquiltrietilamônio representa uma eficaz maneira de controlar a curvatura da superfície micelar e a formação das diferentes fases mesoporosas. Este trabalho tem como objetivo verificar a influência, na síntese de sílicas mesoporosas, de surfactantes contendo uma cauda com número fixo de átomos de carbono (C16) e diferentes tamanhos de cabeça hidrofílica.
PARTE EXPERIMENTAL Preparação dos surfactantes Os surfactantes necessários para a síntese das sílicas, brometo de cetilmetildietilamônio (C16Me1Et2Br), brometo de cetiltrietilamônio (C16Et3Br) e brometo de cetiltriproprilamônio (C16Pr3Br), foram preparados através da quaternização entre o brometo de hexadecila (1-bromohexadecano, Aldrich) e a amina terciária correspondente (metildietilamina, trietilamina e tripropilamina - Aldrich). Tipicamente, para obtenção dos surfactantes, 0,02 mol da amina foi misturado com 10% de excesso molar do brometo de alquila, ao qual foi adicionado um volume de acetonitrila correspondente a 25% do volume total dos reagentes. As reações foram conduzidas em autoclave de teflon encamisadas com aço inox, em regime isotérmico e estático. Para evitar reações de oxidação que provocam o amarelamento do produto, antes do fechamento da autoclave foi injetada nela uma vazão de nitrogênio gasoso por um período de 3 minutos. Estudos realizados em várias condições mostraram que, independente da amina e do brometo de alquila, o máximo rendimento da quaternização ocorre após 48 horas à temperatura de 100 ºC. Após o resfriamento da autoclave, o produto da reação foi submetido durante uma hora ao rotaevaporador, para remoção do acetonitrila. Após a remoção do solvente, o produto sólido foi recristalizado de 1-3 vezes com acetato de etila até que desaparecesse a coloração levemente amarela. Após a purificação, o rendimento de surfactante foi de aproximadamente 80%. A formação dos produtos desejados foi confirmada através da análise elementar (CHN) e 13C MAS-NMR. Os demais surfactantes utilizados na síntese das sílicas, o brometo de cetiltrimetilamônio e brometo de cetildimetiletilamônio, foram obtidos comercialmente (C16Me3Br e C16M2E1Br, Aldrich). Preparação das sílicas híbridas O procedimento para obtenção das sílicas híbridas foi baseado no trabalho de Araújo et al.,17 empregando uma mistura reacional de composição descrita na Equação 2, porém com tempo e temperatura de tratamento hidrotérmico de 24 horas e 30 ºC, respectivamente. 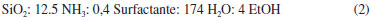 Os quatro mols de etanol presentes na composição são oriundos da hidrólise da fonte de sílica (ortossilicato de tetraetila, denominado TEOS). Caracterização As emulsões aquosas dos surfactantes C16Me3Br, C16Et3Br e C16Pr3Br foram caracterizadas por espalhamento de raios X a ângulos pequenos (SAXS). As curvas de espalhamento foram coletadas usando a linha SAXS2 do Laboratório Nacional de luz Síncrotron (LNLS). O comprimento da radiação e a distância amostra-detector foram de λ = 0,1549 e 562,5 nm, respectivamente. Através da equação de espalhamento (Equação 3) e da equação de Bragg (Equação 4) determinou-se a distância intermicelar (Equação 5). Nestas equações, 2θ é o ângulo de espalhamento em relação à direção da radiação incidente e λ o comprimento da radiação utilizada:    As sílicas foram caracterizadas por difratometria de raios X para identificação da fase e do parâmetro de rede (a0) através da Equação 6. Foi utilizado um difratômetro da Marca Rigaku, modelo Ultima IV. A radiação usada foi do Kα do Cu e os dados foram coletados em uma variação angular 2θ de 1,2 a 10º.  A termogravimetria foi realizada para determinação da perda de massa do material orgânico ocluído no interior dos poros e para determinação da razão Cátion/SiO2 nas sílicas híbridas. Fez-se uso de uma termobalança, modelo SDT Q600 V20.9 do Laboratório de Catálise DEQ-UFSCar. Aproximadamente 0,01 gramas de amostra foram aquecidas em um cadinho de platina, entre 25 e 650 ºC sob taxa de aquecimento de 10 ºC min-1, em atmosfera oxidante (ar sintético) a 30 mL min-1. As sílicas obtidas nesse estudo foram caracterizadas também por fisissorção de nitrogênio, para determinação da área específica, do diâmetro de poros (Dp) e, juntamente com a técnica de difratometria de raios X, da espessura da parede (e), através da Equação 7. Para realização das medidas, as sílicas foram previamente calcinadas com taxa de aquecimento de 5 ºC min-1 da temperatura ambiente até 150 ºC (permanecendo por 2 horas), em seguida 10 ºC min-1 até atingir 300 ºC (permanecendo por 2 horas) e, por fim, a 10 ºC min-1 até 550 ºC (permanecendo por 5 horas). A área específica foi determinada pelo método de Brunauer, Emmett e Teller (BET), sendo o cálculo feito considerando a região de pressão relativa (P/P0) entre 0 e 0,3. As curvas de distribuição do diâmetro de poros foram obtidas aplicando-se o método BJH a partir das isotermas de adsorção. As isotermas foram determinadas no equipamento ASAP 2020 da Micromeritics. Inicialmente, as sílicas foram pré-tratadas a 120 ºC e sob vácuo para remoção das moléculas de água fisissorvida.  A microscopia eletrônica de varredura (MEV) foi utilizada para obtenção das imagens das sílicas. As sílicas foram dispersas em acetona e sonicadas por 1 hora. Em seguida o sobrenadante foi depositado em porta amostra polido de alumínio, deixado em dessecador por 12 h e levado para metalização com ouro. As imagens foram coletadas no microscópio eletrônico de varredura FEI INSPECT S50. A avaliação catalítica das sílicas híbridas foi realizada através da reação de transesterificação do acetato de etila com metanol, representada pela Equação 8. Essa reação foi realizada em um reator com capacidade de 50 mL, à temperatura de 30 ºC, contendo 4% (mássica) de catalisador, razão molar álcool/éster igual a 6 e tempo de reação de 10 min. 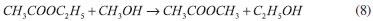
RESULTADOS E DISCUSSÃO Formação de micelas contendo surfactantes cetiltrialquilamônio Na Figura 1 são apresentadas as curvas de SAXS decorrentes das micelas catiônicas das dispersões aquosas com concentração 0,16 mol L-1 dos surfactantes C16Me3Br, C16Et3Br e C16Pr3Br. Essa concentração corresponde à razão de síntese surfactante/SiO2 de 0,4 (Equação 1). Como pode-se observar, a intensidade das bandas de espalhamento do surfactante que contem cabeça com três radicais metila é muito maior que os outros dois surfactantes, que possuem substituintes maiores. Portanto, de acordo com estes resultados, o aumento do tamanho da cabeça dos surfactantes com cauda cetila levou à desorganização do sistema micelar. Segundo Aswal et al.,18 a primeira banda (q ≈ 0,6 nm-1) é referente ao espalhamento de raios X no núcleo das micelas e a segunda banda (q ≈ 1,1 nm-1) referente ao espalhamento na camada dos ânions brometo, organizados em torno das micelas.
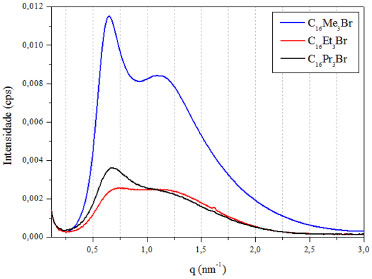 Figura 1. Curvas de SAXS das dispersões aquosas das micelas dos surfactantes com diferentes tamanhos de cabeça, C16Me3Br, C16Et3Br e C16Pr3Br (concentração de surfactante de 0.16 mol L-1)
Segundo Lin et al.9 e Sastry et al.,19 o aumento da desorganização com o tamanho da cabeça do surfactante é decorrente de impedimentos estéricos durante a micelização, promovendo uma menor condensação de ânions brometo ao redor das micelas dos surfactantes C16Et3Br e C16Pr3Br. De acordo com Mukerjee et al.,20 a menor condensação dos ânions brometo ao redor das micelas dos surfactantes C16Et3Br e C16Pr3Br está relacionado com o menor número de moléculas desses surfactantes presentes nas micelas, comparado às micelas do surfactante C16Me3Br. Como observado na Tabela 1, alterações na área da cabeça catiônica dos surfactantes com cauda cetila ocasionam mudanças no fator de empacotamento e na organização micelar (Figura 1). Assim sendo, seria interessante estimar o valor do fator de empacotamento g para os surfactantes utilizados neste trabalho e sua possível influência na estrutura das sílicas formadas. A estimativa de g foi realizada aplicando-se o cálculo do volume V e do comprimento l da cauda hidrofóbica (Equações 9 e 10)21 na Equação 1. Nestas equações, n(CH3) e m(CH2) representam o número de grupos metila e metileno, respectivamente, da cauda do surfactante. 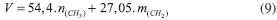 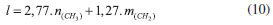 Os valores de A0 usados na Equação 1 foram estimados por Warr et al.22 Os resultados dos valores de g para alguns dos surfactantes utilizados nesse estudo estão apresentados na Tabela 2.
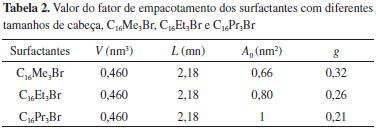
Como pode-se observar na Tabela 2, o aumento do tamanho da cabeça dos surfactantes com cauda cetila implicou na diminuição de g, decorrente do aumento da área da cabeça dos surfactantes, A0. Entretanto, os resultados de g da Tabela 2 mostram que todos os surfactantes utilizados neste estudo apresentaram valores de g inferiores a 0,33. Esses resultados comparados com os da Tabela 1 indicam que suas dispersões aquosas dos surfactantes da Tabela 2 devem estar constituídas por micelas esféricas.15 Como o valor de g encontra-se em uma mesma faixa da Tabela 1, espera-se que o uso desses surfactantes na síntese de sílicas dê origem a uma mesma fase. Formação de sílicas híbridas contendo surfactantes cetiltrialquilamônio A Figura 2 apresenta os difratogramas de raios X das sílicas híbridas preparadas a partir dos surfactantes com cauda C16 e diferentes tamanhos de cabeça: C16Me3Br, C16Me2Et1Br, C16Me1Et2Br, C16Et3Br, C16Pr3Br. Como pode-se observar, as sílicas preparadas a partir dos surfactantes C16Me3Br e C16M2E1Br apresentaram quatro bandas de difração, correspondentes aos planos (100), (110), (200) e (210), característicos da MCM-41. Comparado ao difratograma da MCM-41 preparada com o C16Me3Br, observa-se que o aumento do tamanho da cabeça dos surfactantes provocou o deslocamento da banda referente ao plano (100) para ângulos menores. Isso significa um aumento da distância interplanar (d100), apresentados na Tabela 3. Entretanto, em paralelo, verifica-se que o aumento do tamanho da cabeça dos surfactantes provocou uma diminuição da intensidade e um alargamento da banda referente ao plano (100), significando a formação de sílicas com menor ordenação estrutural. No caso extremo das sílicas preparadas com os surfactantes C16Et3Br e C16Pr3Br, observa-se a presença de apenas uma banda de difração, correspondente ao plano (100). Estes resultados estão de acordo com as curvas de SAXS da Figura 1, na qual se pode observar a formação de micelas com menor organização para estes dois surfactantes.
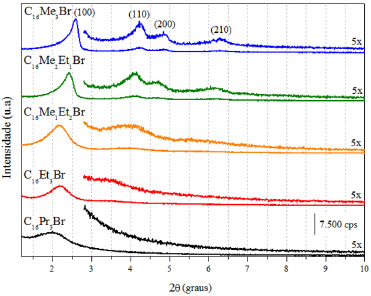 Figura 2. Difratogramas de raios X das sílicas sintetizadas a partir de surfactantes com cauda cetila e diferentes tamanhos de cabeça
As dispersões aquosas dos surfactantes indicados na Tabela 2 devem ser constituídas de micelas esféricas, tendo em vista que o fator de empacotamento é inferior a 0,33. No entanto os difratogramas das sílicas obtidas com esses surfactantes (Figura 2) mostram que elas são mesoporosas sem organização ou com estrutura hexagonal, referente a MCM-41. Essa diferença de resultados é decorrente do mecanismo cooperativo,23 no qual se supõe que a presença das espécies de sílica modifica o formato das micelas de esférica para cilíndrica. Segundo a Tabela 1, se fosse um sistema em dispersão aquosa, essa organização micelar corresponderia a um fator de empacotamento 0,33 < g < 0,5. As isotermas de fisissorção de nitrogênio das sílicas calcinadas preparadas a partir dos surfactantes com diferentes tamanhos de cabeça são apresentadas na Figura 3. Verifica-se que com o aumento da cabeça do surfactante há uma tendência de aumento do volume máximo de N2 adsorvido, além de um gradual deslocamento da rampa de preenchimento dos mesoporos para maiores valores de pressão relativa. Isto sugere que, nesse mesmo sentido, haja um aumento do diâmetro dos poros dessas sílicas. Todas as sílicas apresentaram área superficial BET superior a 1000 m2 g-1 indicadas na Tabela 1.
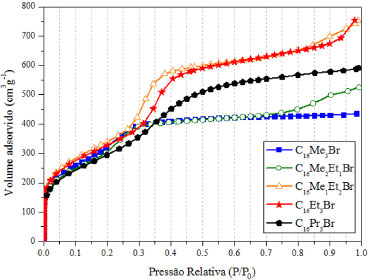 Figura 3. Isotermas de fisissorção de nitrogênio das sílicas calcinadas preparadas a partir de surfactantes com cauda cetila e diferentes tamanhos de cabeça
A partir das isotermas de adsorção de N2 foram calculadas as curvas de distribuição do diâmetro de poros das sílicas, representadas pela Figura 4. Observa-se, em todos os casos, uma distribuição unimodal, com máximos localizados entre 1,5 e 3,0 nm. Além disso, verifica-se um deslocamento dos máximos das curvas de distribuição para diâmetros de poros maiores em função do emprego de surfactantes com maior tamanho de cabeça, indicando a expansão dos diâmetros dos poros das sílicas. A Figura 4 mostra também que, com o aumento do tamanho da cabeça do surfactante, o valor da derivada passa por um máximo na sílica formada na presença surfactante C16Me1Et2Br. Isso é um indício de que, nesse mesmo sentido, a uniformidade do diâmetro dos poros passa por um máximo. Esse indício é confirmado pelo valor da largura à meia altura, l1/2, como pode-se observar na Tabela 3.
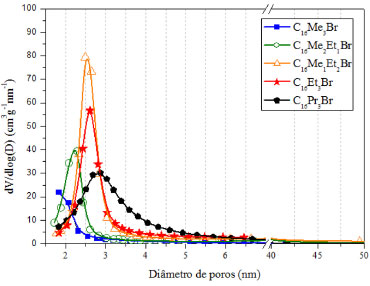 Figura 4. Curvas de distribuição do tamanho de poros das sílicas calcinadas preparadas a partir de surfactantes com cauda cetila e diferentes tamanhos de cabeça
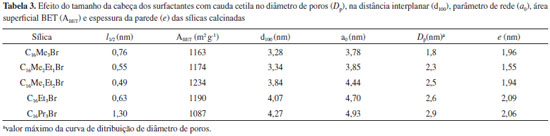
A Tabela 3 compara várias propriedades das sílicas calcinadas e preparadas a partir dos surfactantes com cauda cetila e com diferentes tamanhos de cabeça. Observa-se que o aumento do tamanho da cabeça do surfactante provocou o aumento do diâmetro de poros e da distância interplanar. Estas sílicas apresentam espessura média de parede de aproximadamente 2 nm, mas sem uma tendência clara relacionada ao tamanho da cabeça do surfactante. Os termogramas (a) e as curvas dm/dT (b) das sílicas híbridas preparadas a partir dos surfactantes com cauda cetila e diferentes tamanhos de cabeça são apresentados na Figura 5. Como pode-se observar, as curvas de decomposição desses materiais ocorrem através de quatro estágios, cujas faixas de temperatura são aproximadamente as seguintes: (I) até 100 ºC, (II) entre 100 e 300 ºC, (III) entre 300 e 400 ºC, e (IV) acima de 400 ºC. Segundo Kleitz et al.24 a análise dos produtos dessas regiões, por espectroscopia de massas, indica que ocorre (I) a dessorção das moléculas de água, (II) e (III) a decomposição dos cátions orgânicos e (IV) a saída de moléculas de água decorrentes da condensação de grupos silanóis.
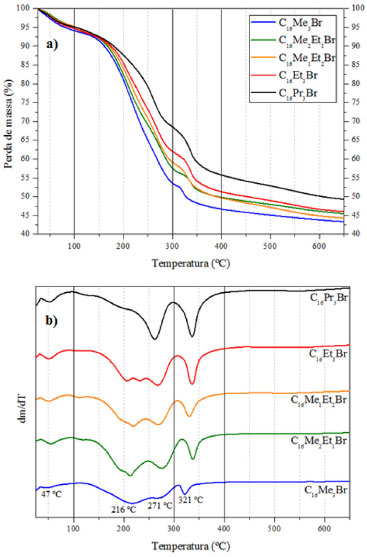 Figura 5. Termogramas (a) e curvas dm/dT (b) em atmosfera oxidante das sílicas sintetizadas com os surfactantes com cauda cetila e diferentes tamanhos de cabeça
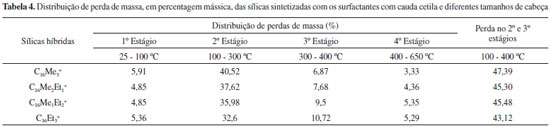
De acordo com esses autores,24 a primeira etapa de decomposição do cátion C16Me3+ (etapa II) da MCM-41 é endotérmica e consiste na eliminação dos grupos da cabeça do surfactante, ou seja, a formação da trimetilamina (N+(CH3)3) e de hidrocarbonetos. Estes resultados foram confirmados por Keene et al.,25 identificando que o principal hidrocarboneto é o hexadeceno, formado via degradação de Hoffmann (216 ºC). Ainda dentro da etapa II, Kleitz et al.24 identificaram ainda a presença de hidrocarbonetos menores, decorrentes da fragmentação do hexadeceno (270 ºC). A próxima etapa de decomposição do cátion C16Me3+, (etapa III) corresponde à oxidação dos compostos orgânicos (320 ºC) nos mesoporos recém-formados da sílica, levando à formação de dióxido de carbono, água, entre outras. A partir da Figura 5 foi calculada a distribuição de perda de massa (em percentagem mássica), cujos resultados são apresentados na Tabela 4. Pode-se observar que quanto menor a cabeça dos surfactantes com cauda cetila, maior a perda de massa referente à decomposição do cátion orgânico. Ou seja, quanto menor o tamanho da cabeça dos surfactantes com cauda cetila, maior a razão Cátion:SiO2.
Avaliação catalítica das sílicas híbridas Kubota et al.26 encontraram que a sílica MCM-41 contendo o cátion C16Me3+ em seus poros apresentou elevada atividade catalítica na condensação de Knoevenagel. Segundo esses autores, a atividade da MCM-41 híbrida é decorrente da basicidade dos ânions silóxi (≡SiO-) associados aos cátions C16Me3+. Esses resultados foram confirmados por Martins et al.27 através da Ressonância Magnética Nuclear de 29Si (CP-29Si-MAS-RMN) e Espectroscopia de Fotoelétrons estimulados por Raios X (O1s XPS). Sendo assim, as sílicas sintetizadas com os surfactantes com cauda cetila e diferentes tamanhos de cabeça foram avaliadas cataliticamente na reação modelo de transesterificação (Equação 8). A Tabela 5 apresenta os resultados de conversão de acetato de etila em função da razão molar Cátion:SiO2 das sílicas contendo os cátions C16Me3+, C16Et3+ e C16Pr3+. A razão molar Cátion:SiO2 foi estimada a partir dos resultados da perda de massa do cátion orgânico apresentados na última coluna da Tabela 4.
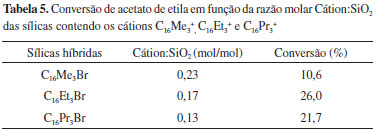
Os resultados da Tabela 5 mostram que o teor de cátion nas sílicas híbridas diminui na sequência C16Me3+ > C16Et3+ > C16Pr3+, ou seja, com o aumento do tamanho de cabeça do cátion (Tabela 2). Consequentemente, nessa mesma ordem diminui a quantidade de sítios catalíticos, isto é, de ânions silóxi. No entanto, a atividade catalítica segue uma sequência contrária: um aumento da atividade com a diminuição do teor de cátion. Uma possível explicação para esse comportamento seria que, com o aumento do tamanho do cátion, há uma diminuição da sua densidade de carga, tornando-os menos eletronegativos. Portanto, os ânions silóxi se tornam mais básicos.28 Como consequência, os sítios presentes na sílica contendo os cátions C16Pr3+ devem ser os mais fortes. No entanto, isso não explica porque a sílica que contem C16Et3+ possui a maior atividade catalítica. A Figura 6 apresenta as imagens de microscopia eletrônica de varredura das sílicas contendo os cátions da Tabela 5. Como se observa, a imagem da sílica contendo o cátion (b) C16Et3+ mostra a formação de partículas com dimensões muito menores que as imagens das sílicas contendo os cátions (a) C16Me3+ e (c) C16Pr3+. Dessa forma, acredita-se que sua melhor atividade catalítica seja decorrente da maior acessibilidade dos reagentes aos sítios catalíticos, em função do aumento de sua área superficial, comparada às sílicas contendo os cátions C16Me3+ e C16Pr3+.
 Figura 6. Micrografias das sílicas contendo os cátions (a) C16Me3+, (b) C16Et3+ e (c) C16Pr3+
CONCLUSÃO Este trabalho apresenta o comportamento das dispersões aquosas de surfactantes cetiltrialquilamônio, bem como as propriedades de sílicas mesoporosas híbridas contendo esses cátions. As curvas de espalhamento de raios X a ângulos pequenos (SAXS) das dispersões aquosas destes surfactantes mostraram uma diminuição da organização micelar com o aumento do tamanho da cabeça desses, conforme a sequência: C16Me3Br < C16Et3Br < C16Pr3Br. Provavelmente, com o aumento do tamanho da cabeça dos surfactantes, essa desorganização seja decorrente de impedimentos estéricos e, consequentemente, da menor condensação dos ânions brometo ao redor das micelas. Os difratogramas de raios X (DRX) das sílicas sintetizadas com os surfactantes cetiltrialquilamônio mostraram que o aumento do tamanho da cabeça provocou o deslocamento da banda de difração referente ao plano (100) para ângulos menores. Este resultado indica que, com o aumento do tamanho da cabeça dos surfactantes, há um aumento do diâmetro de poros das sílicas. Estes resultados foram confirmados pela fisissorção de nitrogênio. As sílicas híbridas contendo os cátions cetiltrialquilamônio possuem ânions silóxi com propriedades básicas, com atividade catalítica para a reação modelo de transesterificação. Os resultados mostraram também que a atividade catalítica aumenta com o tamanho da cabeça do cátion e também da área superficial das sílicas.
AGRADECIMENTOS Agradecemos ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo apoio na realização deste trabalho.
REFERÊNCIAS 1. Kresge, C. T.; Leonowics, M. E.; Roth, W. J.; Vartuli J. C.; US pat. 5,098,684 1992. 2. Meynen, V.; Cool, P.; Vansant, E. F.; Microporous Mesoporous Mater. 2009, 125, 170. DOI: http://dx.doi.org/10.1016/j.micromeso.2009.03.046 3. Keene, M. T. J.; Gougeon, R. D. M.; Denoyel, R.; Harris, R. K.; Rouquerol, J.; Llewellyn, P. L.; J. Mater. Chem. 1999, 9, 2843. DOI: http://dx.doi.org/10.1039/a904937a 4. Kruk, M.; Jaroniec, M.; Chem. Mater. 1997, 9, 2499. DOI: http://dx.doi.org/10.1021/cm970128o 5. Huo Q.; Margolese D. I.; Stucky, G. D.; Chem. Mater. 1996, 8, 1147. DOI: http://dx.doi.org/10.1021/cm960137h 6. Sayari, A.; Yang, Y.; Kruk, M.; Jaroniec, M.; J. Phys. Chem. B 1999, 103, 3651. DOI: http://dx.doi.org/10.1021/jp984504j 7. Jana, S. K.; Mochizuki, A.; Namba S.; Catal. Surv. Asia 2004, 8, 1. DOI: http://dx.doi.org/10.1023/B:CATS.0000015110.85694.d9 8. Beck, J. S.; Vartuli, J. C.; Roth, W. J.; Leonowicz, M. E.; Kresge, C. T.; Schmitt, K. D.; Chu, C. T-W.; Olson D. H.; Sheppard E. W.; McCullen, S. B.; Higgins J. B.; Schelenker J. L.; J. Am. Chem. Soc. 1992, 114, 10843. DOI: http://dx.doi.org/10.1021/ja00053a021 9. Lin, H-P.; Cheng, S.; Mou, C-Y.; Microporous Mater. 1997, 10, 111. DOI: http://dx.doi.org/10.1016/S0927-6513(96)00125-3 10. Ryoo, R.; Ko, C. H.; Park, I-S.; Chem. Commun. 1999, 1413. DOI: http://dx.doi.org/10.1039/a904355a 11. Wang, X.; Bu, X.; Feng, P.; Porous Inorganic Materials, 2th ed., John Wiley & Sons, 2005. 12. Beck, J.S.; US pat. 5,057,296, 1991. 13. Corma, A.; Kan, Q.; Navarro, M. T.; Pérez-Pariente, J.; Rey, F.; Chem. Mater. 1997, 9, 2123. DOI: http://dx.doi.org/10.1021/cm970203v 14. Kao, H-M.; Liao, Y-W.; Ting, C-C.; Microporous Mesoporous Mater. 2007, 98, 80. DOI: http://dx.doi.org/10.1016/j.micromeso.2006.08.018 15. Israelachvili, J. N.; Mitchell, D. J.; Ninham, B. W. J.; J. Chem. Soc. 1976, 72, 1525. 16. Soler-Lllia, G. J. A. A.; Sanchez, C.; Lebeau, B.; Patarin, J. Chem. Rev. 2002, 102, 4093. DOI: http://dx.doi.org/10.1021/cr0200062 17. Araújo, J. A.; Cruz, F. T.; Cruz, I. H.; Cardoso, D.; Microporous Mesoporous Mater. 2013, 180, 14. DOI: http://dx.doi.org/10.1016/j.micromeso.2013.05.010 18. Aswal, V. K.; Goyal, P. S.; Amenitsch, H.; Bernstorff, S.; J. Phys. 2004, 63, 333. 19. Sastry, N. V.; Vaghela, N. M.; Aswal, V. K.; Fluid Phase Equilib. 2012, 327, 2. DOI: http://dx.doi.org/10.1016/j.fluid.2012.04.013 20. Mukerjee, P.; Mysels, K. J.; U.S. Gov. Printing Office, Superintendent of Documents, 1971. 21. Patrick, H. N.; Warr, G. G.; Manne, S.; Aksay, I. A.; Langmuir 1999, 15, 1685. DOI: http://dx.doi.org/10.1021/la981612o 22. Warr, G. G.; Zemb, T. N.; Drifford, M.; J. Phys. Chem. 1990, 94, 3086. DOI: http://dx.doi.org/10.1021/j100370a063 23. Chen, C. Y.; Burkette, S. L.; Li, H. X.; Davis, M. E.; Microporous Mater. 1993, 2, 27. DOI: http://dx.doi.org/10.1016/0927-6513(93)80058-3 24. Kleitz, F.; Schmidt, W.; Schüth, F.; Microporous Mesoporous Mater. 2001, 44-45, 95. DOI: http://dx.doi.org/10.1016/S1387-1811(01)00173-1 25. Keene, M. T. J.; Gougeon, R. D. M.; Denoyel, R.; Harris, R. K.; Rouquerol, J.; Llewellyn, P. L.; J. Mater. Chem. 1999, 9, 2843. DOI: http://dx.doi.org/10.1039/a904937a 26. Kubota, Y.; Nishizaki, Y.; Ikeya, H.; Saeki, M.; Hida, T.; Kawazu, S.; Yoshida, M.; Fujii, H.; Sugi, Y.; Microporous Mesoporous Mater. 2004, 70, 135. DOI: http://dx.doi.org/10.1016/j.micromeso.2004.02.017 27. Martins, L.; Bonagamba, T. J.; Azevedo, E. R.; Bargiela, P.; Cardoso, D.; Appl. Catal., A 2006, 312, 77. DOI: http://dx.doi.org/10.1016/j.apcata.2006.06.035 28. Almeida, K. A.; Martins, L.; Cardoso, D.; Quim. Nova 2010, 33, 1077. DOI: http://dx.doi.org/10.1590/S0100-40422010000100030 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access