Educação
|
|
| Metodologia experimental para reações gás-líquido Experimental methodology for gas-liquid systems |
|
Lilian C. Mello*; Edmilson R. de Castro; Luiz A. Jermolovicius
Escola de Engenharia Mauá, Instituto Mauá de Tecnologia, 09580-900 São Caetano do Sul-SP, Brasil Recebido em 28/09/2015 *e-mail: lc_mello@hotmail.com Although the gas-liquid reactions are employed in many industrial processes, this issue in the most of time is not included in the curriculum of Chemistry and Chemical Engineering courses. This work aims to propose the study of gas-liquid reaction for the degree course, considering a widespread system, the reaction of CO2-NaOH. A reaction mechanism was proposed considering all the intermediate reactions. For each point collected in the outlet solution all the products formed were quantified included residual absorbing solutions. The pH of the outlet solution received a special attention, because with this information was possible to study the controversy that there is in the state of art between some authors in consider the product of the reaction bicarbonate when under conditions of high temperature of or long exposure time of the liquid to gas. For this study was used a continuous stirred-tank reactor in which the gas phase simulate a bubble with a defined size in contact with the liquid phase. The experimental were made by trails under atmospheric pressure, using a feed mixture containing 76% to 69% of CO2 and 24% to 31% of synthetic air and as liquid solution sodium hydroxide 0.015 mol L-1, 0.08 mol L-1, 0.56 mol L-1 and 2.0 mol L-1. The experimental results obtained and the behavior of CO2-NaOH reaction were compared with the data reported in the literature and show a good performance. INTRODUÇÃO Reações gás-líquido são empregadas em muitos processos industriais e frequentemente o maior interesse nessas reações compreende os processos de separação e purificação, bem como os processos de síntese para a obtenção de produtos.1-3 Apesar disso, este tema na maioria das vezes não é incluído no currículo dos cursos de química e engenharia química,3 devido ao fato que as reações gás-líquido serem sistemas reagentes bifásicos, o que torna seu estudo mais complexo do que das reações em fase homogênea (líquida ou gás), pois é necessário considerar, simultaneamente, o fenômeno cinético e o de transferência da massa. Aliado a esse aspecto, junta-se a falta de equipamentos de laboratório, de custo acessível, que permitam realizar experimentos quantitativos com essas reações. O equipamento descrito neste artigo visa suprir esta lacuna e permitir que as reações gás-líquido possam ser mais amiúde assunto de experimentos didáticos. O estudo do comportamento destas reações com relação à cinética, bem como os fenômenos físicos envolvidos no sistema como área interfacial efetiva e os coeficientes de transferência de massa deveriam ser mais estudados, pois erros nestes parâmetros podem acarretar em falhas de projeto.4 Entretanto, os aspectos químicos das reações gás-líquido são costumeiramente abordados de maneira simples considerando se a reação é lenta ou rápida, se apresenta uma cinética linear ou não linear, e qual fase é a limitante na reação. Embora estes tópicos sejam importantes para uma apresentação do tema, ainda não é possível identificar todos os efeitos que caracterizam as reações gás-líquido.3 Desta forma, partindo-se de conhecimentos fundamentais de química é proposto um estudo das reações gás-líquido, tomando como base um exemplo prático e bem difundido deste tipo de reação. Considerando o processo de absorção de dióxido de carbono (CO2) presente numa corrente gasosa por uma solução absorvedora,5-7 propõe-se um experimento para o sistema CO2-NaOH, que pode ser aplicado para os alunos de graduação do curso de Química e Engenharia Química e com conhecimentos de química básica é possível explorar esta reação usando como base a controvérsia que há no estado da arte com relação a considerar ou não a formação do hidrogenocarbonato (bicarbonato), pois segundo o autor Hikita,8 após um longo tempo de exposição entre os reagentes ou sob condições de alta temperatura o efeito da reação entre o CO2 com para a formação do não pode ser desconsiderada, como que é usual.9-11 Para explorar com os alunos este tópico e levar a um termo esta discussão, foi proposto um mecanismo de reação para o sistema CO2-NaOH baseado na sequência de suas reações até a formação final de carbonato. Esta reação foi realizada num equipamento em escala laboratorial idealizado por Levenspiel,12 que possibilita o estudo dos fenômenos que envolvem as reações gás-líquido, sabendo reconhecer e explicar o mecanismo de reação do sistema fluído-fluído e os parâmetros que influenciam nesta reação.13 O equipamento laboratorial é especificamente, um reator de mistura, em que a fase gás simula uma bolha de tamanho definido em contato com a fase líquida. A configuração do reator proporciona que as variáveis tamanho de bolha e velocidade de agitação das fases possam ser alteradas de maneira conhecida. Os resultados experimentais são interpretados com base na quantificação do e do formados a partir da técnica de volumetria ácido-base com o acompanhamento do pH ao longo da titulação, além da adição de indicadores visuais fenolftaleína e alaranjando de metila. O mecanismo de reação proposto foi estudado segundo o detalhamento de cada etapa da reação.14,15
FUNDAMENTAÇÃO TEÓRICA Fundamentos da reação gás-líquido absorção reativa Segundo Khol e Seader,16,17 a reação gás-líquido consiste na transferência de um componente presente na fase gás para fase líquida na qual este componente é solúvel. Baseado na natureza das interações entre a solução absorvedora e o gás contaminante presente na corrente de gás, a reação gás-líquido, considerando como ela ocorre, pode ser classificada em: absorção física, absorção com reação reversível e absorção com reação irreversível. A absorção física ocorre quando o contaminante da corrente gasosa (que se deseja purificar) apresenta maior solubilidade na solução absorvedora do que os outros componentes da referida corrente, sem, contudo, reagir com o meio absorvedor.16 Esta absorção é vantajosa para altas concentrações na fase gasosa (acima de 10% molar) e pressões parciais acima de 1400 kPa. Na absorção química, se tem pelo menos uma reação química na fase líquida, que pode ser irreversível ou reversível. A reação química ocorre entre o componente gasoso que será absorvido e os componentes da fase líquida. Para uma absorção com reação reversível, o produto de reação formado possui ligações química fracas. Já na absorção com uma reação irreversível, o produto de reação formado não é decomposto facilmente. Reação química na fase líquida A maioria dos estudos de reação gás-líquido com o objetivo de purificar uma corrente gasosa envolve reações químicas, e por esta razão, deve-se entender a natureza das mesmas. Contudo, para os estudos que envolvem a reação CO2-NaOH com objetivo de purificar uma corrente gasosa, estes foram conduzidos sob condições limitadas e modelos simplistas foram considerados para estudar as reações químicas envolvidas neste processo.8 Sabe-se que o CO2, também conhecido como anidrido carbônico,11 ácido de Lewis, reage com água formando uma solução de caráter ácido, conforme a reação (r.1). 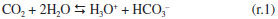 O mesmo autor ainda argumenta que a reação entre o CO2 com uma base B pode ser escrita de forma generalizada como a reação (r.2).11  O composto CO2·B pode ser interpretado como um complexo formado entre o CO2 e a base.13 Partindo-se de uma solução de NaOH para reagir com CO2, as reações que ocorrem neste processo estão apresentadas na Tabela 1.8,10,18
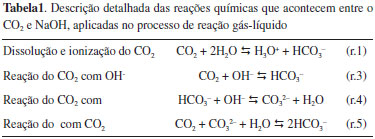
Segundo Astarita,11 a contribuição relativa das reações (1) e (3) depende do pH da solução. Para pH menor do que 7,0 a reação (r.1) é o principal mecanismo, já para soluções com pH maior do que 10,0 a reação (r.3) irá predominar. Vale ressaltar que ambas as reações são importantes em pH intermediários na faixa de 7,0 a 10,0. Contudo, para maioria dos estudos envolvendo a absorção do CO2 em presença de soluções alcalinas, a reação (r.5) é desconsiderada, mas segundo Hikita,8 sob condições em que há um aumento da temperatura ou um longo tempo de exposição entre as fases ou ainda, quando a solução alcalina é fraca, o efeito da reação do com o íon para formar o íon H, não pode ser desconsiderada.8 Sendo a solução de NaOH para reagir com CO2 presente em uma corrente de ar a reação global será: 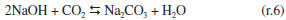 Tomando como base os estudos mais recentes de reações gás-líquido, ainda algumas hipóteses simplificadoras foram adotadas, a saber:18 (a) a dissolução do CO2 em água é alta; (b) a reação (r.4) é uma reação de transferência de prótons e apresenta uma constante de velocidade alta quanto comparado com a reação (3);8-11 (c) a fase líquida é a fase controladora na reação gás-líquido. Com o objetivo de estudar as hipóteses simplificadoras adotadas por Danckwrtes,10 Astarita,11 Hikita8 e Gondal18, a reação (r.6) foi estudada no reator de mistura gás-líquido. A partir desta reação foi investigado o comportamento do pH na solução de saída, durante a reação gás-líquido e a formação do HCO3-,reação (r.5), bem como foi proposto o mecanismo de reação que contempla todos os produtos de reação formados em cada etapa da reação global.
PARTE EXPERIMENTAL Substâncias e fluidos utilizados nas correntes de gás e líquido A fase gás foi composta por CO2, padrão industrial fornecido pela empresa Air Liquide, com 98% de nominal, conforme o laudo do fornecedor, e os seguintes teores de impurezas: O2< 10 ppm, N2< 400 ppm, H2 < 20 ppm, CH4 < 20 ppm, H2O < 20 ppm, porém foi utilizado diluído a 78%. A fase líquida foi uma série de soluções aquosas de NaOH. Estas soluções foram preparadas a partir de NaOH fornecida pela empresa Casa Americana, com pureza de 99,00%. Descrição do reator gás-líquido O fluxograma da instalação laboratorial empregado neste estudo está apresentado na Figura 1. A instalação é composta por um reator que permite simular uma bolha em um líquido. Para tanto é constituído por três partes de vidro borossilicato (Pyrex), referindo-se à Figura 1: a parte inferior do corpo do reator (7) com um volume de 2,0 L, contém a solução de NaOH; a parte superior do reator (9) contém a fase gás com volume de 0,44 L; e a parte intermediária (8), que se acopla com as duas partes anteriores. A estrutura interna deste reator é apresentada em corte, na Figura 2, onde se observa que a parte (8) é equivalente a um diafragma e nele há um orifício central. Foram usadas duas peças da parte (8) uma com orifício central de diâmetro interno de 41 mm e outra de 75 mm. A Figura 3 apresenta uma fotografia desta parte (8).
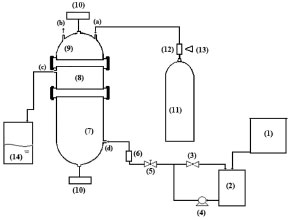 Figura 1. Esquema do sistema de absorção, reator gás líquido, escala de laboratório
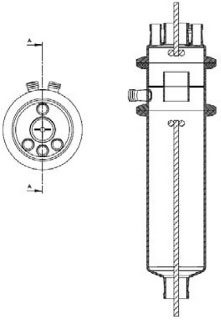 Figura 2. Vista frontal em corte do reator de mistura gás-líquido, representando a menor área de contato interfacial
 Figura 3. Corpo cilíndrico intermediário de diâmetro menor que representa uma bolha de tamanho definido para contato entre as fases gás-líquida
Como se observa na Figura 2, as câmaras que contém o gás e o líquido possuem uma haste de agitação com pás de propulsão marinha com diâmetro de 25 mm para a fase líquida e 15 mm em aço inox 316, para a fase gás, acionados por seus respectivos motores (10). A circulação da solução absorvedora que alimenta o reator no sentido ascendente em contracorrente com a fase gasosa, é efetuado por uma bomba centrifuga (4) da marca Iwaki Walchem, com vazão máxima de 850 L min-1 e pressão de 0,064 kPa, cuja sucção está conectada a um tanque de vidro (2) com capacidade de 10 L que está conectado a um tanque de polietileno (1), com capacidade de 180 L, que serve de reserva de solução. Na descarga da bomba, conectou-se uma tubulação de aço inoxidável 304L. Como a vazão na fase líquida deve ser baixa, foi montada uma derivação na saída da bomba, e com o acoplamento de uma válvula do tipo esfera (3) de ¼" em aço inoxidável 304 L, para evitar danos mecânicos à bomba, devido ao aumento de pressão, pois na sequência da linha para o reator há uma válvula do tipo agulha (5) em aço inox com diâmetro de ¼", para garantir que a vazão não ultrapasse 0,2 L min-1. Depois da válvula, há um rotâmetro (6) da marca Matec Flow, com capacidade máxima de 5 L min-1, que está conectado a entrada do reator gás-líquido na parte inferior do reator (d), por uma tubulação de aço inoxidável 304L. Após a saída do reator a soda que reagiu com o CO2 é coletada em um tanque de vidro de 10 L (14). A alimentação de CO2 foi realizada a partir de um cilindro (11), dotado de um regulador de pressão (12), com pressão máxima de 200 kPa e próximo ao regulador de pressão é acoplado um soprador térmico (13), para evitar o congelamento da válvula, devido à expansão do gás. No topo do reator têm-se os pontos de amostragem da fase gasosa: (a) entrada da mistura gasosa, (b) saída da mistura gasosa. A amostragem da fase líquida efluente do reator foi feita no corpo intermediário (c). Procedimento de operação e preparo de soluções Inicialmente, ao se empregar este equipamento algumas hipóteses devem ser consideradas, a saber:10 (a) a composição de ambas as fases em cada volume é uniforme, (b) a velocidade de agitação é mantida constante durante toda a duração do experimento e (c) a área de contato entre as fases pode ser alterada. Preparo de soluções (a) deve-se preparar uma solução de NaOH, cerca de 5 L, na mesma concentração da solução que será empregada no ensaio de absorção, para ambientar o reator gás-líquido; (b) preparar uma solução de hidróxido de sódio, 180 L, garantindo-se a concentração especificada para cada ensaio; (c) deve-se preparar uma mistura gasosa, ar-CO2, a partir da concentração de CO2 de 78% molar. Variáveis a serem consideradas As variáveis a serem consideradas foram: (a) variáveis operacionais - velocidade de agitação das fases gás e líquida, vazões das fases gás e líquida, temperatura e pressão; (b) variáveis de sistema - concentrações do contaminante na fase gasosa e a concentração da solução absorvedora na fase líquida; (c) variáveis geométricas - tamanho da bolha. Operação da instalação, coleta de amostras e análise das fases Estabilizada a vazão de solução de NaOH, injeta-se a corrente da fase gasosa de CO2, e o teste é iniciado. A duração do ensaio fora de 1 h 20 min a 3 h, e ao final interrompe-se a injeção de CO2 e a circulação de líquido. Procede-se a drenagem do tanque de 10 L que contém a solução absorvedora e inicia-se a lavagem do reator através da circulação da água. Coleta de amostras e análise das fases Conforme indicado na Figura 1 pela letra c, as amostras da fase líquida de saída são coletas a cada 15 minutos, em frascos de 50 mL, para posterior análise química, por volumetria ácido-base com o acompanhamento do pH e os cálculos são feitos com base no processo Warder.19,20 Para se determinar a concentração da fase gasosa de entrada e saída usa-se o aparelho de Orsat,21 que constitui em um equipamento empregado para quantificar a composição e o peso molecular dos gases: CO2, O2 e CO a partir do método volumétrico de absorções sucessivas e oxidações seletivas. Em conjunto a esta técnica será aplicado o balanço de massa para confirmar a concentração do gás de saída. Determinação dos teores de hidróxido de sódio, bicarbonato e carbonato pelo Processo Warder19,20 A fase líquida é quantificada com o auxílio da volumetria ácido-base com o acompanhamento de pH durante a titulação, além da adição de indicadores visuais fenolftaleína e alaranjado de metila.19,20 Partindo-se da amostra da fase líquida tanto de entrada como de saída do reator, toma-se uma alíquota de 10 mL, adiciona-se duas gotas do indicador fenolftaleína, e inicia-se a titulação desta solução com ácido clorídrico (HCl), na concentração similar à concentração de NaOH. Tem-se as reações (r.7) e (r.8). 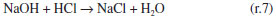 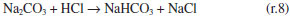 Nesta primeira fase da titulação, haverá a neutralização completa do NaOH e da primeira "metade" da neutralização do carbonato. Após esta primeira viragem, ponto de viragem pH 8,3 a 8,0, adicionam-se duas gotas do indicador alaranjado de metila e continua-se a titulação em que haverá desenvolvimento completo até o segundo ponto de viragem pH 4,0 a 3,8, da reação (r.9). 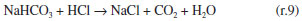 Nesta sequência de titulação ocorre a neutralização da "outra metade" carbonato. A determinação da quantidade de NaOH que não reagiu com o dióxido de carbono é feita a partir do primeiro volume, v1 , consumido até a primeira viragem com o indicador fenolftaleína. Contudo, parte do carbonato formado é contabilizado neste primeiro volume de HCl gasto, desta forma o desconto do carbonato no primeiro volume faz-se necessário, para esta primeira quantificação. Para se determinar a quantidade de carbonato e bicarbonato na solução, parte-se do segundo volume, v2 , consumido entre o primeiro ponto de viragem, fenolftaleína e do segundo ponto de viragem, alaranjando de metila. Para neutralizar o carbonato são necessários dois mols de HCl, conforme representado pelas reações (r.10) e (r.11) e na reação global (r.12): 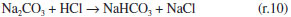 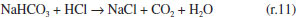 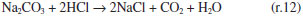 Desta forma, o volume consumido no segundo ponto de viragem, v2 , deve ser multiplicado por dois, para estabelecer a equivalência do HCl com Na2CO3. A quantificação de NaOH, NaHCO3 e Na2CO3 é representada pelas Equações (1-3). 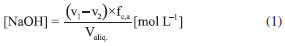 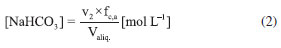 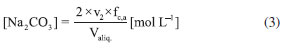 em que fc,a é o fator de correção da solução de HCl usada na titulação e Valiq.é o volume da alíquota em mL que está sendo titulada. Condições experimentais que foram realizados os ensaios Foram realizados dois conjuntos de ensaios, nos quais as variáveis operacionais foram mantidas constantes com exceção da velocidade de agitação das fases gás e líquida e foram alteradas as variáveis de sistema exceto a concentração da fase gasosa, conforme apresentado nas Tabelas 2 e 3.


A Tabela 2 apresenta as variáveis operacionais que foram mantidas constantes na realização dos ensaios. A partir destas condições experimentais propostas, pode-se trabalhar de maneira prática a reação gás-líquido. O experimento tem como objetivo a formação do Na2CO3. Para a execução dos ensaios os autores recomendam que a turma de alunos seja formada por equipes de no máximo 4 alunos, para que todas as etapas do ensaio sejam completadas.
RESULTADOS E DISCUSSÃO Mecanismo de reação proposto Propor um mecanismo de reação é um excelente exercício, pois auxilia ao aluno a compreender a sequência de eventos que ocorre entre os reagentes até a formação dos produtos incluindo todos os estágios, isso é fundamental para explicar como a reação global se desenvolve. Para o sistema NaOH-CO2 apresentado neste trabalho, considera-se uma reação unimolecular, para um pH maior do que 7,0 e a reação realizada a temperatura ambiente. O mecanismo mais representativo para a formação do bicarbonato de sódio é: 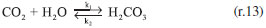 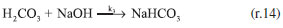 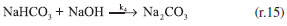 A partir das reações (r.13) a (r.15) o mecanismo proposto foi considerando o consumo do CO2, a equação que representa a velocidade de reação pode ser escrita segundo a equação (4). 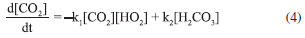 Este mecanismo foi determinado experimentalmente por Kern,23 e conforme argumentado por Astarita,11 em que o CO2 só irá reagir com NaOH a partir da formação do H2CO3. A equação proposta que representa a velocidade de formação do bicarbonato de sódio (NaHCO3), (r.14) será: 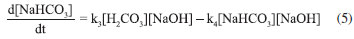 Segundo Kern,23 esta velocidade pode ser interpretada como uma reação de catálise básica, e instantânea. Para a formação do carbonato de sódio (Na2CO3), (r.15) a velocidade de formação proposta é apresentada na Equação (6). 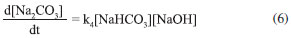 Este mecanismo de reação proposto deve ser explorado com os alunos antes de iniciar os ensaios, para familiariza-los com a reação ora estudada. Avaliação do pH na solução de saída Durante os experimentos foram medidos os pHs da solução de saída do reator. Do conjunto de 16 ensaios realizados tem-se a Figura 4, que representa o comportamento do ensaio 5 para a concentração de NaOH de 0,08 mol L-1 na entrada do reator de mistura gás-líquido. A Figura 5, representa o ensaio 13 para a concentração de 2,0 mol L-1 na entrada do reator.
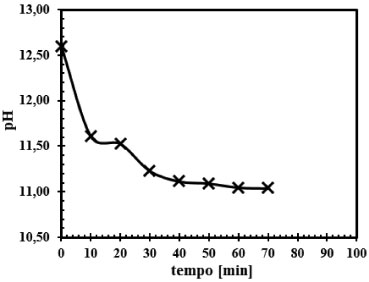 Figura 4. Acompanhamento do pH da fase líquida de saída para a reação do CO2 com solução de NaOH nas concentrações de 0,015 mol L-1 e 0,08 mol L-1. Curva representativa de um dos ensaios realizados (Ensaio 5)
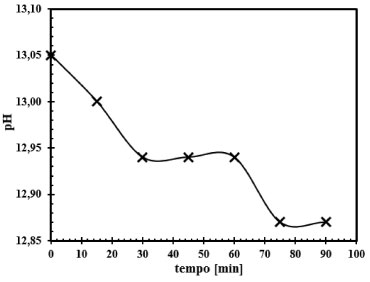 Figura 5. Acompanhamento do pH da fase líquida de saída para a reação do CO2 com solução de NaOH nas concentrações de 0,56 mol L-1 e 2,0 mol L-1. Curva representativa de um dos ensaios realizados (Ensaio 1)
Observa-se que os pHs iniciais estão na ordem de 12,60 a 13,05 na entrada do reator de mistura e ao longo do experimento, a solução de saída apresenta um valor de pH da ordem de 11,0 para concentração de 0,08 mol L-1 de NaOH. Já para a concentração de NaOH de 2,0 mol L-1 o pH inicial está na ordem de 13,00 na entrada do reator e na saída do reator a solução apresenta valores de pHs na ordem 12,83. Pelas Figuras 4 e 5, fica constatado que na solução de saída do reator ainda há NaOH que não reagiu, no entanto, ao examinar com mais detalhes a Figura 4, observa-se que a partir de concentrações de NaOH da ordem de 0,08 mol L-1 o pH da solução de saída fica em torno de 11,0 o que induz a questionar se há formação de NaHCO3, pois segundo Kern,23 a formação do NaHCO3 é importante a partir da faixa de pH de ordem 10,0 a 8,0. Quantificação da NaOH residual, do Na2 CO3 e do NaHCO3 Mesmo com o acompanhamento do pH, a formação do NaHCO3 ainda não ficou evidenciada. Desta forma, com o auxílio das Figuras 6 a 9, que representam 4 dos ensaios no conjunto dos 16 experimentos realizados, foram quantificados todos os produtos formados. Nestas quatro figuras o consumo do reagente NaOH durante o experimento é apresentado, bem como a formação do Na2CO3 e NaHCO3.
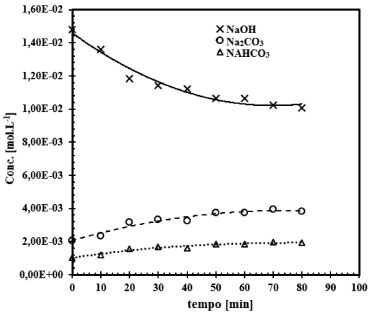 Figura 6. Representação do ensaio 3, do conjunto de 16 ensaios. Comportamento da reação gás-líquido para o sistema CO2-NaOH para a concentração de NaOH de 0,015 mol L-1 e área de contato entre as fases de 38,48 cm2
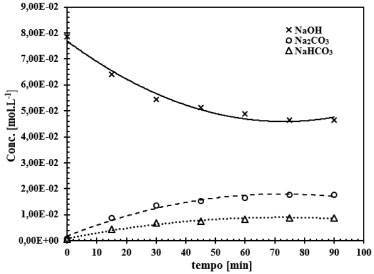 Figura 7. Representação do ensaio 5, do conjunto de 16 ensaios. Comportamento da reação gás-líquido para o sistema CO2-NaOH para a concentração de NaOH de 0,08 mol L-1 e área de contato entre as fases de 16,62 cm2
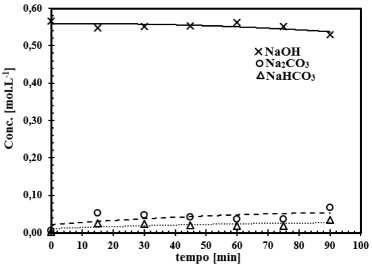 Figura 8. Representação do ensaio 10, do conjunto de 16 ensaios. Comportamento da reação gás-líquido para o sistema CO2-NaOH para a concentração de NaOH de 0,56 mol L-1 e área de contato entre as fases de 16,62 cm2
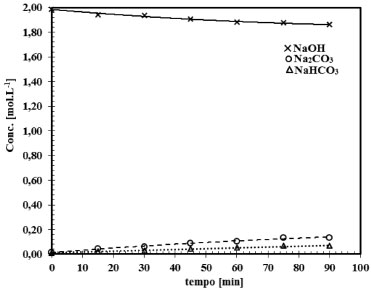 Figura 9. Representação do ensaio 10, do conjunto de 16 ensaios. Comportamento da reação gás-líquido para o sistema CO2-NaOH para a concentração de NaOH de 2,00 mol L-1 e área de contato entre as fases de 38,48 cm2
O comportamento da reação CO2-NaOH em função do tempo, pode ser observado nas Figuras 6 a 9. Verifica-se que a taxa de consumo de NaOH decresce com o tempo. Este perfil de curva foi reportado por Mello.24 Nas Figuras 6 a 9 fica evidenciado, que há formação do NaHCO3 tanto nas soluções de NaOH de concentração elevada (2,0 mol L-1) como nas soluções de NaOH de baixa concentração (0,015 mol L-1). Há autores,9-11,25 que afirmam que a formação do NaHCO3 pode ser desconsiderada, mas há autores,8,23,26 que argumentam sobre o erro que é cometido ao se ignorar a formação do NaHCO3. Pelas Figuras 6 a 9 é comprovado que para baixas concentrações de NaOH, da ordem de 0,015 mol L-1 a 0,08 mol L-1, a formação do NaHCO3 é mais evidente. Sendo assim, observando as Figuras 6 a 9, e tomando como base as relações entre as concentrações de saída do reator gás-líquido, verifica-se que, para concentrações de NaOH elevadas, a relação entre o Na2CO3 formado com o NaHCO3 é da ordem de 2%, justificando que a formação do NaHCO3 pode ser ignorada, como afirma Danckwerts,25 Astarita,11 Fleisher,26 Yoo.27 Mas a partir do instante que a concentração de NaOH decresce devido a reação com CO2, a formação do NaHCO3 não pode ser desprezada, pois a relação entre os produtos formados Na2CO3 e NaHCO3 faz-se presente, sendo da ordem de 13,5%, justificando Hikita.8 Havendo a formação do NaHCO3 tem-se a formação de uma solução tampão formada por Na2CO3-NaHCO3 conforme evidenciado por Kern.23 Este fenômeno acontece, quando se trabalha num sistema de circuito fechado, em que a solução de NaOH é usada até a sua saturação, esta condição de trabalho visa minimizar os custos envolvidos no processo industrial ou no ambiente acadêmico. Considerando um sistema de reciclo de solução absorvedora num ambiente industrial ou de laboratório, inicialmente tem-se uma solução de NaOH com concentração elevada e pH da ordem de 12,5 a 13,0. Após a injeção da corrente gasosa tem-se a reação gás-líquido com o consumo de NaOH e formação de Na2CO3, mas conforme a reação está ocorrendo em circuito, observa-se que o pH do sistema começa a cair,como demonstrado nas Figuras 4 e 5. Como consequência, a reação gás-líquido fica comprometida, pois haverá um longo tempo de exposição entre as fases gás e líquido, como argumenta Hikita,8 que a reação entre CO2 e Na2CO3 não pode ser desconsiderada. A reação entre CO2 e Na2CO3 é representada conforme (r.16). 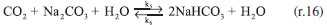 Assim, tomando como base a concentração de todos os produtos formados na reação principal entre o CO2 com NaOH, e ao se optar em desconsiderar a reação (r.16) a partir do instante em que há o decréscimo da concentração de NaOH, isto implicará num erro de 16,74%, erro este que não pode ser desprezado, sendo assim o argumento do autor Hikita é válido.8 A Figura 10 expressa o comportamento do sistema NaOH-CO2 quando há um longo tempo de exposição entre as fases. Fica evidente o distanciamento entre as curvas de formação do Na2CO3 e do NaHCO3. Note na Figura 10, o aumento da concentração de Na2CO3 em relação ao NaOH, a partir deste instante, tem-se a hidrólise do Na2CO3. É importante ressaltar que esta reação de hidrólise também foi reportada por Kern.23
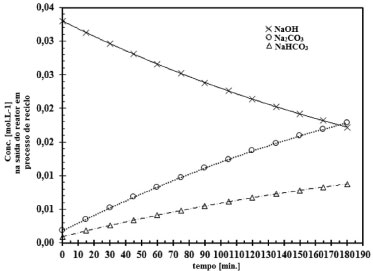 Figura 10. Análise das correntes de saída considerando um sistema em reciclo de CO2-NaOH para a concentração de NaOH de 2,00 mol L-1 e área de contato entre as fases de 38,48 cm2
Em conjunto com a análise das correntes foi estudado o comportamento do pH durante três horas de ensaio, Figura 11. Inicialmente, tem-se o consumo de NaOH e o decréscimo do pH da solução de saída do reator até o valor de 4. Após uma hora de ensaio observa-se a formação de uma solução tampão,28 caracterizado pelo aumento no valor do pH chegando este na ordem de 9, isto deve-se ao fato que nesta condição a concentração de NaOH está muito baixa, Figura 10, mas é continuamente regenerada por hidrólise do Na2CO3.
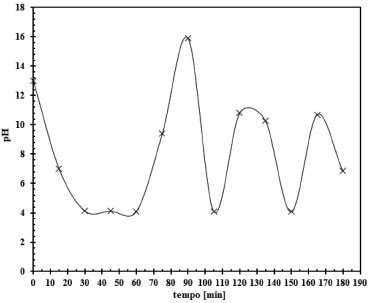 Figura 11.Comportamento do pH, considerando um longo tempo de exposição entre as fases, 3 horas de ensaio, reação CO2-NaOH para a concentração de NaOH de 2,00 mol L-1 e área de contato entre as fases de 38,48 cm2
Sendo assim, o argumento do autor Hikita deve ser considerado a partir de baixas concentrações de NaOH,8 pois a baixa concentração de NaOH e a formação da solução tampão oferecem uma séria competição, e como consequência um decréscimo da quantidade de CO2 que poderia reagir com NaOH.
CONCLUSÃO Como colaboração à inclusão deste tópico no currículo dos cursos de Química e Engenharia Química, este trabalho apresentou um experimento que demonstra uma reação gás-líquido. Os alunos do quarto ano do curso de engenharia química que tiveram a oportunidade de vivenciar este estudo, demonstraram uma maior compreensão dos fenômenos envolvidos na reação gás-líquido, em relação àqueles que não fizeram este experimento. Observou-se que os alunos que participaram deste método de ensino, desenvolveram uma visão crítica do processo químico por um todo, buscando entender o porquê dos detalhes de mecanismo de reação proposto e em muitas vezes propondo mecanismo diferentes, mas que contemplavam todos os produtos formados e o motivo da controvérsia que há no estado da arte. O mecanismo de reação para o sistema CO2-NaOH foi proposto e contempla todos os produtos de reação formados. O acompanhamento do pH durante a reação auxiliou para identificar que havia NaOH residual na solução de saída do reator. Para concentrações de NaOH da ordem de 0,08 mol L-1 há uma queda no pH da solução de saída de 12%. Com relação a argumentação do autor Hikita,8 considerar a reação para a formação do NaHCO3 é válida a partir de pHs da ordem de 11, durante a reação gás-líquido num sistema de circuito fechado, ou quando o aluno estiver trabalhando em baixas concentrações de NaOH, vale ressaltar, que a reação Na2CO3 e CO2 também foi evidenciada por Kern.23 Com este trabalho ficou demonstrado que a partir de conhecimentos fundamentais de química o aluno pode em seu futuro profissional aplicar estes conceitos para a resolução de problemas ou identificar melhorias em alguma etapa do processo. O equipamento empregado neste trabalho mostrou-se útil para estudos de reações gás-líquido, contribuindo para os alunos estudarem os fenômenos que influenciam estas reações.
AGRADECIMENTOS Os autores agradecem a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior, CAPES, pelo suporte financeiro da bolsa de Pós-Doutorado. E ao Instituto Mauá de Tecnologia por ceder o espaço físico para a realização dos experimentos.
REFERÊNCIAS 1. Froment, G.; Bischoff, K. B.; Chemical reactor analysis and design, 2nd ed, John Wiley: New York, 1990. 2. Missen, R. W.; Mims, C. A.; Saville, B.; Introduction to chemical reaction engineering and kinetics, 1st ed., John Wiley: Toronto, 1999. 3. Luzi, C. D.; Bressa, S. P.; Mazza, G. D.; Barreto, G. F.; Education for Chemical Engineers. 2014, 9, 50. DOI: http://dx.doi.org/10.1016/j.ece.2014.04.001 4. Hosten, L. H.; Kinetics of gas-liquid reactions, Bicentenary Scientific Session of the Faculty of Chemical Engineering Technical University Budapest, 1983. 5. Neves, C. F.; Schvartzman, M. M. A.; Quim. Nova 2005, 28, 622. DOI: http://dx.doi.org/10.1590/S0100-40422005000400013 6. Dey, A.; Arronwilas, A.; EIC Climate Change Technology, Ottawa, Canada, 2006. 7. Machado, P. L. O. A.; Quim. Nova 2005, 28, 329. DOI: http://dx.doi.org/10.1590/S0100-40422005000100001 8. Hikita, H.; Takatsuka, T.; Chem. Eng. J. 1976, 11, 131. DOI: http://dx.doi.org/10.1016/S0300-9467(76)80035-4 9. Danckwerts, P. V.; Sharma, M. M.; I. Chem. E. review series, no. 2, Institution of Chemical Engineers: London, 1966. 10. Danckwerts, P. V.; Gas Liquid Reactions, 1st ed., McGraw-Hill: New York, 1970. 11. Astarita, G. D.; Savage, D. W.; Gas Treating with Chemical Solvents, 1st ed., John Wiley: New York, 1983. 12. Levenspiel, O.; Engenharia das Reações Químicas, 4th ed., Edgard Blücher: São Paulo. 1994. 13. Oliveira, T. G.; Machado, S. W. M.; Santos, S. C. G.; Souza, M. J. B.; Pedrosa, A. M. G.; Quim. Nova 2014, 37, 610. DOI: http://dx.doi.org/10.1590/S0100-40422014000100025 14. March, J.; Advanced Organic Chemistry: Reactions, Mechanism, and Structure, 3rd ed., New York: New York, 1992. 15. Atkins, P.; Paula, J.; Physical Chemistry, 6th ed., Omega: Barcelona, 1998. 16. Khol, A. L.; Nielsen, R. B.; Gas Purification, 5th ed., Gulf Publishing Company: Texas, 1997. 17. Seader, J. D.; Henley, E. J.; Separation Process Principles, 2nd ed., John Wiley: New Jersey, 2006. 18. Gondal, S.; Asif, N.; Svendsen, H. F.; Knnutila, H.; Chem. Eng. Sci. 2015, 123, 487. DOI: http://dx.doi.org/10.1016/j.ces.2014.10.038 19. Kobal, J. J.; Sartori, L.; Química Analítica Quantitativa, 2nd ed., Moderna: São Paulo, 1982. 20. Harvey, D.; Modern Analytical Chemistry, 1st ed., McGraw-Hill: New York, 2000. 21. Kreisinger, H.; Ovitz, F. K.; Sampling and Analyzing Flue Gas, Bulletin 97. Washington, 1915. 23. Kern, D. M.; J. Chem. Educ. 1960, 37, 15. DOI: http://dx.doi.org/10.1021/ed037p14 24. Mello, L. C; Tese de Doutorado, Universidade de São Paulo, Brasil, 2013. 25. Fleischer, C.; Becker, S.; Eigenberger, G.; Chem. Eng. Sci. 1996, 51, 1715. DOI: http://dx.doi.org/10.1016/0009-2509(96)00030-9 26. Yoo, M.; Han, S. J.; Wee, J. H.; J. Environ. Manage. 2013, 114, 512. DOI: http://dx.doi.org/10.1016/j.jenvman.2012.10.061 PMID: 23183145 27. Fiorucci, A. R.; Soares, M. H. F. B.; Cavalheiro, E. T. G.; Química Nova na Escola 2001, 13, 18. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





