Artigo
|
|
| Elaboração e caracterização de blendas de amido fosforilado com quitosana e PVA Preparation and characterization of phosphorylated starch blends with chitosan and polyvinyl alcohol |
|
Paloma L. da SilvaI; Anida M. M. GomesII,*; Nágila M. P. S. RicardoI; Terezinha F. MachadoIII
IDepartamento de Química Orgânica e Inorgânica, Universidade Federal do Ceará, 60451-970 Fortaleza - CE, Brasil Recebido em 20/10/2015 *e-mail: anidamoraes@yahoo.com.br The aims of this study were to produce films from phosphorylated starch/chitosan/PVA blends and evaluate their physicochemical properties. The film properties were dependent on the starch percentage in the blend. The infrared spectra of the blends showed the appearance of bands at 1716 and 1733 cm-1 (stretching C = O of PVA acetate residues) and 1556 cm-1 (amide II deformation of the chitosan) indicating the incorporation of these components into the blends. The films with high phosphorylated starch content showed low thermal and mechanical strength and high water absorption capacity while blends with higher content of chitosan and PVA showed good mechanical properties and low water vapor permeability. Films containing 40% and 20% starch showed excellent properties such as high water absorption capacity and biodegradability for use as bandages and agricultural films and also as a source of organic matter in soil. INTRODUÇAO A elaboraçao de blendas com outros biopolímeros é uma das maneiras mais utilizadas para melhorar as propriedades mecânicas dos filmes e membranas de amido.1 No entanto, a adiçao de altas quantidades de amido a uma matriz polimérica diminui suas propriedades físicas e mecânicas, principalmente porque a imiscibilidade do amido hidrofílico e de polímeros hidrofóbicos, em nível molecular, leva a uma separaçao de fases.2 Dessa forma, torna-se importante modificar a estrutura do amido a fim de aumentar sua miscibilidade e suprir uma ou mais ausências e/ou deficiências de suas propriedades. A introduçao de substituintes químicos na molécula de amido tem sido usada para melhorar propriedades funcionais tais como viscosidade, gelatinizaçao, retrogradaçao, solubilidade em água, adesao e formaçao de filmes. Vários estudos sobre hidrólise ácida, oxidaçao, eterificaçao e esterificaçao em amido têm sido realizados.3-5 Para melhorar a hidrofilicidade, o amido pode ser modificado através da fosforilaçao dos grupos hidroxilas reativos das unidades de anidroglicose do amido. As ligaçoes cruzadas resultantes da modificaçao reforçam as ligaçoes de hidrogênio que atuam como ponte entre as moléculas de amido. Como resultado, os amidos contendo ligaçoes cruzadas possuem maior resistência a altas temperaturas, pH baixo e altas taxas de cisalhamento, além de apresentarem pastas claras de alta consistência, alta solubilidade e poder de inchamento.6 A fosforilaçao pode ser obtida por reaçoes do amido com ácido fosfórico ou soluçoes aquosas de sais de ácido orto, piro ou tripolifosfórico em pH e temperatura controlados.7 O pH influencia o tipo e a qualidade do amido fosforilado produzido, pois dependendo do pH da reaçao, diferentes produtos sao formados.8 Em pH abaixo de 9,0 os grupos fosfato terminais da molécula de tripolifosfato de sódio estao protonados e produzem mono-metafosfatos, que podem reagir rapidamente com os grupos hidroxila do amido produzindo fosfato de amido mono-substituído. Em reaçao com pH acima de 10, as hidroxilas do amido reagem com o fosfato central do tripolifosfato de sódio, formando pirofosfato de amido, que pode ainda reagir com as hidroxilas do amido para formar fosfato de amido dissubstituído.9 O'Brien e Wang5 modificaram amidos de várias fontes botânicas com diferentes teores de amilose e observaram que os fosfatos de amido preparados em pH 9 apresentaram maiores teores de fósforo que em pH 11 e a eficiência da fosforilaçao diminuiu com o aumento do percentual de amilose. A fosforilaçao pode aumentar o poder de inchamento e a solubilizaçao dos grânulos de amido, reduzir a retrogradaçao e a temperatura de gelatinizaçao e aumentar a claridade da pasta e a viscosidade do gel. Além disso, o amido fosforilado adquire boa estabilidade a ciclos de congelamento/descongelamento, possibilitando seu uso em produtos congelados.10 Dependendo do grau de substituiçao (GS) o amido fosforilado pode ser solúvel em água11 e pode ser convertido em hidrogéis expansíveis em água por reticulaçao com agentes bifuncionais. Conforme observado por Murúa-Pagola e colaboradores,12 o amido de milho ceroso fosforilado por extrusao apresentou boas características como suporte para encapsulaçao por spray-drying. Sitohy e Ramadan13 elaboraram blendas de amido de milho fosforilado e poliacrilato com altas taxas de desintegraçao e degradaçao por α-amilase as quais podem ser utilizadas como plásticos descartáveis e biodegradáveis. O'Brien e Wang5 estudaram as propriedades de hidrogéis de amido fosforilado que se mostraram promissores para utilizaçao em sistemas de liberaçao controlada de tartarato de metropolol. Os polímeros naturais receberam grande atençao no ramo de biomateriais, pois suas similaridades estruturais com as macromoléculas biológicas os tornam facilmente reconhecidos pelo organismo, além de serem metabolizados a resíduos atóxicos e naturalmente eliminados.14 A presença de grupos hidroxilas na estrutura química do poli (álcool vinílico) permite a formaçao de ligaçoes de hidrogênio intermoleculares e intramoleculares que ocorrem em altas temperaturas entre o amido gelatinizado e o PVA.15 Sin e colaboradores16 estudaram a interaçao sinergística de blendas de amido de mandioca e PVA através de análises de DSC. Os autores observaram evidências nos picos endotérmicos, que mostraram fortes interaçoes entre esses dois componentes. Outro polímero que tem sido bastante utilizado em blendas com o amido é a quitosana que, além de ser biocompatível, possui atividade antimicrobiana e cicatrizante. Por esta razao, o amido, a quitosana e suas blendas com PVA apresentam um enorme potencial para ser usado na área biomédica como curativos e implantes (substituto de pele). O presente estudo tem o objetivo de unir as características do amido fosforilado, quitosana e PVA e obter filmes com propriedades mecânicas e funcionais melhoradas.
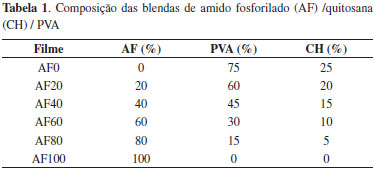
PARTE EXPERIMENTAL Materiais As raízes de inhame (Dioscorea esculenta L.) foram obtidas nos supermercados de Fortaleza. Utilizou-se quitosana (CH) em flocos, com grau de desacetilaçao de 80%, fornecido pelo PADETEC/CE (Parque de Desenvolvimento Tecnológico), poli (álcool vinílico) (PVA) (Vetec), com grau de hidrólise de 86% e tripolifosfato de sódio (Na5P3O10) (Vetec). Isolamento do amido de inhame Foi realizado de acordo com metodologia descrita em Pérez e colaboradores,17 com algumas modificaçoes. As raízes de inhame foram lavadas, descascadas e trituradas até obtençao de uma massa densa e uniforme, a qual se acrescentou água suficiente para facilitar a peneiraçao. Deixou-se a suspensao descansar por 24 horas, até que a água pudesse ser sifonada. Adicionou-se mais água à massa o número de vezes necessárias para a obtençao do amido purificado. O material foi seco em estufa com circulaçao de ar a 40 °C por 24 horas. Fosforilaçao do amido A reaçao foi desenvolvida conforme metodologia de Paschall18 modificada. Cerca de 200 g de amido foram adicionados a 334 mL de soluçao de tripolifosfato de sódio (0,025 g mL-1) cujo pH foi ajustado para 11 com NaOH 20%. Após 30 minutos sob agitaçao à temperatura ambiente, a dispersao foi filtrada a vácuo e o resíduo seco em estufa com circulaçao forçada de ar entre 40-45 °C. Após a secagem o sólido foi pulverizado em almofariz e levado a estufa a 65 °C por 90 minutos e posteriormente a 155 °C por 20 minutos. Após esfriar, a mistura foi dispersa em 600 mL de água e filtrada, repetindo-se esse procedimento até se obter pH 6,5-7,0. O amido foi seco em estufa a 40 °C. Determinaçao do teor de fósforo O teor de fósforo (P) foi determinado por espectrometria de emissao óptica em plasma indutivamente acoplado (ICP-OES), modelo Perkin Elmer 4300 Duo view. Aproximadamente 200 mg de amostra foram digeridas com ácido nítrico (65% p/v) e peróxido de hidrogênio (30% v/v) e posteriormente diluída para 25 mL. O teste foi realizado nas seguintes condiçoes: fluxo de gás (Ar) de 15 L min-1; velocidade do fluxo de amostra de 1,4 mL min-1; limite de detecçao do P= 0,010 mg L-1 e λ=213,617 nm. O grau de substituiçao (GS) foi calculado em funçao do teor de fósforo através da relaçao sugerida por Wurzburg:19  onde: %P é o teor de fósforo e MP é o peso molecular do substituinte. Elaboraçao dos filmes (blendas) A soluçao de amido fosforilado (1% m/v) foi gelatinizada a 95 ºC por 1 hora. Em seguida, foi adicionada soluçao de PVA (2% m/v) e soluçao de quitosana em ácido acético 1% à soluçao filmogênica em diferentes concentraçoes conforme mostrado na Tabela 1. A mistura ficou sob agitaçao por 1 hora para homogeneizaçao e após esse período a soluçao foi vertida sobre placas de acrílico e seca em estufa a 60 °C por 2 horas. Após secagem, os filmes foram retirados das placas, etiquetados e armazenados em sacos plásticos. A codificaçao dos filmes e as concentraçoes de amido, PVA e quitosana estao representadas na Tabela 1.
Caracterizaçao físico-química dos filmes (blendas) Espessura dos filmes Foi determinada em micrômetro digital Mitutoyo (± 0,001 mm) em 12 pontos diferentes, considerando-se a espessura dos filmes como a média entre todas as leituras. Solubilidade dos filmes A solubilidade dos filmes em meio tampao fosfato (pH = 7,0) e em água destilada (pH=5,0) foi determinada segundo método descrito por Gontard e colaboradores20 com algumas modificaçoes. Inicialmente, determinou-se através de pesagem a porcentagem de matéria seca dos filmes em estufa a 70 °C por 2 horas. Em seguida, os filmes foram cortados em quadrados de 2 x 2 cm, pesados e imersos em 50 mL de soluçao tampao fosfato (pH 7,0) e em água destilada (pH 5,0) e mantidos sob agitaçao lenta a 27 °C/24 h. Após esse período, cada soluçao foi filtrada e o material retido foi seco em estufa a 70 °C/24 h e pesado até se obter peso constante, determinando-se, dessa forma, a quantidade de matéria seca nao solubilizada através da seguinte equaçao: 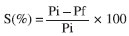 em que: Pi = peso inicial do material seco; Pf= peso final do material seco nao solubilizado Intumescimento dos filmes O intumescimento dos filmes em meio tampao e em água destilada foi realizado de acordo com método descrito em Pal e Pal.21 As membranas (2 x 2 cm) secas e previamente pesadas foram imersas em 50 mL de soluçao tampao fosfato (pH 7,0) e em água destilada (pH 5,0) em intervalos variados por 3 horas. Após cada intervalo, os filmes foram secos com papel absorvente e pesados, obtendo-se o peso úmido (Pu). O cálculo de intumescimento foi feito em triplicata através da seguinte equaçao: 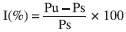 em que Ps é o peso do produto seco. Permeabilidade ao vapor d'água (WVP) A permeabilidade foi determinada gravimetricamente segundo método E-96-90 da ASTM.22 Os filmes foram aplicados em células de permeaçao (4-4,5 cm de diâmetro e 8,5-9,0 cm de altura) utilizando-se um anel de silicone para fixaçao. O interior da célula foi parcialmente preenchido com sílica gel (4 cm de altura aproximadamente) previamente ativada em estufa a 200 °C. As células foram colocadas em dessecador contendo água destilada (UR=100%), nas quais o vapor de água permeado através do filme foi absorvido pela sílica. O peso da célula foi determinado em triplicata a cada meia hora em uma balança analítica perfazendo um total de 12 pesagens. Inicialmente calculou-se a taxa de permeabilidade ao vapor de água (WVPR) de acordo com a equaçao: 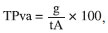 em que A é a área de permeaçao (15,89 cm2). O termo g/t foi calculado por regressao linear entre os pontos de ganho de peso e o tempo, no regime constante. Em seguida calculou-se a permeabilidade ao vapor de água (WVP), utilizando-se a equaçao: 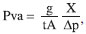 sendo X a espessura média dos filmes; Dp a diferença de pressao de vapor do ambiente contendo sílica gel (zero) e do ambiente contendo água pura (3,16746 KPa, 25 °C). Espectroscopia no infravermelho (FTIR-ATR) As análises foram realizadas em espectrofotômetro de infravermelho com transformada de Fourier (FT-IR) VERTEX 70 no modo ATR (Reflectância Atenuada Total), com módulo Raman RAMII BRUKER acoplado. Os filmes foram colocados diretamente sobre o cristal de ZnSe com índice de refraçao de 2,4 e ângulo de incidência de 45º e pressionados de maneira uniforme, de modo que todas as amostras recebessem a mesma pressao. Uma média de três espectros foi obtida para cada amostra no modo absorbância na faixa de 4000-600 cm-1 com uma resoluçao de 4 cm-1. Calorimetria exploratória diferencial (DSC) Cerca de 7,0 mg de filmes cortados foram pesados e analisados em calorímetro diferencial de varredura (DSC 204 F1Phoenix, NETZSCH), a uma taxa de aquecimento de 10 ºC/min, faixa de temperatura de 25 ºC a 350 ºC e fluxo de nitrogênio de 50 mL min-1 g-1. Difraçao de raios-X Os filmes foram cortados em quadrados de 2 x 2 cm fixados com silicone em uma placa de alumínio e as análises foram realizadas em difratômetro de raios-X Dmax-B (Rigaku, Japan), com radiaçao de cobre (k = 0.1542 nm), operando a 40 kV e 25 mA. A regiao de varredura do ângulo de difraçao (2θ) foi de 3-40º (1/2º/min). Teste de traçao Os testes de traçao foram realizados em INSTRON modelo 4443. Os filmes foram cortados em tiras de 15 mm de largura e 100 mm de comprimento, fixados no aparelho e submetidos a teste de tensao e deformaçao com velocidade de traçao de 10 mm min-1, baseando-se no método padrao da ASTM D 882-97.23 Foram obtidos os parâmetros de tensao ou carga e extensao na quebra em triplicata.
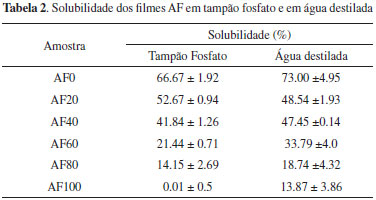
RESULTADOS E DISCUSSAO O amido fosforilado (AF) apresentou teor de fósforo de 0,03% ± 0,005 e grau de substituiçao baixo (GS= 0,002) devido ao baixo teor de tripolifosfato utilizado (2,5%). Apesar disso, a modificaçao foi suficiente para alterar algumas propriedades do amido conforme observado por outros autores. Nabeshima e Grossman24 obtiveram amidos fosforilados com baixo GS na faixa de 1,5 × 10-4 e observaram diminuiçao no índice de solubilidade em água e coesividade do gel e aumentos da força do gel e viscosidade de pasta. Espessura dos filmes As espessuras dos filmes, cujos valores variaram de 0,051 a 0,1 mm, estao dentro da faixa encontrada na literatura para filmes de amido. Filmes com essa faixa de espessura podem ser utilizados em diversas aplicaçoes como embalagens (0,0551 a 0,1279 mm),25 filmes agrícolas (mulchings) (0,02-0,2 mm)26 e curativos (0,05-0,1 mm).27 Solubilidade dos filmes de amido fosforilado em tampao fosfato e em água destilada Todos os filmes, com exceçao da amostra AF20, foram mais solúveis em água que em tampao fosfato (Tabela 2). Os filmes com 100% de amido (AF100) apresentaram baixa solubilidade em tampao e em água destilada, enquanto o filme sem amido (AF0) que continha maior quantidade de PVA e quitosana, em compraçao aos demais filmes, foram os mais solúveis. Este comportamento demonstrou a grande influência do PVA e da quitosana na solubilidade destes filmes, pois além de sua afinidade pela água, o PVA forma ligaçoes de hidrogênio com as cadeias de amido aumentando sua flexibilidade e facilitando a penetraçao da água.
Intumescimento dos filmes em tampao fosfato e em água destilada O intumescimento pelo contato direto com um meio líquido é uma propriedade relevante dos filmes biodegradáveis, uma vez que para várias aplicaçoes é necessário conhecer a resistência e o comportamento do material em soluçao. O intumescimento das blendas de amido fosforilado em soluçao tampao e em água destilada é apresentado na Figura 1.
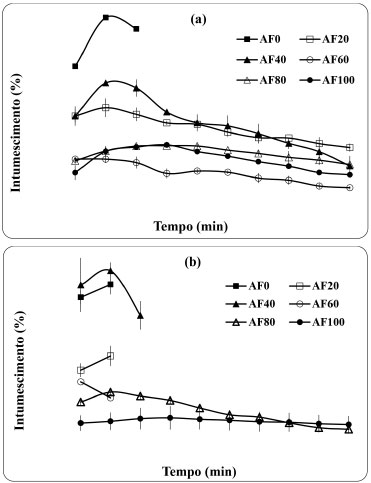 Figura 1. Intumescimento dos filmes AF em tampao fosfato (a) e em água destilada (b)
Em água destilada, os filmes com baixo teor de amido (AF0-AF40) intumesceram rapidamente e se desintegraram com 15 minutos de contato com o meio. A influência da alta hidrofilicidade do PVA em água destilada foi maior que em tampao fosfato, visto que a blenda sem amido (AF0) apresentou quase o dobro do teor de intumescimento. A maior resistência dos filmes observada em tampao foi provavelmente devido à formaçao de ligaçoes cruzadas entre os grupos fosfato do tampao e as moléculas de amido. As blendas AF20 e AF40 apresentaram altos valores de intumescimento em tampao, provavelmente por possuírem maiores quantidades de PVA (60 e 45%, respectivamente) e CH (20 e 15%, respectivamente) do que as demais, o que tornou a blenda mais hidrofílica, resultando em maior absorçao da soluçao. A alta taxa de intumescimento de filmes em tampao fosfato é benéfica para a finalidade destes como curativos, visto que esse sistema tamponado atua no plasma, no líquido intracelular e nos túbulos renais onde se concentra em grande quantidade. Dessa forma, filmes com excelentes propriedades de inchamento em tampao fosfato poderiam absorver maior quantidade de líquidos provenientes de ferimentos ou excreçoes cutâneas,28 tornando-os promissores para aplicaçao como curativos. Permeabilidade ao vapor d'água (WVP) dos filmes A permeabilidade de um filme ao vapor de água depende dos valores do coeficiente de difusao da água através do filme e do coeficiente de solubilidade da água no filme. O coeficiente de difusao está relacionado com a mobilidade molecular através da matriz polimérica e depende do tamanho e da estrutura da molécula, enquanto que o coeficiente de solubilidade diz respeito ao comportamento da molécula permeante com relaçao à superfície da matriz polimérica.29 Os valores de WVP e da taxa de permeabilidade ao vapor d'água (WVPR) dos filmes sao mostrados na Tabela 3. Os valores encontrados em torno de 0,7 × 10-3 g mm h-1 m-2 kPa-1 para AF0 (filmes contendo apenas CH/PVA) mostraram a influência da adiçao de PVA na reduçao da permeabilidade, visto que estes valores se aproximaram da permeabilidade do filme de PVA puro (0,47 × 10-3 g mm h-1 m-2 kPa-1) e mais baixos que o da quitosana pura (2,30 × 10-3 g mm h-1 m-2 kPa-1).
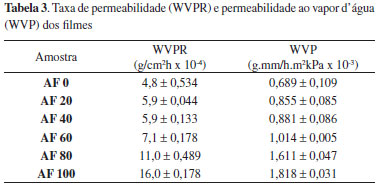
Gomes30 analisou a permeabilidade de filmes de amido/quitosana/PVA com espessura média de 0,05 mm e verificou valores de 0,14 × 10-3 g mm h-1 m-2 kPa-1 para filme de amido de inhame e 0,05 a 0,39 × 10-3 g mm h-1 m-2 kPa-1 para blendas de amido de feijao verde/CH/PVA, os quais foram menores que os apresentados neste trabalho. Conforme observado por Cuq e colaboradores,31 filmes de cera de abelha (0,1 mm de espessura) apresentaram WVP igual a 2,07 × 10-3 g mm h-1 m-2 kPa-1, enquanto filmes de PEBD (0,025 mm), bastante utilizados em embalagens, mostraram permeabilidade em torno de 3,1 × 10-3 g mm h-1 m-2 kPa-1. Conforme observado na Tabela 3, as blendas com maior teor de amido foram mais permeáveis ao vapor d'água e, dessa forma, o filme AF100 apresentou maior taxa de permeabilidade (1,82 × 10-3 g mm h-1 m-2 kPa-1). A medida que a concentraçao de amido aumentou na blenda (20-100%), as longas cadeias de amido constituídas por várias hidroxilas facilitaram a penetraçao da água (efeito plastificante). Por outro lado, o aumento na concentraçao de PVA e quitosana permitiu que os grupos OH do PVA e NH2 da quitosana interagissem com as cadeias de amido por forças intermoleculares como pontes de hidrogênio. Dessa forma, a estrutura dos filmes tornou-se mais compacta dificultando a permeaçao de vapores d'água nas blendas contendo PVA e quitosana as quais obtiveram menores valores de permeabilidade (Tabela 3). Quando analisamos os valores de permeabilidade, do ponto de vista da aplicaçao como curativos, os valores verificados encontram-se dentro da faixa considerada ideal para curativos. Um curativo de alta capacidade de retençao de umidade deve ter uma taxa de permeabilidade ao vapor d'água (WVPR) inferior a 0,0035 g m-2 h-1.32 Os valores de WVPR variam muito entre os tipos de curativos e materiais usados. Os curativos obtidos a partir de hidrocolóides têm uma WVPR menor que 0,0013 g m-2 h-1, porém curativos permeáveis, como as gazes, têm uma WVPR de 0,0067 g m-2 h.33 Em comparaçao, a taxa de perda de água trans-epidérmica, um conceito semelhante à WVPR de uma pele intacta é 4-9 g m-2 h-1.34 Geralmente, os curativos com alta capacidade de reter umidade e com uma baixa WVPR sao usados para manter a umidade em ferimentos secos ou com baixo volume de exsudado. Por outro lado, feridas com grandes quantidades de exsudado exigem curativos mais permeáveis e com uma alta taxa de transmissao de vapor. Espectroscopia no infravermelho Os espectros de infravermelho dos filmes na regiao entre 4000 e 600 cm-1 estao representados na Figura 2. As bandas entre 1200 e 1400 cm-1 (deformaçao angular de CH2 e estiramentos de C-CH, respectivamente)35 tornaram-se bem definidas e com maior intensidade à medida que as concentraçoes de PVA e quitosana aumentaram nas blendas. O aparecimento das bandas em 1716 e 1733 cm-1, atribuído ao estiramento do grupo carbonila proveniente do resíduo de acetato,36 se dá devido à presença de PVA nas blendas. A banda em 1556 cm-1 foi atribuída à deformaçao do grupo amida II da quitosana, indicando a incorporaçao desses componentes nas blendas. As bandas em 1076 e 999 cm-1, atribuídas ao estiramento C-OH do anel,37 tornaram-se mais largas e menos intensas à medida que a concentraçao de amido diminuiu.
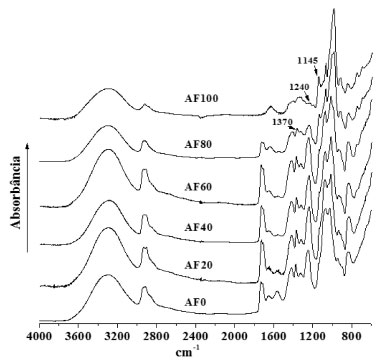 Figura 2. Espectros de infravermelho das blendas AF/PVA/quitosana na regiao de 4000-600 cm-1
Calorimetria exploratória diferencial (DSC) Na Figura 3 sao mostrados os termogramas dos filmes em que se observam três transiçoes endotérmicas: a primeira, bem larga, com picos variando entre 87,6 a 96,8 °C, referente à perda de água (representa a energia necessária para vaporizar a água presente nos filmes) e as transiçoes na faixa de 252-276 °C e 300-343 °C (2 picos) estao relacionadas à quebra das cadeias de amido pela dissociaçao dos complexos da amilose decorrentes da recristalizaçao das moléculas após resfriamento. Estes complexos sao altamente estáveis e por isso necessitam de maior energia para romper essas ligaçoes. Cervera e colaboradores3 verificaram que a presença de picos endotérmicos entre 280 °C a 300 °C em filmes de quitosana é característico de decomposiçao polimérica.
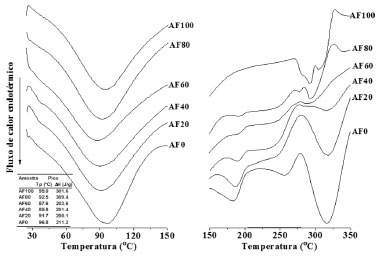 Figura 3. Termogramas das blendas AF/PVA/quitosana
Nas blendas AF80-AF0, além do pico de evaporaçao da água, a transiçao com temperatura de pico na faixa de 177-200 °C é atribuída à fusao cristalina do PVA, cujo valor da entalpia diminuiu à medida que o conteúdo desse componente foi reduzido nas blendas. O mesmo comportamento foi observado por Mucha e Pawlak39 onde os autores observaram o pico em torno de 190 °C. A presença de grupos hidroxila tende a favorecer a formaçao de fortes ligaçoes de hidrogênio entre as moléculas, levando a uma maior estabilidade e melhor integridade do sistema,40 o que é observado quando amido e PVA sao misturados nos filmes. Sin e colaboradores16 estudaram a interaçao em blendas constituídas de PVA e amido através de análise de DSC e concluíram que o deslocamento na faixa de fusao do PVA para temperaturas mais elevadas indica maior energia de estabilizaçao devido ao efeito sinergístico entre amido e PVA comprovando a interaçao entre esses componentes. Difraçao de raios-X Os difratogramas dos filmes estao representados na Figura 4. Os filmes sao formados após aquecimento na presença de água até completa gelatinizaçao dos grânulos, o que provoca destruiçao de sua estrutura cristalina apresentando assim um padrao amorfo. O filme de amido puro (AF100) apresentou padrao de difraçao de raios-X típico de material amorfo.
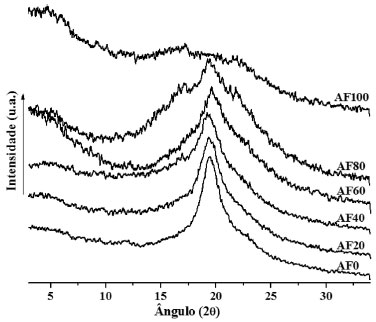 Figura 4. Difratogramas de raios-X das blendas AF/PVA/quitosana
A cristalinidade residual afeta as propriedades do filme de amido devido à incompleta desestruturaçao do amido granular (rompimento dos grânulos) e rápida recristalizaçao da estrutura da amilose durante o resfriamento ou armazenagem prolongados do material processado. Isto pode gerar materiais com baixa resistência mecânica devido à presença de uma interface entre o grânulo intacto e a fase termoplástica. Em todas as blendas observou-se um pico em torno de 19°(2θ), que aumentou de intensidade quando o teor de amido diminuiu, sendo, provavelmente, devido ao aumento na concentraçao de quitosana e PVA, pois na blenda AF0 este pico é bem definido e de maior intensidade. Os picos oriundos da recristalizaçao do amido, que frequentemente aparecem em 12° e 23° (2θ), nao foram observados nas blendas indicando que a adiçao de PVA e quitosana impediu o processo de retrogradaçao do amido. Teste de traçao As propriedades mecânicas sao essenciais para materiais plásticos, já que estao relacionadas com a resistência de um material, a deformaçao, o alongamento ou rompimento quando submetidos a uma força de traçao. Os valores de tensao na ruptura e extensao na quebra dos filmes estao representados na Figura 5.
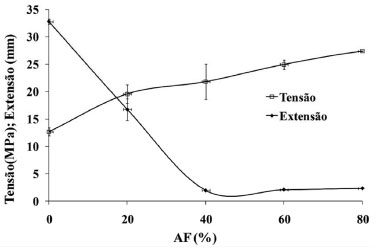 Figura 5. Tensao e extensao na quebra das blendas AF/PVA/quitosana
A blenda com maior concentraçao de PVA (AF20) foi a mais flexível obtendo 16,72% de extensao em comparaçao com o filme de amido puro (AF100) que obteve 2,25% de extensao. O PVA apresentou um efeito semelhante a um plastificante, provocando, de modo geral, aumento na flexibilidade com o incremento da sua concentraçao.41 O aumento da cristalinidade tipo B nos amidos termoplásticos em decorrência da retrogradaçao provoca um aumento na tensao de ruptura e diminuiçao no alongamento dos filmes.42 A opacidade e força dos filmes sao dependentes do teor de amilose, já que as cadeias lineares da amilose possuem mais grupos hidroxilas livres para interagir através de ligaçoes de hidrogênio, ao contrário das cadeias de amilopectina. Dessa forma, os géis e filmes de amilose ou de amido com alto teor de amilose sao mais fortes e resistentes que os de amilopectina43 e têm maior tendência a retrogradaçao.
CONCLUSAO Os filmes elaborados a partir da blenda de amido fosforilado/CH/PVA (20 e 40%) apresentaram boas propriedades mecânicas e baixa permeabilidade ao vapor d'água, porém média resistência à umidade o que limita sua utilizaçao como embalagens de produtos secos, já que estes requerem mínima transferência de umidade entre o alimento e o meio. Estas blendas mostraram-se promissoras para aplicaçao como filmes agrícolas, por apresentar alta capacidade de absorçao de água (que garantiria umidade ao solo) e ser obtido a partir de matéria-prima biodegradável (sendo fonte de matéria orgânica após o descarte). Além disso, os filmes podem ser utilizados como curativos, por apresentarem boas características de permeabilidade ao vapor d'água, flexibilidade, alta capacidade de absorçao e biodegradabilidade.
REFERENCIAS 1. Guan, J.; Fang, Q.; Hanna, M. A.; J. Polym. Environ. 2004, 12, 57. DOI: http://dx.doi.org/10.1023/B:JOOE.0000010051.46648.0e 2. Bhattacharya, M.; Vaidya, U. R.; Zhang, D.; Narayan, R.; J. Appl. Polym. Sci. 1995, 57, 539. DOI: http://dx.doi.org/10.1002/app.1995.070570504 3. Singh, V.; Ali, S. Z.; Carbohydr. Polym. 2000, 41, 191. DOI: http://dx.doi.org/10.1016/S0144-8617(99)00086-7 4. Wongsagon, R.; Shobsngob, S.; Varavinit, S.; Starch/Stärke 2005, 57, 166. DOI: http://dx.doi.org/10.1002/star.200400299 5. O'Brien, S.; Wang, Y.-J.; Carbohydr. Polym. 2009, 77, 464. DOI: http://dx.doi.org/10.1016/j.carbpol.2009.01.014 6. Waliszewski, K. N.; Aparicio, M. A.; Bello, L. A.; Monroy, J. A.; Carbohydr. Polym. 2003, 52, 237. DOI: http://dx.doi.org/10.1016/S0144-8617(02)00270-9 7. Wattanchant, S.; Muhammad, K.; Hashim, D.; Rahman, R. A.; Food Chem. 2003, 80, 463. DOI: http://dx.doi.org/10.1016/S0308-8146(02)00314-X 8. Huang, R.; Li, C-P.; Chen, D.; Zhao, G.; Cheng, W.; Zhang, Y.; Zhao, H.; J. Food Sci. Technol. 2013, 50, 561. DOI: http://dx.doi.org/10.1007/s13197-011-0353-9 PMID: 24425953 9. Lim, S.; Seib, P. A.; Cereal Chem. 1993, 70, 137. 10. Sitohy, M. Z.; El-Saadany, S. S.; Labib, S. M.; Ramadan, M. F.; Starch/Stärke 2000, 52, 101. DOI: http://dx.doi.org/10.1002/1521-379X(200006)52:4<101::AID-STAR101>3.0.CO;2-W 11. Liu, H.; Ramsden, L.; Corke, H.; Cereal Chem. 1999, 76, 938. DOI: http://dx.doi.org/10.1094/CCHEM.1999.76.6.938 12. Murúa-Pagola, B.; Beristain-Guevara, C. I.; Martínez-Bustos, F.; J. Food Eng. 2009, 91, 380. DOI: http://dx.doi.org/10.1016/j.jfoodeng.2008.09.035 13. Sitohy, M. Z.; Ramadan, M. F.; Starch/Stärke 2001, 53, 27. DOI: http://dx.doi.org/10.1002/1521-379X(200101)53:1<27::AID-STAR27>3.3.CO;2-C 14. Yi, H.; Wu, L.-Q.; Bentley, W. E.; Ghodssi, R.; Rubloff, G. W.; Culver, J. N.; Payne, G. F.; Biomacromolecules 2005, 6, 2881. DOI: http://dx.doi.org/10.1021/bm050410l PMID: 16283704 15. Siddaramaiah; B. R.; Somashekar, R.; J. Appl. Polym. Sci. 2004, 91, 630. DOI: http://dx.doi.org/10.1002/app.13194 16. Sin, L. T.; Rahman, W. A.; Rahmat, A. R.; Khan, M. I.; Carbohydr. Polym. 2010, 79, 224. DOI: http://dx.doi.org/10.1016/j.carbpol.2009.08.003 17. Pérez, E.; Bahnassey, Y.; Breene, W.; Starch/Stärke 1993, 4, 211. DOI: http://dx.doi.org/10.1002/star.19930450605 18. Paschall, E. F. Em Methods in carbohydrate chemistry; Whistler, R. L. ed.; Academic Press Publishers: New York, 1964, vol. 4, p. 214-296. 19. Wurzburg, O. B. Em Modified Starches: Properties and Uses; Wurzburg, O. B., ed.; CRC Press: Boca Raton, 1986, p. 97-103. 20. Gontard, N.; Guilbert, S.; Cuq, J. L.; J. Food Sci. 1992, 57, 190. DOI: http://dx.doi.org/10.1111/j.1365-2621.1992.tb05453.x 21. Pal, K.;Pal, S.; Mater. Manuf. Processes 2006, 21, 325. DOI: http://dx.doi.org/10.1080/10426910500464826 22. ASTM, American Society for Testing and Materials. Em Annual Book of ASTM Standards, American Society for Testing and Materials, 1990, Method E-96-90, p. 834-841. 23. ASTM, American Society for Testing and Materials. Em Annual Book of ASTM Standards, American Society for Testing and Materials, 1997, Method D 882-97 p. 159-197. 24. Nabeshima, E. H.; Grossmann, M. V. E.; Carbohydr. Polym. 2001, 45, 347. DOI: http://dx.doi.org/10.1016/S0144-8617(00)00273-3 25. Henrique, C. M.; Cereda, M. P.; Sarmento, S. B. S.; Ciência e Tecnologia de Alimentos 2008, 28, 231. DOI: http://dx.doi.org/10.1590/S0101-20612008000500035 26. Bilck, A. P.; Grossmann, M. V.E.; Yamashita, F.; Polym. Test. 2010, 29, 471. DOI: http://dx.doi.org/10.1016/j.polymertesting.2010.02.007 27. Mangala, E.; Kumar, T. S.; Baskar, S.; Rao, K. P.; Trends in Biomaterials & Artificial Organs 2003, 17, 34. 28. Tang, R.; Du, Y.; Fan, L.; J. Polym. Sci.: Part B: Polymer Physics 2003, 41, 993. DOI: http://dx.doi.org/10.1002/polb.10405 29. Larotonda, F. D.; Matsui, K. N.; Sobral, P. J. A.; Laurindo, J. B.; J. Food Eng, 2005, 71, 394. DOI: http://dx.doi.org/10.1016/j.jfoodeng.2004.11.002 30. Gomes, A. M. M.; Tese de doutorado. Universidade Federal do Ceará, Brasil, 2009. 31. Cuq, B.; Gontard, N.; Guilbert, S.; Em Active food packagings; Rooney, M. L., ed.; Glasgow: Blackie Academic & Professional, 1995, p. 111-142. 32. Bolton, L. L.; Johnson, C. L.; Van Rijswijk, L.; Clinics in Dermatology 1992, 9, 573. DOI: http://dx.doi.org/10.1016/0738-081X(91)90087-2 33. Bolton, L. L.; Monte, K.; Pirone, L. A.; Ostomy Wound Management 2000, 46, 51S. 34. Wu, P.; Nelson, E. A.; Reid, W. H.; Biomaterials 1996, 17, 1373. DOI: http://dx.doi.org/10.1016/0142-9612(96)87277-2 PMID: 8830962 35. Pawlak, A.; Mucha, M.; Thermochim. Acta 2003, 396, 153. DOI: http://dx.doi.org/10.1016/S0040-6031(02)00523-3 36. Chen, Y.; Cao, X.; Chang, P. R.; Huneault, M. A.; Carbohydr. Polym. 2008, 73, 8. DOI: http://dx.doi.org/10.1016/j.carbpol.2007.10.015 37. Fang, J. M.; Fowler, P. A.; Tomkinson, J.; Hill, C. A. S.; Carbohydr. Polym. 2002, 47, 245. DOI: http://dx.doi.org/10.1016/S0144-8617(01)00187-4 38. Cervera, M. F.; Heinämäki, J.; Krogars, K.; Jörgensen, A. C.; Karjalainen, M.; Colarte, A. I.; Yliruusi, J.; AAPS PharmSciTech 2004, 5, 109. DOI: http://dx.doi.org/10.1007/BF02830583 39. Mucha, M.; Pawlak, A.; Thermochim. Acta 2005, 427, 69. DOI: http://dx.doi.org/10.1016/j.tca.2004.08.014 40. Rahmat, A. R.; Rahman, W. A. W. A.; Sin, L. T.; Yussuf, A. A.; Mater. Sci. Eng., C 2009, 29, 2370. DOI: http://dx.doi.org/10.1016/j.msec.2009.06.009 41. Shimazu, A. A.; Mali, S.; Grossmann, M. V. E.; Semina Ciências Agrárias 2007, 28, 79. DOI: http://dx.doi.org/10.5433/1679-0359.2007v28n1p79 42. Forssel, P. M.; Hulleman, S. H. D.; Myllärinen, P. J.; Moate, G. K.; Parker, R.; Carbohydr. Polym. 1999, 39, 43. DOI: http://dx.doi.org/10.1016/S0144-8617(98)00128-3 43. Rindlav-Westling, Å.; Stading, M.; Hermansson, A.-M.; Gatenholm, P.; Carbohydr. Polym. 1998, 36, 217. DOI: http://dx.doi.org/10.1016/S0144-8617(98)00025-3 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





