Artigo
|
|
| Procedimento automático para determinação espectrofotométrica de hidroquinona empregando multicomutação em sistema de análise em fluxo Automatic procedure for spectrophotometric determination of hydroquinone employing multicommutation flow in analysis system |
|
Manoel de Jesus de Aquino LimaI,II; Quésia Guedes da Silva CastilhoI; Ridvan Nunes FernandesI; Auro Atsushi TanakaI; Boaventura Freire dos ReisII,*
IDepartamento de Química, Universidade Federal do Maranhão, 65080-805 São Luís - MA, Brasil Recebido em 13/11/2015 *e-mail: reis@cena.usp.br This paper describes a procedure based on multicommutation in flow analysis system for photometric determination of hydroquinone in pharmaceutical gel formulations. The procedure involves oxidation of hydroquinone by Fe (III) and subsequent reaction between the generated Fe (II) species with 1,10-phenanthroline, producing a complex detected at 510 nm. Under optimized conditions, the proposed system showed a linear response in the range between 5 to 120 µmol L-1 (r = 0.9995), a limit of detection (3σ) 0.52 µmol L-1 and a relative standard deviation (RSD) of 1.5% for a 80 µmol L-1 hydroquinone standard solution. Others profitable features such as an analytical frequency of 72 samples per hour; a reagent consumption of 0.432 and 0.117 mg 1-10-phenantroline and FeCl3.6H2O per determination, respectively; and a waste generation of 4.0 ml per determination were also achieved. INTRODUÇÃO Hidroquinona (benzeno-1,4-diol) é um composto pertencente à classe dos fenóis e é muito utilizado como componente principal em reveladores fotográficos, inibidor de reações de polimerização e antioxidante para borrachas e corantes.1 Na medicina, a hidroquinona (HQ) representa o composto ativo mais utilizado no tratamento de despigmentação de manchas dermatológicas.2,3 Tais aplicações podem ter efeitos colaterais em seus usuários, devido à utilização de maneira inadequada ou em dosagens maiores que a recomendada (em geral entre 2 e 10 %).2 Além disso, o descarte inapropriado causa impacto ambiental desfavorável. A Farmacopeia Brasileira contempla somente o procedimento para quantificação de HQ pura sem excipientes,4 portanto não há metodologia oficial para o doseamento de HQ em formulações farmacêuticas. A Farmacopeia Americana5 apresenta procedimentos para doseamento de amostras farmacológicas contendo HQ na formulação com creme e para HQ pura. Este produto também é fornecido na forma Gel e geralmente contendo HQ em dosagem em torno de 40 mg/g. Entretanto, as farmacopeias citadas, não descrevem procedimentos para o controle de qualidade deste tipo de formulação. Geralmente, a HQ é encontrada associada a outros princípios ativos, por exemplo, ácido retinóico, ácido glicólico e ácido kójico, na forma de géis, loções ou pomadas cremosas, tanto em cosméticos industriais quanto em produtos manipulados. Em vista disso, a disponibilidade de métodos analíticos simples, rápidos e eficientes para a determinação de hidroquinona se faz necessário. Na literatura, diversos métodos analíticos têm sido reportados para determinação HQ de forma isolada ou simultaneamente com catecol ou ácido kójico.6,7 Os procedimentos usuais têm empregado métodos baseados em cromatografia liquida de alta eficiência (HPLC),8,9 espectrofotometria,7 quimiluminescência,3,10 fluorescência,11 amperometria, 2,12,13 e voltametria. 6,14 O presente trabalho compreende o desenvolvimento e a aplicação de um procedimento espectrofotométrico para a determinação de HQ em formulações farmacêuticas (Gel), empregando o processo de multicomutação em análise em fluxo (MCFA).15,16 O procedimento é baseado na reação de oxidação da molécula de HQ com ferro (III) em meio ácido e posterior reação do ferro (II) gerado com 1,10-fenantrolina, formando um complexo que é detectado em 510 nm.7 Atualmente, é consenso de que os procedimentos analíticos devem ser ambientalmente amigáveis, e para isso devem atender as diretrizes preconizadas pelo conceito de química verde (GAC - Green Analytical Chemistry).17,18 Os requisitos relacionados com a redução do consumo de reagentes e a geração de efluentes, são facilmente atendidos empregando procedimento analítico baseado no processo de multicomutação em análise em fluxo (MCFA).17 Nos procedimentos citados, inclusive os baseados no processo FIA, não há indicações referentes ao consumo de reagente e ao volume de efluente gerado,3,4,10 parâmetros que permitem atestar a sustentabilidade ambiental do procedimento analítico. O corrente procedimento analítico, baseado no processo MCFA, tem como foco a utilização das facilidades deste sistema para desenvolver um procedimento analítico com redução do consumo de reagentes e do volume de efluente gerado. Alta produtividade é também um parâmetro pleiteado, e deve ser alcançado sem comprometer a exatidão e a precisão dos resultados.
PARTE EXPERIMENTAL Reagentes e soluções Todos os reagentes químicos utilizados foram de grau analítico e as soluções foram preparadas com água purificada com resistividade específica de 18,2 MΩ cm-1 a 25 ºC. A solução estoque de ferro (III) 0,01 mol L-1, foi preparada a partir do composto sólido FeCl3.6H2O (Vetec, Brasil) em HNO3 (Merck, Alemanha) 0,1 mol L-1, soluções de trabalho foram preparadas por diluição em HNO3 0,01 mol L-1. Para a preparação da solução de 1,10-fenantrolina (Merck, Alemanha), concentração de 0,3% (m/v), quantidade adequada do reagente foi dissolvida em 100 mL de água a uma temperatura de 70 ºC. Após dissolução, a solução foi resfriada à temperatura ambiente (≈ 23 ºC) e o volume completado com água. As soluções "Clark-Labs" (CL) com o pH na faixa de 3,0 a 5,0 foram preparadas a partir de soluções 0,1 mol L-1 de KCl (Sigma, Alemanha) e de HCl (Vetec, Brasil). A solução estoque de HQ (Merck, Alemanha) com concentração de 0,01 mol L-1 foi preparada dissolvendo 11,01 mg do sólido em 10 mL de água e armazenada em frasco âmbar e mantida sob refrigeração. A partir desta solução, soluções diluídas de HQ com concentrações entre 5 e 200 µmol L-1 foram preparadas diariamente por diluição apropriada com solução tampão (pH 3,0). As amostras de fármacos analisadas, foram adquiridas no comércio local (formulação gel). As soluções foram preparadas, pesando uma massa ≈ 1,0 g dissolvendo em 100 mL de água sob agitação e sonicação durante 10 minutos. Diluições com a solução tampão CL (pH 3,0) foram realizadas para obtenção da solução dentro da faixa linear de trabalho. Para averiguar a exatidão do procedimento proposto, foi empregado o método oficial da farmacopeia americana para HQ em formulações creme.5 As amostras foram preparadas, pesando uma massa de 0,5 g do gel e dissolvendo em 100 mL de metanol. As soluções padrão de HQ também foram preparadas em metanol. A detecção espectrofotométrica (λ = 293 nm) foi realizada utilizando uma cela de quartzo com passo óptico de 1 cm. Equipamentos O módulo de análise foi construído empregando quatro válvulas solenoide de três vias (Nresearch 161T031), tubos de polietileno 0,8 mm (d.i) e uma confluência construída em acrílico. Como sistema de propulsão foi utilizado uma bomba peristáltica Ismatec IPC-8 de oito canais. Um microcomputador equipado com uma interface PCL711S (Advantech corp. OH, USA), foi utilizado para gerar os sinais de controle das válvulas solenoide, os quais foram enviados para uma interface de potência baseada no circuito integrado ULN 2803.16 Esses sinais são gerados com uma diferença de potencial de 5 V, e a interface de potência permite o acionamento das válvulas solenoide alimentadas com uma diferença de potencial de 12 V. O espectrofotômetro FEMTO 700 Plus (São Paulo, Brasil), equipado com cela de fluxo de 80 µL e caminho óptico de 10 mm, foi acoplado ao computador através da interface serial RS 232C, permitindo a realização da aquisição de dados. O controle de todo o sistema e a aquisição dos dados foram executados, usando um programa computacional escrito em linguagem Quick BASIC 4.5. Procedimento experimental A Figura 1 mostra o diagrama do módulo de análise utilizado no presente trabalho. O sistema funciona no modo aspiração, então a bomba peristáltica foi posicionada entre o detector e o recipiente de armazenamento do descarte. Nesta configuração, todas as válvulas solenoide estão desligadas e somente o fluído transportador (Ca) está sendo aspirado através da válvula V1, passando através do reator (B) e da cela de fluxo do espectrofotômetro (Det) em direção à bomba peristáltica (Pb). Ao iniciar o processo de amostragem, o computador envia um sinal de controle através da interface PCL711S para acionar a válvula V1, a qual muda de posição e interrompe o fluxo da solução transportadora (Ca). Enquanto a válvula V1 é mantida ligada, as válvulas solenoide V2, V3 e V4 são ligadas e desligadas sequencialmente o número de vezes necessária para inserir os volumes de cada solução previamente programado. Os intervalos de tempo em que as válvulas V2, V3 e V4 permanecem ligadas, define o volume da alíquota de cada solução e é um dos parâmetros investigados.
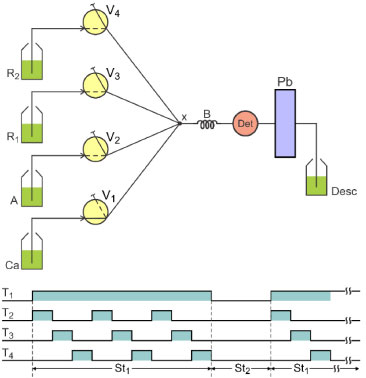 Figura 1. Diagrama do módulo de análise. Ca = solução transportadora (HNO30,014 mol L-1); A = solução do padrão ou amostra de HQ; R1 = solução de ferro (III); R2 = solução de 1,10-fenantrolina 0,3 % (m/v); X = confluência feita em acrílico; B = reator helicoidal feito em polietileno (l= 100 cm e Φint = 0,8 mm); Pb = bomba peristáltica; Desc = descarte de efluente; V1, V2, V3 e V4 = válvulas solenoide de três vias. As linhas contínua e interrompida nos símbolos das válvulas solenoide, indicam o caminho de passagem de fluído quando os dispositivos estão desligados ou ligados, respectivamente. T1, T2, T3 e T4 = diagrama de tempo de acionamento das válvulas solenoide V1, V2, V3 e V4, respectivamente. As superfícies sombreadas em azul indicam que a válvula correspondente está ligada. St1 e St2 = estágio de amostragem e de leitura, respectivamente
Os volumes das alíquotas das soluções da amostra (A) e dos reagentes R1 e R2 são definidos pela vazão de bombeamento e pelo tempo em que cada válvula permanece ligada. Uma sequência de acionamento das válvulas solenoide V2, V3 e V4 é definida como um ciclo de amostragem, o qual pode ser repetido o número de vezes necessário. As alíquotas das soluções de hidroquinona, ferro (III) e 1,10-fenantrolina são inseridas sequencialmente na bobina de reação (B) por aspiração. Uma vez finalizada a etapa de amostragem (St1), todas as válvulas são desligadas e a solução transportadora flui (St2) através da bobina de reação e desloca a zona da amostra para a cela de fluxo no espectrofotômetro (Det). Durante o transporte, ocorre a mistura das soluções dos reagentes, a hidroquinona reduz o ferro (III) para ferro (II), que reage com a 1,10-fenantrolina, formando o composto detectado em 510 nm. O sinal gerado pelo espectrofotômetro no formato digital, é enviado para o computador através da interface serial RS 232C. Estes dados são armazenados em arquivos no padrão ASCII para posterior tratamento. Finalizada esta etapa, a execução do programa de controle retorna ao início para executar outra corrida analítica, e assim procede automaticamente até completar as replicatas programadas. As condições operacionais do sistema foram estabelecidas após otimização das seguintes variáveis: duração dos intervalos de tempo de acionamento das válvulas V2, V3 e V4; concentração da solução de ferro (III); estabilidade da solução de HQ em tampão CL; vazão de bombeamento; efeito da solução carregadora; ordem de adição dos reagentes; número de ciclos de amostragem; comprimento do reator e intervalo de tempo de leitura.
RESULTADOS E DISCUSSÃO Testes preliminares e pH da solução O procedimento analítico desenvolvido para a determinação de HQ em soluções aquosas foi baseado na reação de redução do ferro (III) para ferro (II) pela hidroquinona, em seguida o ferro (II) reage com a 1,10-fenantrolina, e forma um complexo de cor avermelhada, mostrado na Figura 2, o qual apresenta absorção de radiação eletromagnética com máximo em torno de 510 nm. Testes preliminares mostraram que não era necessário uma etapa previa para ocorrer a reação de redução do ferro (III) pela hidroquinona, permitindo assim que as alíquotas das soluções dos reagentes fossem inseridas na bobina de reação sem uma ordem preferencial. Esta facilidade permitiu que as alíquotas das três soluções fossem introduzidas no mesmo ponto de confluência, possibilitando a concepção de um módulo de análise com estrutura simples.
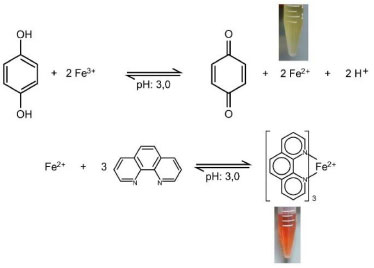 Figura 2. Reação de oxidação de hidroquinona na presença de Fe (III) em tampão CL, resultando no produto p-quinona e formação de um complexo entre o Fe (II) e 1,10-fenantrolina, que absorve na região do visível do espectro eletromagnético, monitorado em 510 nm
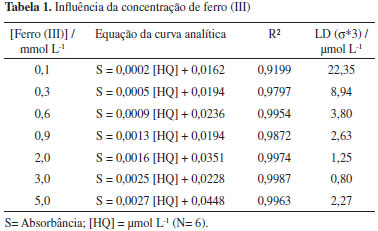
Tendo em vista que a acidez do meio poderia afetar o desenvolvimento da reação, este parâmetro foi o primeiro a ser avaliado. Os testes iniciais foram realizados com soluções padrão de HQ com pH 3,0; 4,0 e 5,0. Em pH 5,0 foi obtido um aumento significativo na sensibilidade em relação aos resultados obtidos em pH 3,0 e 4,0. Entretanto, observou-se que em pH 4,0 e 5,0, os sinais não apresentaram repetibilidade ao longo do tempo, indicando deterioração das soluções de hidroquinona. Em vista disso, para dar sequência aos experimentos, as soluções padrão de hidroquinona foram preparadas em pH 3,0. Influência da concentração de ferro A influência da concentração de ferro (III) foi avaliada, a partir de experimentos realizados usando as seguintes soluções: 1,10-fenantrolina 0,3 % (m/v); hidroquinona na faixa de 10 a 100 µmol L-1 (pH = 3,0); e Fe (III) com concentrações na faixa de 0,1 a 5,0 mmol L-1. Nestes experimentos, foram empregados uma bobina de reação de 100 cm de comprimento, 6 ciclos de amostragem, vazão de 3,6 ml min-1 e intervalos de tempo de 0,5 s para o acionamento de cada válvula solenoide (V2, V3 e V4), e os resultados obtidos são apresentados na Tabela 1. Estabelecendo como parâmetros de avaliação, a resposta linear e o limite de detecção, podemos observar que o melhor resultado foi alcançado com a solução de Fe (III) 3,0 mmol L-1.
Tempo de acionamento das válvulas solenoide Em sistemas de análise em fluxo, os volumes das soluções inseridos afetam a sensibilidade do procedimento analítico, assim para estabelecer a melhor condição, experimentos foram realizados variando-se os intervalos de tempo programados para manter cada válvula solenoide ligada. Os experimentos foram realizados de forma univariada, ou seja, variando-se o intervalo de tempo da válvula V2, que controlava a inserção da solução padrão de hidroquinona, e mantendo-se os intervalos de tempo para manter V3 e V4 ligadas em 0,5 s. Este procedimento foi mantido para os experimentos com as soluções de ferro (III) (V3) e 1,10-fenantrolina (V4), mantendo 8 ciclos de amostragem e vazão de 3,6 ml min-1. Os resultados da Figura 3, mostraram um pequeno aumento de sinal para a solução de 1,10-fenantrolina com a variação do intervalo de tempo até 0,2 s (Curva A; Figura 3). O decréscimo de sinal para intervalos de tempo maiores, pode ser atribuído à diluição da amostra na solução do reagente. O aumento do tempo de permanência da válvula solenoide ligada, aumenta o volume da solução inserida, então se o reagente já estava em excesso, não haveria ganho de sinal. Para a solução de ferro (III) (Curva B; Figura 3), o efeito foi semelhante, embora menos acentuado que para a solução de 1,10-fenantrolina. Um ganho significativo de sinal foi obtido até o intervalo de tempo de 0,2 s para o acionamento das válvulas V3 e V4. O intervalo de tempo de 0,2 s (volume ≈ 11,9 µL) foi estabelecido como condição ótima. Para a hidroquinona (analito), o comportamento linear esperado foi observado (Curva C; Figura 3), uma vez que em sistemas de análise em fluxo o sinal gerado é também função do volume inserido. A partir destes resultados, o intervalo de tempo de 0,3 s foi selecionado para a válvula da solução de HQ (V2). Além disso, o comportamento da curva C indica possibilidade de se aumentar o intervalo de tempo de inserção da solução de HQ. Este recurso poderia ser usado em caso da necessidade de ganho de sensibilidade.
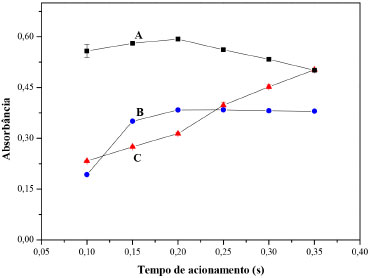 Figura 3. Influência do tempo de acionamento das válvulas na magnitude do sinal. A = solução de 1,10-fenantrolina 0,3% (m/v); B = solução de ferro (III) 3,0 mmol L-1; C = solução padrão de hidroquinona 100 µmol L-1. Vazão de bombeamento de 3,6 mL min-1; 8 ciclos de amostragem; e reator de 100 cm de comprimento
Estudo da vazão do sistema Para avaliar o efeito da vazão de bombeamento, foram realizados experimentos com soluções padrão de HQ 100 µmol L-1 e do branco, aplicando 8 ciclos de amostragem, a vazão foi avaliada na faixa de 2,42 até 5,14 mL min-1. Os resultados mostrados na Figura 4, indicam um comportamento praticamente linear até a vazão de 4,8 mL min-1. O aumento da vazão tem como consequência, o aumento do volume da zona da amostra, portanto um ganho na magnitude dos sinais gerados seria esperado. A resposta praticamente linear não é usual em sistema de análise fluxo, onde a alíquota da amostra é selecionada por alça de amostragem,19,20 entretanto em sistemas de análise em fluxo baseado em multicomutação este efeito já foi relatado.21 Empregando um intervalo de tempo de 0,7 s para cada ciclo de amostragem e a vazão de 4,8 mL min-1, o volume inserido de cada solução foi de 56 µL por ciclo de amostragem, portanto para 8 ciclos de amostragem o volume da zona da amostra foi de 448 µL. Considerando-se que valores de vazão mais elevados não produziram aumento significativo do sinal analítico, a vazão de 4,8 mL min-1 foi estabelecida para prosseguimento do trabalho.
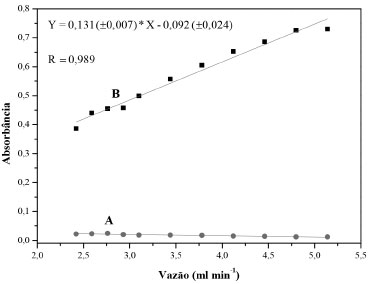 Figura 4. Influência da vazão no sinal analítico. As curvas A e B correspondem às soluções do branco e do padrão de HQ 100 µmol L-1, respectivamente. Condições experimentais: 8 ciclos de amostragem; intervalo de tempo de 0,3 s para inserção da solução de HQ (V2); e intervalos de tempo de 0,2 s para inserções das soluções dos reagentes (R1 e R2)
Efeito do volume da zona da amostra O módulo de análise empregado neste trabalho, foi baseado em um sistema de análise em fluxo por multicomutação (MCFA), onde o volume da zona da amostra pode ser controlado, variando-se o número de ciclos de amostragem. Assim, o número de ciclos de amostragem foi variado de 2 a 10 e o volume de cada solução por ciclo amostragem, mantido em 56 µL. Tomando-se como parâmetro de medição, o valor máximo do sinal gerado, foi obtida a curva mostrada na Figura 5. O comportamento linear observado é característico do processo de multicomutação, o qual é diferente do que ocorre em sistemas de análise em fluxo (FIA) com inserção da amostra usando alça de amostragem, onde o sinal aumenta, mas a resposta não é linear. 19,20 Para estudos posteriores, o volume da zona da amostra foi mantido constante em 504 µL (9 ciclos de amostragem).
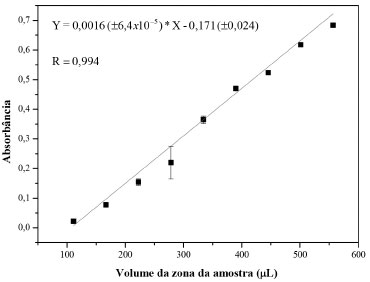 Figura 5. Efeito do volume da zona da amostra. Intervalos de tempo de 0,3 s para inserção de HQ e de 0,2 s para as soluções de reagentes. Solução padrão de HQ 100 µmol L-1
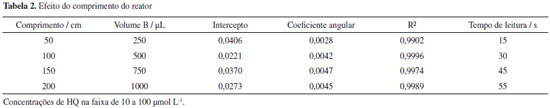
Influência do comprimento do reator na magnitude do sinal Para verificar a influência do comprimento do reator no sinal analítico e no desempenho do sistema, foram construídas curvas analíticas empregando bobinas de reação (reator) com comprimentos de 50, 100, 150 e 200 cm e soluções padrão de HQ com concentrações na faixa de 10 até 100 µmol L-1. Os experimentos foram realizados empregando-se 9 ciclos de amostragem e mantendo os intervalos de tempo de inserção estabelecidos anteriormente. Os valores máximos dos sinais gerados em função das concentrações das soluções padrão de HQ, foram usados para obter as curvas de regressão linear, e os respectivos parâmetros são apresentados na Tabela 2. Uma análise destes dados mostra que houve um aumento do coeficiente angular até o reator de 150 cm. Tendo em vista que o volume da zona da amostra foi mantido constante (504 µL), este incremento de sensibilidade pode ser atribuído ao maior tempo de residência, permitindo melhor desenvolvimento da reação. Quanto à linearidade, exceto para o reator de 50 cm, não foi observada uma diferença significativa. O aumento do percurso analítico (reatores de 150 e 200 cm) influenciou na etapa de leitura/limpeza, sendo necessário um intervalo de tempo maior para esta etapa, incorrendo em maior consumo do fluído transportador e diminuição da frequência analítica. Além disso, estes reatores não produziram aumento significativo na sensibilidade do método, então o reator de 100 cm foi selecionado, considerando-se que contemplaria os requisitos de frequência de amostragem alta, sensibilidade adequada e menor volume de efluente gerado.
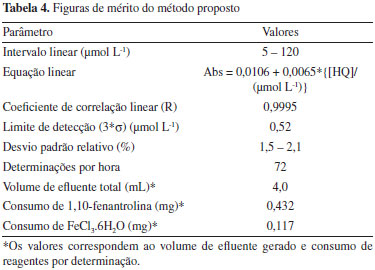
Estudo de interferentes A influência de substâncias interferentes foi avaliada, usando uma solução padrão de HQ 11,011 mg L-1 (100 µmol L-1). Considerando-se como critério de avaliação, uma variação de sinal em uma faixa de ± 5%, tendo como referência a leitura obtida com uma solução padrão do analito sem o possível interferente. Os testes foram realizados com os seguintes excipientes: carbomer 980, edetato dissódico diidratado, metilparabeno, metabissulfito de sódio, propilenoglicol e trometamol. A menor tolerância foi observada para o metabissulfito de sódio, usando uma concentração 50 vezes maior que a concentração de HQ. Para os demais excipientes, a tolerância observada foi da ordem de 500 vezes a concentração de hidroquinona. Desempenho do módulo de análise Os parâmetros analíticos otimizados foram agrupados na Tabela 3, de modo a permitir uma visão geral dos valores selecionados para a avaliação do desempenho do sistema proposto. Neste sentido, um conjunto de soluções padrão de hidroquinona foi processado, empregando os valores dos parâmetros de controle estabelecidos na Tabela 3 e o resultado é apresentado na Figura 6. Uma análise dos registros mostrou ótima repetibilidade, sem desvios da linha de base, indicando a robustez do módulo de análise. Além disso, observa-se que 27 determinações foram realizadas em um intervalo de tempo de 1350 s, então o procedimento analítico proposto permite realizar 72 determinações por hora. A partir dos valores máximos dos sinais registrados, uma curva analítica foi construída (Figura 6b) e mostrou uma resposta linear para concentrações de HQ na faixa de 5 a 120 µmol L-1, representada pela seguinte equação: Absorbância = {0,0106 + (0,0065*[HQ])}, bom coeficiente de correlação linear (r = 0,9995) e um desvio padrão relativo de 1,5 e 2,1% para soluções padrão de 10 e 80 µmol L-1 de HQ, respectivamente. Além disso, o limite de detecção (3*σ) estimado foi de 0,52 µmol L-1 HQ.
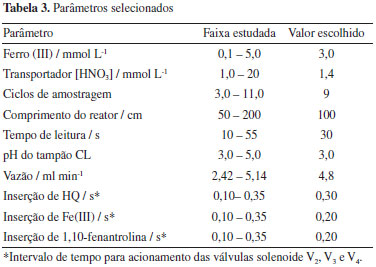
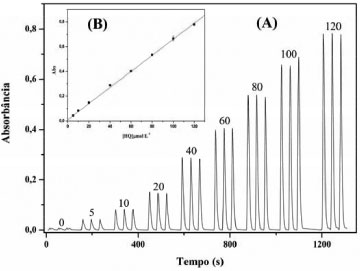 Figura 6. Sinais transientes das soluções padrão de hidroquinona. (A) da esquerda para direita: soluções padrão de HQ 0, 5, 10, 20, 40, 60, 80, 100 e 120 µmol L-1. (B) Curva analítica correspondente aos sinais transientes
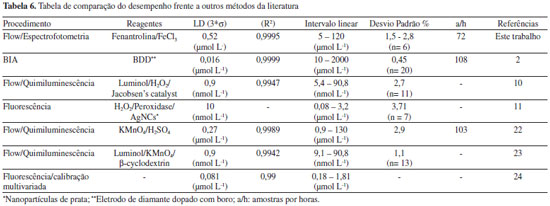
Operando o módulo de análise empregando os parâmetros estabelecidos na Tabela 3, encontramos as figuras de mérito sumarizadas na Tabela 4, onde podemos destacar a alta frequência de amostragem e baixo consumo de reagentes.
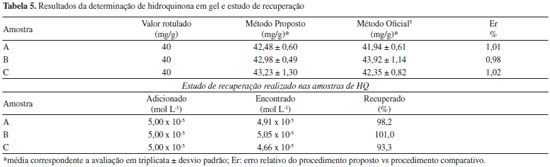
Uma vez estabelecidas as condições experimentais, o sistema proposto foi testado com produtos farmacêuticos em formulações gel contendo hidroquinona e os resultados são apresentados na Tabela 5. Nesta tabela, também são apresentados os valores obtidos com a aplicação do método oficial da farmacopeia americana para amostras de HQ em creme.5 Uma análise comparativa destes dados com a aplicação do teste t-pareado, mostrou que o valor calculado 0,286, é menor que o tabelado 2,920, indicando que os resultados obtidos com o método proposto são equivalentes ao da farmacopeia americana com nível de confiança de 95%. Além disso, uma comparação dos resultados apresentados com outros trabalhos relatados na literatura (Tabela 6), mostrou que o método é adequado para a determinação de HQ em formulações gel.
CONCLUSÃO O procedimento analítico apresentado mostrou-se adequado para a determinação de hidroquinona em formulações farmacêuticas na forma de gel. O sistema de análise em fluxo com multicomutação apresentou baixo consumo de reagentes sem comprometer a precisão e a exatidão do método. Os resultados mostraram uma elevada taxa de amostragem (cerca de 72 determinações por hora) e um consumo de reagentes estimado em 0,432 e 0,1127 mg para 1,10-Fenantrolina e FeCl3.6H2O, respectivamente. Em resumo, o procedimento é rápido, robusto e está de acordo com os conceitos da química limpa, 17,18 indicando que é uma alternativa viável para a determinação de HQ em formulações farmacêuticas gel.
AGRADECIMENTOS Os autores agradecem os auxílios financeiros outorgados pelos órgãos de fomento à pesquisa CNPq, CAPES e FAPESP.
REFERÊNCIAS 1. Wang, J.; Park, J.; Wei, X.; Lee, C. W.; Chem. Commun. 2003, 7, 628. DOI: http://dx.doi.org/10.1039/b212296k 2. Cunha, R. R.; Tormin, T. F.; Richter, E. M.; Munoz, R. A. A.; Quim. Nova 2013, 36, 663. DOI: http://dx.doi.org/10.1590/S0100-40422013000500009 3. Chao, Y.; Zhang, X.; Liu, L.; Tian, L.; Pei, M.; Cao, W.; Microchim. Acta 2015, 182, 943. DOI: http://dx.doi.org/10.1007/s00604-014-1415-2 4. ANVISA; Farmacopeia Brasileira, v 2, 5ª ed, 2010, ANVISA; Farmacopeia Brasileira, v 2, 5ª ed, 2010, http://www.anvisa.gov.br/hotsite/cd_farmacopeia/pdf/volume2.pdf , acessado em março 2016. 5. United States Pharmacopeia (USP 32), 2008. USP Convention, Rockville, MD. http://www.usp.org/sites/default/files/usp_pdf/EN/products/usp2008p2supplement3.pdf , acessado em março de 2016. 6. Zheng, L. Z. Z.; Xiong, L.; Li, Y. D.; Xu, J. P.; Kang, X. W.; Zou, Z. J.; Yang, S. M.; Xia, J.; Sens. Actuators, B 2013, 177, 344. DOI: http://dx.doi.org/10.1016/j.snb.2012.11.006 7. Calaça, G. N.; Stets, S.; Nagata, N.; Quim. Nova 2011, 34, 630. DOI: http://dx.doi.org/10.1590/S0100-40422011000400015 8. Huang, S.; Lin, C.; Huang, M.; Wen, K.; J. Food Drug Anal. 2004, 12, 13. 9. Lin, C.; Sheu, J.; Wu, H.; Huang, Y.; J. Pharm. Biomed. Anal. 2005, 38, 414. DOI: http://dx.doi.org/10.1016/j.jpba.2005.01.031 PMID: 15925241 10. Wang, Z.; Tang, Y.; Hu, H.; Xing, L.; Zhang, G.; Gao, R.; J. Lumin. 2014, 145, 818. DOI: http://dx.doi.org/10.1016/j.jlumin.2013.07.049 11. Guo, X.; Deng, L.; Wang, J.; RSC Adv. 2013, 3, 401. DOI: http://dx.doi.org/10.1039/C2RA21615A 12. Kavanoz, M.; Pekmez, N. Ö.; J. Solid State Electrochem. 2012, 16, 1175. DOI: http://dx.doi.org/10.1007/s10008-011-1505-6 13. Upan, J.; Reanpang, P.; Chailapakul, O.; Jakmunee, J; Talanta 2016, 146, 766. DOI: http://dx.doi.org/10.1016/j.talanta.2015.06.026 PMID: 26695328 14. He, J.; Qiu, R.; Li, W.; Xing, S.; Song, Z.; Li, Q.; Zhang, S.; Anal. Methods 2014, 6, 6494. DOI: http://dx.doi.org/10.1039/C4AY00575A 15. Lavorante, A. F.; Feres, M. A.; Reis, B. F.; Spectrosc. Lett. 2006, 39, 631. DOI: http://dx.doi.org/10.1080/00387010600867677 16. Santos, F. G.; Pereira, A. C.; Cruz, S. M.; Bizzi, C. A.; Flores, E. M. M.; Reis, B. F.; Anal. Methods 2015, 7, 4769. DOI: http://dx.doi.org/10.1039/C5AY00565E 17. Armenta, S.; Garrigues, S.; de la Guardia, M.; TrAC, Trends Anal. Chem. 2008, 27, 497. DOI: http://dx.doi.org/10.1016/j.trac.2008.05.003 18. Melchert, W. R.; Reis, B. F.; Rocha, F. R. P.; Anal. Chim. Acta 2012, 714, 8. DOI: http://dx.doi.org/10.1016/j.aca.2011.11.044 PMID: 22244133 19. Gine, M. F.; Zagatto, E. A. G.; Bergamin Filho, H.; Analyst 1979, 104, 371. DOI: http://dx.doi.org/10.1039/an9790400371 20. Ruzicka, J.; Hansen, E. H.; Anal. Chim. Acta 1980, 114, 19. DOI: http://dx.doi.org/10.1016/S0003-2670(01)84277-X 21. Borges, S. S.; Reis, B. F.; Anal. Chim. Acta 2007, 600, 66. DOI: http://dx.doi.org/10.1016/j.aca.2006.11.050 22. Corominas, B. G.; Icardo, M. C.; Zamora, L. L.; Mateo, J. V. G.; Calatayud, J. M.; Talanta 2004, 64, 618. DOI: http://dx.doi.org/10.1016/j.talanta.2004.03.031 23. Zhao, L.; Lv. B.; Yuan, H.; Zhou, Z.; Xiao, D.; Sensors 2007, 7, 578. DOI: http://dx.doi.org/10.3390/s7040578 24. Pistonesi, M. F.; Di Nezio, M. S.; Centurión, M. E.; Lista, A. G.; Fragoso, W. D.; Pontes, M. J. C.; Araújo, M. C. U.; Band, B. S. F.; Talanta 2010, 83, 320. DOI: http://dx.doi.org/10.1016/j.talanta.2010.09.027 PMID: 21111140 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access