Artigo
|
|
| Síntese e caracterização de novos organometálicos de estanho (IV) com ligantes ditiocarbimatos e sua ação acceleradora na vulcanização de borracha nitrílica Syntheses and characterization of novel organometallic tin (IV) complexes with dithiocarbimates and their action as accelerators in the nitrile rubber vulcanization |
|
Fernanda C. BottegaI; Marcelo R. L. OliveiraI,*; Vanessa Pio SérvuloI; Leila L. Y. VisconteII: José D. ArdissonIII; Mayura M. M. RubingerI
IDepartamento de Química, Universidade Federal de Viçosa, 36570-000 Viçosa - MG, Brasil Recebido em 08/12/2015 *e-mail: marcelor@ufv.br This paper describes the synthesis of four new organotin compounds of general formula: (Ph4P)[Sn(Cy)3(RSO2N=CS2)] [Ph4P = tetraphenylphosphonium cation, Cy = cyclohexyl, R = C6H5 (1), 4-ClC6H4 (2), 4-BrC6H4 (3) and 4-IC6H4 (4)]. They were obtained by the reaction between four different potassium N-R-sulfonyldithiocarbimate salts and tricyclohexyltin chloride in methanol, and were isolated as tetraphenylphosphonium salts. The elemental analyses of C, H, N and the data of high-resolution mass spectrometry were consistent with the proposed formulae. The 119Sn NMR spectra and 119Sn Mössbauer spectroscopic data were consistent with the presence of tetracoordinated tin(IV) species in solution and in the solid state. The electrolytic molar conductance and the integration curves in the 1H NMR spectra are in accord with the 1:1 proportion between the tetraphenylphosphonium cations and the complex anions. The activity of the new compounds in the vulcanization of nitrile rubber was evaluated and the results were compared to those achieved with the commercial accelerators: N-tert-butyl-2-benzothiazolesulfenamide (TBBS), tetramethylthiuram disulfide (TMTD) and zinc diethyldithiocarbamate (ZEDC). INTRODUÇAO A borracha nitrílica (NBR) é um copolímero sintético de acrilonitrila e butadieno (Figura 1). Apresenta maior polaridade e resistência a óleos e solventes que a borracha natural (NR), tem baixa permeabilidade a gases e se degrada em temperaturas mais altas. É disponível comercialmente com vários teores de acrilonitrila. É muito usada em produtos como selos de óleo e mangueiras de combustível.1,2
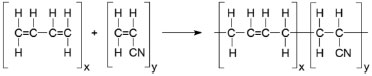 Figura 1. Esquema de reaçao entre acrilonitrila e 1,4-butadieno para a formaçao da borracha nitrílica
Aceleradores de vulcanizaçao sao aditivos importantes às composiçoes de borracha, pois aumentam a velocidade de vulcanizaçao ou diminuem a temperatura necessária para atingir um índice satisfatório de cura, gerando vulcanizados com propriedades adequadas à aplicaçao desejada.3 Complexos de zinco com ânions ditiocarbamatos (Figura 2a), por exemplo: bis(dietilditiocarbamato)zinco (ZEDC), sao aceleradores de vulcanizaçao eficientes, tanto para a vulcanizaçao da NBR quanto da NR.4,5 Sao conhecidos como ultra-aceleradores por apresentarem rápida taxa de vulcanizaçao. Mas apresentam também alguns problemas de "scorch" (vulcanizaçao prematura durante a composiçao).3
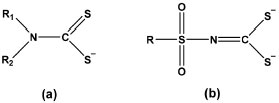 Figura 2. Estruturas genéricas dos ânions ditiocarbamato (a) e sulfonilditiocarbimato (b)
Complexos metálicos com ânions ditiocarbimatos (Figura 2b) sao conhecidos desde 1965.6 A primeira constataçao de que essa classe de compostos também apresentava atividade no processo de vulcanizaçao da NR foi reportada em 2007, para o sal (Bu4N)2[Zn(4-CH3C6H4SO2N=CS2)2] (Bu4N = tetrabutilamônio).7 Mais recentemente, observou-se que este composto é também eficiente na vulcanizaçao de NBR.4,5 Nao foram ainda estabelecidos os mecanismos que envolvem a vulcanizaçao da borracha por essa classe de compostos. Possívelmente, como no caso dos ditiocarbamatos, na presença de S8 ocorre a formaçao de ditiocarbimatos ricos em enxofre com posterior transferência desses átomos para a formaçao das ligaçoes cruzadas.8,9 Essa possibilidade é corroborada pelo fato de já terem sido isolados complexos de ditiocarbimatos ricos em enxofre.10 Foi verificado, ainda, que vários complexos de metais com ditiocarbimatos derivados de sulfonamidas de fórmulas gerais: (Ph4P)2[Zn(RSO2N=CS2)2] e (Ph4P)2[Ni(RSO2N=CS2)2] [Onde Ph4P = tetrafenilfosfônio, R = CH3, CH3CH2, CH3(CH2)3 e CH3(CH2)7] também têm açao aceleradora na vulcanizaçao da NR.11,12 Os metais e os grupos ligados ao ditiocarbimato interferem em vários parâmetros, como o tempo de cura e as propriedades mecânicas do material vulcanizado.11,12 Isso pode estar relacionado à inércia ou à labilidade dos complexos (os complexos de níquel sao aceleradores mais lentos que os de zinco), e também à solubilidade dessas substâncias na mistura a ser vulcanizada, que depende dos grupos substituintes R e dos contraíons utilizados, uma vez que, por serem espécies dianiônicas os ditiocarbimatos geralmente produzem compostos de coordenaçao iônicos. Como complexos de sulfonilditiocarbimatos de zinco e de níquel mostraram um grande potencial de vulcanizaçao, foi decidido estender o estudo a outros metais, no caso deste trabalho, a organometálicos de estanho. Ressalte-se que compostos organometálicos de estanho (IV) sao conhecidos catalisadores para a formaçao de compostos poliméricos, em especial de poliuretanos.13 Para esses estudos, foram sintetizados e caracterizados por diversas técnicas analíticas, quatro novos sais de fórmula geral: (Ph4P)[Sn(C6H11)3(RSO2N=CS2)] [Ph4P = cátion tetrafenilfosfônio, R = C6H5 (1), 4-ClC6H4 (2), 4-BrC6H4 (3), e 4-IC6H4 (4)]. Além disso, escolheu-se trabalhar com borracha nitrílica e comparar a atividade aceleradora de vulcanizaçao dos novos compostos com a dos aceleradores comerciais N-tert-butil-2-benzotiazolsulfenamida (TBBS), dissulfeto de tetrametiltiuram (TMTD) e dietilditiocarbamato de zinco (ZEDC).
PARTE EXPERIMENTAL Materiais e métodos Química Os solventes, dissulfeto de carbono, soluçao aquosa de amônia concentrada, hidróxido de potássio e metanol foram adquiridos de Vetec. Cloreto de 4-iodobenzenossulfonila, benzenossulfonamida, 4-cloro-benzenossulfonamida, 4-bromo- benzenossulfonamida, cloreto de triciclo-hexilestanho(IV) e cloreto de tetrafenilfosfônio foram adquiridos da Aldrich. A 4-iodobenzenossulfonamida foi sintetizada a partir do cloreto de 4-iodobenzenossulfonila em soluçao de amônia concentrada, sob refluxo, de acordo com procedimentos descritos na literatura para compostos semelhantes.14 Os sais N-R-sulfonilditiocarbimatos de potássio di-hidratados foram preparados em dimetilformamida utilizando as sulfonamidas apropriadas, dissulfeto de carbono e hidróxido de potássio, de acordo com metodologia descrita para a síntese de compostos semelhantes. A obtençao desses compostos foi confirmada pela comparaçao dos espectros vibracionais com os dados já publicados.15,16 As temperaturas de fusao foram medidas, sem correçao, com aparelho Microquímica MQAPF-302. As massas exatas foram determinadas a partir da soluçao dos compostos em acetonitrila utilizando um espectrômetro de massas de alta resoluçao micrOTOF Q-II Bruker e as análises elementares de C, H e N foram feitas usando TruSpec Micro da Leco. As condutividades molares (ɅM) foram obtidas em soluçao de DMF a 25°C com aparelho Jenway 4010 Conductivity Meter. Os espectros no infravermelho foram registrados em pastilhas de CsI em espectrofotômetro Perkin Elmer FT-IR 1000. Os espectros de RMN de 1H (300 MHz) e de 13C (75 MHz) foram obtidos em espectrômetro Varian (Mercury 300) em CDCl3 com TMS como padrao interno e os espectros de RMN de 119Sn (75 MHz) em aparelho Bruker Avance DPX 200, em CDCl3. Os dados de espectroscopia Mössbauer foram coletados à temperatura de 78 K, em um espectrômetro de aceleraçao constante convencional com uma fonte de CaSnO3 mantido à temperatura ambiente. Vulcanizaçao da borracha Os testes de atividade aceleradora da vulcanizaçao da NBR seguiram procedimentos descritos pela ASTM (American Society for Testing and Materials). As composiçoes de borracha nitrílica foram preparadas utilizando-se um misturador de rolos Lab Tech Engineering, modelo LRMR-S, segundo as especificaçoes estabelecidas para borracha nitrílica na norma ASTM D3187.17 A NBR utilizada foi a N726 com teor em acrilonitrila (ACN) entre 27-29%. A temperatura dos rolos foi de 50°C +/- 5°C com razao de fricçao de 1:1,25 e a velocidade de 24 rpm para o rolo dianteiro e 30 rpm para o rolo traseiro. A formulaçao utilizada foi (em phr): Borracha nitrílica (NBR) (100); óxido de zinco (3,0); ácido esteárico (1,0); enxofre (1,5). Para os aceleradores, a quantidade utilizada foi de 0,6 mmol. O tempo total médio de confecçao das misturas foi de 13 minutos. Os dados reométricos foram obtidos 24 horas depois das misturas terem sido preparadas. Foi utilizado um Analisador de Processamento de Borracha (RPA 2000), operando com arco de 1°, segundo a norma ASTM D 2084,18 com tempo de corrida de 1 hora. A partir das curvas reométricas foram determinados os seguintes parâmetros reométricos: torque mínimo (ML), torque máximo (MH), tempo de pré-cura ou scorch (ts1), tempo ótimo de vulcanizaçao (t90) e o índice de velocidade de cura (CRI), calculado segunda a norma ASTM D 2084-95.18 As propriedades mecânicas realizadas foram resistência à traçao (DIN 53504)19 e ao rasgamento (ASTM D 624-00).20 Os corpos de prova utilizados nos ensaios foram obtidos a partir de placas vulcanizadas em prensa hidráulica, modelo MA 098, com pressao de 8 t, a 150 °C. Os ensaios de resistência à traçao e ao rasgamento foram realizados em máquina universal de ensaios da marca EMIC, modelo DL 3000, com célula de carga de 100N, de acordo com as normas correspondentes. Procedimento geral para a síntese dos compostos As sínteses dos quatro compostos foram realizadas conforme representado na Figura 3. Cloreto de triciclo-hexilestanho(IV) (1,0 mmol) foi adicionado a uma suspensao do ditiocarbimato de potássio apropriado (1,0 mmol) em metanol (10 mL). A mistura foi agitada durante 1,5 h à temperatura ambiente e, em seguida, filtrada. Cloreto de tetrafenilfosfônio, solubilizado em água (10 mL), foi adicionado à soluçao anteriormente obtida. A mistura formada ficou sob agitaçao durante 15 minutos, em seguida foi filtrada, lavada com água destilada e secada sob pressao reduzida. Os rendimentos foram entre 70-75% em relaçao ao cloreto de triciclo-hexilestanho(IV).
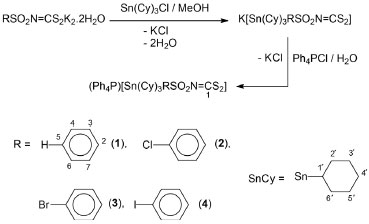 Figura 3. Esquema de síntese e numeraçao para RMN
Tricicloexil(N-fenilsulfonilditiocarbimato)estanato(IV) de tetrafenilfosfônio (1). T.F (ºC): 133,0-133,9. Condutividade molar (Ω-1 cm2 mol-1) 40. IV (cm-1): 1340 ʋ(C=N); 1268 ʋass(SO2); 1140 ʋsim(SO2); 944 ʋ(CS2); 366 ʋ(Sn-S). 1H RMN (300 MHz, CDCl3) (δ): 7,96-7,27 (m, 25H, H3, H4, H5, H6 e H7 + sinais do cátion tetrafenilfosfônio, e sobreposto ao sinal de CDCl3); 1,91-0,95 (m, 33H, H1', H2', H3', H4', H5' e H6'). 13C RMN (75 MHz, CDCl3) (δ): 205,91 (C1); 143,78 (C2); 129,99 (C5); 128,20 (C4 e C6); 127,20 (C3 e C7); 32,09 (C1'); 31,93 (2J13C-119Sn = 15,75 Hz C2' e C6'); 29,30 (3J13C-119Sn = 63,75 Hz, C3' e C5'); 27,17 (C4'). 119Sn{1H} (CDCl3, ppm) (δ): -30,70; 20,07. 119Sn Mössbauer: δ = 1,49, Δ = 1,75. Análise elementar calculada para C49H58NO2PS3Sn (%): C: 62,68; H: 6,18; N: 1,49; Encontrado: C: 63,29; H: 6,52; N: 1,50. EM (modo aniônico) m/z: Calculado para C25H38NO2S3Sn-: 600,1086; Encontrado: 600,1026. Triciclo-hexil(N-4-clorofenilsulfonilditiocarbimato)estanato(IV) de tetrafenilfosfônio (2). T.F (ºC): 125,9-127,0. Condutividade molar (Ω-1 cm2 mol-1) 50. IV (cm-1): 1318 ʋ(C=N); 1264 ʋass(SO2); 1136 ʋsim(SO2); 966 ʋ(CS2). 1H RMN (300 MHz, CDCl3) (δ): 7,89-7,61 (m, 22H, H3 e H7 + sinais do cátion tetrafenilfosfônio); 7,26-7,17 (m, 2H, H4 e H6, sobreposto ao sinal de CDCl3); 1,93-1,21 (m, 33H, H1', H2', H3', H4', H5' e H6'). 13C RMN (75 MHz, CDCl3) (δ): 206,83 (C1); 142,24 (C2); 135,88 (C5); 129,95 (C4 e C6); 127,23 (C3 e C7); 32,10 (2J13C-119Sn = 15,75 Hz, C2' e C6'); 32,05 (1J13C-119Sn = 330,75 Hz, C1'); 29,31 (3J13C-119Sn = 64,50 Hz, C3' e C5'); 27,17 (C4'). 119Sn{1H} (CDCl3, ppm) (δ): -29,91; 19,72. 119Sn Mössbauer: δ = 1,48, Δ = 1,75. Análise elementar calculada para C49H57ClNO2PS3Sn (%): C: 60,47; H: 5,85; N: 1,44; Encontrado: C: 59,42; H: 6,04; N: 1,38. EM (modo aniônico) m/z: Calculado para C25H37ClNO2S3Sn-: 634,0696; Encontrado: 634,0655. Triciclo-hexil(N-4-bromofenilsulfonilditiocarbimato)estanato(IV) de tetrafenilfosfônio (3). T.F (ºC): 83,4-85,1. Condutividade molar (Ω-1 cm2 mol-1) 41. IV (cm-1): 3052 ʋ(C-H); 1322 ʋ(C=N); 1268 ʋass(SO2); 1136 ʋsim(SO2); 962 ʋ(CS2). 1H RMN (300 MHz, CDCl3) (δ): 7,90-7,75 (m, 14H, H3 e H7 + sinais do cátion tetrafenilfosfônio); 7,35 (d, J = 8,1 Hz, 2H, H4 e H6); 1,96-1,21 (m, 33H, H1', H2', H3', H4', H5' e H6'). 13C RMN (75 MHz, CDCl3) (δ): 206,90 (C1); 142,73 (C2); 130,20 (C4 e C6); 130,16 (C3 e C7); 124,47 (C5); 32,09 (1J13C-119Sn = 330,00 Hz, C1'; 2J13C-119Sn = 15,75 Hz, C2' e C6'); 29,30 (3J13C-119Sn = 63,00 Hz, C3' e C5'); 27,16 (C4'). 119Sn{1H} (CDCl3, ppm) (δ): -28,62; 19,80. 119Sn Mössbauer: δ = 1,50, Δ = 1,95. Análise elementar calculada para C49H57BrNO2PS3Sn (%): C: 57,83; H: 5,65; N: 1,38; Encontrado: C: 56,34; H: 5,61; N: 1,31. EM (modo aniônico) m/z: Calculado para C25H37BrNO2S3Sn-: 678,0191; Encontrado: 678,0158. Triciclo-hexil(N-4-iodofenilsulfonilditiocarbimato)estanato(IV) de tetrafenilfosfônio (4). T.F (ºC): 91,6-93,4. Condutividade molar (Ω-1 cm2 mol-1) 42. IV (cm-1): 3052 ʋ(C-H); 1320 ʋ(C=N); 1266 ʋass(SO2); 1142 ʋsim(SO2); 960 ʋ(CS2); 342 ʋ(Sn-S). 1H RMN (300 MHz, CDCl3) (δ): 7,95-7,50 (m, 24H, H3, H4, H6 e H7 + sinais do cátion tetrafenilfosfônio); 1,85-1,21 (m, 33H, H1', H2', H3', H4', H5' e H6'). 13C RMN (75 MHz, CDCl3) (δ): 206,91 (C1); 143,39 (C2); 136,18 (C4 e C6); 130,16 (C3 e C7); 96,90 (C5); 32,08 (1J13C-119Sn = 331,5 Hz, C1'; 2J13C-119Sn = 15,75 Hz, C2' e C6'); 29,30 (3J13C-119Sn = 62,25 Hz, C3' e C5'); 27,15 (C4'). 119Sn{1H} (CDCl3, ppm) (δ): -28,46; 19,91. 119Sn Mössbauer: δ = 1,50, Δ = 1,92. Análise elementar calculada para C49H57INO2PS3Sn (%): C: 55,27; H: 5,40; N: 1,31; Encontrado: C: 55,28; H: 5,75; N: 1,25. EM (modo aniônico) m/z: Calculado para C25H37INO2S3Sn-: 726,0053; Encontrado: 726,0040. Todos os espectros vibracionais e de RMN apresentaram as bandas e sinais esperados para o cátion tetrafenilfosfônio, que foram omitidos nas listas de dados anteriormente apresentados para maior clareza. As curvas de integraçao nos espectros de RMN de 1H foram consistentes com uma proporçao 1:1 cátion tetrafenilfosfônio:complexo aniônico.
RESULTADOS E DISCUSSAO Química Os quatro compostos sintetizados sao sólidos brancos, insolúveis em água, hexano e éter dietílico; e solúveis na maioria dos solventes orgânicos. As análises elementares de C, H e N, e as análises por espectrometria de massas de alta resoluçao no modo negativo, estao consistentes com as fórmulas propostas. As condutividades molares em soluçao de dimetilformamida foram consistentes com a proporçao 1:1 entre cátions e ânions.21 Nos espectros no infravermelho dos ligantes livres, a banda correspondente à ligaçao CN encontra-se na faixa de 1280 a 1244 cm-1.15,16 Nos espectros dos complexos sintetizados ocorreu um deslocamento dessa banda para maiores números de onda (1360-1318 cm-1). Por outro lado, valores menores de números de onda foram encontrados para as bandas de estiramento da ligaçao CS2 (966-938 cm-1) em relaçao aos ligantes livres (979-966 cm-1).15,16 Esses dados confirmam a complexaçao. Entretanto, nao sao conclusivos sobre o modo de coordenaçao, que poderia ser por dois átomos: SS e SN ou apenas por um átomo de enxofre (Figura 4). A banda de estiramento da ligaçao Sn-S é geralmente observada na regiao de 400-300 cm-1.22-24 Essa observaçao foi possível no caso dos compostos 1 e 4, mas foi dificultada para 2 e 3 devido à presença de muitas bandas na regiao. Pelo mesmo motivo, a banda na regiao de 470 e 400 cm-1 correspondente a uma possível ligaçao Sn-N e bandas de estiramento assimétrico (610-500 cm-1) e simétrico (530-450 cm-1) da ligaçao Sn-C, nao puderam ser atribuídas. 23,24
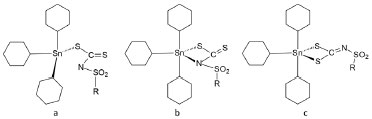 Figura 4. Possíveis modos de coordenaçao do grupo ditiocarbimato
Entretanto, os dados obtidos para a banda de estiramento CN estao próximos aos valores observados em espectros de complexos do tipo [Sn(Bu)2L2]2- (Onde Bu = butil e L = ligantes N-R-sulfonilditiocarbimatos). Neste caso, foi demonstrado que os ligantes L se encontravam ligados ao átomo de estanho por um átomo de enxofre do grupo ditiocarbimato, com uma interaçao adicional mais fraca N-Sn.22 Os espectros de RMN de 1H apresentaram dois conjuntos de sinais, um em campo baixo atribuído aos átomos de hidrogênio do cátion tetrafenilfosfônio e do ligante ditiocarbimato, e outro em campo alto, correspondente aos átomos de hidrogênio do grupo ciclo-hexila. As curvas de integraçao estao consistentes com a proporçao 1:1 cátion tetrafenilfosfônio:ânion complexo. Nos espectros de RMN de 13C, o sinal do átomo de carbono do grupo ditiocarbimato (C=N) está deslocado para campo mais alto (ca. δ 205), quando comparado ao mesmo sinal no ligante livre (ca. δ 220).15,16 Em todos os casos foram observados os demais sinais do ligante ditiocarbimato e os quatro dupletos esperados para o cátion tetrafenilfosfônio. Os sinais dos átomos de carbono do grupo ciclo-hexila aparecem na regiao de δ 30 conforme esperado para esse grupo.25 O valores das constantes de acoplamento 1J (13C-119Sn) em torno de 330 Hz, 2J (13C-119Sn) em torno de 15 Hz e 3J(13C-119Sn) em torno de 65 Hz, sao típicos de derivados de triciclo-hexilestanho(IV) tetracoordenados.25 Adicionalmente, a aplicaçao da equaçao estabelecida por A. Holeček, relacionando o ângulo C-Sn-C com o valor de 1J (13C-119Sn) aos compostos aqui estudados resulta num valor de θ aproximadamente igual a 107,8º, o que reforça a proposta de geometria aproximadamente tetraédrica.26 A Figura 5 apresenta os espectros de RMN de 1H e 13C para o composto 2. Os espectros dos demais compostos podem ser encontrados no material suplementar.
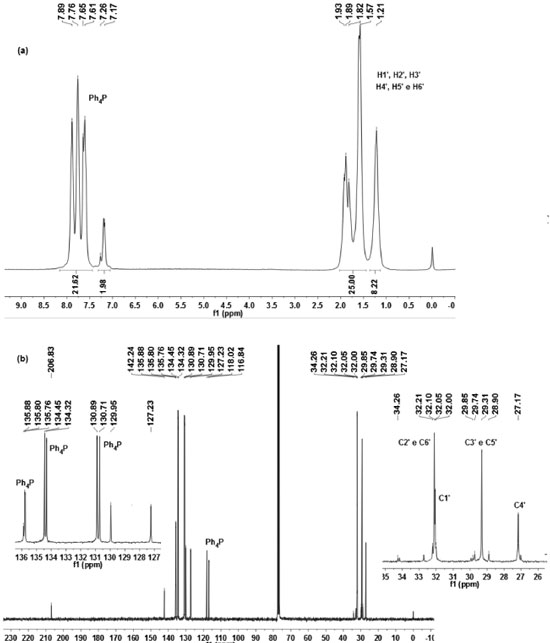 Figura 5. Espectros de RMN de 1H (a) e 13C (b) do composto 2 (esquema de numeraçao definido na figura 3)
Os deslocamentos químicos dos sinais de RMN de 119Sn estao relacionados com o número de coordenaçao do átomo de estanho. Sinais na faixa de δ 200 a -60 indicam tetracoordenaçao.25 Os deslocamentos químicos obtidos nos espectros de RMN de 119Sn dos compostos 1-4 estao na faixa de δ -31 a -28 sugerindo uma geometria tetraédrica para os compostos em soluçao. Além deste sinal principal, todos os espectros apresentam outro de menor intensidade em torno de δ 20, provavelmente devido a confórmeros com o estanho em equatorial/axial no anel ciclohexano. Os parâmetros desdobramento quadrupolar (Δ) e desvio isomérico (δ) obtidos por espectroscopia Mössbauer têm sido utilizados na proposiçao de estruturas de compostos no estado sólido. Por formar polímeros em baixas temperaturas, o cloreto de triciclo-hexilestanho é pentacoordenado, apresentando valor de Δ igual a 3,49 mms-1. Valores de Δ para compostos tetracoordenados sao normalmente menores do que 3 mms-1.27,28 A razao Δ/δ, representada por (ρ), também pode ser usada para se estimar o número de coordenaçao no átomo de estanho.29 Valores de ρ inferiores a 1,8 mms-1 sao indicativos de compostos de estanho(IV) tetracoordenados, enquanto valores maiores que 2,1 mms-1 sao atribuídos a complexos de estanho com mais de quatro coordenaçoes. Os dados apresentados na Tabela 1 sugerem, entao, que a geometria em torno do estanho nos compostos 1-4 é tetraédrica, como já foi observado em compostos do tipo triciclo-hexilestanho(IV) com outros ligantes.29 Os valores de desvio isomérico (δ) observados sao típicos para Sn(IV). A presença de apenas um centro metálico é indicada pela observaçao de apenas um dupleto nos espectros de 1-4 e também pelos valores de área iguais a 100%.24
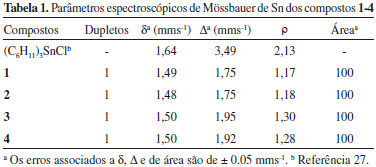
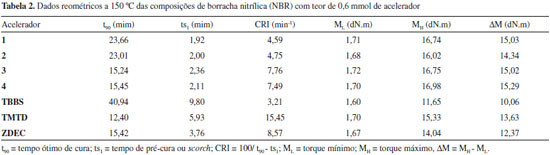
Portanto, os dados de análises elementares e os resultados das técnicas espectroscópicas indicam que os complexos aniônicos, isolados na forma de sais de tetrafenilfosfônio, apresentam geometria tetraédrica em torno do átomo de estanho (Figura 4a), tanto em soluçao, quanto no estado sólido. Vulcanizaçao A Tabela 2 apresenta os valores das propriedades reométricas obtidos a partir dos experimentos de vulcanizaçao com os compostos 1-4 e com os aceleradores comerciais, N-tert-butil-2-benzotiazolsulfenamida (TBBS), dissulfeto de tetrametiltiuram (TMTD) e dietilditiocarbamato de zinco (ZDEC).
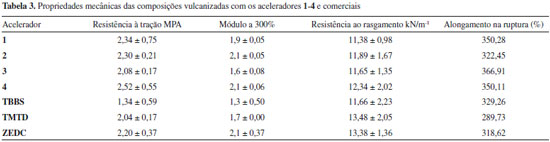
TMTD e ZDEC sao classificados como aceleradores super-rápidos e, portanto, vulcanizam em menor tempo que o TBBS. Observa-se que, os quatro complexos de estanho avaliados, forneceram valores de t90 (tempo necessário à formaçao de 90% das ligaçoes cruzadas) intermediários entre aqueles obtidos pelos aceleradores comerciais TMTD (12,4 mim) e TBBS (40,9 min). Os compostos 3 e 4, contendo halogênios mais volumosos, forneceram valores de t90 em torno de 15 minutos, próximos ao encontrado para o ultra-acelerador ZDEC. Embora tenham sido mais lentos que 3 e 4, os compostos 1 e 2 foram mais eficientes que o acelerador comercial TBBS. Os melhores resultados de t90 apresentados por 3 e 4 podem estar relacionados à solubilidade desses compostos na matriz polimérica, favorecida por grupos substituintes maiores. Os derivados organoestânicos apresentaram tempos de scorch ou pré-cura (ts1), em torno de 2 minutos, menores que os valores apresentados pelos aceleradores TBBS e TMTD, porém próximos ao observado para o ZEDC (3,76 min). Os valores de CRI (índice de velocidade de cura) apresentados pelos compostos 1-4 foram intermediários entre aqueles observados para o TBBS (3,2 min-1) e para o TMTD (15,5 min-1), sendo os resultados de 3 e 4 bem próximos ao valor para o ZDEC. Portanto, esse parâmetro, que leva em conta tanto o t90 quanto o ts1, indicou que os novos compostos apresentam velocidade de cura adequada para aplicaçoes industriais. O torque mínimo (ML) é observado logo antes do início da vulcanizaçao, quando a mistura apresenta a menor viscosidade. Quanto maior o valor de ML, mais difícil é o processamento da composiçao. Os resultados encontrados para os complexos 1-4 estao próximos aos dos três acelerados comerciais testados, indicando condiçoes favoráveis de processabilidade das composiçoes de borracha com os complexos 1-4. O torque máximo (MH) está relacionado à densidade das ligaçoes cruzadas e do grau de reticulaçao no tempo ótimo de vulcanizaçao. Observa-se na Tabela 2 que os novos compostos apresentaram valores de MH maiores que os dos aceleradores comerciais indicando maior eficiência em termos de formaçao de ligaçoes cruzadas na vulcanizaçao da NBR. Os valores de ΔM, diferença entre os torques máximo e mínimo, dao suporte a essa conclusao, pois representam o aumento do torque resultante das ligaçoes cruzadas formadas durante a vulcanizaçao. A Tabela 3 mostra os dados das propriedades mecânicas das composiçoes de NBR vulcanizadas na presença dos compostos 1-4 e dos aceleradores comerciais: Resistência à traçao e o módulo a 300% (resistência à traçao quando a borracha alcança um comprimento três vezes maior que seu tamanho original), resistência ao rasgamento e alongamento na ruptura (quanto o corpo de prova se alongou no momento do rasgamento). Considerando os desvios das medidas, nao foi possível diferenciar os resultados dos sete aceleradores testados e, portanto, os novos aceleradores propiciam a formaçao de borrachas de qualidades semelhantes àquelas fornecidas por aceleradores comerciais.
Um dos fatores que podem afetar a resistência à traçao é o grau de ligaçoes cruzadas.25 Assim, em relaçao à resistência à traçao, é possível observar a seguinte tendência: Como os valores de ΔM (Tabela 2) indicaram que os novos aceleradores promovem uma maior densidade de ligaçoes cruzadas e, considerando os valores médios das medidas de resistência à traçao e o módulo a 300% (Tabela 3), os vulcanizados com os compostos 1-4 sao mais semelhantes aos obtidos com o TMTD e o ZEDC, sendo mais resistentes à traçao que aqueles obtidos com o TBBS. Os vulcanizados com os compostos 1-4 apresentam resistência ao rasgamento semelhante àquela obtida com o TBBS, TMTD e ZEDC. O alongamento na ruptura também apresentou valores semelhantes ou ligeiramente superiores àqueles obtidos com os aceleradores comerciais.
CONCLUSAO Quatro novos complexos (1-4) contendo ânions triciclo-hexil(N-R-sulfonilditiocarbimato)estanato(IV) foram sintetizados, isolados como sais de tetrafenilfosfônio e caracterizados por espectroscopias no IV, de RMN de 1H, 13C e 119Sn, Mossbauer de 119Sn, análise elementar de C, H e N, condutividade molar e por espectrometria de massas de alta resoluçao. Os espectros de RMN de 1H e de 13C apresentaram os sinais esperados para cátions e ânions e, juntamente com os dados de RMN de 119Sn e da espectroscopia Mössbauer, indicaram a tetracoordenaçao em torno do átomo de estanho. A condutividade molar e as curvas de integraçao dos espectros de RMN de 1H foram consistentes com a proporçao 1:1 entre cátions e ânions. A vulcanizaçao das misturas de NBR com os compostos 1-4 apresentou velocidades de cura intermediárias entre aquelas obtidas com os aceleradores comerciais TMTD e TBBS, sendo que os compostos 3 e 4 foram tao rápidos quanto o ultra-acelerador ZEDC. Apesar do baixo tempo de scorch (ts1) na vulcanizaçao com os novos aceleradores, resultados de ML muitos próximos aos dos aceleradores comerciais foram observados para 1-4. Assim, os compostos 1-4 apresentam processabilidade adequada ao uso industrial. As propriedades mecânicas dos vulcanizados obtidos como os compostos 1-4 sao comparáveis aos resultados obtidos com os aceleradores comerciais, apresentando os novos aceleradores maior eficiência na formaçao de ligaçoes cruzadas (considerando ΔM), quando comparados aos aceleradores de referência.
MATERIAL SUPLEMENTAR O material suplementar inclui espectros no infravermelho, de RMN de 1H, 13C e 119Sn e Mössbauer de 119Sn. Podem ser obtidos na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Este trabalho foi financiado pela CAPES, CNPq e FAPEMIG (Brasil).
REFERENCIAS 1. Morton, M. Rubber Technology, Van Nostrand Reinhold: New York, 1987. 2. Hofmann, W. Rubber Technology Handbook, Hanser Publishers: Cincinnati, 1989. 3. da Costa, H. M.; Visconte, L. L. Y.; Nunes, R. C. R.; Furtado, C. R. G.; Polímeros 2003, 13, 125. DOI: http://dx.doi.org/10.1590/S0104-14282003000200011 4. Oliveira, I. T. D.; Pacheco, E. B. A.; Visconte, L. L. Y.; Rubinger, M. M. M.; Oliveira, M. R. L.; Polímeros 2010, 20, 366. DOI: http://dx.doi.org/10.1590/S0104-14282010005000059 5. Oliveira, I. T. D.; Cunha, L. M. G.; Visconte, L. L. Y.; Oliveira, M. R. L.; Rubinger, M. M. M.; Chem. Chem. Technol. 2010, 4, 237. 6. Fackler, J. P.; Coucouvanis, D.; Chem. Commun. 1965, 21, 556. 7. Mariano, R. M.; Oliveira, M. R. L.; Rubinger, M. M. M.; Visconte, L. L. Y.; Eur. Polym. J. 2007, 43, 4706. DOI: http://dx.doi.org/10.1016/j.eurpolymj.2007.08.013 8. Nieuwenhuizen, P. J.; Reedijk, J.; van Duin, M.; McGill, W. J; Rubber Chem. Technol. 1997, 70, 368. DOI: http://dx.doi.org/10.5254/1.3538436 9. Nieuwenhuizen, P. J.; Ehlers, A. W.; Hofstraat, J. H.; Janse, S. R.; Nielen, M. W. F.; Reedijk, J.; Baerends, E. J.; Chem. Eur. J. 1998, 4, 1816. DOI: http://dx.doi.org/10.1002/(SICI)1521-3765(19980904)4:9<1816::AID-CHEM1816>3.0.CO;2-Z 10. Tavares, E. C.; Oliveira, M. R. L.; Janczak, J.; Vieira, C. G.; Alves, L. C.; Castro, R. A.; Vieira, L. M. M.; Lindemann, R. H.; Perpétuo, G. J.; Visconte, L. L. Y.; Rubinger, M. M. M.; Polyhedron 2012, 31, 494. DOI: http://dx.doi.org/10.1016/j.poly.2011.10.004 11. Cunha, L. M. G.; Rubinger, M. M. M.; Sabino, J. R.; Visconte, L. L. Y.; Oliveira, M. R. L.; Polyhedron 2010, 29, 2278. DOI: http://dx.doi.org/10.1016/j.poly.2010.04.026 12. Cunha, L. M. G.; Rubinger, M. M. M.; Oliveira, M. R. L.; Tavares, E. C.; Sabino, J. R.; Pacheco, E. B. A.; Visconte, L. L. Y.; Inorg. Chim. Acta 2012, 383, 194. DOI: http://dx.doi.org/10.1016/j.ica.2011.11.002 13. Devendraa, R.; Edmonds, N. R.; Söhnel, T.; J. Mol. Catal. A: Chem. 2013, 366, 126. DOI: http://dx.doi.org/10.1016/j.molcata.2012.09.015 14. Vogel, A. I. A Textbook of Practical Organic Chemistry Including Qualitative Organic Analysis, 3th Ed., Longmans: London, 1956. 15. Franca, E. F.; Oliveira, M. R. L.; Guilardi, S.; Andrade, R. P.; Hernandez, L.; Amim, J.; Ellena, J.; De Bellis, V. M.; Rubinger, M. M. M.; Polyhedron 2006, 25, 2119. DOI: http://dx.doi.org/10.1016/j.poly.2005.11.035 16. Oliveira, M. R. L.; De Bellis, V. M.; Trans. Met. Chem. 1999, 24, 127. DOI: http://dx.doi.org/10.1023/A:1006945923839 17. ASTM D 3187-00, American Society for Testing and Materials, "Standard Test Methods for Rubber - Evaluation of NBR (Acrylonitrile-Butadiene Rubber)", vol. 9.01, Philadelphia, 2000. 18. ASTM D 2084-81, American Society for Testing and Materials, "Vulcanization characteristics using oscillation disk cure meter", vol.9.01, Philadelphia, 1981. 19. DIN 53504-2009, Deutsches Institut für Normung, "Testing of rubber - determination of tensile strength at break, tensile stress at yield, elongation at break, and stress values in a tensile test. 20. ASTM D 624-86, American Society for Testing and Materials, "Standard test method for rubber property - Tear resistance", vol.9.01, Philadelphia, 1986. 21. Geary, W. J., Coord. Chem. Rev. 1971, 7, 81. DOI: http://dx.doi.org/10.1016/S0010-8545(00)80009-0 22. Dias, L. C.; Rubinger, M. M. M.; Barolli, J. P.; Ardisson, J. D.; Mendes, I. C.; Lima, G. M.; Zambolim, L.; Oliveira, M. R. L.; Polyhedron 2012, 47, 30. DOI: http://dx.doi.org/10.1016/j.poly.2012.08.037 23. Ferreira, I. P.; de Lima, G. M.; Paniago, E. B.; Rocha, W. R.; Takahashi, J. A.; Pinheiro, C. B.; Ardisson, J. D.; Polyhedron 2014, 79, 161. DOI: http://dx.doi.org/10.1016/j.poly.2014.05.001 24. Nath, M.; Sulaxna.; Song, X.; Eng, G.; J. Organomet. Chem 2006, 691, 1649. DOI: http://dx.doi.org/10.1016/j.jorganchem.2005.11.047 25. Xie, Y.; Yu, Y.; Fan, Z., Ma, L.; Mi, N.; Tang, T.; Appl. Organomet. Chem. 2010, 24, 1. 26. Holeček, J.; Lyčka, A; Inorg. Chim. Acta 1986, 118, L15. DOI: http://dx.doi.org/10.1016/S0020-1693(00)86401-4 27. Platt, R. H.; J. Organomet. Chem. 1970, 24, C23. DOI: http://dx.doi.org/10.1016/S0022-328X(00)80255-7 28. Asadi, A.; Eaborn, C.; Hitchcock, P.; Meehan, M. M.; Smith, J. D.; Inorg. Chem. 2003, 42, 4141. DOI: http://dx.doi.org/10.1021/ic026272f PMID: 12817973 29. Duong, Q.; Song, X.; Mitrojorgji, E.; Gordon, S.; Eng, G.; J. Organomet. Chem 2006, 691, 1775. DOI: http://dx.doi.org/10.1016/j.jorganchem.2005.12.005 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access