Revisão
|
|
| Estratégias de síntese na descoberta de fármacos: o emprego da síntese orientada pela diversidade estrutural# Synthetic strategies in drug discovery: employng diversity-oriented synthesis |
|
Diego Pereira Sangi*
Departamento de Química, Instituto de Ciências Exatas, Universidade Federal Fluminense, 27213-145 Volta Redonda - RJ, Brasil Recebido em 06/01/2016 *e-mail: dpsangi@id.uff.br Drug discovery often involves screening synthetic small molecules for their ability to bind to a macromolecular target. Target-Oriented Synthesis of a specific compound or a focused library can be planned combining retrosynthetic analysis and rational drug design. Biologically active molecules also can be identified through the unfocused screening of compound libraries. Diversity-Oriented Synthesis (DOS) emerges as an excellent strategy that leads to a library of structurally complex and diverse small molecules, covering a larger chemical space and increasing the probability of identifying modulators. INTRODUÇAO Antes do desenvolvimento da síntese orgânica, a obtençao de substâncias orgânicas para os seus diversos fins, inclusive terapêuticos, era feita por processos de fermentaçao ou isolamento de fontes naturais. Devido a sua ampla diversidade estrutural e funcional, muitos compostos de origem natural sao usados no tratamento de diversos males e desordens biológicas. Por anos, a maioria dos fármacos disponíveis no mercado eram produtos naturais ou mesmo análogos inspirados neles, alguns obtidos por modificaçao estrutural outros por síntese total, quando a fonte natural nao supria a demanda.1,2 Os produtos naturais bioativos geralmente sao isolados em baixas quantidades, e muitas vezes apresentam alta complexidade estrutural, contendo vários centros estereogênicos. A complexidade destes compostos dificulta muito a sua obtençao através de métodos sintéticos rápidos e a baixa disponibilidade inviabiliza o seu emprego em High-Throughput Screening (HTS). Portanto, a busca por lucros mais rápidos por parte das indústrias farmacêuticas aliada ao grande desenvolvimento dos métodos de síntese orgânica fez com que os produtos naturais deixassem de ser a maior fonte de novos fármacos, sendo substituídos por compostos sintéticos.1 A identificaçao das funçoes biológicas, o isolamento e determinaçao estrutural de muitas macromoléculas e de seus ligantes naturais têm permitido o planejamento racional de moduladores destes novos alvos macromoleculares. Desta forma, a síntese de coleçoes focadas empregando a química combinatória emergiu como uma das principais ferramentas na busca por novos fármacos. Nas últimas décadas a área de síntese orgânica passou por uma grande evoluçao3. O número e a complexidade dos novos compostos sintetizados aumentaram drasticamente, e dentre estes novos compostos pode-se incluir um grande número de fármacos e candidatos, além de muitos reagentes usados para explorar processos biológicos de várias formas. Atualmente, a síntese de compostos orgânicos constitui uma importante parte no processo de descoberta e desenvolvimento de novos fármacos. Na busca por um fármaco que tenha como alvo uma macromolécula biológica, anteriormente selecionada, é comum fazer uso da estratégia de síntese orientada pelo alvo, seja com o planejamento de uma única substância ou mesmo de uma coleçao de compostos de uma determinada classe, empregando a química combinatória.4 Quando se desconhece qualquer alvo terapêutico a ser utilizado no tratamento de uma determinada desordem, os compostos sintéticos podem ser empregados tanto na descoberta de uma proteína alvo como também na descoberta de um novo fármaco que funcione como ligante modulador. Neste caso é bastante comum a triagem de coleçoes de pequenas moléculas. Neste contexto a síntese orientada pela diversidade estrutural surge como uma estratégia interessante, pois permite a síntese de coleçoes de compostos com elevada diversidade estrutural, de forma antagônica ao que ocorre com a química combinatória.5,6 A diversidade de esqueletos moleculares providenciada pela síntese orientada pela diversidade estrutural é essencial para uma maior cobertura do espaço químico e identificaçao de alvos macromoleculares nao explorados, permitindo a possível identificaçao de novos protótipos de fármacos com diferentes modos de açao. Síntese Orientada pelo alvo na descoberta de novos fármacos Desde que Wohler realizou a síntese da uréia em 1828, marcando o início da química orgânica nos moldes em que a conhecemos, a área de síntese orgânica passou por enormes avanços. Atualmente existem muitos métodos sintéticos e possibilidades de reaçoes, permitindo a síntese de compostos complexos de forma muito mais eficiente que há algumas décadas.7 A química medicinal nos seus primórdios esteve fortemente vinculada à fitoterapia, e a pesquisa por novos fármacos sempre teve inspiraçao em produtos naturais bioativos isolados de plantas, principalmente nas universidades.8 Desta forma os trabalhos de síntese orgânica tiveram como foco um composto alvo ou mesmo uma coleçao de compostos de uma determinada classe. Entretanto, somente no fim da década de 50, E. J. Corey começou a sistematizar um algoritmo lógico a ser utilizado no planejamento de síntese dos compostos orgânicos. O planejamento de síntese com um composto (ou classe) alvo específico ficou conhecido como Síntese Orientada pelo Alvo e o algoritmo desenvolvido é conhecido como Análise Retrossintética.7,9,10 Muitas vezes é possível visualizar todas as etapas necessárias para a síntese da substância desejada a partir de precursores óbvios. Entretanto, frequentemente a sequência de reaçoes que permitem a obtençao do composto alvo é muito complexa para que a planejemos do início ao fim. Nestes casos, uma vez que sabemos a estrutura da molécula alvo a se obter, planejamos as etapas de trás para frente, identificando precursores imediatos, que podem levar ao produto desejado. Uma vez escolhidos os precursores, estes se tornam as moléculas alvo e o processo é repetido até que tenhamos precursores simples o suficiente para que estejam disponíveis no laboratório. Este processo é conhecido como análise retrossintética (Figura 1).9
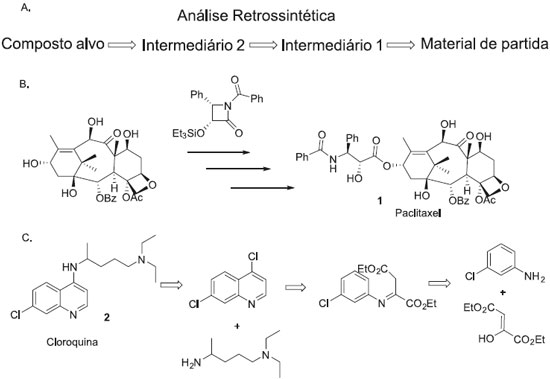 Figura 1. A. Síntese orientada pelo alvo. B. Análise retrossintética usada no planejamento de semi-síntese do paclitaxel. C. Análise retrossintética usada no planejamento de síntese da cloroquina
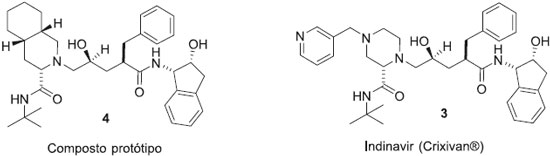
O paclitaxel (1) e a cloroquina (2) sao dois fármacos atualmente disponíveis no mercado, o primeiro é um produto natural utilizado no tratamento de diversos tipos de cânceres e que atualmente devido a alta demanda é produzido por via semissintética, e o último é um antimalárico da classe das quinolinas, à qual pertence o produto natural quinina, que foi o primeiro fármaco empregado no tratamento da malária. A Figura 1 mostra como a síntese orientada pelo alvo, utilizando a análise retrossintética foi aplicada no desenvolvimento do método para a síntese destes fármacos de origem natural.11-13 A síntese orientada pelo alvo e por consequência a análise retrossintética tem sido muito utilizada na obtençao de novos fármacos e compostos de interesse medicinal, visto que atualmente inúmeros trabalhos têm sido desenvolvidos empregando a técnica de planejamento racional. Esta técnica se baseia na identificaçao de uma proteína alvo, determinaçao estrutural da proteína e ou ligante e modelagem molecular, que fornecerá a estrutura de possíveis ligantes ativos na proteína alvo.14,15 Desta forma, a avaliaçao da capacidade de pequenas moléculas interagirem com enzimas alvo pré-selecionadas constituí parte primordial no desenvolvimento de novos fármacos. O indinavir (Crixivan, 3), fármaco atualmente usado no tratamento da AIDS, atua como inibidor da enzima Asp-protease, que é essencial no ciclo viral. A determinaçao estrutural da enzima e o conhecimento do formato e distribuiçao de carga no sítio receptor permitiu o planejamento do composto protótipo (4). Posteriormente empregando a estratégia de simplificaçao molecular o sistema cis-perisoquinolínico foi substituído por um anel piperazínico substituído, eliminando dois centros estereogênicos e dando origem ao fármaco indinavir (Figura 2).13,16
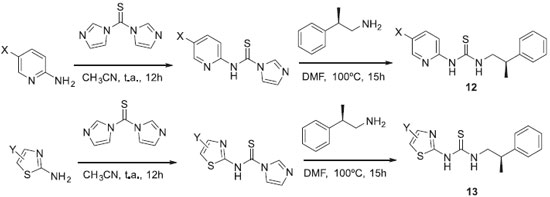
Os compostos da família dos triazóis têm sido utilizados como fármacos antifúngicos (ex: fluconazol, 5) desde os anos 1970, e o reconhecimento da atividade de inibiçao da enzima esterol 14α-desmetilase como mecanismo de açao, tem permitido o desenvolvimento de novos agentes antifúngicos desta classe.17 Aher e colaboradores mostraram como a síntese orientada pelo alvo pode ser utilizada na busca de novos derivados triazólicos antifúngicos (Figura 3).18
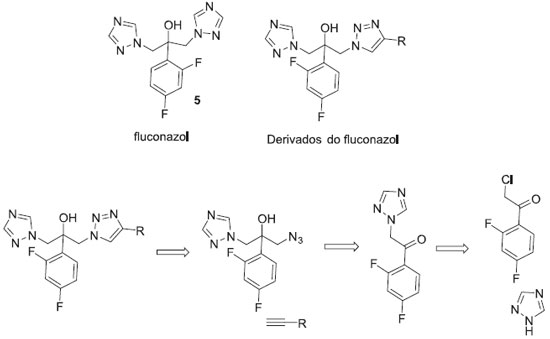 Figura 3. Análise retrossintética aplicada na síntese orientada pelo alvo de uma coleçao de derivados do fluconazol
Usando a estratégia de planejamento racional de fármacos, baseado na estrutura do ligante natural, Ganellin e colaboradores sintetizaram uma série de compostos imidazólicos inspirados na estrutura da histamina (6), buscando desenvolver um antagonista para os receptores histaminérgicos do tipo H2. Variando o tamanho da cadeia lateral, metilando o anel imidazólico, e por fim modificando o grupo funcional no final da cadeia lateral obtiveram a cimetidina (7), fármaco que inaugurou a era dos blockbusters (fármacos capazes de superar a marca de 1 bilhao de dólares em vendas anuais). A cimetidina foi introduzida no mercado no ano de 1976 e revolucionou o tratamento de úlceras estomacais (Figura 4).19
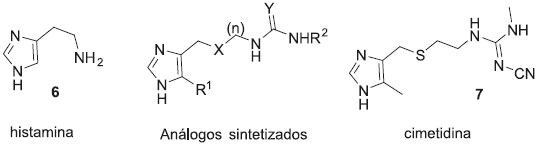 Figura 4. Estrutura da cimetidina, fármaco desenvolvido empregando o planejamento racional baseado na estrutura da histamina (substrato natural)
As coleçoes de compostos obtidas por química combinatória, geralmente apresentam resultados promissores, quando sao planejadas tendo como base a forma do sítio ativo da enzima e ou a estrutura do ligante natural. Estas mesmas coleçoes combinatórias (ou o conjunto de coleçoes) também têm sido submetidas a HTS, com o fim de fornecer compostos líderes para o desenvolvimento de outras coleçoes direcionadas. Usando testes HTS de uma extensa coleçao de quase 340 mil compostos, He e colaboradores identificaram compostos benzofuranos como inibidores do vírus da hepatite C. A otimizaçao do núcleo benzofurânico baseada na estrutura do composto líder (8), foi conseguida através da síntese de uma coleçao de compostos focada, onde 45 compostos foram sintetizados e alguns deles foram identificados como potentes inibidores de baixa toxicidade (Esquema 1).20,21
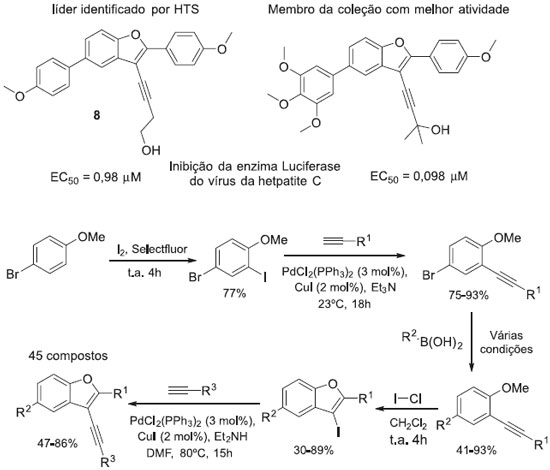 Esquema 1. Síntese de uma coleçao de compostos benzofuranos com atividade sobre o vírus da hepatite C
Nas últimas duas décadas, o HTS de pequenas moléculas tornou-se o método mais comum para a descoberta de compostos líderes para o desenvolvimento de fármacos. Estes testes sao realizados geralmente com milhares de compostos de forma automatizada, despendem de grande quantidade de recursos financeiros e os compostos líderes identificados geralmente necessitam de significantes otimizaçoes estruturais, utilizando processos sintéticos.22 Embora as indústrias farmacêuticas tenham direcionado uma quantidade de recursos bastante superior nos últimos anos, o número de novas entidades químicas aprovadas por ano tem permanecido relativamente constante, algo em torno de 20-30 novos compostos por ano.23 A atividade biológica de um determinado composto é intrinsicamente dependente da sua estrutura molecular, assim a diversidade de funçoes biológicas encontradas nos componentes de uma coleçao de pequenas moléculas está diretamente correlacionada com a diversidade estrutural da coleçao, que em última instância é proporcional a quantidade de espaço químico ocupado.24 As coleçoes de compostos obtidas por química combinatória geralmente possuem baixa diversidade estrutural, portanto apresentam baixos índices de compostos bioativos, quando submetidas a HTS (triagem aleatória). O espaço químico que compreende todas as pequenas moléculas orgânicas é muito amplo, de forma que apenas uma pequena fraçao tem sido explorada. Esta exploraçao permitiu o desenvolvimento do conhecimento a respeito do funcionamento dos sistemas biológicos, e com isso a obtençao de vários dos fármacos disponíveis no mercado. Neste contexto, a síntese de compostos com esqueletos moleculares diversos e ainda nao explorados tem grande potencial para aumentar o conhecimento a respeito dos sistemas biológicos, providenciando fármacos inovadores no futuro.25
SINTESE ORIENTADA PELA DIVERSIDADE ESTRUTURAL Embora o planejamento racional seja muito utilizado no desenvolvimento de novos fármacos por grupos de pesquisa tanto na indústria quanto na academia, esta nao é a única estratégia de trabalho. A identificaçao de pequenas moléculas com aplicaçoes biológicas e médicas, nem sempre requer o conhecimento da macromolécula, sobre a qual o composto atuará. A avaliaçao biológica de compostos em células e até mesmo microorganismos, pode também ser de grande valia e muito esclarecedora. No entanto para que se alcance bons resultados na avaliaçao destas pequenas moléculas, é necessário que estas componham uma coleçao bastante diversa, quanto às suas variaçoes estruturais.5,10,26 As coleçoes de compostos planejados empregando a química combinatória (síntese orientada pelo alvo), raramente sao eficientes quando se desconhece a estrutura da proteína alvo, e isso se deve a baixa diversidade encontrada nestas coleçoes de compostos. Além da diversidade, a complexidade é outra característica muito importante para uma coleçao de compostos utilizada em testes biológicos diretamente nas células e ou micro-organismos, visto que a maioria dos processos biológicos depende de interaçoes entre proteínas, e muitas das moléculas conhecidas por interromper estas interaçoes, sao produtos naturais complexos. A rigidez conformacional geralmente encontrada em estruturas complexas também é essencial para permitir boa interaçao com os sítios ativos de proteínas.26 A síntese orientada pela diversidade estrutural pode ser definida como a simultânea e eficiente síntese de compostos estruturalmente diversos, e tem como objetivo a síntese de coleçoes de compostos com elevada diversidade e complexidade. A síntese orientada pela diversidade constitui a melhor estratégia na obtençao de coleçoes de compostos na busca de potenciais fármacos para diversos males e desordens, sem um alvo macromolecular específico e também para a realizaçao de testes HTS. Na síntese orientada pela diversidade estrutural nao se tem uma estrutura alvo particular, assim a análise retrossintética nao pode ser utilizada na conduçao deste tipo de trabalho. No início dos anos 2000, reconhecendo a necessidade de se criar um algoritmo a ser utilizado na síntese de coleçoes de compostos orientadas pela diversidade estrutural, Stuart Schreiber propôs e iniciou o desenvolvimento do algoritmo de análise sintética direta onde se busca delinear a estratégia de síntese de modo a maximizar a complexidade, diversidade e eficiência dos produtos obtidos.5 No algoritmo de análise sintética direta, a complexidade dos membros de uma coleçao de compostos deve ser aumentada na realizaçao das etapas da síntese proposta, e a diversificaçao estrutural pode ser promovida pela variaçao de quatro elementos básicos, os blocos de síntese (a), os grupos funcionais (b), a estereoquímica (c) e os esqueletos moleculares (d) e (e) (Figura 5).24,26-28
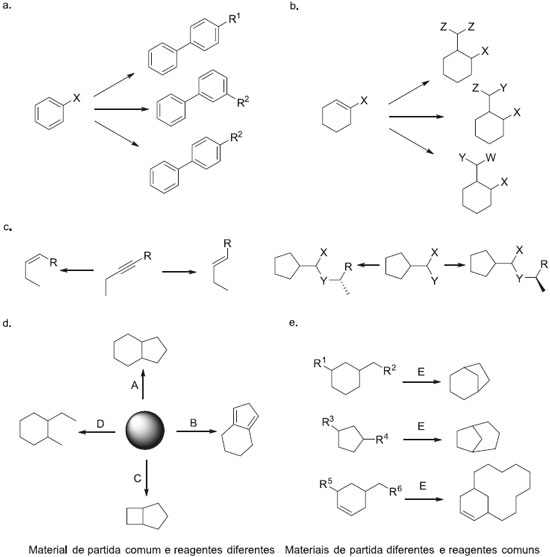 Figura 5. Síntese orientada pela diversidade estrutural de a. Blocos sintéticos. b. Grupos funcionais c. Estereoquímica. d. Esqueletos moleculares via ramificaçao dos caminhos sintéticos. e. Esqueletos moleculares pelo Processo de dobragem
Vieira e colaboradores realizaram a diversificaçao estrutural de uma coleçao de cumarinas, empregando a variaçao de blocos sintéticos na reaçao de Suzuki, onde uma cumarina iodo substituída (9) foi submetida a reaçao com diversos ácidos fenilborônicos. As reaçoes foram realizadas em condiçoes de química verde, usando irradiaçao de micro-ondas (MO) e polietilinoglicol como solvente, e as cumarinas aril-substituídas (10) tiveram sua atividade avaliada na enzima acetilcolinesterase imobilizada, apresentando atividade inibitória (Esquema 2).29,30
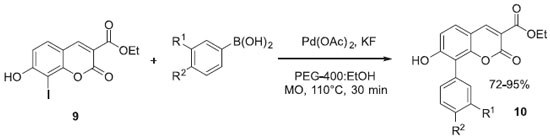 Esquema 2. Síntese de derivados cumarínicos empregando a reaçao de Suzuki e a estratégia de geraçao de diversidade através da variaçao de blocos de síntese
Recentemente, Cogo e colaboradores sintetizaram uma coleçao de quinoxalinas empregando a variaçao de blocos sintéticos e grupos funcionais para a diversificaçao estrutural. Neste trabalho, alguns derivados quinoxalínicos contendo os grupos funcionais amino e sulfonas ou sulfóxidos, foram identificados como novos agentes promissores no tratamento da doença de chagas e leishmaniose, com destaque para o composto 11 (Esquema 3).31,32
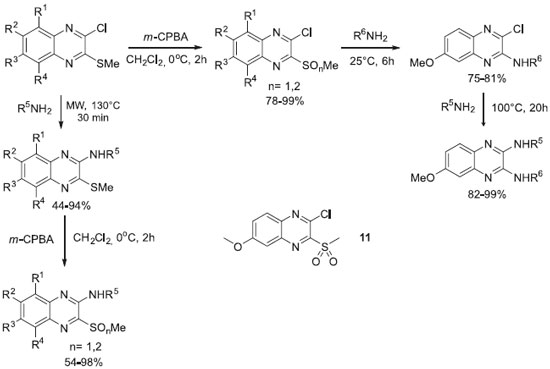 Esquema 3. Síntese de derivados quinoxalínicos empregando as estratégias de geraçao de diversidade através da variaçao de blocos de síntese e grupos funcionais
A variaçao estereoquímica também é muito utilizada na geraçao de diversidade estrutural. Embora compostos esteoisoméricos sejam constitucionalmente idênticos, existem diferenças topológicas que fazem com que estereoisômeros apresentem interaçoes diferenciadas com macromoléculas quirais e, portanto, apresentem atividades biológicas também diferenciadas. Uckun e colaboradores sintetizaram uma coleçao de halopiridil (12) e tiazoliltioureas (13) assimétricas e mostraram que os estereoisômeros com a configuraçao R possuem maior potência anti-HIV, apresentando maior inibiçao da replicaçao do vírus em células sanguíneas (Esquema 4).33
A enzima histona deacetilase (HDAC) regula uma série de processos celulares coordenando a desacetilaçao de diversas proteínas. Disfunçoes da enzima HDAC estao relacionados com uma série de doenças, como o câncer, artrite reumatóide, hipertrofia coronária e anemia. Dessa forma, inibidores de HDAC têm sido desenvolvidos para intervençao terapêutica em uma série de doenças.34 Atualmente, dois inibidores estao aprovados para uso, o ácido hidroxâmico suberoilanilida (vorinostato) e a rompidepsina (ISTODAX®), outros estao em fase clínica. A enzima HDAC possui dezoito isoformas identificadas, entretanto nenhum dos inibidores possui boa seletividade, apresentando efeitos colaterais.34 Macaurelle e colaboradores realizaram estudos da relaçao estrutura-atividade de uma coleçao de compostos na enzima histone deacetilase e observaram diferenças de atividade e seletividade de isômeros individuais, indicando a importância da estéreo-diversidade nas coleçoes de compostos. O composto BRS-4805 foi identificado como um composto líder para o desenvolvimento de novos fármacos, por apresentar seletividade muito maior que o fármaco aprovado vorinostato.34 O processo de síntese do BRS-4805 e análogos empregou como etapas chave a síntese de aminas estereoisoméricas através da formaçao de amidas e posterior reduçao, e a reaçao de metátese de fechamento de anel entre substituintes contendo ligaçoes dupla (Esquema 5).
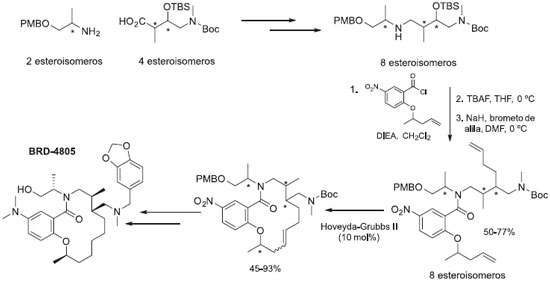 Esquema 5. Estratégia para a geraçao dos compostos macrocíclicos explorando a diversidade gerada pelos centros estereoisoméricos
Embora as estratégias de diversificaçao citadas acima sejam bastante empregadas na síntese de coleçoes de compostos, observa-se que a diversidade estrutural de uma coleçao é primariamente dependente da diversidade dos esqueletos moleculares centrais, sendo os substituintes periféricos menos importantes. Assim, o alto grau de diversidade dos esqueletos moleculares é essencial para uma maior cobertura do espaço químico ocupado pela coleçao de compostos.24,28,35 Existem dois modos principais utilizados na geraçao de diversidade de esqueletos moleculares (Figura 5d e 5e). A estratégia de ramificaçao dos caminhos sintéticos é baseada no uso de um material de partida e diversos reagentes, assim diversas reaçoes sao realizadas de forma divergente para produzir uma coleçao de compostos com arquitetura molecular diferente. A segunda estratégia é conhecida como processo de dobragem, onde diferentes materiais de partida sao submetidos a uma mesma condiçao reacional levando a diferentes esqueletos moleculares, geralmente usando reaçoes intramoleculares. Os dois modos de geraçao de diversidade eventualmente podem estar presentes no mesmo planejamento sintético e diversidade adicional pode ser introduzida usando variados grupos funcionais, blocos sintéticos e estereoquímica.24,27,28 A estratégia de ramificaçao dos caminhos sintéticos permite a obtençao de diversidade de esqueletos moleculares por dois métodos principais:
Porco e colaboradores demonstraram como múltiplos esqueletos moleculares podem ser obtidos usando estruturas densamente funcionalizadas. Utilizando a reaçao de adiçao conjugada em compostos nitro α,β-insaturados, obtiveram os composto 14, densamente funcionalizados. As funçoes dos compostos 14 foram convenientemente pareadas usando condiçoes para lactamizaçao, metátese e cicloadiçao 1,3 conforme mostrado na Esquema 6.36
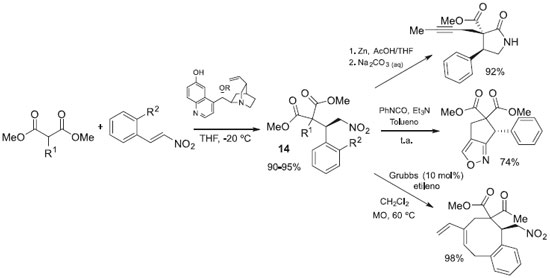 Esquema 6. Diversificaçao de esqueletos moleculares, por ramificaçao dos caminhos sintéticos, empregando substratos densamente funcionalizados
Grande diversidade de esqueletos moleculares também pode ser conseguida empregando materiais de partida sinteticamente versáteis, capazes de sofrer uma larga variedade de transformaçoes químicas envolvendo o mesmo grupo funcional. Um exemplo de DOS empregando grupo funcional de múltipla reatividade foi publicado por Thomas e colaboradores, onde um fosfonato ancorado em suporte sólido (15) foi utilizado como material de partida. O uso da ancoragem favoreceu a purificaçao dos produtos em todas as etapas de síntese.37 No trabalho desenvolvido por Thomas, inicialmente foi realizada a reaçao de Horner-Wadsworth-Emmons com diversos aldeídos (blocos sintéticos), para produzir uma série de acilimidazolinonas α,β-insaturadas (16) com configuraçao E, ancoradas em suporte sólido. Na segunda etapa, a reatividade da ligaçao dupla carbono-carbono foi explorada empregando três reaçoes catalíticas divergentes, a) dihidroxilaçao assimétrica, b) cicloadiçao (2+3) e c) cicloadiçao (4+2) para fornecer produtos com esqueletos moleculares diferentes. Os produtos obtidos na segunda etapa foram submetidos a uma série de reaçoes permitindo a diversificaçao dos esqueletos moleculares da coleçao de compostos (Esquema 7).37
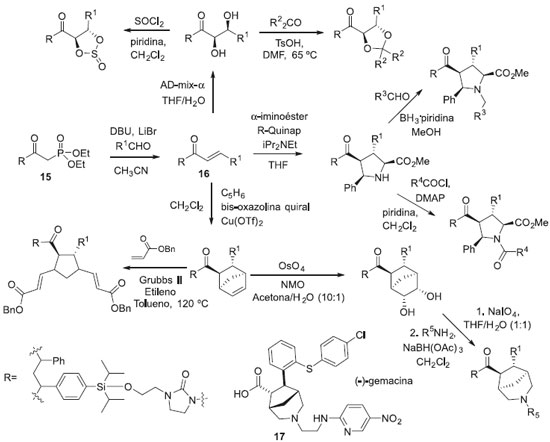 Esquema 7. Síntese de compostos contendo esqueletos moleculares diversos empregando o método de ramificaçao dos caminhos sintéticos, partindo de substratos com grupos funcionais de múltiplas reatividades
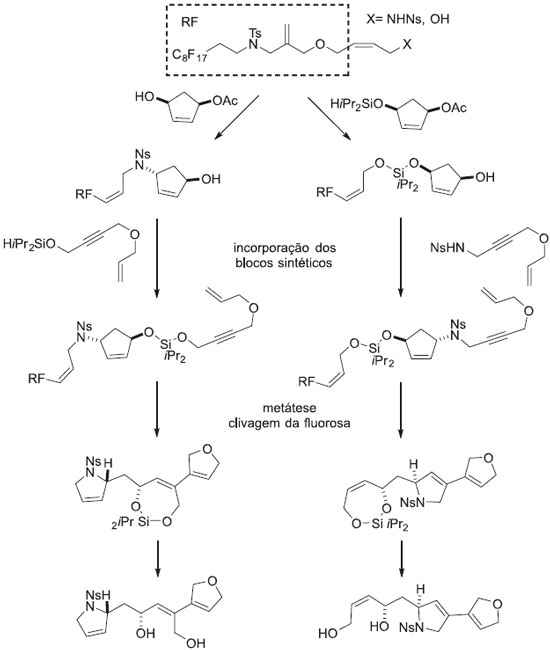
Thomas e colaboradores foram capazes de produzir uma coleçao de 242 compostos, contendo 18 esqueletos moleculares diferentes (alguns nao mostrados na figura), e empregando um número limitado de blocos sintéticos, através da síntese orientada diversidade estrutural. Esta coleçao de compostos foi submetida a avaliaçao biológica em cepas de bactérias resistentes à penicilinas e eritromicina, tais como a Staphylococcus aureus resistentes a meticilina (MRSA). Alguns compostos previniram a proliferaçao das bactérias, sendo a gemmacina (17) o mais potente dos compostos obtidos. Contrastando com os modos de geraçao de diversidade estrutural baseados em mudanças de reagentes, os processos de desdobramento sao aplicados usando substratos diferentes com características estruturais pré-determinadas de forma a poderem ser aplicados a uma determinada condiçao reacional produzindo diferentes esqueletos moleculares. Morton e colaboradores desenvolveram um método onde pares de blocos sintéticos insaturados foram ligados a uma fase fluorosa, gerando uma grande variedade de substratos, onde cada um destes substratos continha ligaçoes duplas. Os compostos foram submetidos a reaçoes de metátese, para a ciclizaçao intramolecular gerando uma coleçao de compostos com esqueletos moleculares diferentes. Interessantemente, a fase fluorosa foi projetada de forma a liberar em soluçao os produtos ciclizados, facilitando o processo de purificaçao (Figura 6).38
O trabalho de Morton, empregando este método permitiu a síntese de 96 compostos contendo 84 tipos de esqueletos moleculares diferentes, muitos deles desconhecidos na literatura, dessa forma, providenciou uma coleçao de compostos cobrindo uma grande faixa do espaço químico, ainda nao estudada. Este trabalho representa bem o estado da arte de geraçao de diversidade de esqueletos moleculares, providenciando coleçoes de compostos com grande potencial para a terapêutica de alvos macromoleculares considerados desafiadores.38 Nielsen e Schreiber identificaram uma estratégia comum a muitos dos processos de síntese orientada pela diversidade estrutural, a qual eles chamaram de construir/acoplar/parear.39
A estratégia de construir/acoplar/parear foi aplicada pelo grupo de Brummond para explorar a habilidade de alguns catalisadores metálicos na síntese de diversos esqueletos moleculares. Uma série de blocos sintéticos α-aminoácidos (18) e alcoóis propargílicos (19) foram acoplados e posteriormente transformados em alquinil alenos (20) que puderam ser pareados em reaçoes intramoleculares do tipo Alder-Ene, Pauson-Khand e cicloadiçao (2+2) (Figura 7).40,41
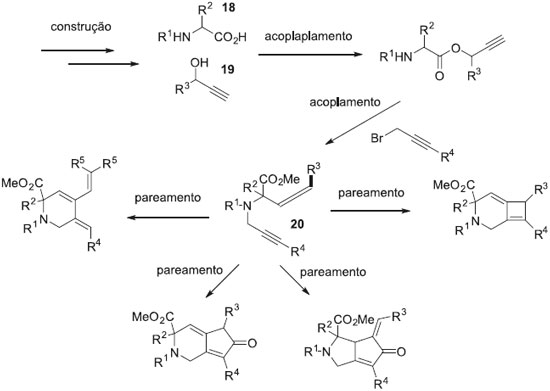 Figura 7. Síntese orientada pela diversidade estrutural de quatro esqueletos moleculares empregando a estratégia de construir/acoplar/parear
Nos últimos anos alguns trabalhos têm sido desenvolvidos combinando o conceito de síntese orientada pela diversidade estrutural com o conceito de estruturas privilegiadas. Esta estratégia se baseia no fato de que algumas classes de esqueletos moleculares (estruturas privilegiadas) sao capazes de atuar como ligantes para diversos receptores biológicos, devido às suas propriedades físico-químicas favoráveis.42,43 Alguns núcleos heterocíclicos sao conhecidos como estruturas privilegiadas, por estarem presentes em um grande número de produtos naturais bioativos. Assim, muitas coleçoes de compostos têm sido construídas usando sequencias de reaçoes químicas de forma a promover aumento da complexidade e diversificaçao estrutural em torno de esqueletos moleculares privilegiados. Park e colaboradores produziram uma coleçao de mais de 2000 compostos com esqueletos moleculares diversos, contendo o núcleo privilegiado benzopirano. A coleçao de compostos foi submetida a avaliaçoes biológicas diversas, e entre os constituintes desta coleçao foram identificados moduladores biológicos diversos, como um antagonista do receptor androgênico (21), um ativador da osteogênese (22) e um inibidor indireto da gênese dos osteoclastos (23) (Figura 8).44
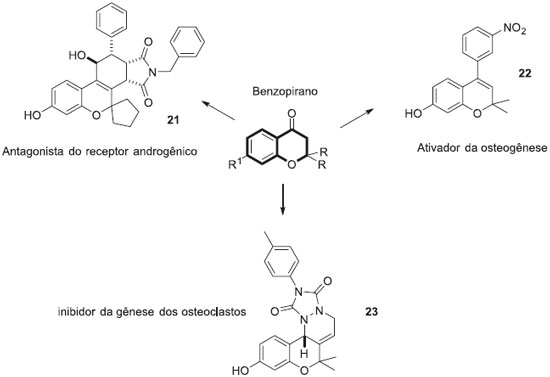 Figura 8. Modulares biológicos identificados usando a estratégia de síntese orientada pela diversidade estrutural baseada em estruturas privilegiadas
CONCLUSOES E PERSPECTIVAS A síntese de novos compostos orgânicos tem papel crucial no desenvolvimento de novos fármacos. Atualmente muitas doenças possuem alvos terapêuticos bem elucidados, permitindo o planejamento racional e síntese de ligantes ou mesmo possuem agentes terapêuticos que possam servir no planejamento de novos compostos. Entretanto muitos males ainda carecem de estratégias específicas e alvos biológicos. Nos casos onde o planejamento racional nao é possível, a síntese orientada pela diversidade estrutural surge como alternativa, permitindo a obtençao de coleçoes de compostos com estruturas diversas e complexas. A alta diversidade estrutural de uma coleçao de compostos amplia as possibilidades de identificaçao de protótipos de fármacos utilizando HTS. A síntese orientada pela diversidade estrutural ainda nao possui um algoritmo bem definido como a análise retrossintética, entretanto faz uso de um planejamento direto empregando quatro principais modos de diversificaçao: 1. Uso de blocos de síntese variados. 2. Variaçao de grupos funcionais, 3. Exploraçao da estereoquímica e 4. esqueletos moleculares diferentes. A síntese orientada pela diversidade estrutural tem contribuído para o desenvolvimento de novos métodos sintéticos e novas reaçoes químicas, sendo extensivamente empregada para providenciar coleçoes de compostos complexos e diversos para aplicaçao no processo de descobrimento de fármacos. A eficiente geraçao de novos esqueletos moleculares diversos é essencial no processo de síntese orientada pela diversidade. Os recentes progressos na área trazem como marco o número de 84 diferentes esqueletos moleculares em uma coleçao de 96 compostos, assim a síntese de centenas de novos esqueletos permanece um desafio. No desenvolvimento de novos fármacos, a grande diversidade de esqueletos moleculares é essencial para uma maior cobertura do espaço químico e identificaçao de alvos macromoleculares nao explorados, permitindo a possível identificaçao de novos protótipos de fármacos com diferentes modos de açao. Schreiber afirma que em última instância o principal objetivo da síntese de coleçoes de compostos, deve ser providenciar tal grau de diversidade que para qualquer aspecto dos processos biológicos, membros da coleçao possam ser encontrados como moduladores. Embora este objetivo ainda esteja distante a contínua evoluçao da síntese orientada pela diversidade estrutural representa avanços na direçao correta.
AGRADECIMENTOS O autor agradece à FAPERJ pelo apoio financeiro recebido.
REFERENCIAS 1. Li, J. W. H.; Vederas, J. C.; Science 2009, 325, 161. DOI: http://dx.doi.org/10.1126/science.1168243 PMID: 19589993 2. Newman, D. J.; Cragg, G. M. J. Nat. Prod. 2012, 75, 311. DOI: http://dx.doi.org/10.1021/np200906s PMID: 22316239 3. Brocksom, T. J.; Desiderá, A. L.; Alves, L. C.; Oliveira, K. T.; Curr. Org. Synth. 2015, 12, 496. DOI: http://dx.doi.org/10.2174/157017941205150821121222 4. Fraga, C. A. M.; Lima, L. M.; Barreiro, E. J. Em Química Medicinal: Métodos e Fundamentos em Planejamento de Fármacos; Montanari, C. A. Ed.; Sao Paulo: Editora da Universidade de Sao Paulo, 2011. 5. Schreiber, S. L.; Science 2000, 287, 1964. DOI: http://dx.doi.org/10.1126/science.287.5460.1964 PMID: 10720315 6. Galloway, W. R. J. D.; Bender, A.; Welch, M.; Spring, D. R.; Chem. Commun. 2009, 2446. DOI: http://dx.doi.org/10.1039/b816852k 7. Burke, M. D.; Lalic, G.; Chemistry and Biology 2002, 9, 535. DOI: http://dx.doi.org/10.1016/S1074-5521(02)00143-6 8. Nogueira, L. J.; Montanari, C. A. Donici, C. L.; Rev. Virtual Quim. 2009, 1, 227. DOI: http://dx.doi.org/10.5935/1984-6835.20090017 9. Corey, E. J.; Cheng, X. -M.; The logic of Chemical Synthesis, New York: John Wiley and Sons, 1995. 10. Spring, D. R.; Org. Biomol. Chem. 2003, 1, 3867. DOI: http://dx.doi.org/10.1039/b310752n PMID: 14664374 11. Corey, E. J.; Czakó, B.; Kurti, L.; Molecules and Medicine, New Jersey: John Wiley and Sons, 2007. 12. Viegas, C.; Bolzani, V. S.; Barreiro, E. J.; Quim. Nova 2006, 29, 326. DOI: http://dx.doi.org/10.1590/S0100-40422006000200025 13. Barreiro, E. J.; Quim. Nova 2002, 25, 1172. DOI: http://dx.doi.org/10.1590/S0100-40422002000700018 14. Montanari, C. A.; Bolzani, V. S.; Quim. Nova 2001, 24, 105. 15. Sant'Anna, C. M. R.; Rev. Virtual Quim. 2009, 1, 49. 16. Tavel, J. A.; Exp. Opin. Invest. Drugs 2000, 9, 917. DOI: http://dx.doi.org/10.1517/13543784.9.4.917 17. Ferreira, E. I.; Rev. Virtual Quim. 2012, 4, 225. DOI: http://dx.doi.org/10.5935/1984-6835.20120004 18. Aher, N. G.; Pore, V. S.; Mishra, N. N.; Kumar, A.; Shukla, P. K.; Sharma, A.; Bhat, M. K.; Bioorg. Med. Chem. Lett. 2009, 19, 759. DOI: http://dx.doi.org/10.1016/j.bmcl.2008.12.026 PMID: 19110424 19. Ganellin, R.; J. Med. Chem. 1981, 24, 913. DOI: http://dx.doi.org/10.1021/jm00140a001 PMID: 6120235 20. He, S.; Jain, P.; Lin, B.; Ferrer, M.; Hu, Z.; Southall, N.; Hu, X.; Zheng,W.; Neuenswander, B.; Cho, C. H.; Chen, Y.; Worlikar, S. A.; Aubé, J.; Larock, R.; Schoenen, F. J.; Marugan, J. J.; Liang, T. J.; Frankowski, K. J.; ACS Comb. Sci. 2015, 17, 641. DOI: http://dx.doi.org/10.1021/acscombsci.5b00101 PMID: 26332742 21. Cho, C. H.; Neuenswander, B.; Lushington, G. H.; Larock, R. C.; J. Comb. Chem. 2008, 10, 941. DOI: http://dx.doi.org/10.1021/cc800120y PMID: 18937516 22. Gao, Y.; Amar, S.; Pahwa, S.; Fields, G.; Kodadek, T.; Acs Comb. Sci. 2015, 17, 49. DOI: http://dx.doi.org/10.1021/co500154e PMID: 25434974 23. Butler, M. S.; Robertson, A. A. B.; Cooper, M. A.; Nat. Prod. Rep. 2014, 31, 1612. DOI: http://dx.doi.org/10.1039/C4NP00064A PMID: 25204227 24. Galloway, W. R. J. D.; Llobet, A. I.; Spring, D. R.; Nat. Commun. 2010, Article 80, DOI: 10.1038/ncomms1081. DOI: http://dx.doi.org/10.1038/ncomms1081. PMID: 20865796 25. Dobson, C. M.; Nature 2004, 432, 824. DOI: http://dx.doi.org/10.1038/nature03192 26. Burke, M. D.; Schreiber, S. L.; Angew. Chem. Int. ed. 2004, 43, 46. DOI: http://dx.doi.org/10.1002/anie.200300626 27. Spandl, R. J.; Gavilan, M. D.; O'Connell, K. M. G.; Thomas, G. L., Spring, D. R.; The Chemical Record, 2008, 8, 129. DOI: http://dx.doi.org/10.1002/tcr.20144 28. O'Connell, C. J.; Beckmann, H. S. G.; Spring, D. R.; Chem. Soc. Rev. 2012, 41, 4444. DOI: http://dx.doi.org/10.1039/c2cs35023h 29. Vieira, L. C. C.; Paixao, M. W.; Corrêa, A. G.; Tetrahedron Lett. 2012, 53, 2715. DOI: http://dx.doi.org/10.1016/j.tetlet.2012.03.079 30. Vanzolini, K. L.; Vieira, L. C. C.; Corrêa, A. G.; Cardoso, C. L.; Cass, Q. B.; J. Med. Chem. 2013, 56, 2038. DOI: http://dx.doi.org/10.1021/jm301732a PMID: 23330848 31. Cogo, J.; Kaplum, V.; Sangi, D. P.; Nakamura, T. U.; Corrêa, A. G.; Nakamura, C. V.; Eur. J. Med. Chem. 2015, 90, 107. DOI: http://dx.doi.org/10.1016/j.ejmech.2014.11.018 PMID: 25461316 32. Rodrigues, J. H. S.; Nakamura, T. U.; Corrêa, A. G.; Sangi, D. P.; Nakamura, C. V.; PLoS One 2014, 9, e85706. 33. Venkatachalam, T. K.; Mao, C.; Uckun, F. M.; Bioorg. Med. Chem. 2004, 12, 4275. DOI: http://dx.doi.org/10.1016/j.bmc.2004.04.050 PMID: 15246104 34. Marcaurelle, L. A.; Comer, E.; Dandapani, S.; Duvall, J. R.; Gerard, B.; Kesavan, S.; Lee IV, M. D.; Liu, H.; Lowe, J. T.; Marie, J. C.; Mulrooney, C. A.; Pandya, B. A.; Rowley, A.; Ryba, T. D.; Suh, B. C.; Wei, J.; Young, D. W.; Akella, L. B.; Ross, N. T.; Zhang, Y. L.; Fass, D. M.; Reis, S. A.; Zhao, W. N.; Haggarty, S. J.; Palmer, M.; Foley, M. A.; J. Am. Chem. Soc. 2010, 132, 16962. DOI: http://dx.doi.org/10.1021/ja105119r PMID: 21067169 35. Sauer, W. H. B.; Schwarz, M. K.; J. Chem. Inf. Comput. Sci. 2003, 43, 987. DOI: http://dx.doi.org/10.1021/ci025599w PMID: 12767158 36. Comer, E.; Rohan, E.; Deng, L.; Porco, J. A.; Org. Lett. 2009, 9, 2123. DOI: http://dx.doi.org/10.1021/ol070606t 37. Thomas, L. G.; Spandl, R. J.; Glansdorp, F. G.; Welch, M.; Bender, A.; Cockfield,J.; Lindsay, J. A.; Bryant, C.; Brown, D. F. J.; Loiseleur, O.; Rudyk, H.; Ladlow, M.; Spring, D. R.; Angew. Chem., Int. Ed. 2008, 47, 2808. DOI: http://dx.doi.org/10.1002/anie.200705415 38. Morton, D.; Leach, S.; Cordier, C.; Warriner, S.; Nelson, A.; Angew. Chem., Int. Ed. 2009, 48, 104. DOI: http://dx.doi.org/10.1002/anie.200804486 39. Nielsen T. E.; Schreiber, S. L.; Angew. Chem. Int. Ed. 2008, 47, 48. DOI: http://dx.doi.org/10.1002/anie.200703073 40. Brummond, K. M.; Mitasev, B.; Org. Lett. 2004, 6, 2245. DOI: http://dx.doi.org/10.1021/ol0492391 PMID: 15200331 41. Brummond, K. M.; Chen, D.; Org. Lett. 2005, 7, 3473. DOI: http://dx.doi.org/10.1021/ol051115g PMID: 16048320 42. Welsch, M. E.; Snyder, S. A.; Stockwell, B. R.; Curr. Opin Chem. Biol. 2010, 14, 347. DOI: http://dx.doi.org/10.1016/j.cbpa.2010.02.018 PMID: 20303320 43. Evans B. E.; Rittle K. E.; Bock M. G.; DiPardo R. M.; Freidinger R. M.; Whitter W. L.; Lundell G. F.; Veber D. F.; Anderson P. S.; Chang R. S. L.; Lotti, V. J.; Cerino, D. J.; Chen, B.; Kling, P. J.; Kunkel, K. A.; Springer, J. P.; Hirshfieldt, J.; J. Med. Chem. 1988, 31, 2235. DOI: http://dx.doi.org/10.1021/jm00120a002 PMID: 2848124 44. Oh, S.; Park, S. B.; Chem. Commun. 2011, 47, 12754 DOI: http://dx.doi.org/10.1039/c1cc14042f
#This paper is part of the PubliSBQ Special Issue in honor of the late Prof. Angelo da Cunha Pinto. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access