Artigo
|
|
| Síntese e caracterização de surfactantes alquilfenil poliglicosídicos a partir da amilose e alquil fenóis extraídos do LCC natural Synthesis and characterization of alkylphenyl polyglycosidic surfactants from amylose and alkyl phenols extracted from natural CNSL |
|
Francisco C. F. de FrançaI,II; Ethanielda de L. CoelhoII; Antônia F. J. UchôaII; Francisco H. A. RodriguesII,III; Maria E. N. P. RibeiroII,*; Sandra de A. SoaresII; Nágila M. P. S. RicardoII
IFaculdade de Educação, Ciências e Letras do Sertão Central, Universidade Estadual do Ceará, 63900-000 Quixadá - CE, Brasil Recebido em 30/09/2015 *e-mail: elenir.ribeiro@ufc.br The surfactants were synthesized by condensing the obtained oligosaccharides of amylose and alkyl phenols extracted from the natural cashew nut shell liquid (nCNSL). The Nuclear Magnetic Resonance (NMR) and Fourier Transform Infrared Spectroscopy (FTIR) data showed aromatic ring bands, glycosidic rings, olefins and paraffins. The Nuclear Overhauser Effect Spectroscopy (NOESY) experiments showed that the conformation of the glycosidic units is of the type 4C1 with an α anomeric configuration. The values of Gibbs free energy of micellization (ΔGomic) indicate that the spontaneity of formed micelles are cardanyl oligoglycosides > cardyl oligoglycosides > anacardyl oligoglycosides. The surface tension (γ) measurements showed that critical micelle concentration (cmc) values were low for surfactants. The study γ versus lnc (g dm-3) indicated that the aggregation behavior of the surfactants is dependent on their structural characteristics, as well as their thermal behavior. The area per molecule (A) values indicates that cardyl oligoglycosides are likely to form aggregates smaller than cardanyl oligoglycosides and anacardyl oligoglycosides. The critical packing parameter (cpp) indicates that the aggregates are of the vesicles and bilayers. INTRODUÇAO Surfactantes derivados de carboidratos e óleos vegetais sao de interesse especial por causa de sua produçao a partir de recursos renováveis e suas propriedades ecológicas favoráveis (eles sao, por exemplo, biodegradáveis). Estas propriedades os tornam interessante como substitutos de outros agentes tensoativos que sao potencialmente prejudiciais à saúde e ao ambiente.1 Membros importantes desta família sao alquil poliglicosídeos (APGs), os quais têm sido relatados por aproximadamente 120 anos.2 Alquil poliglicosídeos sao considerados surfactantes verdes e bons substitutos dos biosurfactantes que sao eficazes para acelerar e melhorar a qualidade da compostagem, mas que sao caros e tem uso proibido em adubos microbianos.3 Alquil poliglicosídeos também têm atraído interesse na suplementaçao dietética de animais.4 Os surfactantes aniônicos como o lauril sulfato de sódio e o dodecil sulfato de sódio sao extensivamente utilizados em cosméticos, embora sejam irritantes para a pele.5,6 Dessa forma, há a necessidade de novos surfactantes substitutos que nao sejam tao agressivos e os alquil poliglicosídeos, surfactantes nao-iônicos, apresentam-se como bons candidatos.7 A síntese inicial de alquil poliglicosídeos era e ainda é realizada por dois tipos de matéria prima: carboidratos e álcoois graxos derivados do petróleo.8 No entanto, novos materiais têm substituído os alcoóis graxos derivados do petróleo por óleos vegetais.9 Neste trabalho optou-se pela utilizaçao de materiais única e exclusivamente de origem vegetal. Os carboidratos utilizados foram extraídos do amido da batata inglesa e o óleo utilizado foi o líquido da casca da castanha do caju (LCC). A amilose foi escolhida como carboidrato para a síntese dos surfactantes, pois ela é um homopolissacarídeo linear do amido. Ela é vantajosa com relaçao aos heteropolissacarídeos, pois apresenta apenas como único monômero a glicose. O LCC foi escolhido por ser rico em meta alquil fenóis que podem ser utilizados como porçao hidrofóbica dos surfactantes. O LCC e seus constituintes sao empregados há sete décadas em pesquisas relacionadas à transformaçao destes materiais em moléculas de alto valor agregado.10-17 Esses produtos apresentam várias propriedades importantes do ponto de vista industrial, ambiental, farmacológico ou biológico, tais como: molhabilidade, atoxicidade, baixo valor de cmc, propriedades emulsificantes, boas propriedades dermatológicas, biocompatibilidade, biodegradabilidade, boas propriedades carreadoras e solubilizadoras de drogas18 e sao sintetizados por uma rota sintética verde.19 Os meta alquil fenóis do LCC utilizados neste trabalho foram: o ácido anacárdico, o cardanol e o cardol. Na literatura já existem trabalhos com surfactantes alquil poliglicosídicos derivados do cardanol,20 no entanto, nenhum trabalho com o ácido anacárdico ou o cardol.
PARTE EXPERIMENTAL Materiais Metanol (Synth); Acido clorídrico (Merck); Peneira molecular 4A (Merck) n-Butanol (Synth); Nitrogênio (White Martins); Diclorometano (Synth); Hidróxido de sódio (Merck); Hexano (Synth); Acetato de etila (Synth); Trifluoreto de boro dietil-eterato (Merck); Cloreto de Sódio (Merck); Hidróxido de Cálcio (Merck), Hidróxido de amônio (Synth); 4-metil-2,6-di-terc-butilfenol (Merck); Sulfato de sódio anidro (Merck); Acido acético glacial (Synth); Acido sulfúrico (Synth); Anidrido acético (Synth); Etanol (Synth); Hidróxido de potássio (Merck); Fenolftaleína (Merck); Bicarbonato de sódio (Merck); Trimetilamina (Synth); Acetonitrila (Synth). Todos os solventes foram utilizados como recebidos, sem purificaçao prévia. O LCC técnico foi proveniente da fábrica de castanha CIONE (Fortaleza-Ce) e o LCC natural foi obtido a partir das cascas de castanhas provenientes da EMBRAPA (Fortaleza-Ce), clones CCP09. O LCC21,22 e seus constituintes23,24 foram extraídos segundo metodologia pré-estabelecida. A amilose foi isolada a partir do amido extraído da batata inglesa (Solanum tuberosum L.) segundo Whistler,25 pré-tratada, acetilada e hidrolisada segundo metodologia estabelecida.26-29 Os alquilfenil glicosídeos foram sintetizados pelo método de George John e colaboradores sem nenhuma modificaçao.30 Detalhes da síntese dos alquilfenil glicosídeos podem ser encontrados no material suplementar. Determinaçao do grau de substituiçao (GS) e percentagem de acetilaçao (PA) O grau de substituiçao (GS)31 e a percentagem de acetilaçao (PA)32 foram calculados a partir das seguintes expressoes: 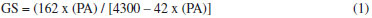 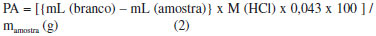 em que: mL branco é o volume gasto na titulaçao da amilose após tratamento com KOH 1 mol L-1; mL amostra é o volume gasto na titulaçao dos triacetatos após tratamento com KOH 1 mol L-1; Molaridade do HCl = 0,501; mamostra é a massa da amostra. Os valores 162 e 43 sao relativos ao peso molecular do anidro D-glicose e ao peso molecular do grupo acetil, respectivamente. O valor 42 refere-se ao peso molecular do grupo acetil após a saída de um hidrogênio, ao se ligar a anidroglicose. O grau de substituiçao também foi determinado por RMN 1H pela seguinte expressao:33  Espectroscopia de absorçao na regiao do infravermelho (FTIR) Os espectros FTIR dos surfactantes foram obtidos em pastilha de KBr em um espectrômetro SHIMADZU FTIR 8300 com varredura de 400 a 4000 cm-1. Ressonância magnética nuclear de 1H e 13C (RMN 1H e RMN 13C) Os alquilfenil oligoglicosídeos foram caracterizados por espectroscopia, RMN 1H e RMN 13C. As atribuiçoes dos sinais de absorçao de RMN 1H e RMN 13C foram realizadas pelas técnicas HMQC e COSY, e a conformaçao das unidades glicosídicas dos grupos cabeça hidrofílicos confirmadas pela técnica NOESY. Os espectros de RMN 1H e RMN 13C em soluçao (clorofórmio deuterado para materiais acetilados, LCC e seus componentes, água deuterada para os surfactantes e DSS como padrao interno) foram obtidos em um equipamento Brucker Avance 300, com transformada de Fourier, funcionando a 300 MHz na frequência do hidrogênio, e a 75 MHz para RMN 13C. Tensao superficial Para as medidas da tensao superficial (γ) foi utilizada uma balança de torçao da White Elec. Inst. Co. LTD. Todas as medidas foram feitas a 30 ± 0,1 ºC. Parâmetros termodinâmicos foram calculados a partir das isotermas de tensao superficial de equilíbrio versus logaritmo natural da concentraçao (Eqs 4-10).34-38 A partir das isotermas de γ versus ln c (g dm-3) foi determinado o excesso interfacial, 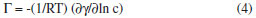 em que: (∂γ/∂ln c) é obtido a partir das inclinaçoes das curvas; R é a constante universal dos gases (8,314 J.K-1mol-1); T é a temperatura em Kelvin. E a área por molécula (A) é calculada por:  em que: NA é o número de Avogadro. π é a pressao interfacial, a qual é calculada por:  em que: γ é a tensao superficial da água pura; gcmc é o valor da tensao superficial das soluçoes dos surfactantes (Figura 12S e Tabela 3).
Os valores de concentraçao micelar crítica (cmc) podem ser encontrados no ponto onde as duas curvas lineares se cruzam nas isotermas. Os valores do parâmetro crítico de empacotamento (PCE) foi calculado pela equaçao:  em que: v é o volume da cadeia alquílica; lc é o comprimento para a cadeia alquílica estendida. As incógnitas v e lc sao determinados pelas seguintes expressoes: 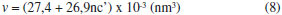 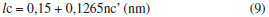 em que: nc' o número de átomos de carbono por cadeia no núcleo micelar. A energia livre de Gibbs de micelizaçao (ΔGºmic) é determinada pela seguinte fórmula: 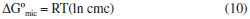 Cromatografia de permeaçao em gel (GPC) A massa molar média de todos os surfactantes foi estimada através de cromatografia de permeaçao em gel (GPC). As soluçoes preparadas (0,4 %) foram injetadas (0,5 µL), com fluxo de 1,0 mL por minuto em sistema de duas colunas em série da Phenomenex, do tipo Phenogel LINEAR/MIXED 5U com 7,80 x 300 mm, sendo utilizado tolueno como fase móvel à temperatura ambiente. A curva de calibraçao foi construída utilizando-se padroes de poliisopreno com massas molares em intervalo de grandeza de 1.130 g/mol a 2.160.000 g/mol. Foi utilizado cromatógrafo SHIMADZU LC-10AD, com detectores de índice de refraçao (RID-6A) e ultravioleta (UV-VIS SPD-10AV). Análise térmica (TGA e DSC) Medidas de DSC e TGA foram realizadas em equipamentos SHIMADZU (DSC-50 e TGA-50) em atmosfera de hélio a uma razao de aquecimento de 10 ºC/min na faixa de temperatura de 25-350 ºC para o DSC e 25-900 ºC para o TGA. Difraçao de raios-X Os padroes de difraçoes de raios-X dos produtos e intermediários foram obtidos em um difratômetro de raios-X da marca Philips MDR Pro com uma fonte geradora de 40 kV e 220 mA usando tubo de cobre como alvo. As amostras foram pulverizadas e depositadas na superfície de um suporte contendo graxa de silicone como fixador, em seguida o suporte foi introduzido no equipamento para a efetuaçao das medidas. Para tratamento dos dados foi utilizado o programa de refinamento dbws9807 o qual utiliza o método Rietveld para identificaçao das fases presentes em amostras pulverizadas.
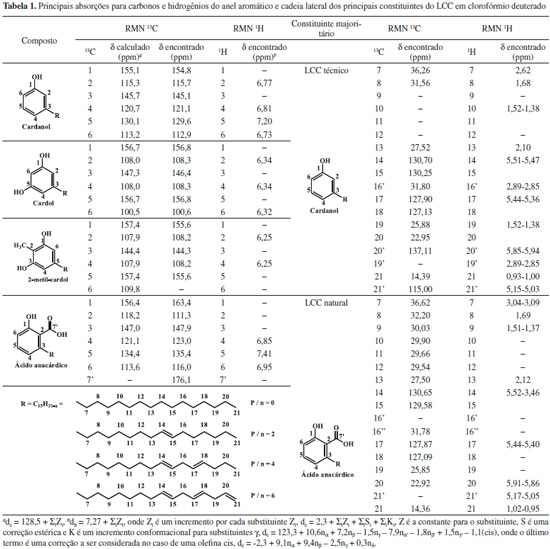
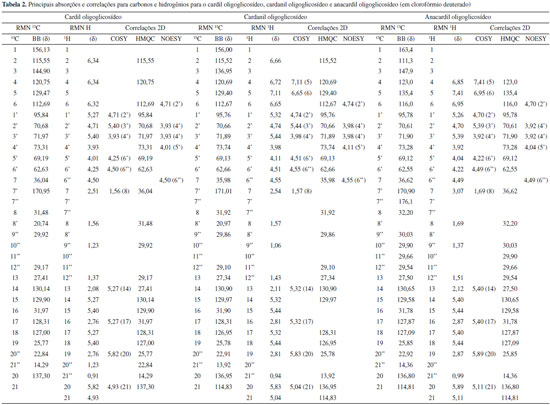
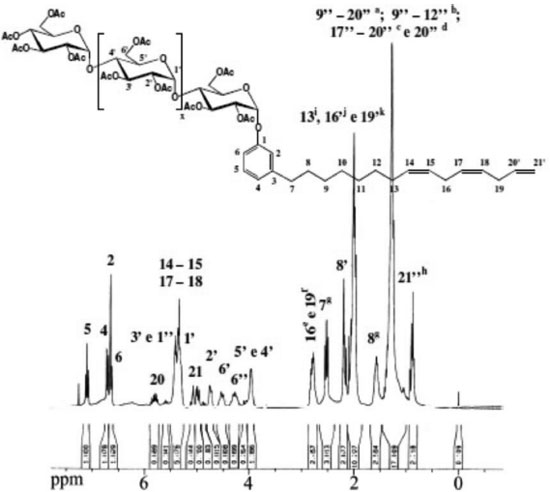
RESULTADOS E DISCUSSAO Espectroscopia de absorçao na regiao do infravermelho (FTIR) A acetilaçao da amilose foi confirmada pelo aparecimento de quatro bandas características dos grupos acetilas39 (1751 cm-1, 1365 cm-1, 1234 cm-1 e 1036 cm-1). A banda fraca em torno de 3500 cm-1 ocorreu, provavelmente, devido a grupos OH remanescentes na molécula, considerando-se que o grau de substituiçao (GS) do polímero foi de ~2,8. As atribuiçoes das bandas características mais representativas para os alquilfenil glicosídeos foram:40 Cardil: FTIR/KBr (cm-1) - 3449 (νOH); 2926, 2847 (νCH2); 1455 (δCH2, δCH3); 1368 (δCH2); 1150 (νC-O); 951 (δCH alceno), 899 (νC1H); 776 (δCH, 3H adj.); Cardanil: FTIR/KBr (cm-1) - 3474 (νOH); 2926, 2848 (νCH2); 1438 (δCH2, δCH3); 1368 (δCH2); 1229 (νC-O, ωCH2, τCH2); 1150 (νC-O); 942 (δCH alceno), 899 (νC1H); 750 (δCH, 4H adj.); Anacardil: FTIR/KBr (cm-1) - 3474 (νOH); 2952, 2848 (νCH2); 1751 (νC=O); 1646 (νC=C); 1438 (δCH2, δCH3); 1378 (δCH2); 1211 (νC-O, ωCH2, τCH2); 1133 (νC-O); 951 (δCH alceno), 899 (νC1H); 760 δCH, 3H adj.). A condensaçao das partes hidrófilicas e hidrofóbicas foi confirmada pelas bandas do carbono anomérico em 946 e 899 cm-1 e pela presença das bandas relativas aos grupos acetilas em 1759 cm-1. O isolamento e purificaçao foram confirmados pelas técnicas CCD e GPC. Grau de substituiçao (GS) e percentagem de acetilaçao (PA) A percentagem de acetilaçao (PA) foi calculada usando a Eq. 132 obtendo-se uma percentagem de acetilaçao de aproximadamente 43%. O grau de substituiçao (GS) dos malto oligosacarídeos peracetilados obtidos a partir da acetólise do triacetato de amilose foi determinado por titulaçao de retorno pela Eq. 231 e por RMN 1H pela Eq. 333 e o valor encontrado foi de 2,8 em ambos os métodos empregados. Cromatografia de permeaçao em gel (GPC) Notou-se três picos com uma distribuiçao de massa unimodal nos cromatogramas de GPC para o LCC técnico e para o cardanol (Figura 1S). Observam-se ainda dois ombros no cromatograma para o LCC técnico. O pico em 21,76 mL foi atribuído ao cardanol. Os outros observados foram um a 23,71 mL e outro a 25,98 mL, sendo este último também observado para o cardanol técnico.41 Notou-se dois picos com uma distribuiçao de massa unimodal nos cromatogramas de GPC para os alquilfenil poliglicosídeos sintetizados (Figuras 2S-4S). Observa-se ainda um ombro no primeiro pico dos cromatogramas para o anacardil e cardil. Os ombros observados nos cromatogramas de GPC do anacardil e cardil provavelmente se devem ao fato de os cromatogramas possuírem baixa resoluçao, seletividade e eficiência ruins (uma seletividade ruim implica que os picos nao se separam suficientemente enquanto que uma eficiência ruim implica em picos largos), por isso, nao houve a separaçao dos picos e, sendo assim, observou-se apenas um pico e um ombro ao invés de dois picos. Os dois principais picos observados no cromatograma GPC do anacardil poliglicosídeo foram em torno de 20,2 e 23,4 mL (Figura 2S). Os principais picos do cromatograma GPC para o cardil poliglicosídeo foram 20,3 e 23,5 mL e os dois picos correspondentes para o cardanil poliglicosídeos foram 21,1 e 23,6 mL. Análise térmica (TGA e DSC) As curvas TGA para LCC, cardanol e cardol naturais exibiram eventos principais em 283 ºC, 252 ºC e 235 ºC respectivamente42,43 (Figura 5S). O LCC apresentou outro evento em aproximadamente 208 ºC, mostrando que o cardol e o cardanol sao mais estáveis do que o próprio LCC. Isto pode ser explicado com base nas diferenças estruturais. Os dados indicam que à medida que o percentual de compostos insaturados nos constituintes do LCC aumenta, as temperaturas dos eventos principais de decomposiçao (TD1) diminuem, indicando o efeito da composiçao no comportamento térmico. A menor estabilidade do LCC pode ser explicada levando-se em consideraçao que seu componente majoritário é o ácido anacárdico (aprox. 90%), o qual apresenta um processo de descarboxilaçao em aproximadamente 180-200 ºC (ver ombro "208 ºC" na curva DTGA na Figura 6S). Nas curvas TGA e DTGA, o primeiro evento está associado à perda de voláteis, enquanto que o segundo e o terceiro evento estao associados aos processos de decomposiçao propriamente ditos. Para os surfactantes no estado puro, inicialmente, precede a etapa de decomposiçao a quebra da estrutura supramolecular, isto é, a ruptura de ligaçoes de hidrogênio entre os grupos cabeça e as forças de van der Waals entre as caudas hidrofóbicas. Os valores encontrados sugerem uma interaçao intermolecular maior nos agregados puros dos surfactantes cardil (156 ºC) e anacardil (155 ºC) do que no cardanil (150 ºC). Os valores ligeiramente maiores para o anacardil e cardil oligoglicosideos foram associados às diferenças estruturais, uma vez que os surfactantes, além da cadeia hidrocarbônica no C-3, apresentam grupos substituintes diferentes no anel benzênico. Comparando-se os glicosídeos e materiais de partida, observou-se um comportamento térmico completamente diferente para os glicosídeos (Figuras 7S e 8S): as temperaturas de pico (DTGA) nos dois principais eventos de decomposiçao dos surfactantes sao bem menores (diferença cerca de 60-120 ºC na primeira etapa de decomposiçao) que aquelas correspondentes para os respectivos materiais de partida (Figuras 5S-6S). Isto está associado à formaçao de mesofases (cristais líquidos sensíveis a mudanças de temperatura e concentraçao do solvente) devido à segregaçao das partes hidrofílicas e hidrofóbicas dos surfactantes nos agregados antes que qualquer processo de decomposiçao seja iniciado. A "ausência" de "ordem" nos "cristais" dos surfactantes torna-os mais susceptíveis a decomposiçao e por isso se decompoem a temperaturas mais baixas do que os respectivos materias de partida. As curvas DSC para os materiais de partida mostram que o cardol natural (163,1 ºC) entra em ebuliçao a uma temperatura menor do que aquelas para o cardanol natural (205,7 ºC) e ácido anacárdico (218,4 ºC) (Figura 9S). Como estes materiais sao misturas de compostos com diferentes graus de insaturaçoes, o menor ponto de ebuliçao do cardol pode ser explicado com base na composiçao destes materiais, uma vez que o número de ligaçoes duplas em um determinado material determina sua fluidez. Como se sabe da literatura, a maior composiçao de dieno e trieno é encontrada no cardol e cardanol, apresentando o cardol um maior percentual destes constituintes, o que justifica menores temperaturas de ebuliçao para o cardol e cardanol, respectivamente. Como o ácido anacárdico tem percentuais menores destes constituintes insaturados ele apresenta um valor de Te bem maior (Te cardol < Te cardanol < Te ác. anacárdico). Dados da literatura mostram que, para o cardanil poliglicosídeo, cujo grau de insaturaçao varia de 0 a 3, Tf varia de 143 a 96 ºC e Tg-l varia de 77,8 a -25,4 ºC respectivamente, devido ao aumento na fluidez das cadeias com o aumento do grau de insaturaçoes.44 Neste trabalho verificou-se que Tf varia entre 131,7 a 126,2 ºC, enquanto que Tg-l varia de 77,9 a 70 ºC (Figura 10S). Comparando-se os valores de Tf e Tg-l dos cardanil glicosídeos sintetizados pelo grupo de Shimizu44 com os valores encontrados para os cardil, cardanil e anacardil oligoglicosídeos sintetizados neste trabalho, podemos observar que os valores de Tg-l para cardil, cardanil e anacardil oligoglicosídeos (77,9 ºC, 66,6 ºC e 72,6 ºC respectivamente) estao próximos daquele do cardanil glicosídeo saturado (77,8 ºC). Entretanto, os valores de Tf (Figura 10S) (131,3 ºC, 131,7 ºC e 126,2 ºC respectivamente) estao próximos daquele para o cardanil glicosídeo monoeno (132,0 ºC). Difraçao de raios-X Observa-se que o pó do cardil oligoglicosídeo mostra-se mais cristalino que o cardanil oligoglicosídeo. A Figura 11S mostra os padroes de difraçao de raios-X para a amilose, anacardato de cálcio, cardil oligoglicosídeo, e cardanil oligoglicosídeo. Observou-se que os difratogramas das amostras dos alquilfenil oligoglicosídeos exibiram picos de difraçao característicos de porçoes oligossacarídicas (11,4º a 22,8º) e lipídicas (26,7º a 45,7º respectivamente. Picos de difraçao característicos de amilose de baixo peso molecular, semelhantes àqueles encontrados na literatura,45 foram observados tanto na amilose utilizada neste trabalho quanto nos seus derivados alquilfenil glicosídicos obtidos a partir do hidrolizado desta. Estes picos estao situados em: 2θ = 11,6º, 15,1º, 17,0º, 19,6º, e 22,8º. Também foram observados nas amostras dos surfactantes picos característicos da porçao hidrofóbica, semelhantes àqueles encontrados no anacardato de cálcio46 em 2θ = 28,7º, 29,4º, 34,2º, 36,0º, 39,5º, 43,2º e 47,2º. Ressonância Magnética Nuclear (RMN) Os principais sinais de absorçao de RMN 1H e 13C (Figuras 1-4) observados nos espectros dos alquilfenil oligoglicosídeos estao listados na Tabela 247 e os principais sinais de absorçao de RMN 1H e 13C para o LCC natural e seus constituintes estao listados na Tabela 1.
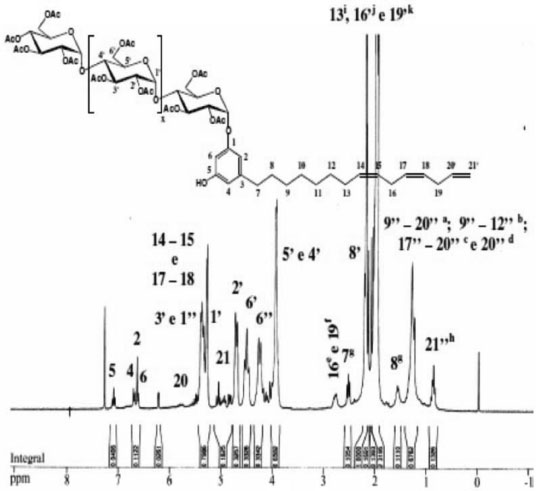 Figura 2. Espectro RMN 1H do Cardil oligoglicosídeo em clorofórmio deuterado
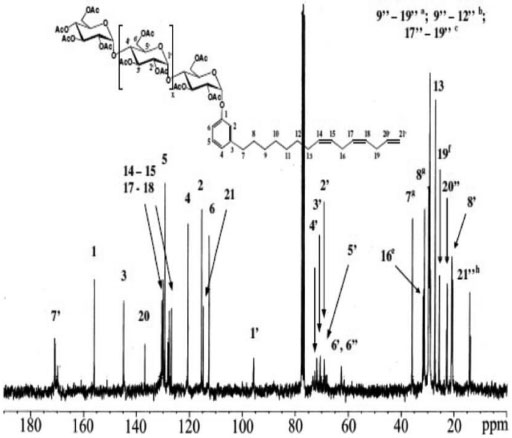 Figura 3. Espectro RMN 13C do Cardanil oligoglicosídeo em clorofórmio deuterado
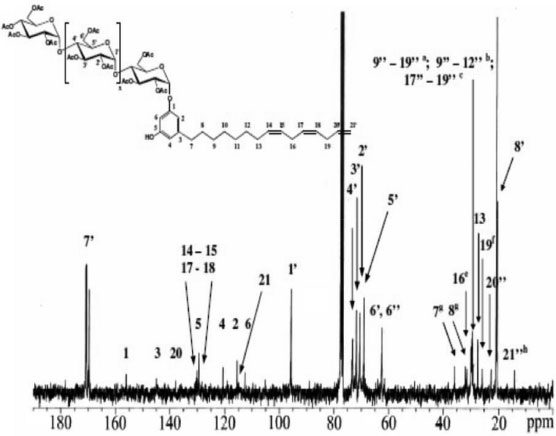 Figura 4. Espectro RMN 13C do Cardil oligoglicosídeo em clorofórmio deuterado
Os espectros de correlaçao, COSY (Figuras 5) e HMQC (Figuras 6), foram poderosas ferramentas na elucidaçao das estruturas dos surfactantes sintetizados. As principais correlaçoes 2D estao na Tabela 2.
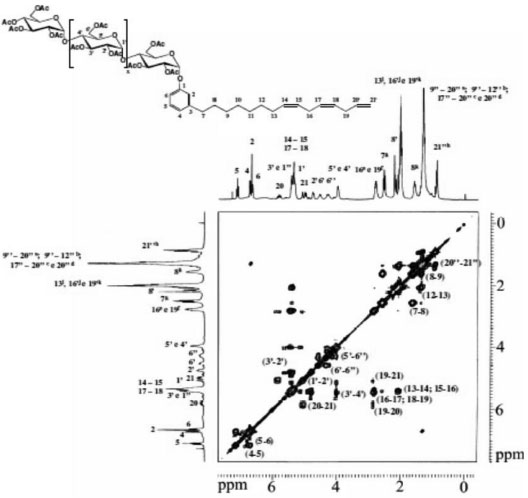 Figura 5. Espectro COSY do Cardanil oligoglicosídeo em clorofórmio deuterado
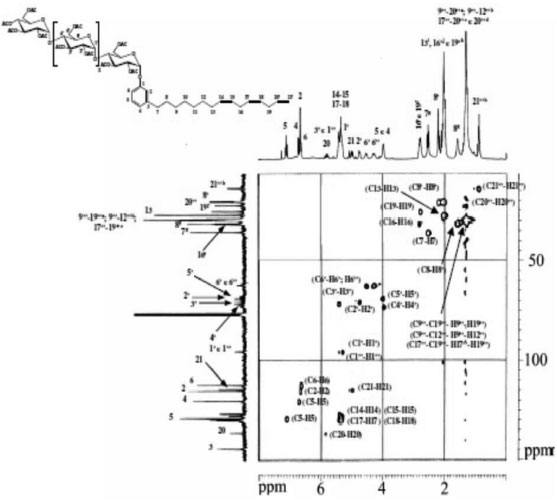 Figura 6. Espectro HMQC do Cardanil oligoglicosídeo em clorofórmio deuterado
Os picos cruzados do espectro NOESY mostraram que a conformaçao preferida das unidades glicosídicas nos grupos cabeça sao do tipo 4C1 com uma configuraçao anomérica α. No espectro NOESY (Figura 7) foram observadas as seguintes relaçoes espaciais (valores em ppm): unidades glicosídicas: (5,32 - 4,74; H1' - H2'); (5,44 - 4,11; H3' - H5'); (5,32 - 3,98; H1' - H4'); (4,54 - 4,31; H6' - H6''); (4,74 - 3,98; H2'- H4').
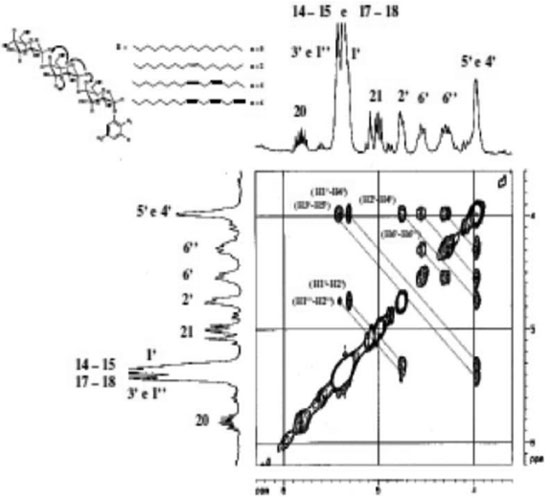 Figura 7. Expansao do espectro NOESY para o Cardanil oligoglicosídeo (grupo cabeça) em clorofórmio deuterado
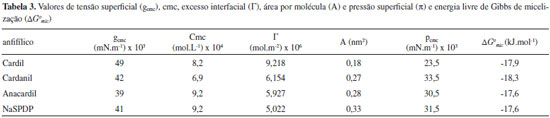
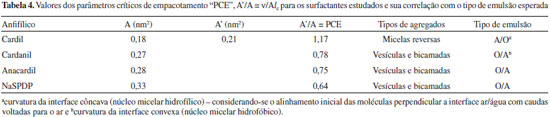
Comportamento de agregaçao em soluçao Os dados da Tabela 3 mostram que os valores de cmc (8,2 x 10-4 mol/L-1; 6,9 x 10-4 mol/L-1; 9,2 x 10-4 mol/L-1 e 9,2 x 10-4 mol/L-1) variam quando a estrutura do surfactante é modificada, indicando o efeito das estruturas dos surfactantes no comportamento de agregaçao. O cardanil apresentou menor valor de cmc seguido pelo cardil, anacardil e sal de sódio do cardanol sulfonado (cmccardanil< cmccardil< cmcanacardil ≈ cmcsal de sódio do cardanol sulfonado). Os valores de ΔGomic foram -17,9 kJ mol-1, -18,3 kJ mol-1, -17,6 kJ mol-1 e -17,6 kJ mol-1 para cardil, cardanil, anacardil e sal de sódio do cardanol sulfonado respectivamente (ΔGomic cardanil < ΔGomic cardil < ΔGomic anacardil ≈ ΔGomic sal de sódio do cardanol sulfonado), o que indica que o cardanil glicosídeo forma micelas mais espontaneamente do que o cardil e este forma micelas mais espontaneamente do que o anacardil. Já o processo de formaçao de micelas do anacardil e do sal de sódio do cardanol sulfonado apresentam a mesma espontaneidade, pois apresentam o mesmo valor da energia livre de Gibbs. Os dados de área por molécula (A) indicam que os surfactantes anacardil oligoglicosídeo e cardanil oligoglicosídeo ocupam na interface áreas aproximadamente 1,6 e 1,5 vezes maiores do que aquela do surfactante cardil oligoglicosídeo, respectivamente, e o sal de sódio do cardanol sulfonado apresenta área 1,8 vezes maior do que a do cardil (Acardil < Acardanil < Aanacardil < Asal de sódio do cardanol sulfonado). Isto revela um empacotamento mais denso, demonstrando uma maior interaçao das moléculas do surfactante cardil nos agregados formados em soluçao. Como o sal de sódio do cardanol sulfonado apresenta um grupo volumoso no C-4 (Figura 13S) próximo à cadeia alquílica, devido a dissociaçao do sal, este grupo encontra-se muito mais hidratado, prevalecendo as forças de hidrataçao repulsivas aumentando a área disponível para a molécula surfactante. O anacardil oligoglicosídeo apresenta maior valor de A do que o cardil oligoglicosídeo, pois apresenta um grupo carboxílico volumoso no C-2 (Figura 13S), o qual, devido à ionizaçao, deve estar mais hidratado, enquanto que o cardil oligoglicosídeo apresenta apenas uma hidroxila pequena e nao ionizável no C-5 (Figura 13S) que provavelmente deve estar menos hidratada. Na cmc do anacardil oligoglicosídeo existem menos moléculas deste por área interfacial, pois possui maior valor de A e, por conseguinte, o maior valor de cmc em relaçao ao cardil oligoglicosídeo, o qual possui menor A e, por isso, deve haver mais moléculas deste por área interfacial, justificando o menor valor de cmc. Já o cardanil oligoglicosídeo nao apresenta nenhum grupo no C-2 e C-5 (Figura 13S) e, desta forma, deve estar menos hidratado do que o anacardil oligoglicosídeo e o cardil oligoglicosídeo e, por isso, este possui menor valor de A do que o Anacardil oligoglicosídeo. No entanto, ele deveria ter valor de A menor do que a do cardil oligoglicosídeo também, o que nao foi observado. Tal resultado deve-se, provavelmente, ao fato do cardil oligoglicosídeo estar mais intimamente empacotado, já que possui uma hidroxila no C-5 que favorece a formaçao de ligaçoes de hidrogênio intermolecular, favorecendo um maior empacotamento e, portanto, menor área deste. A Tabela 4 apresenta os dados dos parâmetros críticos de empacotamento (PCE) e sua correlaçao com os tipos de agregados formados. Os valores de PCE indicam que o sal de sódio do cardanol sulfonado forma agregados com empacotamento menos denso do que o anacardil, e este forma agregados com empacotamento menos denso do que o cardanil, que, por sua vez, forma agregados com empacotamento menos denso do que o cardil (PCEsal de sódio do cardanol sulfonado < PCEanacadil < PCEcardanil < PCEcardil). Os valores de PCE indicam que os tipos de agregados preferenciais sao do tipo bicamadas e/ou vesículas as quais sao estruturas intermediárias que antecedem a formaçao de nanoestruturas do tipo: nanofios, nanofitas, nanolâminas e/ou tubos dependendo das estruturas dos grupos hidrofílico e hidrofóbico e do número de insaturaçoes neste último.44
Os possíveis tipos de agregados formados pelos surfactantes previstos pelos valores de PCE sao consistentes com os dados reportados na literatura. Considerando o modelo micelar proposto pela literatura e tendo como base os dados obtidos das isotermas de tensao superficial versus logaritmo natural da concentraçao, foi proposto um modelo micelar para os surfactantes sintetizados evidenciando o efeito da estrutura dos oligoglicosídeos no comportamento de agregaçao (Figura 14S). Como os grupos carboxila e hidroxila no anacardil e cardil, respectivamente, sao hidrofílicos, considerou-se que os grupos fenilas destes estariam mergulhados no manto hidrofílico, enquanto que o grupo fenila do cardanil estaria mergulhado no núcleo hidrofóbico, o que justificaria a repulsao hidrofóbica entre estes no núcleo micelar e, portanto, maior área para o cardanil oligoglicosíeo relativamente ao cardil. Com base em dados da literatura a previsao da formaçao de nano estruturas para estes materiais nao é mera especulaçao, uma vez que já é experimentalmente comprovado que glicosídeos (sintéticos ou naturais) com grupos alquil fenílicos de cadeia longa contendo uma, duas ou três ligaçoes duplas cis, tal como nos surfactantes sintetizados neste trabalho, naturalmente formam nano estruturas.48,49
CONCLUSAO A ressonância magnética nuclear comprovou a formaçao dos alquilfenil glicosídeos, uma vez que nos espectros foram observados picos de absorçao característicos de carbonos e prótons alifáticos, olefínicos e aromáticos. Os picos cruzados do espectro bidimensional nuclear overhauser effect spectroscopy (NOESY) mostraram que a conformaçao preferida das unidades glicosídicas nos grupos cabeça sao do tipo 4C1 com uma configuraçao anomérica α. O comportamento térmico dos materiais de partida e dos surfactantes mostra que os últimos sao menos estáveis termicamente. Verificou-se a seguinte ordem de estabilidade térmica: Cardanol > Cardol > Líquido da casca da castanha de caju natural (LCCn) > Cardil ≈ Anacardil > Cardanil. O estudo da isoterma de tensao superficial versus logaritmo natural da concentraçao indicou que o comportamento de agregaçao dos alquilfenil glicosídeos é dependente de suas características estruturais. O cardanil apresentou menor valor de concentraçao micelar crítica (cmc) seguido pelo cardil, anacardil e sal de sódio do cardanol sulfonado (cmccardanil < cmccardil < cmcanacardil ≈ cmcsal de sódio do cardanol sulfonado). A ausência de um mínimo nas curvas que representam as isotermas de tensao superficial versus ln da concentraçao indica a pureza dos surfactantes. Os valores de energia livre de Gibbs de micelizaçao (ΔGomic) indicam que o cardanil glicosídeo forma micelas mais espontaneamente do que o cardil e este forma micelas mais espontaneamente do que o anacardil. Já o processo de formaçao de micelas do anacardil e do sal de sódio do cardanol sulfonado apresentam a mesma espontaneidade, pois apresentam o mesmo valor de ΔGomic (ΔGomic cardanil < ΔGomic cardil < ΔGomic anacardil ≈ ΔGomic sal de sódio do cardanol sulfonado). Os valores de área por molécula (A) indicam que os cardil oligoglicosídeos provavelmente formam agregados menores do que os cardanil e anacardil oligoglicosídeos, e o sal de sódio do cardanol sulfonado apresenta área por molécula maior do que os demais surfactantes (Acardil < Acardanil < Aanacardil < Asal de sódio do cardanol sulfonado). Os valores de parâmetro crítico de empacotamento (PCE) indicam que o sal de sódio do cardanol sulfonado forma agregados com empacotamento menos denso do que o anacardil e este forma agregados com empacotamento menos denso do que o cardanil e o cardanil forma agregados com empacotamento menos denso do que o cardil (PCEsal de sódio do cardanol sulfonado < PCEanacadil < PCEcardanil < PCEcardil). Consideraçoes teóricas sobre os dados de PCE indicam que os principais tipos de agregados sao do tipo vesículas e bicamadas, indicando a possibilidade da formaçao de nanotubos por autoassociaçao, uma vez que estas estruturas sao intermediárias que antecedem a formaçao de nanoestruturas em soluçao.
MATERIAL SUPLEMENTAR Algumas imagens dos sistemas utilizados neste trabalho e detalhes da síntese dos alquilfenil glicosídeos estao disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS CNPq, CAPES, Departamento de Química Orgânica e Inorgânica da Universidade Federal do Ceará (DQOI-UFC).
REFERENCIAS 1. Valente, A. J. M.; Nilsson, M.; Söderman, O.; J. Colloid Interface Sci. 2005, 281, 218. DOI: http://dx.doi.org/10.1016/j.jcis.2004.08.018 PMID: 15567399 2. Fischer, E.; Ber. Dtsch. Chem. Ges. 1893, 26, 2400. DOI: http://dx.doi.org/10.1002/cber.18930260327 3. Zhang, F.; Gu, W.; Xu, P.; Tang, S.; Xie, K.; Huang, X.; Huang, Q.; Waste Manage. 2011, 31, 1333. DOI: http://dx.doi.org/10.1016/j.wasman.2011.02.002 4. Yuan, Z. Q.; Tang, S. X.; Zeng, B.; Wang, M.; Tan, Z. L.; Sun, Z. H.; Zhou, C. S.; Han, X. F.; Bamikole, M. A.; J. Anim. Sci. 2010, 88, 3984. DOI: http://dx.doi.org/10.2527/jas.2009-2397 PMID: 20709873 5. Charbonnier, V.; Morrison, B. M.; Paye, M.; Maibach, H. I.; Food Chem. Toxicol. 2001, 39, 279. DOI: http://dx.doi.org/10.1016/S0278-6915(00)00132-0 PMID: 11278060 6. Effendy, I.; Maibach, H. I.; Contact Dermatitis 1995, 33, 217. DOI: http://dx.doi.org/10.1111/j.1600-0536.1995.tb00470.x PMID: 8654070 7. Desai, S. G.; Hessel, J. F.; Urfer, A. D.; Allen, C. B.; Fischer, S. A.; US5605683A 1997. 8. Rybinski, W. V.; Hill, K.; Angew. Chem., Int. Ed. 1998, 37, 1328. DOI: http://dx.doi.org/10.1002/(SICI)1521-3773(19980605)37:10<1328::AID-ANIE1328>3.3.CO;2-0 9. Lalitha, K.; Muthusamy, K.; Prasad, Y. S.; Vemula, P. K.; Nagarajan, S.; Carbohydr. Res. 2015, 402, 158. DOI: http://dx.doi.org/10.1016/j.carres.2014.10.008 PMID: 25498016 10. Gedam, P. H.; Sampathkumaran, P. S.; Prog. Org. Coat. 1986, 14, 115. DOI: http://dx.doi.org/10.1016/0033-0655(86)80009-7 11. Tyman, J. H. P.; Bruce, I. E.; J. Surfactants Deterg. 2003, 6, 291. DOI: http://dx.doi.org/10.1007/s11743-003-0272-3 12. Fua, C.; Liua, J.; Xia, H.; Shen, L.; Prog. Org. Coat. 2015, 83, 19. DOI: http://dx.doi.org/10.1016/j.porgcoat.2015.01.020 13. Darroman, E.; Durand, N.; Boutevin, B.; Caillol, S.; Prog. Org. Coat. 2015, 83, 47. DOI: http://dx.doi.org/10.1016/j.porgcoat.2015.02.002 14. Swain, J.; Kamalraj, M.; Rao, H. S. P.; Mishra, A. K.; J. Mol. Struct. 2015, 1081, 124. DOI: http://dx.doi.org/10.1016/j.molstruc.2014.10.013 15. Kang, H.; Choi, Y. S.; Hong, H.; Ko, T.; Kang, D.; Lee, J. C.; Eur. Polym. J. 2014, 61, 13. DOI: http://dx.doi.org/10.1016/j.eurpolymj.2014.09.019 16. Garg, M. S.; Srivastava, K.; Srivastava, D.; Prog. Org. Coat. 2015, 78, 307. DOI: http://dx.doi.org/10.1016/j.porgcoat.2014.08.004 17. Massaro, M.; Colletti, C. G.; Noto, R.; Riela, S.; Poma, P.; Guernelli, S.; Parisi, F.; Milioto, S.; Lazzara, G.; Int. J. Pharm. 2015, 478, 476. DOI: http://dx.doi.org/10.1016/j.ijpharm.2014.12.004 PMID: 25498322 18. Pakpayat, N.; Nielloud, F.; Fortuné, R.; Tourne-Peteilh, C.; Villarreal, A.; Grillo, I.; Bataille, B.; Eur. J. Pharm. Biopharm. 2009, 72, 444. DOI: http://dx.doi.org/10.1016/j.ejpb.2009.01.005 PMID: 19462481 19. Guilbot, J.; Kerverdo, S.; Milius, A., Escola, R.; Pomrehn, F.; Green Chem. 2013, 15, 3337. DOI: http://dx.doi.org/10.1039/c3gc41338a 20. Shimizu, T.; John, G.; Fukagawa, A.; Ito, K.; Frusawa, H.; Int. J. Nanosci. 2002, 1, 465. DOI: http://dx.doi.org/10.1142/S0219581X02000516 21. Garkal, D. J.; Bhande, R. S.; International Journal of Innovations in Engineering Research and Technology 2014, 1, 1. 22. Tyman, J. H. P.; Johnson, R. A.; Muir, M.; Rokhgar, R.; J. Am. Oil Chem. Soc. 1989, 66, 553. DOI: http://dx.doi.org/10.1007/BF02885447 23. Paramashivappa, R.; Kumar, P. P.; Vithayathil, P. J.; Rao, A. S.; J. Agric. Food Chem. 2001, 49, 2548. DOI: http://dx.doi.org/10.1021/jf001222j PMID: 11368634 24. Kumar, P. P.; Paramashivappa, R.; Vithayathil, P. J.; Rao, P. V. S.; Rao, A. S.; J. Agric. Food Chem. 2002, 50, 4705. DOI: http://dx.doi.org/10.1021/jf020224w 25. Whistler, R. L.; Smith, R. J.; BeMiller, J. N.; Wolfrom, M. L.; Methods in Carbohydrate Chemistry, Academic Press Inc.: New York, 1964. 26. Golachowski, A.; Zieba, T.; Zeberska, M. K.; Drozdz, W.; Gryszkin, A.; Grzechac, M.; Food Chem. 2015, 176, 350. DOI: http://dx.doi.org/10.1016/j.foodchem.2014.12.060 PMID: 25624243 27. Colussi, R.; Halal, S. L. M. E.; Pinto, V. Z.; Bartz, J.; Gutkoski, L. C.; Zavareze, E. R.; Dias, A. R. G.; LWT -- Food Sci. Technol. 2015, 62, 1076. DOI: http://dx.doi.org/10.1016/j.lwt.2015.01.053 28. Tejeda, Y. V. G.; Moreno, Y. S.; Bustos, F. M.; Food Bioprod. Process. 2015, 94, 717. DOI: http://dx.doi.org/10.1016/j.fbp.2014.10.003 29. Shogren, R. L.; Carbohydr. Polym. 1996, 29, 51. DOI: http://dx.doi.org/10.1016/0144-8617(95)00145-X 30. Uzawa, H.; Zeng, X.; Shimizu, T.; John, G.; Minoura, N.; EP1512750A1 2005. 31. Han, F.; Gao, C.; Liu, M.; Huang, F.; Zhang, B.; Int. J. Biol. Macromol. 2013, 59, 372. DOI: http://dx.doi.org/10.1016/j.ijbiomac.2013.04.080 PMID: 23664930 32. Colussi, R.; Pinto, V. Z.; Halal, S. L. M. E.; Vanier, N. L.; Villanova, F. A.; Silva, R. M.; Zavareze, E. R.; Dias, A. R. G.; Carbohydr. Polym. 2014, 103, 405. DOI: http://dx.doi.org/10.1016/j.carbpol.2013.12.070 PMID: 24528747 33. Elomaa, M.; Asplund, T.; Soininen, P.; Laatikainen, R.; Peltonen, S.; Hyvärinen, S.; Urtti, A.; Carbohydr. Polym. 2004, 57, 261. DOI: http://dx.doi.org/10.1016/j.carbpol.2004.05.003 34. Coppola, L.; Gordano, A.; Procopio, A.; Sindona, G.; Colloids Surf., A 2002, 196, 175. DOI: http://dx.doi.org/10.1016/S0927-7757(01)00865-2 35. Söderberg, I.; Drummond, C. J.; Furlong, D. N.; Godkin, S.; Matthews, B.; Colloids Surf., A 1995, 102, 91. DOI: http://dx.doi.org/10.1016/0927-7757(95)03250-H 36. Israelachvili, J. N.; Colloids Surf., A 1994, 91, l. DOI: http://dx.doi.org/10.1016/0927-7757(94)02743-9 37. Binks, B. P.; Curr. Opin. Colloid Interface Sci. 2002, 7, 21. DOI: http://dx.doi.org/10.1016/S1359-0294(02)00008-0 38. Bazito, R. C.; Seould, O. A. E.; Langmuir 2002, 18, 4362. DOI: http://dx.doi.org/10.1021/la0117552 39. Xu, Y.; Miladinov, V.; Hanna, M. A.; Cereal Chem. 2004, 81, 735. DOI: http://dx.doi.org/10.1094/CCHEM.2004.81.6.735 40. Yui, H.; Guo, Y.; Koyama, K.; Sawada, T.; John, G.; Yang, B.; Masuda, M.; Shimizu, T.; Langmuir 2005, 21, 721. DOI: http://dx.doi.org/10.1021/la040109a PMID: 15641846 41. Fu, C.; Liu, J.; Xia, H.; Shen, L.; Prog. Org. Coat. 2015, 83, 19. DOI: http://dx.doi.org/10.1016/j.porgcoat.2015.01.020 42. Papadopoulou, E.; Chrissafis, K.; Thermochim. Acta 2011, 512, 105. DOI: http://dx.doi.org/10.1016/j.tca.2010.09.008 43. Wilson, L.; Yang, W.; Blasiak, W.; John, G. R.; Mhilu, C. F.; Energy Convers. Manage. 2011, 52, 191. DOI: http://dx.doi.org/10.1016/j.enconman.2010.06.058 44. John, G.; Jung, J. H.; Masuda, M.; Shimizu, T.; Langmuir 2004, 20, 2060. DOI: http://dx.doi.org/10.1021/la030177h PMID: 15835651 45. Chung, H. J.; Jeong, H. Y.; Lim, S. T.; Carbohydr. Polym. 2003, 54, 449. DOI: http://dx.doi.org/10.1016/j.carbpol.2003.05.001 46. Guo, Y.; Yui, H.; Minamikawa, H.; Masuda, M.; Kamiya, S.; Sawada, T.; Ito, K.; Shimizu, T.; Langmuir 2005, 21, 4610. DOI: http://dx.doi.org/10.1021/la046906q PMID: 16032879 47. John, G.; Jung, J. H.; Minamikawa, H.; Yoshida, K.; Shimizu, T.; Chem. - Eur. J. 2002, 8, 5494. DOI: http://dx.doi.org/10.1002/1521-3765(20021202)8:23<5494::AID-CHEM5494>3.0.CO;2-P 48. Jung, J. H.; John, G.; Yoshida, K.; Shimizu, T.; J. Am. Chem. Soc. 2002, 124, 10674. DOI: http://dx.doi.org/10.1021/ja020752o PMID: 12207520 49. Balachandran, V. S.; Jadhav, S. R.; Vemula, P. V.; John, G.; Chem. Soc. Rev. 2013, 42, 427. DOI: http://dx.doi.org/10.1039/C2CS35344J PMID: 23114456 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access