Artigo
|
|
| Carcinogenicidade de hidrocarbonetos policíclicos aromáticos Carcinogenicity of polycyclic aromatic hydrocarbons |
|
Douglas L. Bernardo*; Karina A. Barros; Renato C. Silva; Antonio C. Pavao
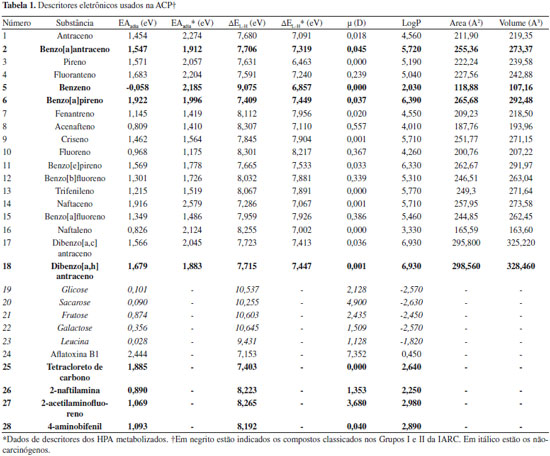
Departamento de Química Fundamental, Universidade Federal de Pernambuco, 50740-540 Recife - PE, Brasil Recebido em 24/11/2015 *e-mail: dougpcl@hotmail.com The assessment of the carcinogenic potential of polycyclic aromatic hydrocarbons (PAH) is obtained by a principal component analysis (PCA) and quantitative structure-activity relationship (QSAR) using hydrophobic (LogP), stereo and electronic parameters (electron affinity, dipole moment and HOMO-LUMO gap) calculated from the AM1 method. The PAH-DNA interaction model is based on the unsynchronized resonating valence bond theory (RVB) developed by L. Pauling. The QSAR study reproduces the experimental values of LD50 in rats with 95% confidence. The PCA analysis classify all the selected compounds as potential carcinogens, an important result since many of these PAH are not classified as carcinogens, indicating the need for an urgent revision of its classification. INTRODUÇAO Formados na queima do material orgânico através da combustao incompleta ou pirólise de materiais, os hidrocarbonetos policíclicos aromáticos (HPA) sao uma classe de compostos exaustivamente estudados, devido principalmente ao seu potencial carcinogênico e mutagênico.1,2 A variedade de fontes de HPA, incluindo a extensa exaustao de motores a diesel ou à gasolina, queima de carvao e churrascos, resulta em misturas muito complexas, contendo grande variedade de hidrocarbonetos em diferentes níveis de concentraçao.2,3 Os HPA e seus derivados estao associados à incidência de câncer, sendo que alguns já estao incluídos nas Grupos I e II da International Agency for Research on Cancer (IARC).4 Entretanto a maioria dos HPA aqui estudados se classificam no Grupo 3 da IARC, ou seja, eles nao sao classificados quanto à sua carcinogenicidade. Neste trabalho, desenvolvemos um modelo que permite caracterizar o potencial carcinogênico destas espécies químicas utilizando parâmentros eletrônicos obtidos por cálculos de orbitais moleculares combinados a uma análise estatística multivariada de Componentes Principais (ACP) e à Relaçao Quantitativa da Estrutura-Atividade (QSAR). Trata-se de uma metodologia muito mais rápida e de baixo custo do que a verificaçao experimental, que apresenta um elevado grau de confiabilidade para a identificaçao de carcinógenos, podendo assim ser bastante útil na construçao de uma política de precauçao. Por exemplo, nossos resultados motram que aqueles HPA que estao na lista 3 do IARC precisam ser urgentemente reavaliados. Ativaçao metabólica dos HPA Os HPA nao interagem diretamente com o material genético, eles entram no organismo através da pele, boca e outros pontos de entrada, mas depois sofrem ativaçoes enzimáticas através do citocromo P450, formando metabólitos com elevada natureza eletrofílica denominados carcinógenos efetivos. Os novos compostos podem agora interagir com o DNA e RNA e possibilitar o surgimento de tumores.5 Quatro mecanismos foram propostos para elucidar a ativaçao metabólica sofrida pelos HPA no organismo até formar o metabólito que pode interagir com o material genético:6-8 (a) Oxidaçao enzimática seguida de hidrólise com a formaçao de diolepóxidos (é o mecanismo mais aceito); (b) De-hidrogenaçao enzimática que produz quinonas capazes de reagirem diretamente com o DNA ou capazes de reagirem com O2, gerando espécies oxigenadas reativas que podem atacar o DNA; (c) Formaçao de ésteres benzílicos e eletrofílicos, por meio de uma série de reaçoes de substituiçao; (d) Produçao de radicais catiônicos através da oxidaçao enzimática com envolvimento de um elétron. É importante considerar que esses mecanismos nao sao excludentes e podem ocorrer simultaneamente.5 Na Figura 1 temos o exemplo da ativaçao metabólica do benzo(a)pireno (B(a)P) com formaçao de diolepóxido que ocorre em três etapas. Uma vez formado o metabólito, é provável que ele ataque eletrofilicamente o DNA através do mecanismo S1N com a formaçao de carbocátions estáveis. Desse modo a reatividade entre o metabólito e o DNA está diretamente ligada à facilidade de formaçao dos cátions.9
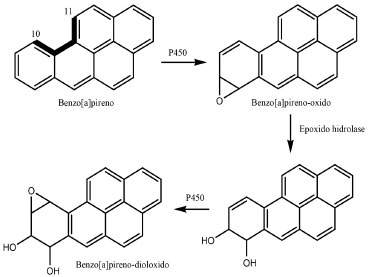 Figura 1. Ativaçao metabólica do benzo[a]pireno com formaçao de diolepóxido
Na Figura 1 o diolepóxido formado é o B(a)P-7,8-diol-9,10-epóxido (B(a)P-diolepóxido). Este metabólito possui maior tendência à carcinogenicidade em relaçao a outros metabólitos do B(a)P que possuem o anel epóxido em outras posiçoes, ou seja, a interaçao com o DNA é favorecida quando o B(a)P-7,8-diol-9,10-epóxido é formado na ativaçao metabólica. Esse comportamento é explicado pela Teoria da Baía (bay-region).10 A hipótese básica dessa teoria, é que o anel epóxido a ser formado no diol fará parte da regiao de baía dos HPA, que no caso do B(a)P fica entre as posiçoes 10 e 11, conforme podemos verificar na Figura 1. A regiao de baía é o local onde ocorre a perda da ressonância para o envelope aromático, provocando a delocalizaçao dos elétrons π, o que aumenta o caráter eletrofílico da regiao, favorecendo o processo. Como resultado desse fenômeno, a ativaçao metabólica e a ligaçao entre HPA e DNA tem maior possibilidade de ocorrer nesta regiao da estrutura. O suporte experimental para a Teoria de Baía veio de interpretaçoes dos dados sobre a carcinogenicidade dos HPA, que indicam uma reduçao do potencial carcinogênico quando sao adicionados radicais metila à regiao de baía. Para os HPA que nao possuem a regiao de baía, outros caminhos de ativaçao metabólica podem ocorrer. O naftaleno e benzeno, por exemplo, sao ativados via formaçao de quinona conforme podemos verificar na Figura 2. Esse processo ocorre em quatro etapas.7
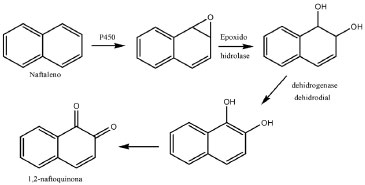 Figura 2. Ativaçao metabólica do naftaleno via formaçao de quinona
A Figura 2 mostra a ativaçao metabólica do naftaleno com formaçao do 1,2-naftoquinona (1,2-NQ). Esse metabólito apresenta natureza eletrofílica, logo ele pode se ligar covalentemente aos nucleófilos celulares de DNA e RNA.7 O benzeno é ativado metabolicamente de maneira análoga ao naftaleno, formando o catecolquinona.6 Modelo de interaçao carcinógeno-DNA Para a caracterizaçao do potencial carcinogênico de uma espécie química é necessário utilizar parâmetros que descrevam bem o processo de interaçao entre o carcinógeno efetivo e o material genético. Neste trabalho utilizaremos os parâmetros eletrônicos do modelo de interaçao DNA-carcinógeno proposto por Marcelo e Pavao,11 que combina a Teoria do Orbital Molecular de Fronteira e a Teoria da Ressonância Nao-Sincronizada das Ligaçoes Covalentes de Pauling (RVB).12 O modelo descreve a interaçao HPA-DNA como sendo uma transferência de elétron do HOMO (Orbital Ocupado de Maior Energia) da base do DNA para o LUMO (Orbital Desocupado de Menor Energia) do carcinógeno e a consequente formaçao de uma ligaçao covalente entre essas espécies. A Figura 3 mostra a interaçao entre DNA, representado pela guanina, e HPA, representado pelo B(a)P-diolepóxido, o metabólito do B(a)P.
 Figura 3. (a) Modelo de interaçao DNA-carcinógeno; (b) Formaçao da ligaçao DNA-carcinógeno
No processo de interaçao, a guanina tem caráter nucleofílico, utilizando o seu par de elétrons, enquanto que o B(a)P-diolepóxido tem caráter eletrofílico, recebendo o par de elétrons. Portanto, a interaçao será mais forte quanto maior for o caráter eletrofílico do B(a)P-diolepóxido. Já do ponto de vista da interaçao HOMO-LUMO (ΔEL-H), quanto menor a diferença de energia entre eles, mais efetiva será a interaçao (Figura 3a). O resultado da interaçao HPA-GUA é a formaçao da ligaçao covalente entre essas moléculas, formando um aduto com o material genético (Figura 3b). A ligaçao covalente entre carcinógeno e guanina pode se formar no nitrogênio-7 (N7) ou no oxigênio-6 (O6), pois esses sao os átomos mais susceptíveis ao ataque oxidante, mas de acordo com Leao e Pavao,13 o O6 possui carga negativa maior do que a do N7, sugerindo onde a ligaçao será preferencialmente formada, conforme mostrado na Figura 3b. O modelo de interaçao apresentado já foi utilizado com sucesso para avaliar o potencial de várias substâncias.13-16 Análise de Componentes Principais (ACP) A ACP é uma análise muito útil para separar informaçoes importantes quando temos um grande conjunto de dados distribuídos numa série de variáveis químicas e biológicas. Sendo assim, ela é usada na escolha do conjunto de dados mais representativo de combinaçoes lineares das variáveis originais, reconhecendo assim alguns padroes que os dados possivelmente apresentam. Matematicamente, a ACP corresponde à fatoraçao da matriz X dos dados originais com n pontos (HPA) e p parâmetros. Esse procedimento consiste na diagonalizaçao da matriz de covariância XtX em que Xt é a transposiçao da matriz X. Os autovalores da ACP sao denominados pesos e representam a contribuiçao de cada eixo original na componente formada, o qual é chamado de componente principal. A PC1 (primeira componente principal) descreve o eixo de maior variância e a PC2 (segunda componente principal), ortogonal à PC1, representa o eixo com a segunda maior variância e assim por diante. Estes eixos representam um padrao que permite relacionar as variáveis com o potencial carcinogênico.16 Relaçao quantitativa estrutura-atividade (QSAR) O estudo QSAR tem como principal objetivo a construçao de modelos matemáticos que relacionem a estrutura química e a atividade biológica das substâncias.17 A açao biológica de uma substância é dependente de suas interaçoes com o meio biológico, consequentemente, é dependente de fatores relacionados com a sua estrutura química e propriedades físico-químicas. Essas propriedades, que podem ser de caráter eletrônico, hidrofóbico ou estéreo, podem ser utilizadas para prever a atividade biológica das substâncias.18 Na construçao de nosso modelo temos o conjunto de dados que contém os valores da atividade biológica Y e das m variáveis descritivas X referentes aos n compostos. O conjunto de dados será utilizado para determinar modelos matemáticos, que em geral sao lineares e multidimensionais, representados genericamente pela equaçao 1. 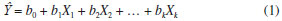 Nessa equaçao, Y representa os valores previstos da atividade biológica, X1, X2,..., Xk representam as propriedades físico-químicas e b0, b1, b2,..., bk sao os coeficientes de ajuste, que podem ser obtidos através da Regressao Linear Múltipla (RLM). Com a equaçao podemos prever a atividade biológica, como a concentraçao inibitória (IC50) e a dose letal DL50.17 Descritores A análise de componentes principais foi realizada por meio de uma comparaçao entre os HPA e espécies reconhecidamente nao-carcinógenas ou carcinógenas. Os descritores utilizados foram: coeficiente de partiçao octanol/água (logP), afinidade eletrônica ou eletroafinidade do carcinógeno efetivo (EA) e o gap HOMO-LUMO (ΔEL-H). Nessa análise os valores de logP dos HPA foram calculados a partir das estruturas dos HPA nao metabolizados, enquanto que os valores de EAadia e ΔEL-H utilizados foram calculados a partir das estruturas dos metabólitos. A combinaçao de dados teve a finalidade de refinar o modelo teórico, visto que a estrutura que irá interagir diretamente com o HPA é o metabólito final. No estudo QSAR foram utilizados os parâmetros de área superficial, volume molecular, LogP, EAadia e ΔEL-H. A variável dependente empregada como atividade biológica foi o DL50, que expressa a toxicidade aguda do composto. Estes descritores foram selecionados para o estudo da ACP e do QSAR porque descrevem bem processos básicos, como a entrada e o transporte do carcinógeno no meio celular, o acoplamento do composto com o receptor e a interaçao química com o DNA (guanina). O logP é um parâmetro hidrofóbico que descreve o transporte do HPA no meio biológico e sua facilidade de interaçao com a membrana celular, portanto, a facilidade dessa substância em penetrar na célula. O volume molecular e a área superficial sao parâmetros estéreos que podem ser importantes na interpretaçao dos mecanismos de interaçao entre um composto e seu receptor biológico. Os parâmetros EA e ΔEL-H descrevem a interaçao DNA-HPA de acordo com o modelo RVB de interaçao DNA-carcinógeno adotado neste trabalho. A EA descreve o caráter eletrofílico do HPA, indicando a sua facilidade em receber elétrons. Aqui ela foi calculada de forma adiabática, isto é, usando a diferença Eneutra - Eânion. A ΔEL-H foi calculada por meio da diferença de energia entre o LUMO do HPA e o HOMO da guanina, representando a interaçao entre HPA e DNA.
PROCEDIMENTO COMPUTACIONAL Os descritores eletrônicos foram obtidos a partir de cálculos semiempíricos AM1 (Austin Modelo 1)19 através do programa MOPAC 2012.20 O método AM1 é reconhecido por descrever bem as propriedades eletrônicas dos sistemas aqui estudados e o MOPAC é um dos programas implementados com métodos semiempíricos mais conhecidos, com versoes comerciais e gratuitas. O descritor logP foi calculado para todos os compostos usando o software ALOGPS 2.1 encontrado na plataforma VCCLAB,21 enquanto que ACP e QSAR foram desenvolvidos no software STATISTICA 8.0.
RESULTADOS E DISCUSSOES As estruturas químicas dos compostos estudados neste trabalho foram otimizadas e os comprimentos de ligaçao das moléculas obtidos estao em boa corcondância com os valores experimentais. Isso é uma indicaçao de que a estrutura alcançou seu estado de mínima energia na superfície de potencial e que os parâmetros eletrônicos mostrados na Tabela 1 estao bastante qualificados para a presente análise. Os compostos foram separados em três conjuntos: (i) os HPA, (as substâncias 1,2,...,18); (ii) os nao carcinógenos (substâncias 19,..., 23) e (iii) os carcinógenos (substâncias 24,...,28).
Dentre os compostos do primeiro conjunto da Tabela 1, alguns já sao classificados como carcinogênicas, por exemplo, o benzeno e o benzo[a]pireno, os quais estao classificados no Grupo I da lista da IARC, indicando que definitivamente sao carcinógenos em humanos. Contudo, a maioria dos HPA do primeiro grupo da Tabela 1 se classificam no Grupo III da IARC, ou seja, eles nao sao classificados quanto à sua carcinogenicidade. Nestes casos onde há indefiniçao sobre sua carcinogenicidade, o presente estudo teórico é muito útil, pois pode prever o potencial carcinogênico destas espécies com boa confiabilidade. O conjunto dos nao-carcinógenos e carcinógenos citados na Tabela 1 sao os padroes aqui utilizados para classificar os HPA quanto à sua carcinogenicidade. Os valores de EAadia e ΔEL-H dos metabólitos apresentados na Tabela 1 foram usados com a finalidade de refinar a Análise dos Componentes Principais. Consideramos duas vias de ativaçao metabólica: (i) oxidaçao enzimática com formaçao de diolepóxidos para aqueles HPA que possuem regiao de baía, por exemplo, o benzo[a]pireno e benzo[a]antraceno e (ii) desidrogenaçao enzimática, produzindo quinonas para aqueles HPA que nao possuem regiao de baía, por exemplo, naftaleno e benzeno. No caso dos HPA que apresentaram mais de um metabólito por ativaçao enzimática, foi usada a estrutura mais estável, com base no calor de formaçao obtido por cálculos AM1. O parâmetro logP foi incluído na ACP para descrever o transporte no meio biológico e a interaçao com a membrana celular. Uma vez que os HPA só sao ativados metabolicamente dentro da célula, no caso desse descritor foram utilizados os valores dos HPA nao metabolizados, que sao as espécies que irao interagir com a membrana celular, Os valores da EAadia listados na Tabela 1 mostram que os carcinógenos, em negrito, apresentam elevadas eletroficilicidade, indicando que eles têm maior facilidade de receber os elétrons da guanina (DNA). Esse comportamento também é verificado na comparaçao da EAadia dos HPA, isto é, os metabólitos apresentam maior eletrofilicidade do que os HPA nao metabolizados, o que sugere uma maior interaçao entre os metabólitos e o material genético. Os dados do ΔEL-H mostram que a interaçao será mais efetiva para os HPA metabolizados, uma vez que, segundo o modelo de interaçao RVB, esses compostos apresentam um menor valor para a energia de tranferência de elétron do DNA para o carcinógeno. As equaçoes 2 e 3 obtidas na ACP: 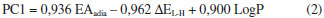 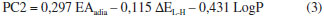 mostram que todos os parâmetros selecionados tiveram pesos significativos na PC1. Logo, todos influenciaram na separaçao dos conjuntos, com destaque para a EAadia que apresentou maior peso na PC1. Em relaçao à PC2 o parâmetro com maior peso foi o LogP, indicando que o parâmetro hidrofóbico é importante na investigaçao do potencial carcinogênico. A Figura 4 mostra os pesos que os descritores possuem nas componentes principais.
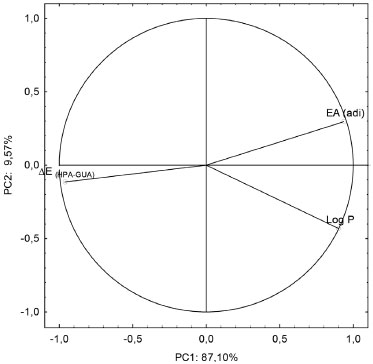 Figura 4. Pesos dos descritores nas componentes principais
Verifica-se que a PC1 e PC2, respectivamente, conseguem explicar 87,10% e 9,57% da variância total, indicando que existe uma correlaçao entre os dois descritores usados, uma vez que as duas componentes principais conseguem explicar juntas 96,67% da variância total. Outra análise importante é sobre o comportamento apresentado pelos descritores no gráfico dos pesos. A EAadia e o LogP estao localizados no lado direito da PC1, o que sugere que os compostos localizados nessa regiao do gráfico possuem altos valores para os dois parâmetros citados. A Figura 5 mostra o resultado da ACP com uma nítida separaçao das substâncias em dois grupos, nao carcinógenos e carcinógenos.
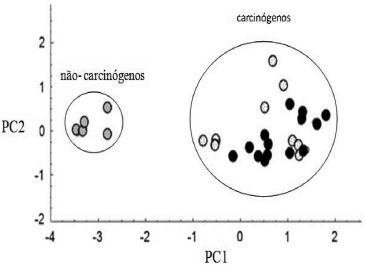 Figura 5. Resultado da ACP agrupando os HPA (preto) entre os carcinógenos
O conjunto dos nao-carcinógenos apresentou um comportamento contrário ao que é esperado para substâncias potencialmente carcinogênicas, ficando do lado esquerdo da PC1. Os compostos que pertencem a esse conjunto apresentam altos valores de ΔEL-H e baixos valores de EAadia e LogP. Já o conjunto dos carcinógenos está localizado no lado direito da PC1, ou seja, esses compostos apresentam elevado potencial para interagir com o material genético. Além desta classificaçao geral da ACP, foi realizado um estudo QSAR dos HPA visando quantificar seu potencial carcinogênico. Embora os modelos que combinam parâmetros eletrônicos (ΔEL-H e EAadia) com parâmetros estéreos (área e volume) e hidrofóbicos (LogP) tenham fornecido resultados satisfatórios, o que apresentou o melhor resultado na previsao do DL50 foi o modelo relacionando o parâmetro ΔEL-H e volume molecular, mostrado na Tabela 2.
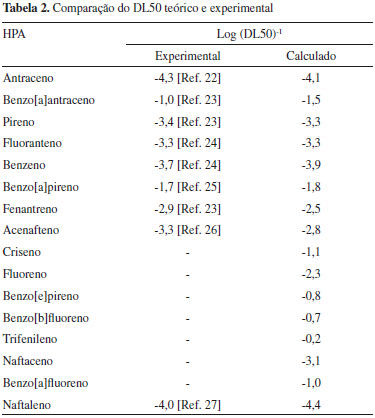
Os valores teóricos mostrados na Tabela 2 foram obtidos com o modelo representado pela equaçao 4. 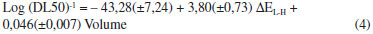 Este modelo, que passou por todos os testes de validaçao estatística, consegue prever satisfatóriamente os valores experimentais. Fluoranteno, benzo[a]pireno e pireno, por exemplo, aprensentam erros relativos de 0,7%, 3,2% e 3,2%, respectivamente. O modelo apresentou um coeficiente de determinaçao R = 0,950, indicando que existe uma boa correlaçao entre os descritores ΔEL-H e volume com a atividade biológica. No caso do coeficiente de correlaçao, o valor de R2 = 0,903 indica que o modelo consegue explicar mais de 90% da variabilidade dos dados experimentais. Em relaçao à avaliaçao do grau de significância, o modelo apresenta desvio padrao baixo (s = 0,384) e satisfaz ao teste de Ficher (F) em um nível de 95% de confiança com F(2,5)calc = 27,84 (F(2,5)Tab = 5,79), indicando que os valores obtidos sao estatisticamente confiáveis. A análise de regressao linear múltipla apresentou pontos bem alinhados em relaçao à reta de regressao, mostrando que o modelo está bem ajustado (Figura 6). Os resíduos, com valores próximos de zero, foram pontos dispersos aleatoriamente, o que sugere uma boa eficiência do modelo em reproduzir os valores eperimentais do DL50.
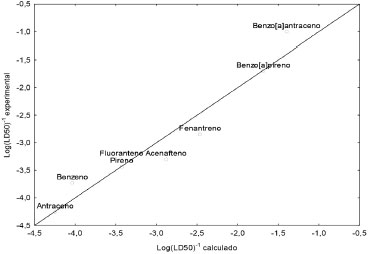 Figura 6. Relaçao linear entre os valores experimentais e calculados
Quanto ao grau de previsibilidade do modelo, foi realizada uma validaçao cruzada com exclusao de 1 ponto (leave-one-out cross-validation). A regressao apresentou um desvio padrao da validaçao cruzada (SPRESS) próximo de zero e um valor de correlaçao da validaçao cruzada (Q2) igual a 0,816, indicando que a equaçao 4 possui uma capacidade de 81,6% em prever o DL50 de HPA nao inclusos no modelo, ou seja, o modelo QSAR construído apresenta uma boa capacidade de previsao do potencial carcinogênico de espécies ainda poucos estudadas e com informaçoes insuficientes sobre a sua atividade biológica.
CONCLUSAO A presente análise ACP utilizando descritores eletrônicos (EAadia, ΔL-H) e hidrofóbico (LogP) classificou todos os HPA como carcinógenos. Este resultado é importante porque alerta que os HPA que estao no Grupo III do IARC, ainda nao sao classificados quanto à sua carcinogenicidade, precisam ser urgentemente reavaliados. No Brasil, espera-se que a Agência Nacional de Vigilância Sanitária (ANVISA) adote medidas preventivas em relaçao a estes compostos. A utilizaçao de dados de metabólitos na ACP foi extremamente relevante, uma vez que possibilitou um refinamento do modelo. Por sua vez, o estudo QSAR resultou em uma regressao bem ajustada e estatisticamente satisfatória, com elevado nível de confiança e boa capacidade de previsao. O modelo é eficaz na reproduçao dos valores experimentais de DL50 para os HPA estudados, sobretudo dos valores de fluoranteno, pireno e benzo[a]pireno, que apresentaram baixos desvios. Diante destes resultados, abre-se entao a perspectiva de aplicar o presente modelo teórico a outros hidrocarbonetos policíclicos aromáticos, além de se expandir a análise para diferentes grupos de moléculas com a finalidade de identificar seu potencial carcinogênico.
AGRADECIMENTOS A Coordenaçao de Aperfeiçoamente de Pessoal de Nível Superior (CAPES) pelo suporte financeiro.
REFERENCIAS 1. Luo, P.; Bao, L.; Li S.; Zeng, E. Y.; Environ. Pollut. 2015, 200, 10. DOI: http://dx.doi.org/10.1016/j.envpol.2015.02.007 PMID: 25686883 2. Li, J.; Lu, S.; Liu, G.; Zhou, Y.; Lv, Y.; She, J.; Fan, R.; Sci. Total Environ. 2015, 524, 74. DOI: http://dx.doi.org/10.1016/j.scitotenv.2015.04.020 PMID: 25889546 3. Talaska, G.; Thoroman, J.; Schuman, B.; Kafferlein, H. U.; Toxicol. Lett. 2014, 231, 213. DOI: http://dx.doi.org/10.1016/j.toxlet.2014.10.025 PMID: 25445007 4. International Agency for Research on Cancer; IARC Monogr. Eval. Carcinog. Risks Hum. 2014, 1-107. 5. Netto, A. D. P.; Moreira, J. C.; Dias, A. E. X. O.; Arbilla, G.; Ferreira, L. F. V.; Oliveira, A. S.; Barek, J.; Quim. Nova 2000, 23, 765. DOI: http://dx.doi.org/10.1590/S0100-40422000000600010 6. Cavalieri, E. L.; Rogan, E. G.; Drug Discovery Today: Dis. Mech. 2012, 9, 55. DOI: http://dx.doi.org/10.1016/j.ddmec.2013.02.001 7. Saeed, M.; Higginbotham, S.; Rogan, E.; Cavalieri, E. L; Chem.-Biol. Interact 2007, 165, 175. DOI: http://dx.doi.org/10.1016/j.cbi.2006.12.007 PMID: 17224140 8. Xue, W.; Warshawsky, D.; Toxicol. Appl. Pharmacol. 2005, 206, 73. DOI: http://dx.doi.org/10.1016/j.taap.2004.11.006 PMID: 15963346 9. Fetzer, S. M.; Huang, C. R.; Harvey, R. G.; Lebreton, P. R.; J. Phys. Chem. 1993, 97, 2385. DOI: http://dx.doi.org/10.1021/j100112a045 10. Jerina, D. M.; Thakker, D. R.; Yagi, H.; Pure Appl. Chem. 1978, 50, 1033. 11. Leao, M. B. C.; Longo, R. L.; Pavao, A. C.; J. Mol. Struct. 1999, 490, 145. DOI: http://dx.doi.org/10.1016/S0166-1280(99)00095-0 12. Pauling, L.; J. Solid State Chem. 1984, 54, 297. DOI: http://dx.doi.org/10.1016/0022-4596(84)90160-9 13. Leao, M. B. C.; Pavao, A. C.; J. Mol. Struct. 2001, 539, 297. DOI: http://dx.doi.org/10.1016/S0166-1280(00)00800-9 14. Silva, R. C.; Barros, K. A.; Pavao, A. C.; Quim. Nova 2014, 37, 1329. DOI: http://dx.doi.org/10.1590/S0100-40422014000100022 15. Barros, K. A.; Bedor, C. N. G.; Taft, C. A.; Pavao, A. C.; Curr. Bioact. Compd. 2014, 7, 140. DOI: http://dx.doi.org/10.2174/157340721003141013142159 16. Bedor, C. N. G.; Morais, R. J. L.; Cavalcante, L. S.; Ferreira, J. V.; Pavao, A. C.; Sci. Total Environ. 2010, 408, 6281. DOI: http://dx.doi.org/10.1016/j.scitotenv.2010.09.014 PMID: 20889188 17. Ferreira, M. M. C.; Montanari, C. A.; Gaudio, A. C.; Quim. Nova 2002, 25, 439. DOI: http://dx.doi.org/10.1590/S0100-40422002000100001 18. Tavares, L. C.; Quim. Nova 2004, 27, 631. DOI: http://dx.doi.org/10.1590/S0100-40422004000400018 19. Dewar, M. J. S.; Zoebisch, E. G.; Healy, E. F.; Stewart, J. J. P.; J. Am. Chem. Soc. 1985, 107, 3902. DOI: http://dx.doi.org/10.1021/ja00299a024 20. Stewart, J. J. P.; Mopac2012, Colorado Springs, Estados Unidos, 2012. 21. Texto, I. V.; Tanchuk, V. Y.; J. Chem. Inf. Comput. Sci. 2002, 42, 1136. DOI: http://dx.doi.org/10.1021/ci025515j 22. United Nations; Global Report 2003, 199. 23. Hoffmann, S.; Ovaskainen, A. K.; Prieto, P.; Mangelsdorf, I.; Bieler, C.; Cole, T.; Regul. Toxicol. Pharmacol. 2010, 58, 395. DOI: http://dx.doi.org/10.1016/j.yrtph.2010.08.004 PMID: 20709128 24. Layton, D.W.; Mallon, B. J.; Rosenblatt, D. H.; Small, M. J.; Regul. Toxicol. Pharmacol. 1987, 7, 96. DOI: http://dx.doi.org/10.1016/0273-2300(87)90050-X PMID: 3575800 25. Chena, X.; Anb, H.; Aob, L.; Sunb, L.; Liub, W.; Zhoub, Z.; Wanga, Y.; Caob, J.; J. Hazard. Mater. 2011, 186, 835. DOI: http://dx.doi.org/10.1016/j.jhazmat.2010.11.078 26. Knobloch, K.; Szedzikowski, S.; Zablobona, A. S.; Med. Pracy 1969, 20, 210. 27. United States Environmental Protection Agency; Ambient water quality criteria: Naphthalene 1978, PB-296, 786. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access