Artigo
|
|
| Recuperação de sesquiterpenos do óleo-resina de copaíba a partir da destilação molecular Sesquiterpenes recovery of copaiba oil-resin from molecular distillation |
|
Cleyson de S. GalúcioI,*; Cibelem I. BenitesI; Rodney A. F. RodriguesII; Maria Regina Wolf MacielI
IFaculdade de Engenharia Química, Universidade Estadual de Campinas, 13083-852 Campinas - SP, Brasil Recebido em 18/11/2015 *e-mail: cs.galucio@gmail.com Copaiba oil-resin has aromatic characteristics and pharmacological activities attributed to sesquiterpenes compounds. These purified compounds present application in perfume, pharmaceutical and cosmetic industries. Therefore, the objective of this work was to use molecular distillation to recover and purify sesquiterpenes of the copaiba oil-resin with purity high. The parameters evaporator temperature (TEV) from 45 to 100 ºC and feed flow rate (Q) between 15 and 30 ml min-1 were evaluated through design of experiments (22 with center points). The results showed that it was possible to recover sesquiterpenes with 98.12% purity in the distillate stream. Increased in TEV and reduction in Q were the effects observed experimentally and through the response surface. The best experimental condition was TEV of 100 °C and Q of 15 mL min-1. Collor differences were noticed between distillate streams (colorless) and residue (brown). These can be used as parameters for separation of sesquiterpenes and diterpenes. The molecular distillation proved to be an efficient processo to both recovery and purification of sesquiterpenes from the copaiba oil-resin. INTRODUÇAO O óleo-resina de copaíba pode ser extraído sustentavelmente a partir do tronco das árvores do gênero Copaifera. Este é constituído de sesquiterpenos (óleo essencial) e diterpenos (resina) que apresentam variaçoes no teor mesmo sendo da mesma espécie. Entretanto, alguns destes compostos ocorrem com mais frequência e apresentam comprovada propriedade medicinal. Dentre eles, o β-cariofileno é o sesquiterpeno mais comum e destaca-se por sua atividade anti-inflamatória. Para o óleo essencial de copaíba também se reporta a atividade antifúngica e antipsoríase.1-5 Umas das características observadas para o óleo-resina é a variaçao de cor. De acordo com Rigamonte-Azevedo et al.,6 estes podem apresentar-se incolor, amarelo claro, amarelo médio, amarelo dourado e acastanhado. Os motivos podem ser fatores sazonais e ambientais. Diferenças no conteúdo de óleo essencial e resina também sao apontadas como responsáveis nas mudanças de cor no óleo-resina de copaíba. Amostras com maior teor de óleos essenciais apresentam coloraçao mais clara. A confirmaçao destas características é muito importante e as análises cromatográficas estao entre as técnicas analíticas mais eficientes para determinaçao da composiçao dos terpenos do óleo-resina de copaíba. Geralmente, estes sao identificados por meio da combinaçao de duas técnicas cromatográficas: cromatografia em fase gasosa equipada com detector seletivo de massas (GC-MS) e cromatografia em fase gasosa com detector de ionizaçao de chama (GC-FID).2,7 O método comumente empregado para a obtençao do óleo essencial é a hidrodestilaçao.8,9 Este método caracteriza-se por ser um procedimento simples e de baixo custo. Porém, a exposiçao do óleo essencial a um longo período de extraçao sob altas temperaturas é uma desvantagem deste processo, interferindo na qualidade do produto.10 Como alternativa para estes compostos termossensíveis, destaca-se a destilaçao molecular.11 A destilaçao molecular é um processo que permite a separaçao de compostos por meio de um sistema de evaporaçao e condensaçao sob alto vácuo (1,0x10-3 mbar). Deste modo, permite que compostos termossensíveis sejam separados com baixas temperaturas e curto tempo de residência (entre 1 a 10 s). As moléculas evaporadas atingem o condensador facilmente o que é explicado pelo livre percurso médio das moléculas que é menor que a distância entre o evaporador e o condensador.12-14 A aplicaçao da destilaçao molecular pode ser evidenciada na obtençao de diferentes produtos a partir de óleos vegetais e óleos essenciais. Para produtos obtidos a partir de óleos vegetais cita-se a destilaçao molecular para a recuperaçao de tocoferóis,15 concentraçao de monoacilgliceróis e diacilgliceróis de óleos vegetais.16 No tocante aos óleos essenciais, cita-se a concentraçao de citral do óleo essencial de capim limao,17 o fracionamento do óleo de laranja18 e do óleo essencial de orégano.19 Portanto, a destilaçao molecular mostra-se uma alternativa vantajosa para a purificaçao de produtos com alto valor agregado, podendo ser empregada para diferentes materiais, inclusive para materiais termossensíveis como os óleos essenciais. No processo de destilaçao molecular os compostos mais voláteis, como os sesquiterpenos do óleo-resina de copaíba, sao separados na corrente de destilado. Entretanto, uma parcela destes voláteis é obtida na corrente de resíduo. Assim, o objetivo deste trabalho foi empregar a destilaçao molecular para recuperar e purificar sesquiterpenos do óleo-resina de copaíba na corrente de destilado.
PARTE EXPERIMENTAL Matéria-prima A matéria-prima submetida ao processo de destilaçao molecular foi o óleo-resina de Copaifera officinalis (Jacq.) L. (CAS Number: 8001-61-4), adquirido da empresa FERQUIMA-SP, BRASIL, lote: 155, dezembro/2011. Este trabalho apresenta autorizaçao para o estudo do óleo-resina de copaíba (SISBIO, número: 32800-1) e acesso a patrimônio genético (CGEN, processo: 010789/2014-6), aprovado em 12/11/2014. Destilaçao molecular O equipamento utilizado neste trabalho foi o Destilador Molecular de Filme Descente modelo KDL 5, UIC-GmbH (Alzenau-hörstein Germany). A distância entre o evaporador e o condensador é de 0,02 m. A área de superfície do evaporador é de 0,048 m2 e a área de superfície do condensador de 0,065 m2. O esquema do sistema de separaçao deste equipamento é apresentado na Figura 1. Este dispoe de evaporador (1) de forma cilíndrica e encamisada para a circulaçao do fluido responsável pelo aquecimento. Na parte interna, possui um condensador (2) que fica localizado no centro do equipamento e um prato giratório (3) que faz o espalhamento da amostra. Na parte inferior é constituída da correntes de saída (destilado e resíduo). Os compostos com maior massa molar ou que nao evaporaram sao obtidos na corrente de resíduo (4). Os compostos com menor massa molar (voláteis), que evaporam, atingem o condensador e sao obtidos na corrente de destilado (5).
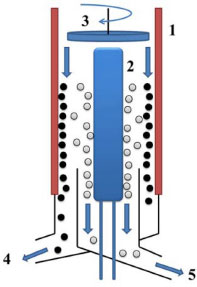 Figura 1. Esquema do sistema de separaçao do destilador molecular de filme descendente: 1) evaporador; 2) condensador; 3) disco giratório; 4) corrente de resíduo; 5) corrente de destilado
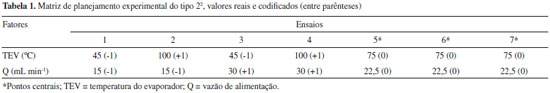
Os fatores temperatura do evaporador (TEV) e vazao de alimentaçao (Q) sao fundamentais na separaçao de compostos e por isso foram avaliados na destilaçao molecular do óleo-resina de copaíba. As condiçoes experimentais foram definidas a partir de um estudo preliminar. A matriz de planejamento experimental (Tabela 1) foi estabelecida de acordo Barros Neto et al.,20 sendo um fatorial do tipo 22 com três pontos centrais. O software Statistica 7.0®21 foi utilizado para analisar as condiçoes de estudo.
Para a conduçao dos experimentos foi mantida a temperatura do condensador de 10 ºC, pressao de 1,0x10-3 mbar, alimentaçao à temperatura ambiente (≈ 25 ºC) e velocidade do disco giratório para o espalhamento da amostra em 350 rpm. O trap foi sempre mantido com nitrogênio líquido para proteger o sistema de bombas dos compostos voláteis. As corridas foram realizadas por 5 minutos, contados a partir do momento que foram observadas correntes de destilado e resíduo, ou seja, separaçao das fraçoes. O cálculo para a recuperaçao de sesquiterpenos na corrente de destilado (RSD) (Equaçao 1) foi realizado de acordo com apresentado por Martins et al.,22 onde sesq corresponde aos compostos sesquiterpênicos. 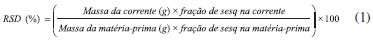 Todas as amostras foram armazenadas à temperatura ambiente (≈ 25 ºC) em frascos envolvidos com papel alumínio devido a sua sensibilidade à luz. Uma parte destas amostras foi transferida para frascos âmbar e conservadas a -10 ºC até o momento das amostras serem analisadas por cromatografia em fase gasosa (5 dias após o fracionamento). Identificaçao de terpenos O óleo-resina de copaíba e as correntes de destilado e resíduo foram submetidas à metilaçao para a identificaçao dos diterpenos. Para esta reaçao o diazometano é o mais utilizado, realizando metilaçao direta.23 Devido à carência do diazometano, o reagente (trimetilsilil) diazometano (TMSD), soluçao 2 mol L-1 em hexano da Sigma Aldrich (St. Louis, MO, USA), também foi utilizado e as condiçoes de reaçao foram estabelecida de acordo com Migowska et al.24 Para esta reaçao adicionou-se 2 mL de uma soluçao de 10% de metanol em acetona para aproximadamente 10 mg das amostras em frascos de vidros. As amostras foram homogeneizadas e em seguida adicionou-se 50 µL de TMSD utilizando uma microsseringa. A reaçao foi conduzida à temperatura ambiente por 15 minutos e em seguida evaporou-se todo o reagente. As amostras foram solubilizadas em acetato de etila (10 mL) e uma alíquota de 1,5 mL foi transferida para os vials para posterior injeçao no cromatógrafo. A análise para identificaçao dos terpenos e o seu teor foi realizada no Cromatógrafo à Gás equipado com detector seletivo de massas (2850 Centerville Rd, Agilent Technologies Inc., Wilmington, DE, USA), operando no modo impacto de elétrons (70 eV). Para a confirmaçao do teor dos terpenos foi utilizado Cromatógrafo à Gás com detector de ionizaçao de chama (20900 Rodano, Thermo Fisher Scientific S.p.a., Strada Rivoltana, Milan, Italy). As condiçoes para os dois equipamentos foram: Coluna capilar HP-5MS (30 m x 0.25 mm x 0.25 µm diâmetro). O injetor operou no modo Split com razao 1:40, injetor: 220 ºC. O programa de aquecimento da coluna foi de 60 ºC a 240 ºC (3 ºC min-1). Foi utilizado o gás hélio a 1 mL min-1. O volume de amostra injetada nos equipamentos foi de 1 µL. A identificaçao dos sesquiterpenos foi realizada através do cálculo do Indice de Retençao (IR) e comparaçao dos espectros obtidos nas análises com os da biblioteca NIST 05 do equipamento e com os da literatura.25 Para o cálculo do IR foi utilizada uma série homologa de padroes cromatográficos de alcanos lineares (C8-C22). Os diterpenos foram identificados por comparaçao dos espectros de massa obtidos com os existentes na biblioteca NIST 05 e com os encontrados na literatura.26,27 Na identificaçao dos constituintes por GC/MS, somente aqueles com similaridade acima de 90% foram considerados. O teor de sesquiterpenos e diterpenos sao resultantes da soma dos constituintes destes compostos analisados por cromatografia em fase gasosa (GC/MS e GC/FID). Para a recuperaçao e purificaçao de sesquiterpenos na destilaçao molecular foi utilizado somente o teor total de sesquiterpenos e diterpenos. Somente os constituintes sesquiterpênicos foram apresentados nesta etapa, visto serem a fonte de estudo deste trabalho. Análise visual das correntes (cor) O óleo-resina de diferentes espécies do gênero Copaifera apresentam variaçoes na cor e estas podem estar relacionadas à diferença nos constituintes terpênicos. As características de cor do óleo-resina de copaíba e das correntes de destilaçao molecular (destilado e resíduo) foram classificadas por comparaçao visual e com as estabelecidas por Rigamonte-Azevedo et al.6 Assim, a análise de cor seguiu a seguinte classificaçao: incolor, amarelo claro, amarelo médio, amarelo dourado e acastanhado.
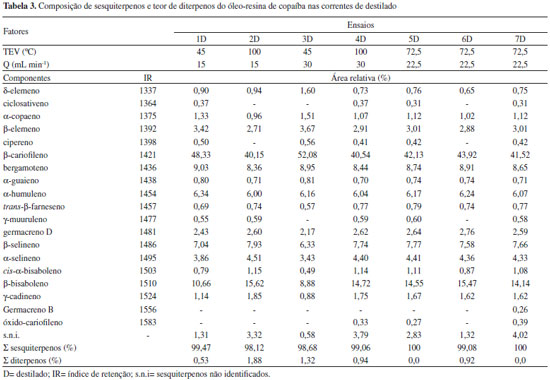
RESULTADOS E DISCUSSAO Composiçao de terpenos O óleo-resina de copaíba apresentou 63,63% de sesquiterpenos e 36,38% de diterpenos (Tabela 2). Os constituintes sesquiterpênicos majoritários foram: β-cariofileno (26,32%), β-bisaboleno (9,24%), bergamoteno (5,25%), β-selineno (5,11%) e α-humuleno (3,90%). O somatório de outros sesquiternos corresponderam a 13,81%. Dentre os diterpenos, destaca-se o ácido poliáltico (11,69%). Os terpenos do óleo-resina de copaíba destacam-se por suas propriedades medicinais. Entretanto, os sesquiterpenos têm despertado maior interesse das industrias de perfumaria, farmacêuticas e de cosméticos. De acordo com Leandro et al.,28 esse interesse nos sesquiternos tem elevado o seu valor e o concentrado destes compostos pode chegar a 600 vezes o valor do óleo-resina. Nessa perspectiva, este trabalho propoe a concentraçao destes compostos por meio da destilaçao molecular. A composiçao de sesquiterpenos e o teor de diterpenos nas correntes de destilado e de resíduo sao apresentados na Tabela 3 e 4, respectivamente.

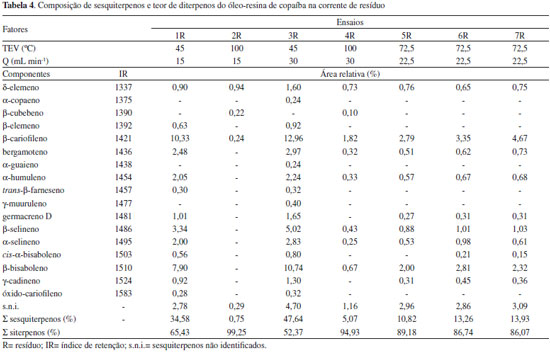
Nas correntes de destilado (Tabela 3) os sesquiterpenos somaram entre 98 e 100%. O β-cariofileno foi o constituinte majoritário e detectado em todos os produtos de destilado, aumentando de 26,32% para 40-52%. Outros sesquiterpenos mais abundantes também aumentaram em relaçao à matéria-prima: O β-bisaboleno alcançou teor de 15,62% (ensaio 2), o bergamoteno de 9,03% (ensaio 1), o β-selineno de 7,93% (ensaio 2) e o α-humuleno de 6,34% (ensaio 1). Os parâmetros de TEV e Q nao influenciaram no teor total de sesquiterpenos. Em relaçao aos constituintes, o β-cariofileno apresentou teor mais alto sob TEV de 45 ºC (ensaios 1 e 3) do que sob TEV de 100 ºC (ensaios 4 e 5). Essa reduçao do β-cariofileno com o aumento da TEV deve-se ao aumento percentual dos outros sesquiterpenos no destilado, sendo o principal o β-bisaboleno. Esta afirmativa pode ser comprovada na corrente de resíduo, onde o teor do β-bisaboleno nao foi detectado no ensaio 2 e no ensaio 4 apresentou teor mais baixo que os dos ensaios 1 e 3. Nas correntes de resíduo (Tabela 4) os sesquiterpenos somaram entre 0,75 - 47,64%. O β-cariofileno foi detectado em todas as correntes com teores entre 0,24 e 12,96%. Devido as correntes de resíduo serem enriquecidas de diterpenos (compostos com maior massa molar) foi necessário o aquecimento de alguns dos tubos coletores (ensaios 2, 4, 5, 6 e 7) entre 60 e 80 ºC para remoçao das amostras. Na análise de cor, utilizando a tabela de cores de Rigamonte-Azevedo et al.,5 o óleo-resina de copaíba apresentou cor acastanhada. Já nas correntes de destilado e resíduo, duas características de coloraçao foram predominantes (Figura 2). As correntes de destilado, ricas em sesquiterpenos, apresentaram-se incolores. Já as correntes de resíduo, ricas em diterpenos, apresentaram cor acastanhada. A cor acastanhada foi atribuída aos diterpenos e a diferença na coloraçao das correntes pode ser utilizada como indicador na separaçao dos constituintes sesquiterpênicos e diterpênicos. De acordo Silva et al.,29 alguns compradores têm interesse no óleo-resina de copaíba que se destacam no óleo essencial e que sejam incolores ou mais claros. Assim, a destilaçao molecular nao só permite obter óleo essencial com alta pureza como também obter este produto incolor que é de interesse comercial.
 Figura 2. Fraçoes da destilaçao molecular do óleo-resina de copaíba na corrente de destilado (a) e na corrente de resíduo (b)
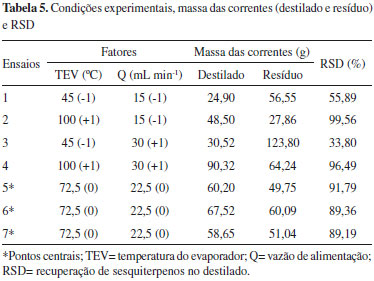
Portanto, nas correntes de destilado o teor total dos sesquiterpenos somaram acima de 98%. O alto vácuo no sistema foi o principal responsável por estes resultados, o qual favoreceu a maior evaporaçao dos sesquiterpenos. Deste modo, os parâmetros de TEV e Q nao influenciaram na composiçao destes compostos. No entanto, nem todos os sesquiterpenos presentes no óleo-resina de copaíba antes da destilaçao molecular foram obtidos nas correntes de destilado. Como apresentado na Tabela 4, foi observado teor total de sesquiterpenos com 47,64% (ensaio 3R). Assim, foi avaliada a recuperaçao e, consequentemente, purificaçao de sesquiterpenos para a corrente de destilado. Recuperaçao de sesquiterpenos no destilado (RSD) A Tabela 5 apresenta as condiçoes experimentais, massa das correntes (destilado e resíduo) e os valores para RSD. Os melhores resultados foram obtidos sob TEV de 100 ºC (ensaios 2 e 4). Com o aumento da TEV para 100 ºC houve maior evaporaçao das moléculas de sesquiterpenos e estes saíram em maior proporçao na corrente de destilado. A TEV de 45 ºC (ensaios 1 e 3) apresentou baixo RSD, ou seja, esta condiçao nao foi suficiente para destilar os sesquiterpenos e esses permaneceram em grande quantidade na corrente de resíduo. Nestes ensaios, a Q de 15 mL min-1 teve melhor RSD do que a Q de 30 mL min-1, indicando que a vazao mais baixa favorece a recuperaçao destes compostos no destilado, visto que eles escoam mais lentamente propiciando a evaporaçao. Deste modo, a condiçao ótima para a recuperaçao e purificaçao de sesquiterpenos foi TEV de 100 ºC e Q de 15 mL min-1.
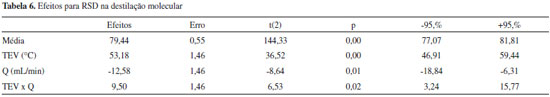
Na Tabela 6 apresentam-se os termos efeitos, erro, t, p (p-value), limites de confiança (-95% e +95%) dos fatores estudados. Através do nível de confiança de 95% (p-value < 0,05) observa-se que TEV, Q e a interaçao entre eles apresentam influência estatística. Estes fatores e coeficientes de regressao foram utilizados no modelo matemático para RSD (Equaçao 2). No cálculo realizado para obtençao do modelo foram utilizados os valores codificados do planejamento experimental. 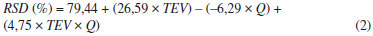
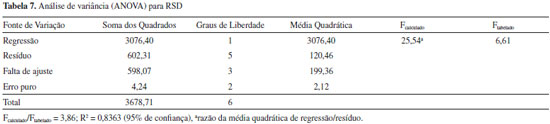
A validaçao do modelo foi realizada por meio da análise de variância - ANOVA (Tabela 7). O R2 de 0,8761 significa que a variaçao explicada pelo modelo foi de 83,63%. A máxima foi de 99,88%, sendo esta calculada a partir da diferença entre a soma dos quadrados (total e erro puro) e dividido pela soma do quadrado total. Quanto mais próximo de 100% for a variaçao explicada, melhor é o ajuste do modelo às respostas. O Fcalculado tem que ser maior que o Ftabelado e quanto maior for a razao destes termos, mais aceitável é o modelo. A relaçao Fcalculado/Ftabelado foi de 3,86. Deste modo, os resultados indicam que o modelo é estatisticamente significativo.
Por meio da superfície de respostas (Figura 3) obtida a partir do modelo matemático (Equaçao 2), pode ser observado que o aumento da TEV e a reduçao da Q sao os efeitos responsáveis para o aumento da RSD. O efeito da Q mostra-se menor que TEV, porém é um fator importante no processo. A superfície de resposta permitiu visualizar que a TEV de 100 ºC e Q de 15 mL/min correspondem as condiçoes ótimas do processo de destilaçao molecular. Este resultado é satisfatório e está de acordo os dados experimentais. As condiçoes avaliadas na destilaçao molecular sao robustas e atenderam o objetivo desejado, que foi recuperar e purificar sesquiterpenos na corrente de destilado.
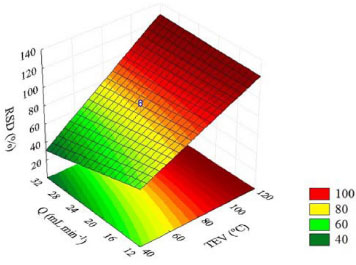 Figura 3. Superfície de resposta para a recuperaçao de sesquiterpenos no destilado
CONCLUSAO O processo de destilaçao molecular foi empregado pela primeira vez para a separaçao dos compostos do óleo-resina de copaíba. Neste estudo a melhor condiçao para recuperaçao e purificaçao de sesquiterpenos na corrente de destilado foi alcançada, sendo que os efeitos observados foram o aumento da TEV e a reduçao da Q. As melhores condiçoes do processo foram sob pressao de 1,0 x 10-3 mbar, TEV de 100 ºC e Q de 15 mL min-1. Os sesquiterpenos foram obtidos em 98,12% de pureza. O β-cariofileno, que é um dos principais constituintes bioativos encontrados no óleo-resina de copaíba, aumentou o teor para 40,15% em relaçao ao apresentado no material de alimentaçao (26,32%). As correntes de destilado foram ricas em sesquiterpenos e apresentaram-se incolores. Esta característica foi atribuída ao menor teor de diterpenos obtidos majoritariamente na corrente de resíduo. Por meio da superficie de respostas foi possível confirmar a melhor condiçao experimental para RSD. Os resultados obtidos nas condiçoes avaliadas foram satisfatórios e atenderam aos objetivos deste estudo. Portanto, através do processo de destilaçao molecular foi possível agregar valor ao óleo-resina de copaíba, recuperando e purificando sesquiterpenos com alta qualidade na corrente de destilado. Os sesquiterpenos purificados obtidos por destilaçao molecular propiciam diversificada aplicaçao, contudo, seu aroma agradável e por ser rico em constituintes bioativos sao características de interesse das indústrias de perfumes, fármacos e cosméticos.
AGRADECIMENTOS Os autores agradecem à Coordenaçao de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e à Fundaçao de Amparo a Pesquisa do Estado do Amazonas (FAPEAM) pelo suporte financeiro no Programa PRO-DPD/AM-BOLSAS.
REFERENCIAS 1. Lima, S. R. M.; Veiga Junior, V. F.; Christo, H. B.; Pinto, A. C.; Fernandes P. D.; Phytother. Res. 2003, 17, 1048. DOI: http://dx.doi.org/10.1002/ptr.1295 PMID: 14595585 2. Veiga Junior, V. F.; Rosas, E. C.; Carvalho, M. V.; Henriques, M. G. M. O.; Pinto, A. C.; J. Ethnopharmacol. 2007, 112, 248. DOI: http://dx.doi.org/10.1016/j.jep.2007.03.005 3. Deus, R. J. A.; Alves, C. N.; Arruda, M. S. P.; Rev. Bras. Plantas Med. 2011, 13, 1. DOI: http://dx.doi.org/10.1590/S1516-05722011000100001 4. Gelminia, F.; Beretta, G.; Anselmi, C.; Centini, M.; Magni, P.; Ruscica, M.; Cavalchini,.A.; Facino, R. M. Int. J. Pharm. 2013, 440, 170. DOI: http://dx.doi.org/10.1016/j.ijpharm.2012.08.021 5. Lucca, L. G.; Matos, S. P.; Borulle, B. T.; Dias, D. O.; Teixeira, H. F.; Veiga Junuior, V. F.; Limberger, R. P.; Koester, L. S.; J. Pharm. Biomed. Anal. 2015, 104, 144. DOI: http://dx.doi.org/10.1016/j.jpba.2014.11.013 PMID: 25499655 6. Rigamonte-Azevedo, O. C.; Wadt, P. G. S.; Wadt, L. H. O.; Veiga Junior, V. F.; Pinto, A. C.; Regiane, A. M.; Revista brasileira de oleaginosas e fibrosas 2004, 8, 851. 7. Barbosa, P. C. S.; Wiedemann, L. S. M.; Medeiros, R. S.; Sampaio, P. T. B.; Vieira, G.; Veiga Junior, V. F.; Chem. Biodiversity 2013, 10, 1350. DOI: http://dx.doi.org/10.1002/cbdv.201200356 8. Pereira, F. J.; Martins, F. T.; Corrêa, R. S.; Moreira, M. E. C.; Costa, A. M. D. D.; Santos, M. H.; Polo, M.; Barbosa, L. C. A.; Lat. Am. J. Pharm. 2008, 27, 364. 9. Souza, A. B.; Martins, C. H. G.; Souza, M. G. M.; Furtado, N. A. J. C.; Heleno, V. C. G.; Sousa, J. P. B.; Rocha, E. M. P.; Bastos, J. K.; Cunha, W. R.; Veneziani, R. C. S.; Ambrósio, S. R.; Phytother. Res. 2011, 25, 215. PMID: 20632306 10. Chemat, F.; Vian, M. A.; Cravotto, G.; Int. J. Mol. Sci. 2012, 13, 8615. DOI: http://dx.doi.org/10.3390/ijms13078615 PMID: 22942724 11. Cermak, S. C.; Isbell, T. A.; Ind. Crops Prod. 2002, 15, 145. DOI: http://dx.doi.org/10.1016/S0926-6690(01)00105-4 12. Lutisan, J.; Cvengros, J.; Chem. Eng. J. 1995, 56, 39. 13. Cvengros, J.; Pollak, S.; Micov, M.; Lutsan, J.; Chem. Eng. J. 2001, 81, 9. DOI: http://dx.doi.org/10.1016/S1385-8947(00)00195-9 14. Wang, S.; Gu, Y.; Liu, Q.; Yao,Y.; Guo, Z.; Luo, Z.; Cen, K.; Fuel Process. Technol. 2009, 90, 738. DOI: http://dx.doi.org/10.1016/j.fuproc.2009.02.005 15. Shao, P.; Jiang, S. T.; Ying, Y. J.; Food Bioprod. Process. 2007, 85, 85. DOI: http://dx.doi.org/10.1205/fbp06048 16. Fregolente, P. B. L.; Pinto, G. M. F.; Wolf Maciel, M. R.; Maciel Filho, R.; Batistella, C. B.; Quim. Nova 2009, 160, 1539. DOI: http://dx.doi.org/10.1590/S0100-40422009000600034 17. Tovar, L. P.; Wolf Maciel, M. R.; Pinto, G. M. F.; Maciel Filho, R.; Gomes, D. R.; Chem. Eng. Res. Des. 2010, 88, 239. DOI: http://dx.doi.org/10.1016/j.cherd.2009.07.018 18. Liu, K.; Chen, Q.; Liu, Y.; Zhou, X.; Wang, X.; J. Food Sci. 2012, 77, C1156. DOI: http://dx.doi.org/10.1111/j.1750-3841.2012.02924.x PMID: 23106968 19. Olmedo, R.; Nepote, V.; Grosso, N. R.; Food Chem. 2014, 156, 212. DOI: http://dx.doi.org/10.1016/j.foodchem.2014.01.087 PMID: 24629960 20. Barros Neto, B.; Scarminio, I.; Bruns, R.; Como fazer experimentos: pesquisa e desenvolvimento na ciência e na indústria, 3ª ed., UNICAMP: Campinas, 2007. 21. Statsoft, Inc.; Statistica (data analysis software system), version 7. Tulsa, USA. 22. Cascon, V.; Gilbert, B.; Phytochemistry 2000, 55, 773. DOI: http://dx.doi.org/10.1016/S0031-9422(00)00284-3 PMID: 11190394 23. Martins, P. F.; Batistella, C. B.; Maciel Filho, R.; Wolf Maciel, M. R.; Ind. Eng. Chem. Res. 2006, 45, 753. DOI: http://dx.doi.org/10.1021/ie050614i 24. Migowska, N.; Stepnowski, P.; Paszkiewicz, M.; Golebiowski, M.; Kumirska, J.; Anal. Bioanal. Chem. 2010, 397, 3029. DOI: http://dx.doi.org/10.1007/s00216-010-3853-y PMID: 20563796 25. Adams, P. R.; Identification of essential oil components by gas chromatography/mass spectrometry, 4th ed., Allured Publishing Corporation: Carol Stream, 2007. 26. Pinto, A. C.; Braga, W. F.; Rezende, C. M.; Garrido, F. M. S.; Veiga Junior, V. F.; Bergter, L.; Patitucci, M. L.; Antunes, O. A. C.; J. Braz. Chem. Soc. 2000, 11, 355. DOI: http://dx.doi.org/10.1590/S0103-50532000000400005 27. Van Den Berg, K. J.; Analysis of diterpenoid resins and polymers in paint media and varnishes: with an atlas of mass spectra. FOM Institute AMOLF: Amsterdam, 2012. 28. Leandro, L. M.; de Souza Vargas, F.; Barbosa, P. C. S; Neves, J. K. O.; da Silva, J. A.; Veiga Junior, V. F.; Molecules, 2012, 17, 3866. DOI: http://dx.doi.org/10.3390/molecules17043866 PMID: 22466849 29. Silva, E. S.; Mathias, C. S.; Lima, M. C. F.; Veiga Junior, V. F.; Rodrigues, D. P.; Clement, C. R.; Pesqui. Agropec. Bras. 2012, 47, 1621. DOI: http://dx.doi.org/10.1590/S0100-204X2012001100009 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access