Artigo
|
|
| Imobilização de dióxido de titânio em diferentes materiais suporte para o emprego em fotocatálise heterogênea Immobilized titanium dioxide (TiO2) in different support materials to use in heterogeneous photocatalysis |
|
Shalimar S. BorgesI; Leandro P. S. XavierII; Adilson C. da SilvaII; Sérgio F. de AquinoII,*
IDepartamento de Engenharia Ambiental, Universidade Federal de Ouro Preto, Campus Universitário S/N, Morro do Cruzeiro, 35400-000 Ouro Preto - MG, Brasil Recebido em 27/01/2016 *e-mail: sergio@iceb.ufop.br The technological bottleneck for the application of heterogeneous photocatalysis with titanium dioxide (TiO2) is the retention and reuse of the catalyst, which brings opportunities for studying techniques for its immobilization on solid supports. The main objective of this paper was to test different methods to effectively immobilize TiO2 on granular activated carbon (GAC), crushed ceramic material (CCM) and zeolite (ZEO) in order to use the catalyst for sulfamethoxazole (SMX) removal from aqueous solutions. For this, three TiO2 immobilization methods (1-immersion of the support in TiO2 slurry; 2-covering by sol-gel synthesis using titanium isopropoxide; 3- impregnating the support with white wall paint doped with TiO2) were tested and the resulting catalyst were characterized and evaluated for SMX removal. The results showed that GAC was the best support and that its immersion in a 50% (w/v) TiO2 suspension was the best immobilization method. Photodegradation assays with such catalyst carried out with 10 mg.L-1 of the antibiotic sulfamethoxazole (SMX) led to 90% of removal of this pharmaceutical after 3.5 hours, which was ~38% higher than the UV photolysis at the same contact time. INTRODUÇAO Nas últimas décadas houve um aumento significativo, em todo o mundo, no consumo de medicamentos de diversas classes como antipiréticos, analgésicos, reguladores lipídicos, antibióticos, drogas contraceptivas e outras e, consequentemente, a preocupaçao da comunidade científica com a presença de fármacos no meio ambiente tem se tornado cada vez maior.1,2 Isso porque os efeitos à saúde humana provocada pela ingestao de água contendo fármacos, ainda que nao estejam completamente elucidados, podem incluir desenvolvimento de resistência em bactérias patogênicas, genotoxicidade e distúrbios endócrinos.3 A presença de fármacos em águas superficiais é um risco real uma vez que o processo de clarificaçao - coagulaçao, floculaçao, sedimentaçao e filtraçao - utilizada na maioria das estaçoes de tratamento de água (ETA) nao é eficaz na sua remoçao de águas contaminadas.4 Além disso, sabe-se que o uso de cloro na etapa de desinfecçao pode levar à formaçao de compostos organoclorados, cuja toxicidade pode ser maior do que os seus precursores.5 Assim novas alternativas para tratamento destes compostos precisam ser investigadas. Uma opçao para complementar o sistema convencional de tratamento de água seria a utilizaçao de processos oxidativos avançados (POA), que envolvem a geraçao e consumo de uma espécie altamente oxidante e nao seletiva como os radicais hidroxila (*OH). Tais radicais tem a capacidade de oxidar substâncias dissolvidas ou dispersas, reduzindo assim a concentraçao de diversos contaminantes em fase aquosa. Uma maneira de gerar radicais hidroxila é por meios fotoquímicos com radiaçao ultravioleta (UV) em combinaçao com um semicondutor sendo o mais utilizado dióxido de titânio (TiO2), no processo conhecido como fotocatálise heterogênea. A maioria dos estudos utilizando TiO2 como fotocalisador sao realizados com o mesmo em suspensao e sob mistura completa, o que confere vantagens como maior área superficial disponível para reaçao e minimizaçao de resistências de transferência de massa. Por outro lado, a principal desvantagem deste método relaciona-se à perda contínua do fotocatalisador e a elevaçao dos custos operacionais, dada a dificuldade de recuperaçao do TiO2 da água tratada, uma vez que, sua forma comercial assemelha-se a um talco fino de baixa velocidade de sedimentaçao.6,7 Uma das alternativas para evitar a perda do fotocatalisador é a sua utilizaçao na forma imobilizada, e diferentes materiais têm sido testados para esta finalidade: carvao ativado granular, aço inoxidável, quartzo, vidro, materiais cerâmicos, zeólitas, polímeros, dentre outros.8-10 Embora haja diversas técnicas para imobilizar o fotocatalisador sobre o suporte, na maioria dos casos, tem-se usado ligaçao térmica e métodos de recobrimento por sol-gel.11-13 Ainda que diversos fatores influenciem diretamente a efetividade da imobilizaçao, a rugosidade do suporte e a característica da suspensao sao considerados os mais relevantes.14 Os meios suportes devem ser substratos porosos e com grande capacidade de adsorçao a fim de promover um aumento na área superficial, uma maior estabilidade térmica na transformaçao das fases cristalinas, e uma diminuiçao da densidade do catalisador, podendo promover assim uma maior interaçao fotocatalisador/poluente.15 Logo, materiais adsorventes como sílica, óxido de alumínio, zeólitas, carvao ativado e outros materiais mesoporosos vêm sendo testados para a imobilizaçao do TiO2.16 O emprego de TiO2 imobilizado para a remoçao de fármacos e desreguladores endócrinos de soluçoes aquosas já foi reportado na literatura, mas a maioria dos poucos estudos realizados empregou métodos onerosos de imobilizaçao, com baixa probabilidade de serem aplicados em estaçoes de tratamento de água (ETA) em escala plena, ou materiais de elevada densidade. Como exemplos cita-se a degradaçao de estradiol com TiO2 imobilizado em uma liga Ti-6Al-4V, que resultou em 98% de remoçao após 3 h e 30 min de contato17 e o estudo em que o TiO2 foi imobilizado em aparas de Al visando a remoçao de diclofenaco (DCF), bezafibrato (BZF) e etinilestradiol (EE2) de águas contaminadas.18 Neste estudo observou-se que apesar de a imobilizaçao em aparas de Al proporcionar boa retençao do catalisador no reator, as eficiências de degradaçao dos fármacos foram pequenas (BZF 15%; DCF 8%, EE2 < 1%), devido ao fato de a maior parte da radiaçao incidente ser bloqueada pelo material suporte, que configurava um leito fixo no fotorreator. Pelo exposto, faz-se necessário pesquisar suportes porosos, de baixo custo e pouco densos, de forma que a retençao do TiO2 seja efetiva e se permita fluidizar o catalisador suportado, garantindo assim boa mistura com baixo consumo de energia.19 A revisao da literatura nesse tema mostra ainda que a maioria dos estudos publicados emprega elevada densidade de potência nominal como, por exemplo, 500 W/L20 ou até mesmo de 1500 W/L,21 o que implicaria em elevado custo de implantaçao (número elevado de lâmpadas) e operacional (gasto energia elétrica e reposiçao de lâmpadas) do sistema de tratamento. Dessa forma, faz-se necessário ainda pesquisar configuraçoes de fotorreatores adequadas e de baixo consumo energético, de forma a aumentar a relaçao custo-benefício e a viabilidade econômica/energética do processo fotocatalítico Sendo assim, o objetivo deste trabalho é avaliar três métodos de imobilizaçao e três materiais suportes de baixo custo para a produçao de TiO2 suportado com vistas à sua utilizaçao na remoçao fotocatalítica do antibiótico sulfametoxazol de soluçoes aquosas em fotorreatores de mistura completa.
PARTE EXPERIMENTAL Preparo dos catalisadores Neste trabalho foram testados três meios suportes de baixa densidade e/ou baixo custo: carvao ativado granular (CAG), zeólita (ZEO) e material cerâmico triturado (MCT). O CAG e a ZEO foram adquiridos, respectivamente, das empresas Carbosolution® e Cubos ® , ao passo que o MCT foi obtido a partir de telha cerâmica a qual foi triturada de forma a adequar sua granulometria para os ensaios. Todos os materiais utilizados como suporte do TiO2 foram classificados com peneiras de 10 e 5 mesh; logo os materiais possuíam entre 2 e 4 mm de diâmetro, esta seleçao foi realizada afim de se padronizar os materiais. Em seguida cada material suporte foi submetido a três métodos de imobilizaçao, detalhados a seguir. Método 1- Imobilizaçao por imersao dos suportes em suspensao de TiO2 Neste método de imobilizaçao foi feita a imersao de cada um dos três suportes em suspensao aquosa contendo TiO2. Para tanto preparou-se uma suspensao com concentraçao de 50% (m/v) de TiO2 que foi utilizada no recobrimento do suporte até formar uma camada considerada satisfatória, ou seja, até que todo o material estivesse completamente recoberto (análise visual). Em seguida, o material foi levado para secagem em estufa a 115 ºC por 45 min para a remoçao de água e, em seguida, o material (suporte+catalisador) foi novamente calcinado a 450 °C por 2 h, com um gradiente de aquecimento de 0,7 ºC min-1, para fixaçao térmica do TiO2 sobre o suporte. Após o processo de calcinaçao, aguardou-se o resfriamento do material em dessecador à vácuo para sua posterior classificaçao em peneira de 10 mesh. Como esta peneira tem aberturas menores que àquela adotada para classificar o material suporte (5 mesh), tal procedimento permitia separar o suporte (CAG, ZEO ou MCT) do excesso de TiO2 eventualmente desprendido. Para se determinar a massa de TiO2 imobilizada as amostras do meio suporte eram pesadas antes do recobrimento, descontando-se os valores da perda por calcinaçao (PPC), conforme detalhado no tópico "Ensaios de Erosibilidade e de Perda por Calcinaçao". Após o processo de imobilizaçao realizava-se nova pesagem do material, de forma que a diferença entre as massas aferidas representava a massa de TiO2 efetivamente imobilizada sobre cada suporte. Método 2- Imobilizaçao pelo método sol-gel Para a imobilizaçao do TiO2 pelo processo sol-gel foi utilizado isopropóxido de titânio, que permite a formaçao de uma resina de titanato sobre o meio suporte que finalmente leva à formaçao de dióxido de titânio após calcinaçao do polímero. Para tanto pesou-se 39,71 g de ácido cítrico que foi dissolvido em 500 mL de água destilada a 70 °C e, em seguida, adicionou-se à esta soluçao 18,8 mL de isopropóxido de titânio (97% Sigma Aldrich) em pequenas porçoes. Após a sua dissoluçao, adicionou-se 26,5 g de etilenoglicol para promover a polimerizaçao. Essa mistura ficou sob agitaçao à temperatura de 90 °C durante 30 minutos. Em seguida, mergulharam-se os meios suportes na suspensao polimérica e repetiu-se o mesmo procedimento de fixaçao, ou seja, calcinaçao a 450 °C por 2 h, conforme descrito no item anterior. Método 3- Imobilizaçao por imersao dos suportes em tinta dopada com TiO2 Por fim, testou-se a imobilizaçao do catalisador sobre os suportes pelo seu recobrimento com tinta comercial branca dopada com TiO2. Assim, procedeu-se de forma similar à descrita no método 1, substituindo-se a suspensao aquosa de TiO2 pela tinta branca. Cabe ressaltar que a tinta branca já possui em sua composiçao o TiO2, contudo na forma alotrópica conhecida como rutilo. Como a fase fotoativa é a anatase, a dopagem da tinta com o TiO2 adquirido da Sigma-Aldrich se fez necessária sendo utilizada a proporçao de 50% m v-1. Após a imobilizaçao uma parte do material foi calcinada (método 3A) enquanto outra parte foi separada para utilizaçao sem calcinaçao (método 3B) nos subsequentes ensaios de fotodegradaçao. Isso permitiu comparar a influência do tratamento térmico/oxidativo, e consequente exposiçao do TiO2 na superfície do suporte, na eficiência de degradaçao do SMX. Os materiais imobilizados pelos métodos descritos anteriormente, além de peneirados, passaram por outro pré-tratamento antes de serem utilizados nos ensaios de fotodegradaçao. Tal pré-tratamento consistiu na lavagem dos materiais para remoçao do TiO2 fracamente aderido à superfície dos suportes, minimizando assim o seu desprendimento durante os ensaios de fotodegradaçao. Posteriormente os materiais eram levados a estufa a 100 °C por 24 h para secarem. Caracterizaçao dos catalisadores e materiais precursores Os catalisadores obtidos e os materiais precursores foram caracterizados por meio de ensaios de difraçao de raios X (DRX); determinaçao da área superficial e porosidade (BET); determinaçao do ponto de carga zero (PCZ) e análises termogravimétricas (TGA/DTG). Para as análises de DRX utilizou-se um difratômetro Shimadzu, modelo XRD 6000, sendo que as varreduras foram feitas entre 7-70º (2-theta) com velocidade do goniômetro de 2º por minuto. Já as medidas de área superficial e porosidade das amostras foram realizadas em equipamento NOVA1000, marca Quantachrome, que utiliza o princípio da adsorçao de um gás (Nitrogênio) na superfície do sólido, por meio do modelo desenvolvido por Brunauer, Emmett e Teller (BET), e este foi realizado da mesma forma para as amostras de meio suporte. A determinaçao da densidade das amostras foi determinada em um picnômetro a gás Hélio, marca Quantachrome, obtida a partir da diferença de pressao quando uma quantidade conhecida de gás, sob pressao, flui de um volume conhecido e calibrado para o porta amostra contendo o material em pó. As amostras (~10 g) foram desgaseificadas a 150 ºC, por 2 horas. Assim foram obtidos parâmetros de superfície específica e porosidade, para valores progressivos de pressao relativa no intervalo de 0,05 a 1,00. A área superficial específica dos materiais foi obtida por meio da determinaçao da quantidade de gás necessária para formar uma monocamada completa na superfície do sólido. A determinaçao do Ponto de Carga Zero (PCZ) do TiO2 foi realizada com três porçoes de água destilada A, B, C que tiveram seu pH inicial ajustado para os valores 3, 6 e 11, respectivamente.22 Para ajuste de pH utilizaram-se soluçoes de ácido nítrico e hidróxido de sódio 0,1 M. De cada uma dessas soluçoes (A, B e C) foram retiradas 7 alíquotas de 20 mL, e a cada uma destas alíquotas foram adicionadas quantidades diferentes de TiO2. As porcentagens em massa de TiO2 usadas foram 0,05; 0,1; 0,5; 1,0; 3,0; 7,0 e 10,0% (m/v), resultando em 7 erlenmeyers para cada pH. Em seguida os 21 erlenmeyers foram levados à incubadora Shaker para agitaçao constante a 200 rpm por 24 h a 25 ºC para que se alcançasse o pH de equilíbrio, o qual foi medido ao final do experimento para cada erlenmeyer. De posse dos resultados, traçaram-se curvas de pH versus percentagem em massa de TiO2, possibilitando a determinaçao gráfica do PCZ. As análises termogravimétricas (TGA/DTG) foram realizadas em um equipamento SDT2960 Simultaneous, no Laboratório de Análise Térmica do Departamento de Química da UFOP. Para tanto foram utilizados cerca de 7 mg de amostra de cada meio suporte em cadinho de alumina. As amostras foram aquecidas da temperatura ambiente até 450 °C com taxa de 7 °C por minuto em atmosfera oxidante, e foram mantidas na temperatura informada por 2 h. Esse tipo de análise mede a variaçao da massa da amostra em funçao da temperatura, sendo que a curva resultante fornece informaçoes quanto à estabilidade térmica da amostra. Ensaios de erosibilidade e de perda por calcinaçao (PPC) Para esse ensaio avaliou-se a perda de massa por calcinaçao (PPC) de diferentes massas do suporte que foram submetidas, após pesagem inicial (que incluia a umidade natural dos suportes), à calcinaçao em mufla na temperatura de 450 °C, por 2 horas, com um gradiente de aquecimento de 0,7 ºC min-1. Após a calcinaçao, o material foi levado ao dessecador a vácuo por 15 min antes de ser novamente pesado. A diferença entre a pesagem inicial e final representa a PPC, que foi utilizada para estimar a massa de TiO2 efetivamente aderida a cada meio suporte. A fim de se determinar a perda de massa do fotocatalisador por erosao durante os ensaios de fotodegradaçao, realizaram-se testes em dois equipamentos JarTest (Nova Ética, modelo 218-6 LDB) idênticos, nos quais se ajustou a rotaçao das pás à 200 rpm, sendo os jarros preenchidos com 2 L de água destilada. Os meios suportes (CAG, ZEO e MCT) contendo o TiO2 imobilizado foram entao adicionados aos jarros após pesagem inicial. No total foram utilizados 12 jarros, de forma que para cada material foram testadas todas as condiçoes de imobilizaçao (métodos 1, 2, 3A e 3B). Os jarros ficaram sob agitaçao durante 90 min, durante o qual foram coletadas 7 amostras nos intervalos de 0, 5, 10, 15, 35, 60 e 90 min. As alíquotas foram coletadas com o JarTest ligado e analisadas em turbidímetro da marca Hack modelo 2100 Q para se avaliar a turbidez gerada pela massa de TiO2 erodida do material suporte. Ao sair do jartest a amostra de água contendo o material em suspensao passava por uma peneira cuja abertura permitia a retençao do material suporte deixando passar o TiO2 erodido. Ao final do teste recolheram-se os materiais de cada jarro e os mesmos foram secos em estufa por 24 h para, em seguida, realizar a sua pesagem e determinar gravimetricamente o desprendimento do TiO2 imobilizado. Ensaios de fotodegradaçao Todos os ensaios de avaliaçao da capacidade fotocatalítica dos materiais produzidos foram realizados nos equipamentos JarTest descritos anteriormente, que simulam bem reatores de mistura completa. O equipamento foi adaptado com jarros de vidro octagonais com capacidade de 2 L e lâmpadas UV-C (PL-S de 9W, da Philips, 85-90% da radiaçao emitida a 254 nm), resultando em densidade nominal de potência de 4,5 W/L. A agitaçao foi mantida em 450 rpm durante todo o tempo de ensaio (530 min), sendo os jarros mantidos à temperatura ambiente. Nas primeiras 2 h mantiveram-se as lâmpadas desligadas a fim de se observar apenas a adsorçao do fármaco pelo meio suporte. As amostras foram coletadas a cada 30 minutos, durante 530 min, foram analisadas em espectrofotômetro HP 8453 UV-Visible System a fim de se avaliar a fotodegradaçao do microcontaminante alvo. Os testes de fotodegradaçao empregaram soluçoes do antibiótico sulfametoxazol (SMX) preparadas em água destilada com concentraçao inicial teórica de 10 mg L-1. Embora essa concentraçao seja mais elevada do que aquela encontrada no ambiente, ela se fez necessária para permitir a detecçao espectrofotométrica de tal contaminante. Para tanto foi necessário determinar inicialmente o comprimento de onda de máxima absorbância do SMX, o que foi feito pelo método de varredura (190 a 1100 nm) no espectrofotômetro HP 8453 UV-Visible System com as amostras filtradas. Após este ensaio o meio suporte foi coletado, seco em estufa e macerado. Em seguida tal material foi utilizado para análise de raios X por reflectância total, TX-RF, em espectrômetro S2 PicoFox (Bruker), que permitiu quantificar a porcentagem de TiO2 impregnada por kg de meio suporte.
RESULTADOS E DISCUSSAO Caracterizaçao do fotocatalisador (TiO2) e meios suportes Ao se analisar os difratogramas de Raios-X do TiO2, Figura 1, pode-se afirmar que nao houve mudança na distribuiçao de fases do catalisador de anatase para rutilo após o processo de imobilizaçao. Dessa forma, as propriedades do material imobilizado devem ser as mesmas do material em pó; logo, seria esperado que nao houvesse perda de eficiência de remoçao (devido à reduçao de fotoatividade) ao utilizar-se o material imobilizado em relaçao ao suspenso devido à eventual conversao de uma forma cristalina (anatase) em outra (rutilo ou brookita).
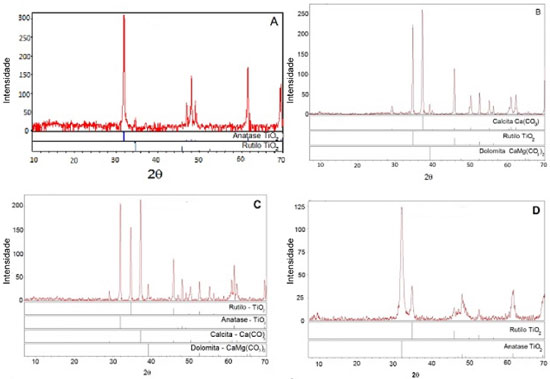 Figura 1. Difratograma de raios-X de amostras de TiO2 (A), tinta sem dopar (B), tinta dopada com TiO2 (C) e isopropóxido de Ti (D)
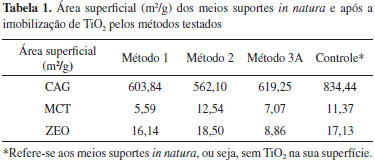
Na amostra de tinta nao foi possível notar a fase cristalina anatase, apenas a fase rutilo que é fotoestável. Já no método de imobilizaçao com isopropóxido de titânio pode se observar que há a presença das duas fases cristalinas, porém pode-se notar que a fase anatase, fase de maior atividade fotocatalítica, comparada aos outros métodos apresenta um pico de menor intensidade. Como será visto posteriormente a eficência de fotodegradaçao com o catalisador obtido por esse método nao foi tao boa quanto para os outros. De acordo com a Tabela 1 o processo de imobilizaçao de TiO2 levou à reduçao da área superficial do material suporte, e que o CAG possui a maior área superficial, mesmo após a imobilizaçao de TiO2 pelos três métodos testados, quando comparados aos outros materiais suportes (MCT e ZEO). Isso tende a facilitar a remoçao de poluentes da fase aquosa pelos processos conjugados de adsorçao e fotodegradaçao. Além disso, uma maior área superficial favorece a imobilizaçao de mais fotocatalisador na superfície do suporte, contribuindo assim para a fotodegradaçao do poluente alvo. Como nem toda a superfície do meio suporte foi recoberta pelo fotocatalisador logo houve adsorçao de SMX pelo meio suporte bem como sua fotodegradaçao nos sítios recobertos pelo TiO2 impregnado.
Os ensaios de determinaçao do PCZ resultaram em um valor de convergência igual a 7,46 (Figura 2). Isso sugere que em valores de pH superiores a 7,46 o catalisador terá carga superficial líquida negativa, apresentando carga positiva em valores menores que o PCZ. Dessa forma, no pH da soluçao utilizada nos testes de fotodegradaçao (6,5 a 7,0) o catalisador teria maior afinidade por moléculas com carga negativa, e isso seria uma força motriz para a aproximaçao do SMX (pKa1 = 1,6 e pKa2 = 5,7) junto à superfície do catalisador onde sao gerados os radicais hidroxila o que, em tese, poderia favorecer o processo de degradaçao.
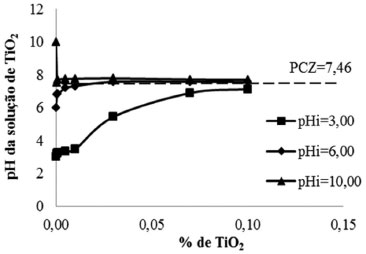 Figura 2. Determinaçao gráfica do ponto de carga zero (PCZ) do TiO2
A análise termogravimétrica dos materiais suporte in natura e recobertos com TiO2 foi feita para avaliar a perda de massa durante o processo de queima para a fixaçao do TiO2. Analisando as curvas apresentadas na Figura 3, referentes às análises térmicas dos meios suportes, é possível perceber que as maiores perdas de massa foram observadas nos materiais preparados com a tinta dopada com TiO2 (método 3), exceto para o material cerâmico (MCT) em que se observou maior perda de massa na imobilizaçao com isopropóxido (método 2), o que pode ter ocorrido devido a oxidaçao de residual da resina de titânio na superfície de tal material. Já para o CAG in natura observa-se uma perda de aproximadamente 15% entre a temperatura de 0 a 50 °C que pode ser atribuída ao CO2 adsorvido. Para os demais métodos nao foram observadas perdas de massas significativas nessa faixa de temperatura. Para o meio suporte ZEO imobilizado pelo método 2 pode-se dizer que houve dois eventos de perda de massa sendo o primeiro possivelmente atribuído a liberaçao de moléculas de água das cavidades das zeólita e o segundo devido a perda de hidroxilas estruturais em temperaturas entre 200 e 450 °C. 23
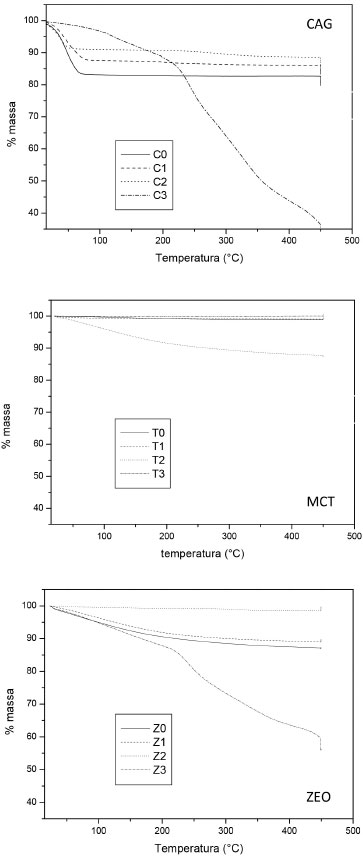 Figura 3. Análise térmica (7 ºC min-1 em O2) dos meios suportes ZEO, CAG e MCT contendo TiO2 imobilizado conforme os diferentes métodos (1, 2 e 3), e meio suporte in natura (0)
Após os ensaios de caracterizaçao do catalisador suportado determinaram-se os percentuais de perda de massa por calcinaçao (PPC) dos suportes testados com intuito de estimar a massa de TiO2 efetivamente imobilizada em cada meio suporte, uma vez que esta determinaçao também é feita por método gravimétrico. Os resultados da perda por calcinaçao (PPC) para os meios suportes in natura (sem TiO2 imobilizado) sao apresentados na Tabela 2 e corroboram os dados apresentados na Figura 3 referentes aos suportes in natura.

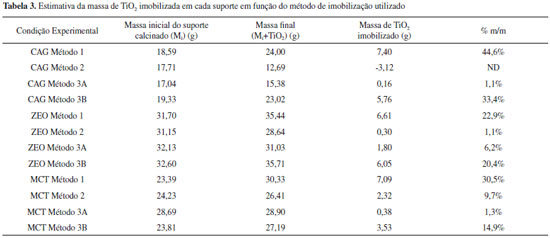
Nota-se que os materiais CAG e ZEO tiveram maior perda de massa o que é coerente com sua composiçao, sendo o primeiro um material predominantemente orgânico e o segundo, embora seja um aluminossilicato, também apresentou perda de massa devido à desidrataçao e reaçoes de desidroxilaçao. Já para o MCT pode-se dizer que a perda de massa é desprezível, o que é coerente com o fato desse material ter sofrido calcinaçao durante sua fabricaçao. Embora as condiçoes de armazenamento e a umidade do ar possam ter contribuído para a absorçao de água e aumento de massa do MCT, os resultados apresentados indicam que essa foi desprezível. A estimativa de massa de TiO2 imobilizado foi feita para cada meio suporte e método de imobilizaçao considerando a massa dos materias in natura (controle) e após o processo de recobrimento, descontando-se apropriadamente a perda de massa por calcinaçao. Conforme pode-se observar (Tabela 3), para apenas um material nao foi possível estimar a massa de TiO2 imobilizada.
A partir da Tabela 3 pode-se concluir que o método de imobilizaçao mais eficiente foi método 1 (suspensao de TiO2) para todos os meios suportes. Além disso, pode-se concluir que o método 3A (dopagem de tinta seguido de calcinaçao) nao foi adequado uma vez que resulta em baixa fixaçao de TiO2 (< 7%), o que provavelmente comprometeria a atividade fotocatalítica do material obtido. De acordo com os dados da Tabela 3 o CAG pode ser considerado o melhor material suporte, provavelmente por ser mais poroso e possuir maior área superficial. Além disso, este é o material suporte mais leve dentre os testados, logo o gasto de energia para fluidizaçao ou expansao do meio suporte também seria menor. No método de recobrimento sol-gel observa-se que a massa de TiO2 imobilizada foi muito pequena para os materiais ZEO e MCT. Para o CAG o balanço de massa foi negativo, provavelmente devido à grande perda de massa na calcinaçao da resina, o que inviabilizou a determinaçao da massa de TiO2 efetivamente imobilizada. Foram realizadas análise por microscopia eletrônica (MEV) para todos os materiais obtidos a partir de meios suportes e técnica de imobilizaçoes diferentes, porém, como os resultados foram bem semelhantes de um material para o outro, optou-se por apresentar apenas as micrografias do CAG (Figura 4), que foi o material escolhido para os ensaios de fotodegradaçao.
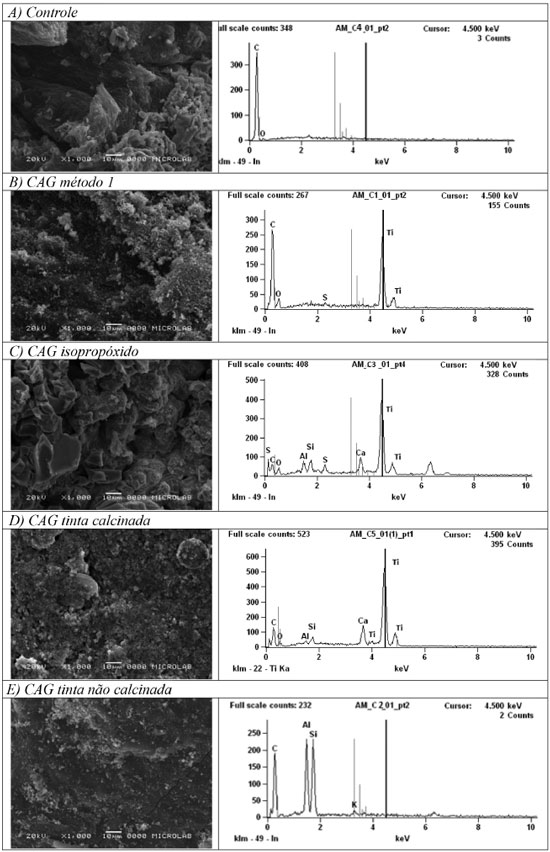 Figura 4. Micrografia e análise química dos diferentes materiais: A) Controle, B) CAG método 1, C) CAG isopropóxido, D) CAG tinta calcinada, E) CAG tinta nao calcinada
Conforme mostra a Figura 4-B, a imobilizaçao por meio da suspensao de TiO2 (método 1) resulta em um recobrimento no qual o TiO2 apresenta-se bem disperso sobre a superfície, isto é, nao está sinterizado, o que resultaria na formaçao de grânulos maiores. A análise química confirmou a presença de TiO2 sobre o material imobilizado pelo método 1. De fato, o TiO2 é proveniente do recobrimento, já que a análise química da Figura 4-A indica que nao houve picos referentes ao TiO2 no CAG in natura. Esta figura permite, ainda, a observaçao dos poros do material, os quais podem, por um lado, adsorver os contaminantes e, por outro, contribuir para a melhor fixaçao do catalisador, além de proporcionar maior área catalítica. Já a Figura 4-C mostrou que a imobilizaçao pelo método 2 (sol-gel) proporciona um recobrimento heterogêneo do suporte, em que o TiO2 apresenta-se distribuído de maneira nao uniforme, uma vez que ele se agrupa em grandes aglomerados sobre o suporte. Além disso, foi possível identificar o pico do TiO2 com intensidade expressiva, tal qual observada na imobilizaçao em suspensao, indicando a efetiva imobilizaçao do TiO2 pela síntese do mesmo diretamente sobre a superfície do meio suporte. Quanto à imobilizaçao utilizando-se a tinta dopada com TiO2, observou-se duas situaçoes distintas. No caso em que o material nao foi calcinado após a imobilizaçao (Figura 4-E), ainda que tenha sido adicionado TiO2 à tinta, o método de imobilizaçao nao foi favorável, uma vez que a tinta, devido à sua composiçao, pode ter mascarado a presença do TiO2. Em outras palavras, ao invés de o TiO2 estar na superfície do meio suporte, ele ficou coberto pela resina da tinta e isso possivelmente inibiria a atividade fotocatalítica do mesmo. Já no caso da imobilizaçao com tinta seguida de calcinaçao, (Figura 4-D), observaram-se a presença de TiO2 na superfície do suporte. Os resultados de MEV-EDS nao sao conclusivos quanto à vantagem da utilizaçao de um ou outro método de imobilizaçao, pois na maioria dos casos houve presença do TiO2 na superfície do material suporte, mas permitem inferir que se o método de imobilizaçao for o método 3 é necessário calcinar o material suporte antes da sua utilizaçao para garantir que o TiO2 esteja exposto na sua superfície. Para determinaçao do melhor método de imobilizaçao, procederam-se aos ensaios preliminares de degradaçao e testes de erosibilidade do material, de forma a verificar a resistência do mesmo às condiçoes de ensaio, conforme se discutirá posteriormente. Ensaios de Erosibilidade Os resultados obtidos nos ensaios de erosibilidade, em que foram monitorados os valores de turbidez gerada pelos materiais em meio aquoso sao apresentados na Figura 5. A turbidez no meio aquoso aumenta com o tempo devido à perda de TiO2 e é justamente isso que deve ser evitado tendo em vista os aspectos econômicos (perda contínua do catalisador) e técnicos (reduçao da eficiência de fotodegradaçao pelo bloqueio da radiaçao incidente).
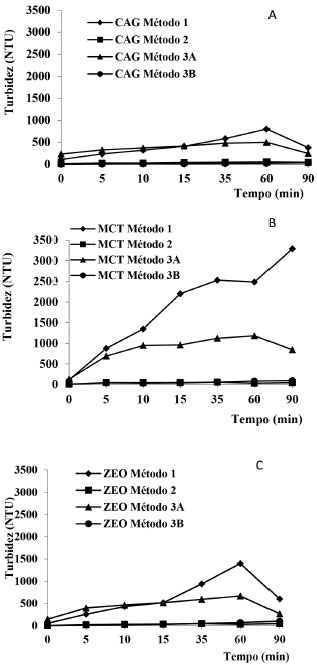 Figura 5. Turbidez gerada em meio aquoso pelo emprego dos materiais recobertos com TiO2 pelos diferentes métodos nos meios suportes: A) CAG, B) MCT e C) ZEO
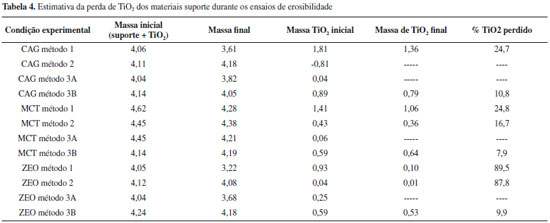
Os resultados apresentados mostram que além do método de suspensao ter sido o que mais fixou TiO2, foi também o que levou às maiores taxas de erosao (Figura 5-A). Já os materiais imobilizados pelo método 2 apresentaram baixa turbidez porém ao se analisar a quantidade de massa imobilizada no suporte (Tabela 3) pode-se inferir que havia pouco catalisador na superfície dos materiais, o que provavelmente levaria a pequenas eficiências de remoçao por fotodegradaçao. Já para os materiais imobilizados com tinta sem posterior calcinaçao (método 3B) obteve-se uma imobilizaçao de TiO2 mais significativa do que a do método 3A. A calcinaçao da tinta leva à queima da resina o que expoe o TiO2 na superfície e resultou na segunda maior perda de catalisador por erosao (Figura 5). Por outro lado, o método 3B resultou nas menores percentagens de fotocatalisador perdido, ou seja, baixa taxa de erosao, mas o TiO2 estava encapsulado pela resina e indisponível para a fotocatálise. Os resultados apresentados na Figura 5 indicam que, para a maioria dos materiais, a turbidez é gerada logo no início do ensaio, sendo que depois se estabiliza, indicando que a perda de TiO2 nao é contínua. Isso sugere que numa situaçao real haveria um desprendimento inicial do excesso de catalisador imobilizado e que, depois de atingido o equilíbrio, as perdas seriam minimizadas. A Tabela 4 apresenta as porcentagens de TiO2 perdidas ao final do ensaio de erosibilidade. Observa-se que a determinaçao nao foi possível em alguns casos, devido à perda de material durante os ensaios.
Os resultados apresentados na Figura 5 e na Tabela 3 mostram que é necessário um pré-tratamento dos suportes para remover o excesso de TiO2 sobre o mesmo, permitindo assim a recuperaçao e reutilizaçao do catalisador erodido. Tal pré-tratamento seria simples e consistiria na exposiçao do material às condiçoes operacionais de agitaçao e posterior recuperaçao do suporte e secagem do mesmo. Dessa forma o TiO2 desprendido na água poderia ser recuperado e utilizado para fazer nova imobilizaçao de meios suportes. Ensaios de Fotodegradaçao Foram realizados ensaios de fotodegradaçao do fármaco SMX para avaliar a atividade fotocatalítica do CAG-TiO2 obtido com os diferente métodos de imobilizaçao testados. A Figura 6 apresenta os resultados da fotodegradaçao em batelada no ensaio que durou 530 min. Percebe-se que a imobilizaçao utilizando tinta sem calcinar (método 3B) foi a que proporcionou menor porcentagem de remoçao, aproximadamente igual aquela obtida apenas por fotólise direta (UV). Essa remoçao foi menor inclusive do que a que ocorre com CAG in natura, condiçao em que predomina a adsorçao. Tais resultados indicam que o TiO2 nao estava disponível para a fotocatálise e que o recobrimento do CAG com tinta diminuiu sua capacidade de adsorçao. Por outro lado, a calcinaçao da tinta expoe o TiO2 e favorece a fotodegradaçao de SMX, mas por outro lado aumenta a erosibilidade do catalisador, como visto anteriormente.
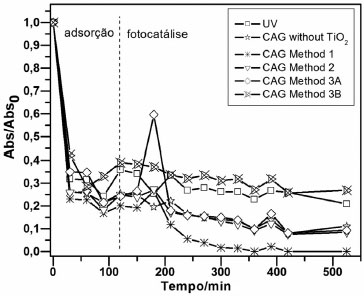 Figura 6. Variaçao temporal da concentraçao de SMX (10 mg L-1) nos ensaios fotocatalíticos usando CAG como suporte para a imobilizaçao de TiO2. No período de adsorçao nao foi aplicada radiaçao ultravioleta.
A Figura 6 mostra que o uso de TiO2 imobilizado no CAG pelo método 1 (suspensao) resultou na maior degradaçaode SMX quando comparado aos outros métodos de imobilizaçao. A remoçao com tal material atingiu 90% após 3 h e 30 min de tratamento, tendo sido completa após um tempo de contato de 5 h e 30 min. Embora alguns métodos de imobilizaçao tenham resultado em eficiências menores, ou iguais àquela obtida apenas por fotólise direta, as eficiências foram todas superiores a 60%, provavelmente devido à elevada adsorçao inicial do fármaco no CAG. Vale ressaltar que um experimento com alimentaçao contínua levaria à saturaçao do CAG caso nao houvesse a fotodegradaçao concomitante para regenerar os sítios de adsorçao. Dessa forma o uso de CAG-TiO2 conjugaria os processos de adsorçao, o que facilitaria a proximidade do poluente e as partículas de TiO2 imobilizadas; com a fotodegradaçao do poluente adsorvido, que seria levada à cabo pelos radicais hidroxila gerados na superfície do catalisador irradiado. Isso levaria à mineralizaçao ou mudança estrutural do poluente, o que poderia contribuir para a sua dessorçao e regeneraçao dos sítios de adsorçao.
CONCLUSAO Este trabalho avaliou três métodos de imobilizaçao e três materiais suportes (zeólita - ZEO, material cerâmico triturado - MCT e carvao ativado granular - CAG) de baixo custo para a produçao de TiO2 suportado com vistas à sua utilizaçao na remoçao fotocatalítica do antibiótico sulfametoxazol. O método de imobilizaçao via sol-gel (método 2) resultou em baixa fixaçao de TiO2 (1 a 10% m v-1) em todos os materiais testados como suporte, e produçao de material com TiO2 disperso de forma heterogênea na superfície do suporte. Os melhores métodos de imobilizaçao foram a imersao em suspensao aquosa de TiO2 (método 1) seguida da imersao em tinta dopada com anatase (método 3). Tais métodos produziram materiais contendo de 15 a 45 g TiO2/100 g suporte, que exibiram baixa erosibilidade (exceto método 3A) nos ensaios de mistura completa. Embora a imobilizaçao do CAG pelo método 3B tenha levado à boa fixaçao de TiO2 e na menor erosibilidade, os ensaios de degradaçao do fármaco SMX indicaram menor eficiência fotocatalítica. O CAG-TiO2 produzido pelo método 1 foi considerado o melhor material tendo em vista que seu uso em fotorreatores de mistura completa levou à remoçao de 90% do fármaco SMX em 3h e 30 min de contato, e remoçao total após 5h e 30 min. O melhor desempenho deste catalisador foi provavelmente devido à sua maior porosidade e área superficial. Além disso, o CAG é o suporte mais leve dentre os testados, logo o gasto de energia para fluidizaçao ou expansao do leito catalítico também seria menor, conferindo adicional vantagem a este material.
AGRADECIMENTOS Os autores gostariam de agradecer ao CNPq, CAPES e FAPEMIG pela concessao das bolsas de produtividade em pesquisa, mestrado e iniciaçao científica, respectivamente.
REFERENCIAS 1. Lee, H. B.; Peart, T. E.; Svoboda, M. L.; J. Chromatogr. A 2005, 1094, 122. DOI: http://dx.doi.org/10.1016/j.chroma.2005.07.070 PMID: 16257298 2. Feitosa, R. S.; Sodré, F. F.; Maldaner, A. O.; Quim. Nova 2013, 36, 291. DOI: http://dx.doi.org/10.1590/S0100-40422013000200016 3. Kümerer, K.; J. Antimicrob. Chemother. 2004, 54, 311. DOI: http://dx.doi.org/10.1093/jac/dkh325 4. U. S. E. P. A.; Disruptor Chemicals Using Drinking Water Removal of Endocrine Disruptor 2001, 27. 5. Pereira, R. O.; Carminato, V. M.; Vieira, E. M.; Daniel, L. A.; Eng Sanit Ambiental 2013, 18, 215. DOI: http://dx.doi.org/10.1590/S1413-41522013000300004 6. Lepore, G. P.; Persaund, L.; Langford, C. H; J. Photochem. Photobiol., A 1996, 98, 103. DOI: http://dx.doi.org/10.1016/1010-6030(95)04242-3 7. Stroyuk, A. L.; Theor. Exp. Chem.. 2015, 51, 183. DOI: http://dx.doi.org/10.1007/s11237-015-9414-x 8. Kumazawa, H.; Inoue, M.; Kasuya, T. Beer, L.; Ind. Eng. Chem. Res. 2003, 42, 3237. DOI: http://dx.doi.org/10.1021/ie020723m 9. Jiménez-Tototzintle, M.; Oller, I.; Hernández-Ramírez, A.; Malato, S.; Maldonado, M. I.; Chem. Eng. J. 2015, 273, 205. DOI: http://dx.doi.org/10.1016/j.cej.2015.03.060 10. Zhang, Q.; Wang, J. J.; Lin, C.-F.; Jing, Y. H.; Chang, C-T.; Mater. Sci. Semicond. Process. 2015, 30, 162. DOI: http://dx.doi.org/10.1016/j.mssp.2014.09.029 11. Kumara, G. R. R. A.; Sultanbawa, F. M.; Perera, V. P. S.; Kottegoda, I. R. M.; Tennakone, K.; Sol. Energy Mater. Sol. Cells. 1999, 58, 167. DOI: http://dx.doi.org/10.1016/S0927-0248(98)00200-1 12. Yurdakal, S.; Augugliaro, V.; Sanz, J.; Soria, J.; Sobrados, I.; Torralvo, M. J;. J. Catal. 2014, 309, 97. DOI: http://dx.doi.org/10.1016/j.jcat.2013.09.006 13. Su, C.; Hong, B. Y.; Tseng, C. M.; Catal. Today 2004, 96, 119. DOI: http://dx.doi.org/10.1016/j.cattod.2004.05.005 14. Pozzo, R. L.; Baltanfis, M. A.; Cassano, A. E.; Catal. Today 1997, 39, 219. DOI: http://dx.doi.org/10.1016/S0920-5861(97)00103-X 15. Saleiro, G. T.; Cardoso, S. L.;Toledo, R.; Holanda, J. N. F.; Cerâmica 2010, 56, 162. 16. Silva, L. P.; Dissertaçao de mestrado. Universidade de Sao Paulo, Brasil, 2007. 17. Coleman, H. M.; Eggins, B. R.; Byrne, J. A.; Palmer, F. L; King, E. Appl. Catal., B 2000, 24, 3. DOI: http://dx.doi.org/10.1016/S0926-3373(99)00091-0 18. Xavier, L. P. S.; XIX SEIC da Universidade Federal de Ouro Preto. Ouro Preto, Brasil, 2011. Disponível em http://www.seic.ufop.br/anais/exibir_trabalho/1915 Acessado em Janeiro 2016. 19. Rao, K. V. S.; Subrahmanyam, M.; Boule, P.; Appl. Catal., B. 2004, 49, 239. DOI: http://dx.doi.org/10.1016/j.apcatb.2003.12.017 20. Sirtori, C.; Altvater, P. K.; Freitas, A. M.; Peralta-Zamora, P. G. J. Hazard. Mater. B 2006, 129, 110. DOI: http://dx.doi.org/10.1016/j.jhazmat.2005.08.017 21. Abellán, M. N.; Giménez, J.; Esplugas, S.; Catal. Today. 2009, 144, 131. DOI: http://dx.doi.org/10.1016/j.cattod.2009.01.051 22. Valdés, H.; Sánchez-Polo, M.; Rívere-Utrilla, J.; Zaror, C. A.; Langmuir 2002, 18, 2111. DOI: http://dx.doi.org/10.1021/la010920a 23. Rowsell, J. L. C.; Yaghi, O. M.; Microporous Mesoporous Mater. 2004, 73, 3. DOI: http://dx.doi.org/10.1016/j.micromeso.2004.03.034 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access