Artigo
|
|
| Híbridos de quitosana-argila para encapsulamento e liberação sustentada do fertilizante nitrato de potássio Chitosan-clay hybrid for encapsulation of fertilizers and release sustained of potassium nitrate fertilizer |
|
Lucas L. MessaI; José Daniel FroesII; Claudinei F. SouzaII; Roselena FaezI,*
IDepartamento de Ciências da Natureza, Matemática e Educação, Centro de Ciências Agrárias, Universidade Federal de São Carlos, km 174 Araras - SP, Brasil Recebido em 11/05/2016 *e-mail: faez@cca.ufscar.br The use of controlled release fertilizers is a trend for improving productivity, reducing costs and environmental pollution. Such materials release gradually the nutrients to the plant in order to supply its requirement and are an alternative to improve fertilization. The preparation of a microsphere from natural materials (chitosan and montmorilonite clay) added with nutrients, according to the needs of plants nutritional, is one of the main motivations of this work. The addition of lamellar silicates as natural clays is a promising alternative to increase water and chemical compounds sorption capacity. In the present chitosan/montmorilonite clay composites were prepared via inversion phase and thermal, structural and morphologically studies were performed. The release of the KNO3 was realized in water using conductimetry and time domain reflectometry technique was used to monitor the in situ release in soil. Double coated microspheres provide the better nutrient encapsulation and a swelling of 200% was observed. The release was influenced by pH and fast release was observed for pH 4 and 5.5. According to the soil tests a slow release was observed since the KNO3 delivery was accompanied during 60 days showing higher values in the first ten days and a constant value until 60 days. INTRODUÇAO O Brasil é considerado um dos maiores importadores de fertilizantes no mundo e o quarto maior consumidor, ficando atrás apenas da China, da India e dos Estados Unidos.1 Essa grande importaçao e consumo de adubos na agricultura brasileira podem ser justificadas por diversos fatores, tais como: grande área de cultivo no país que indica a enorme produçao agrícola; características dos solos, pobres em nutrientes como potássio e fósforo; e produçao insuficiente de adubos potássicos, fosfatados e, principalmente, nitrogenados.2 Fertilizantes industriais têm sido largamente empregados nas áreas agrícolas para a adubaçao do solo. No entanto, a utilizaçao incorreta desses insumos pode causar tanto impactos ambientais quanto econômicos. No ambiente, pode ser responsável pela poluiçao de lençóis freáticos e águas de rios devido à erosao, acidificaçao e emissao de gases de efeito estufa como o óxido nitroso (N2O), principalmente pelo uso de adubos de origem nitrogenada. Os impactos econômicos sao decorrentes das despesas de aquisiçao de fertilizantes, muitos importados, que representam grande parte dos custos de produçao de alimentos.3 Assim, é necessário procurar métodos alternativos para manejo de nutrientes ao solo. O uso de fertilizantes em liberaçao controlada na agricultura tem sido utilizado de modo crescente nos últimos anos, sendo considerada uma alternativa promissora para melhorar inúmeros aspectos de fertilizaçao com base no conceito de liberaçao controlada.4 A utilizaçao de insumos agrícolas em liberaçao controlada tem aumentado devido à necessidade de reforçar os sistemas de produçao com o aumento da produtividade e reduçao de custos. Adicionalmente, estes materiais podem ser utilizados como condicionadores do solo uma vez que melhoram a disponibilidade de água.5,6 As principais vantagens do seu uso sao: o fornecimento regular e contínuo de nutrientes para as plantas; menor frequência de aplicaçoes em solos; reduçao de perdas de nutrientes devido à lixiviaçao, imobilizaçao e volatilizaçao; eliminaçao de danos causados a raízes pela alta concentraçao de sais; maior praticidade no manuseio dos fertilizantes: contribuiçao à reduçao da poluiçao ambiental pelo NO3-; atribuiçao de valor ecológico à atividade agrícola (menor contaminaçao de águas subterrâneas e superficiais); reduçao de custos de produçao.7 A quitosana tem sido amplamente explorada como um material de revestimento para a preparaçao de materiais de liberaçao controlada por um sistema em que as taxas de dissoluçao e de liberaçao dependem diretamente das características do material.8 A quitosana é um copolímero de 2-amino-2-deoxi-D-glicopiranose e 2-acetamido-2-deoxi-D-glicopiranose de composiçao variável em funçao do grau médio de acetilaçao.9 Este biopolímero é obtido a partir da desacetilaçao parcial da quitina, que é um polissacarídeo encontrado abundantemente na natureza e principal componente do exoesqueleto de insetos e crustáceos.10 Em relaçao a sua estrutura química, possui grupos amina (NH2) e hidroxila (OH-) capazes de interagir com distintas moléculas e/ou íons. É solúvel em alguns ácidos diluídos formando um polímero catiônico com a protonaçao do grupo amino (NH3+), que lhe confere propriedades interessantes como biocompatibilidade, biodegradabilidade e nao toxicidade, aliadas à capacidade de formar fibras, filmes, géis e microesferas, responsáveis por suas mais diversas aplicaçoes.11,12 Além disso, a combinaçao de materiais inorgânicos e polímeros tem sido uma estratégia de sucesso no desenvolvimento de novas propriedades, chamando a atençao nos últimos anos, devido à obtençao de materiais com propriedades novas ou melhores do que o polímero puro. A adiçao de silicatos lamelares, tais como argila montmorilonita, é uma alternativa promissora para melhorar certas propriedades, ou seja, aumentar a capacidade de sorçao para ambos os compostos químicos e de água.13 Na literatura, diferentes métodos descrevendo o processo de preparaçao de microesferas de quitosana têm sido publicados, tais como atomizaçao,14 gelificaçao ionotrópica15 e inversao de fase.6,10 Neste último método, a formaçao de microesferas se dá pela neutralizaçao da soluçao ácida de quitosana por uma base forte, tipicamente hidróxido de sódio. Esta soluçao coagula a quitosana no formato de gotas que ficam em suspensao na soluçao coagulante com ajuda de uma agitaçao mecânica lenta.10 Com base no que foi exposto, este trabalho teve como objetivo congregar as propriedades de materiais de origem natural (quitosana e argila montmorilonita) na obtençao de um material híbrido na forma de microesfera para encapsulamento e liberaçao controlada de fertilizantes. As microesferas de quitosana-argila foram preparadas com dupla camada pelo método de inversao de fase baseado no trabalho de Santos.6 O fertilizante comercial nitrato de potássio (KNO3) foi testado como nutriente devido ao fato de este composto apresentar grande mobilidade no solo. A motivaçao principal está na preparaçao de uma microesfera a partir de materiais naturais (quitosana e argila montmorilonita) aditada com nutrientes e a sua aplicaçao no solo com acompanhamento in situ da liberaçao do nutriente por uma técnica eletromagnética que avalia a movimentaçao iônica em sistemas particulados, como é o caso do solo. O aumento da eficiência do uso do fertilizante, a reduçao da toxicidade no solo e a diminuiçao dos efeitos negativos associados à sobredosagem sao algumas das vantagens de materiais de liberaçao controlada. Vale ressaltar que a sinergia das propriedades dos materiais quitosana/argila alia as propriedades de biopolímeros e cargas naturais com a sustentabilidade do seu uso no solo em funçao das propriedades biodegradáveis da quitosana.13
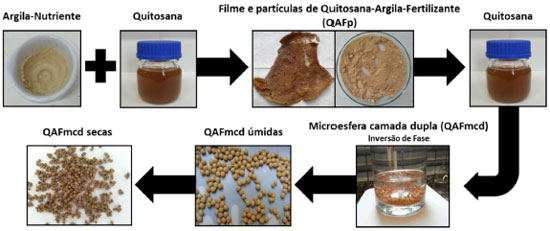
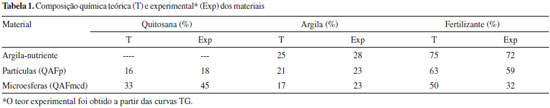
PARTE EXPERIMENTAL Materiais Os reagentes Quitosana (Polymar S/A, grau de desacetilaçao 85% e massa molar 1,8x10-5 g mol-1), Acido Acético Glacial (Synth, P.A.), Acido Bórico (Sigma-Aldrich, P.A.), Acetato de Sódio (Synth, P.A.), Cloreto de Potássio (Exodo Científica, P.A.), Hidróxido de Sódio Micropérola (Synth, P.A.), Argila Montmorilonita Brasgel Aço A (concedida pela Bentonit Uniao, CTC 85 mmol/100 g de argila), Nitrato de Potássio (concedido pelo Laboratório de Solos - UFSCar - Centro de Ciências Agrárias) foram utilizados sem prévia purificaçao. Preparaçao de argila-nutriente O nitrato de potássio foi adicionado à argila na proporçao de argila: fertilizante 1:3 (m/m), considerando a capacidade de troca catiônica da argila. A mistura foi realizada pelo processo mecanoquímico em que o nutriente foi adicionado à argila por maceraçao em almofariz previamente à mistura com a quitosana e preparaçao das microesferas. A mistura foi macerada durante 10 minutos e, após este período, foi levada à estufa para secar a temperatura controlada de 100 ºC. Preparaçao de microesferas ferti-liberadoras Inicialmente, foram preparadas duas soluçoes de quitosana de concentraçoes de 2 e 5% (m/v). Para isso, a quitosana em pó foi solubilizada em uma soluçao aquosa de ácido acético 5% (v/v), permanecendo sob agitaçao por 24 horas. Após total solubilizaçao, as dispersoes apresentaram-se com coloraçao marrom (claro), transparente e sem a presença de grumos. O pH das soluçoes de quitosana de 2 e 5% (m/v) foram 3,2 e 3,6, respectivamente. Para a preparaçao das microesferas de camada dupla (QAFmcd), partículas de quitosana-argila-fertilizante (QAFp) foram preparadas em uma etapa intermediária à preparaçao das microesferas. Inicialmente, 50 mL da soluçao de quitosana 2% (m/v) e 7 g de argila-nutriente foram misturados por agitaçao mecânica durante 24 horas. Após o processo de agitaçao, foi obtido um filme por evaporaçao da mistura (quitosana-argila-fertilizante), o qual foi triturado para obtençao de partículas. Após, as partículas foram adicionadas a 50 mL de soluçao de quitosana 5% (m/v). A soluçao assim obtida foi gotejada sobre uma soluçao de hidróxido de sódio 8% (m/v) sob agitaçao magnética, produzindo as microesferas de camada dupla. As microesferas foram lavadas com água destilada até atingir pH 7,5. Por fim, as microesferas úmidas foram levadas à estufa para secar a temperatura controlada de 100 ºC. A Figura 1 mostra um fluxograma do processo de preparaçao das microesferas de camada dupla. A fim de comparaçao, microesferas de camada simples (QAFmcs) foram obtidas pela homogeneizaçao em agitaçao mecânica de 7 g de argila-nutriente e 70 mL de soluçao de quitosana 5% (m/v). A soluçao obtida foi gotejada sobre uma soluçao de hidróxido de sódio 8% (m/v) sob agitaçao magnética. Após, as microesferas foram lavadas e secas em estufas. A Tabela 1 mostra a composiçao teórica e experimental dos materiais.
Caracterizaçao estrutural, morfológica e composiçao química dos materiais Espectros de infravermelho por transformada de Fourier (FTIR) foram registrados varrendo a regiao do espectro eletromagnético entre 4000 a 400 cm-1, usando um Espectrômetro Bomem, modelo MB100 equipado com detector DGTS e técnica de pastilha em KBr para sólidos. Ensaios de difraçao de raios-X (DRX) foram realizados em um difratômetro D8 Discover em configuraçao padrao OP1: passo 0,02, t = 6 s, 10 rpm, twin primária 0,6 mm = 0,3º, soller axial primária, twin secundária aberta fixa 5 mm = 2,5º, soller axial secundária, filtro de níquel, detector modo ID aberto 2,94º, com feixe de cobre e configuraçao 40 kV, 30 mA, monitorando os ângulos de difraçao 2 theta (2θ) de 0 a 30º, sobre amostra na forma de pó. Imagens de microscopia eletrônica de varredura (MEV) das microesferas foram registradas em um microscópio eletrônico modelo HITACHI TM3000, com tensao de aceleraçao de 15 kV, fonte de tungstênio. Análises de espectroscopia de absorçao atômica foram realizadas por um espectrômetro de absorçao atômica Varian AA240FS Fast Sequential AAS para determinar os teores dos macronutrientes. A abertura da amostra foi feita com digestao nítrico-perclórico (razao 3:1), visando solubilizar totalmente a amostra sólida. A estabilidade térmica das amostras foi determinada por análise termogravimétrica, sendo as amostras aquecidas à taxa de 10º / minuto de 25 a 1100 ºC, sob atmosfera de ar sintético em um equipamento da marca NETZCH modelo STA 449 F3. Ensaio de intumescimento Amostras de microesferas previamente pesadas foram imersas em água destilada. Após intervalos de tempos pré-determinados, as microesferas foram retiradas do solvente e novamente pesadas. O grau de intumescimento (%) da amostra foi calculado a partir da Equaçao 1, sendo mu a massa úmida após a imersao e ms a massa inicial seca do material. 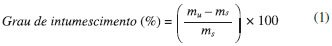 Influência do pH na taxa liberaçao A influência do pH na taxa de liberaçao foi avaliada por ensaios de condutividade iônica em diferentes meios de liberaçao, incluindo água e soluçoes tampao (pH 4, ácido acético; pH 8, ácido bórico e pH 5,5, ácido acético, que simula o pH do solo), Tabela 2. Amostras de microesferas contendo fertilizante foram imersas em cada meio à temperatura ambiente e, após intervalos de tempos específicos, alíquotas das soluçoes foram coletadas e quantificadas através de um condutivímetro microprocessado GEHAKA modelo CG 2000. A concentraçao de íons em soluçao foi determinada usando uma curva de calibraçao do respectivo fertilizante. As análises de condutividade iônica foram realizadas em triplicata.
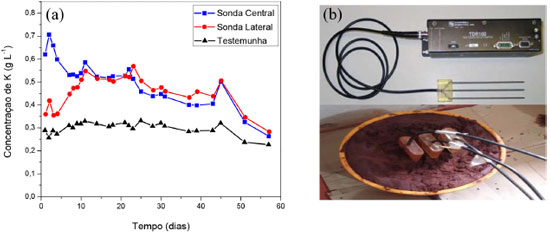
Ensaios de liberaçao em solo Ensaios in situ foram realizados e acompanhados por medidas de condutividade elétrica utilizando a técnica da TDR (Reflectometria no Domínio do Tempo). Esta técnica permite calcular o teor de água e a condutividade elétrica do solo utilizando mediçoes em tempo real.16,17 Para a realizaçao do experimento, as microesferas contendo KNO3 foram acondicionadas em baldes de 7,5 L preenchidos com solo (latosso vermelho distrófico típico), a uma profundidade de 10 cm ao meio dos baldes. A Tabela 2 mostra as características químicas do solo. As sondas, que fazem a medida elétrica, foram imersas em dois pontos: uma ao meio atingindo as microesferas e duas nas laterais do balde com 5 cm de distância, para avaliaçao da liberaçao de fertilizantes da microesferas ao longo de todo perfil do balde, Figura 7b. Os dados foram obtidos diariamente e, sempre que necessário para manter a umidade do solo (de acordo com a capacidade de campo), realizava-se a irrigaçao do sistema.
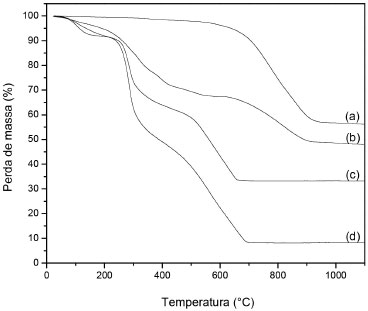 Figura 2. Curvas TG de argila-nutriente (a), QAFp (b), QAFmcd (c) e quitosana (d)
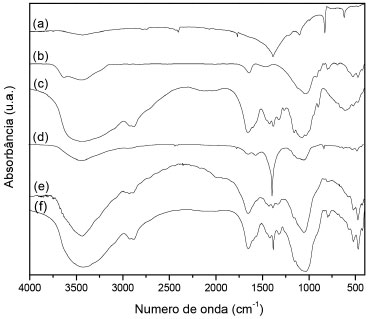 Figura 3. Espectro de FTIR do fertilizante (a), argila (b), quitosana (c), QAFp (d), QAFmcs (e) QAFmcd (f)
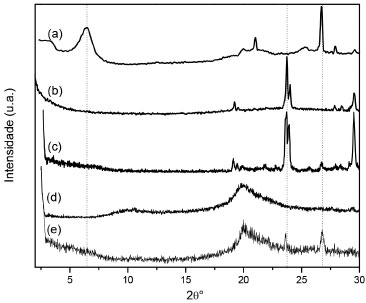 Figura 4. Difratogramas de raios-X de argila montmorilonita (a), fertilizante KNO3 (b), argila-nutriente (c), quitosana (d) e QAFmcd (e)
 Figura 5. MEV da microesfera dupla camada da superfíce (a, b) e da regiao da fratura (c, d)
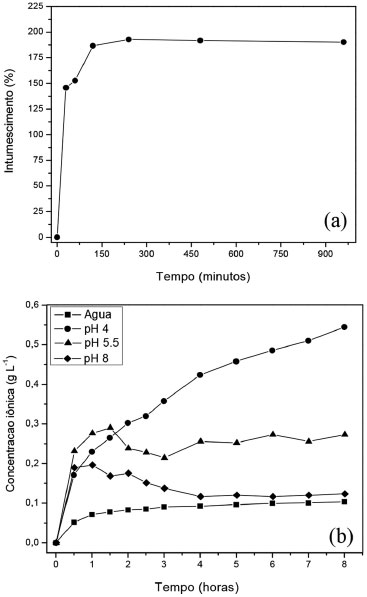 Figura 6. Grau de intumescimento em água (a) e taxas de liberaçao de íons em diferentes pHs (b) das microesferas de camada dupla
RESULTADOS E DISCUSSAO Composiçao química, caraterizaçao estrutural e morfológica O fertilizante KNO3 utilizado como fonte de potássio e nitrogênio vem sendo estudado em nosso grupo como um sistema padrao para avaliar os métodos de encapsulaçao e de liberaçao em diferentes meios e análise direta no solo.6 Neste trabalho, híbridos de quitosana-argila foram preparados em sistemas de dupla camada e os materiais foram caracterizados química, estrutura e morfologicamente. A Figura 2 mostra os resultados de TG para as amostras analisadas. Observa-se que a degradaçao ocorre em três etapas principais, exceto para a amostra argila-nutriente. As etapas de perda de massa observadas para as amostras de quitosana, QAFp e QAFmcd ocorrem aproximadamente nos intervalos de 25 a 196 ºC, 282 a 416 ºC e 516 a 910 ºC, os quais sao atribuídos a perdas de água residual, à decomposiçao do polímero através de desacetilaçao-despolimerizaçao, degradaçao dos resíduos finais do polímero e do fertilizante,18 respectivamente. As curvas TG sao importantes na determinaçao da composiçao de materiais, principalmente para materiais inorgânicos baseado em análises comparativas dos componentes dos materiais. Baseado na Tabela 1, verifica-se que o teor de fertilizante se mantém constante nos materiais argila-nutriente e QAFp, mas há uma perda de fertilizante para as microesferas de camada dupla. Esta perda está relacionada com o processo de gotejamento das soluçoes quitosana-argila-fertilizante e à lavagem das microesferas com água até pH neutro. Partículas de quitosana-argila-fertilizante foram obtidas pela simples mistura em soluçao dos componentes quitosana e argila-nutriente e levados à evaporaçao do solvente sem prévia lavagem para neutralizaçao do pH. Estes dados corroboram com os resultados obtidos por absorçao atômica em que aproximadamente 66% do nutriente potássio permaneceu encapsulado no material. Apesar da perda de ~34% do fertilizante após a obtençao das microesferas em pH neutro, ressalta-se que a preparaçao de dupla camada de quitosana é mais eficiente comparada à camada simples, em que os dados de absorçao atômica refletem que apenas 7% do fertilizante foi encapsulado, Tabela 3.
Comparando-se os espectros de FTIR das amostras QAFmcs e QAFmcd, Figura 3, verifica-se que as bandas associadas à quitosana permanecem inalteradas. Observa-se também uma banda larga na regiao de 3400 cm-1 referente ao estiramento axial de O-H sobreposta à banda de estiramento N-H. As bandas em 1648 e 1550 cm-1 foram atribuídas ao estiramento C=O de amida I e as vibraçoes de deformaçao N-H de amida II, respectivamente. Além disso, bandas de estiramento C-O em 1100 cm-1 e de estruturas polissacarídicas na regiao entre 890 a 1150 cm-1 podem ser observadas. As bandas relacionadas com Si-O e Si-O-Si em 796 e 523 cm-1 estao associadas com a argila no compósito. A presença de KNO3 nos materiais é confirmada pela presença da banda em 1380 cm-1 atribuída ao estiramento simétrico NO3- e verifica-se que as amostras QAFp e QAFmcd apresentam maior intensidades devido à presença do fertilizante no material, corroborando os resultados de TG e absorçao atômica. Informaçoes estruturais obtidas a partir de difratogramas de raios-X da dispersao argila-nutriente, Figura 4, indicam a presença de partículas contidas nas fases cristalinas associadas aos picos (2θ = 24,1 e 26,6º) característicos do fertilizante nitrato de potássio e da argila montmorilonita, respectivamente. No entanto, no difratograma das microesferas nao sao observados o aparecimento destes picos. Este comportamento pode estar relacionado ao método de preparo das microesferas por inversao de fase, cujo processo de coagulaçao do polímero se dá de forma rápida. Assim, o tempo necessário para a cristalizaçao do sal pode nao ter sido suficiente para gerar os cristais, evitando a organizaçao da fase cristalina. Além disso, também é observado que o espaçamento basal da argila montmorilonita (1,70 nm) nao está presente em nenhum dos difratogramas, que pode ser devido ao processo de esfoliaçao da mesma. As imagens de MEV, Figura 5, revelaram que as microesferas apresentam formato de gota com pequenas deformaçoes no ponto de interrupçao e superfície sem fissuras. A fase de argila dispersa na matriz de quitosana e a regiao da interface descreve a compatibilizaçao das fases, indicando boa interaçao matriz e cargas. As análises também apresentam o nutriente potássio disposto em várias regioes do material juntamente com a argila, nas áreas mais claras. A regiao de fratura evidencia uma superfície interna rugosa e porosa para o híbrido polimérico, o que proporciona uma melhor absorçao de substâncias, corroborando com os resultados de intumescimento mostrados na Figura 6. Intumescimento e liberaçao em soluçao aquosa e em solo A Figura 6a mostra o grau de intumescimento das microesferas ferti-liberadoras em água destilada. Nas primeiras horas, verificou-se que as microesferas têm alta capacidade de absorver água atingindo os valores no equilíbrio de 192%. Uma justificativa para este fenômeno pode estar associada à intercalaçao do polímero nas galerias da argila, o que pode diminuir a capacidade de ambos os materiais (argila e quitosana) incharem. Estes resultados foram consistentes com Qu e cols.,19 uma vez que os aumentos de cristalinidade para compósitos proporcionam uma reduçao de inchaço, inibindo o efeito de difusao da água. O perfil da curva de liberaçao de íons a partir das microesferas QAFmcd sugere um processo de dois estágios, Figura 6b. O primeiro estágio resulta no intumescimento das microesferas devido ao contato com o solvente. No segundo estágio, os íons sao liberados por difusao através do polímero, exceto no pH 4. Observou-se que para a liberaçao em água, os íons sao liberados de forma mais vagarosa, devido ao tempo requerido para que a permeaçao das cargas alcance o meio a partir das cavidades internas das microesferas. Para as liberaçoes nos pHs 4 e 5,5, pode-se observar uma velocidade de liberaçao mais rápida dos íons encapsulados em relaçao aos demais meios. No entanto, notou-se que as amostras de microesferas sao dissolvidas em pH 4 por conta da acidez do próprio meio. Assim, isto pode ter contribuído para que os íons contidos e/ou depositados na matriz de quitosana das microesferas alcançassem o meio em menor tempo. Para a liberaçao no pH 8, verificou-se que a liberaçao segue o processo de dois estágios citado anteriormente e seu perfil aproxima-se do comportamento observado em água, como mostrado na Figura 6b. A técnica de TDR foi usada para avaliar a liberaçao do fertilizante por 60 dias. O TDR avalia as alteraçoes na condutividade do solo, no entanto, pode-se correlacionar a condutividade iônica com a concentraçao de íons utilizando a Equaçao 2,20 sendo C a concentraçao de nitrato de potássio (mmol L-1) e CES a condutividade elétrica da soluçao (dS m-1). 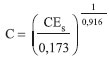 A liberaçao de fertilizante foi estimada com base na condutividade elétrica das sondas central e lateral, Figura 7, e os dados foram relacionados com a concentraçao de íons potássio no solo. De acordo com o perfil de liberaçao de potássio das sondas centrais, a maior liberaçao de fertilizante ocorre durante os primeiros dias, atingindo valores próximos de 0,706 g L-1. Esta liberaçao inicial representa a quantidade de fertilizante depositada sobre as superfícies das microesferas (as sondas centrais estao em contato com o material). Ao longo do experimento, a concentraçao de íons potássio diminui até um valor constante ser atingido. Com isso, os fertilizantes contidos no interior das microesferas permeiam para solo. Este estágio de liberaçao se apoia na dinâmica de íons em solo devido à concentraçao de K+ aumentar nas sondas laterais com o tempo.
CONCLUSOES O presente estudo demonstra um processo fácil para a síntese de um material com liberaçao controlada de fertilizantes combinado com a determinaçao direta dos nutrientes em água e solo. O método de preparo empregado mostrou-se promissor para a produçao de microesferas e encapsulamento do fertilizante nitrato de potássio. Análises estruturais confirmaram a presença do nutriente KNO3 nas microesferas ferti-liberadoras, evidenciando a capacidade do híbrido polimérico em encapsular o fertilizante químico. Resultados de DRX indicaram a ocorrência da formaçao de um sistema amorfo, o que do ponto de vista tecnológico é interessante, pois a capacidade do híbrido em absorver moléculas é favorecida com a diminuiçao do grau de cristalinidade de sua estrutura. Ensaios de intumescimento constataram que as microesferas possuem alta capacidade de absorver água, corroborando com os resultados de DRX. O perfil de liberaçao comprovou que os íons sao liberados das microesferas para o meio de forma lenta e continua por difusao através do polímero. Verificou-se que fatores como pH impoe uma modificaçao ao perfil de liberaçao. A técnica TDR permitiu a determinaçao do perfil real de liberaçao de nutrientes no solo.
AGRADECIMENTOS A FAPESP (proc. 2014/06566-9 e 2014/09045-0) e à Bentonit Uniao pela concessao da Argila Montmorilonita.
REFERENCIAS 1. http://www.ibram.org.br/sites/1300/1382/00000978.pdf, acessada em março 2016. 2. Welter, M. K.; Melo, V. F.; Bruckner, C. H.; de Góes, H. T.; Chagas, E. A.; Uchôa, S. C. P.; Rev. Bras. Frutic. 2011, 33, 922. 3. http://www.anda.org.br/boletins/fertilizantes_meio_ambiente.pdf, acessada em março 2016. 4. Chen, L.; Xie, Z.; Zhuang, X.; Chen, X.; Jing, X.; Carbohydr. Polym. 2008, 72, 342. 5. Ghormade, V.; Deshpande, M. V.; Paknikar, K. M.; Biotechnol. Adv. 2011, 29, 792. 6. Santos, B. R.; Bacalhau, F. B.; Pereira, T. S.; Souza, C. F.; Faez, R.; Carbohydr. Polym. 2015, 127, 340. 7. Vandana, G.; Mukund, V. D.; Kishore, M. P.; Biotechnol. Adv. 2011, 29, 792. 8. Wu, L.; Liu, M.; Carbohydr. Polym. 2008, 72, 240. 9. Torres, M. A.; Vieira, R. S.; Beppu, M. M.; Arruda, E. J.; Santana, C. C.; Mat. Res. 2007, 10, 347. 10. Dias, F. S.; Queiroz, D. C.; Nascimento, R. F.; Lima, M. B.; Quim. Nova 2008, 31, 160. 11. Kumar, M. N. V. R.; React. Funct. Polym. 2000, 46, 27. 12. Azevedo, V. V. C.; Chaves, S. A.; Bezerra, D. C.; Fook, M. V. L.; Costa, A. C. F.; Revista Eletrônica de Materiais e Processos 2007, 2.3, 27. 13. Park, D.-H.; Hwang, S.-J.; Oh, J.-M.; Yang, J-H.; Choy, J.-H.; Prog. Polym. Sci. 2013, 38, 1442. 14. Torres, M. A.; Viera, R. S.; Beppu, M. M.; Santana, C. C.; Polímeros 2005, 15, 306. 15. Kashyap, P. L.; Xiang, X.; Heiden, P.; Int. J. Biol. Macromol. 2015, 77, 36. 16. Noborio, K.; Computers and Electronics in Agriculture 2001, 31, 213. 17. Conciani, W.; Herrmann, P. S. P.; Machado, S. L.; Soares, M. M.; Solos e Rochas 1996, 19, 189. 18. Wang, S. F.; Shen, L.; Tong, Y. J.; Chen, L.; Phang, I. Y.; Lim, P. Q.; Liu, T. X.; Polym. Degrad. Stabil. 2005, 90, 123. 19. Qu, X.; Wirsén, A.; Albertsson, A. C.; Polymer 2000, 41, 4589. 20. Souza, C. F.; Folegatti, M. V.; Matsura, E. E.; Or, D.; Eng. Agric. 2006, 26, 282. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access