Artigo
|
|
| Aplicação da técnica de eletrodiálise no tratamento de efluentes de tingimento de gemas contendo íons nitrato e cromo Application of electrodialysis to the treatment of effluent from the agate dyeing industry with nitrate and chromium ions |
|
Maria de Lourdes Martins Magalhaes; Verônica Radaelli Machado; Eduardo Miranda Ethur; Simone Stülp*
Centro de Ciências Exatas e Tecnológicas, Univates, 95900-000 Lajeado - RS, Brasil Recebido em 26/04/2016 *e-mail: stulp@univates.br The dyeing agate employs large quantities of potentially harmful wastewater to the environment, such as, effluent with chromium and nitrate ions. The aim of the present study was investigate the electrodialysis technique efficiency in the removal of contaminant ions present in wastewater generated by the agate dyeing industry and evaluate the toxicity of the effluent studied. The electrodialysis experiments were performed in acrylic cell 5 compartments separated by ion selective membranes and fitted with a 70TiO2/30RuO2 DSA® anode and a titanium plate as cathode. After application of the electrodialysis treatment, toxicity of the effluent was evaluated in two different trophic levels, Artemia salina and Lactuca sativa. The results indicated the removal of 233.3 mg L-1 of nitrate and 223.6 mg L-1 of chromium was extracted, in flow mode. The toxicity tests showed a tendency to decrease the percentage of mortality of organisms after application of the electrodialysis technique. Thus, it concludes that the electrodialysis is an effective method for treating effluents containing metal ions, and is possible reuse the recovered solutions in the dyeing process. INTRODUÇAO O Brasil destaca-se mundialmente pela diversidade de gemas encontradas em seu solo. O estado do Rio Grande do Sul apresenta um dos maiores centros de produçao gemológica do país.1 Alguns municípios concentram um alto número de indústrias de processamento com empresas de pequeno, médio e grande porte que atuam no setor de beneficiamento de gemas. Dentre estas, destaca-se a ágata, que pode ser utilizada em sua forma natural ou modificada, na maioria das vezes, por processos de tingimento com corantes e obtençao de várias coloraçoes como rosa, roxa, verde e vermelha.2 Os processos convencionais de tingimento envolvem tratamentos térmicos3 e empregam corantes orgânicos sintéticos tais como cristal violeta e rodamina-B,4 além de soluçoes contendo nitrato, cianeto ou amônio e complexos de cromo ou ferro2 e têm gerado consideráveis volumes de efluentes líquidos caracterizados por coloraçoes acentuadas, concentraçoes elevadas de íons de vários metais, além de alta carga orgânica, tendo como consequências a geraçao de um passivo ambiental, já que esses corantes sao potenciais contaminantes. Atualmente, há um crescente interesse em processos alternativos de tratamento de águas residuais que gerem o mínimo de agressao ao meio ambiente, sejam economicamente viáveis e permitam o reuso da água. Estudos na área de tratamento de efluentes dos tingimentos de gemas têm sido realizados a partir de processos fotocatalíticos e de adsorçao no caso da remoçao da rodamina-B,5 métodos fotocatalíticos6 e de biossorçao7 para a degradaçao do cristal violeta, além dos métodos de oxidaçao química8 e por Fenton,9 que visam a remoçao dos componentes orgânicos. Entretanto, há a necessidade de técnicas que permitam a remoçao dos íons metálicos presentes nesses efluentes. A eletrodiálise (ED) é uma técnica eletroquímica que tem sido empregada na dessalinizaçao da água10 e no tratamento de águas residuais para a remoçao de íons como, por exemplo, cádmio,11 cromo,12,13 e nitrato,14-17 na qual espécies iônicas em soluçao sao transportadas em compartimentos de uma célula através de membranas íon-seletivas, aniônica e catiônica, por açao de um campo elétrico,18 sem a necessidade da adiçao de reagentes químicos. A ED apresenta benefícios quando comparada aos processos tradicionais,19,20 já que nao demanda mudança de fases, funciona de forma contínua, nao requer adiçao de reagentes, além de minimizar a geraçao de resíduos poluentes ao meio ambiente. Com base em algumas aplicaçoes, como o tratamento de efluentes, a ED surge como uma tecnologia limpa e demonstra a possibilidade de reuso dos íons presentes inicialmente no efluente e da água. Neste sentido, o objetivo do presente trabalho é avaliar a eficiência da técnica de ED na extraçao de íons presentes em efluentes gerados pelo tingimento de ágatas em célula de 5 compartimentos. Além disso, propoe-se investigar a toxicidade do efluente estudado, antes e após a aplicaçao da técnica de ED, vislumbrando possibilidades de reuso.
PARTE EXPERIMENTAL Aplicaçao do tratamento de eletrodiálise Os experimentos de ED foram realizados em célula de acrílico de 5 compartimentos,21 sendo que no compartimento central foi adicionado o efluente a ser tratado. O efluente estudado é um efluente real proveniente de indústria de beneficiamento de gemas localizada no RS, constituído de soluçoes de lavagem provenientes do pós-tingimento verde e vermelho2 de ágatas, que contém em meio ácido íons tais como ferro, cromo (Cr6+ e Cr3+), nitrato e amônio. A corrente elétrica aplicada no sistema de ED foi de 2,2 A, com base em estudos prévios de corrente limite por meio de curvas de polarizaçao (Figura 1S - Material suplementar), e o potencial de célula era de 30 V. A célula de eletrodiálise em escala laboratorial foi construída em material acrílico transparente e compoe 5 compartimentos separados por membranas íon seletivas (Figura 1) e seu volume total aproximado é de 7 litros, sendo 1,4 L por compartimento. Como ânodo foi utilizado um eletrodo de 70TiO2/30RuO2 DSA® e como cátodo uma placa de titânio De Nora com áreas de imersao de 189 cm2. As membranas ânion e cátion seletivas sao Selemion AMV e Selemion CMV, respectivamente, com uma área de 63,61 cm2. Os compartimentos laterais foram preenchidos com uma soluçao de sulfato de sódio 0,2 mol L-1 como soluçao eletrolítica,22,23 concentraçao esta que foi utilizada por questoes de design e resistência elétrica da célula eletrodialítica.24 Para a aplicaçao de corrente no sistema foi utilizada uma fonte de corrente constante ICEL PS 7000 (0-35 V; 0-3 A). O tempo de tratamento aplicado ao efluente foi em um período de 6 horas. As análises de pH e condutividade foram feitas in situ do tempo 0 a 6 horas, o pHmetro utilizado foi o 827 pH Lab da Metrohm e o condutivímetro utilizado é o 856 Conductivity Module da Metrohm. Para as demais análises foram coletadas alíquotas de hora em hora. Dentre os parâmetros analisados, tem-se o nitrogênio total pelo TNM-1 da Shimadzu, a concentraçao de íons nitrato por meio da utilizaçao do medidor de nitrato 781 pH/ ion meter Metrohm e a concentraçao dos íons cromo por espectrometria de absorçao atômica (Perkin Elmer Analyst 100). O sistema de eletrodiálise foi operado em modo estático e em fluxo (recirculaçao), em relaçao ao compartimento central da célula. Nos ensaios em fluxo foi utilizada bomba peristáltica (AWG 5000 ABS Provitec), com vazao de 100 L h-1,25 com fluxo ascendente.
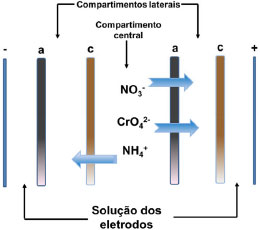 Figura 1. Esquema da célula e da passagem de íons no sistema estudado
Os resultados obtidos sao expressos em termos de reduçao percentual de íons nitrato e cromo. Para íons nitrato foi utilizada a Equaçao 1. 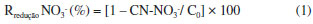 em que C0 é a concentraçao inicial de nitratos e CN-NO3- é a concentraçao de nitrato no tempo t. Esta equaçao foi igualmente utilizada para a avaliaçao da reduçao percentual dos íons cromo presentes em soluçao. Além dos parâmetros mencionados, foi realizado o monitoramento dos íons ferro presentes no efluente por espectrometria de absorçao atômica. Ensaios de toxicidade do efluente antes e após a aplicaçao de eletrodiálise Utilizaram-se os organismos teste Artemia salina26 e Lactuca sativa27 para avaliaçao de toxicidade em dois diferentes níveis tróficos. Para o teste de toxicidade com sementes de alface (Lactuca sativa) foram utilizadas alíquotas do efluente antes e após o tratamento, em concentraçoes do efluente de 10 e 100% com as quais foram realizados os ensaios. Para cada concentraçao, foi utilizada uma placa de petri com 10 sementes, sendo que sobre estas foi adicionado o efluente, onde foram cultivadas no período de 120 horas, com ausência de luz, com temperatura controlada de 25 ºC. Após este período, as sementes foram retiradas da estufa de germinaçao (SL 225 Solab) para contagem e mediçao do desenvolvimento da raiz e caule. Já para os testes de toxicidade com o organismo Artemia salina28 foram utilizadas alíquotas do efluente bruto e pós-tratamento.29 Foi utilizada soluçao aquosa contendo cloreto de sódio 27 g L-1 para a eclosao dos ovos da Artemia salina, com ajuste de pH para a neutralidade. Após eclosao e estabilizaçao, foram transferidos 10 náuplios de Artemia salina para 24 tubos de ensaio utilizados como poços e adicionados 2 mL do efluente bruto e do efluente tratado por 6 horas, nas concentraçoes de 10, 20, 50, 80 e 100%. As placas foram mantidas sob temperatura controlada entre 26 e 28 ºC e proteçao da luz. Foi verificado o número de sobreviventes no intervalo de 24 horas.30 O ensaio foi realizado em triplicata de amostras. Reuso das soluçoes contendo íons recuperados por ED Após aplicaçao do tratamento de ED, a soluçao recuperada no compartimento anódico foi utilizada em estudos de tingimento de ágatas, avaliando a possibilidade de utilizaçao desta após recuperaçao. Para a reutilizaçao da soluçao, foi adicionado sal de amônio ao meio. Esta adiçao faz-se necessária em funçao do procedimento para tingimento de gemas com soluçoes que contém íons cromo2 seguindo as seguintes etapas: o tratamento envolve imersao inicial em soluçao aquosa contendo ácido crômico e sal de amônio, em pH ácido, na proporçao 3:2 v/v. As gemas permanecem imersas nesta soluçao por 15 dias. Após lavagem, é realizado tratamento térmico em mufla, a 220 ºC, por 48 horas. E como última etapa tem-se a lavagem final. Após o processo de tingimento, a avaliaçao da coloraçao antes e após o processo de imersao seguido do tratamento térmico foi realizada segundo metodologia proposta, que se baseia na análise por scanner das gemas seguida de avaliaçao por software adequado em termos de parâmetros tais como brilho, cor, dentre outros,31,32 utilizando parâmetros do sistema cromático HSB (Hue, Saturation and Brightness).
RESULTADOS E DISCUSSAO Aplicaçao da técnica de eletrodiálise A técnica de eletrodiálise foi aplicada por 6 horas em efluentes provenientes do processo de tingimento de ágatas. Os parâmetros condutividade, nitrogênio total (NT), concentraçao de nitratos e cromo foram avaliados em funçao do tempo de aplicaçao do experimento de eletrodiálise. Na Figura 2 tem-se os resultados em termos de condutividade (mS cm-1) para os efluentes do compartimento central (b) e dos compartimentos anódico e catódico (a) em funçao do tempo do tratamento de eletrodiálise, em célula estática.
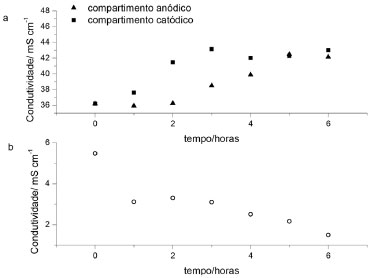 Figura 2. Valores de condutividade para os efluentes de tingimento de gemas durante o experimento de eletrodiálise estático, nos compartimentos anódico e catódico da célula de eletrodiálise (a) e central (b)
Analisando os resultados apresentados na Figura 2, relativos ao experimento de ED estático, verifica-se que a condutividade relativa ao compartimento central (efluente antes do tratamento) tende a diminuir, sendo que inicialmente o efluente apresenta condutividade de 5,48 mS cm-1 e após 6 horas de tratamento a condutividade é igual a 1,5 mS cm-1. Já para os compartimentos laterais, catódico e anódico, respectivamente, no tempo inicial a condutividade é de 36,19 mS cm-1, para ambos compartimentos, e após 6 horas a condutividade é de 43,01 e 40,13 mS cm-1, apresentando portanto valores crescentes em funçao do tempo de tratamento, demonstrando a passagem dos íons pelas membranas íon-seletivas, de forma crescente, durante o processo de ED. Para o sistema em fluxo, o comportamento foi semelhante em termos de variaçao de condutividade, ficando na mesma ordem de grandeza o decréscimo de condutividade no compartimento central. Já nos compartimentos laterais, a variaçao (incremento) de condutividade foi de 9,88 mS cm-1 no anódico e, no catódico, houve o incremento de 5,55 mS cm-1. As concentraçoes de nitrogênio e cromo, em mg L-1, também foram avaliadas nos diferentes compartimentos em funçao do tempo, na célula de eletrodiálise. Na Tabela 1 sao apresentados os valores de NT, nitrato e cromo nos compartimentos central, anódico e catódico da célula de eletrodiálise para experimentos realizados em modo estático e em fluxo.
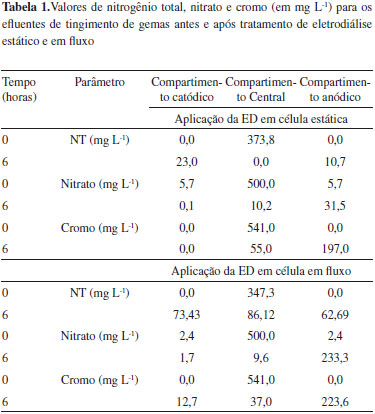
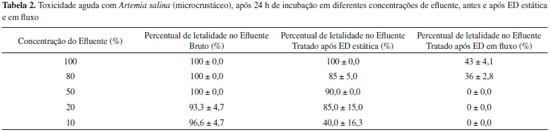
Por meio da avaliaçao dos resultados (Tabela 1), nos três compartimentos avaliados - central e laterais, após 6 horas de tratamento por eletrodiálise, espera-se que ocorra, no compartimento central, a diminuiçao da concentraçao de NT e nitratos, sendo que os resultados obtidos demonstram que houve reduçao de NT de 373,8 mg L-1 para 0 mg L-1. Já em termos de nitrato, a concentraçao passou de 500 mg L-1 para 10,2 mg L-1, para os experimentos no modo estático. No compartimento anódico era esperado o aumento da concentraçao de nitrato, sendo que, com a aplicaçao do tratamento houve, neste compartimento, o aumento para 31,5 mg L-1 de nitrato e 10,7 mg L-1 em termos de concentraçao de nitrogênio. Já no compartimento catódico a concentraçao de nitrogênio aumentou e passou para 23,0 mg L-1. Ou seja, ao final do tratamento, partindo de uma concentraçao inicial de nitrato de 373,8 mg L-1, obteve-se, em termos de recuperaçao e concentraçao nos compartimentos laterais, 54,5 mg L-1 em termos de concentraçao de espécies de nitrogênio. Estes resultados sao concordantes com a representaçao apresentada na Figura 1, onde pode ser observada, de forma esquemática, a migraçao de íons pelas membranas ânion e cátion seletivas. Comparando os resultados encontrados com estudos anteriores,33,34 verifica-se que o percentual de reduçao obtido para o íon nitrato está de acordo com o tempo de tratamento utilizado. Em relaçao ao comportamento dos valores de pH nos compartimentos da célula durante a realizaçao do tratamento de eletrodiálise, verifica-se que o compartimento central tende a manter o pH ácido. O compartimento catódico tende ao decréscimo do valor de pH, em funçao da passagem dos prótons presentes inicialmente no compartimento central, sendo que em t0 o pH da soluçao de sulfato de sódio utilizada como soluçao dos compartimentos laterais é igual a 5. Já em relaçao ao compartimento anódico, há a tendência de incremento de pH, em funçao especialmente das espécies de cromo que migram para este compartimento no decorrer do experimento, na forma de CrO42-. Em relaçao à remoçao dos íons cromo presentes no efluente, houve uma expressiva reduçao percentual de 89,8% quando avaliado o compartimento central da célula. Comparando os resultados encontrados com estudos anteriores verifica-se, portanto, a eficiência do processo aplicado, sendo que o percentual de remoçao de cromo é extremamente dependente das condiçoes experimentais utilizadas quando da aplicaçao da técnica de ED.35,36 Desta forma, a partir dos resultados obtidos para os experimentos de ED em modo estático verifica-se que houve a remoçao em termos de íons nitrato e cromo, na avaliaçao relativa ao compartimento central, devendo ser considerado que houve a formaçao de precipitado neste compartimento durante o experimento de ED. Além da formaçao de precipitados, há também a decantaçao de materiais particulados ao fundo da célula no mesmo compartimento. A formaçao do precipitado insolúvel, que pode ser removido posteriormente por separaçao física, promove diferenças no somatório total, em termos de concentraçao de íons nitrato e cromo, quando comparados os valores iniciais e após 6 horas de tratamento, dos compartimentos central, anódico e catódico. A decantaçao de materiais particulados ao fundo da célula no compartimento central também pode ocasionar a variaçao do somatório de concentraçoes, devendo ser considerado que as soluçoes (efluente) antes do tratamento, quando da sua estocagem após coleta na indústria, igualmente apresentam pequena decantaçao de particulados. Isto pode ser explicado pela presença de concentraçoes de matéria orgânica (TOC ≈ 60 mg L-1) no efluente proveniente das etapas de corte e lapidaçao das gemas, com a utilizaçao de óleo diesel marítimo como lubrificante, etapas estas que sao realizadas previamente ao processo de tingimento.3 A ocorrência destes fenômenos durante a ED pode estar vinculada ao fato de que quando há o contato de soluçoes que contém ácido crômico com membranas aniônicas, estas podem ser gradualmente preenchidas com íons policromato (do tipo CrnO2-3n+1), que sao oxo-ânions com estrutura de tamanho maior resultante de ligaçoes entre íons HCrO4- tetraédricos. Este preenchimento diminui a mobilidade e aumenta a resistência da célula, podendo inclusive alterar a permeseletividade da membrana.37-39 Ainda, apesar da manutençao do pH ácido, há a tendência de aumento do pH no compartimento central (de pH 3 para pH 4) pela migraçao de íons durante a ED, o que pode favorecer a precipitaçao e/ou complexaçao dos íons Cr3+ presentes no efluente.39-41 Adicionalmente, há a presença de íons ferro no efluente em estudo, em concentraçoes iniciais de 124 mg L-1, que igualmente podem participar da formaçao de precipitados, considerando que apesar do pH ácido, a formaçao destes precipitados pode ser originada em funçao de variaçoes locais do pH, como por exemplo, na interface membrana/soluçao.42 A formaçao destes precipitados constitui-se em uma limitaçao43 da aplicaçao do tratamento de eletrodiálise, que pode ser minimizada com alteraçoes de layout da célula e condiçoes de realizaçao dos experimentos,44,45 sendo que a agitaçao do sistema pode minimizar esses efeitos.25,46 Já em relaçao aos experimentos em fluxo, houve a recuperaçao de 306,73 mg L-1 de íons nitrogenados, e 223,6 mg L-1 de íons cromo hexavalente. Verifica-se que para esta condiçao experimental o fenômeno de precipitaçao é minimizado, bem como a decantaçao. Estes resultados superiores em termos de eficiência de remoçao podem estar relacionados com o incremento de íons transportados devido à turbulência local na interface soluçao/membrana.25 Ensaios de toxicidade do efluente antes e após a aplicaçao de eletrodiálise Em termos de toxicidade foram avaliados dois organismos teste, sendo que inicialmente avaliou-se a toxicidade frente à Artemia salina, e posteriormente a fitotoxidade foi avaliada utilizando-se sementes de Lactuca sativa. A avaliaçao em diferentes níveis tróficos segue orientaçoes de resoluçoes ambientais vigentes.47 Na Tabela 2 sao mostrados os resultados obtidos a partir dos ensaios de toxicidade aguda utilizando como organismo teste a Artemia salina. Os resultados foram comparados em termos de percentual de mortalidade48 da Artemia salina para o efluente bruto e tratado (após 6 h de ED).
Avaliando a Tabela 2, pode-se verificar que o efluente bruto, nas diferentes concentraçoes avaliadas, apresentou toxicidade aguda em níveis elevados frente à Artemia salina. Já o efluente após ser submetido ao tratamento de eletrodiálise (em sistema estático) teve sua toxicidade diminuída, sendo que a Concentraçao Letal (LC50) para o efluente tratado é de LC50 = 17%. Já para o modo em fluxo, os resultados foram ainda mais interessantes em termos de reduçao de toxicidade após ED, sendo que para todas as concentraçoes analisadas a letalidade ficou abaixo de 50%. Resultados obtidos em efluentes49 contendo cromo indicaram elevado LC50 com efeitos prejudiciais em diferentes organismos, resultados estes que confirmam os obtidos no presente estudo, já que os efluentes tratados por ED em fluxo foram menos tóxicos, provavelmente em funçao dos valores de concentraçao menores em termos de íons cromo após aplicaçao do tratamento. Em termos de avaliaçao de fitotoxidade, os efluentes bruto e tratado (ED modo estático) apresentaram alta toxicidade em funçao da completa letalidade promovida nas sementes de Lactuca sativa. Já quando estes sao diluídos a 10%, verifica-se que há uma tendência de diminuiçao do percentual de letalidade após a aplicaçao da técnica de ED em modo estático. Porém, cabe salientar que mesmo apresentando reduçao de toxicidade, o efluente após tratamento ainda apresenta fitotoxidade elevada, demonstrando a importância de avaliaçao da toxicidade em mais de um nível trófico. O efluente bruto apresentou percentual de letalidade de 91,85%, já o efluente tratado 85,74%. Em relaçao ao efluente na concentraçao 10%, tratado por ED em fluxo, o percentual de letalidade foi de 83%. Estudos demonstraram que há um significativo aumento da mortalidade das sementes de Lactuca sativa na presença de cromo.50 Além disso, o alongamento da raiz foi a medida mais sensível em termos de inibiçao. Reuso das soluçoes contendo íons recuperados por ED Em termos de avaliaçao de possibilidade de reuso, em relaçao aos íons recuperados após aplicaçao da técnica de ED em fluxo, em especial o íon cromo, estes podem retornar para o banho de tingimento utilizado no beneficiamento de gemas,1 e a água tratada do compartimento central pode ser incorporada ao banho de lavagem, consistindo na segunda etapa do processo de tingimento de gemas, ou ainda adicionada ao tanque de lavagem após tratamento térmico das gemas coradas. Em estudos realizados pelo grupo de pesquisa, verificou-se a possibilidade de tingimento de ágatas com soluçao proveniente do compartimento anódico após aplicaçao da técnica de ED. Na Figura 3 podem ser avaliadas imagens, do aspecto visual, de gemas antes e após tingimento utilizando soluçoes contendo majoritariamente íons cromo recuperados pela técnica de ED. A avaliaçao por meio da utilizaçao de scanner permitiu verificar que as gemas após terem sido submetidas ao processo de tingimento em soluçoes recuperadas pela técnica de ED apresentaram tons entre amarelo e verde,31 enquanto que as nao tingidas apresentaram, pela avaliaçao, tons cinza azulado, característicos de ágata no estado bruto,2 indicando a viabilidade de aplicaçao deste processo.
 Figura 3. Imagens das gemas antes (a) e após tingimento (b) com soluçao recuperada pela técnica de eletrodiálise
Cabe ressaltar que, por este setor produtivo se configurar como um setor vinculado à economia criativa, este segue tendências de mercado vinculadas ao processo de criaçao, sendo que as coloraçoes e tonalidades podem sofrer alteraçoes de uma coleçao para outra, exigindo a possibilidade de minimizaçao de impactos ambientais, sendo adequada a possibilidade de produçao em ciclo fechado. Ainda é importante destacar que a incorporaçao de práticas que permitam o reuso de água e insumos se torna cada vez mais necessária. Diversos estudos têm sido publicados apresentando resultados de aplicaçao de técnicas avançadas de tratamento de efluentes, mas poucos discutem e apresentam alternativas de reuso,51 sendo esta uma medida altamente desejável, buscando diminuir o consumo de água e insumos e reduzir os custos de produçao.
CONCLUSOES Os resultados obtidos nesse estudo evidenciaram que é válida a possibilidade de utilizar a técnica de eletrodiálise como um tratamento de efluentes contendo íons metálicos nas indústrias de gemas, principalmente no tingimento de ágatas. Verificou-se uma reduçao na condutividade das soluçoes do compartimento central e incrementos nos compartimentos laterais após 6 horas de tratamento em modo estático e em fluxo, o que expressa a passagem de íons pelas membranas íon-seletivas. Houve a recuperaçao de 306,73 mg L-1 de íons nitrogenados e 223,6 mg L-1 de cromo hexavalente inicialmente presentes no efluente bruto, o que demonstra a eficiência da técnica de ED em fluxo. Ensaios de toxicidade com Artemia salina e Lactuca sativa apresentaram uma reduçao na porcentagem de mortalidade de organismos após o tratamento da ED. Os resultados apontam a possibilidade do reuso de íons, principalmente cromo, em um subsequente processo de tingimento de ágatas.
MATERIAL SUPLEMENTAR No material suplementar, disponível em http://quimicanova.sbq.org.br na forma de arquivo PDF, com acesso livre, está a curva de polarizaçao relativa aos ensaios para determinaçao da corrente limite para o sistema em estudo (Figura 1S).
AGRADECIMENTOS Os autores agradecem a Capes e CNPq (processo nº 310421/2013-6) pelos auxílios concedidos.
REFERENCIAS 1. Brum, I. A. S.; Silva, R. A. Em Tecnologia para o Setor de Gemas, Joias e Mineraçao; Hartmann, L. A.; da Silva, J. T., eds.; UFRGS: Porto Alegre, 2010, cap. 15. 2. Silva, R. de A.; Petter, C. O.; Schneider, I. A. H.; REM, Rev. Esc. Minas 2007, 60, 477. 3. Pshenichnyi, M. I.; Russ. J. Gen. Chem. 2011, 81, 1375. 4. Machado, E. L.; Dambros, V. S.; Kist, L. T.; Lobo, E. A. A.; Tedesco, S. B.; Moro, C. C.; Water, Air, Soil Pollut. 2012, 223, 1753. 5. Jain, R.; Mathur, M.; Sikarwar, S.; Mittal, A.; J. Environ. Manage. 2007, 85, 956. 6. Sahoo, C.; Gupta, A. K.; Pal, A.; Dyes Pigm. 2005, 66, 189. 7. Saha, P. D.; Chakraborty, S.; Chowdhury, S.; Colloids Surf., B. 2012, 92, 262. 8. Pizzolato, T. M.; Carissimi, E.; Machado, E. L.; Schneider, I. A. H.; Int. J. Miner. Process. 2002, 65, 203. 9. Barros, A. L.; Pizzolato, T. M.; Carissimi, E.; Schneider, I. A. H.; Miner. Eng. 2006, 19, 87. 10. Valerdi-Pérez, R.; Ibáñez-Mengual, J. A.; Desalination 2001, 141, 23. 11. Marder, L.; Bernardes, A. M.; Ferreira, J. Z.; Sep. Purif. Technol. 2004, 37, 247. 12. Chen, S-S.; Li, C-W.; Hsu, H-D.; Lee, P-C.; Chang, Y-M.; Yang, C-H.; J. Hazard. Mater. 2009, 161, 1075. 13. Nataraj, S. K.; Hosamani, K. M.; Aminabhavi, T. M.; Desalination 2007, 217, 181. 14. Menkouchi Sahli, M. A.; Annouar, S.; Mountadar, M.; Soufiane, A.; Elmidaoui, A.; Desalination 2008, 227, 327. 15. Ndusekhar, V. K.; Trivedi, G. S.; SHAH, B. G.; Desalination 1991, 84, 213. 16. Menkouchi Sahli, M. A.; Tahaikt, M.; Achary, I.; Taky, M.; Elhanouni, F.; Hafsi, M.; Elmghari, M. Elmidaoui, A.; Desalination 2004, 167, 359 17. Bosko, M. L.; Rodrigues, M. A. S.; Ferreira, J. Z.; Miró, E. E.; Bernardes, A. M.; J. Membr. Sci. 2014, 451, 276. 18. Brett, C. M. A.; Brett, A. M. O.; Electrochemistry: principles, methods and applications, 1st ed., Oxford Science: London, 2005. 19. Strathmann, H.; Ion-exchange membrane separation processes. Membrane Science and Technology Series, 1st ed., Elsevier: Amsterdam, 2004. 20. Tahaikt, M.; Achary, I.; Menkouchi Sahli, M. A.; Amor, Z.; Taky, M.; Alami, A.; Boughriba, A.; Hafsi, M.; Elmidaoui, A.; Desalination 2004, 167, 357. 21. Marder, L.; Sulzbach, G. O.; Bernardes, A. M.; Ferreira, J. Z.; J. Braz. Chem. Soc. 2003, 14, 610. 22. Banasiak, L. J.; Kruttschnitt, T. W.; Schäfer, A. I.; Desalination 2007, 205, 38. 23. Grigorchuk, O. V.; Vasil'eva, V. I.; Shaposhnik, V. A., Kuz'minykh, V. A.; Russ. J. Electrochem. 2003, 39, 777. 24. Vera, E.; Sandeaux, J.; Persin, F.; Pourcelly, G.; Dornier, M.; Ruales, J.; J. Food Eng. 2007, 78, 1427. 25. Cifuentes, L.; García, I.; Arriagada, P.; Casas, J. M.; Sep. Purif. Technol. 2009, 68, 105. 26. Pimentel, M. F.; Silva Júnior, F. C. G.; Santaella, S. T.; Lotufo, L. V. C.; J. Braz. Soc. Ecotoxicol. 2011, 6, 15. 27. Garcia, J. C.; Simionato, J. I.; Almeida, V. C.; Palácio, S. M.; Rossi, F. L.; Schneider, M. V.; de Souza, N. E.; J. Braz. Chem. Soc. 2009, 20, 1589. 28. Coelho, G. A.; Weinschutz, R.; Dallavalli, M. J.; Mathia, A. L.; Rev. Arvore 2014, 38, 927. 29. Meyer, B. N.; Ferrigni, N. R.; Putnam, L. B.; Jacobsen, L. B.; Nichols, D. E.; Mclaughlin, J. L.; J. Med. Plants Res. 1982, 45, 31. 30. Migliore, L.; Civitareale, C.; Brambilla, G.; Di Delupis, G. D.; Water Res. 1997, 31, 1801. 31. Motoki, A.; Zucco, L. L.; Sichel, S. E.; Aires, J. R.; Petrakis, G. H.; Geociências 2006, 5, 403. 32. Motoki, A.; Vargas, T.; Peixoto, J. L. N.; Min. Metal. 2000, 554, 14. 33. Menkouchi Sahlia, M. A.; Tahaikta, M.; Acharya, I.; Takya, M.; Elhanounia, F.; Hafsib, M.; Elmgharib, M.; Elmidaouia, A.; Desalination 2006, 189, 200. 34. Schoeman, J. J.; Water SA 2009, 35, 721. 35. Hsu, H.-T.; Chen, S.-S.; Chen, Y-S.; Sep. Purif. Technol. 2011, 80, 663. 36. Moura, R. C. A.; Bertuol, D. A.; Ferreira, C. A.; Amado, F. D. R.; Int. J. Chem. Eng. 2012, 2012, ID 179312. 37. Vallejo, M. E.; Persin, F.; Innocent, C.; Sistat, P.; Pourcelly, G.; Sep. Purif. Technol. 2000, 21, 61. 38. De Körösy, F.; Zeigerson, E.; Desalination 1968, 5, 185. 39. Jin, W.; Du, H.; Zheng, S.; Zhang, Y.; Electrochim. Acta 2016, 191, 1044. 40. Mandich, N. V.; Plat. Surf. Finish. 1997, 84, 108. 41. Medina, B. Y.; Torem, M. L.; Mesquita, L. M. S.; Miner. Eng. 2005, 18, 225. 42. Chekioua, A.; Delimi, R.; Energy Procedia 2015, 74, 1418. 43. Bannoud, A.; Desalination 1993, 93, 545. 44. Feng, X. Wu, Z. Chen, X. Sep. Purif. Technol. 2007, 57, 257. 45. Dermentzis, K.; J. Hazard. Mater. 2010, 173, 647. 46. Brauns, E.; Bossaer, J.; Toye, S.; Mijnendonckx, K.; Pinoy, L.; Van der Bruggen, B.; Sep. Purif. Technol. 2012, 98, 356. 47. BRASIL. Ministério do Desenvolvimento Urbano e Meio Ambiente. Conselho Nacional do Meio Ambiente (CONAMA); Resoluçao do no 430, de 13/05/11, Brasília: Brasil. 48. de Souza, S. M. A. G. U.; Forgiarini, E.; de Souza, A. A. U.; J. Hazard. Mater. 2007, 147, 1073. 49. Arias-Barreiro, C. R.; Nishizaki, H.; Okubo, K.; Aoyama, I.; Mori, I. C.; J. Environ. Biol. 2010, 31, 471-475. 50. Naaz, S.; Pandey, S. N.; J. Environ. Biol. 2010, 31, 273. 51. Zanella, G.; Scharf, M.; Vieira, G. A.; Peralta-Zamora, P.; Quim. Nova 2010, 33, 1039. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access