Artigo
|
|
| Degradação fotocatalítica de tartrazina com TiO2 imobilizado em esferas de alginato Photocatalytic degradation of tartrazine with immobilized TiO2 in alginate beads |
|
Ithiara Dalponte*; Alvaro Luiz Mathias; Regina Maria Matos Jorge; Regina Weinschutz
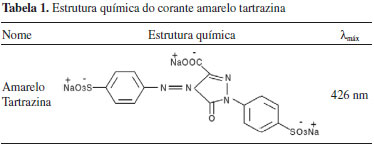
Departamento de Engenharia Química, Universidade Federal do Paraná, 81531-980 Curitiba - PR, Brasil Recebido em 28/02/2016 *e-mail: ithiaradalponte@gmail.com The potential of heterogeneous photocatalysis using TiO2 immobilized in alginate beads was evaluated for the degradation of tartrazine yellow azo dye. The treatment was performed under the action of a high-pressure mercury vapor lamp of 125 W and the degradation performance was investigated with the absorbance supplied by a photocolorimeter. Alginate beads with TiO2 were prepared and the catalyst was quantified by thermogravimetric analysis (TG) and characterized by scanning electron microscopy (SEM) with energy-dispersive X-ray spectroscopy (EDS) and specific area analysis (BET). The immobilization was performed as a very simple and reproductible technique. The bead diameter was approximately 1 mm and its surface presented a homogeneous dispersion of catalytic sites containing about 1-2% (w/w) of TiO2. The TiO2/alginate beads presented low density and can be easier separated than the TiO2 dispersed from the reacting medium, remaining available to be reused in another batch. The dye degradation reached 30% after 120 minutes of irradiation, for the following conditions: alcaline pH (pH=9.0), 3 g of TiO2/alginate beads and 20 mol L-1 dye concentration. INTRODUÇAO O descarte de efluentes com alto índice de coloraçao leva a alteraçoes na quantidade e qualidade da luz que penetra nas camadas mais profundas dos corpos hídricos, alterando as condiçoes da biota aquática, diminuindo a transparência da água e a penetraçao da luz solar, o que pode afetar a atividade fotossintética e o regime de solubilidade dos gases, principalmente próximos às regioes de descarga.1,2 Devido ao alto grau de aromaticidade das moléculas de corantes e à sua alta estabilidade, os métodos de tratamento biológicos sao ineficientes para a descoloraçao e degradaçao. Esta estrutura recalcitrante também inibe o metabolismo de certos microrganismos presentes no tratamento biológico.3,4 Logo, outras técnicas de tratamento físico-químico se fazem necessárias, tais como coagulaçao com agentes químicos, adsorçao em carvao ativado, ultrafiltraçao, osmose reversa, remoçao com uso de resinas de troca iônica, etc. Todavia, essas operaçoes constituem técnicas nao destrutivas, uma vez que transferem os compostos orgânicos da água para outra fase, causando entao uma poluiçao secundária.5 Neste contexto, a fotocatálise heterogênea surge como uma tecnologia muito efetiva e limpa, e que tem se destacado para a eliminaçao definitiva de poluentes orgânicos tóxicos de efluentes, sendo capaz de promover a degradaçao total de inúmeros compostos orgânicos a dióxido de carbono, água e íons inorgânicos provenientes de heteroátomos.5-8 O dióxido de titânio está muito próximo de ser um catalisador ideal para o processo de fotooxidaçao, pois apresenta muitas vantagens: nao é tóxico, tem baixo custo, é abundante, é de simples obtençao e é resistente a processos fotocorrosivos.5,7 No processo da fotocatálise, o TiO2 promove a transferência de um elétron da banda de valência para a banda de conduçao na regiao UV-A (λ = 320-400 nm) e pode ser utilizado em temperatura ambiente, permanecendo estável após repetidos ciclos catalíticos.7,9,10-12 Muitos estudos registraram elevados percentuais de degradaçao ao aplicar a fotocatálise com o TiO2 em suspensao para inúmeros compostos recalcitrantes, dentre os quais os corantes do tipo azo.4,12-16 Por outro lado, a limitaçao da implementaçao da fotocatálise em larga escala está relacionada à separaçao e reuso do fotocatalisador após o tratamento do efluente. Em sistemas comerciais, é mais vantajoso utilizar reatores nos quais o TiO2 esteja imobilizado, pois assim elimina-se a necessidade de recuperaçao do mesmo, o que é um problema sério devido ao pequeno tamanho dessas partículas. É possível que com a utilizaçao de outros tipos de reatores, como os empacotados17 e os reatores tipo filme, esta eficiência possa ser aumentada, além de ser possível tratar um maior volume de efluente e operar em regime contínuo. Adicionalmente estudos promissores vêm sendo realizados para o desenvolvimento de catalisadores imobilizados em matrizes de baixa densidade,18,19 o que permite a flutuaçao do fotocatalisador mantendo-o na superfície do meio reacional, otimizando o contato das partículas de TiO2 com a radiaçao UV e com o oxigênio dissolvido. Logo, o uso de fotocatalisadores inseridos em matrizes diversas tem sido uma prática muito estudada,17 como o uso de polímeros, por exemplo de alginato de cálcio, que vem sendo explorados como matrizes para imobilizaçao do TiO2.12,20-22 Derivado do ácido algínico, o alginato é um polissacarídeo extraído principalmente de algas marinhas marrons, pertencentes à classe Phaeophyceae.23,24 É um sal polimérico hidrossolúvel, pertencente a uma família de polissacarídeos lineares, que contêm unidades dos ácidos β-D-manurônico (bloco M) e α-L-gulurônico (bloco G).24 Uma propriedade importante do alginato é a habilidade de formar hidrogéis, o que permite o seu extenso uso em aplicaçoes industriais. Dentre os processos de confecçao de esferas de alginato de cálcio está o processo por gelificaçao iônica que tem se revelado simples e de baixo custo.25 O processo ocorre quando uma soluçao polimérica de alginato de sódio, contendo o material a ser nucleado é gotejada sobre uma soluçao catiônica. Na formaçao de esferas de alginato pelo método de gotejamento, o processo de formaçao do gel começa imediatamente após o contato da soluçao de alginato de sódio com a soluçao de cloreto de cálcio.26,27 As propriedades gelificantes do alginato sao provenientes de ligaçao cooperativa dos cátions divalentes (Ca2+) localizados entre os blocos homopoliméricos de resíduos de guluronato ou blocos - G. Os íons cálcio ficam ocluídos dentro de cavidades eletronegativas, análogo à ovos em uma caixa de ovos, e desta semelhança surgiu o termo modelo "caixa de ovo" ou "egg-box".28 As interaçoes iônicas entre os blocos guluronato e os íons cálcio conduzem à formaçao de um gel termoestável resistente cujas propriedades dependem largamente das características do polímero e do método de preparaçao.27 Neste trabalho, o potencial de produçao de esferas de alginato de cálcio contendo TiO2 imobilizado foi avaliado quanto à factibilidade de produçao, características morfológicas e ao seu poder de degradaçao do corante azo amarelo tartrazina (Tabela 1), também conhecido como amarelo FD&C nº 5 ou amarelo ácido 23 (C.I. 19140, C16H9N4Na3O9S2, peso molecular - 534,3 g mol-1), extensamente utilizado na indústria de alimentos, cosmética e farmacêutica.29
PARTE EXPERIMENTAL Reagentes Soluçoes de alginato de sódio a 3% (g g-1) (GastronomyLab, Brasil) e de cloreto de cálcio 2% (g mL-1) (GastronomyLab, Brasil) foram preparadas com água deionizada e utilizadas na confecçao das esferas catalíticas. Nos ensaios de fotocatálise, a soluçao do corante alimentício comercial amarelo tartrazina (Duas Rodas, Brasil), sem purificaçao prévia, foi preparada em água deionizada a 20 µmol L-1. O fotocatalisador utilizado foi o dióxido de titânio P-25 (Degussa, Alemanha) com 80% anatase (forma fotocatalítica ativa),30 20% rutilo e área BET de 50 m2 g-1. Aparato experimental Os estudos de degradaçao do corante foram conduzidos em compartimento fechado de madeira com dimensoes de 50x50x85 cm em largura, comprimento e altura, respectivamente, e seu interior pintado de preto fosco. O reator constituído por um béquer de vidro de 250 mL foi equipado com agitador magnético a fim de manter uma agitaçao vigorosa para homogeneizaçao do catalisador e oxigenaçao do meio reacional. A radiaçao ultravioleta foi produzida por uma lâmpada a vapor de mercúrio de alta pressao de 125 W HPL-N (Philips, Holanda), sem o bulbo protetor, disposta horizontalmente a uma distância de 20 cm da superfície da soluçao corante. Imobilizaçao do TiO2 em esferas de alginato As esferas de alginato contendo dióxido de titânio (alginato/TiO2) foram preparadas por gotejamento pelo método de gelificaçao iônica.27,31,32 O TiO2 P-25 foi adicionado à soluçao de alginato na proporçao de 0,5 g para cada litro de soluçao e a mistura foi vigorosamente homogeneizada mediante agitaçao manual usando um bastao de vidro. O gel foi gotejado na soluçao de CaCl2 mantida em temperatura ambiente de 25 ºC (±2 ºC), empregando-se uma seringa de 10 mL com agulha 22G. As esferas produzidas foram mantidas em soluçao de CaCl2 sob agitaçao durante 1 h, de modo a minimizar a resistência à transferência de massa externa e evitar que elas permanecessem grudadas umas às outras.27 Posteriormente, as esferas foram mantidas em repouso sob refrigeraçao a 8 ºC na soluçao de CaCl2 durante 24 h para maturaçao. Em seguida, foram retiradas da soluçao, lavadas abundantemente com água deionizada para remoçao do cloreto de cálcio livre, e secas superficialmente em papel filtro. As esferas foram secas em estufa a 75 ºC, à pressao atmosférica durante 3 h. Caracterizaçao das esferas Determinaçao da área específica B.E.T. e densidade aparente Para a determinaçao da área específica B.E.T., as esferas de alginato/TiO2 foram ativadas por 5 h sob vácuo a 75 ºC. Os dados foram adquiridos a partir do instrumento de análise de área específica Nova 1000 series (Quantachrome, Estados Unidos). A densidade aparente foi determinada por picnometria com uma amostra de 700 esferas. Análise termogravimétrica (TG) Com o objetivo de determinar a quantidade de TiO2 imobilizado nas esferas, uma análise por termogravimetria foi realizada para as esferas de alginato preparadas sem a adiçao do fotocatalisador (alginato) e para as esferas fotocatalíticas, com a adiçao do TiO2 (alginato/TiO2). Esta análise foi realizada em equipamento STA 443 F3 Júpiter (Netszch, Alemanha), no intervalo de 20 a 1000 ºC, com taxa de aquecimento de 10 ºC min-1, atmosfera de ar sintético (N2/O2) com vazao de 50 mL min-1, empregando 5 mg das amostras em cadinho de alumina. Análise por Microscopia Eletrônica de Varredura A morfologia superficial das esferas foi avaliada com microscópio Quanta FEG 450 (FEI, Holanda) com aumentos de 50, 500 e 2000 vezes e potencial de 5 a 15 kV. Concomitantemente, algumas áreas das imagens foram submetidas à análise de mapeamento químico semi-quantitativo por espectroscopia por dispersao de energia de raios X (EDS). Degradaçao fotocatalítica Os ensaios fotocatalíticos foram realizados nas seguintes condiçoes experimentais: 150 mL de soluçao de corante a 20 µmol L-1, pH 5,0 e 9,0 e massa de esferas catalíticas de 1,5 e 3,0 g.12 Os experimentos foram realizados em duplicata sob agitaçao e irradiaçao durante 160 minutos. Alíquotas de 1000 µL da soluçao do corante foram amostradas com micropipeta (Digipet, Estados Unidos) em intervalos de tempo determinados, com interrupçao simultânea da irradiaçao, e sua absorbância foi determinada em um fotocolorímetro AT-100PB (Alfakit, Brasil) selecionado para operar na faixa de 565-590 nm. A porcentagem de degradaçao do corante foi determinada pela Equaçao 1: 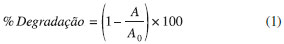
RESULTADOS E DISCUSSAO Caracterizaçao das esferas Area específica B.E.T. e densidade aparente A área específica das esferas (SBET) foi de 8,25 m2 g-1 (R2 = 0,9981). O método B.E.T. revelou também que o volume total de poros foi de 0,0126 cm3 g-1 e o diâmetro médio de poros foi de 62 Å. Como era esperado, houve uma diminuiçao significativa da área específica e do volume de poros quando comparados com o catalisador TiO2 comercial P-25 Degussa (SBET = 56 m2 g-1 e Vp=0,25 cm3 g-1).33 As esferas apresentaram densidade aparente de 1,43108 g cm-3, sendo facilmente removidas do efluente com a utilizaçao de peneira plásticas com malha com cerca de 0,7 mm. Análise térmica As curvas de termodegradaçao para ambas as amostras apresentaram tendências similares (Figura 1), o que sugere que o TiO2 presente nao altera drasticamente a degradaçao do alginato. Observa-se a existência de cinco eventos térmicos para as esferas de alginato e alginato/TiO2. Os dados de perda de massa e as temperaturas de pico para os eventos térmicos estao sumarizados na Tabela 2.
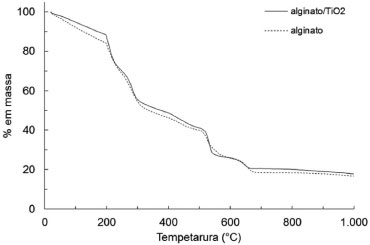 Figura 1. Termograma das esferas de alginato e de alginato/TiO2. Massa perdida após análise termogravimétrica a 1000°C - alginato: 83,42%; alginato/TiO2: 82,28%
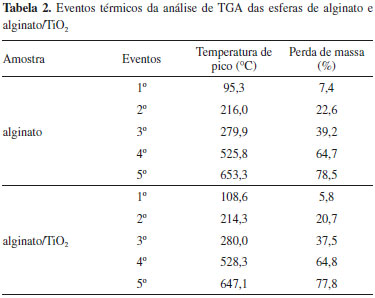
Estudos reportaram que esferas de alginato reticuladas com cálcio apresentaram a decomposiçao em três etapas principais, com o primeiro evento atribuído à desidrataçao (de 25 a 180 ºC), o segundo decorrente da decomposiçao do material biopolimérico (em torno de 200 ºC e estende-se até aproximadamente 500 ºC), formando um resíduo carbonizado.21,34-36 A queima do resíduo carbonizado ocorre entre 500 e 600 ºC e produz compostos intermediários pouco estáveis termicamente, que se decompoem formando resíduos estáveis até 1000 ºC.36 No presente estudo, o resíduo nao foi caracterizado, porém, estudos prévios apontam que a massa é constituída principalmente por óxido de cálcio.36 A massa residual da termodegradaçao (Figura 1) revelou 16,58% para esferas de alginato e 17,72% para esferas catalíticas (alginato/TiO2). O teor de TiO2 de 1,14% (g g-1) para os 5 mg de esferas fotocatalíticas (alginato/TiO2) analisadas foi obtido pela diferença entre a massa residual de esferas de alginato (alginato) e a massa de esferas com o catalisador imobilizado (alginato/TiO2) após serem submetidas a temperatura de 1000 ºC (Figura 1). Análise por microscopia eletrônica de varredura (MEV) Conforme as imagens da Figura 2, as partículas apresentaram morfologia esferóide com superfície regular e diâmetro médio de 1,00 mm com desvio padrao de 0,049 mm em um total de 5 amostras (Figura 2A). O mapeamento químico (EDS) revelou que a distribuiçao de TiO2 na superfície das esferas foi homogênea (Figura 2B e 2C, pontos brancos), demonstrando que a técnica de produçao de esferas por gelificaçao iônica foi adequada. Os pontos brancos (EDS Spot 1) constituem depósitos do fotocatalisador TiO2, com teor de 42,35% de Ti, sendo pouco inferior aos 59,93% esperado para o Ti no cálculo teórico para o TiO2. As regioes mais escuras (EDS Spot 2), com teor de apenas 5,50%, sao compatíveis com a matriz orgânica com sinais subsuperficiais37 de fotocatalisador (Figura 3). De modo geral, acredita-se que possivelmente as partículas de TiO2 ficaram envolvidas pelo alginato de cálcio, seja na porçao interna, bem como na mais externa, sendo que o tempo de espera de estabilizaçao e de amadurecimento contribuem para a formaçao de uma camada superficial de alginato de cálcio sobre toda a esfera.
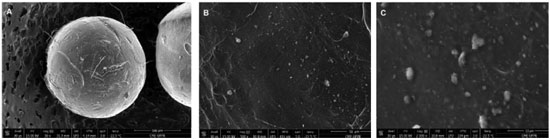 Figura 2. Micrografias das esferas de alginato/TiO2 (15kV) com aumento de 50X (A); 500X (B); 2000X (C)
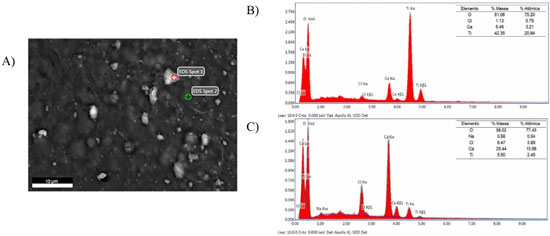 Figura 3. Mapeamento químico (2000X) EDS Spot 1 e Spot 2 (A) e espectro EDS Spot 1 (B) e EDS Spot 2 (C)
Degradaçao fotocatalítica Estudos preliminares de fotodegradaçao com as esferas secas produzidas e caracterizadas revelaram que em ausência de irradiaçao, as esferas de alginato/TiO2 nao alteraram o teor de corante da soluçao após 160 minutos de exposiçao (pontos nao mostrados), o que descarta a possibilidade de degradaçao catalítica pura, bem como a inexistência de capacidade de adsorçao do corante. Por outro lado, este resultado nao exclui a possibilidade de ter ocorrido uma pequena adsorçao do corante nas esferas de alginato. O ensaio de fotólise apresentou degradaçao de 3,8% do corante em 40 min e atingiu 10,2% em 160 minutos (Figura 4); logo, esta fonte de onda eletromagnética (320-400 nm) tem energia suficiente para fotodegradar o corante.
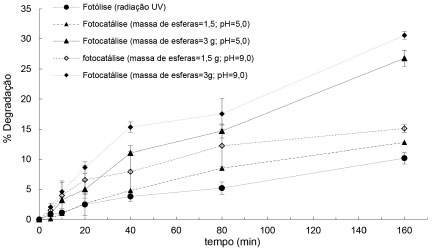 Figura 4. Degradaçao por fotólise (UV) e por fotocatálise (UV+esferas de alginato /TiO2)
Os ensaios de fotocatálise revelaram que a máxima degradaçao do corante atingiu cerca de 30% de eficiência após 160 minutos, em pH 9,0 e com massa de esferas catalíticas correspondente a 3 g (Figura 4). O aumento do pH de 5,0 para 9,0 provocou o aumento da eficiência. Conforme estudos, o pH é um parâmetro importante na fotodegradaçao.5 O maior percentual de degradaçao em pH alcalino pode ser explicado devido ao aumento de íons hidroxila (OH-) no meio reacional, que por sua vez induzem a formaçao de mais radicais hidroxila (·OH), conforme observado em estudos anteriores para o corante tartrazina.4,12 Estes radicais sao altamente oxidantes e provocam o processo de degradaçao, logo, quanto mais radicais sao formados, maior é o percentual a ser degradado. Além disso, para o mesmo pH, a maior quantidade de esferas proporcionou um aumento de 50% na área de contato entre o corante e o catalisador e consequente maior eficiência. Em pH 9,0 e massa de esferas de 1,5 g (concentraçao de TiO2 correspondente a 0,1 g L-1), a degradaçao foi de apenas 15%, provavelmente devido à baixa quantidade de catalisador disponível. Nestas mesmas condiçoes experimentais, estudos revelaram percentuais de degradaçao do corante tartrazina da ordem de 97% com o uso do catalisador TiO2 puro em suspensao.12 A maior eficiência de degradaçao pode ser atribuída a maiores quantidades de sítios ativos, devido à maior área específica de contato entre o TiO2 ativado e as espécies moleculares que podem formar os radicais que desencadeiam a decomposiçao do corante.38,39 A presença das esferas contendo o catalisador constitui uma barreira para a passagem das ondas eletromagnéticas,40,41 pois elas se tornam opacas após a secagem (imagem nao mostrada), e também deve ser avaliada. Por último, tem sido relatado que a disponibilidade de fotocatalisador é limitada à área específica disponível, pois a reaçao fotoquímica se dá na superfície das esferas.38,39 Isto é compatível com as imagens das esferas após a secagem em estufa (Figuras 2A, 2B e 2C), as quais perderam os poros, revelados na metodologia B.E.T. e de acordo com outros relatos.22,31,35,42 Assim, deve-se avaliar também o uso de esferas hidratadas ou secadas com técnicas diferentes. No estudo realizado, as partículas reidratadas nao atingiram a umidade original (apenas 38% enquanto que inicialmente era 93%). Já para partículas de alginato de cálcio secadas por liofilizaçao foi descrito considerável poder de reidrataçao após contato com a água, sendo observado apenas mudança parcial de sua estrutura,43 demonstrando que o método de secagem pode influenciar fortemente na estrutura morfológica final e que o teor de umidade após reidrataçao pode permitir a difusao, mesmo que parcial, de corante para camadas mais internas das esferas. É válido ressaltar, que a secagem das esferas foi realizada de maneira a aproximar o experimento do contexto real, pois é comercialmente vantajosa a produçao e venda de esferas secas, por questoes de armazenamento, manipulaçao e transporte, além de garantir a estabilidade mecânica das esferas.42 Finalmente, nao foi verificada fragmentaçao das esferas durante os ensaios, revelando sua boa estabilidade quimiomecânica.
CONCLUSAO A confecçao das esferas catalíticas de alginato descrita é uma técnica simples, reprodutível e de fácil execuçao. As esferas podem ser produzidas com teor de 1 a 2% de TiO2 e após secagem apresentaram menor porosidade que o TiO2 em pó, ou seja, menor número de sítios catalíticos disponíveis por massa. Isto foi confirmado pelas imagens das esferas contendo parte das partículas de TiO2 em sua superfície, pela ausência de poros (possivelmente as partículas de TiO2 contidas no interior da matriz nao estariam disponíveis) e pelo menor rendimento de fotodegradaçao com uso esferas catalíticas (15,1% das moléculas iniciais de corante) do que em estudo descrito com uso TiO2 em pó (97%). A fim de se alcançar o mesmo rendimento, seria necessária uma demanda de 6,4 vezes maior de TiO2 na forma imobilizada do que a quantidade de TiO2 em pó. Por outro lado, as esferas podem ser facilmente recuperadas por macro e microfiltraçao (0,07-2,0 µm),44 ao contrário do TiO2 P-25 em pó (tamanho de partícula de 0,021 µm)45 que exige nanofiltraçao. Visualmente as esferas também nao sofreram fragmentaçao durante a reaçao de fotodegradaçao, seja em meio ácido (pH 5,0) ou alcalino (pH 9,0), independentemente do teor de TiO2 incorporado. Finalmente, a esfera catalítica foi confeccionada com material biopolimérico, totalmente biodegradável, contribuindo para o descarte ambientalmente correto com a possibilidade de recuperaçao e reutilizaçao.
AGRADECIMENTO Ao Programa de Pós-Graduaçao em Meio Ambiente Urbano e Industrial da Universidade Federal do Paraná, Universidade de Stuttgart e SENAI/PR.
REFERENCIAS 1. Souza, C. R. L.; Peralta-Zamora, P.; Quim. Nova 2005, 28, 226. 2. Goscianska, J.; Pietrzak, R.; Catal. Today 2015, 249, 259. 3. Peralta-Zamora, P.; Moraes, S. G.; Pelegrini, R.; Freire, M. J.; Reyes, J.; Mansilla, H.; Duran, N.; Chemosphere 1998, 36, 2119. 4. Gupta, V. K.; Jain, R.; Nayak A.; Agarwal, S.; Shivastava, M.; Mater. Sci. Eng., C 2011, 31, 1062. 5. Konstantinou, I. K.; Albanis, T. A; Appl. Catal., B 2004, 49, 1. 6. Pruden, A. L.; Ollis, D. F.; Environ. Sci. Technol. 1983, 17, 628. 7. Malato, S.; Fernandéz-Ibañez, P.; Maldonado, M. I.; Blanco, J.; Gernjak, W.; Catal. Today 2009, 147, 1. 8. Gaya, U. I.; Abdullah, A. H.; J. Photochem. Photobiol., C 2008, 9, 1. 9. Gupta, S. M.; Manoj, T.; Chin. Sci. Bull. 2011, 56, 1639. 10. Al-Dawery, S.; J. Eng. Sci. Technol. Rev. 2013, 8, 683. 11. Mills, S, A.; Lehunte, S.; J. Photochem. Photobiol., A 1997, 108, 1. 12. Dalponte, I.; Dissertaçao de Mestrado, Universidade Federal do Paraná, Brasil, 2015. 13. Silva, C. G.; Faria, J. L; J. Photochem Photobiol., A 2003, 155, 133. 14. Muruganandham, M.; Swaminatham, M.; Dyes Pigm. 2006, 68, 133. 15. Bergamini, R. B. M.; Azevedo, E. B.; Araújo, L. R. R.; Chem. Eng. J. (Amsterdam, Neth.) 2009, 149, 215. 16. Lachheb, H.; Puzenat, E.; Houas, A.; Ksibi, M.; Elaloui, E.; Guillard, C.; Hermann, J. M.; App. Catal., B 2002, 39, 75. 17. Sarkar, S.; Chakraborty, S.; Bhattacharjee, C.; Ecotoxicol. Environ. Saf. 2015, 121, 154. 18. Magalhaes, F.; Lago, R.; Sol. Energy 2009, 83, 1521. 19. Magalhaes, F.; Moura, F. C. C.; Lago, R.; Desalination 2011, 276, 266. 20. Papageorgiou, S. K; Katsaros, F. K; Favvas, E. P.; Romanos, G. E.; Athanasekou, C. P.; Beltsios, K. G.; Tzialla, O. I.; Falaras, P.; Water Res. 2012, 46, 1858. 21. Dong, Y.; Dong, W.; Cao, Y.; Han, Z.; Ding, Z.; Catal. Today 2011, 175, 346. 22. Sirtori, C.; Freitas, A. M.; Fujiwara, S. T.; Peralta-Zamora, P.; J. Braz. Chem. Soc. 2012, 23, 1563. 23. Torres, C. F.; Dissertaçao de Mestrado, Universidade Estadual de Campinas, Instituto de Química, Brasil, 2013. 24. Draget, K.; Smidsrod, O.; Skjak-Braek, G.; Em Polysaccharides and Polyamides in the Food Industry, Properties, Production and Patents; Steinbuchel, A.; Rhee S. K., eds.; Wiley-VCH Verlag GmBH & Co. KGaA: Weinheim, cap. 2, 2005. 25. Hassan, A. F.; Mohsen-Abdel, A. M.; Fouda, M. M. G.; Carbohydr. Polym. 2014, 102, 192. 26. Culpi, T. A.; Pasqualim, P.; Fin, M. T.; Sasso, D. G. B.; Kaminski, G. A. T.; Fujiwara, G. M.; Nunes, P. M. P.; Rodrigues, B. H.; Dias, J. F. G.; Zanin, S. M. W.; Visao Acad. 2010, 11, 38. 27. Blandino, A.; Macías, M.; Cantero, D.; J. Biosci. Bioeng. 1999, 88, 686. 28. Grant, G. T.; Morris, E. R.; Reeds, D. A.; Smith, P. J. C.; Thom, D.; FEBS Lett. 1973, 32, 195. 29. Moutinho, I. L. D.; Bertges, L. C.; Assis, R. V. C.; Brazilian Journal of Biology 2007, 67, 141. 30. Hurum, D. C.; Gray, K. A.; Agrios, A. G.; Rajh, T.; J. Phys. Chem. B 2003, 107, 4545. 31. Fundueanu, G.; Nastruzzi, C.; Carpov, A.; Desbrieres, J.; Rinaudo, M.; Biomaterials 1999, 20, 1427. 32. Couto, S. R.; Domínguez, A.; Sanromán, A.; Chemosphere, 2002, 46, 83. 33. Raj, K. J. A; Viswanathan, B.; Indian J. Chem. 2009, 48, 1378. 34. Paula, H. C. B.; Oliveira, E. F.; Abreu, F. O. M. S.; Paula, R. C. M.; Morais, S. M.; Forte, M. M. C.; Polimeros 2010, 20, 112. 35. Soares, J. P.; Santos, J. E.; Chierice, G.O.; Cavalheiro, E. T. G.; Eclética Química 2004, 29, 57. 36. Segato, M. P.; Dissertaçao de Mestrado, Instituto de Química, Universidade de Sao Paulo, Sao Carlos, Brasil, 2007. 37. Chinaglia, C. R.; Correa, C. A.; Polímeros 1997, 7, 19 38. Albarelli, J. Q.; Santos, D. T.; Murphy, S.; Oelgemoller, M.; Water Sci. Technol. 2009, 60, 1081. 39. Rincón, A. G.; Pulgarín, C.; Appl. Catal., B 2003, 44, 263. 40. Dijkstra, M. F. J.; Buwalda, H.; Jong, A. W. F.; Michorius, A.; Winkelman, J. G. M.; Beenackers, A. A. C. M.; Chem. Eng. Sci. 2001, 56, 547. 41. Pozzo, R. L.; Baltanás, M. A.; Cassano, A., E.; Catal. Today 1997, 39, 219. 42. Lagoa, R.; Rodrigues, J. R.; Biochem. Eng. J. 2009, 46, 320. 43. Mukai-Correa, R.; Prata, A. S.; Alvim, I. D.; Grosso, C.; Braz. J. Food Technol. 2005, 8, 73. 44. Metcalf, L.; Eddy, H. P.; Tratamento de efluentes e recuperaçao de recursos, 5ª ed., AMGH: Porto Alegre, 2016. 45. Degussa Technical Information 1243; AEROXIDE®, AERODISP® and AEROPERL® Titanium Dioxide as Photocatalyst, 2013. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





