Revisão
|
|
| Como estudar interações entre nanopartículas e sistemas biológicos Studying the interactions between nanoparticles and biological systems |
|
Allan RadaicI; Gustavo Oliveira PuglieseI; Guilherme Capiraço CampeseI; Francisco Benedito Teixeira PessineII; Marcelo Bispo de JesusI,*
IDepartamento de Bioquímica e Biologia Tecidual, Instituto de Biologia, Universidade Estadual de Campinas, 13083-970 Campinas - SP, Brasil Recebido em 02/05/2016 *e-mail: dejesus@unicamp.br Although in recent years there has been an increasing amount of literature on nanotechnology and their clinical applications, it is still scarce a deep understanding of the interactions at the molecular levels between nanoparticles and cells. Studies demonstrating the underlying mechanisms of nanoparticles endocytosis, intracellular trafficking, and cellular processing are imperative to understand better how cells interact with those materials and their possible undesired effects, e.g. nanotoxicity. The rising awareness concerning nanoparticles applications and its interactions with the cellular environment is part of the new research field called Nanotoxicology. The cumulative knowledge in nanotoxicology will allow us to foresee toxic effects, establish regulations and limits for nanoparticles applications. In this work, we discuss the theoretical concepts about studying endocytosis and intracellular trafficking of nanoparticles. The nanoparticles-cell interactions are a multi-step process, which can be divided into nanoparticles' internalization, intracellular processing and triggering effects of nanomaterials on eukaryotic cells. Finally, we discuss the main techniques used to study this process: flow cytometry, use of endocytosis inhibitors and confocal microscopy. INTRODUÇAO Nanotecnologia é um dos ramos mais promissores de tecnologia, sobre o qual se deposita grandes expectativas.1 Somente em 2015, foram publicados cerca de 9400 artigos relacionados ao termo "Nanotechnology" no banco de dados Science Direct; além disso, diversos produtos têm sido testados e comercializados, por exemplo, protetores solares, cosméticos, produtos biomédicos, biosensores e sistemas para transporte e entrega de fármacos.2 Entretanto, há uma crescente preocupaçao com a segurança e possíveis efeitos nocivos de nanomateriais que vêm sendo desenvolvidos,3 pois dados e regulamentaçoes internacionais referentes à segurança e uso desses materiais ainda sao escassos, ainda estao em debate ou em fase de implementaçao.4 Uma nova área da ciência destinada ao estudo de efeitos adversos de nanomateriais foi recentemente criada, a Nanotoxicologia.5 O conhecimento acumulado nessa área tem como objetivo prever efeitos tóxicos e auxiliar nas regulamentaçoes e diretrizes para aplicaçao da nanotecnologia6 e uso de produtos a ela relacionados. A Figura 1 mostra o crescimento do número de artigos científicos que contêm o termo "nanotoxicology" e estao no banco de dados do National Center for Biotechnology Information (NCBI), subdivisao do National Institute of Health (NIH/USA).
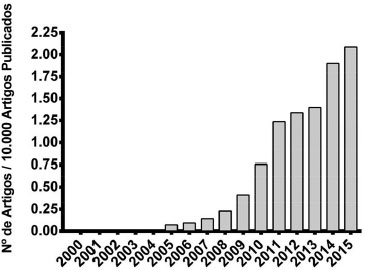 Figura 1. Crescimento do número de artigos científicos publicados, relacionados ao termo "nanotoxicology" normalizado a cada 10 mil artigos publicados no website "PubMed" (http://www.ncbi.nlm.nih.gov/pubmed), parte do National Center for Biotechnology Information (NCBI), subdivisao do National Institute of Health (NIH/USA), entre os anos 2000 e 2015. Pesquisa realizada em 02/05/2016
Apesar do número de artigos em nanotoxicologia ser crescente, esta é uma área ainda muito recente (com menos de uma década), e ainda nao é possível determinar exatamente quais impactos os sistemas naturais e artificiais com dimensoes nanométricas podem causar ao ser humano e ao meio ambiente.3,7 Apesar de todo conhecimento acumulado nesse período, ainda é difícil fazer generalizaçoes sobre a biodisponibilidade, biodistribuiçao, degradaçao, eliminaçao e atividade biológica de nanoestruturas, bem como sobre os processos moleculares envolvidos em sua internalizaçao, tráfego e processamento celular.4,8 Portanto, o conhecimento sobre como as células lidam e interagem com estes materiais é parte essencial para avanços dessa nova área.9 Estudos que demonstram como nanopartículas sao internalizadas, processadas (ex. degradadas) pelas células e as respostas celulares desencadeadas sao imperativos para estabelecer procedimentos de segurança na fabricaçao e nas aplicaçoes comerciais e médicas de nanomateriais.10 Para atingir esse objetivo, os primeiros passos devem envolver estudos moleculares sobre interaçoes nanopartículas-células, endocitose, tráfego intracelular e resposta celular a estes materiais. Por que estudar a endocitose, o tráfego e o processamento intracelular de nanopartículas? Formas de interaçao nanopartículas-células A membrana plasmática é a principal interface celular, através da qual o interior da célula se comunica com o meio externo.11 O primeiro contato da célula com qualquer material extracelular é através de seus componentes lipídicos (ex. fosfolipídios) e proteicos (ex. receptores membranares).12 Sendo assim, um dos primeiros testes para avaliar a interaçao dos nanomaterias com células eucarióticas é avaliar a integridade da membrana. Para isso é possível dosar a presença ou atividade de enzimas intracelulares (ex. lactato desidrogenase)13 ou testar a integridade da membrana com moléculas que nao a permeiam (ex. azul de tripano ou iodeto de propídio).14 Por exemplo, Carlson e colaboradores15 demonstraram que nanopartículas de prata (diâmetro de 15 a 55 nm) causaram danos à membrana, os autores avaliaram o extravasamento da enzima lactato desidrogenase para o meio extracelular, levando macrófagos à apoptose em menos de 24 h. Os autores sugeriram que a perda da integridade de membrana foi responsável pela morte celular. Nanopartículas podem acessar o citoplasma de células eucarióticas, graças a danos causados à membrana, ou sendo internalizadas pelas células. Para discernir entre essas possibilidades, é importante avaliar os efeitos observados em condiçoes normais e compará-los a resultados obtidos à 4 ºC,16 ou em presença de inibidores do metabolismo energético (ex. cloreto de amônia combinado com 2-desoxiglicose).17 Experimentos in vitro à 4 ºC, bem como inibidores do metabolismo energético, diminuem a produçao de ATP, portanto, inibem o processo de endocitose, responsável pela internalizaçao das nanopartículas.18 O comprometimento da produçao de energia, pela diminuiçao da temperatura ou por agentes que reduzem a produçao de ATP; podem trazer informaçoes importantes sobre interaçoes nanosistemas-célula. Assim, efeitos em decorrência de danos causados à membrana seriam observados em ambas as situaçoes (controle e experimentos à 4 ºC ou em presença de inibidores do metabolismo energético), enquanto que efeitos decorrentes da internalizaçao dos nanomateriais seria drasticamente diminuído em baixas temperaturas ou na presença do inibidor. Além do inibidores do metabolismo energético, é possível utilizar um inibidor de endocitose generalizado, atualmente o mais utilizado é o Dynosore, que pressupoe inibir a dinamina, uma GTPase da qual depende a maioria das vias de endocitose.11 Comparando os resultados destes experimentos com os obtidos sem o uso desse inibidor, obtém- se os primeiros indícios de que as partículas sao ou nao endocitadas pelas células. Os detalhes dessa estratégia serao apresentados por metodologias a seguir. Endocitose Um dos mais importantes mecanismos de comunicaçao celular com o meio externo envolve o fluxo transmembranar e bidirecional de vesículas, este fenômeno é o movimento de internalizaçao de conteúdos extracelulares, denominado endocitose.11 Esta pode ser dividida em fagocitose (somente para algumas células especializadas, como macrófagos) e pinocitose (presente virtualmente em todas as células eucaróticas) a qual, por sua vez, pode ser subdividida em endocitose mediada por clatrina, endocitose mediada por caveolina e macropinocitose. Atualmente outras vias têm sido propostas, como endocitose independente de clatrina e caveolina.12 Para mais detalhes destes mecanismos, consultar a referência.19 Estudos têm mostrado que o formato, tamanho, características (como porosidade) da superfície, carga superficial e composiçao de nanopartículas influenciam diretamente a endocitose.20 De fato, é sabido que, no caso de entrega seletiva de ativos às células, sao acopladas moléculas às nanopartículas intencionalmente que interagem com receptores específicos da superfície celular. Isso evita danos às células que nao expressam esses receptores ou o fazem em menor número. Mas, apesar das propriedades físico-químicas dos nanomateriais influenciarem a sua via de internalizaçao, um mesmo material pode ser internalizados por vias diferentes em diferentes linhagens celulares, demonstrando que esse é um processo célula-dependente.21 A análise da endocitose em células vivas (tanto in vitro quanto in vivo) é normalmente feita com inibidores químicos (farmacológicos) de endocitose,22 células mutantes que têm algumas proteínas das principais vias de endocitose nao funcionais23 ou, ainda, células cujas proteínas chave das vias de endocitose têm sua expressao diminuída por ferramentas de biologia molecular (ex. RNA de interferência).24 Inibidores sao ferramentas valiosas para determinar a via de endocitose utilizada, pois sao simples, confiáveis e de custo acessível.11 Entretanto, é necessário que os experimentos sejam realizados cuidadosamente, como discutido a seguir, e suportados por outros experimentos (ex. microscopia confocal).22 Uma vez confirmada a internalizaçao do nanomaterial, o próximo passo é avaliar a translocaçao do material exógeno para o destino específico na célula, processo denominado de tráfego intracelular. Tráfego intracelular Após internalizaçao, independentemente da via utilizada, a partícula é englobada em uma vesícula (e.g., endossomo), sem acesso direto ao citosol ou a organelas citoplasmáticas e, portanto, fica impedida de exercer sua funçao biológica, particularmente crítico para carreamento de material genético, ou de fármacos que têm alvos intracelulares.11 Caso nao aconteça o escape do endossomo, os materiais endocitados podem: i. ser degradados nos lisossomos; ii. redirecionados para o meio exterior através de endossomos de reciclagem; iii. encaminhados para outras organelas; ou iv. exocitados.25 A literatura mostra que a maior parte das nanopartículas, após internalizaçao, sao direcionadas para os lisossomos, nos quais sao degradadas.26 A degradaçao lisossomal pode limitar a aplicaçao de diversos nanomateriais, em especial daqueles que carreiam biomoléculas, como oligonucleotídeos (DNA, RNA, entre outros). Portanto, o estudo das estratégias de escape endossomal pode auxiliar na otimizaçao de aplicaçoes terapêuticas envolvendo nanopartículas.27 Em geral, a formaçao de complexos de DNA com lipossomas catiônicos tem como motor propulsor um grande aumento de entropia, dada a liberaçao de contra-íons para a soluçao. Sendo assim, a simples mistura de DNA e lipossomas catiônicos na soluçao leva a reorganizaçao de suas estruturas formando agregados em múltiplas camadas podendo estar organizadas no estado líquido-cristalinas a depender, entre outras coisas, da relaçao entre as cargas positivas e negativas dos eletrólitos, das características estruturais dos lipossomas (como raio de curvatura), do tamanho do fragmento de nucleotídeo, pH, etc.28 Lin et al29 desenvolveram um estudo comparativo em que foram preparados dois complexos entre DNA e lipossomas com estruturas distintas: lamelar (Lcα), utilizando os lipídios DOTAP/DOPC e hexagonal invertida (HIIc) e os lipídios DOTAP/DOPE. Essas estruturas, ao serem colocadas em contato com células de fibroblastos de rato, apresentaram perfis de transfecçao distintos. Os complexos com estrutura hexagonal invertida obtiveram eficiência de transfecçao aproximadamente 100 vezes superior em comparaçao com os complexos com estrutura lamelar. Segundo os autores, a fase hexagonal invertida (HIIc) leva a um mecanismo fusao dos lipoplexos com a membrana do endossomo, isso levaria a uma maior liberaçao do DNA no citoplasma da célula e, consequentemente, resultaria em maiores níveis de transfecçao. Para estudar o papel da acidificaçao sobre o processamento de um dado nanomaterial é possível empregar estratégias que utilizam ensaios com inibidores da acidificaçao endossomal, denominados de lisossomotrópicos (ex. cloroquina, bafilomicina, metilaminas e ionóforos carboxílicos) podem ser bastante úteis.30 Inibidores de acidificaçao endomossoal sao bases fracas que, ao entrarem em ambiente ácido, ficam protonadas e reduzem a acidificaçao endossomal e lisossomal. A nao acidificaçao do endossomo impede a fusao do endossomo com o lisossomo, evitando que enzimas líticas presentes no interior dos lisossomos degradem o material internalizado. Isso pode ser benéfico para nanomateriais que seriam prontamente degradados em ambiente mais ácido, mas pode ser prejudicial para nanomateriais que dependem da acidificaçao para a liberaçao de seu conteúdo, ou para desempenhar sua funçao biológica. Por exemplo, Behr,26 em 1997, hipotetizou que nanopartículas poliméricas de poli (etilenoimina) (PEI), utilizadas para transfecçao, poderiam escapar de endossomos através da ruptura osmótica da membrana endossomal. Esse efeito poderia estar associado com a grande quantidade de grupos amina protonáveis na estrutura do polímero. Neste caso, à medida em que o interior do endossomo vai se tornando mais ácido, até chegar aos valores de pH lisossomais (pH ~5,5), o equilíbrio osmótico desses compartimentos é desfeito, e culmina na ruptura da vesícula com liberaçao do material carreado.26 Atualmente os detalhes sobre o exato mecanismo associados a esta hipótese estao em debate.31 Para sistemas que nao possuem estas propriedades químicas, há possibilidade do uso de moléculas lisossomotrópicas, que inibem a acidificaçao lisossomal, aumentando o tempo de permanência das partículas em seu interior e com isso as chances de ocorrer a liberaçao do conteúdo para o citoplasma.32
TÉCNICAS E ESTRATÉGIAS PARA ESTUDO DA INTERAÇAO NANOPARTICULA-CÉLULAS Para obter maiores detalhes da interaçao nanopartícula-células discutiremos a seguir detalhes da aplicaçao das três técnicas mais utilizadas para estudar esse fenômeno: citometria de fluxo, uso de inibidores de endocitose e microscopia confocal. Para estudos visando a caracterizaçao do nanomaterial, em especial nanopartículas lipídicas sólidas, e técnicas relacionadas sugerimos a leitura da referência33 e para técnicas físicas para estudar a interaçao nanopartículas-membrana celular, sugerimos a leitura da referência.34 Citometria de fluxo Citometria de fluxo é uma técnica que permite avaliar individualmente células e até mesmo partículas de naturezas diversas,35 através da focalizaçao hidrodinâmica em um capilar. Ao passar pelo capilar, as células sao irradiadas por lasers que excitam diferentes fluoróforos, possibilitando análises bastante detalhadas de eventos celulares.36 Para isso, sao usados marcadores específicos, como anticorpos ligados a fluoróforos ou fluoróforos que têm afinidade por estruturas celulares específicas ou respondem a processos celulares (ex. a sonda DCFDA - 2',7'-diclorofluoresceína diacetato - que responde a formaçao de espécies reativas de oxigênio), e possibilitam a análise qualitativa e quantitativa de eventos celulares, por exemplo ciclo celular, estresse oxidativo, fosforilaçao de proteínas, apoptose, etc. Análises corriqueiras podem ser realizadas com um a três fluoróforos e testes mais avançados chegam a combinar até 18 fluoróforos. Quando acoplada à espectrometria de massas, esse número pode passar de 36.37 Em geral, citômetros de fluxo descartam as amostras após a análise, ainda que alguns possam utilizar a técnica de separaçao de células cuja fluorescência foi previamente ativada (Fuorescence-Activated Cell Sorting, FACS) permitindo a coleta e análise de informaçoes sobre subpopulaçoes, separadamente. Nesse caso, as células das subpopulaçoes podem ser cultivadas isoladamente, ampliando o leque de análises possíveis.38 A citometria de fluxo permite analisar milhares de células por segundo e obter resultados dependentes das propriedades intrínsecas das amostras, como tamanho das células, granulosidade, intensidade da fluorescência, etc. Pode ser empregada também para estudar eventos celulares como a eficiência de transfecçao de um plasmídeo contendo um gene codificante para uma proteína modelo, usualmente eGFP (enhanced Green Fluorescent Protein), transportado por nanopartículas. Isso pode ser medido avaliando a frequência de células que respondem positivamente à excitaçao do laser no comprimento de onda de fluorescência da proteína, com excitaçao em 488 nm e emissao 509 nm. A análise de 10 mil células é considerada padrao para a maioria dos testes.39 Entretanto, esse número pode variar dependendo das características de cada amostra. Se, por exemplo, o evento celular estudado é raro, entao milhares de células devem ser analisadas, desde que haja um tratamento estatístico adequado ao evento estudado. A Citometria de fluxo tem se mostrado uma técnica bastante poderosa para investigar eventos celulares, sendo empregada no estudo entre células eucarióticas e procarióticas, como bactérias32 e vírus.40 No processo de internalizaçao celular, é cada vez mais utilizada para estudar interaçoes de células e nanopartículas41 e também propriedades de sistemas nanoparticulados, como tamanho de complexos nanoestruturados que transportam material genético em fluidos biológicos.42 A seguir será discutido em detalhes como essa técnica pode ser utilizada para estudar as principais etapas do processo de interaçao entre nanopartículas e células eucarióticas: internalizaçao, tráfego intracelular e resposta biológica. Internalizaçao: a análise, via citometria de fluxo, da interaçao de nanomateriais e células eucarióticas pode ser feita de duas maneiras, que fornecem informaçoes complementares: a primeira, quando o material adsorvido à membrana celular é incluído na análise (em inglês referido como total cell association) e, a segunda, quando esse material é excluído da análise (em inglês referido como internalization ou uptake). Em princípio, o material adsorvido deveria ser excluído para que o resultado possa ser correlacionado somente com as partículas internalizadas. Todavia, isso nem sempre é possível, pois, tecnicamente, a exclusao das partículas externas às células nem sempre é possível. Alguns fluoróforos, como os derivados de fluoresceína, podem ter a fluorescência suprimida por outros compostos, como o azul de tripano,43 corante incapaz de penetrar células saudáveis. Nesse caso, seu uso para extinguir a fluorescência das partículas aderidas à membrana da célula se limita a ensaios com células vivas, pois se estiverem fixadas, as partículas dentro das células teriam também a fluorescência suprimida.43 O emprego de azul de tripano em citometria de fluxo foi validado para o estudo da interaçao entre leveduras e granulócitos44 e, atualmente, é bastante empregado para investigar interaçoes entre nanomateriais e células eucarióticas em geral.45 Shimoni et al investigaram a internalizaçao de nano-cápsulas de hidrogel de ácido polimetacrílico em células HeLa, concluindo que cápsulas esféricas eram internalizadas em maior quantidade que outras com mesma composiçao, mas com formato alongado.46 Martins et al. demonstraram que nanopartículas lipídicas sólidas apresentavam taxa de internalizaçao preferencial em linhagens de glioma humano (A172 e U87) em relaçao à macrófagos, fato que aumenta a relevância dessas nanopartículas como carreadores de fármacos anti-neoplásicos.47 Silva et al empregaram nanopartículas poliméricas para carrear siRNA em protoplastos de tabaco BY-2 e demonstraram que esse processo depende do tempo e da concentraçao.32 Esses sao apenas alguns exemplos da aplicaçao da citometria de fluxo para estudar a internalizaçao de nanomateriais em células eucarióticas. Tráfego intracelular: citometria de fluxo nao é comumente utilizada para estudos sobre tráfego intracelular de nanopartículas. Contudo, é possível obter informaçoes indiretas, como sobre interaçao com organelas (via alteraçoes no potencial mitocondrial) ou alteraçoes nas células (via fragmentaçao do DNA), que podem servir de guia para experimentos mais específicos a serem realizados mediante outras técnicas. Resposta biológica: após internalizaçao e processamento celular, muitas nanopartículas ativam respostas celulares, que vao desde alteraçoes com efeitos terapêuticos ou de entrega de fármacos e genes, até efeitos citotóxicos como pequenas alteraçoes no citoesqueleto celular, estresse, etc.48 A citometria é uma técnica estabelecida para estudar eventos intracelulares como estresse oxidativo,49 autofagia,50 alteraçoes no ciclo celular,51 apoptose,52 entre outros. Mesmo alteraçoes como fragmentaçao do DNA celular, antes analisada por eletroforese ou microscopia, também pode ser investigada por citometria de fluxo. Zhang et al observaram alto nível de fragmentaçao de DNA, uma característica de apoptose, em tratamentos de 24 h em hepatócitos humanos de Chang e fibroblastos de pulmao de hamster chinês (V79-4).53 Uso de inibidores de internalizaçao Considerando que as várias vias de endocitose de nanomateriais sao diretamente relacionadas aos efeitos causados,21 é crucial que elas sejam determinadas. O estudo da inibiçao dessas vias constitui estratégia largamente usada para compreensao desse fenômeno.54 A inibiçao de endocitose pode ser abordada por métodos seletivos e nao seletivos para cada tipo de endocitose, mediante emprego de inibidores químicos ou através de regulaçao da expressao gênica.32 O uso de inibidores químicos é comum na caracterizaçao da via de internalizaçao, principalmente de nanomateriais,55 como ocorre com carreadores de genes.56 Os protocolos que utilizam estes inibidores sao vantajosos, pois sao de baixo custo e rápidos. Como exemplos podem ser citados o uso de clorpromazina, que atua na inibiçao de endocitose mediada por clatrina57 e o de metil-β-ciclodextrina, que atua na inibiçao de endocitose mediada por flotilina e caveolina.58 Outro ponto favorável aos ensaios com inibidores com atividade farmacológica é que eles afetam todas as células em uma populaçao, e os efeitos sao facilmente quantificados.11 A Tabela 1S apresenta uma relaçao dos inibidores de endocitose mais utilizados, organizados pelas vias de endocitose, além de uma breve descriçao de seu mecanismo de açao e concentraçoes de uso, que podem servir como guia na padronizaçao dos experimentos e a estrutura de cada um dos inibidores. A Figura 2 apresenta uma visao geral dos principais inibidores de endocitose e as respectivas vias em que atuam. Além disso, como o tráfego de vesículas intracelulares no interior das células é mediado por fibras do citoesqueleto (actina ou miosina) representamos moléculas (como latranculina, citocalasinas, faloidina e nocodazol) que atuam no citoesqueleto. Elas sao importantes para determinar quais fibras do citoesqueleto sao relevantes para o papel biológico de um determinado nanomaterial. Agentes lisossomotrópicos que, em sua maioria, sao bases fracas inibidoras da acidificaçao de vesículas intracelulares, auxiliam também na determinaçao do papel desse efeito para o papel biológico de um dado nanomaterial. Como discutido acima, alguns nanomateriais dependem da acidificaçao para desempenhar seu papel biológico.
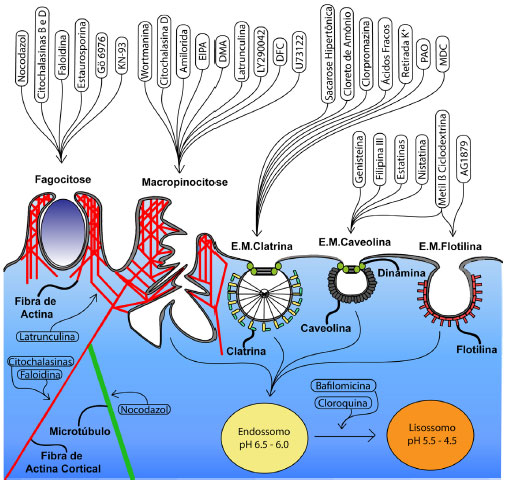 Figura 2. Local de atuaçao de inibidores de endocitose nas vias clássicas: Fagocitose, Macropinocitose, Endocitose mediada por Clatrina (E.M. Clatrina), Endocitose mediada por Caveolina (E.M. Caveolina) e Endocitose mediada por Flotilina (E.M. Flotilina) e tráfego intracelular
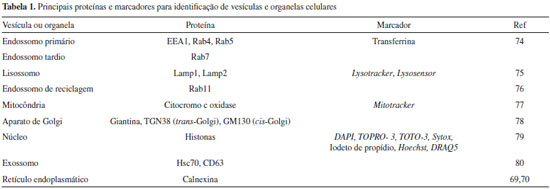
Precauçoes no uso de inibidores Para evitar problemas com a inespecificidade dos inibidores é necessário a padronizaçao de seu uso para cada tipo celular, o primeiro passo é determinar a concentraçao tóxica do inibidor. A concentraçao utilizada nao pode apresentar efeitos tóxicos significativos, pois nessa condiçao nao é possível distinguir se o efeito observado ocorre devido à inibiçao da via de interesse ou se é consequência da toxicidade do inibidor.59 Via de regra, ensaios de viabilidade padrao (ex. com MTT) devem apresentar, no máximo, 15% de reduçao de viabilidade, sendo o ideal utilizar concentraçoes que nao apresentam nenhuma toxicidade. Além disso, é importante levar em consideraçao o tempo de exposiçao das células aos inibidores. Exposiçoes muito longas (> 8 h, dependendo do inibidor e da célula) devem ser evitadas, pois as células podem metabolizar os inibidores, que perdem seu efeito. Caso sejam encontrados resultados contraditórios deve-se validar a atividade do inibidor naquele determinado tempo. Cumprida esta etapa, o próximo passo é validar as concentraçoes utilizadas do inibidor. Faz-se necessário padronizar as concentraçoes dos inibidores utilizando marcadores específicos de cada via que depende do inibidor, do tipo celular e do tempo de exposiçao. Os marcadores mais utilizados sao a transferrina para endocitose mediada por clatrina,60 toxina da cólera para a endocitose mediada por caveolina61 e dextrana para macropinocitose.62 Os marcadores geralmente sao disponíveis comercialmente já associados a um fluoróforo. A validaçao da concentraçao usada do inibidor pode ser obtida através de citometria de fluxo (quantitativo) ou microscopia confocal (qualitativo). Neste caso, determina-se a concentraçao de inibidor capaz de causar reduçao significativa da internalizaçao do marcador de cada via. Para auxiliar na determinaçao das concentraçoes iniciais de inibidor compilamos as concentraçoes mais utilizadas na literatura (Tabela 1S). Caso as células de interesse sejam diferentes daquela utilizadas nos trabalhos citados, será necessária uma busca em literatura pela célula específica. Por fim, é importante ressaltar que células em geral utilizam mais de uma via para internalizaçao de moléculas ou nanoestruturas. Em presença de inibidor, a célula pode apresentar um efeito compensatório, utilizando outra via endocítica para suprir a internalizaçao. Isso pode, por exemplo, aumentar a resposta biológica (ex. transfecçao ou citotoxicidade) e nao diminuí-la, como poderia ser pensado inicialmente,63 ou, entao, suprimir parcialmente as respostas biológicas frente ao uso de inibidor.63,64 Microscopia confocal A observaçao direta de nanomateriais exige o uso de microscópios e por isso a microscopia tem se tornado a técnica indispensável em nanotecnologia. Diversos tipos de microscopia sao usadas para caracterizar nanopartículas: microscopia eletrônica de varredura, microscopia eletrônica de transmissao, microscopia de varredura por tunelamento, microscopia por difraçao de elétrons, microscopia de força atômica, microscopia de fluorescência (em suas várias modalidades), microscopia confocal Raman, etc.65 Em particular, a microscopia de fluorescência vem sendo empregada em investigaçoes sobre interaçoes entre nanopartículas e meios biológicos. A evoluçao dessa técnica nas últimas décadas originou diversas variantes da mesma. Dentre as mais importantes há a microscopia de varredura confocal à laser, microscopia de fluorescência de 2 fótons, microscopia confocal com super-resoluçao óptica com depleçao via emissao estimulada (STED), microscopia de fluorescência em campo e com reflexao interna total (TIRF) entre outras.66 As técnicas mais avançadas de microscopia de fluorescência possibilitam elucidar processos celulares em nível molecular. Com maior poder de resoluçao revelam, com resoluçao espacial e temporal, detalhes do processamento de nanomateriais por células eucarióticas. Algumas técnicas baseadas em transferência de energia de ressonância por fluorescência (FRET), tempo de vida de fluorescência, medidas de grau de anisotropia, de variaçao temporal do grau de anisotropia e espectroscopia de correlaçao de fluorescência têm alcançado limite de resoluçao abaixo de 30 nm, aproximando o poder de resoluçao ao da microscopia eletrônica (0,1 nm). Entre as vantagens adicionais podem ser citadas: técnica nao destrutiva, menos laboriosa, menos dispendiosa, necessidade de uma menor quantidade de amostra e possibilidade de analisar amostras vivas.66 A microscopia de fluorescência é fundamentada na emissao de luz por um fluoróforo endógeno ou exógeno da amostra e tem se tornado bastante comum, em virtude também da facilidade de manuseio do equipamento. Todavia, o preparo, marcaçao, análise e processamento das imagens devem ser feitos com o devido cuidado para nao levar a interpretaçoes equivocadas dos resultados. A análise dos dados obtidos por microscopia pode ser feita qualitativa e quantitativamente, e é fundamental o conhecimento do sistema para que essa análise seja feita corretamente.67 Além disso, as limitaçoes intrínsecas de cada uma dessas técnicas devem ser sempre ser consideradas. Por exemplo, microscópios de epifluorescência nao permitem concluir se nanopartículas estao dentro ou fora de células. A marcaçao utilizada em microscopia de fluorescência é semelhante à da citometria. Proteínas de interesse podem ser etiquetadas através de técnicas de biologia molecular como associaçao com proteínas fluorescentes (GFP, RFP, BFP) ou com anticorpos fluorescentes (ou, ainda, um anticorpo secundário fluorescente). Assim, estruturas e organelas celulares podem ser identificadas juntamente com a nanopartícula de interesse. A Tabela 1 apresenta um resumo das principais proteínas e marcadores fluorescentes utilizados para identificaçao de organelas e vesículas intracelulares. É pré-requisito que essas proteínas ou estruturas reconhecidas na identificaçao de vesículas ou organelas nao deixem a estrutura de origem, mesmo após a fixaçao do material estudado. A mesma regra deve ser aplicada à marcaçao de nanopartículas, sendo imperativo garantir que, mesmo após a fixaçao, o material e o fluoróforo utilizado para marcaçao nao se separem. Para isso, quando o nanomaterial nao apresenta fluorescência intrínseca, é sempre desejável que o fluoróforo esteja ligado por ligaçao covalente; fluoróforos que têm coeficiente de partiçao com nanomaterial nao devem ser utilizados. A marcaçao de organelas como núcleo, mitocôndria e lisossomos pode ser feita com moléculas pequenas que exibem interaçoes específicas com essas estruturas (Tabela 1). Os marcadores fluorescentes de núcleos de células vivas e fixadas sao empregados por serem confiáveis, práticos e mais baratos que anticorpos. É preciso destacar que alguns desses marcadores podem interferir na proliferaçao celular, pois muitos deles interagem diretamente com o DNA. Em experimentos de longa duraçao com células vivas sao empregadas por exemplo histonas, proteínas responsáveis pelo empacotamento do DNA no núcleo, associadas a proteínas fluorescentes (ex. GFP).
A seguir serao apresentados exemplos de aplicaçoes da microscopia de florescência no estudo das principais etapas do processo de interaçao de nanopartículas com células eucarióticas: internalizaçao, tráfego intracelular e resposta biológica. Internalizaçao: sao frequentes estudos de colocalizaçao entre partículas marcadas e alguns marcadores ou proteínas envolvidas com o processo de internalizaçao.68 Tais estudos, juntamente com o uso de inibidores, sao fundamentais para demonstrar a via de internalizaçao de nanomateriais. A internalizaçao via clatrina geralmente leva nanomateriais à degradaçao lisossomal. Isso pode ser utilizado para racionalizar a entrega intracelular de fármacos ou ativos. Por exemplo, em um estudo sobre internalizaçao de nanopartículas inorgânicas lamelares contendo metotrexato (fármaco antagonista de ácido fólico, utilizado no tratamento de algumas neoplasias malignas), internalizadas preferencialmente por clatrina em células de osteosarcoma (linhagem MNNG/HOS), foi sugerido que esta seja uma via especialmente eficiente para o transporte de quimioterápicos. Isso porque a diminuiçao do pH, característico do tráfego intracelular, leva à liberaçao gradual do quimioterápico no interior das células, graças à possibilidade da troca de íons localizados na regiao interlamelar dessas nanopartículas.69 Em contrapartida, nanopartículas poliméricas altamente compactas, carreando DNA, apresentaram internalizaçao mediada por caveolina, em células epiteliais de via respiratória humana (BEAS-2B), como confirmado pela alta colocalizaçao com a toxina da cólera. Essa internalizaçao resultou em processamento mais lento quando comparado com nanopartículas de poliestireno havendo, ainda, acúmulo na regiao perinuclear, benéfica para entrega de DNA.32 Estudos sobre colocalizaçao sao vastamente empregados na caracterizaçao da via de internalizaçao de nanomateriais. Em sua maioria, esses experimentos adotam duas estratégias: colocalizar as nanopartículas com i. proteínas envolvidas na endocitose (ex. clatrina, caveolina), ou ii. com moléculas que sao sabidamente internalizadas por uma via específica associadas a fluoróforos, como transferrina, para endocitose mediada por clatrina, toxina da cólera para endocitose mediada por caveolina e dextrana para endocitose por macropinocitose, para mais exemplos vide Tabela 1. Tráfego intracelular: após internalizaçao é importante avaliar o tráfego intracelular das nanopartículas. Apesar de fortemente influenciado pela via de internalizaçao, nem sempre é possível prever o destino intracelular de nanopartículas. É possível que elas escapem dos endossomos ao citosol ou que seu acúmulo intracelular as leve à degradaçao e/ou exocitose. Os vários tipos de microscopia de fluorescência constituem as técnicas mais poderosas para investigar o tráfego intracelular de nanopartículas. Porém, neste caso é necessário considerar que ocorre acidificaçao dos endossomos, como já mencionado, o que pode alterar as características da fluorescência. Por exemplo, a proteína fluorescente eGFP, uma das variantes mais utilizadas da proteína fluorescente verde (GFP), apresenta brusca queda na fluorescência quando em meio ácido (pH < 6).70 Organelas ácidas, como endossomos tardios e lisossomos, tendem a perder o gradiente de prótons após fixaçao. Essa característica constitui um inconveniente para algumas aplicaçoes, pois a emissao de fluorescência da maioria dos marcadores é afetada pela acidez (ex. pHRodo e Lysotracker). A título de exemplo, acreditou-se por alguns anos que a internalizaçao via caveolina levasse à estruturas especiais chamadas caveossomos,71 as quais teriam pH mais próximos do fisiológico e nao apresentariam enzimas líticas. Entretanto, os mesmos autores que descreveram essas estruturas demonstraram posteriormente que este resultado era um artefato. Ao analisarem as células após fixaçao observaram que o gradiente de pH era desfeito, e por consequência, ocorria o mesmo com a marcaçao das estruturas.72 Esse artefato levou a uma interpretaçao errônea sobre o tráfego intracelular subsequente à endocitose mediada por caveolina. Inclusive, até hoje é descrito em artigos científicos e de revisao que essa via era mais apropriada para entrega de biomoléculas a células eucarióticas. O destino intracelular de nanopartículas pode ser fundamental para seu papel biológico ou terapêutico. Consequentemente, o direcionamento intracelular do nanomaterial pode ser uma estratégia para melhorar seu desempenho. Nanopartículas de óxido de ferro foram ligadas ao peptídeo D[KLAKLAK]2, inicialmente sintetizado como antibacteriano e que apresenta alta afinidade pela mitocôndria quando internalizado por células eucarióticas, e direcionaram essas nanopartículas até as mitocôndrias nao só de células em cultura, mas também in vivo, conforme demonstrado pela colocalizaçao da partícula e do marcador MitoTracker®.73 Ao entrarem em contato com células, nanopartículas podem ocasionar efeitos indesejados, apresentados resumidamente na Fig. 3.
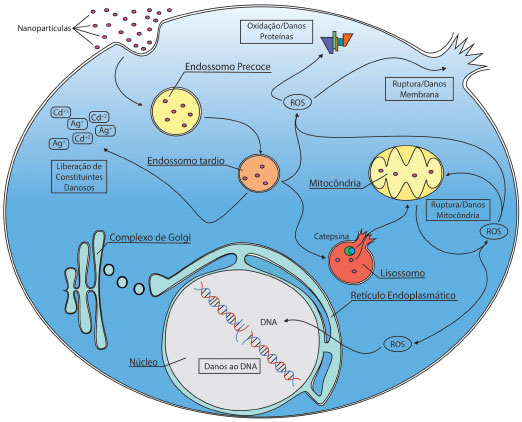 Figura 3. Principais efeitos tóxicos desencadeados por nanomateriais em células eucarióticas
Ao serem internalizadas e passarem ao sistema endossomo-lisossomo, nanopartículas podem ser degradadas, liberando constituintes que podem, por exemplo, gerar espécies reativas de oxigênio (ROS). Estas causam danos à proteínas, à membrana celular e ao DNA.81 Danos à membrana dos lisossomos pode liberar enzimas líticas, como a Catepsina (enzima degradadora de polipeptídios), que uma vez no citosol, pode atacar a membrana da mitocôndria, provocando danos e até ruptura desta organela. Ao danificar a mitocôndria, sao produzidas mais ROS, entrando em um processo cíclico, no qual ROS é produzida, induzindo mais danos à mitocôndria, gerando ainda mais ROS. Esse processo, na maioria dos casos, pode levar à mutagenicidade do material genético (DNA) e morte celular.82 O tráfego intracelular de nanopartículas é um processo dinâmico e bastante complexo. Por isso nos últimos anos as técnicas para imageamento nessa área têm evoluído e criado uma expectativa de melhor compreensao desse processo.83 Essas técnicas permitem observaçao direta de nanopartículas individuais no interior das células e oferecem avanços significativos na resoluçao espacial (10-20 nm) e temporal (1-2 s) para imagens subcelulares.84 Por isso, para os próximos anos, com o desenvolvimento e custos mais acessíveis dessas ferramentas espera-se elucidar melhor esses eventos, o que certamente auxiliaria no entendimento do processo de interaçao nanopartículas-células.
CONCLUSAO A internalizaçao, o tráfego e o processamento intracelular de nanopartículas sao processos bastante complexos. A evoluçao e aplicaçao de técnicas para imageamento têm contribuído para investigaçao desses fenômenos possibilitando melhor entendimento dos mesmos.83 Essas técnicas permitem observaçao direta de nanopartículas individuais no interior de células e de organelas intracelulares, proporcionando avanços significativos na resoluçao espacial (10-20nm) e temporal (1-2 s) de imagens subcelulares.84 A utilizaçao de nanopartículas já é uma realidade crescente a cada dia nas mais diversas áreas. Atualmente as três técnicas descritas aqui sao as mais utilizadas na caracterizaçao da internalizaçao e tráfego intracelular de nanopartículas em células eucarióticas. Apesar de muitos dos métodos descritos aqui serem utilizados in vivo, em sua maioria essas técnicas sao utilizadas em sistemas in vitro. As limitaçoes e a utilidade desses métodos ainda estao sendo determinados. Entretanto, a importância desse tema cresce a cada dia e tem despertado grande preocupaçao em relaçao à segurança na utilizaçao de nanomateriais. Nos últimos anos vemos que a nanotoxicologia apresenta importância crescente e o desenvolvimento dessa área depende do desenvolvimento de novas ferramentas. Cresce a conscientizaçao para uso de experimentaçao em animais; portanto, o desenvolvimento de ferramentas para o entendimento das interaçoes nanopartícula-célula é vital para o futuro desses sistemas.
MATERIAL SUPLEMENTAR Uma tabela contendo os principais inibidores de endocitose, conjuntamente com breve descriçao de seus mecanismos de açao, concentraçao de uso e estrutura química estao disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Os autores agradecem à FAPESP (Proc. 2014/03002-7 e 2013/05432-6) e CNPq (Proc 140802/2014-2) pelo apoio financeiro.
REFERENCIAS 1. Martins, M. A.; Trindade, T.; Quim. Nova 2012, 35, 1434. 2. Perugini, P.; Simoni, S.; Scalia, S.; Genta, I.; Modena, T.; Conti, B.; Pavanetto, F.; Int. J. Pharm. (Amsterdam, Neth.) 2002, 246, 37. 3. Brown, D. M.; Wilson, M. R.; MacNee, W.; Stone, V.; Donaldson, K.; Toxicol. Appl. Pharmacol. 2001, 175, 191. 4. Asharani, P. V.; Lian Wu, Y.; Gong, Z.; Valiyaveettil, S.; Nanotechnology 2008, 19, 255102. 5. Arora, S.; Rajwade, J. M.; Paknikar, K. M.; Toxicol. Appl. Pharmacol. 2012, 258, 151. 6. Oberdörster, G.; Oberdörster, E.; Oberdörster, J.; Environ. Health Perspect. 2005, 113, 823; Franchi, L. P.; Santos, R. A.; Matsubara, E. Y.; de Lima, J. C.; Rosolen, J. M.; Takahashi, C. S.; Quim. Nova 2012, 35, 571. 7. Paschoalino, M. P.; Marcone, G. P. S.; Jardim, W. F.; Quim. Nova 2010, 33, 421; Dimer, F. A.; Friedrich, R. B.; Beck, R. C. R.; Guterres, S. S.; Quim. Nova 2013, 36, 1520. 8. Cancino, J.; Marangoni, V. S.; Zucolotto, V.; Quim. Nova 2014, 37, 521. 9. Stern, S. T.; Adiseshaiah, P. P.; Crist, R. M.; Part. Fibre Toxicol. 2012, 9, 1. 10. Sahu, S. C.; Casciano, D. A.; Nanotoxicity: from in vivo and in vitro models to health risks, 1st ed., Wiley: Wiltshire, 2009. 11. Ivanov, A. I.; Exocytosis and Endocytosis, 1st ed., Springer: New York, 2008. 12. Alberts, B.; Johnson, A.; Lewis, J.; Raff, M.; Roberts, K.; Walter, P.; Molecular Biology of the Cell, 5th ed., Garland Science: New York, 2007. 13. Marquis, B. J.; Love, S. A.; Braun, K. L.; Haynes, C. L.; RSC Adv. 2009, 134, 425. 14. Nogueira, D. R.; Mitjans, M.; Rolim, C. M. B.; Pilar Vinardell, M.; Nanomaterials 2014, 4, 454. 15. Carlson, C.; Hussain, S. M.; Schrand, A. M.; K. Braydich-Stolle, L.; Hess, K. L.; Jones, R. L.; Schlager, J. J.; J. Phys. Chem. B 2008, 112, 13608. 16. Dijkstra, J.; van Galen, W. J. M.; Hulstaert, C. E.; Kalicharan, D.; Roerdink, F. H.; Scherphof, G. L.; Exp. Cell Res. 1984, 150, 161. 17. Bhattacharjee, S.; Ershov, D.; Fytianos, K.; van der Gucht, J.; Alink, G. M.; Rietjens, I. M. C. M.; Marcelis, A. T. M.; Zuilhof, H.; Part. Fibre Toxicol. 2012, 9, 1. 18. Saraste, J.; Palade, G. E.; Farquhar, M. G.; Cell 1986, 83, 6425. 19. Ferreira, L. A. B.; Radaic, A.; Pugliese, G. O.; Valentini, M. B.; Oliveira, M. R.; Jesus, M. B.; Acta Farmacêutica Portuguesa 2014, 3, 149. 20. Champion, J. A.; Katare, Y. K.; Mitragotri, S.; Proc. Natl. Acad. Sci. U. S. A. 2007, 104, 11901. 21. Doherty, G. J.; McMahon, H. T.; Annu. Rev. Biochem. 2009, 78, 857. 22. Ivanov, A. I. Em Pharmacological Inhibition of Endocytic Pathways: Is It Specific Enough to Be Useful?; Ivanov, A. I., ed.; Humana Press: New York, 2008, cap. 2; Vercauteren, D.; Vandenbroucke, R. E.; Jones, A. T.; Rejman, J.; Demeester, J.; De Smedt, S. C.; Sanders, N. N.; Braeckmans, K.; Mol. Ther. 2010, 18, 561. 23. Benmerah, A.; Bayrou, M.; Cerf-Bensussan, N.; Dautry-Varsat, A.; J. Cell Sci. 1999, 112 (Pt 9), 1303; Damke, H.; Baba, T.; Warnock, D. E.; Schmid, S. L.; J. Cell Biol. 1994, 12, 915; Hsueh, P.-Y.; Edman, M. C.; Sun, G.; Shi, P.; Xu, S.; Lin, Y.-A.; Cui, H.; Hamm-Alvarez, S. F.; MacKay, J. A.; J. Controlled Release 2015, 208, 2. 24. van den Broeck, D.; de Wolf, M. J. S.; Biotechnology 2006, 41, 475. 25. Segev, N.; Alfonso, A.; Payne, G. S.; Donaldson, J.; Trafficking Inside Cells - Pathways, Mechanisms and Regulation, 1st ed., Landes Bioscience: New York, 2010. 26. Behr, J. P.; Chimia 1997, 51, 34. 27. Martens, T. F.; Remaut, K.; Demeester, J.; De Smedt, S. C.; Braeckmans, K.; Nano Today 2014, 9, 344. 28. de Jesus, M. B.; Ferreira, C. V.; de Paula, E.; Hoekstra, D.; Zuhorn, I. S.; J. Controlled Release 2010, 148, e89; Ewert, K.; Evans, H. M.; Ahmad, A.; Slack, N. L.; Lin, A. J.; Martin-Herranz, A.; Safinya, C. R. Em Lipoplex structures and their distinct cellular pathways.; Leaf, H.; Mien-Chie, H.; Earnest, W., eds.; Academic Press: San Diego, 2005, cap. 5. 29. Lin, A. J.; Slack, N. L.; Ahmad, A.; George, C. X.; Samuel, C. E.; Safinya, C. R.; Biophys. J. 2003, 84, 3307. 30. de Duve, C.; de Barsy, T.; Poole, B.; Trouet, A.; Tulkens, P.; van Hoof, F.; Biochem. Pharmacol. (Amsterdam, Neth.) 1974, 23, 2495. 31. Benjaminsen, R. V.; Mattebjerg, M. A.; Henriksen, J. R.; Moghimi, S. M.; Andresen, T. L.; Mol. Ther. 2013, 21, 149. 32. Silva, A. T.; Nguyen, A.; Ye, C.; Verchot, J.; Moon, J. H.; BMC Plant Biol. 2010, 10, 1. 33. Radaic, A.; Barbosa, L. R. S.; Jaime, C.; Kapila, Y. L.; Pessine, F. B. T.; de Jesus, M. B. Em How lipid cores affect lipid nanopaticles as drug and gene delivery systems; Iglic, A.; Kulkarni, C. V.; Rappol, M., eds.; Elsevier: in press, 2016, cap. 1. 34. Tada, D. B.; Suraniti, E.; Rossi, L. M.; Leite, C. A. P.; Oliveira, C. S.; Tumolo, T. C.; Calemczuk, R.; Livache, T.; Baptista, M. S.; J. Biomed. Nanotechnol. 2014, 10, 519. 35. Givan, A. L. Em Flow Cytometry: An Introduction; Hawley, T. S.; Hawley, R. G., eds.; Humana Press: New York, 2004, cap. 1. 36. Pozarowski, P.; Holden, E.; Darzynkiewicz, Z.; Methods in Molecular Biology, 1st ed., Humana Press: New York, 2013. 37. Bendall, S. C.; Nolan, G. P.; Roederer, M.; Chattopadhyay, P. K.; Trends Immunol. 2012, 33, 323. 38. Barnard, R. M.; Bioanalysis 2012, 4, 2471. 39. Cunningham, R. E. Em Overview of Flow Cytometry and Fluorescent Probes for Flow Cytometry; Oliver, C.; Jamur, M. C., eds.; Humana Press: New Jersey, 2009, cap. 31. 40. McSharry, J. J.; Methods 2000, 21, 249. 41. Ibuki, Y.; Toyooka, T. Em Nanoparticle Uptake Measured by Flow Cytometry; Reineke, J., ed.; Humana Press: New York, 2012, cap. 11. 42. van Gaal, E. V. B.; Spierenburg, G.; Hennink, W. E.; Crommelin, D. J. A.; Mastrobattista, E.; J. Controlled Release 2010, 141, 328. 43. Hed, J.; FEMS Microbiol. Lett. 1977, 1, 357. 44. Hed, J.; Hallden, G.; Johansson, S. G. O.; Larsson, P.; J. Immunol. Methods 1987, 101, 119. 45. Xue, H.-Y.; Wong, H.-L.; ACS Nano 2011, 5, 7034. 46. Shimoni, O.; Yan, Y.; Wang, Y.; Caruso, F.; ACS Nano 2012, 7, 522. 47. Martins, S.; Costa-Lima, S.; Carneiro, T.; Cordeiro-da-Silva, A.; Souto, E. B.; Ferreira, D. C.; Int. J. Pharm. (Amsterdam, Neth.) 2012, 430, 216. 48. Jesus, M. B.; Kapila, Y. L. Em Cellular Mechanisms in Nanomaterial Internalization, Intracellular Trafficking, and Toxicity; Durán, N.; Guterres, S. S.; Alves, O. L., eds.; Humana Press: New York, 2014, cap. 9. 49. Eruslanov, E.; Kusmartsev, S. Em Identification of ROS Using Oxidized DCFDA and Flow-Cytometry; Armstrong, D., ed.; Humana Press: New York, 2010, cap. 4. 50. Hansen, T. E.; Johansen, T.; BMC Biol. 2011, 9, 1. 51. Pozarowski, P.; Darzynkiewicz, Z. Em Analysis of Cell Cycle by Flow Cytometry; Schönthal, A. H., ed.; Humana Press: New York, 2004, cap. 22. 52. Vermes, I.; Haanen, C.; Steffens-Nakken, H.; Reutellingsperger, C.; J. Immunol. Methods 1995, 184, 39. 53. Zhang, R.; Piao, M. J.; Kim, K. C.; Kim, A. D.; Choi, J.-Y.; Choi, J.; Hyun, J. W.; Int. J. Biochem. Cell Biol. 2012, 44, 224. 54. Subtil, A.; Hémar, A.; Dautry-Varsat, A.; J. Cell Sci. 1994, 107 (Pt 12), 3461. 55. Macia, E.; Ehrlich, M.; Massol, R.; Boucrot, E.; Brunner, C.; Kirchhausen, T.; Dev. Cell 2006, 10, 839. 56. Vercauteren, D.; Vandenbroucke, R. E.; Jones, A. T.; Rejman, J.; Demeester, J.; De Smedt, S. C.; Sanders, N. N.; Braeckmans, K.; Mol. Ther. 2010, 18, 561. 57. Callegari, F.; Rossini, G. P.; Toxicology 2008, 244, 133. 58. Rodal, S. K.; Skretting, G.; Garred, Ø.; Vilhardt, F.; van Deurs, B.; Sandvig, K.; Mol. Biol. Cell 1999, 10, 961. 59. Joshi, P.; Chakraborti, S.; Ramirez-Vick, J. E.; Ansari, Z. A.; Shanker, V.; Chakrabarti, P.; Singh, S. P.; Colloids Surf., B 2012, 95, 195. 60. Pozzi, D.; Marchini, C.; Cardarelli, F.; Salomone, F.; Coppola S, M. M., Zabaleta M. E., Digman M. A., Gratton E, Colapicchioni V, Caracciolo G.; Biochim. Biophys. Acta 2014, 1838,957. 61. Wittrup, A.; Zhang, S.-H.; Svensson, K. J.; Kucharzewska, P.; Johansson, M. C.; Mörgelin, M.; Belting, M.; Proc. Natl. Acad. Sci. U. S. A. 2010, 107, 13342. 62. Bang, C.; Batkai, S.; Dangwal, S.; Gupta, S. K.; Foinquinos, A.; Holzmann, A.; Just, A.; Remke, J.; Zimmer, K.; Zeug, A.; Ponimaskin, E.; Schmiedl, A.; Yin, X.; Mayr, M.; Halder, R.; Fischer, A.; Engelhardt, S.; Wei, Y.; Schober, A.; Fiedler, J.; Thum, T.; J. Clin. Invest. 2014, 124, 2136. 63. Rejman, J.; Bragonzi, A.; Conese, M.; Mol. Ther. 2005, 12, 468. 64. Damke, H.; Baba, T.; van der Bliek, A. M.; Schmid, L.; J. Cell Biol. 1995, 131, 69. 65. Rao, A.; Schoenenberger, M.; Gnecco, E.; Glatzel, T.; Meyer, E.; Brändlin, D.; Scandella, L.; J. Phys.: Conf. Ser. 2007, 61, 971. 66. Haustein, E.; Schwille, P.; HFSP J. 2007, 1, 169. 67. North, A. J.; J. Cell Biol. 2006, 172, 9. 68. Fujimoto, K.; Kitamura, M.; Yokokawa, M.; Kanno, I.; Kotera, H.; Yokokawa, R.; ACS Nano 2013, 7, 447; Fichter, K. M.; Ingle, N. P.; McLendon, P. M.; ACS Nano 2013, 7, 347; Vranic S.; Boggetto N.; Contremoulins V.; Mornet S.; Reinhardt N.; Marano F.; Baeza-Squiban A.; S., B.; Part. Fibre Toxicol. 2013, 10, 2; Kasper J.; Hermanns M. I.; Bantz C.; Koshkina O.; Lang T.; Maskos M.; Pohl C.; Unger R. E.; Kirkpatrick C. J.; Arch. Toxicol. 2013, 87, 1052. 69. Oh, J.-M.; Choi, S.-J.; Kim, S.-T.; Choy, J.-H.; Bioconjugate Chem. 2006, 17, 1411. 70. Patterson, G. H.; Knobel, S. M.; Sharif, W. D.; Kain, S. R.; Piston, D. W.; Biophys. J. 1997, 73, 2782. 71. Pelkmans, L.; Kartenbeck, J.; Helenius, A.; Nat. Cell Biol. 2001, 3, 473. 72. Hayer, A.; Stoeber, M.; Ritz, D.; Engel, S.; Meyer, H. H.; Helenius, A.; J. Cell Biol. 2010, 191, 615. 73. Agemy, L.; Friedmann-Morvinski, D.; Kotamraju, V. R.; Roth, L.; Sugahara, K. N.; Girard, O. M.; Mattrey, R. F.; Verma, I. M.; Ruoslahti, E.; Proc. Natl. Acad. Sci. U. S. A. 2011, 108, 17450. 74. Mu, F.-T.; Callaghan, J. M.; Steele-Mortimer, O.; Stenmark, H.; Parton, R. G.; Campbell, P. L.; McCluskey, J.; Yeo, J.-P.; Tock, E. P. C.; Toh, B.-H.; J. Biol. Chem. 1995, 270, 13503; Simonsen, A.; Lippe, R.; Christoforidis, S.; Gaullier, J.-M.; Brech, A.; Callaghan, J.; Toh, B.-H.; Murphy, C.; Zerial, M.; Stenmark, H.; Nature 1998, 394, 494; van der Sluijs, P.; Hull, M.; Webster, P.; Mâle, P.; Goud, B.; Mellman, I.; Cell 1992, 70, 729; Barriocanal, J. G.; Bonifacino, J. S.; Yuan, L.; Sandoval, I. V.; J. Biol. Chem. 1986, 261, 16755; Lippincott-Schwartz, J.; Fambrough, D. M.; J. Cell Biol. 1986, 102, 1593. 75. Chen, J. W.; Murphy, T. L.; Willingham, M. C.; Pastan, I.; August, J. T.; J. Cell Biol. 1985, 101, 85; Lewis, V.; Green, S. A.; Marsh, M.; Vihko, P.; Helenius, A.; Mellman, I.; J. Cell Biol. 1985, 100, 1839; Ullrich, O.; Reinsch, S.; Urbé, S.; Zerial, M.; Parton, R. G.; J. Cell Biol. 1996, 135, 913; Urbe, S.; Huber, L. A.; Zerial, M.; Tooze, S. A.; Parton, R. G.; FEBS lett. 1993, 334, 175. 76. Sanders, E. J.; Parker, E.; J. Anat. 2002, 201, 121; Bossy-Wetzel, E.; Newmeyer, D. D.; Green, D. R.; EMBO J. 1998, 17, 37. 77. Chung, H.-E.; Park, D.-H.; Choy, J.-H.; Choi, S.-J.; Appl. Clay Sci. 2012, 65-66, 24; Alvarez, C.; J. Biol. Chem. 2000, 276, 2693. 78. Nakamura, N.; Rabouille, C.; Watson, R.; Nilsson, T.; Hui, N.; Slusarewicz, P.; Kreis, T. E.; Warren, G.; J. Cell Biol. 1995, 131, 1715; Linstedt, A. D.; Hauri, H.-P.; Mol. Biol. Cell 1993, 4, 679; Martin, R. M.; Leonhardt, H.; Cardoso, M. C.; Cytometry, Part A 2005, 67A, 45; Kanda, T.; Sullivan, K. F.; Wahl, G. M.; Curr. Biol. 1998, 8, 377. 79. Valapala, M.; Vishwanatha, J. K.; J. Biol. Chem. 2011, 286, 30911; Pols, M. S.; Klumperman, J.; Exp. Cell Res. 2009, 315, 1584. 80. Geminard, C.; J. Biol. Chem. 2000, 276, 9910; Escola, J.-M.; Kleijmeer, M. J.; Stoorvogel, W.; Griffith, J. M.; Yoshie, O.; Geuze, H. J.; J. Biol. Chem. 1998, 273, 20121; Rajagopalan, S.; Xu, Y.; Brenner, M. B.; Science (New York, N.Y.) 1994, 263, 387; Hochstenbach, F.; David, V.; Watkins, S.; Brenner, M. B.; Proc. Natl. Acad. Sci. U. S. A. 1992, 89, 4734. 81. Berra, C. M.; Menck, C. F. M.; Martinez, G. R.; de Oliveira, C. S.; Baptista, M. S.; di Mascio, P.; Quim. Nova 2010, 33, 279; Rotilio, G.; Rossi, L.; de Martino, A.; Ferreira, A. M. C.; Ciriolo, M. R.; J. Braz. Chem. Soc. 1995, 6, 221. 82. Meneghini, R.; Martins, E. A. L.; Calderaro, M.; Quim. Nova 1993, 16, 377. 83. Watson, P.; Jones, A. T.; Stephens, D. J.; Adv. Drug Delivery Rev. 2005, 57, 43. 84. Vercauteren, D.; Deschout, H.; Remaut, K.; Engbersen, J. F. J.; Jones, A. T.; Demeester, J.; De Smedt, S. C.; Braeckmans, K.; ACS Nano 2011, 5, 7874. 85. Maxfield, F. R.; Wustner, D.; Methods Cell Biol. 2012, 108, 367. 86. Maréchal, V.; Prevost, M.-C.; Petit, C.; Perret, E.; Heard, J.-M.; Schwartz, O.; J. Virol. 2001, 75, 11166. 87. Cannon, G. J.; Swanson, J. A.; J. Cell Sci. 1992, 101, 907. 88. West, M. A.; Bretscher, M. S.; Watts, C.; J. Cell Biol. 1989, 109, 2731. 89. Nakase, I.; Niwa, M.; Takeuchi, T.; Sonomura, K.; Kawabata, N.; Koike, Y.; Takehashi, M.; Tanaka, S.; Ueda, K.; Simpson, J. C.; Jones, A. T.; Sugiura, Y.; Futaki, S.; Mol. Ther. 2004, 10, 1011. 90. Loike, J. D.; Shabtai, D. Y.; Neuhut, R.; Malitzky, S.; Lu, E.; Husemann, J.; Goldberg, I. J.; Silverstein, S. C.; Arterioscler., Thromb., Vasc. Biol. 2004, 24, 2051. 91. Fretz, M.; Jin, J.; Conibere, R.; Penning, N. A.; Al-Taei, S.; Storm, G.; Futaki, S.; Takeuchi, T.; Nakase, I.; Jones, A. T.; J. Controlled Release 2006, 116, 247; Meier, O.; J. Cell Biol. 2002, 158, 1119. 92. Dharmawardhane, S.; Schürmann, A.; Sells, M. A.; Chernoff, J.; Schmid, S. L.; Bokoch, G. M.; Mol. Biol. Cell 2000, 11, 3341. 93. Peterson, J. R.; Mitchison, T. J.; Chemistry & Biology 2002, 9, 1275. 94. Torgersen, M. L.; Skretting, G.; Deurs, B. v.; Sandvig, K.; J. Cell Sci. 2001, 114, 3737. 95. Araki, N.; Johnson, M. T.; Swanson, J. A.; J. Cell Biol. 1996, 135, 1249. 96. Pol, A.; Lu, A.; Pons, M.; Peiró, S.; Enrich, C.; J. Biol. Chem. 2000, 275, 30566; Mettlen, M.; Platek, A.; Van Der Smissen, P.; Carpentier, S.; Amyere, M.; Lanzetti, L.; de Diesbach, P.; Tyteca, D.; Courtoy, P. J.; Traffic 2006, 7, 589. 97. Ford, M. G. J.; Pearse, B. M. F.; Higgins, M. K.; Vallis, Y.; Owen, D. J.; Gibson, A.; Hopkins, C. R.; Evans, P. R.; McMahon, H. T.; Science (New York, N.Y.) 2001, 291, 1051. 98. Wang, L.-H.; Rothberg, K. G.; Anderson, R. G.; J. Cell Biol. 1993, 123, 1107. 99. Tulapurkar, M. E.; Schäfer, R.; Hanck, T.; Flores, R. V.; Weisman, G. A.; González, F. A.; Reiser, G.; Cell. Mol. Life Sci. 2005, 62, 1388; Yao, D.; Ehrlich, M.; Henis, Y. I.; Leof, E. B.; Mol. Biol. Cell 2002, 13, 4001; Liu, J.; Kesiry, R.; Periyasamy, S. M.; Malhotra, D.; Xie, Z.; Shapiro, J. I.; Kidney Int. 2004, 66, 227; Larkin, J. M.; Brown, M. S.; Goldstein, J. L.; Anderson, R. G. W.; Cell 1983, 33, 273. 100. Carpentier, J. L.; Sawano, F.; Geiger, D.; Gorden, P.; Perrelet, A.; Orci, L.; J. Cell Physiol. 1989, 138, 519; Hansen, S. H.; Sandvig, K.; Van Deurs, B.; J. Cell Biol. 1993, 121, 61. 101. Page, E.; Winterfield, J.; Goings, G.; Bastawrous, A.; Upshaw-Earley, J.; Doyle, D.; Am. J. Physiol.: Heart Circ. Physiol. 1998, 274, H1988. 102. Heuser, J. E.; Anderson, R. G.; J. Cell Biol. 1989, 108, 389; Ivanov, A. I.; Nusrat, A.; Parkos, C. A.; Mol. Biol. Cell 2004, 15, 176; Sandvig, K.; Olsnes, S.; Petersen, O. W.; Deurs, B. v.; J. Cell Biol. 1987, 105, 679. 103. Yumoto, R.; Nishikawa, H.; Okamoto, M.; Katayama, H.; Nagai, J.; Takano, M.; Am. J. Physiol.: Lung Cell Mol. Physiol. 2006, 290, L946. 104. Nandi, P. K.; Van Jaarsveld, P. P.; Lippoldt, R. E.; Edelhoch, H.; Biochemistry 1981, 20, 6706. 105. Schnitzer, J. E.; Oh, P.; Pinney, E.; Allard, J.; J. Cell Biol. 1994, 127, 1217. 106. Ros-Baró, A.; López-Iglesias, C.; Peiró, S.; Bellido, D.; Palacín, M.; Zorzano, A.; Camps, M.; Proc. Natl. Acad. Sci. U. S. A. 2001, 98, 12050. 107. Orlandi, P. A.; Fishman, P. H.; J. Cell Biol. 1998, 141, 905; Rothberg, K. G.; Ying, Y. S.; Kamen, B. A.; Anderson, R. G.; J. Cell Biol. 1990, 111, 2931. 108. Liu, P.; Anderson, R. G. W.; Biochem. Biophys. Res. Commun. 1999, 261, 695; Aoki, T.; Nomura, R.; Fujimoto, T.; Exp. Cell Res. 1999, 253, 629. 109. Keller, P.; Simons, K.; J. Cell Biol. 1998, 140, 1357; Subtil, A.; Gaidarov, I.; Kobylarz, K.; Lampson, M. A.; Keen, J. H.; McGraw, T. E.; Proc. Natl. Acad. Sci. U. S. A. 1999, 96, 6775. 110. Banquy, X.; Suarez, F.; Rabanel, J. M.; Argaw, A.; Grütter, P.; Bouchard, J. F.; Hildgen, P.; Giasson, S.; Soft Matter 2009, 20, 3984; MacLachlan, J.; Wotherspoon, A. T. L.; Ansell, R. O.; Brooks, C. J. W.; J. Steroid. Biochem. Mol. Biol. 2000, 72, 169. 111. Diakonova, M.; Bokoch, G.; Swanson, J. A.; Mol. Biol. Cell 2002, 13, 402. 112. Riento, K.; Frick, M.; Schafer, I.; Nichols, B. J.; J. Cell Biol. 2009, 122, 912. 113. Vercauteren, D.; Piest, M.; van der Aa, L. J.; Al Soraj, M.; Jones, A. T.; Engbersen, J. F. J.; De Smedt, S. C.; Braeckmans, K.; Biomaterials 2011, 32, 3072; DeLoid, G. M.; Sulahian, T. H.; Imrich, A.; Kobzik, L.; PLoS ONE 2009, 4, e6209. 114. Pozarowski, P.; Holden, E.; Darzynkiewicz, Z. Em Laser scanning cytometry: principles and applications-an update; Taatjes, D. J.; Roth, J., eds.; Humana Press: New York, 2014, cap. 8. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access