Revisão
|
|
| Retardantes de chama bromados: uma revisão Brominated flame retardants: a review |
|
Michelle C. Pieroni1; Juliana Leonel2,*; Gilberto Fillmann1
1. Instituto de Oceanografia, Universidade Federal do Rio Grande, 96203-900 Rio Grande - RS, Brasil Recebido em 23/05/2016 *e-mail: juoceano@gmail.com Polybrominated diphenyl ethers (PBDEs), Polybrominated biphenyls (PBBs), Hexabromocyclododecane (HBCD) and Tetrabromobisphenol A (TBBP-A) are flame retardant widely used in plastics, textiles, furniture, consumer electronics, automobiles, among others.They are important components added to retard the spread of flame and, thus,mitigate deaths and destruction caused by fires. However, environmental studies conducted in several places show that these compounds exhibit toxic effects. In addition, some are resistant to degradation, persistant in the environment, bioaccumulate and biomagnify in biota, which have worried the scientific community and government agencies. Therefore, production and use of some brominated flame retardants is being restricted and / or prohibited in many countries and some have recently been listed in the Annexs of Stockholm Convention as Persistent Organic Pollutants (POPs). Thus, a review of their use, production, legislation and environmental occurrence is presented, as well as a brief introduction to the new generation of flame retardants. INTRODUÇAO O crescimento populacional e o consequente aumento da produçao de novos materiais levaram à geraçao e utilizaçao de uma ampla variedade de polímeros sintéticos, empregados nos mais variados bens de consumo, indústrias e construçao civil. A maioria destes polímeros é constituída à base de derivados de petróleo, portanto inflamáveis, havendo assim a necessidade de promover medidas que retardem a propagaçao das chamas.1 O uso de retardantes de chama data de 450 A.C. por egípcios, que utilizavam alume para diminuir a inflamabilidade da madeira; mais tarde, em 200 A.C., os romanos passaram a utilizar uma mistura de alume e vinagre para o mesmo fim. Foi, porém, a partir dos anos 1970, com o aumento do consumo de materiais poliméricos, que houve uma necessidade ainda maior de prover segurança contra incêndios, sendo desenvolvidos, para tanto, novos retardantes de chamas adequados a estes polímeros.2 Atualmente existem mais de 175 produtos químicos classificados como retardantes de chama, divididos em quatro grandes grupos: a) inorgânicos (hidróxidos de alumínio, antimônio e estanho); b) orgânicos halogenados (clorados e bromados); c) organofosforados e d) à base de nitrogênio. Cerca de 40,4% da sua produçao mundial correspondendo a hidróxido de alumínio, 19,7% de bromados, 14,6% de fosforados, 11,3% de clorados, 8,4% de óxido de antimônio e 5,6% de outros.2,3 Em 2011 a produçao mundial de retardantes de chamas foi de 1,9 milhoes de toneladas.4 Esses compostos podem retardar a propagaçao das chamas por meio de açoes físicas ou químicas. No caso das físicas, agem por meio de resfriamento quando os compostos liberam partículas de água ao serem expostos ao calor, ou pela formaçao de uma camada protetora que envolve os materiais. Já nas açoes químicas, na presença de calor os retardantes reagem com o ar, produzindo gases incombustíveis que reduzem o suprimento de oxigênio que seria utilizado pela combustao ou, ainda, inibem a combustao ao reagir com os polímeros na fase sólida, formando uma camada protetora rica em carbono.5 Existem mais de 75 diferentes compostos utilizados como retardantes de chama bromados (BFRs).1 Segundo o Bromine Science and Environmental Forum, em 2000 houve uma demanda global de mais de 310.000 toneladas de BFRs.6 Esses retardantes estao entre os mais usados devido ao seu baixo custo, alta eficiência contra a propagaçao de chamas e fórmulas adaptáveis a quase todos os polímeros.1 Os BFRs sao divididos em três subgrupos, dependendo do modo de incorporaçao em polímeros: monômeros (estirenos bromados e butadieno bromados), reativos (tetrabromobisfenol A) e aditivos (bifenilas polibromadas, éter difenílicos polibromados, hexabromociclododecano e tetrabromobisfenol A). Os monômeros bromados sao usados na produçao de polímeros bromados, os reativos sao ligados quimicamente ao polímero e os aditivos sao apenas misturados aos polímeros. Em razao disso, os aditivos sao mais propensos a serem lixiviados para o ambiente.1 Os retardantes de chama bromados reativos e aditivos, ou seja, as bifenilas polibromadas (PBBs), os éter difenílicos polibromados (PBDEs), o tetrabromobisfenol A (TBBP-A) e os isômeros de hexabromociclododecano (HBCDs) têm atraído grande atençao na última década devido a sua grande produçao e amplo uso, bem como pela sua constante detecçao no meio ambiente e nos seres humanos.1,7-10 Os retardantes de chamas bromados sao, de maneira geral, persistentes, lipofílicos e apresentam elevado potencial para bioacumulaçao, tendo sua ocorrência na biota associada a efeitos deletérios, além de produzirem grande quantidade de fumaça e gases tóxicos nos incêndios.11,12 A presença desses compostos já foi relatada em todos os compartimentos ambientais e em diferentes regioes do globo, incluindo regioes remotas onde nao há histórico do seu uso e/ou produçao (por exemplo, as regioes polares).13-15 Alguns desses compostos (PBBs, Penta-BDE, Octa-BDE e Deca-BDE) já tiveram a sua produçao e comercializaçao restringida ou proibida em alguns países (ex. Uniao Europeia e Japao). Em 2009, os tetrabromodifenis éter (tetra-BDE), os pentabromodifenis éter (penta-BDE), os hexabromodifenis éter (hexa-BDE), os heptabromodifenis éter (hepta-BDE) e o hexabromobifenil (HxBB) foram incluídos no Anexo A da Convençao de Estocolmo. Por serem considerados Poluentes Orgânicos Persistentes (POPs) tiveram a sua produçao, uso e comercializaçao proibida, visando a sua total eliminaçao.16 O hexabromociclododecano (HBCD) foi incluido no Anexo A em 2013. Já as misturas comerciais hexa-, octa- e decabromobifenil (PBB) e penta- e octabromodifenil éter (BDEs) foram incluídas no Anexo III da Convençao de Roterda em 2008 e 2013, respectivamente.17 Esta Convençao promove a responsabilidade compartilhada e o consentimento informado prévio no comércio internacional das substâncias químicas consideradas perigosas, em um esforço cooperativo entre as partes, visando a proteçao da saúde humana e do meio ambiente. No Brasil, ainda nao há uma legislaçao específica em relaçao a estes retardantes, apenas um Projeto de Lei do Senado (n° 173) proposto em 2009 e arquivado em 2011, que estabelece que computadores, componentes de computadores e equipamentos de informática em geral comercializados no Brasil devem apresentar concentraçao nao superior a 0,1% de PBBs, PBDEs, chumbo, mercúrio e cromo hexavalente.18 Além disso, há apenas uma instruçao normativa (número 1 de 2010) a respeito dos critérios ambientais na aquisiçao de bens, contrataçao de serviços ou obras por orgaos públicos, afirmando que estes poderao exigir, entre outros que: "os bens nao contenham substâncias perigosas em concentraçao acima da recomendada na diretiva RoHS (Restriction of Certain Hazardous Substances), tais como mercúrio (Hg), chumbo (Pb), cromo hexavalente (Cr(VI)), cádmio (Cd), bifenil-polibromados (PBBs), éteres difenil-polibromados (PBDEs)".19
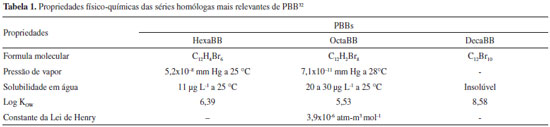
BIFENILAS POLIBROMADAS (PBBs) Bifenilas polibromadas (PBBs) (Figura 1) sao um grupo de retardantes de chama que começaram a ser fabricados no início da década de 1970 e mesmo durante o período de sua máxima utilizaçao nao chegaram a representar 1% das vendas mundiais de retardantes de chama.20 Sua aplicaçao se limitou praticamente a termoplásticos (acrilonitrila-butadieno-estireno - ABS) utilizados em equipamentos eletrônicos de uso doméstico e empresarial.20,21 No Brasil nao foram identificados dados sobre o uso do PBBs no passado, nem de sua produçao ou existência de estoques.22,23 Da mesma forma, nao foram feitas importaçoes ou exportaçoes destes compostos no período de 1997 a 2015, nao existindo dados para os anos anteriores.24
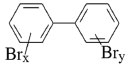 Figura 1. Estrutura química genérica da Bifenila Polibromada (PBB), onde x+y = 1-10
Os PBBs fazem parte de uma classe de compostos que podem ter de um a dez átomos de hidrogênio substituídos por bromo. Dessa forma, apresentam estrutura semelhante às bifenilas policloradas (PCBs) com uma nomeclatura análoga e um mesmo número de congêneres.25 Sua produçao comercial, entretanto, envolve um número restrito de compostos onde apenas 42 congêneres de PBBs foram sintetizados em laboratório.26 Eles foram disponibilizados na forma de três misturas comerciais (NTP 2011): a) Hexabromobifenil (HxBB) - formado por 4,0% de pentabromobifenis, 62,6% de hexabromobifenis e 33,4% de heptabromobifenis. Foi a principal mistura produzida representando até 87% da produçao de PBBs, sendo desses 98% produzidos na forma do produto comercial conhecido como FireMaster BP 6; b) Octabromobifenil (OBB) - sua composiçao possui 1,8% de heptabromobifenis, 47,3% de nonabromobifenil, 45,2% de octabromibifenis e 5,7% de decabromobifenil; c) Decabromobifenil (DBB) - mistura de 96,8% de decabromobifenil, 2,9% de nonabromobifenil e 0,3% octabromobifenil.21 Esses compostos, principalmente as misturas HxBB e o OBB, foram produzidos nos Estados Unidos pela Michigan Chemical Corporation; na Gra-bretanha duas empresas foram responsáveis pela produçao do DBB; na Alemanha fabricou-se o Bromkal 80-9D (basicamente nonabromobifenil); na França a empresa Atochem comercializou o DBB.27 Por terem estrutura semelhante, apresentam propriedades físico-químicas similares às bifenilas policloradas (PCBs) (Tabela 1), sendo também tóxicas, resistentes à degradaçao, hidrofóbicos, lipofílicos e, portanto, bioacumulativos.28 Devido a estas características, a mistura comercial hexabromobifenil foi incluída na lista dos POPs em maio de 2009.9 Apesar da semelhança com os PCBs, a ocorrência dos PBBs no ambiente é mais limitada devido a sua baixa produçao e menor tendência de liberaçao a partir dos termoplásticos nos quais foram incorporados.29 Os PBBs ganharam bastante atençao após um acidente em Michigan (EUA), entre 1973 e 1974, quando cerca de 250-500 quilos de FireMaster BP-6 (HxBB) foram acidentalmente adicionados à raçao animal, sendo a populaçao local posteriormente exposta através da ingestao de leites e outros alimentos contaminados.20,30 Como consequência do acidente, a empresa parou de produzir FireMaster BP-6 em 1974 e demais PBBs em 1977.20,31
Apesar da aplicaçao dos PBBs ter diminuído desde meados da década de 1970, resíduos dos mesmos continuam sendo reportados em amostras ambientais e em seres humanos de diferentes partes do globo, como China, Espanha e Estados Unidos.25,33-37 Os congêneres mais comumente encontrados sao o PBB 153 e outros de baixa bromaçao como o PBB 29, 49, 52, 56, 77 e 80.34,35,38,39 Resíduos de PBBs foram detectados em compartimentos ambientais como lodo de tratamento de efluentes domésticos na Austrália e em amostras de diversas espécies de peixes de valor comercial da Polônia e França, do Mar Báltico e do nordeste dos EUA, em cetáceos da costa sul e sudeste do Brasil e do Atlântico Norte, aves e ar do Artico e em pandas na China.15,33,34,39-42 Muitos trabalhos referem-se especialmente ao acidente ocorrido em Michigan ou a regiao de descarga de efluentes da Michigan Chemical Corporation.25,31,36,37,43 Entre eles, alguns reportaram valores elevados em amostras de sangue humano (933 a 1744 µg L-1) e em amostras de água (0,01 e 0,07 µg L-1) e sedimento (100 e 77000 ng g-1).25,31 A absorçao dos PBBs pelos organismos ocorre de forma rápida e inversamente proporcional ao número de bromos na molécula.44 Devido a sua característica de lipofilicidade, as maiores concentraçoes sao encontradas, principalmente, nos tecidos hepático e adiposo.44,45 Além disso, estudos feitos com humanos mostraram que a transferência placentária ocorre, porém a principal forma de excreçao em mamíferos é através do leite.46,47 A meia-vida desses compostos nos organismos é bastante variável, por exemplo, 22 dias em porquinhos-da-índia a 4 anos em macacos.48,49 Em humanos, pode variar de 8 a 30 anos.43 Esses tempos vao depender da idade, massa corpórea, gestaçao, histórico de vida, etc. Em sedimentos e solos a meia-vida é maior que 6 meses, devido à resistência de misturas de PBB à degradaçao microbiana.50 Embora nao sejam claros todos os efeitos decorrentes da contaminaçao por PBBs, estudos feitos com ratos mostram déficit na funçao neuromuscular, na atividade locomotora, retardo de crescimento e toxicidade neuro comportamental.30 Os efeitos sentidos pela populaçao de Michigan, afetada pelo acidente de 1973, incluem alteraçoes gastrointestinais, cutâneas, músculo-esqueléticas e neurológicas.36,37,51 Outros estudos feitos ainda mostram relaçao entre a exposiçao aos PBBs e incidência de câncer, alteraçao de crescimento, e alteraçao no ciclo menstrual.44,45,52,53 Nos EUA, a produçao do HxBB foi descontinuada em 1976,20 mas a produçao do OBB e DBB continuou até 1979.20,54 Na Gra-Bretanha a produçao dos PBBs foi descontinuada em 1977 e na Alemanha em 1985.21 No Brasil, segundo o Ministério do Meio Ambiente nao foram identificados dados de produçao e uso industrial do HxBB.22,23 Outros países, como Austrália, Japao e República do Líbano, também reportaram que nao mais produzem ou usam o HxBB.27 Por fim, a França foi o último país a cessar a produçao de PBBs em 2000.21 De acordo com a UNEP, devido à pequena produçao e ao uso limitado dos HxBB, acredita-se que a maioria dos materiais que os continha tenham sido eliminados.55 Ainda assim, os HxBB foram inseridos na lista de POPs da Convençao de Estocolmo em 2009.
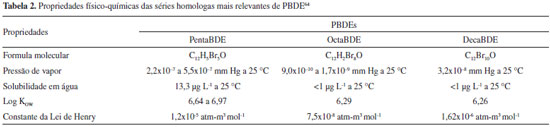
ÉTER DIFENILICOS POLIBROMADOS (PBDEs) Os PBDEs (Figura 2) começaram a ser produzidos no final da década de 1970 através da bromaçao do éter difenílico, na presença de um catalisador (por exemplo, AlCl3) em solvente.1,56 A substituiçao de qualquer um dos 10 átomos de hidrogênio do éter difenílico por bromo (Figura 2) possibilita a formaçao de até 209 congêneres de PBDEs.1
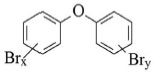 Figura 2. Estrutura química genérica do Éter Difenílico Polibromado (PBDE), onde x+y = 1-10
Comercialmente os PBDEs foram produzidos principalmente na forma de três misturas técnicas: Penta-BDE, Octa-BDE e Deca-BDE.56 A mistura penta-BDEs, composta principalmente por 24-37% de tetra-BDEs, 50-60% de penta-BDE, 4-8% de hexa-BDEs, foi empregada principalmente na manufatura de espumas flexíveis de poliuretano, utilizadas na confecçao de cadeiras, poltronas, sofás, colchoes, cortinas, entre outros.56,57 A mistura octa-BDE, composta principalmente por 10-12% de hexa-BDEs, 44% de hepta-BDEs, 31-35% de octa-BDEs, 10-11% de nona-BDEs e <1% de deca-BDE foi aplicada na manufatura de polímeros à base de acrilonitrila-butadieno-estireno (ABS), usado em monitores de computador e em outros aparelhos eletrônicos correlatos.57,58 Por fim, a mistura deca-BDE, composta por >97% de BDE 209 e o restante por nona-BDEs e resíduos de octa-BDEs, é empregada em têxteis e em plásticos de alta densidade usados em televisoes, computadores e outros equipamentos eletrônicos.57,59 Devido as suas propriedades (Tabela 2), os PBDEs sao resistentes à degradaçao físico-química e biológica e, consequentemente, apresentam alta persistência no ambiente. Sao lipofílicos e hidrofóbicos, podendo entao bioacumular e biomagnificar ao longo da cadeia trófica. Apresentam toxicidade aos organismos e, devido a sua baixa pressao de vapor, podem ser transportados a longas distâncias.58,60 Essas características levaram os congêneres tetra- e penta-BDE, pertencentes à mistura técnica penta-BDE, e os congêneres hexa- e hepta-BDE componentes da mistura técnica octa-BDE, a serem incluídos na lista dos Poluentes Orgânicos Persistentes (POPs) da Convençao de Estocolmo em maio de 2009.9 Alguns congêneres de PBDEs, das misturas penta e octa-BDEs já haviam tido sua produçao e comercializaçao proibida em alguns países.61 A Uniao Europeia baniu as formulaçoes comerciais penta- e octa-PBDE em 2003, porém a mistura deca-BDE continuou em uso.57 Nos EUA, as empresas decidiram voluntariamente parar a produçao da formulaçao deca-BDE no final de 2013.62 Em outubro de 2013, a Noruega propôs à Convençao de Estocolmo que a formulaçao comercial deca-BDE também fosse incluída no Anexo A da Convençao de Estocolmo.63
Apesar da restriçao atual de uso de alguns PBDEs, o aporte ambiental destes compostos ainda é motivo de preocupaçao. A restriçao do uso nao impede que os produtos fabricados anteriormente à proibiçao continuem sendo utilizados ou que o seu destino final, seja na reciclagem ou disposiçao dos bens de consumo em lixoes, acabe consequentemente liberando, de forma lenta e difusa, o contaminante para o ambiente.61 Adicionalmente, como consequência da restriçao das misturas penta- e octa-BDE, a produçao de deca-BDE aumentou e, apesar deste ser considerado um congênere menos biodisponível, pode sofrer debrominaçao gerando formas mais tóxicas e capazes de bioacumular.61,65,66 Os PBDEs nao sao quimicamente ligados aos polímeros, podendo entao ser separados da matriz polimérica durante algumas atividades como incineraçao de componentes eletro-eletrônicos e bens de consumo, ou deposiçao de lixos eletrônicos e transformadores em lixo comum, resultando na introduçao desses compostos no ambiente.56,67 Após sua entrada no ambiente, esses compostos sao encontrados preferencialmente na biota e sedimento. Os níveis mais altos desses compostos encontram-se em regiao altamente industrializada e com maior densidade populacional, onde as concentraçoes apresentam-se na ordem de centenas de ng g-1. Em peixes, por exemplo, os níveis encontrados variaram de 1,5 a 100 ng g-1 (peso lipídico), na regiao dos Grandes Lagos (América do Norte), e de 30,6 a 281 ng g-1 (peso lipídico) em estuários de Taiwan.67,68 Na atmosfera do leste da China, os níveis de PBDEs encontram-se em torno de 200 pg m-3 e, no sedimento de lagos da mesma regiao e áreas adjacentes, os níveis variaram de 0,02 a 46,6 ng g-1 de peso seco.69,70 Já em regioes menos industrializados, as concentraçoes de PBDEs sao menores; por exemplo, na Baía de Concepción valores para sedimentos ficaram próximos de 1 ng g-1 de peso seco e no Sul do Brasil o valor médio em bivalves foi de 6,83 ng g-1 de peso lipídico.71,72 Entretanto, apesar dos resultados serem apresentados em termos de somatório de PBDEs, uma análise comparativa dos resultados deve levar em consideraçao o número de congêneres analisados em cada estudo, visto que isso pode influenciar significativamente na concentraçao reportada. Além da alta industrializaçao, algumas regioes, como a China e países do sudeste da Asia, também enfrentam problemas com a grande quantidade de lixo eletrônico, os chamados e-wastes, que contribuem para elevar os níveis ambientais de diversos contaminantes, dentre eles os PBDEs.73 Esses compostos sao sabidamente tóxicos aos organismos, tendo como prováveis consequências a desregulaçao endócrina, carcinogenia e deficiência neurológica. Devido às semelhanças estruturais entre alguns PBDEs e os hormônios receptores da tireóide pode haver uma possível competiçao entre eles, causando alteraçoes nas funçoes da tireóide, o que pode levar a mudanças das taxas metabólicas, síntese de proteína e desenvolvimento celular.74 A formaçao de tumores e câncer foi também associada à exposiçao a PBDEs.74 Estudo feito com homens e mulheres, com 60 anos em média, relacionou a dificuldade na fala e de memória com altos níveis de PCBs e PBDEs no sangue.75
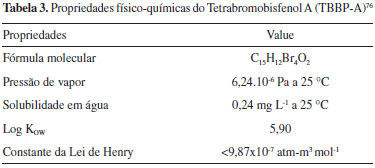
TETRABROMOBISFENOL A (TBBP-A) O tetrabromobisfenol A (TBBP-A) (Figura 3) é produzido pela bromaçao do bisfenol A (BPA) e é amplamente usado como retardante de chama em polímeros, tais como acrilonitrila-butadieno-estireno (ABS), resinas, adesivos, equipamentos elétricos e eletrônicos, eletrodomésticos, móveis e material de construçao.76,77 Sua principal aplicaçao é em resina epóxi utilizada para produçao de placas de circuito impresso, nas quais o teor de bromo pode chegar a 20% do peso.78 O TBBP-A também pode ser usado como composto base para a produçao de outros retardantes de chama comerciais, tais como tetrabromobisfenol A bis (2-hidroxietil éter), Tetrabromobisfenol A dibromopropileter, Tetrabromobisfenol A bis (alquil éter), Tetrabromobisfenol A oligômero de carbonato.76 Em funçao das suas propriedades físico-químicas (Tabela 3), o TBBP-A é considerado um composto lipofílico com grande afinidade por partículas, alta volatilidade e baixa solubilidade em água.
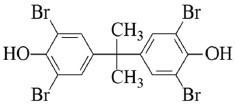 Figura 3. Estrutura química do Tetrabromobisfenol A (TBBP-A)
O TBBP-A é o retardante de chama bromado com o maior volume de produçao global,6 estimada, em 2006, em 150 mil toneladas/ano.76 É produzido principalmente em Israel, Estados Unidos, Jordânia, Japao e China.6 O uso de TBBP-A é permitido em todo o mundo e nao há restriçoes sobre a produçao deste e seus derivados.78 Com a proibiçao dos principais PBDEs nos EUA e Canadá, o TBBP-A tornou-se o retardante de chama bromado mais utilizado nestes países.79 Representou cerca de 60% do mercado global de BFRs em 2001, dos quais 70% foram usados como retardante de chama reativo em equipamentos elétricos e eletrônicos, 20% como aditivo em materiais poliméricos e 10% para a produçao de derivados.76,80 A Asia é o maior consumidor de TBBP-A, visto que a maioria dos itens eletrônicos que utilizam placas de circuito eletrônicos sao produzidos nesta área, especialmente na China.81 O TBBP-A pode ser aplicado tanto na forma reativa, ligando-se covalentemente com o grupo fenílico hidroxilado, fazendo parte da estrutura do polímero, como na forma aditiva, sendo simplesmente aderido/misturado a este.82 A forma reativa representa a maior aplicaçao deste retardante de chama na indústria/mercado (90%). Apesar de ser mais difícil, mesmo a forma reativa pode liberar TBBP-A ao ambiente.6,83,84 A exposiçao pode ocorrer através do vapor ou pó que sao exalados de equipamentos (como televisores ou computadores) quando aquecidos durante o uso.6 Quando usado como aditivo nos polímeros, por nao fazer parte da estrutura dos mesmos, pode ser facilmente liberado para o ambiente. Sendo assim, o TBBP-A pode ser liberado para o ambiente durante a produçao, utilizaçao e, principalmente, através da lixiviaçao de produtos que contenham na sua composiçao este retardante de chama.85 Incêndios acidentais ou incineraçao de materiais contendo TBBP-A causam preocupaçao, pois estes processos podem também resultar na geraçao de dioxinas e furanos bromados.86 O TBBP-A foi reportado em diferentes compartimentos ambientais: ar, solos e sedimentos.84 A revisao feita por Covaci et al. aponta para níveis significativos de TBBP-A em matrizes da biota marinha, incluindo invertebrados, peixes, aves e mamíferos, sendo as maiores concentraçoes encontradas em organismos do topo da cadeia alimentar.77 No ambiente o TBBP-A pode sofrer processos de volatilizaçao, foto-oxidaçao química, oxidaçao, bioacumulaçao, e adsorçao em partículas de sedimentos.87 Durante o processo de degradaçao pode ser transformado em derivados, tais como tri-, di-, mono-bromobisfenol A e bisfenol-A (BPA).56,88-90 Os caminhos biológicos pelos quais TBBP-A é degradado no ambiente sao pouco conhecidos, porém, recentemente, foi demonstrado que um dos principais processos para a remoçao do TBBP-A pode ser feita através da degradaçao microbiana. Em ambientes anaeróbicos o TBBP-A pode ser transformado em Bisfenol A (BPA) e em ambientes aeróbios para éter dimetílico de TBBP-A (TBBPA DME).87,91 A toxicidade do TBBP-A tem sido amplamente investigada em animais e plantas e, apesar de ter sido relatado como composto de baixa toxicidade, sao relatados efeitos imunotóxico e neurotóxico em animais.56,92-94 Em peixes observou-se diminuiçao da frequência cardíaca, edema e má formaçao da cauda, além de efeitos como desorientaçao, sonolência, diminuiçao da produçao de ovos e do sucesso reprodutivo.91,95 Em ratos, o TBBP-A mostrou efeitos neurocomportamental, endócrino e reprodutivo.96-98 Também pode ser considerado como potencial desregulador endócrino, devido a sua semelhança estrutural com o hormônio da tireóide tiroxina (T4). Apesar dos efeitos apontados em laboratório, em razao das baixas concentraçoes encontradas e consequente reduzida exposiçao à biota, acredita-se que o TBBP-A nao apresente risco ao ambiente e ao homem.6,99 No entanto, áreas com maior consumo de TBBP-A, a exemplo de algumas regioes da Asia, onde foi observado um aumento na concentraçao desse contaminante no sedimento, requerem maior atençao devido aos efeitos deletérios associados à presença desse composto.100 Apesar da produçao e do uso do TBBP-A nao serem proibidos, diversos órgaos têm desenvolvido programas de monitoramento e de avaliaçoes de impactos ambientais e na saúde humana. Por exemplo, a Uniao Europeia incluiu o TBBP-A no REACH (Registration, Evaluation, Authorisation and Restriction of Chemicals) e a EPA tem coordenado diversos estudos de ocorrência e efeitos tóxicos. Já na Asia, onde se localizam os maiores consumidores de TBBP-A, como China, Japao, Coreia e Taiwan, parece nao haver iniciativa de órgaos ambientais para que a produçao e o uso deste contaminante sejam proibidos.6 No Brasil nao existem registros sobre seu uso, produçao, exportaçao ou importaçao e nem mesmo informaçoes sobre medidas reguladoras.23
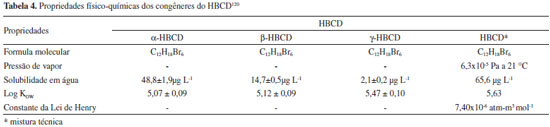
HEXABROMOCICLODODECANO (HBCD) O Hexabromociclododecano (HBCD) (Figura 4) é um retardante de chama do tipo aditivo que tem sido amplamente usado pelas indústrias de polímeros e têxteis nas últimas décadas. Seus principais usos sao em espumas e resinas de poliestireno, posteriormente usadas pela indústria em móveis estofados, interiores de veículos, blocos usados na construçao de residências, telhados, embalagens e equipamentos elétricos.56
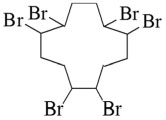 Figura 4. Estrutura química do Hexabromociclododecano (HBCD)
O HBCD é produzido a partir da bromaçao dos quatro isômeros do 1,5,9 ciclododecatrieno (CDTs) (trans,trans,trans-, trans,trans,cis-, trans,cis,cis-, e cis,cis,cis-CDT). Dependendo da constituiçao isomérica da mistura técnica de CDTs usada e das condiçoes do processo industrial, misturas de HBCDs com diferentes composiçoes e proporçoes entre isômeros sao produzidas. De uma forma geral, 16 estereoisômeros de HBCDs sao possíveis: seis diastoisômeros com seus pares de enantiômeros e quatro meso formas.101 Entre esses os mais comuns sao os diasteroisômeros α-, β-, γ-HBCD nas formas de enântionmero (+) e enantiômero (-).102 Na mistura técnica esses isômeros estao presentes nas seguintes proporçoes: 1- 12% para o α-HBCD, 10 - 13% para o β-HBCD e 75 - 89% para o γ-HBCD (Tabela 4).101,103
Por ser um retardante de chama do tipo aditivo, ou seja, é apenas adicionado aos polímeros e nao está quimicamente ligado, o HBCD é facilmente liberado dos produtos nos quais é usado e acumula nos diversos compartimentos ambientais. O HBCD foi detectado pela primeira vez em meados da década de 1990 em amostras de ar, esgoto e sedimento na Suécia e, desde entao, tem sido detectado em vários compartimentos ambientais, biota e seres humanos.104-111 Além disso, estudos reportam sua ocorrência tanto em áreas urbanas e industrializadas, como em locais remotos.73,105,107,112,113 Dessa forma, o HBCD é considerado um contaminante com distribuiçao ubíqua. Por se tratar de um composto orgânico nao-volátil, estudos inferem que sao transportados globalmente pelas correntes atmosféricas e oceânicas, adsorvidos as partículas.73 Embora alguns trabalhos reportem a ocorrência do diasteroisômero δ-HCBD, os mais encontrados em matrizes ambientais sao os α-, β-, e γ-HBCD.107-108,110 O padrao de distribuiçao entre eles é similar ao perfil das formulaçoes comerciais, com predomínio do isômero γ.101,105 Entretanto, em diversos trabalhos, principalmente na biota, a contribuiçao do α-HBCD tem aumentado.109,114,115 Um estudo realizado com peixes expostos a HBCD relatou que o α-HBCD possui maiores valores de meia vida e de fator de bioacumulaçao que os demais isômeros, fator que explicaria a maior abundância de α-HBCD em organismos.116 Poucos estudos avaliaram a toxicidade do HBCD, porém há indícios de que apresenta uma elevada toxicidade, sendo capaz de induzir câncer, afetar o funcionamento do sistema hormonal e hepático.117 Também existem indícios de efeitos sobre a fertilidade e neurotoxicidade em mamíferos e de desregulaçao hormonal da tireóide.117 A exposiçao de filhotes de ratos a α-HBCD mostrou um prejuízo no desenvolvimento do cérebro promovido pelo hormônio da tiroide (T3).117 Outro estudo observou alteraçoes no comportamento reprodutivo de falcoes, com diminuiçao no cuidado parental, na temperatura de incubaçao dos ovos durante a nidificaçao e na taxa de cortejo.118 Os diferentes isômeros também apresentam diferentes toxicidades. Du et al.119 reportou inibiçao do crescimento, má-formaçao, atraso na eclosao dos ovos e decréscimo na taxa de sobrevivência de peixes relacionado, tanto com a concentraçao de exposiçao, quanto com o isômero ao qual os organismos foram expostos. Segundo os resultados desse mesmo estudo, o efeito dos isômeros sobre o crescimento dos organismos se daria na seguinte ordem: γ-HBCD>β-HBCD>α-HBCD. Segundo a Comissao Nacional de Segurança Química (CONASQ) e a Associaçao Brasileira da Indústria Química (Abiquim), o HBCD é usado no Brasil nos setores automotivos, de construçao civil, eletrônica e têxtil. Sua concentraçao pode variar de 0,3 a 0,7%, na forma de polistireno expansível, poliestireno extrudado e poliestireno de alto impacto para uso como isolamento térmico na indústria de construçao civil e como aditivo retardante de chama para uso industrial, obedecendo a norma brasileira NBR 11948.22 No entanto, como o HBCD nao possui código de identificaçao especifico (NCM), nao é possível identificar as quantidades importadas e/ou exportadas.23 Devido as suas características de bioacumulaçao, bioamagnificaçao, persistência e potencial para ser transportado a longas distâncias, o HBCD foi incluído, em 2013, no Anexo A da Convençao de Estocolmo. Entretanto, sao aceitas exceçoes específicas para o seu uso em poliestireno expandido e poliestireno extrudido. O Brasil nao possui legislaçao específica para o uso de HBCD, mas como signatário da Convençao de Estocolmo deve atender às decisoes associadas a inclusao no Anexo A, que envolve a eliminaçao do HBCD.
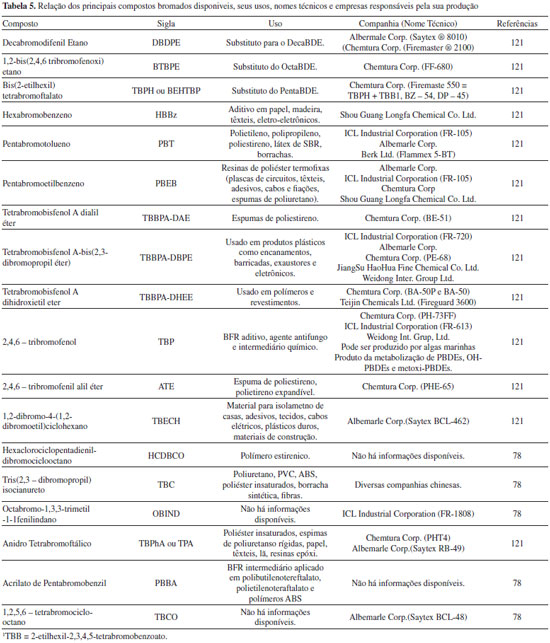
OUTROS RETARDANTES DE CHAMA BROMADOS Com as restriçoes e/ou proibiçoes no uso, produçao e comercializaçao de alguns retardantes de chamas bromados, outros compostos bromados começaram a ganhar espaço como retardantes de chama. Uma relaçao dos principais produtos atualmente disponíveis, juntamente com algumas informaçoes de uso e produçao, encontra-se na Tabela 5.
Os dados de ocorrência desses compostos em matrizes ambientais sao, em geral, informaçoes colaterais em estudos sobre PBDEs, PBBs, HBCDs e TBBP-A.39 No Brasil, apenas um estudo foi encontrado em que três compostos (Decabromodifeniletano (DBDPE), Hexabromobenzeno (HxBB) e Pentabromoetilbenzeno (PBEB)) foram analisados em amostras de fígado de Pontoporia blainville da costa sul e sudeste do Brasil.39
BFRs NO BRASIL: OCORRENCIA E TENDENCIAS Poucos sao os trabalhos que avaliaram a ocorrência de BFRs em amostras ambientais no Brasil. Um compilado do que se encontra publicado é apresentado na Tabela 6. Como pode ser observado, quase a totalidade dos estudos é relacionada à ocorrência de PBDEs em mamíferos marinhos, com poucos estudos realizados em amostras de peixes, sedimento, tecido adiposo humano e bivalves.39,72,122-128 Além disso, os poucos estudos realizados foram com amostras oriundas apenas das regioes sul e sudeste do Brasil. A maioria dos níveis de PBDEs detectados em amostras do Brasil é baixa. No entanto, alguns estudos reportaram valores similares aos encontrados em animais de regioes sabidamente contaminadas do Hemisfério Norte, como por exemplo os valores encontrados em golfinhos do litoral do Rio de Janeiro e Sao Paulo.129,130
RETARDANTES DE CHAMAS NAO HALOGENADOS (ALTERNATIVAS) Com a crescente preocupaçao com os efeitos deletérios dos retardantes de chamas bromados e seu gradual banimento, surgiu a necessidade de substituiçao desses compostos. Uma das alternativas para a substituiçao dos BFRs sao os chamados Retardantes de Chamas Nao Halogenados (HFFRs), dos quais pode-se destacar os retardantes de chama inorgânicos, compostos organofosforados e seus sais, retardantes de chama orgânicos à base de nitrogênio e sistemas intumescentes.140 Esses retardantes já sao encontrados no mercado, porém pouco se sabe sobre seu comportamento ambiental e seus riscos à saúde humana.140 Um estudo recente demonstrou que retardantes de chama fosforados estao amplamente distribuídos pela atmosfera da América Latina, incluindo amostras do sul e nordeste do Brasil.141 Sendo assim, o uso de novos compostos nao halogenados deve ser feito com cautela já que as poucas informaçoes sobre a sua persistência, bioacumulaçao e toxicidade deixam dúvida se realmente seriam menos problemáticos do que os BFRs ao ambiente e seres humanos.
CONSIDERAÇOES FINAIS De maneira geral, os BFRs sao compostos de grande potencial tóxico e que, apesar de já terem sido proibidos em alguns países, ainda sao bastante usados principalmente por países em desenvolvimento. Além disso, novas fontes de BFRs, como o e-waste oriundo de atividades de reciclagem, tem gerado preocupaçao nas últimas décadas. Da mesma forma, compostos que estariam indisponíveis em geleiras ou na pergelissolo podem ser tornar disponíveis devido ao aquecimento associado às mudanças climáticas.142 Apesar do Brasil ser signatários da Convençao de Estocolmo, estando comprometido com a nao comercializaçao de produtos contendo alguns dos BFRs ou seu uso direto, há pouca informaçao disponível sobre a produçao e comercializaçao atual e histórica desses compostos no Brasil. Além disso, é sabido que muitos dos bens de consumo utilizados aqui, desde produtos eletrônicos até utensílios domésticos, sao provenientes de importaçao. Muitos destes produtos sao oriundos da China, por exemplo, país que sabidamente faz uso de BFRs e onde, até o momento, nao há previsao do seu banimento. Fica evidente que nao há um controle efetivo da entrada no mercado brasileiro dos bens de consumo que possam conter estes compostos, tao pouco uma legislaçao pertinente que vise a sua regulamentaçao. A ocorrência de BFRs em amostras ambientais da costa brasileira evidencia o uso desses produtos no Brasil.39,110,122,124,129,131,134 Portanto, é fundamental que este tema seja abordado com maior propriedade, por meio de estudos que permitam uma avaliaçao detalhada do status da contaminaçao atual e futura, bem como pela implementaçao de legislaçoes específicas no país.
MATERIAL SUPLEMENTAR Os números CAS dos compostos citados neste trabalho estao compilados na Tabela 1S, disponível em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Esse trabalho teve apoio da CAPES (bolsa de mestrado: Michelle C. Pieroni e PNPD no. PNPD2509091: Juliana Leonel) e do CNPq (PQ 312341/2013-0 - Gilberto Fillmann). Os autores também agradecem à Gabriela M. Ignácio pela confecçao das figuras.
REFERENCIAS 1. Alaee, M.; Environ. Int. 2003, 29, 683. 2. http://www.inchem.org/documents/ehc/ehc/ehc192.htm, acessada em Setembro 2016. 3. http://www.flameretardants-online.com/web/en/106/7ae3d32234954e28e661e506e284da7f.htm, acessada em Setembro 2016 4. Freedonia; Addit. Polym. 2013, 10. 5. Troitzsch, J. H.; Chem. Today 1998, 16, 19. 6. www.bsef.com, acessada em Setembro 2016. 7. de Wit, C.; Herzke, D.; Vorkamp, K.; Sci. Total Environ. 2010, 408, 2885. 8. Leonel, J.; Tese de Doutorado, Universidade de Sao Paulo, Brasil, 2007. 9. Yogui, G. T.; Sericano, J. L.; Environ. Int. 2009, 35, 655. 10. Hatje, V.; Costa, M. F.; Cunha, L. C.; Quim. Nova 2013, 36, 1497. 11. Bila, D. M.; Dezotti, M.; Quim. Nova 2007, 30, 651. 12. Pestana, C. R.; Borges, K. B.; Fonseca, P.; Oliveira, D. P.; Rev. Bras. Toxicol. 2008, 21, 41. 13. McKinney, M. A.; Letcher, R. J.; Aars, J.; Born, E. W.; Branigan, M.; Dietz, R.; Evans, T. J.; Gabrielsen, G. W.; Peacock, E.; Sonne, C.; Environ. Int. 2011, 37, 365. 14. Evenset, A.; Christensen, G. N.; Carroll, J.; Zaborska, A.; Berger, U.; Herzke, D.; Gregor, D.; Environ. Pollut. 2007, 146, 196. 15. Borghesi, N.; Corsolini, S.; Leonards, P.; Brandsma, S.; de Boer, J.; Focardi, S.; Chemosphere 2009, 77, 693. 16. http://chm.pops.int/Portals/0/download.aspx?d=UNEP-POPS-COP-CONVTEXT-2009.En.pdf, acessada em Setembro 2016. 17. http://www.pic.int/theconvention/chemicals/annexiiichemicals/tabid/1132/language/en-us/default.aspx, acessada em Setembro 2016. 18. http://www25.senado.leg.br/web/atividade/materias/-/materia/90884, acessada em Setembro 2016. 19. http://www.comprasnet.gov.br/legislacao/legislacaoDetalhe.asp?ctdCod=295, acessada em Setembro 2016. 20. Di Carlo, J.; Seifter, J.; Decarlo, V. J.; Environ. Health. Perspect. 1978, 23, 351. 21. Hardy, M. L.; Chemosphere 2002, 46, 717. 22. http://www.mma.gov.br/images/arquivo/80037/Convencao%20de%20Estocolmo/Inventarios/livro_inventario_uso_industrial_novas%20correcoes.pdf, acessada em Setembro 2016. 23. Ministério do Meio Ambiente, comunicaçao pessoal, 2015. 24. http://aliceweb.mdic.gov.br/, acessada em Setembro 2016. 25. Terrell, M. L.; Berzen, A. K.; Small, C. M.; Cameron, L. L.; Wirth, J. J.; Marcus, M.; Environ. Health 2009, 8, 35. 26. Sundstrom, G.; Hutzinger, O.; Safe, S.; Zitko, V.; Canada, E.; Sci. Total Environ 1976, 6, 15. 27. http://chm.pops.int/TheConvention/POPsReviewCommittee/Reports/tabid/2301/ctl/Download/mid/7538/Default.aspx?id=77&ObjID=4867, acessada em Setembro 2016. 28. Ibhazehiebo, K.; Iwasaki, T.; Xu, M.; Shimokawa, N.; Koibuchi, N.; Neurosci. Lett. 2011, 32, 1. 29. Pomerantz, I.; Burke, J.; Firestone, D.; Environ. Health. Perspect. 1978, 24, 133. 30. Henck, W. H.; Mattsson, J. L.; Rezabek, D. H.; Carlson, C. L.; Rech, R. H.; Neurotoxicol. Teratol. 1994, 16, 391. 31. Hesse, J. L.; Powers, R. A.; Environ. Health. Perspect. 1978, 23, 19. 32. http://www.atsdr.cdc.gov/toxprofiles/TP.asp?id=529&tid=94, acessada em Setembro 2016. 33. Von der Recke, R.; Vetter, W.; Chemosphere 2008, 71, 352. 34. Gierón, J.; Grochowalski, A.; Chrza, R.; Chemosphere 2010, 78, 1272. 35. Fernandez, M. F.; Araque, P.; Kiviranta, H.; Molina-molina, J. M.; Neurotoxicology 2007, 66, 377. 36. Valciukas, J. A.; Lilis, R.; Wolff, M. S.; Anderson, H. A.; Environ. Health Perspect. 1978, 23, 199. 37. Chanda, J. J.; Anderson, H. A.; Glamb, R. W.; Lomatch, D. L.; Wolff, M. S.; Voorhees, J. J.; Selikoff, I. J.; Environ. Res. 1982, 29, 97. 38. Zhao, G.; Wang, Z.; Zhou, H.; Zhao, Q.; Sci. Total Environ. 2009, 407, 4831. 39. Alonso, M. B.; Eljarrat, E.; Gorga, M.; Secchi, E. R.; Bassoi, M.; Barbosa, L.; Bertozzi, C. P.; Marigo, J.; Cremer, M.; Domit, C.; Azevedo, A. F.; Dorneles, P. R.; Barceló, D.; Environ. Pollut. 2012, 170, 152. 40. Clarke, B.; Porter, N.; Symons, R.; Marriott, P.; Ades, P.; Stevenson, G.; Blackbeard, J.; Chemosphere 2008, 73, 980. 41. Montie, E. W.; Letcher, R. J.; Reddy, C. M.; Moore, M. J.; Rubinstein, B.; Hahn, M. E.; Mar. Pollut. Bull. 2010, 60, 1160. 42. Hu, G. C.; Luo, X. J.; Dai, J. Y.; Zhang, X. L.; Wu, H.; Zhang, C. L.; Guo, W.; Xu, M-Q.; Mai, B-X.; Wei, F. W.; Environ. Sci. Technol. 2008, 42, 4704. 43. Blanck, H. M.; Marcus, M.; Hertzberg, V.; Tolbert, P. E.; Rubin, C.; Henderson, A. K.; Zhang, R. H.; Environ. Health. Perspect. 2000, 108, 147. 44. Damstra, T.; Jurgelski, W.; Posner, H. S.; Vouk, V. B.; Bernheim, N. J.; Guthrie, J.; Luster, M.; Falk, H. L.; Environ. Health. Perspect. 1982, 44, 175. 45. Bursian, S. Em Veterinary Toxicology; Gupta, R. C., ed.; Elsevier, cap. 55. 46. Zhu, L.; Ma, B.; Li, J.; Wu, Y.; Gong, J.; Chemosphere 2009, 74, 1429. 47. Chen, Z. J.; Liu, H. Y.; Cheng, Z.; Man, Y. B.; Zhang, K. S.; Wei, W.; Du, J.; Wong M-H.; Wang, H. S.; Environ. Int. 2014, 73, 77. 48. Ecobichon, D. J.; Hidvegi, S.; Comeau, A. M.; Cameron, P. H.; Toxicology 1983, 28, 51. 49. Rozman, K. K.; Rozman, T. A.; Williams, J.; Greim, H. A.; J. Toxicol. Environ. Health. 1982, 9, 611. 50. http://www.inchem.org/documents/ehc/ehc/ehc152.htm, acessada em Julho 2015. 51. Anderson, H. A. et al. Unanticipated Prevalence of Symptoms Among Dairy Farmers in Michigan and Wisconsin. Environ. Health Perspect. 1978, 23, 217. 52. Davis, S. I.; Blanck, H. M.; Hertzberg, V. S.; Tolbert, P. E.; Rubin, C.; Cameron, L. L.; Henderson, A. K.; Marcus, M.; Environ. Health 2005, 4, 15. 53. Sweeney, A. M.; Symanski, E.; Environ. Res. 2007, 105, 370. 54. Neufeld, M. L.; Sittenfeld, M.; Wold, K. F.; USEPA 1977, 560/6-77-017. 55. http://chm.pops.int/Implementation/NIPs/Guidance/GuidancefortheinventoryofPBDEs/tabid/3171/Default.aspx, acessada em Setembro 2016. 56. de Wit, C. A.; Chemosphere 2002, 46, 583. 57. Guerra, P.; Alaee, M.; Eljarrat, E.; Barceló, D. Em Brominated Flame Retardants; Eljarrat, E., Barceló, D., eds.; Springer: Berlin, 2011, cap.1. 58. http://www.inchem.org/documents/ehc/ehc/ehc162.htm, acessada em Setembro 2016. 59. Rahman, F.; Langford, K. H.; Scrimshaw, M. D.; Lester, J. N.; Sci. Total Environ. 2001, 275, 1. 60. Wong, A.; Lei, Y. D.; Alaee, M.; Wania, F.; J. Chem. Eng. Data 2001, 46, 239. 61. La Guardia, M. J.; Hale, R. C.; Harvey, E.; Environ. Sci. Technol. 2006, 40, 6247. 62. Park, J-S.; Holden, A.; Chu, V.; Newsome, S.D.; Henry, R.W.; Wang, M.; Kim, M.; Rhee, A.; Patel, P.; Fong, A.; Linthicum, J.; Hooper K.; Organohalogen Compd. 2009, 71, 820. 63. http://chm.pops.int/TheConvention/POPsReviewCommittee/POPRCRecommendations/tabid/243/ctl/Download/mid/13251/Default.aspx?id=53&ObjID=16698, acessada em Setembro 2016. 64. http://www.atsdr.cdc.gov/ToxProfiles/tp.asp?id=901&tid=183, acessada em Setembro 2016. 65. Shanmuganathan, D.; Megharaj, M.; Chen, Z.; Naidu, R.; Pollut. Bull. 2011, 63, 154. 66. Benedict, R. T.; Stapleton, H. M.; Letcher, R. J.; Mitchelmore, C. L.; Chemosphere 2007, 69, 987. 67. Peng, J.; Huang, C.-W.; Weng, Y.-M.; Yak, H.-K.; Chemosphere 2007, 66, 1990. 68. Pérez-fuentetaja, A.; Lupton, S.; Clapsadl, M.; Samara, F.; Gatto, L.; Biniakewitz, R.; Aga, D. S.; Chemosphere 2010, 81, 541. 69. Qiu, X.; Zhu, T.; Hu, J.; Chemosphere 2010, 80, 1207. 70. Wu, F.; Guo, J.; Chang, H.; Liao, H.; Zhao, X.; Mai, B.; Xing, B.; Environ. Pollut. 2012, 162, 262. 71. Pozo, K.; Kukučka, P.; Vaňková, L.; Přibylová, P.; Klánová, J.; Rudolph, A.; Banguera, Y.; Monsalves, J.; Contreras, S.; Barra, R.; Ahumada, R.; Mar. Pollut. Bull. 2015, 95, 480. 72. Pieroni, M. C.; Monografia, Universidade Federal do Rio Grande, Brasil, 2007. 73. Law, R. J.; Covaci, A.; Harrad, S.; Herzke, D.; Abdallah, M. A.-E.; Fernie, K.; Toms, L-M. L.; Takigami, H.; Environ. Int. 2014, 65, 147. 74. Vonderheide, A. P.; Mueller, K. E.; Meija, J.; Welsh, G. L.; Sci. Total Environ. 2008, 400, 425. 75. Fitzgerald, E. F.; Shrestha, S.; Gomez, M. I.; Mccaffrey, R. J.; Zimmerman, E. A.; Kannan, K.; Hwang, S.; Neurotoxicology 2012, 33, 8. 76. http://echa.europa.eu/documents/10162/32b000fe-b4fe-4828-b3d3-93c24c1cdd51, acessada em Setembro 2016. 77. Lévy-bimbot, M.; Major, G.; Courilleau, D.; Blondeau, J.; Lévi, Y.; Chemosphere 2012, 87, 782. 78. Covaci, A.; Voorspoels, S.; Abdallah, M. A. E.; Geens, T.; Harrad, S.; Law, R. J.; J. Chromatogr. A 2009, 1216, 346. 79. Bastos, P. M.; Eriksson, J.; Green, N.; Bergman, Å.; Chemosphere 2013, 70, 1196. 80. Law, R. J.; Allchin, C. R.; de Boer, J.; Covaci, A.; Herzke, D.; Lepom, P.; Morris, S.; Tronczynski, J.; de Wit, C. A.; Chemosphere 2006, 64, 187. 81. He, M. J.; Luo, X. J.; Yu, L. H.; Wu, J. P.; Chen, S. J.; Mai, B. X.; Environ. Pollut. 2013, 179, 105. 82. http://sustainableproduction.org/downloads/AternativestoTBBPAandHBCD.pdf, acessada em Setembro 2016. 83. http://edz.bib.uni-mannheim.de/daten/edz-a/gdgv/11/flame_retardant_substances_study_en.pdf, acessada em Setembro 2016. 84. Birnbaum, L. S.; Staskal, D. F.; Environ. Health Perspect. 2004, 112, 9. 85. Sjödin, A.; Patterson, D. G.; Environ. Int. 2003, 29, 829. 86. https://ec.europa.eu/jrc/en/publication/eur-scientific-and-technical-research-reports/european-union-risk-assessment-report-human-health-addendum-april-2008-44, acessada em Setembro 2016. 87. Chang, B. V; Yuan, S. Y.; Ren, Y. L.; Chemosphere 2012, 87, 535. 88. Brenner, A.; Mukmenev, I.; Abeliovich, A.; Kushmaro, A.; Ecotoxicology 2006, 15, 399. 89. Eriksson, J.; Rahm, S.; Green, N.; Jakobsson, E.; Chemosphere 2004, 54, 117. 90. Gerecke, A. C.; Giger, W.; Hartmann, P. C.; Heeb, N..; Kohler, H. P. E.; Schmid, P.; Zennegg, M.; Kohler, M.; Chemosphere 2006, 64, 311. 91. McCormick, J. M.; Paiva, M. S.; Haggblom, M. M.; Cooper, K. R.; White, L. A.; Aquat. Toxicol. 2010, 100, 255. 92. Debenest, T.; Gagné, F.; Petit, A.; André, C.; Kohli, M.; Blaise, C.; Comp. Biochem. Physiol., Part C: Toxicol. Pharmacol. 2010, 152, 407. 93. Sun, Y.; Guo, H.; Yu, H.; Wang, X.; Wu, J.; Xue, Y.; Chemosphere 2008, 70, 1787. 94. Pullen, S.; Boecker, R.; Tiegs, G.; Toxicology 2003, 184, 11. 95. Kuiper, R. V.; Van den Brandhof, E. J.; Leonards, P. E. G.; Van der Ven, L. T. M.; Wester, P. W.; Vos, J. G.; Arch. Toxicol. 2007, 81, 1. 96. Lilienthal, H.; Verwer, C. M.; Van der Ven, L. T. M.; Piersma, A. H.; Vos, J. G.; Toxicology 2008, 246, 45. 97. Nakajima, A.; Saigusa, D.; Tetsu, N.; Yamakuni, T.; Tomioka, Y.; Hishinuma, T.; Toxicol. Lett. 2009, 189, 78. 98. Van der Ven, L. T. M.; Van de Kuil, T.; Verhoef, A.; Verwer, C. M.; Lilienthal, H.; Leonards, P. E. G.; Piersma, A. H.; Toxicology 2008, 245, 76. 99. http://echa.europa.eu/documents/10162/32b000fe-b4fe-4828-b3d3-93c24c1cdd51, acessada em Setembro 2016. 100. Zhang, X.-L.; Luo, X.-J.; Chen, S.-J.; Wu, J.-P.; Mai, B.-X.; Environ. Pollut. 2009, 157, 1917. 101. Heeb, N. V; Schweizer, W. B.; Kohler, M.; Gerecke, A. C.; Chemosphere 2005, 61, 65. 102. Koch, C.; Schmidt-Kötters, T.; Rupp, R.; Sures, B.; Environ. Pollut. 2015, 199, 26. 103. Wu, T.; Wang, S.; Huang, H.; Zhang, S.; J. Agric. Food Chem. 2012, 60, 8528. 104. Sellström, U.; Bignert, A.; Kierkegaard, A.; Häggberg, L.; de Wit, C. A.; Olsson, M.; Jansson, B.; Environ. Sci. Technol. 2003, 37, 5496. 105. Feng, A. H.; Chen, S. J.; Chen, M. Y.; He, M. J.; Luo, X. J.; Mai, B. X.; Mar. Pollut. Bull. 2012, 64, 919. 106. Haukås, M.; Hylland, K.; Nygård, T.; Berge, J. A.; Mariussen, E.; Sci. Total Environ. 2010, 408, 5910. 107. Ichihara, M.; Yamamoto, A.; Takakura, K.; Kakutani, N.; Sudo, M.; Chemosphere 2014, 110, 78. 108. Poma, G.; Volta, P.; Roscioli, C.; Bettinetti, R.; Guzzella, L.; Sci. Total Environ. 2014, 481, 401. 109. Stapleton, H. M.; Dodder, N. G.; Kucklick, J. R.; Reddy, C. M.; Schantz, M. M.; Becker, P. R.; Gulland, F.; Porter, B. J.; Wise, S. A.; Mar. Pollut. Bull. 2006, 52, 522. 110. Ueno, D.; Alaee, M.; Marvin, C.; Muir, D. C. G.; Macinnis, G.; Reiner, E.; Crozier, P.; Furdui, V. I.; Subramanian, A.; Fillmann, G.; Lam, P. K. S.; Zheng, G. J.; Muchtar, M.; Razak, H.; Prudente, M.; Chung, K.; Tanabe, S.; Environ. Pollut. 2006, 144, 238. 111. Vorkamp, K.; Bossi, R.; Bester, K.; Bollmann, U. E.; Boutrup, S.; Sci. Total Environ. 2014, 470-471, 459. 112. Pizzini, S.; Marchiori, E.; Piazza, R.; Cozzi, G.; Barbante, C.; Microchem. J. 2015, 121, 184. 113. Zhu, N.; Schramm, K.-W.; Wang, T.; Henkelmann, B.; Fu, J.; Gao, Y.; Wang, Y.; Jiang, G.; Sci. Total Environ. 2015, 518-519, 328. 114. Janák, K.; Covaci, A.; Bechert, G.; Environ. Sci. Technol. 2005, 39, 1987. 115. Ramu, K.; Kajiwara, N.; Isobe, T.; Takahashi, S.; Kim, E. Y.; Min, B. Y.; We, S-U.; Tanabe, S.; Environ. Pollut. 2007, 148, 562. 116. Du, M.; Lin, L.; Yan, C.; Zhang, X.; Environ. Sci. Technol. 2012, 46, 11040. 117. Ibhazehiebo, K.; Iwasaki, T.; Xu, M.; Shimokawa, N.; Koibuchi, N.; Neurosci. Lett. 2011, 493, 1. 118. Marteinson, S. C.; Bird, D. M.; Letcher, R. J.; Sullivan, K. M.; Ritchie, I. J.; Fernie, K. J.; Chemosphere 2012, 89, 1077. 119. Du, M.; Zhang, D.; Yan, C.; Zhang, X.; Aquat. Toxicol. 2012, 112-113, 1. 120. http://chm.pops.int/TheConvention/POPsReviewCommittee/Reports/tabid/2301/ctl/Download/mid/7538/Default.aspx?id=341&ObjID=11423, acessada em Setembro 2016. 121. Eljarrat, E.; Barceló, D. Em Brominated Flame Retardants; Eljarrat, E.; Barceló, D., eds.; Springer: Berlin, 2011. 122. Leonel, J.; Sericano, J. L.; Secchi, E. R.; Bertozzi, C.; Fillmann, G.; Montone, R. C.; Sci. Total Environ. 2014, 493, 405. 123. Leonel, J.; Sericano, J. L.; Fillmann, G.; Secchi, E.; Montone, R. C.; Mar. Pollut. Bull. 2010, 60, 412. 124. Quinete, N.; Lavandier, R.; Dias, P.; Taniguchi, S.; Montone, R.; Moreira, I.; Mar. Pollut. Bull. 2011, 62, 440. 125. Silva, S. F. G.; Tese de Doutorado, Pontifícia Universidade Católica, Brasil, 2009. 126. Cascaes, M. J.; Oliveira, R. T.; Ubarana, M. M.; Sato, R. M.; Baldassin, P.; Colabuono, F. I.; Leonel, J.; Taniguchi, S.; Weber, R. R.; Mar. Pollut.Bull. 2014, 86, 591. 127. Souza, A. C.; Monografia, Universidade Federal do Paraná, Brasil, 2015. 128. Kalantzi, O. I.; Brown, F. R.; Caleffi, M.; Goth-Goldstein, R.; Petreas, M.; Environ. Int. 2009, 35, 113. 129. Dorneles, P. R.; Lailson-Brito, J.; Dirtu, A. C.; Weijs, L.; Azevedo, A. F.; Torres, J. P. M.; Malm, O.; Neels, H.;Blust, R.; Das, K.; Covaci, A.; Environ. Int. 2010, 36, 60. 130. Leonel, J.; Taniguchi, S.; Sasaki, D. K.; Cascaes, M. J.; Dias, P. S.; Botta, S.; Santos, M. C. O.; Montone, R. C.; Chemosphere 2012, 86, 741. 131. Fillmann, G.; Leonel, J. Em Global Contamination Trends of Persistent Organic Chemical; Loganathan, B. G.; Lam, P. K. S., eds.; Taylor and Francis Group: United Kingdom, 2011, cap.18. 132. Baldassin, P.; Taniguchi, S.; Gallo, H.; Maranho, A.; Kolesnikovas, C.; Amorim, D. B.; Mansilla, M.; Navarro, R. M.; Tabeira, L. C.; Bicego, M. C.; Montone, R. C.; Chemosphere 2016, 149, 391. 133. Magalhaes, C.; Taniguchi, S.; Cascaes, M. J.; Montone, R. C.; Mar. Pollut. Bull. 2012, 64, 662. 134. Ueno, D.; Kajiwara, N.; Tanaka, H.; Subramanian, A.; Fillmann, G.; Lam, P. K. S.; Zheng, G. J.; Muchitar, M.; Razak, H.; Prudente, M.; Chung, K.; Tanabe, S.; Environ. Sci. Technol. 2004, 38, 2312. 135. Pieroni, M. C.; Dissertaçao de Mestrado, Universidade Federal do Rio Grande, Brasil, 2012. 136. Merico, A.; Montone, R. C.; Silva, J.; Seixas, T. G.; Godoy, J. M.; Saint'Pierre, T. D.; Hauser-Davis, R. A.; Di Beneditto, A. P.; Reis, E. C.; Tavares, D. C.; Lemos, L. S.; Siciliano, S.; Mar. Pollut. Bull. 2015, 95, 402. 137. Lavandier, R.; Arêas, J.; Quinete, N.; de Moura, J. F.; Taniguchi, S.; Montone, R.; Siciliano, S.; Moreira, I.; Environ. Pollut. 2015, 208, 442. 138. Pegoraro, C. N.; Harner, T., Su, K.; Chiappero, M. S.; Sci. Total Environ. 2016, 571, 172. 139. Lee, S. C.; Sverko, E.; Harner, T.; Pozo, K.; Barresi, E.; Schachtschneider, J.; Zaruk, D.; DeJong, M.; Narayanet, J.; Environ. Pollut. 2016, Article in press. http://dx.doi.org/10.1016/j.envpol.2016.01.080 140. Waaijers, S. L.; Kong, D.; Hendriks, H. S.; de Wit, C. A.; Cousins, I. T.; Westerink, R. H. S.; Leonards, P. E. G.; Kraak, M. H. S.; Admiraal, W.; de Voogt, P.; Parsons, J. R. Em Reviews of Environmental Contamination and Toxicology; Whitacre, D. M. ed.; Springer: New York, 2013, Cap. 1. 141. Rauert, C.; Harner, T.; Schuster, J. K.; Quinto, K.; Fillmann, G.; Castillo, L. E.; Fentanes, O.; Ibarra, M. V.; Miglioranza, K. S.; Rivadeneira, I. M.; Pozo, K.; Puerta, A. P.; Zuluaga, B. H. A.; Sci. Total Environ. 2016, Article in press. doi: 10.1016/j.scitotenv.2016.06.229 142. Law, R. J.; Herzke, D.; Em Brominated Flame Retardants; Eljarrat, E., Barceló, D., eds.; Springer: Berlin, 2011, Cap. 5. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access